TINJAUAN PUSTAKA
Salam (Syzygium polyanthum)Syzygium polyanthum [Wight.] Walp.,
sinonim Eugenia polyantha Wight., dan E.
lucidula miq., memiliki nama daerah salam
(Indonesia, Sunda, Jawa, Madura); gowok (Sunda); manting (Jawa); kastolam (Kangean); dan meselangan, ubar serai (Melayu). Salam diklasifikasikan ke dalam divisi Spermatophyta, subdivisi Angiospermae, kelas Dicotyledoneae, ordo Myrtales, family Myrtaceae, genus Syzygium, spesies Syzygium polyanthum (Wight) Walp (Sumono 2008).
Salam merupakan tanaman asli Indonesia dan tumbuh di wilayah iklim tropis dan subtropis, termasuk di Asia Tenggara dan Cina. Secara morfologi (Gambar 1), salam merupakan pohon bertajuk rimbun dengan tinggi mencapai 25 m, berakar tunggang, dan berbatang bulat dengan permukaan yang licin. Daun tunggal, berbentuk lonjong hingga elips, letak berhadapan, panjang tangkai 0,5-1 cm, ujung meruncing, pangkal runcing, tepi rata, panjang 5-15 cm, lebar 3-8 cm, pertulangan menyirip, permukaan atas licin berwarna hijau tua, dan permukaan bawah berwarna hijau muda. Bunga majemuk, tersusun dalam malai yang keluar dari ujung ranting, berwarna putih dan baunya harum. Buah buni, berbentuk bulat, diameter 8-9 mm, saat masih muda berwarna hijau, saat matang berubah warna menjadi merah gelap, dan rasanya agak sepat. Biji berbentuk bulat, penampang sekitar 1 cm, dan berwarna coklat (Sumono 2008).
Gambar 1 Tanaman salam. (Sumono 2008) Efek farmakologi daun salam diperoleh dari daun, kulit batang, akar, dan buah salam. Kandungan kimia tanaman salam dilaporkan di antaranya minyak atsiri (0,05%) yang terdiri dari sitral dan eugenol (Sumono 2008), serta mengandung tanin tidak kurang dari 21,7% dan flavonoid dengan fluoretin dan kuersitrin sebagai golongan utama (BPOM 2004). Kuersitrin merupakan senyawa golongan flavonoid yang diketahui sebagai
senyawa penciri pada daun salam (Depkes RI 2008).
Berdasarkan penelitian Muflihat (2008), dari uji fitokimia yang dilakukan diketahui bahwa ekstrak air daun salam mengandung flavonoid, saponin dan tanin. Ekstrak air bersifat kurang toksik dengan nilai LC50
sebesar 2174,23 ppm. Ekstrak etanol daun salam mengandung alkaloid, flavanoid, saponin, dan tanin serta memiliki potensi bioaktif dan dapat dimanfaatkan sebagai obat karena memiliki nilai LC50 <1000 ppm, yaitu
sebesar 114,55 ppm. Studiawan (2004) menyatakan dalam penelitiannya bahwa ekstrak etanol daun salam dapat menurunkan kadar glukosa darah pada tikus dengan metode aloksan karena daun salam mengandung flavonoid yang dapat menangkap radikal hidroksil, sehingga menghambat aksi diabetik dari aloksan. Ekstrak metanol-air kulit batang salam menunjukkan kandungan fenolik total tertinggi (856 mg ekuivalen asam galat (GAE)/g dan 161 mg ekuivalen katekin (CE)/g) dan total kapasitas antioksidan 449 mg ekuivalen asam askorbat (AAE)/g (Lelono 2009).
Flavonoid
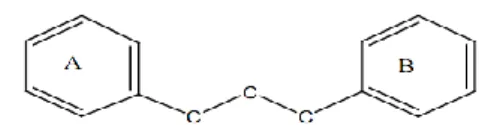
Flavonoid termasuk senyawa fenolik alam yang potensial sebagai antioksidan dan mempunyai bioktivitas sebagai obat. Flavonoid merupakan kandungan khas tumbuhan hijau. Flavonoid dalam tubuh manusia berfungsi sebagai antioksidan sehingga sangat baik untuk pencegahan kanker. Senyawa flavonoid adalah senyawa-senyawa polifenol yang memiliki 15 atom karbon (C6-C3-C6), terdiri dari dua cincin
benzena yang dihubungkan menjadi satu oleh rantai linier yang terdiri dari tiga atom karbon (Gambar 2). Flavonoid mengandung sistem aromatik yang terkonjugasi. Kebanyakan senyawa terkonjugasi pada umumnya berwarna cerah sehingga menunjukkan pita serapan yang kuat pada dearah spektrum sinar ultraviolet dan spektrum sinar tampak (Harborne 1996).
Gambar 2 Kerangka dasar senyawa flavonoid.
Flavonoid dalam tumbuhan terdapat sebagai bentuk O-glikosida dan C-glikosida.
Bentuk flavonoid O-glikosida, satu gugus hidroksil (-OH) flavonoid (lebih) terikat pada satu gula (lebih) dengan ikatan hemiasetal yang tidak tahan asam, biasanya pada posisi 3 atau 7. Bentuk C-glikosida memiliki gula yang terikat pada atom karbon flavonoid dan dalam hal ini gula terikat langsung pada inti benzena dengan ikatan karbon-karbon yang tahan asam, dan hanya ditemukan pada atom C nomor 6 dan 8 dalam inti flavonoid. Glukosa merupakan gula yang paling umum terlibat, selain itu juga terdapat galaktosa, ramnosa, xilosa, dan arabinosa (Markham 1988). Sejumlah gugus hidroksil yang tak terganti atau suatu gula menyebabkan flavonoid bersifat polar sehingga larut dalam pelarut polar seperti etanol, metanol, butanol, aseton, dimetilsulfoksida, dimetilformamida, dan lain-lain. Pengaruh glikosilasi (gula terikat pada flavonoid) menyebabkan flavonoid menjadi kurang reaktif sehingga lebih mudah larut dalam pelarut polar seperti air dan dengan demikian campuran pelarut di atas dengan air merupakan pelarut yang lebih baik untuk glikosida flavonoid (Harborne 1996; Markham 1988).
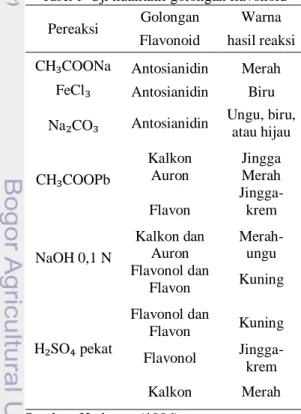
Tabel 1 Uji kualitatif golongan flavonoid Pereaksi Golongan Warna Flavonoid hasil reaksi CH₃COONa Antosianidin Merah
FeCl₃ Antosianidin Biru Na₂CO₃ Antosianidin Ungu, biru,
atau hijau CH₃COOPb Kalkon Jingga Auron Merah Flavon Jingga-krem NaOH 0,1 N Kalkon dan Auron Merah-ungu Flavonol dan Flavon Kuning H₂SO₄ pekat Flavonol dan Flavon Kuning Flavonol Jingga-krem Kalkon Merah Sumber: Harborne (1996)
Perbedaan kelas antara golongan senyawa flavonoid adalah adanya tambahan oksigen yang terikat pada cincin heterosiklik dan gugus hidroksil. Aglikon flavonoid
dikelompokkan ke dalam beberapa golongan, di antaranya flavon, flavonol, flavonon, isoflavon, khalkon, auron, antosianidin. Flavonoid dalam tumbuhan terdapat sebagai campuran. Penggolongan jenis flavonoid didasarkan pada sifat kelarutan dan reaksi warna (Tabel 1).
Ekstraksi Senyawa Metabolit Sekunder Ekstraksi merupakan suatu proses selektif yang dilakukan untuk mengambil zat-zat yang terkandung dalam suatu campuran dengan menggunakan pelarut yang sesuai. Metode pemisahan ini bekerja berdasarkan prinsip kelarutan like dissolve like, yaitu pelarut polar akan melarutkan zat polar, dan sebaliknya (Khopkar 2002). Proses ini merupakan langkah awal yang penting dalam penelitian tanaman obat, karena preparasi ekstrak kasar tanaman merupakan titik awal untuk isolasi dan pemurnian komponen kimia yang terdapat pada tanaman. Pemisahan zat dari suatu campuran relatif mudah dilakukan jika zat tersebut larut dalam pelarut yang digunakan, sedangkan zat lain tidak ikut larut. Dengan demikian, hasil ekstraksi yang diperoleh bergantung pada kandungan ekstrak yang terdapat dalam sampel dan jenis pelarut yang digunakan (Khopkar 2002).
Berdasarkan fase yang terlibat terdapat 2 jenis ekstraksi, yaitu ekstraksi car-cair dan ekstraksi cair. Proses ekstraksi padat-cair sangat dipengaruhi oleh waktu ekstraksi, suhu yang digunakan, pengadukan, dan banyaknya pelarut yang digunakan (Harborne 1996). Perlakuan pendahuluan untuk bahan padat dapat dilakukan dengan beberapa cara di antaranya dengan pengeringan bahan baku sampai kadar air tertentu dan penggilingan untuk mempermudah proses ekstraksi dengan memperbesar kontak antara bahan dan pelarut (Harborne 1996). Kontak yang intensif menyebabkan komponen aktif pada campuran akan berpindah ke dalam pelarut (Gamse 2002).
Pemilihan pelarut merupakan faktor yang menentukan dalam ekstraksi. Pelarut yang digunakan dalam ekstraksi harus dapat menarik komponen aktif dari campuran. Hal-hal yang harus diperhatikan dalam memilih pelarut adalah selektivitas, sifat pelarut, kemampuan untuk mengekstraksi, tidak bersifat racun, mudah diuapkan, dan harganya relatif murah (Gamse 2002). Perendaman suatu bahan dalam pelarut dapat meningkatkan permeabilitas dinding sel dalam 3 tahapan, yaitu masuknya pelarut ke dalam
dinding sel tanaman dan membengkakkan sel, kemudian senyawa yang terdapat dalam dinding sel akan terlepas dan masuk ke dalam pelarut, diikuti oleh difusi senyawa yang terekstraksi oleh pelarut keluar dari dinding sel tanaman (Supriadi 2008). Umumnya pelarut ditambahkan sekurang-kurangnya sampai seluruh contoh tepat terendam.
Salah satu prosedur klasik untuk memperoleh kandungan senyawa organik dari jaringan tumbuhan ialah maserasi. Metode maserasi digunakan untuk mengekstrak komponen, baik yang tidak tahan panas, maupun yang tahan panas. Metode ini dilakukan hanya dengan merendam sampel dalam suatu pelarut dengan lama waktu tertentu, biasanya selama 24 jam tanpa menggunakan pemanasan. Kelebihan metode maserasi di antaranya sederhana, tidak menggunakan peralatan yang rumit, relatif murah, serta dapat menghindari kerusakan komponen senyawa yang tidak tahan panas. Kelemahan dari metode ini di antaranya membutuhkan waktu yang lama dan penggunaan pelarut yang tidak efisien (Meloan 1999).
Metode ekstraksi sonikasi memanfaatkan gelombang ultrasonik dengan frekuensi rendah 20-40 kHz yang dapat mempercepat waktu kontak antara sampel dan pelarut meskipun pada suhu ruang. Hal ini menyebabkan proses perpindahan massa senyawa bioaktif dari dalam sel tanaman ke pelarut menjadi lebih cepat. Sonikasi mengandalkan energi gelombang yang menyebabkan proses kavitasi, yaitu proses pembentukan gelembung-gelembung kecil akibat adanya transmisi gelombang ultrasonik untuk membantu difusi pelarut ke dalam dinding sel tanaman (Ashley et al. 2001).
Radikal Bebas dan Antioksidan Radikal bebas adalah substansi reaktif yang dibentuk dalam sel-sel tubuh sebagai hasil proses metabolisme. Radikal bebas merupakan molekul atau atom yang tidak stabil karena memiliki satu atau lebih elektron tidak berpasangan pada orbital terluarnya. Radikal bebas sangat berbahaya karena sangat reaktif dalam mencari pasangan elektronnya, bereaksi dengan cepat pada biomolekul melalui banyak jenis reaksi, antara lain penangkapan hidrogen, donor elektron, dan penggunaan elektron bersama. Radikal bebas akan melepaskan elektron pada molekul sekitarnya untuk menghasilkan pasangan elektron untuk menjadi molekul yang stabil.
Reaksi ini akan berlangsung terus-menerus dalam tubuh dan bila tidak dihentikan akan menimbulkan berbagai penyakit seperti kanker, penuaan dini, serta penyakit degeneratif lainnya (Ng 2000; Pourmorad 2006). Untuk itu, tubuh memerlukan suatu substansi penting yang mampu menangkap radikal bebas tersebut sehingga tidak dapat menginduksi suatu penyakit.
Antioksidan dinyatakan sebagai senyawa yang secara nyata dapat memperlambat oksidasi, walaupun dengan konsentrasi yang lebih rendah dibandingkan dengan substrat yang dapat dioksidasi. Antioksidan dapat menangkap berbagai jenis oksigen yang secara biologis bersifat reaktif (O2-, H2O2,
-OH, -HOCl, dsb), dengan cara mengubah pembentukan molekul radikal bebas atau dengan melengkapi kekurangan elektron radikal bebas yang dapat menimbulkan stress oksidatif (Pietta 2000). Oleh karena itu, antioksidan merupakan substansi yang diperlukan tubuh untuk menetralisir radikal bebas dan mencegah kerusakan yang ditimbulkan oleh radikal bebas tersebut.
Berdasarkan sumbernya antioksidan dibagi dalam dua kelompok, yaitu antioksidan sintetik (antioksidan yang diperoleh dari hasil sintesa reaksi kimia) dan antioksidan alami (antioksidan hasil ekstraksi bahan alami). Antioksidan sintetik yang diizinkan dalam pangan di antaranya Butylated Hydroxyanisol (BHA), Butylated Hydroxytoluene (BHT), propil galat, dan tokoferol (Leclerrcq et al. 2000).
Menurut Shahidi & Naczk (1995), senyawa antioksidan alami tumbuhan umumnya adalah senyawa fenolik atau polifenolik yang dapat berupa golongan flavonoid, turunan asam sinamat, kumarin, tokoferol dan asam-asam organik polifungsional. Ditambahkan oleh Pratt (1992), golongan flavonoid yang memiliki aktivitas antioksidan meliputi flavon, flavonol, isoflavon, katekin, flavonol dan kalkon.
Aktivitas Antioksidan Metode DPPH Metode DPPH digunakan secara luas untuk menguji kemampuan senyawa dalam menangkap radikal bebas atau donor hidrogen. DPPH merupakan radikal bebas yang stabil pada suhu kamar dan sering digunakan untuk mengevaluasi aktivitas antioksidan beberapa senyawa atau ekstrak bahan alam. DPPH berperan sebagai radikal bebas yang diredam oleh antioksidan dari
bahan uji. DPPH akan bereaksi dengan antioksidan tersebut membentuk 1,3-difenil-2-pikrilhidrazin (Gambar 3). Reaksi ini menyebabkan terjadinya perubahan warna yang dapat diukur dengan spektrometer UV-vis, sehingga aktivitas peredaman radikal bebas oleh sampel dapat ditentukan. Pengukuran diukur secara stoikiometri sesuai dengan jumlah elektron atau atom hidrogen yang ditangkap oleh molekul DPPH akibat adanya zat antioksidan. Aktivitas antioksidan dinyatakan dengan nilai IC50 yaitu konsentrasi
ekstrak yang dibutuhkan untuk menurunkan konsentrasi DPPH sebesar 50% (Blois 1958).
Gambar 3 Reaksi penangkapan radikal bebas DPPH dengan antioksidan. (Windono et al. 2001)
Radikal DPPH merupakan sebuah radikal bebas yang stabil dan memberikan serapan pada panjang gelombang sekitar 520 nm, serta memiliki warna ungu yang ditunjukkan oleh pita absorbans ketika dilarutkan dalam etanol atau metanol. DPPH akan berubah menjadi bentuk tereduksi dan kehilangan warna ungunya ketika dicampurkan dengan zat yang mampu bertindak sebagai donor atom hidrogen (Molyneux 2004).
Kromatografi Lapis Tipis (KLT) Kromatografi lapis tipis, dikenal sebagai kromatografi planar, merupakan teknik yang digunakan untuk memisahkan campuran komponen berdasarkan distribusi komponen tersebut di antara dua fase, yaitu fase diam dan fase gerak. Pemisahan dilakukan pada lapisan tipis fase diam (100-200 µm), pada umumnya silika gel yang terdapat pada pelat. Pelat tersebut dapat terbuat dari kaca, plastik, atau aluminium dengan ukuran beberapa sentimeter. Bahan pengikat inert seperti gipsum dicampurkan ke dalam fase diam selama pembuatan pelat untuk mempetahankan agar fase diam tetap berada pada pelat dan untuk menjamin kepaduan antar-partikel. Fase diam untuk KLT seringkali juga mengandung substansi yang dapat berpendar (fluoresens) dalam sinar ultra
violet (254 nm), ini berfungsi untuk memudahkan visualisasi spot yang dihasilkan. Fase gerak bekerja berdasarkan prinsip kapilaritas terhadap fase diam. Fase gerak menggerakkan komponen sampel pada berbagai laju karena perbedaan tingkatan interaksi dari setiap komponen dengan matriks dan kelarutannya dalam pelarut (Gambar 4). Lokalisasi setiap komponen pada pelat berfungsi untuk mengukur jarak migrasi komponen dari tempat asalnya. Pergerakan zat relatif terhadap garis depan pelarut dalam sistem kromatografi lapis tipis dapat didefinisikan sebagai nilai Rf, yaitu perbandingan jarak tempuh zat dengan jarak tempuh senyawa dengan jarak yang ditempuh pelarut. Nilai Rf khas untuk suatu senyawa tertentu (Khopkar 2002).
Gambar 4 Ruangan pengembang dan pelat kromatografi lapis tipis. (Rouessac & Rouessac 1994) Analisis Sidik Jari
Analisis sidik jari merupakan analisis yang dapat dimanfaatkan untuk evaluasi dan kontrol kualitas multikomponen dari tanaman obat. Komponen kimia dalam tanaman obat sangat bergantung pada musim panen, sumber tanaman, proses pengeringan, dan faktor lainnya, sehingga perlu dilakukan penentuan komponen kimia dalam tanaman obat untuk menjamin kepercayaan dalam penelitian klinis dan farmakologis, mengetahui bioaktivitas dan kemungkinan efek samping dari komponen aktif, dan untuk meningkatkan kontrol kualitas produk (Liang et al. 2004). Analisis ini memberikan informasi komponen kimia dalam bentuk spektrogram, kromatogram, dan grafik lainnya yang diperoleh dari teknik analitik untuk menentukan identitas, kualitas, dan keaslian tanaman obat (Borges et al. 2007).
Beberapa teknik kromatografi seperti kromatografi lapis tipis (KLT), kromatografi cair kinerja tinggi (KCKT), kromatografi gas (KG), dan elektroforesis kapiler dapat digunakan dalam analisis sidik jari. Kromatografi lapis tipis (KLT) direkomendasikan sebagai teknik yang efektif untuk identifikasi tanaman obat. Beberapa
kelebihan dengan menggunakan KLT, yaitu cepat, mudah digunakan pada penapisan awal dengan penilaian semikuantitatif daripada teknik kromatografi lainnya, sederhana, murah, persiapan sampel yang mudah serta dapat mendeteksi dalam jumlah yang besar (Liang et al. 2004). Namun terdapat beberapa keterbatasan dalam ketepatan dan keterulangan dibandingkan dengan analisis kolom.
Rancangan Percobaan
Rancangan percobaan adalah proses perencanaan studi untuk memenuhi tujuan tertentu. Konsep dalam rancangan percobaan yaitu menggunakan satu set percobaan yang dipilih dengan baik yang bertujuan untuk mengoptimumkan proses dengan melakukan masing-masing percobaan dan untuk menarik kesimpulan tentang interaksi dari objek yang dipelajari (Triefenbach 2008). Rancangan percobaan merupakan suatu pendekatan dalam pengembangan dan pengoptimuman. Metode ini layak mendapatkan formulasi yang diinginkan secepat mungkin dengan menghindari percobaan yang tidak perlu. Efek dari setiap faktor pada respon masing-masing formulasi dapat dievaluasi dan faktor-faktor kritis dapat diidentifikasi berdasarkan analisis statistik (Bolourtchian 2008). Metodologi respon permukaan (RSM) adalah kumpulan teknik matematis dan statistik yang berguna untuk merancang percobaan, membangun model, dan menganalisis pengaruh beberapa faktor independen. RSM menyediakan alat yang efektif untuk menyelidiki aspek-aspek yang memengaruhi respon yang diinginkan jika terdapat banyak faktor dan interaksi dalam percobaan (Yin et al. 2009).
Rancangan campuran adalah kelas rancangan permukaan respon dengan jumlah dari semua komponen adalah satu. Rancangan campuran merupakan rancangan yang digunakan pada percobaan dengan campuran bahan. Dalam rancangan ini, faktornya adalah komponen atau bahan dari campuran sehingga taraf dari masing-masing faktor tidak saling bebas (Montgomery 1991). Dalam campuran percobaan, faktor-faktor independen adalah komponen campuran dan respon tergantung pada proporsi relatif masing-masing bahan, hal ini melibatkan perubahan komposisi campuran dan mengeksplorasi dalam mengetahui pengaruh sifat-sifat campuran (Bolourtchian 2008). Rancangan campuran dapat digunakan untuk larutan ekstraksi dan fase gerak kromatografi untuk keperluan
optimisasi (Borges 2007). Rancangan campuran dapat digambarkan dalam sistem koordinat simplex yang terdiri atas simplex
lattice, simplex centroid, dan extreme vartices. Simplex centroid diperkenalkan oleh
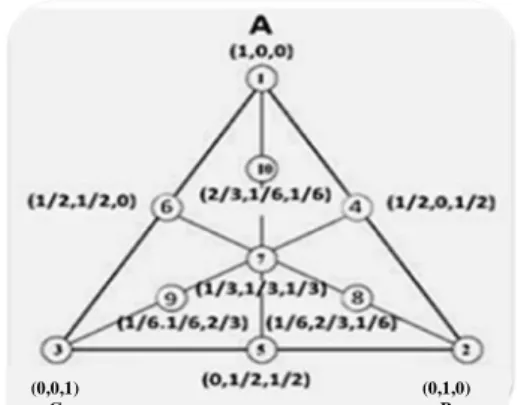
Scheffe pada tahun 1963 untuk memberikan ulasan percobaan dari respon permukaan di bagian tengah bidang. Salah satu cara untuk menggambarkan model adalah mempertimbangkan struktur dari percobaan tiga faktor. Titik tengah ditempatkan dalam model dengan menemukan rata-rata tingkatan dari semua faktor yang terlibat. Rancangan tiga komponen dapat digambarkan dengan segitiga sama sisi dengan dua dimensi (Soares
et al. 2007) dapat dilihat pada Gambar 5.
Penelitian mengenai pengoptimuman fase gerak menggunakan simplex centroid design (SCD) telah dilakukan oleh Borges et al. (2007), serta Soares et al. (2007).
Gambar 5 Model simplex centroid design with
axial.
Rancangan kombinasi merupakan rancangan campuran ganda. Rancangan kombinasi memungkinkan penggabungan antara komponen campuran dan faktor proses. Terdapat dua jenis rancangan untuk membuat rancangan kombinasi. Rancangan optimal termasuk ke dalam kelas rancangan percobaan yang optimal berhubungan dengan beberapa kriteria statistik. Rancangan optimal memungkinkan parameter yang akan diestimasi dengan variasi minimum. Rancangan D-Optimal (D-Optimal design) merupakan salah satu bentuk rancangan yang disediakan oleh algoritma komputer. Rancangan ini dapat disesuaikan untuk memenuhi rancangan campuran klasik, menghasilkan estimasi yang tidak ortogonal dan efek estimasi dapat berkorelasi (Bolourtchian 2008). Kelebihan menggunakan rancangan optimal, yaitu dapat mengurangi biaya percobaan karena memungkinkan model statistik yang akan diestimasi dengan
(0,1,0) B (0,0,1)