30
UJI AKTIVITAS ANTIBAKTERI ISOLAT
ACTINOMYCETES
9ISP1 DARI SPONS
ASAL PERAIRAN PULAU RANDAYAN
Tiara Kumala1*, Afghani Jayuska1, Puji Ardiningsih1 1
Program Studi Kimia, Fakultas MIPA, Universitas Tanjungpura, Jln. Prof. Dr. H. Hadari Nawawi78124,
*email: tiaraasadel@yahoo.co.id
ABSTRAK
Actinomycetes merupakan mikroorganisme penghasil metabolit sekunder yang memiliki aktivitas biologi sebagai antimikroba. Actinomycetes dapat ditemukan di tanah dan di dasar laut. Namun, belum banyak penelitian mengenai kemampuan Actinomycetes yang berasal dari laut sebagai agen antibakteri. Penelitian ini dilakukan untuk mengetahui kemampuan Actinomycetes 9ISP1 yang bersimbiosis dengan spons asal perairan Pulau Randayan sebagai aktimikroba dengan menggunakan metode difusi agar. Isolat bakteri Actinomycetes yang bersimbiosis dengan spons diuji aktivitas antimikroba awalnya dengan media ISP1. Hasil uji menunjukkan bahwa isolat tersebut mampu menghambat pertumbuhan bakteri Bacillus cereus dan Aeromonas hydrophilla dengan zona hambat sebesar 14,4 dan 12,5 mm. Selanjutnya, isolat Actinomycetes 9ISP1 diproduksi dalam media cair ISP1 kemudian diuji aktivitas antimikrobanya dengan metode difusi agar (sumur). Hasil uji menunjukkan isolat Actinomycetes mampu menghambat bakteri uji Gram positif dan negatif yaitu Bacillus cereus, Pseudomonas aerogenosa, Staphylococcus aureus, Aeromonas hydrophylla, Vibrio cholera, Escherichia coli,
Bacillus subtilis dan Salmonella dengan dosis sebesar 10µL/sumur dan kemampuan
menghambat paling baik terhadap bakteri Escherichia coli dengan diameter zona hambat sebesar 29,1 mm sehingga isolat bakteri Actinomycetes yang bersimbiosis dengan spons berpotensi sebagai antibakteri.
Kata kunci : Actinomycetes, spons, antibakteri, simbiosis bakteri dengan spons
PENDAHULUAN
Actinomycetes merupakan jenis
mikroorganisme yang sangat berpotensi sebagai penghasil metabolit sekunder yang memiliki aktivitas biologi sebagai antimikroba (Kelecom, 2002). Actinomycetes dapat ditemukan di tanah dan laut, dimana Actinomycetes yang berasal dari laut dapat ditemukan di permukaan air laut, di dasar laut dalam, batu karang dasar laut dan sedimen. Actinomycetes ini sangat bervariasi spesiesnya sehingga peluang untuk mendapatkan senyawa antimikroba baru lebih besar (Das et al., 2006).
Data dari National Cancer Institute (2005) menunjukkan bahwa beberapa biota laut memiliki aktivitas biologi. Lebih dari 20 kategori senyawa bioaktif yang berbeda-beda telah ditemukan, seperti antivirus, antibiotik, antiinflamasi, antileukimia, insektisidal, sitotoksin, antihelmentik dan antikanker dimana senyawa bioaktif tersebut berasal dari biota laut yaitu spons. Beberapa
mikroba yang bersimbiosis dengan spons seperti Actinomycetes juga diketahui menghasilkan senyawa bioaktif yang dapat digunakan sebagai antimikroba. Actinomycetes membentuk suatu simbiotik dengan spons yaitu di dalam inti sel (simbiosis intranukleus), di dalam sitoplasma sel tubuh spons (simbiosis intraseluler), di sisi dalam tubuh spons (endosimbiosis ekstraseluler) serta dibagian luar tubuh spons (eksosimbiosis ekstraseluler) (Herlina, dkk., 2010).
Eksplorasi spons sebagai penghasil senyawa bioaktif telah banyak dipublikasikan tetapi penggunaan produk alami laut yang bersifat antibiotik dan antifungi sebagai hasil metabolit sekunder dari bakteri yang bersimbiosis dengan spons lebih menguntungkan dibandingkan dengan mengisolasi dari inangnya (Abubakar et al., 2011). Interaksi antara spons dan bakteri terjadi dalam bentuk simbiosis mutualisme dimana dalam interaksi ini dihasilkan senyawa bioaktif (Mahdiyah, dkk., 2012).
31 Penggunaan antibiotik secara tepat memberikan manfaat yang sangat baik, namun bila digunakan atau dikomposisikan secara tidak tepat (irrational prescribing) dapat menyebabkan munculnya kuman-kuman patogen yang kebal terhadap satu atau beberapa jenis antibiotika. Pemakaian antibiotika lini pertama yang sudah tidak bermanfaat harus diganti dengan obat-obatan lini kedua yang memiliki dosis lebih tinggi bahkan lini ketiga (Rahayu, 2012). Hal ini menyebabkan diperlukannya antibiotik baru yang memiliki daya kerja yang lebih baik dalam membunuh mikroba patogen yang telah resistan terhadap antibiotik sebelumnya.
Banyaknya klasifikasi, pola kepekaan kuman dan penemuan antibiotika baru merupakan salah satu faktor pemicu terjadinya resistansi. Resistansi antibiotik terhadap mikroba dapat menimbulkan beberapa konsekuensi yang fatal. Ketika respon terhadap pengobatan menjadi lambat bahkan gagal, maka akan terjadi infeksi untuk waktu yang lama (Deshpande, et al., 2011).
Actinomycetes merupakan kelompok
mikroba yang paling banyak menghasilkan senyawa bioaktif antibiotika, antifungi dan antibakteri (Atlas, 1998). Menurut penelitian yang dilakukan oleh Sunaryanto dkk pada tahun 2010, Actinomycetes laut mampu menghasilkan senyawa aktif citropeptin yang memiliki efek toksik terhadap sel kanker paru-paru. Oleh karena itu, pada penelitian ini akan dilakukan eksplorasi sumber penghasil antibiotik baru yang berasal dari Actinomycetes 9ISP1 bersimbiosis dengan spons yang memiliki aktivitas antimikroba terhadap beberapa mikroba patogen.
.
METODOLOGI PENELITIAN Bahan dan Alat
Bahan Uji dan Bahan Kimia
Bahan- bahan yang digunakan adalah media ISP1 yang mengandung kasein (5 g/L) dan ekstrak ragi (3 g/L), agar, nutrient agar (NA), kertas saring, air laut, akuades (H2O), etanol (C2H5OH), etil asetat
(C2H5COOH), isolat Actinomycetes 9ISP1
dan mikroba uji seperti Bacillus cereus,
Pseudomonas aerogenosa, Staphylococcus
aureus, Aeromonas hydrophilla, Vibrio
cholera, Escherichia coli, Bacillus subtilis, dan Salmonella.
Alat
Alat-alat yang digunakan adalah autoklaf, cawan petri,tabung reaksi, tabung eppendorf, erlenmeyer, botol vial, jarum ose, spatula, batang pengaduk, gelas beaker, blender, thermometer, penangas air, kawat ose, laminar air flow, pipet mikro, pinset, neraca analitik, rotary evaporator, dan seperangkat alat gelas lain yang umum digunakan.
Prosedur Kerja
Uji Awal Aktivitas Antimikroba dari
Actinomycetes 9ISP1 Berasosiasi Spons
(Herlina,R, dkk., 2010)
Suspensi
Actinomycetes
dimasukkan
ke dalam sumur pada media padat ISP1
dan diinkubasi pada suhu kamar selama
7 hari. Suspensi mikroba uji seperti
Bacillus
cereus
,
Pseudomonas
aerogenosa
,
Staphylococcus aureus
,
Aeromonas hydrophilla
,
Vibrio cholera
,
Escherichia coli
,
Bacillus subtilis
, dan
Salmonella
diinokulasi ke permukaan
cawan petri kemudian
Actinomycetes
yang telah ditumbuhkan isolat bakteri
Actinomycetes
dan diinkubasi pada suhu
kamar selama 24 jam. Isolat bakteri
Actinomycetes
yang
menunjukkan
aktivitas antimikroba ditandai dengan
terbentuknya zona bening di sekitar
sumur. Zona bening di sekitar sumur
diukur
diameternya
menggunakan
jangka sorong.
Produksi dan Ekstraksi Actinomycetes
Asosiasi Spons
(Herlina,R,dkk., 2010)
Produksi isolat bakteri dengan media cair dilakukan dengan menginokulasikan bakteri Actinomycetes ke dalam 2 Liter media cair ISP1. Isolat Actinomycetes yang telah diinokulasikan pada media cair ISP1 diinkubasi selama 7 hari pada suhu ruang dalam kondisi tergojok dengan laju penggojokan 120 rpm. Pada akhir proses inkubasi, isolat Actinomycetes kemudian dipindahkan ke dalam erlenmeyer 250 mL dengan volume masing-masing sebanyak 75 mL. Produksi dilakukan selama 7 hari.
Proses ekstraksi dilakukan dengan mengekstraksi pelarut yang digunakan yaitu etil asetat dengan etanol 70%. Ekstrak
Actinomycetes 9ISP1 dilarutkan dalam
32 disaring dan selanjutnya dilakukan sentrifugasi pada kecepatan 3000 x rpm selama 15 menit. Supernatan dipekatkan menggunakan rotary evaporator kemudian ditimbang beratnya. Ekstrak yang diperoleh diuji aktivitas antimikroba.
Ekstraksi dilakukan pada supernatan yang diperoleh dengan pelarut etil asetat dan akan terbentuk dua lapisan. Lapisan yang diambil adalah lapisan organik. Residu yang diperoleh juga dilakukan ekstraksi dengan menggunakan pelarut etil asetat. Ekstrak yang diperoleh dari supernatan dan residu digabungkan. Ekstrak dipekatkan dengan menggunakan rotary evaporator kemudian ditimbang beratnya. Ekstrak yang diperoleh diuji aktivitas antimikroba
.
Uji
Aktivitas
Antimikroba
Ekstrak
Actinomycetes
Pengujian aktivitas antimikroba ekstrak Actinomycetes terhadap bakteri uji dilakukan pada media NA. Ekstrak pekat
Actinomycetes
sebanyak 20 µL/sumur dimasukkan ke dalam sumur pada media NA yang telah diinokulasi dengan bakteri uji dan diinkubasi selama 24 jam pada suhu 37°C. Zona bening yang terbentuk di sekitar sumur diukur diameternya menggunakan jangka sorong.HASIL DAN PEMBAHASAN
Uji Aktivitas Antimikroba Awal Isolat
Actinomycetes Asosiasi Spons
Bakteri hasil isolasi dan peremajaan pada media padat ISP1 memiliki ciri berwarna abu-abu dan membentuk spora yang dapat disimpulkan sebagai bakteri Actinomycetes. Penggunaan media ISP1 bertujuan sebagai pemicu untuk memperkaya atau menyuburkan populasi spesies Streptomyces. Actinomycetes hasil isolasi kemudian dilakukan uji aktivitas antimikrobanya dengan cara menumbuhkannya kembali pada media cair ISP1.
Bakteri Actinomycetes diinokulasi ke dalam media cair ISP1 dan dibiarkan tumbuh selama 7 hari pada suhu ruang. Selama waktu pertumbuhan, bakteri dishaker atau dikocok menggunakan rotary shaker. Tujuan pengocokan adalah untuk menggiatkan kontak antara permukaan bakteri dengan larutan media, memudahkan peresapan larutan nutrisi ke dalam jaringan bakteri,
melancarkan sirkulasi udara, sehingga udara dapat masuk ke dalam media serta menjaga homogenitas atau keseragaman larutan nutrisi dalam media. Setelah bakteri Actinomycetes tumbuh pada media cair, bakteri Actinomycetes kemudian diinokulasi kedalam media padat dengan menggunakan metode sumur. Sebanyak 20 µL/sumur suspensi Actinomycetes diinokulasi ke dalam sumur yang terlah ditumbuhi bakteri uji. Bakteri uji yang digunakan sebanyak 8 jenis yaitu Bacillus cereus, Pseudomonas
aerogenosa, Staphylococcus aureus,
Aeromonas hydrophilla, Vibrio cholera,
Escherichia coli, Bacillus subtilis, dan Salmonella. Kelompok mikroorganisme yang digunakan dalam penelitian ini merupakan bakteri yang bersifat patogen. Indikator besarnya zona hambat yang dihasilkan oleh isolat penghasil antimikroba dan hasil uji aktivitas antibakteri isolat bakteri yang terbaik merupakan penapisan awal seperti pada tabel 1. Namun, dalam uji aktivitas antimikroba isolat bakteri Actinomycetes ini hanya dapat menghambat 2 jenis bakteri uji saja yaitu B. cereus dan A. hydro.
Hasil pengujian aktivitas antibakteri dari bakteri Actinomycetes yang berasosiasi dengan spons ditunjukkan dengan ada atau tidaknya zona bening disekitar sumur. Adanya zona bening disekitar sumur menunjukkan adanya aktivitas antimikroba dari bakteri Actinomycetes asosiasi spons
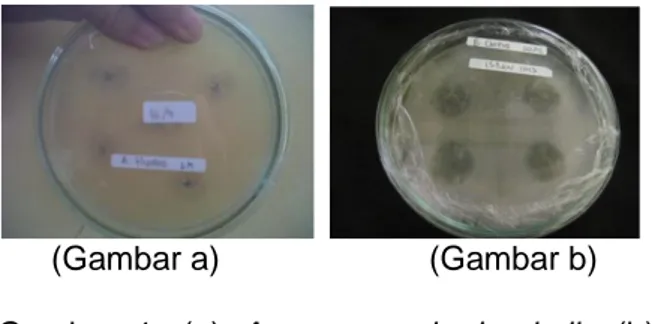
(Gambar a) (Gambar b) Gambar 1. (a) Aeromonas hydrophylla (b)
Bacillus cereus
Isolat Actinomycetes hanya menghambat 2 bakteri uji yaitu Aeromonas hydrophilla (Gambar a) dan Bacillus cereus (Gambar b). Hal ini disebabkan karena isolat Actinomycetes dapat menghambat sintesis dinding sel dari bakteri uji yang mengakibatkan penurunan tekanan osmotik sel sehingga pertumbuhan bakteri uji menjadi terhambat (Jawetz, dkk., 2007). Sedangkan untuk bakteri uji yang lain, isolat bakteri Actinomycetes masih belum mampu
33 menghambatnya. Kemampuan isolat bakteri yang berasosiasi dengan spons dalam menghambat pertumbuhan mikroba uji merupakan bentuk aktivitas antagonis yang diduga dilakukan dengan menghasilkan kandungan senyawa yang bersifat antimikrobial. Dari hasil pengukuran lingkar zona hambat terhadap Bacillus cereus besar zona hambat yang terbentuk adalah sebesar 13,5 mm, sedangkan terhadap Aeromonas
hydrophilla besar zona hambat yang
terbentuk adalah sebesar 12,5 mm. Zona bening yang terbentuk disekeliling isolat disebabkan oleh adanya senyawa antimikroba ekstraseluler yang dikeluarkan oleh Actinomycetes.
Uji awal aktivitas antimikroba hanya mampu menghambat 2 bakteri uji dapat pula disebabkan oleh beberapa faktor seperti isolat tersebut memiliki gen yang mengkode pembentukan senyawa metabolit sekunder namun tidak terekspresi pada keadaan normal. Gen tersebut baru akan terekspresi ketika diinduksi terlebih dahulu dengan cara menambahkan senyawa prekursor. Selain itu, dapat pula disebabkan karena isolat bakteri menghasilkan senyawa antimikroba namun tidak bersifat aktif terhadap bakteri uji dan dapat pula disebabkan karena bakteri menghasilkan senyawa antimikroba secara intraseluler sehingga senyawa yang dihasilkan tidak terekskresi dan terakumulasi di media tumbuh (Jawetz, dkk., 2007). Berikut adalah tabel untuk lingkar zona hambat yang dihasilkan dari uji aktivitas antimiroba bakteri Actinomycetes terhadap bakteri uji tersebut:
Tabel 1. Diameter zona bening yang dihasilkan pada uji aktivitas antimikroba awal (mm)
Bakteri Uji Zona Hambat (mm) B. cereus 13,5 P. Aerogenosa - S. Aureus - A. hydro 12,5 V. Cholera - E. Coli - B. subtilis - Salmonella -
Produksi dan Ekstraksi Actinomycetes
Asosiasi Spons
Produksi bakteri Actinomycetes asosiasi spons dilakukan dengan menginokulasikan bakteri Actinomycetes pada media cair ISP1 kemudian diinkubasi sambil dikocok selama 7 hari pada suhu ruang (Herlina, dkk., 2010). Waktu 7 hari bertujuan untuk menghasilkan metabolit sekunder dari bakteri
Actinomycetes. Metabolit sekunder
dihasilkan pada saat bakteri menjelang fase stasioner. Pertumbuhan bakteri pada media cair ditunjukkan dengan adanya hifa pada media cair sehingga warna larutan media menjadi agak keruh. Tujuan pengocokan adalah untuk menjaga homogenitas atau keseragaman larutan nutrisi dalam media serta menggiatkan kontak antara larutan media dengan permukaan bakteri sehingga memudahkan peresapan larutan nutrisi ke dalam jaringan bakteri dan sirkulasi udara dapat masuk ke dalam media.
Bakteri Actinomycetes yang tumbuh pada media cair ISP1 kemudian dilarutkan ke dalam etil asetat dengan tujuan untuk memisahkan metabolit sekunder yang ingin diperoleh. Etil asetat digunakan karena tingkat kepolarannya yang dekat dengan tingkat kepolaran metabolit sekunder dari bakteri Actinomycetes. Etil asetat dapat mengikat metabolit sekunder dari bakteri Actinomycetes. Setelah dilarutkan ke dalam etil asetat,dilakukan sentrifugasi pada kecepatan 3000 rpm selama 15 menit dengan tujuan memisahkan residu bakteri dengan supernatan yang dihasilkan sebelumnya. Residu dan supernatan masing-masing diekstraksi kembali dengan etil asetat. Hasil ekstraksi dari residu dan supernatan kemudian digabungkan. Ekstrak yang diperoleh dari hasil ekstraksi residu dan supernatan yang digabungkan tersebut kemudian dipekatkan dengan menggunakan
rotary evaporator untuk mendapatkan
metabolit sekunder yang diinginkan. Berat ekstrak yang diperoleh yang didapat dari hasil perhitungan adalah sebesar 5,43 gram. Persen rendemen yang dihasilkan adalah sebesar 0,329%. Ekstraksi dilakukan dengan tujuan untuk memperoleh metabolit sekunder dari ekstrak Actinomycetes yang berasosiasi dengan spons. Ekstrak metabolir sekunder dari Actinomycetes yang diperoleh kemudian digunakan untuk uji aktivitas antimikroba selanjutnya terhadap 8 bakteri
34 uji yang digunakan pada saat uji aktivitas awal untuk mengetahui kemampuannya dalam menghambat pertumbuhan bakteri patogen.
Berdasarkan hasil penelitian yang dilakukan oleh Herlina dkk, isolat Actinomycetes yang diisolasi dari spons termasuk ke dalam genus Streptomyces sp yang menghasilkan metabolit sekunder aktif terhadap bakteri uji Staphylococcus aureus resisten antibiotik dengan kadar 0,0195 µg atau setara dengan 20 µL. Hal ini sesuai dengan penelitian yang telah dilakukan yaitu sebanyak 20 µL ekstrak bakteri dapat menghambat bakteri yang diujikan.
Uji Aktivitas Antimikroba Ekstrak
Actinomycetes
Hasil pengujian aktivitas antibakteri dari ekstrak bakteri yang berasosiasi spons ditunjukkan dengan ada atau tidaknya zona bening disekitar sumur yang telah diinokulasikan bakteri Actinomycetes. Adanya zona bening mengindikasikan adanya aktivitas antibakteri dari ekstrak bakteri Actinomycetes yang berasosiasi spons. Zona bening disekitar sumur menandakan bahwa ekstrak bakteri
Actinomycetes dapat menghambat
pertumbuhan bakteri patogen.
Ekstrak bakteri Actinomycetes hasil evaporasi diencerkan ke dalam etil asetat. Pengujian aktivitas antimikroba ekstrak bakteri Actinomycetes terhadap bakteri dan jamur uji dilakukan pada media padat
Nutrient Agar (NA). Media NA merupakan
suatu medium yang mengandung sumber nitrogen dalam jumlah cukup, yaitu 0,3 % ekstrak daging sapi, 0,5 % pepton tetapi tidak mengandung sumber karbohidrat jadi baik untuk pertumbuhan bakteri namun kapang dan khamir tidak dapat tumbuh dengan baik. Media padat NA digunakan sebagai media universal untuk pertumbuhan bakteri. Ekstrak bakteri Actinomycetes dimasukkan ke dalam sumur pada media padat yang telah diinokulasi dengan bakteri atau jamur uji selama 24 jam pada suhu 37°C. Penggunaan waktu 24 jam bertujuan untuk mengetahui laju pertumbuhan bakteri. Semakin lama waktu inkubasi, maka laju pertumbuhan bakteri semakin meningkat, sedangkan penggunaan suhu 37°C bertujuan agar kondisi lingkungan dari bakteri tetap stabil. Setelah 24 jam, zona bening yang terbentuk kemudian dihitung
besarnya. Pengukuran ekstrak bakteri Actinomycetes dilakukan terhadap 8 bakteri dan jamur uji, yaitu B. cereus, P. aerogenosa, S. aureus, A. hydro, V. colera, E. coli, B. subtilis dan Salmonella.
Hasil pengukuran ekstrak bakteri Actinomycetes terhadap bakteri dan jamur uji tersebut menunjukkan besar zona bening untuk bakteri uji B. cereus adalah sebesar 17,6 mm. Besar zona bening bakteriostatik yang terbentuk dari pengujian ekstrak bakteri
Actinomycetes terhadap bakteri uji P.
Aerogenosa adalah sebesar 26,6 mm. Pada zona bening yang dihasilkan oleh bakteri uji ini, terdapat daerah zona bening di dalamnya yang disebut daerah bakterisida. Daerah bakterisida merupakan daerah dimana ekstrak bakteri Actinomycetes dapat membunuh bakteri uji, sedangkan zona bening yang terdapat di luar bakterisida namun masih merupakan wilayah zona bening disebut dengan daerah bakteriostatik yang berarti daerah dimana ekstrak bakteri Actinomycetes hanya dapat menghambat bakteri yang diujikan. Besar zona bening bakterisida yang terbentuk dari pengujian ekstrak bakteri Actinomycetes terhadap bakteri uji S. aureus adalah sebesar 13,15 mm.
Menurut penelitian yang dilakukan oleh Herlina,R dkk pada tahun 2010, menyimpulkan bahwa senyawa antibakteri yang dihasilkan dari Actinomycetes asosiasi spons diduga merupakan senyawa turunan karboksilat serta isolat Actinomycetes yang diisolasi dari spons termasuk ke dalam genus Streptomyces sp yang menghasilkan metabolit sekunder aktif terhadap bakteri S. aureus resisten antibiotik dengan kadar yang masih bisa menghambat 0,0195 µg. Besar zona bening yang terbentuk oleh ekstrak bakteri Actinomycetes terhadap bakteri uji A. hydro adalah sebesar 24,65 mm.
Besar zona bening yang terbentuk oleh ekstrak bakteri Actinomycetes terhadap bakteri uji V. cholera adalah sebesar 17,4 mm. Besar zona bening yang terbentuk oleh Actinomycetes terhadap bakteri uji E. coli adalah sebesar 29,1 mm. Besar zona bening yang terbentuk oleh ekstrak bakteri Actinomycetes terhadap bakteri uji B. subtilis adalah sebesar 25,7 mm. Besar zona bening yang terbentuk oleh ekstrak bakteri
Actinomycetes terhadap bakteri uji
35 Reaksi positif ditunjukkan oleh ekstrak bakteri Actinomycetes yang diujikan pada 8 bakteri uji pada uji aktivitas antimikroba yang ditandai dengan terbentuknya zona bening disekitar sumur seperti yang ditunjukkan pada Tabel 2.
Tabel 2. Diameter zona bening ekstrak bakteri Actinomycetes hasil uji aktivitas antimikroba terhadap 8 bakteri uji dalam mm dengan konsentrasi 20µL/sumur
Bakteri Uji
Diameter zona bening (mm) Pengulangan 1 2 3 4 B. cereus P. aerogenosa S. aureus A. hydro V. cholera E. coli B. subtilis Salmonella 17,7 25,4 12,9 23,5 16,7 28,25 25,9 24,95 17,75 23,3 13,7 26 17,05 29,5 24,7 25,25 17,3 30,1 12,8 25,6 17,7 29,5 26,6 23,8 17,6 27,6 13,2 23,5 18,1 29,1 25,6 25,2
Ekstrak bakteri menunjukkan aktivitas dari metabolit sekunder yang mampu menghambat bahkan mematikan bakteri uji. Zona penghambatan pertumbuhan bakteri uji disebabkan oleh metabolit sekunder yang dihasilkan oleh ekstrak isolat bakteri
Actinomycetes. Ekstrak bakteri
Actinomycetes selalu membentuk zona bening pada setiap uji aktivitas antibakteri. Hasil ini menunjukkan bahwa senyawa aktif ekstraseluler yang dihasilkannya memiliki spektrum yang luas sebagai agen antimikroba. Ekstrak bakteri Actinomycetes memiliki aktivitas terhadap jenis bakteri berGram positif maupun negatif. Hal inilah yang mengindikasikan bahwa ekstrak isolat bakteri Actinomycetes memiliki spektrum luas yang mampu bekerja untuk bakteri Gram positif dan Gram negatif.
Aktivitas antibakteri yang dihasilkan oleh bakteri simbion berhubungan erat dengan kemampuan spons yang telah menjadi salah satu penghasil senyawa bioaktif paling prospektif dari semua invertebrata laut dan juga peranan besar bakteri simbion itu sendiri dalam proses metabolisme dan pertahanan kimiawi dari spons. Pada uji awal aktivitas antimikroba, Actinomycetes hanya mampu menghambat 2 bakteri uji sedangkan pada saat uji aktivitas akhir,
Actinomycetes dapat menghambat seluruh
bakteri uji. Hal ini dapat disebabkan karena aktivitas spesifik dari Actinomycetes meningkat. Sebab, pada saat proses ekstraksi, Actinomycetes menghasilkan metabolit sekunder (Lee, dkk., 2000).
SIMPULAN
Berdasarkan hasil penelitian yang telah dilakukan dapat disimpulkan bahwa:
1. Bakteri Actinomycetes hasil isolasi berbentuk spora dan memiliki warna abu-abu.
2. Bakteri Actinomycetes yang bersimbion dengan spons yang ditumbuhkan pada media ISP1 terbukti menghasilkan senyawa antimikroba yang dapat menghambat 8 bakteri patogen Gram positif dan Gram negatif.
3. Zona terbaik pada ekstrak bakteri Actinomycetes adalah E. coli dengan zona hambat rata-rata sebesar 29,1 mm.
DAFTAR PUSTAKA
Abubakar Hermawaty, Aris Tri Wahyudi, Munti Yuhana., 2011, Skrining Bakteri yang Berasosiasi dengan Spons Jaspis sp. Sebagai Penghasil Senyawa Antimikroba, ilmu kelautan, 16 (1) : 35-40.
Atlas, R., 1998, Principle of Microbiology, WmC, Brown Publisher, USA.
Das, S., Lyla, P.S., and Khan, S.A., 2006, Marine Microbial Diversity and Ecology, Importance and Future Perspective, Curr. Science, 90 (10) : 1325–1335.
Deshpande, J.D., Joshi, M., 2011, Antimicrobial Resistance : The Global Public Health Challenge, International Journal of Student Research, 1 (2) Jawetz, Melnick dan Adelberg., 2007,
Mikrobiologi Kedokteran, EGC, Jakarta, 165-174.
Kelecom, A, 2002, Secondary Metabolites From Marine Microorganisms, An. Acad. Bras. Scienc, 74 (1) : 151–170. Herlina,Rante., Wahyono, Yosi, B. Murti., Gemini Alam., 2010, Purifikasi dan karakterisasi senyawa antibakteri dari Actinomycetes asosiasi spons terhadap bakteri patogen resisten, Majalah Farmasi Indonesia, 21 (3) : 158–165.
36 Lee, Y. K., Lee, J.-H. & Lee, H. K., 2001,
Microbial Symbiosis In Marine Sponges. J Microbiol 39 : 254-264. Mahdiyah, Dede dan Bayu Hari Mukti., 2012,
Penapisan Bakteri Yang Berasosiasi Dengan Spons Jaspis Sp. Penghasil Enzim Amilase, Bioscientiae 9 (2) : 9-14.
Rahayu, Eka. U., 2012, Antibiotika, Resistensi dan Rasionalitas Terapi,
Fakultas Sains dan Teknologi UIN Maliki Malang, Saintis 1 (1).
Sunaryanto, R., Marwoto, B., Matsuo, Y., 2010, Isolasi Actinomycetes Laut Penghasil Metabolit Sekunder Yang Aktif Terhadap Sel Kanker A549, Jurnal Pascapanen dan Bioteknologi Kelautan dan Perikanan, 5(2).