LAPORAN PRAKTIKUM LAPORAN PRAKTIKUM
PENENTUAN KADAR GLUKOSA PENENTUAN KADAR GLUKOSA
NAMA
NAMA : NURHAJRAH: NURHAJRAH NIM
NIM : H 311 09 275: H 311 09 275 KELOMPOK
KELOMPOK : : II II (DUA)(DUA) HARI /
HARI / TGL. PERC. TGL. PERC. : KAMIS : KAMIS / 07 / 07 APRIL 201APRIL 20111 ASISTEN
ASISTEN : : YUSTINYUSTIN
LABORATORIUM BIOKIMIA LABORATORIUM BIOKIMIA
JURUSAN KIMIA JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS HASANUDDIN UNIVERSITAS HASANUDDIN MAKASSAR MAKASSAR 2011 2011
BAB I BAB I PENDAHULUAN PENDAHULUAN 1.1 Latar Belakang 1.1 Latar Belakang
Setiap hari tubuh kita memerlukan energi untuk menunjang aktivitas yang Setiap hari tubuh kita memerlukan energi untuk menunjang aktivitas yang kita kerjakan. Energi yang diperlukan ini kita peroleh dari bahan makanan yang kita kerjakan. Energi yang diperlukan ini kita peroleh dari bahan makanan yang kita makan. Pada umumnya bahan makanan itu mengandung tiga kelompok kita makan. Pada umumnya bahan makanan itu mengandung tiga kelompok utama, yaitu karbohidrat, protein dan lipid atau lemak. Dari ketiga unsur utama utama, yaitu karbohidrat, protein dan lipid atau lemak. Dari ketiga unsur utama tersebut karbohidrat merupakan salah satu kebutuhan pokok manusia dan tersebut karbohidrat merupakan salah satu kebutuhan pokok manusia dan memegang peranan yang sangat penting karena merupakan sumber tenaga bagi memegang peranan yang sangat penting karena merupakan sumber tenaga bagi kegiatan kita sehari-hari. Sebagian besar zat-zat alam merupakan golongan kegiatan kita sehari-hari. Sebagian besar zat-zat alam merupakan golongan karbohidrat, dimana fungsinya sebagai bahan baku atau bahan sumber energi. karbohidrat, dimana fungsinya sebagai bahan baku atau bahan sumber energi.
Karbohidrat adalah persenyawaan antara karbon, hidrogen, dan oksigen Karbohidrat adalah persenyawaan antara karbon, hidrogen, dan oksigen yang terbentuk di alam dengan rumus umum Cn(H
yang terbentuk di alam dengan rumus umum Cn(H22O)O)nn. Dengan rumus empiris. Dengan rumus empiris
tersebut, senyawa ini dapat diduga sebagai “hidrat dari karbon”, sehingga disebut tersebut, senyawa ini dapat diduga sebagai “hidrat dari karbon”, sehingga disebut karbohidrat.
karbohidrat.
Glukosa adalah karbohidrat sederhana yang paling banyak diperlukan Glukosa adalah karbohidrat sederhana yang paling banyak diperlukan dalam tubuh manusia. Glukosa merupakan salah satu jenis karbohidrat penting dalam tubuh manusia. Glukosa merupakan salah satu jenis karbohidrat penting dan termasuk dalam kelompok gula reduksi. Glukosa dapat mereduksi ion kupri dan termasuk dalam kelompok gula reduksi. Glukosa dapat mereduksi ion kupri menjadi kupro sehingga reaksi ini dapat digunakan sebagai dasar di dalam menjadi kupro sehingga reaksi ini dapat digunakan sebagai dasar di dalam penentuan
penentuan glukosa glukosa dan dan dilakukan dilakukan dengan dengan berbagai berbagai metode metode antara antara lain lain : : LuffLuff Schroll, Munson-Walker, Lane-Eynon dan Somogy-Nelson.
Schroll, Munson-Walker, Lane-Eynon dan Somogy-Nelson.
Berdasarkan hal tersebut di atas maka dilakukanlah percobaan ini, yaitu Berdasarkan hal tersebut di atas maka dilakukanlah percobaan ini, yaitu penentuan kadar glukosa deng
1.2 Maksud dan Tujuan Percobaan 1.2.1 Maksud Percobaan
Maksud dari percobaan ini adalah untuk mengetahui dan mempelajari teknik penentuan kadar glukosa dalam suatu sampel dengan metode Somogy- Nelson.
1.2.2 Tujuan Percobaan
Tujuan dilakukannya percobaan ini adalah untuk menentukan kadar glukosa dalam sampel melalui metode Somogy-Nelson dengan menggunakan spektronik 20D+.
1.3 Prinsip Percobaan
Penentuan kadar glukosa didasarkan dari hasil reduksi ion kupri oleh glukosa dalam suasana basa dengan menggunakan arsenomolibdat yang memberikan warna biru dan absorbansinya diukur dengan spektronik 20D+ pada panjang gelombang tertentu.
BAB II
TINJAUAN PUSTAKA
Karbohidrat didefinisikan secara tepat sebagai senyawa dengan rumus molekul Cn(H2O)n. Namun, kata ’karbohidrat’ umumnya digunakan dalam
pengertian lebih terbatas untuk menunjukkan zat yang terdiri atas polihidroksi aldehida dan keton serta turunannya. Gula yang kita kenal dengan sebutan sakarida, umumnya diperlukan sebagai karbohidrat khas. Monosakarida adalah karbohidrat yang biasanya memiliki tiga sampai sembilan atom karbon (Pine, dkk., 1988).
Karbohidrat ini merupakan sumber kalori atau mikronutrien utama bagi organisme heterotroph. Sebagian lagi sebagai bahan utama sandang (misalnya serta kapas). Industri (rami, rosela), bahan bangunan (kayu, bambu) atau bahan baker (kayu baker, seresah). Disamping sebagai sumber utama biokalori dalam bahan makanan, beberapa jenis karbohidrat dan turunannya (derivatnya) memegang peranan penting dalam teknologi makanan misalnya gum (Arabic, karaya, guar) sebagai bahan pengental atau CMC (carboxymethylcellulose) sebagai bahan penstabil dan banyak lagi sebagai bahan pemanis (sukrosa, glukosa, fruktosa) (Sudarmadji, 1996).
Berdasarkan jumlah monomer pembentuk suatu karbohidrat maka dapat dibagi atas tiga golongan besar yaitu monosakarida, disakarida dan polisakarida. Istilah sakarida berasal dari bahasa latin dan mengacu pada rasa manis senyawa karbohidrat sederhana. Monosakarida adalah karbohidrat yang tidak dapat dihidrolisis menjadi senyawa yang lebih sederhana (Tim Dosen Kimia, 2009).
Monosakarida adalah karbohidrat yang sederhana, dalam arti molekulnya hanya terdiri dari beberapa jenis atom karbon saja dan tidak dapat diuraikan dengan cara hidrolisis dalam kondisi lunak menjadi karbohidrat lain. Monosakarida yang paling sederhana adalah gliseraldehida dan dihidroksiaseton (Poedjiadi, 1994).
Salah satu monosakarida yang amat penting adalah glukosa atau sering dikenal dengan dekstrosa. Glukosa adalah gula yang mempunyai enam atom karbon dan dengan demikian disebut heksosa. Karbohidrat lima karbon dikenal sebagai pentosa dan selanjutnya. Kenyataan bahwa gugus karbonil adalah sebuah aldehida yang ditunjukkan dengan menggolongkan glukosa sebagai aldoheksosa. Monosakarida yang amat penting yaitu D-glukosa sering dikenal sebagai dektrosa.
CHO OH H H HO OH H OH H CH2OH D - glukosa
Rumus proyeksi Fischer adalah cara umum untuk menggambarkan molekul monosakarida. Proyeksinya biasa digambar dengan sebuah rantai karbon vertikal dan gugus karbonil paling dekat dengan puncak (Pine, dkk., 1988).
Glukosa adalah suatu heksosa dan sering disebut dekstrosa karena sifat dapat memutar cahaya terpolarisasi ke arah kanan. Di alam, glukosa terdapat dalam
buah-buahan dan madu lebah. Darah manusia normal mengandung glukosa dalam jumlah atau konsentrasi tetap, yaitu antara 70-100 mg tiap mL darah. Glukosa darah ini bertambah setelah kita makan-makanan sumber karbohidrat, namun kira-kira dua jam setelah itu, jumlah glukosa darah akan kembali pada keadaan semula. Pada orang yang menderita diabetes mellitus atau kencing manis, jumlah glukosa darah lebih besar dari 130 mg per 100 mL darah (Poedjiadi, 1994).
Monosakarida segera mereduksi senyawa-senyawa pengoksidasi seperti fersianida, hydrogen peroksida, atau ion kupri (Cu2+). Pada reaksi seperti ini, gula dioksidasi pada gugus karbonil, dan senyawa pengoksidasi menjadi tereduksi. Glukosa dan gula-gula lain yang mampu mereduksi senyawa pengoksidasi disebut gula pereduksi. Sifat ini berguna dalam analisa gula. Dengan mengukur jumlah dari senyawa pengoksidasi yang tereduksi oleh suatu larutan gula tertentu. Dapat dilakukan pendugaan konsentrasi gula. Dengan cara ini, darah dan air seni dapat dianalisa kandungan gulanya pada diagnosa diabetes mellitus. Penderita penyakit ini menunjukan tingkat gula darah yang tinggi secara Abnormal, dan pengeluaran gula pada air seni yang berlebih (Lehninger, 1982).
Penentuan monosakarida yang dihasilkan dapat dilakukan dengan metoda oksidasi dengan kupri. Metoda ini didasarkan pada peristiwa terduksinya kupri-oksida menjadi kupro-kupri-oksida karena adanya gula reduksi. Reagen yang digunakan merupakan campuran kupri sulfat, Na-karbonat, dan asam sitrat atau campuran kupri sulfat dengan K-Na-Tartrat. K-Na-Tartrat berfungsi sebagai pencegah terjadinya pengendapan kupri oksida yang ada dalam reagen. Pada kedua macam reagen tersebut yang berfungsi sebagai oksidator adalah kuprooksida dan mengendap berwarna merah bata. Jumlah endapan kuprooksida ekivalen dengan
banyaknya gula reduksi yang ada. Selain dengan cara tersebut, dapat juga dengan menentukan kelebihan kuprioksida yang ada dalam larutan sebelum dan sesudah direaksikan dengan gula reduksi (Sudarmadji, 1996).
Berbagai cara analisa dapat dilakukan terhadap karbohidrat untuk memenuhi berbagai keperluan. Dalam ilmu dan teknologi pangan, analisa karbohidrat yang biasa dilakukan misalnya penentuan jumlahnya secara kuantitatif dalam rangka menentukan komposisi suatu bahan makanan, penentuan sifat fisis atau kimiawinya dalam kaitannya dengan pembentukan kekentalan, kelekatan, stabilitas larutan, dan tekstur hasil olahannya (Sudarmadji, 1996).
Banyak cara yang dapat digunakan untuk menentukan banyaknya karbohidrat dalam suatu bahan yaitu antara lain dengan cara kimiawi, cara fisik, cara enzimatik atau biokimiawi dan cara kromatografi. Penentuan karbohidrat yang termasuk polisakarida maupun oligosakarida memerlukan perlakuan pendahuluan yaitu hidrolisa terlebih dahulu sehingga diperoleh monosakarida. Untuk keperluan ini, maka bahan dihidrolisa dengan asam atau enzim pada suatu keadaan yang tertentu (Sudarmadji, 1996).
Penentuan gula pereduksi selama ini dilakukan dengan metode pengukuran konvensional seperti metode osmometri, polarimetri, dan refraktometri maupun berdasarkan reaksi gugus fungsional dari senyawa sakarida tersebut (seperti metode Luff-Schrool, Seliwanoff, Nelson-Somogy dan lain-lain). Hasil analisisnya adalah kadar gula pereduksi total dan tidak dapat menentukan gula pereduksi secara individual (Ratnayani, dkk., 2008).
Metode Somogy-Nelson didasarkan pada hasil reduksi ion kupri oleh glukosa (gula reduksi) dalam suasana basa dengan arsenomolibdat yang
memberikan warna biru (molybdenium blue). Intensitas warna yang terbentuk bergantung pada konsentrasi glukosa. Absorbansi diukur pada panjang gelombang tertentu dengan spektrofotometer. Dengan menggunakan larutan standar maka konsentrasi glukosa dapat diketahui (Patong, 2011).
Salah satu alat yang dapat mengukur absorban dari larutan yang berwarna adalah spektrofotometer. Teknik spektrofotometri telah lama digunakan sebagai suatu teknik yang handal untuk deteksi, identifikasi, dan pengukuran kadar senyawa kimia dalam suatu larutan. Spektrum cahaya yang dapat terlihat oleh mata terentang antara 400 nm sampai 800 nm. Pada teknik spektrofotometri, cahaya dari sumber cahaya diuraikan dengan menggunaka prisma sehingga diperoleh cahaya monokromatis yang diserap oleh zat yang akan diperiksa. Cahaya monokromatis merupakan cahaya satu warna dengan satu panjang gelombang, sehingga cahaya yang diserap oleh larutan berwarna dapat diukur. Hubungan antara konsentrasi dengan cahaya yang diserap dinyatakan dalam hukum Beer-Lambert. Hukum Beer-Lambert menyatakan pengurangan intensitas cahaya monokromatis yang melalui suatu larutan berwarna berlangsung secara eksponensial dan bergantung pada panjang larutan yang dilalui cahaya dan kadar zat dalam larutan (Soewoto, 2001).
Hukum Beer-Lambert menghasilkan persamaan sebagai berikut (Soewoto, 2001):
I
log = - kcl
Dengan, Io = intensitas cahaya masuk I = intensitas cahaya keluar
k = konstanta yang didasarkan pada sifat-sifat zat dalam larutan c = konsentrasi zat tersebut
l = panjang larutan yang dilalui cahaya
Perbandingan I/Io disebut sebagai transmisi sinar (T) dan dinyatakan dalam persen (%). Serapan ( Absorbance) = A atau disebut juga kerapatan optik (optical density) = OD, merupakan istilah yang lebih sering digunakan dan berasal dari persamaan (Soewoto, 2001) :
A = - log T
Jadi, A = K c l
Pada alat spektrofotometer yang lebih canggih, sinar yang datang benar- benar diusahakan berupa sinar monokromatis dengan cara membuat kontainer
larutan (kuvet) yang sedemikian rupa, sehingga tidak ada sinar yang tertahan. Jika jalur sinar pada setiap bagian kuvet itu sama, maka nilai k untuk berbagai
senyawa dalam berbagai larutan dan berbagai panjang gelombang dapat dihitung (Soewoto, 2001).
BAB III
METODE PERCOBAAN
3.1 Bahan
Bahan yang digunakan dalam percobaan ini adalah larutan sampel M-150, larutan Nelson A 15,38 mL dan Nelson B 0,62 mL, glukosa monohidrat, arsenomolibdat, akuades, spiritus, aluminium foil, tissue roll, korek, sabun dan kertas label.
3.2 Alat
Alat yang digunakan dalam percobaan ini adalah tabung reaksi, rak tabung, sikat tabung, pipet tetes, pipet skala 0,2 mL, pipet skala 5 mL, pipet skala 10 mL, gelas kimia 100 mL, labu ukur 10 mL, statif, klem, buret 50 mL, bulb, filler pipet, gegep, kaki tiga, pembakar spiritus, labu semprot, spektronik 20D+.
3.3 Prosedur Kerja
3.3.1 Pembuatan Larutan Induk
Ditimbang 10 mg glukosa monohidrat dan dilarutkan dalam labu ukur 10 mL dengan akuades sampai tanda batas. Sehingga diperoleh larutan induk 1 mg/mL.
3.3.2 Pembuatan Larutan Standar
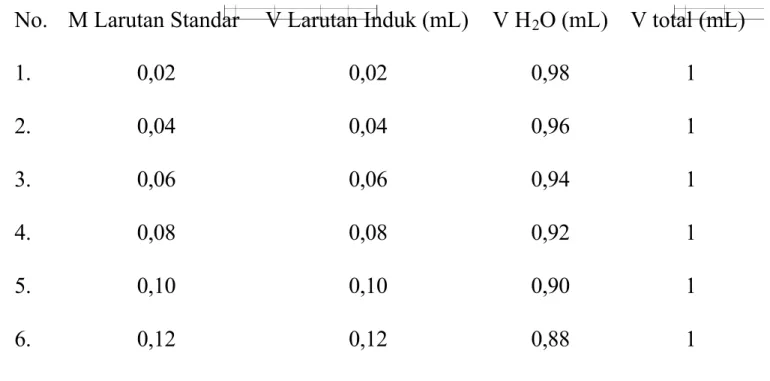
Dipipet larutan induk ke dalam masing-masing tabung reaksi sebanyak 0,02 mL; 0,04 mL; 0,06 mL; 0,08 mL; 0,10 mL dan 0,12 mL. Kemudian ditambahkan aquades masing-masing 0,98 mL; 0,96 mL; 0,94 mL; 0,92 mL; 0,90 mL, dan 0,88 mL. Tiap larutan dalam tabung dihomogenkan.
Tabel 1. Data Pembuatan Larutan Standar
No. M Larutan Standar V Larutan Induk (mL) V H2O (mL) V total (mL)
1. 0,02 0,02 0,98 1 2. 0,04 0,04 0,96 1 3. 0,06 0,06 0,94 1 4. 0,08 0,08 0,92 1 5. 0,10 0,10 0,90 1 6. 0,12 0,12 0,88 1 3.3.3 Preparasi Sampel
Pada pembuatan larutan sampel digunakan faktor pengenceran sebanyak 10.000 kali. Pada tahap pertama dilakukan pengenceran 100 kali, yaitu sampel dibuat dengan mengambil 0,01 mL larutan sampel (M 150) dan dimasukkan dalam tabung reaksi lalu ditambahkan akuades sebanyak 0,99 mL kemudian dikocok. Dilanjutkan pada tahap kedua, dilakukan lagi pengenceran 100 kali, yaitu dipipet sebanyak 0,01 larutan sampel tadi kemudian ditambahkan lagi akuades sebanyak 0,99 mL kemudian dikocok.
3.3.4 Pembuatan Pereaksi
Larutan Nelson A dan Larutan Nelson B dibuat dengan perbandingan 25 : 1. Dipipet larutan Nelson A sebanyak 15,38 mL ke dalam gelas ukur dan ditambahkan 0,62 mL larutan Nelson B kemudian dihomogenkan.
3.3.5 Penentuan Kadar Glukosa
Masing-masing larutan standar, sampel, dan blanko ditambahkan 1 mL pereaksi Nelson, kemudian dipanaskan ± 20 menit lalu didinginkan. Ditambahkan reagen arsenomolibdat sebanyak 1 mL. Setelah itu ditambahkan akuades se banyak 7 mL dan dikocok. Ditambahkan lagi 10 mL akuades ke dalam setiap tabung kemudian dikocok. Hal ini dilakukan karena warna yang ditimbulkan masih sangat pekat. Diukur absorban pada panjang gelombang maksimum 670 nm dengan menggunakan spektronik 20D+.
DAFTAR PUSTAKA
Lehninger, A. L., 1982, Dasar-dasar Biokimia diterjemahkan oleh Maggy Thenawijaya, Penerbit Erlangga, Jakarta.
Patong, A. R., 2011, Penuntun dan Laporan Praktikum Biokimia, Universitas Hasanuddin, Makassar.
Pine, S. H., J. B. Hendrickson, D. J. Cram, dan G. S. Hammond, 1988, Kimia Organik 2 edisi keempat diterjemahkan oleh Hamid, A., ITB, Bandung. Poedjiadi, A., 1994, Dasar-Dasar Biokimia, UI-Press, Jakarta.
Ratnayani, K., N. M. A. Dwi Adhi S., dan I G. A. M. A. S. Gitadewi, Penentuan Kadar Glukosa dan Fruktosa pada Madu Randu dan Madu Kelengkeng
dengan Metode Kromotografi Cair Kinerja Tinggi , Jurnal Kimia (online), 2 (2), 77-86, (http://www.Jstage.jst.go.jp, diakses tanggal 06 April 2011, pukul 21:38).
Soewoto, H. M., Sadikin, M. V., Kurniati, S. I., Wanandi, D., Retno, P., Abadi, A., Retnoprijati, I. P., Harahap, S. A., dan Jusman, 2001, Biokimia Eksperimen Laboratorium, Widya Medika, Jakarta.
Sudarmadji, 1996, Analisa Bahan Makanan, Liberty, Yogyakarta.
Tim Dosen Kimia, 2009, Kimia Dasar , UPT MKU Universitas Hasanuddin, Makassar.
LEMBAR PENGESAHAN
Makassar, 14 April 2011
Asisten Praktikan
BAB IV
HASIL DAN PEMBAHASAN
Pada percobaan penentuan kadar glukosa ini dilakukan dengan menggunakan metode Somogy-Nelson. Metode ini didasarkan pada hasil reduksi ion kupri oleh glukosa (gula reduksi) dalam suasana basa dengan reagen arsenomolibdat yang memberikan warna biru (molybdenum blue). Selanjutnya diukur absorbansinya pada panjang gelombang tertentu dengan menggunakan spektrofotometer. Pada percobaan ini absorban yang diukur yaitu pada larutan sampel, blanko, dan larutan standar.
Tabel. 2 Data Penentuan Panjang Gelombang Maksimum
Panjang Gelombang () (nm) Absorban
650 0,99
660 0,012
670 1,024
675 1,014
Berdasarkan tabel di atas, maka dapat dibuat grafik sebagai berikut : Grafik. 1 Penentuan Panjang Gelombang Maksimum
Jadi, panjang gelombang maksimum adalah 670 nm.
Tabel 3. Data Penentuan Kadar Glukosa pada = 760 nm
Konsentrasi Larutan Contoh Absorban
0,02 0,008 0,04 0,588 0,06 1,026 0,08 1,276 Sampel 1,026 0 0.2 0.4 0.6 0.8 1 1.2 645 650 655 660 665 670 675 680 685 A b s o r b a n Panjang gelombang (nm)
Berdasarkan tabel di atas, maka dapat dibuat grafik sebagai berikut : Grafik. 2 Penentuan Kadar Glukosa
Berdasarkan grafik hubungan konsentrasi dan absorbansi, diperoleh persamaan garis y = 21,21x – 0,336, sehingga kadar glukosa dalam sampel M 150
dapat dihitung : y = 21,21x – 0,336 1,026 = 21,21x – 0,336 21,21x = 1,026 + 0,336 x = 1,026 + 0,336 21,21 x = 0,064 mg/mL
Jadi, kadar glukosa dalam sampel M 150 = x . fp
= 0,06 . 10000 = 640 mg/mL
Pada percobaan ini, penentuan kadar glukosa dalam sampel dilakukan dengan metode Somogy-Nelson. Deret standar yang digunakan yaitu pada konsentrasi 0,02 M; 0,04 M; 0,06 M; 0,08 M; 0,10 M dan 0,12 M. Sampel yang dianalisa diberikan pengenceran sebanyak 10000 kali.
y = 21.21x - 0.336 R² = 0.9705 0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 0 0.02 0.04 0.06 0.08 0.1 A b s o r b a n Konsentrasi larutan
Deret standar, sampel dan blanko diberi perlakuan sesuai dengan metode Somogy-Nelson. Setelah larutan standar, sampel, dan blanko dibuat, ditambahkan pereaksi Nelson sebanyak 1 mL, dimana penambahan pereaksi Nelson ini berguna sebagai pembawa ion kupri. Setelah ditambahkan pereaksi Nelson dipanaskan secara bersamaan selama ± 20 menit hal ini bertujuan agar ion kupri tereduksi oleh gula pereduksi (glukosa) sehingga menjadi ion kupro dalam suasana basa.
Setelah pemanasan selama ± 20 menit, terbentuk endapan merah bata (Cu2O) yang warnanya semakin pekat sesuai dengan konsentrasi glukosa pada
larutan. Semakin banyak glukosa maka semakin merah pula warnanya. Setelah itu larutan standar, sampel, dan blanko didinginkan dan ditambahkan arsenomolibdat masing-masing 1 mL, dimana arsenomolibdat ini berfungsi sebagai pembentuk kompleks yang berwarna biru. Setelah itu ditambahkan akuades sebanyak 7 mL. Karena warna yang ditimbulkan masih sangat pekat, maka ditambahkan lagi pada masing-masing tabung dengan 10 mL akuades. Selanjutnya, masing-masing larutan diukur absorbansinya pada spektronik 20D+ dengan menggunakan panjang gelombang maksimum yaitu 670 nm.
Pengukuran absorbansi hanya sampai pada konsentrasi 0,08 M, karena pada konsentrasi 0,10 M, sprektonik 20D+ sudah tidak dapat terbaca, hal ini
disebabkan karena warna dari larutan tersebut sudah sangat pekat.
Dari data yang diperoleh, maka didapatkan kadar glukosa dalam sampel adalah 640 mg/mL.
BAB V PENUTUP
5.1 Kesimpulan
Berdasarkan percobaan yang telah dilakukan, dapat disimpulkan bahwa kadar glukosa dalam sampel adalah 640 mg/mL.
5.2 Saran
Untuk laboratorium, agar peralatan yang akan digunakan pada saat praktikum diperiksa terlebih dahulu sebelum praktikum berlangsung.
Untuk asisten, agar dalam memberi penjelasan jangan terlalu cepat agar praktikan dapat menyimaknya dengan baik sehingga dapat melakukan percobaan
LAMPIRAN
Bagan Kerja
1. Pembuatan Larutan Induk
2. Pembuatan Larutan Standar
0,02 mg/mL
0,04 mg/mL
Glukosa
- Ditimbang sebanyak 0,01 gram
- Dimasukkan kedalam labu ukur 10 mL - Ditambahkan akuades sampai tanda
batas
- Dihomogenkan Hasil
Larutan Induk
- Dipipet sebanyak 0,02 mL
- Dimasukkan kedalam tabung reaksi - Ditambahkan 0,98 mL akuades - Dihomogenkan
- Dipipet sebanyak 0,04 mL
- Dimasukkan kedalam tabung reaksi - Ditambahkan 0,96 mL akuades - Dihomogenkan
Larutan Induk Hasil
0,06 mg/mL
0,08 mg/mL
0,10 mg/mL
Larutan Induk
- Dipipet sebanyak 0,06 mL
- Dimasukkan kedalam tabung reaksi - Ditambahkan 0,94 mL akuades - Dihomogenkan
Hasil
Larutan Induk
- Dipipet sebanyak 0,08 mL
- Dimasukkan kedalam tabung reaksi - Ditambahkan 0,92 mL akuades - Dihomogenkan
Hasil
Larutan Induk
- Dipipet sebanyak 0,10 mL
- Dimasukkan kedalam tabung reaksi - Ditambahkan 0,90 mL akuades - Dihomogenkan
0,12 mg/mL
3. Preparasi Sampel
4. Penentuan Kadar Glukosa Larutan Induk
- Dipipet sebanyak 0,12 mL
- Dimasukkan kedalam tabung reaksi - Ditambahkan 0,88 mL akuades - Dihomogenkan
Hasil
Larutan Sampel (M-150)
- Dipipet sebanyak 0,01 mL kedalam tabung reaksi
- Ditambahkan 0 99 mL akuades 1 mL larutan sampel
- Dipipet sebanyak 0,01 mL kedalam tabung reaksi - Ditambahkan 0,99 mL akuades
- Dihomogenkan 1 mL larutan sampel
Larutan Standar, Sampel, dan Blanko
- Ditambahkan 1 mL pereaksi Nelson - Dipanaskan selama ± 20 menit - Didinginkan
- Ditambahkan 1 mL arsenomolibdat - Ditambahkan 17 mL akuades
- Diukur absorbannya pada panjang gelombang 670 nm menggunakan spektrofotometer
Perhitungan
1. Pembuatan Larutan Induk
Dik: M = 1 mg/mL
Volume = 10 mL
Mr. Glukosa monohidrat = 198 gr/mol
Mr. Glukosa = 180 gr/mol
Dit: Massa glukosa monohidrat = ...? Penyelesaian: M = r lukosa
mg 1 mg/mL = x
x mg = 11 mg/10 mL = 1,1 mg = 0,01 gram2. Pembuatan Larutan Standar Dik: M1 = 1 mg/mL M2 : a. 0,02 mg/mL b. 0,04 mg/mL c. 0,06 mg/mL d. 0,08 mg/mL e. 0,010 mg/mL f. 0,012 mg/mL V2= 1 mL Dit: V1 = ...?
Penyelesaian: a. Konsentrasi glukosa 0,02 mg/mL V1 . M1 = V2 . M2 V1 . 1 mg/mL = 1 mL . 0,02 mg/mL V1 = 0,02 mL V akuades = 1 mL – 0,02 mL = 0,98 mL b. Konsentrasi glukosa 0,04 mg/mL V1 . M1 = V2 . M2 V1 . 1 mg/mL = 1 mL . 0,04 mg/mL V1 = 0,04 mL V akuades = 1 mL – 0,04 mL = 0,96 mL c. Konsentrasi glukosa 0,06 mg/mL V1 . M1 = V2 . M2 V1. 1 mg/mL = 1 mL . 0,06 mg/mL V1 = 0,06 mL V akuades = 1 ml – 0,06 mL = 0,94 mL d. Konsentrasi glukosa 0,08 mg/mL V1 . M1 = V2 . M2 V1. 1 mg/mL = 1 mL . 0,08 mg/mL V1 = 0,08 mL
100 x 100 x V akuades = 1 mL – 0,08 mL = 0,92 mL e. Konsentrasi glukosa 0,10 mg/mL V1 . M1 = V2 . M2 V1. 1 mg/mL = 1 mL . 0,10 mg/mL V1 = 0,10 mL V akuades = 1 mL – 0,10 mL = 0,99 mL f. Konsentrasi glukosa 0,12 mg/mL V1 . M1 = V2 . M2 V1. 1 mg/mL = 1 mL . 0,12 mg/mL V1 = 0,12 mL V akuades = 1 mL – 0,12 mL = 0,88 mL 3. Preparasi Sampel
Faktor Pengenceran 10000 kali
0,01 mL + 0,99 mL H2O 1 mL
dipipet
4. Penyiapan Larutan Nelson
Larutan Nelson A : Larutan Nelson B
25 : 1
25 x 16 : 1 x 16
26 26