Kimia EBTANAS
Tahun 1996
EBTANAS-96-01
1. Lilin di dalam tabung reaksi dipanaskan 2. Gula pasir dilarutkan dalam air
3. pita magnesium dibakar
4. Larutan KI 0,1 M dan Pb(NO3)2 0,1 M dicampur 5. Pita magnesium dimasukkan ke asam klorida
dan gas yang dihasilkan dibakar
Dari percobaan di atas, yang menunjukkan perubahan kimia adalah … A. 1 B. 2 C. 3 D. 3 dan 4 E. 3, 4 dan 5 EBTANAS-96-02
Pada penguraian 10 liter (TP) suatu oksida nitrogen yang berupa gas dihasilkan 20 liter (TP) nitrogen monoksida dan 10 liter (TP) gas oksigen. Rumus oksida nitrogen tersebut adalah … A. N2O B. NO2 C. N2O3 D. N2O4 E. N2O5 EBTANAS-96-03
Manakah di antara pernyataan di bawah ini yang bukan
merupakan sifat periodik unsur-unsur ?
A. Dari atas ke bawah dalam satu golongan energi ionisasi makin kecil
B. Dari kkiri ke kanan dalam satu periode afinitas elektron makin besar
C. Dari atas ke bawah dalam satu golongan jari-jari atom makin besar
D. Dari kiri ke kanan dalam satu periode keelektro negatifan makin besar
E. Dari kiri ke kanan dalam satu periode titik didih makin tinggi
EBTANAS-96-04
Rumus elektronnitrometana adalah sebagai berikut: . • • 3 • × 5 • • × × • • × • 4 × • • 2 × × • × 1 • • • • • •
Ikatan kovalen koordinasi ditunjukkan pada nomor … A. 1 B. 2 C. 3 D. 4 E. 5 EBTANAS-96-05
Di bawah ini terdapat contoh beberapa larutan 1. asam klorida
2. cuka 3. amonia 4. air kapur 5. gula
Dari contoh larutan di atas uang merupakan larutan asam lemah dan basa lemah berturut-turut adalah …
A. 1 dan 4 B. 2 dan 4 C. 1 dan 5 D. 2 dan 3 E. 3 dan 5 EBTANAS-96-06
Dari tabel anion dan kation di bawah ini:
Anion Kation K+ Na+ Ba2+ Fe3+ Cl -SO4 2-PO4 3-CO32-
Rumus garam yang benar adalah … A. KCO3
B. NaPO4 C. Ba(CO3)2 D. NaCl2 E. Fe2(SO4)3
EBTANAS-96-07
Nama yang benar untuk senyawa dengan rumus struktur: CH3––C==CH2––CH3 CH2 CH3 adalah … A. 2–etil–3 pentena B. 2–etil–3 pentena C. 3 metil–3 heksena D. 4 etil–3 pentena E. 4 metil–3 heksena EBTANAS-96-08
Dari hasil penyulingan bertingkat minyak bumi:
No. Banyak atom C Titik didih (oC)
1 2 3 4 5 C1 – C4 C5 – C10 C11 – C12 C13 –C25 C26 – C28 < 40 40 – 180 160 – 250 220 – 350 > 350 Fraksi nomor 3 digunakan untuk … A. bahan bakar diesel
B. bahan bakar kendaraan bermotor C. bahan bakar kompor masak D. bahan bakar pembuatan plastik E. bahan bakar pembuatan lilin
EBTANAS-96-09
Bahan detergen yang digunakan sebagai penambah busa adalah …
A. karboksi metil selulusa (CMC) B. Sodium Lauryl Sulfat (SLS) C. Alkil Benzena Sulfonat (ABS) D. Natrium Tripolyphospat (STTP) E. Natrium Silikat (Na2SiO3)
EBTANAS-96-10
Reaksi asam sulfat dengan natrium hidroksida menghasil kan natrium sulfat dan air. Perbandingan mol asam sulfat dan hidroksida yang digunakan …
A. 1 : 1 B. 1 : 2 C. 2 : 1 D. 2 : 2 E. 2 : 3 EBTANAS-96-11
Tabel pengisisian elektron ke dalam orbital : [Ar] ↑ ↑ ↑ ↑ ↑ ↑ ↓ [Ar] ↑ ↓ ↑ ↓ ↑ ↑ ↑
[Ar] ↑ ↓ ↑ ↓ ↑ ↑ ↑ ↑ ↓ [Ar] ↑ ↓ ↑ ↓ ↑ ↑
Pengisian elektron yang sesuai dengan prinsip Aufbau dan aturan Hund terdapat pada nomor …
A. 1 dan 2 B. 1 dan 3 C. 1 dan 4 D. 3 dan 3 E. 2 dan 4 EBTANAS-96-12
Dua buah unsur mempunyai konfigurasi sebagai berikut P = 1s2, 2s2, 2p6, 3s1
Q = 1s2, 2s2, 2p6, 3s2, 3p5
Sifat periodik yang tepat untuk unsur P dan Q adalah … A. energi lintasan P lebih besar dari energi lintasan Q B. jari-jari atom P lebih besar dari jari-jari atom Q C. keelektronrgatifan P lebih besar dari
keelektro-negatifan Q
D. afinitas elektron P lebih besar dari afinitas elektron Q E. titik didih unsur P lebih rendah dari titik didih unsur Q
EBTANAS-96-13
Diketahui unsur-unsur dengan nomor atom sebagai berikut: 8X, 9Y, 11Q, 16R, 19Z. Pasangan unsur yang dapat membentuk ikatan ion adalah …
A. X dengan Q B. Q dengan Z C. Y dengan X D. R dengan X E. Y dengan R
EBTANAS-96-14
Gambar bentuk molekul yang sesuai dengan molekul NH3 adalah … (Nomor atom N = 7 , H = 1)
A. B. C. D. E. EBTANAS-96-15
Larutan NaOH 1 M sebanyak 100 cm3 direaksikan dengan 100 cm3 larutan HCl 1M dalam sebuah bejana. Tercatat suhu naik dari 29oC menjadi 37,5oC. Jika larutan dianggap sama dengan air. Kalor jenis air = 4,2 J g–1K–1, massa jenis air = 1 g cm–3, maka perubahan entalpi reaksi (∆H) netralisasi adalah … A. +82,3 kJ mol–1 B. +71,4 kJ mol–1 C. –71,4 kJ mol–1 D. –54,6 kJ mol–1 E. –45,9 kJ mol–1 EBTANAS-96-16
Data hasil percobaan untuk reaksi : A + B → hasil
Perco-baan Massa/bentuk zat A Konsentrasi B (mol/L) t (detik) Suhu (oC) 1 2 3 4 5 5 gram serbuk 5 gram larutan 5 gram kepingan 5 gram larutan 5 gram larutan 0,1 0,1 0,1 0,2 0,1 20 30 50 15 15 25 25 25 25 25 Pada percobaan 1 dan 3 kecepatan reaksi dipengaruhi oleh faktor … A. konsentrasi zat B. sifat zat C. suhu sistem D. luas permukaan E. jenis zat EBTANAS-96-17
Kebaikan suhu akan mempercepat kecepatan reaksi karena …
A. kenaikan suhu akan memperbesar energi kinetik molekul pereaksi
B. kenaikan suhu akan memperbesar tekanan molekul pereaksi
C. kenaikan suhu akan memperkecil energi pengaktifan zat yang bereaksi
D. kenaikan suhu akan memperbesar konsentrasi zat bereaksi
E. kenaikan suhu akan memperbesar luas permukaan zat pereaksi
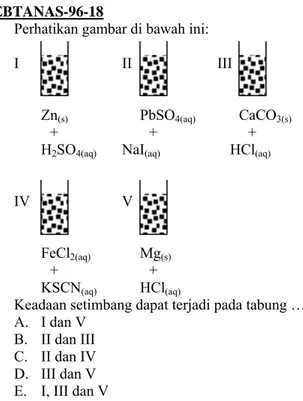
EBTANAS-96-18
Perhatikan gambar di bawah ini: I II III
Zn(s) PbSO4(aq) CaCO3(s)
+ + + H2SO4(aq) NaI(aq) HCl(aq)
IV V FeCl2(aq) Mg(s)
+ + KSCN(aq) HCl(aq)
Keadaan setimbang dapat terjadi pada tabung … A. I dan V B. II dan III C. II dan IV D. III dan V E. I, III dan V EBTANAS-96-19
Setelah disetarakan rumus tetapan kesetimbangan untuk reaksi : Fe2O3(s) + CO(g)↔ Fe(s) + CO2(g) adalah … A. [CO] ] O [Fe ] [CO [Fe] K 3 2 2 = B. 3 3 2 [CO] ] [CO K = C. 3 3 2 3 2 2 [CO] ] O [Fe ] [CO [Fe] K = D. [CO] ] [CO K = 2 E. ] O [Fe [Fe] K 3 2 2 =
EBTANAS-96-20
Sebanyak 11,1 gram CaCl2 (Mr = 111) dilarutkan dalam air sampai volume 500 cm3. Konsentrasi ion Cl– yang berada dalam larutan tersebut adalah …
A. 0,40 mol dm–3 B. 0,30 mol dm–3 C. 0,20 mol dm–3 D. 0,10 mol dm–3 E. 0,05 mol dm–3 EBTANAS-96-21 Larurtan 100 cm3 H 2SO4 pH = 2 diencerkan hingga volum larutan menjadi 1.000 cm3, maka pH larutan yang terbentuk adalah … A. 1 B. 2 C. 3 D. 4 E. 5 EBTANAS-96-22
Campuran larutan NH4Cl 0,01 M dan NH4OH 0,01 M (Kb = 1 × 10–5) mempunyai pH = 9. Volume NH4OH dan NH4Cl yang dicampur masing-masing adalah …
A. 1 ml dan 10 ml B. 100 ml dan 200 ml C. 100 ml dan 50 ml D. 50 ml dan 100 ml E. 100 ml dan 100 ml EBTANAS-96-23
Trayek perubahan warna beberapa indikator:
INDIKATOR WARNA TRAYEK
pH
Phenolptalein )PP) Bromtimol biru (BTB) Lakmus
Metil merah (MM) Metil jingga (MO)
tidak berwarna – merah kuning – biru merah – biru merah – kuning merah – kuning 8,3 – 10 6,0 – 7,6 5,5 – 8,0 4,4 – 6,2 3,1 – 4,4 Indikator BTB dan PP dalam larutan NH4Cl menunjukkan warna berturut-turut adalah …
A. biru, kuning B. kuning, merah
C. tidak berwarna, kuning D. merah, kuning
E. kuning, tidak berwarna
EBTANAS-96-24
Diberikan 5 reaksi asam basa menurut Bronsted-Lowry: 1. CH3COOH + H2O ↔ CH4COO– + H2O 2. H2SO3 + H2O ↔ H3O+ + HSO4– 3. H2O + NH3↔ NH4+ + OH– 4. CN– + H 2O ↔ HCN + OH– 5. HSO4– + H2O ↔ H3O+ + SO42–
Pasangan reaksi yang menunjukkan sifat H2O yang berbeda adalah … A. 1 dan 2 B. 2 dan 3 C. 3 dan 4 D. 1 dan 5 E. 2 dan 5 EBTANAS-96-25
Jika Ksp Ag2CrO4 = 4 × 10–12, maka larutan Ag2CrO4 dalam larutan 0,01 M K2CrO4 adalah …
A. 1 × 10–8 M B. 5 × 10–8 M C. 1 × 10–5 M D. 5 × 10–5 M E. 1 × 10–4 M EBTANAS-96-26
Suatu reaksi redoks:
a KBr + KMnO4 + b H2SO4→c Br2 + MnSO4 +
d K2SO4 + H2O Setelah disetarakan maka harga koefisien a, b, c dan d
bertururt-turut adalah … A. 10, 8, 6, 5 B. 2, 8, 5, 3 C. 10, 8 , 5 , 6 D. 10, 2, 5, 8 E. 2, 8, 1, 6 EBTANAS-96-27
Perhatikan gambar di bawah ini: – +
Mg Cu
Mg2+ Cu2+
Bagan sel yang menyatakan reaksi sel tersebut adalah … A. Cu(s) | Cu2+ | | Mg2+ | Mg(s) B. Cu2+ (aq) | Cu(s) | | Mg2+(aq) | Mg(s) C. Mg(s) | Mg2+(aq) | | Cu2+(aq) | Cu(s) D. Mg(aq) | Mg(s)| | Mg(s) | Cu2+(aq) E. Mg(s) | Cu2+(aq) | | Mg2+(aq) | Cu(s)
EBTANAS-96-28
Pasangan unsur gas mulia berikut yang senyawanya telah dapat disintesis adalah …
A. Xenon dan Argon B. Helium dan Kripton C. Helium dan Xenon D. Xenon dan Kripton E. Helium dan Argon
EBTANAS-96-29
Dari reaksi berikut: 1. I2(aq) + NaCl(aq) 2. Cl2(aq) + MgBr2(aq) 3. Br2(aq) + KF(aq) 4. Fe(aq) + KCl(aq) 5. Br2(aq) + KCl(aq)
Reaksi yang dapat berlangsung secara spontan adalah … A. 1 dan 2 B. 2 dan 4 C. 3 dan 5 D. 3 dan 4 E. 1 dan 4 EBTANAS-96-30
Logam alkali tanah yang tidak menghasilkan gas
hidrogen jika bereaksi dengan air adalah … A. Ba B. Sr C. Mg D. Ca E. Be EBTANAS-96-31
Data sifat fisis dan sifat kimia dari unsur seperiode dari kiri ke kanan sebagai berikut:
1. sifat logam bertambah dan sifat bukan logam berkurang
2. sifat pereduksi berkurang, sifat pengoksidasi bertambah
3. titik didih dan titik leleh semakin bertambah 4. sifat basa berkurang, sifat asam bertambah 5. sifat asam berkurang, sifat basa bertambah Sifat di atas yang sesuai dengan unsur periode ke-3 adalah … A. 1 dan 5 B. 2 dan 4 C. 2 dan 3 D. 3 dan 4 E. 2 dan 5 EBTANAS-96-32
Massa logam almunium yang terkandung dalam 920 gram zamrut (Al2F2SiO4) (Ar: Al = 27, F = 19, Si = 28, O = 16) adalah … A. 10 gram B. 17 gram C. 34 gram D. 135 gram E. 270 gram EBTANAS-96-33
Grafik hubungan unsur-unsur transisi periode ke-4 dengan bilangan-bilangan oksidasinya.
+ 7 B ila ngan O ksi dasi + 2 + 1 21 22 23 24 25 26 27 26 29 30
Bilangan oksidasi unsur krom, (Ar), 4s1, 3d5 adalah … A. +2, +3, +6 B. +2, +3, +4, +5 C. +2, +3, +4 D. +2, +3 E. +2, +4 EBTANAS-96-34
Nama senyawa kompleks yang terdiri dari atom pusat Co3+ dengan ligan 4 molekul NH
3 dan 2 ion Cl–, anion Cl– adalah …
A. tetramin dikloro kobal (III) klorida B. diamin tetrakloro kobaliat (III) klorida C. diamin tetra kloro kobal (III) klorida D. tetra amin kloro kobaliat (III) klorida E. tetra amin kloro kobal (III) klorida
EBTANAS-96-35
Senyawa karbon mempunyai rumus empiris C2H6O dan Mr = 46. Bila senyawa tersebut direaksikan dengan HCl menghasilkan alkil klorida dan air.
Senyawa tersebut mengandung gugus fungsional … A. alkohol B. eter C. aldehid D. keton E. asam karbosilat EBTANAS-96-36
Diketahui senyawa rabon: 1. CH3–CH2–CH2–CH2–OH 2. CH3–CH2–CH2–CHO 3. CH3–CH2–C–CH3
O 4. CH3–CH2–CH2–COOH
Pasangan senyawa yang berisomer fungsi adalah … A. 1 dan 3
B. 2 dan 4 C. 2 dan 3 D. 1 dan 4 E. 1 dan 2
EBTANAS-96-37
Dari reaksi berikut yang masuk reaksi eliminasi adalah … A. H2C=CH2 + H2–H3C–CH3 B. CH3=C – CH + Cl2→ CH3–CCl=CHCl C. CH3Cl + NaOH → CH3OH + NaCl D. CH3–CHCl–CH3 + CH3OK → CH3–CH2 + CH3OH + KCl E. CaC2 + 2H2O → HC≡CH + Ca(OH)2 EBTANAS-96-38
Diantara turunan benzenaq berikut ini yang bersifat asam adalah …
A. CH3 D. NH
B. OH E. COH
C. NO2
EBTANAS-96-39
Proses biokimia yang menghasilkan energi dalam tubuh adalah …
A. pembakaran glukosa B. proses ATP menjadi ADP C. proses ADP menjadi ATP D. proses AMP menjadi ADP E. proses glukosa menjadi tepung
EBTANAS-96-40
Pada reaksi inti: 105B+ 42He→137N+X , X adalah … A. proton B. elektron C. positron D. netron E. deutron EBTANAS-96-41
Contoh reaksi yang merupakan reaksi fisi adalah … A. Mo n 99Mo 42 1 0 98 42 + → +γ B. 23892U+ 24He→24094Mo+211n C. He He He H 1H 1 1 1 4 2 3 2 3 2 + → + + D. 147N+ 42He→178O+ 11H E. U n Ba Kr 31n 0 94 36 139 56 1 0 235 92 + → + + EBTANAS-96-42
Diberikan reaksi pembuatan koloid sebagai berikut: 1. FeCl3(aq)
2. 1H2(g) 3. 2AuCl2(g) 4. As2O3(aq) 5. AgNO3(aq)
Dari reaksi di atas yang merupakan reaksi hidrolisis adalah … A. 1 B. 2 C. 3 D. 4 E. 5 EBTANAS-96-43
Salah satu contoh emulsi yang sering kita jumpai dalam kehidupan sehari-hari adalah …
A. kabut B. sabun C. mutiara D. santan E. lem EBTANAS-96-44
Zat kimia yang dapat merusak lapisan ozon di atmosfir adalah … A. CH3Cl B. CH2Cl2 C. CHCl3 D. CCl4 E. CCl2F2 EBTANAS-96-45
Pasangan logam berat yang bersifat racun dan membahayakan kehidupan hewan air adalah …
A. Pb dan Ca B. Sn dan Cd C. Hg dan Cd D. Ag dan Zn E. Cu dan Hg EBTANAS-96-46
Suatu logam X yang massanya 11,2 gram tepat habis bereaksi dengan larutan asam klorida encer dan menghasilkan 6,72 liter gas hidrogen (STP) menurut reaksi : 2X(s) + 6HCl(aq)→ 2XCl3(aq) + 3H2(g)
Tentukanlah :
a.) massa atom relatif logam X
EBTANAS-96-47
Diketahui:
2S(s) + 2O2(g)→ 2SO2(g) H = – 593,8 kJ 2S(s) + 3O2(g)→ 2SO3(g) H = – 790,4 kJ a) Hitunglah ∆H untuk reaksi
b) Buatlah diagram tingkat energi dari reaksi-reaksi di atas.
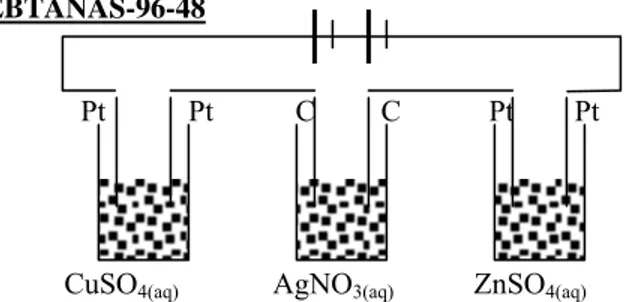
EBTANAS-96-48
Pt Pt C C Pt Pt
CuSO4(aq) AgNO3(aq) ZnSO4(aq)
Gambar di atas adalah gambar 3 buah sel elektrolisis yang disusun seri.
Tentukan:
a) Persamaan reaksi elektrolisis pada gambar III b) Massa zat yang terjadi pada katoda I, jika massa Ag
yang diendapkan pada katoda II = 10,8 gram, Ar: Ag = 108, Cu = 63,5
EBTANAS-96-49
Suatu senyawa karbon dengan jumlah C = 4, mengan- O
dung gugus fungsional: ––C ––
a) Tulislah rumus struktur zat tersebut ! b) Tulislah salah satu isomernya !
c) Tulislah reaksi zat tersebut dengan gas hidrogen
EBTANAS-96-50
Reaksi berikut adalah reaksi pembuatan sabun dari asam stearat dengan natrium hidroksida
O O C17H35C––OH(l) + NaOH(aq)→ C17H35C–ONa(s) + H2O(l)
a) Sebutkan nama zat hasil dari reaksi di atas
b) Berapa gram sabun diperoleh, jika asam lemak yang direaksikan sebanyak 568 gram.
![Tabel pengisisian elektron ke dalam orbital : [Ar] ↑ ↑ ↑ ↑ ↑ ↑ ↓ [Ar] ↑ ↓ ↑ ↓ ↑ ↑ ↑ [Ar] ↑ ↓ ↑ ↓ ↑ ↑ ↑ ↑ ↓ [Ar] ↑ ↓ ↑ ↓ ↑ ↑](https://thumb-ap.123doks.com/thumbv2/123dok/3222283.2351512/2.918.491.735.128.320/tabel-pengisisian-elektron-dalam-orbital-ar-ar-ar.webp)