SPEKTROSKOPI INFRAMERAH, SERAPAN ATOMIK,
SERAPAN SINAR TAMPAK DAN ULTRAVIOLET
HIDROKSIAPATIT DARI CANGKANG TELUR
FIFIA ZULTI
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
FIFIA ZULTI. Spektroskopi Inframerah, Serapan Atomik, dan Ultraviolet-Visible Hidroksiapatit dari Cangkang Telur. Dibimbing oleh KIAGUS DAHLAN dan YESSIE WIDYA SARI.
Pembuatan biomaterial yang cocok dengan kondisi fisiologis tubuh digunakan untuk mengganti jaringan keras khususnya tulang. Komponen utama penyusun jaringan keras ini adalah senyawa kalsium fosfat. Senyawa kalsium fosfat dalam tulang hadir dalam dua bentuk fasa yaitu fasa amorf dan fasa kristal. Fasa stabil kristal kalsium fosfat mempunyai rumus kimia Ca10(PO4)6(OH)2 yang lebih dikenal dengan nama hidroksiapatit. Hidroksiapatit adalah senyawa mineral dari kelompok mineral apatit. Hidroksiapatit hasil presipitasi dibuat dari larutan ion kalsium yang diperoleh dari cangkang telur dengan penambahan larutan diamonium fosfat pada suhu 37oC dan kontrol pH dilakukan dengan menggunakan NH3. Penelitian dilakukan dengan memvariasikan suhu kalsinasi dan konsentrasi kalsium dan fosfat. Sampel dikalsinasi dengan variasi suhu 110oC, 800oC, dan 900oC. Variasi konsentrasi Ca/P yang digunakan adalah 0,01M/0,006M, 0,05M/0,03M, dan 0,5M/0,3M. Analisis sampel dilakukan dengan menggunakan spektroskopi inframerah, serapan atomik dan Ultraviolet-Visible. Hasil analisis sampel dengan spektroskopi serapan atomik (AAS) dan UV-Vis menunjukkan peningkatan konsentrasi akan meningkatkan jumlah kalsium dan fosfor dalam sampel. Kenaikan suhu kalsinasi juga akan meningkatkan kadar Ca dan P dalam sampel. Hasil analisis sampel dengan menggunakan spektroskopi inframerah (FTIR) menunjukkan peningkatan suhu kalsinasi akan meningkatkan derajat kristalinitas hidroksiapatit. Semakin tinggi suhu dan konsentrasi maka jumlah kristal hidroksiapatit yang terbentuk akan semakin banyak. Spektrum FTIR dari semua sampel mengidentifikasi hadirnya gugus karbonat (CO32-). Ion CO32- merupakan inhibitor pertumbuhan kristal dalam sampel. Pita serapan v2 dan v3 karbonat menunjukkan terbentuknya kristal apatit tipe-B.
SPEKTROSKOPI INFRAMERAH, SERAPAN ATOMIK,
SERAPAN SINAR TAMPAK DAN ULTRAVIOLET
HIDROKSIAPATIT DARI CANGKANG TELUR
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
FIFIA ZULTI
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Spektroskopi Inframerah, Serapan Atomik, Serapan Sinar Tampak
dan Ultraviolet Hidroksiapatit dari Cangkang Telur
Nama
: Fifia Zulti
NIM
: G74104003
Menyetujui:
Pembimbing I
Dr. Kiagus Dahlan
NIP. 131663021
Pembimbing II
Yessie Widya Sari M,Si
Mengetahui :
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. Drh. Hasim, DEA
NIP. 131578806
Bogor, Mei 2008
Fifia Zulti
PRAKATA
Assalamualaikum Wr.Wb
Puji dan syukur penulis ucapkan kehadirat Allah SWT yang telah melimpahkan rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan skripsi yang berjudul “ Spektroskopi Inframerah, Serapan Atomik dan Ultraviolet-Visible serta Analisis Termal Hidroksiapatit dari Cangkang Telur.” Hasil penelitian ini disusun untuk memenuhi syarat menyelesaikan program pendidikan Sarjana Sains (S.Si) di Departemen Fisika, Fakultas matematika dan Ilmu pengetahuan Alam, Institut Pertanian Bogor. Sholawat serta salam semoga tetap tercurah kepada Nabi Muhammad SAW beserta keluarga, sahabat dan umatnya sampai akhir zaman
Topik ini sangat baik dikembangkan di Indonesia dalam rangka penyediaan biomaterial untuk meningkatkan kemudahan dalam dunia medis. Penelitian ini merupakan kerjasama program A2 dengan departemen fisika IPB yang dilakukan di laboratorium Biofisika IPB dan karakterisasi di Laboratorium Terpadu IPB dan Biofarmaka. Penelitian dilaksanakan dari bulan April 2007 – Januari 2008. Penulis mengucapkan terima kasih kepada Bapak Dr. Kiagus Dahlan dan Ibu Yessie Widya Sari, M.Si sebagai dosen pembimbing yang telah memberikan bimbingan, motivasi dan arahan demi kelancaran penelitian ini. Kepada DIKTI yang telah mendanai penelitian ini melalui program Hibah A2. Kepada Bapak M.Nur Indro, M,Sc selaku dosen penguji yang banyak memberikan saran yang bermanfaat. Terimakasih penulis ucapkan kepada pak Wawan sebagai operator AAS dan UV-Vis dan ibu Titis yang membantu karakterisasi FTIR di Biofarmaka. Kepada orang tua dan adik ku tercinta (Ninit dan Yoza) dirumah serta seluruh keluarga besar atas doa dan motivasinya yang selalu menyertai setiap langkah ku. Ucapan terima kasih juga penulis ucapkan untuk teman satu tim penelitian (Qori dan Viter), rekan-rekan di laboratorium Biofisika (Asfiny, Rahmi, Hasti, kak Awit, teh Tia dan kak Opik), Az-zahra crew, teman-teman fisika 41, 40, dan 42 yang selalu mendorong dan memberi semangat kepada penulis. Penulis berharap semoga penelitian ini bermanfaat bagi semua pihak yang membutuhkan.
RIWAYAT HIDUP
Penulis dilahirkan di Andaleh pada tanggal 29 Mei 1986 dari pasangan Bapak H. Zulherdi dan Ibu Hj.Nurbaiti. Penulis merupakan putri pertama dari tiga bersaudara. Penulis menempuh pendidikan di SDN 63 Andaleh (1992 – 1998), SLTPN 5 Luhak (1998 – 2001), SMUN 1 Lareh Sago Halaban (2001 – 2004) dan tahun 2004 penulis masuk ke Departemen Fisika Institut Pertanian Bogor melalui jalur USMI.
Selama mengikuti perkuliahan, penulis pernah aktif sebagai staff Departemen Kewirausahaan Badan Eksekutif Mahasiswa Tahap Persiapan Bersama (BEM TPB) periode 2004 – 2005, sekretaris Komisi Eksternal Dewan Perwakilan Mahasiswa Keluarga Mahasiswa (DPM KM) IPB periode 2005 – 2006, staff Administrasi dan Keuangan Badan Eksekutif Mahasiswa Keluarga Mahasiswa (BEM KM) IPB periode 2006 – 2007. Penulis pernah menjadi asisten praktikum Fisika dasar pada tahun 2005 – 2007, asisten praktikum Biofisika tahun 2007, asisten praktikum Pendidikan Agama Islam tahun 2007. Penulis juga aktif mengajar Fisika di Bimbingan Belajar mahasiswa dan Sekolah Menengah Kejuruan. Penulis pernah mendapat penghargaan sebagai mahasiswa terbaik I Departemen Fisika 2007.
DAFTAR ISI
Halaman
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... vii
PENDAHULUAN Latar Belakang ... 1 Tujuan ...= 1 Manfaat ... 1 Hipotesis ... 1 TINJAUAN PUSTAKA Cangkang telur ... 1 Komposisi Tulang ... 2 Mineral Apatit... 2
Identifikasi hidroksiapatit dengan Fourier Transfrom Infrared(FTIR)Spectroscopy... 2
Identifikasi hidroksiapatit dengan Atomic Absorption Spectroscopy (AAS) ... 3
Identifikasi hidroksiapatit dengan Ultraviolet-Visible (UV-Vis) Spectroscopy... 3
BAHAN DAN METODE Bahan dan Alat... 3
Metode Penelitian Persipan Sampel... 3
Presipitasi Sampel... 4
Karakterisasi dengan FTIR Spectroscopy... 4
Karakterisasi dengan AAS dan spektroskopi UV-Vis... 4
HASIL DAN PEMBAHASAN Pembentukan mineral apatit dari cangkang telur ... 5
Analisis Kandungan Ca, Na dan P Menggunakan AAS dan Spektrometer UV-VIS... 6
Identifikasi gugus anion PO43-, CO32- dan H2O dengan FTIR... 7
KESIMPULAN... 10
DAFTAR PUSTAKA... 11
DAFTAR TABEL
Halaman
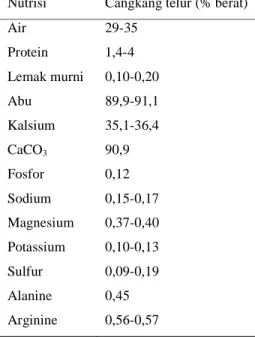
1 Komposisi nutrisi cangkang telur... 1
2 Kandungan unsur mineral dalam tulang... 2
3 Konsentrasi Ca dan P yang digunakan pada proses presipitasi ... 4
4 Keterangan jenis sampel... 6
5 Kadar Ca dan P hasil karakterisasi AAS dan UV-Vis... 6
6 Rasio Ca/P dalam sampel... 7
7 Nilai bilangan gelombang setiap pita serapan ... 9
DAFTAR GAMBAR
Halaman 1 Unit sel dari struktur krista; hidroksiapatit... 22 Diagram alir penelitian... 4
3 Spektrum spektroskopi FTIR cangkang telur yang dikalsinasi pada suhu 10000C... 5
4 Hubungan suhu kalsinasi terhadap % berat Ca dalam sampel ... 6
5 Hubungan suhu kalsinasi terhadap % berat P dalam sampel …….………. 6
6 Spektrum spektroskopi FTIR sampel A1, A2, A3, B1, B2, B3, C1, C2, dan C3 ... 8
DAFTAR LAMPIRAN
Halaman 1 Set alat percobaan... 142 Alur kerja penelitian ... 15
3 Kadar unsur dalam sampel hasil AAS dan UV-Vis ... 17
4 Tabel perhitungan Ca/P dalam sampel... 18
5 Hasil Karakterisasi sampel A dengan spektroskopi inframerah (FTIR) ... 19
6 Hasil Karakterisasi sampel B dengan spektroskopi inframerah (FTIR) ... 20
7 Hasil Karakterisasi sampel C dengan spektroskopi inframerah (FTIR) ... 21
PENDAHULUAN
Latar BelakangPertumbuhan tulang memerlukan banyak mineral terutama kalsium. Kalsium dapat diperoleh secara alami maupun sintesis. Secara alami kalsium dapat diperoleh dari susu, daging, sayuran, dan buah-buahan sedangkan secara sintesis dapat diperoleh dari suplemen. Bahan alami lain yang mengandung kalsium adalah cangkang telur. Kekurangan kalsium pada tubuh dapat menyebabkan berbagai macam penyakit, salah satunya adalah keropos tulang (osteoporosis). Penyakit ini banyak diderita oleh orang tua karena kebutuhan kalsium tinggi sedangkan kemampuan metabolisme sudah berkurang. Salah satu cara praktis yang dilakukan oleh tubuh adalah mengambil kalsium dari tulang. Jika konsumsi makanan tidak baik, maka akan terjadi keropos tulang yang salah satu efeknya adalah pembungkukan.
Kerusakan pada tulang akan mengganggu fungsi tubuh karena tulang sebagai komponen yang sangat penting dalam tubuh manusia. Salah satu kerusakan tulang yang paling sering terjadi adalah fraktur (retak atau patah) pada tulang. Fraktur tulang pada umumnya disebabkan oleh kecelakaan. Kerusakan pada tulang dapat diatasi dengan membuat suatu biomaterial yang cocok dengan kondisi fisiologis tubuh. Hal ini memacu perkembangan riset di bidang biomaterial termasuk hidroksiapatit untuk mengatasi masalah kerusakan pada tulang
Tulang manusia tersusun dari senyawa kalsium fosfat. Senyawa kalsium fosfat dalam tulang hadir dalam dua bentuk fase yaitu fase amorf dan fase kristal. Hadirnya kedua fase ini mendukung dua fungsi utama tulang dalam tubuh yaitu penopang pertumbuhan tubuh dan kekuatan. Fase stabil kristal kalsium fosfat mempunyai rumus kimia Ca10(PO4)6(OH)2 yang lebih dikenal dengan nama hidroksiapatit. Hidroksiapatit adalah senyawa mineral dari kelompok mineral apatit. Hidroksiapatit merupakan material keramik kalsium fosfat yang saat ini banyak digunakan sebagai material pensubstitusi tulang1.
Tujuan
Penelitian ini bertujuan untuk menganalisis kebolehjadian cangkang telur menjadi starting material pembentukan hidroksiapatit. Analisis dilakukan dengan
menggunakan Fourier Transform Infrared (FTIR) spectroscopy, Atomic Absorption
Spectroscopy (AAS), dan Ultraviolet-Visible
(UV-VIS) Spectroscopy. Manfaat
Penelitian ini memberikan informasi mengenai kandungan kalsium pada cangkang telur. Analisis terhadap cangkang telur selanjutnya dapat dijadikan sebagai acuan untuk pembentukan biomaterial substitusi tulang yang sesuai.
Hipotesis
1.Cangkang telur mengandung kalsium yang dapat dijadikan sebagai starting
material untuk pembentukan apatit.
2.Kenaikan suhu kalsinasi pada batas tertentu akan meningkatkan kristalinitas apatit yang muncul.
3.Kenaikan konsentrasi kalsium dan fosfat akan meningkatkan jumlah hidroksiapatit.
TINJAUAN PUSTAKA
Cangkang TelurCangkang telur adalah salah satu sumber kalsium yang paling kaya. Cangkang telur merupakan 11% dari berat total telur yang disusun oleh adalah 94 % kalsium karbonat, dan sisanya adalah 1 % kalsium fosfat , 4% bahan organik dan 1 % magnesium karbonat 1
.
Komposisi nutrisi cangkang telur dapat secara lengkap dilihat pada Tabel 1.
Tabel 1 Komposisi nutrisi cangkang telur2 Nutrisi Cangkang telur (% berat)
Air 29-35 Protein 1,4-4 Lemak murni 0,10-0,20 Abu 89,9-91,1 Kalsium 35,1-36,4 CaCO3 90,9 Fosfor 0,12 Sodium 0,15-0,17 Magnesium 0,37-0,40 Potassium 0,10-0,13 Sulfur 0,09-0,19 Alanine 0,45 Arginine 0,56-0,57
Tabel 2 Kandungan unsur mineral dalam tulang. Unsur Kandungan (% berat) Ca 34 P 15 Mg 0,5 Na 0,8 K 0,2 C 1,6 Cl 0,2 F 0,08 Zat sisa 47,62 Komposisi Tulang
Tulang manusia tersusun dari komponen organik dan inorganik. Komponen inorganik yaitu mineral tulang yang sebagian besar terdiri dari senyawa kalsium fosfat sekitar 70%. Kandungan mineral tulang secara umum terdapat pada Tabel 1. Komponen organik pada tulang sekitar 30% yang sebagian besarnya adalah kolagen (protein)4. Bahan organik lain seperti polisakarida dan lemak terdapat dalam jumlah yang kecil.
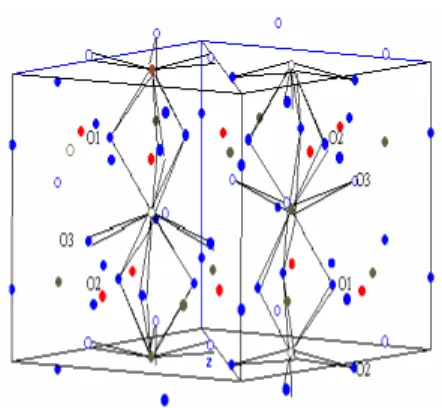
Senyawa kalsium fosfat hadir dalam dua bentuk yaitu fase amorf dan fase kristal. Senyawa kalsium fosfat kristal sintetis mempunyai 4 fase yaitu dikalsium fosfat dihidrat (DKFD, CaHPO4.2H2O), oktakalsium fosfat (OKF, Ca8H2 (PO4)6.5H2O, trikalsium fosfat (TKF,Ca3(PO4)2), dan hidroksiapatit (HAP, Ca10(PO4)6(OH)2). Hidroksiapatit mempunyai struktur kristal heksagonal dengan parameter kisi a = b = 9.432 Å and c = 6.881 Å seperti terlihat pada Gambar 1. Hidroksiapatit juga merupakan senyawa kalsium fosfat dengan rasio Ca/P sekitar 1,67 3.
Biomaterial yang digunakan pada tubuh harus bersifat biokompatibel dan bioaktif. Biokompatibel adalah kemampuan material untuk menyesuaikan dengan kecocokan tubuh penerima, sedangkan bioaktif adalah kemampuan material bereaksi dengan jaringan dan menghasilkan ikatan kimia yang sangat baik. Hidroksiapatit adalah biomaterial yang penggunaannya semakin meningkat dalam bidang medis karena struktur kristalografi dan kimia hidroksiapatit sama dengan material tulang serta biokompatibilitasnya baik4.
Mineral Apatit
Mineral apatit mempunyai rumus kimia M10(ZO4)6X2. Unsur pada bagian M, Z dan
Gambar 1 Unit sel dari struktur kristal hidroksiapatit5.
X dapat disubstitusi dengan unsur-unsur sebagai berikut: M = Ca, Sr, Ba, Cd, Pb, dll ; Z = P, V, As, S, Si, Ge, dll; X = F, Cl, OH, O, Br, CO3, dll. Hidroksiapatit merupakan anggota dari mineral apatit dan mempunyai rumus kimia Ca10-xAx(PO4)6-yBy(OH) 2-zCz. Posisi A dapat ditempati ion magnesium, natrium atau kalium, posisi B dan C dapat ditempati ion karbonat, klorid ataupun fluorid.
Ion karbonat (CO3
2-) merupakan salah satu contoh ion kompleks yang dapat menggantikan ion kisi dalam kristal. Selain ion karbonat, terdapat ion lain yang dapat menggantikan ion kisi Ca2+, PO4
ataupun OH- dalam struktur kristal stabil hidroksiapatit seperti ion Na+, H+, F-, Sr+, dan Mg2+ yang cenderung menghasilkan kristal apatit dengan komposisi dan kristalinitas bervariasi3.
Kristal apatit tulang banyak mengandung karbon dalam bentuk karbonat. Karbonat dalam tubuh dapat mensubstitusi formula hidroksiapatit dengan menempati dua posisi. Karbonat menggantikan posisi OH- disebut apatit karbonat tipe A dan menggantikan posisi PO43- disebut apatit karbonat tipe B. Apatit karbonat tipe A dapat dibentuk pada suhu yang tinggi dan apatit karbonat tipe B dapat dibentuk pada suhu rendah. Pita serapan apatit karbonat tipe A dapat diteliti pada bilangan gelombang sekitar disekitar 1545, 1450, dan 890 cm-1. Apatit karbonat tipe B mempunyai daerah bilangan gelombang disekitar 1465, 1412, 873 cm-1.
Pengaruh panas yang diberikan terhadap senyawa kalsium fosfat akan menyebabkan adanya perubahan fase amorf menjadi fase kristal, bobot dari senyawa kalsium fosfat, dan komposisi kimia pembentuk struktur6. Perubahan panas terhadap tulang manusia
mempengaruhi bobot yang terkandung dalam tulang. Perubahan panas yang terjadi merupakan proses termodinamika, proses yang dapat terjadi yaitu penyerapan panas dan pelepasan panas7.
Identifikasi Hidroksiapatit dengan Fourier Transform Infrared (FTIR) Spectroscopy
Spektroskopi inframerah (FTIR) dapat mengidentifikasi kandungan gugus kompleks dalam senyawa hidroksiapatit. Spektroskopi inframerah memanfaatkan energi vibrasi dari gugus penyusun senyawa hidroksiapatit, yaitu: gugus PO43-, gugus CO3
2-, gugus OH-. Ada dua jenis energi vibrasi yaitu vibrasi stretching dan vibrasi
bending. Vibrasi stretching adalah
pergerakan atom yang teratur sepanjang sumbu ikatan antara dua atom sehingga jarak antara dua atom dapat bertambah atau berkurang, sedangkan vibrasi bending
adalah pergerakan atom yang menyebabkan perubahan sudut ikatan antara dua ikatan atom atau pergerakan dari seluruh atom terhadap atom lainnya. Gugus PO4
3-mempunyai 4 mode vibrasi, yaitu:
1. Vibrasi simetri stretching (v1) dengan bilangan gelombang sekitar 956 cm-1.
2. Vibrasi simetri bending (v2) dengan bilangan gelombang sekitar 430-460 cm-1.
3. Vibrasi asimetri stretching (v3) dengan bilangan gelombang sekitar 1040-1090 cm-1.
4. Vibrasi asimetri bending (v4) dengan bilangan gelombang sekitar 575-610 cm-1.
Apabila bentuk pita v3 dan v4 tidak simetri menunjukkan bahwa senyawa hidroksiapatit dalam fase kristal8. Hadirnya gugus karbonat juga berpengaruh dalam proses presipitasi dan kristalisasi senyawa hidroksiapatit. Pita serapan OH- dapat terlihat pada bilangan gelombang di sekitar 3576 cm-1 dan 632 cm-1.
Identifikasi hidroksiapatit dengan Atomic Absorption Spectroscopy (AAS)
Atomic Absorption Spectroscopy (AAS)
dapat digunakan untuk menentukan kadar unsur-unsur logam seperti: Ca, Mg, K, Na, dll. AAS yaitu proses penyerapan energi oleh atom dalam sampel. Sumber energi yang digunakan adalah hollow cathode
lamp. Fenomena yang terjadi pada proses
AAS adalah produksi atom bebas dari
sampel (atomisasi) dan serapan radiasi dari sumber luar oleh atom. Pembebasan atom dari sampel yaitu dengan pemanasan dari nyala api. Atomisasi meliputi nebulization,
desolvation, volatilization, dan dissociation9. Serapan radiasi oleh atom bebas saat disinari lampu melibatkan transisi atom dari populasi tinggi pada tingkat dasar (ground state) ke tingkat eksitasi elektronik. Umumnya transisi antara tingkat dasar dan tingkat eksitasi pertama disebut garis resonansi pertama. Garis resonansi pertama memiliki penyerapan paling tinggi. Banyaknya energi yang diserap menunjukkan besarnya konsentrasi atau kadar logam dalam sampel. Identifikasi Hidroksiapatit dengan Ultraviolet-Visible (UV-Vis) spectroscopy
Ultraviolet-Visible spectroscopy
digunakan untuk mengukur kandungan molekul atau gugus yang terdapat dalam sampel misalnya pengukuran kadar fosfor dalam suatu bahan. Prinsip kerja spektroskopi UV-Vis memanfaatkan panjang gelombang pada daerah ultraviolet dan cahaya tampak. Panjang gelombang ini dihasilkan oleh sumber lampu yang memiliki panjang gelombang spesifik, lampu hidrogen dan deuterium (160-375 nm), tungsten (350-2500 nm) dan xenon (200-1000 nm). Prinsip kerja alat ini adalah dengan menghitung transmitansi dari sinar yang dilewatkan oleh larutan. Transmitansi dari larutan akan menunjukkan kadar penyusun senyawa tersebut sesuai dengan panjang gelombang yang digunakan9.
BAHAN DAN METODE
Bahan dan AlatBahan yang digunakan dalam penelitian ini adalah cangkang telur, aquades, aquabides, (NH4)2HPO4, gas nitrogen, aluminium foil dan pH buffer. Alat yang digunakan dalam penelitian ini adalah
crucible (cawan keramik), statip, buret,
pipet, gelas piala, labu takar, corong, kertas saring, furnace, magnetic stirer, hot plate, pH meter, termometer dan neraca analitik. Karakterisasi menggunakan Atomic
Absorption Spectrometer (AAS) ,
Ultraviolet – Visible (UV-Vis)
Spectroscopy, dan spektroskopi inframerah (
Metode Penelitian Persiapan Sampel
Perlakuan diawali dengan membersihkan cangkang telur dari membrannya, selanjutnya dicuci dengan aquades dan dikeringkan diudara terbuka. Cangkang telur selanjutnya ditimbang dengan menggunakan neraca analitik. Cangkang telur dimasukkan kedalam
crucible dan dikalsinasi dalam furnace.
Kalsinasi dilakukan pada suhu 1000oC dengan laju pemanasan 5 oC/menit kemudian ditahan selama 5 jam, 10 jam dan 15 jam.
Variasi waktu penahanan pada proses kalsinasi bertujuan untuk melihat kondisi optimum terlepasnya ion CO2 ke udara. Cangkang telur yang dikalsinasi akan mengalami reaksi kimia sebagai berikut:
CaCO3→ CaO + CO2
Reaksi kalsinasi dapat terjadi apabila senyawa yang mengandung kalsium dipanaskan pada suhu diatas titik leburnya (Tlebur Ca = 825oC). Cangkang telur yang dikalsinasi pada suhu 1000oC menyebabkan senyawa kalsium karbonat terdekomposisi menjadi kalsium oksida dan karbon dioksida. Karbondioksida pada kondisi ini dibebaskan ke udara. Sampel yang sudah dikalsinasi siap untuk dikarakterisasi dengan FTIR untuk melihat kandungan gugus yang ada pada cangkang telur.
Presipitasi Sampel
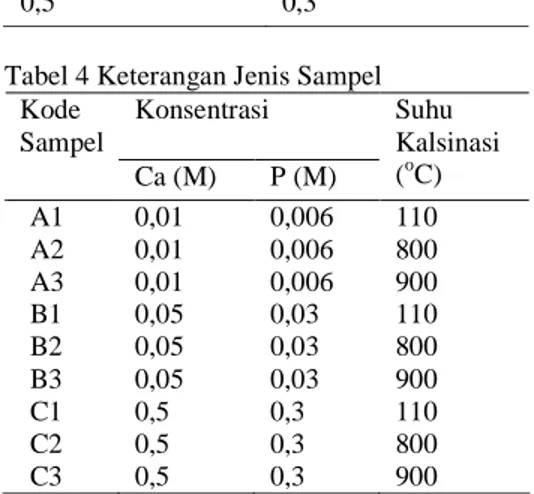
Hidroksiapatit diperoleh dengan cara melarutkan cangkang telur yang telah dikalsinasi dalam aquabides sebanyak 50 ml, dilanjutkan dengan penambahan diamonium fosfat ((NH4)2HPO4) yang dilarutkan dalam aquabides sebanyak 50 ml. Jumlah cangkang telur dan (NH4)2HPO4 yang dilarutkan ditentukan berdasarkan hasil perhitungan stoikiometri sehingga menghasilkan rasio konsentrasi Ca/P sebesar 1,67. Proses presipitasi dilakukan beberapa kali dengan variasi konsentrasi Ca dan P seperti pada Tabel 3.
Presipitasi dilakukan pada suasana fisiologis (atmosfer nitrogen, dan suhu 37oC). Kontrol pH dilakukan dengan menggunakan NH3. Stirring dilakukan pada presipitat selama 30 menit setelah presipitasi tanpa perlakuan panas. Sampel selanjutnya disimpan dalam waktu yang lama yang disebut dengan proses aging. Aging pada presipitat dilakukan selama 24 jam. Presipitat kemudian disaring dengan menggunakan kertas saring. Sisa presipitat
yang menempel pada gelas piala dicuci dengan aquabides hangat dan disaring kembali. Pengeringan presipitat dilakukan dengan menggunakan furnace pada suhu 110oC kemudian ditahan 3 jam. Diamati pula perubahan yang terjadi akibat kalsinasi pada suhu 800oC dan 900oC untuk masing-masing konsentrasi. Presipitat yang dihasilkan dapat terlihat pada Tabel 4. Semua presipitat yang dihasilkan dikarakterisasi dengan AAS, UV-Vis dan FTIR. Urutan proses penelitian dapat digambarkan melalui diagram alir seperti pada Gambar 2.
Karakterisasi dengan FTIR Spectroscopy Presipitat yang sudah dikalsinasi dikarakterisasi dengan menggunakan spektroskopi FTIR. Dua milligram presipitat dicampur dengan 100 mg KBr, dibuat pellet inframerah (IR) kemudian diuji dengan
jangkauan bilangan gelombang 4000-400 cm-1. KBr selalu disertakan pada
setiap pengukuran untuk menghilangkan serapan latar belakang.
Karakterisasi dengan AAS dan UV-Vis Spectroscopy
Sampel masing-masing sebanyak 0,1 gram yang sudah dikalsinasi kemudian dikarakterisasi dengan menggunakan AAS dan UV-Vis. Karakterisasi dengan AAS bertujuan untuk mengukur kadar Kalsium (Ca2+) sedangkan karakterisasi dengan spektroskopi UV-Vis bertujuan untuk mengukur kadar fosfor (P5+).
Tabel 3 Konsentrasi Ca dan P yang digunakan pada proses presipitasi Konsentrasi Ca (M) Konsentrasi P (M)
0,01 0,006
0,05 0,03
0,5 0,3
Tabel 4 Keterangan Jenis Sampel Konsentrasi Kode Sampel Ca (M) P (M) Suhu Kalsinasi (oC) A1 0,01 0,006 110 A2 0,01 0,006 800 A3 0,01 0,006 900 B1 0,05 0,03 110 B2 0,05 0,03 800 B3 0,05 0,03 900 C1 0,5 0,3 110 C2 0,5 0,3 800 C3 0,5 0,3 900
Sampel sebanyak 0,1 gram yang telah halus ditambahkan asam nitrat pekat (HNO3) sebanyak 10 ml dalam erlenmeyer 125 ml. Sampel didestruksi pada suhu 110oC selama satu jam kemudian didinginkan. Sampel selanjutnya diencerkan dengan aquades 100 ml dan disaring. Ekstrak yang dihasilkan siap dikarakterisasi dengan AAS dan UV-Vis. Alat spektrometer AAS yang digunakan merek varian tipe spectra A30 dengan tipe lampu hollow cathode lamp. Alat spektrometer UV-Vis yang digunakan merek shimadzu dengan panjang gelombang 400 m.
Gambar 2 Diagram alir penelitian.
HASIL DAN PEMBAHASAN
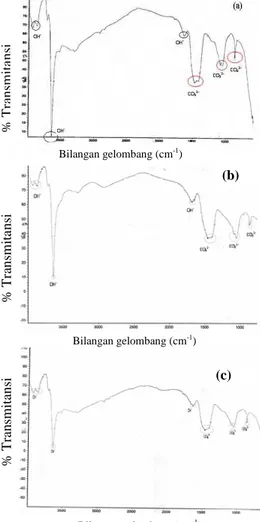
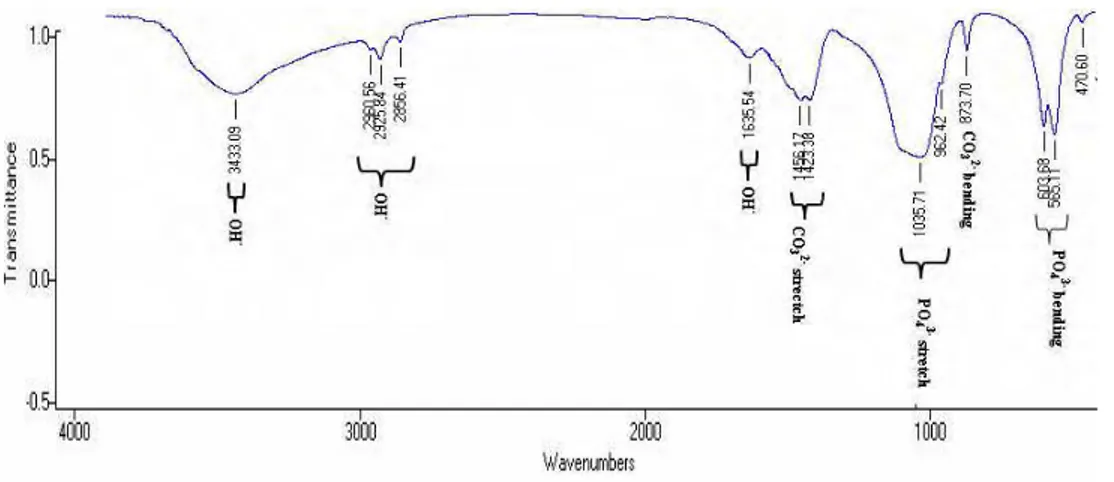
Pembentukan Mineral Apatit dari Cangkang TelurSpektroskopi FTIR mengidentifikasi gugus fungsi dalam sampel yang telah dikalsinasi. Gugus fungsi yang teridentifikasi dari hasil kalsinasi cangkang telur yang dikalsinasi pada suhu 1000oC seperti terlihat pada Gambar 3 yaitu gugus hidroksil (OH-) dan gugus karbonat (CO3
2– ). Gugus OH- pada spektrum FTIR muncul pada bilangan gelombang sekitar 3400-3600cm-1 dengan puncak yang tajam. Gugus OH- dengan bilangan gelombang tersebut merupakan ikatan O-H dalam bentuk H2O yang ada pada permukaan sampel10. Gugus CO32- muncul dari kandungan cangkang telur pada bilangan gelombang sekitar 873cm-1 dan 1450cm-1
Tabel 5 Kadar Ca dan P hasil karakterisasi AAS dan UV-Vis
% T ra n sm it an si % T ra n sm it a n si
Gambar 3 Spektrum spektroskopi FTIR cangkang telur yang dikalsinasi pada suhu 10000C dengan penahanan (a) 5 jam, (b) 10 jam, dan (c) 15 jam. Bilangan gelombang (cm-1 ) Bilangan gelombang (cm-1 ) Bilangan gelombang (cm-1) % T ra n sm it a n si Cangkang telur
Kalsinasi pada suhu 10000C dengan waktu penahanan
5, 10 dan 15jam
Penentuan kadar Ca dengan AAS
Presipitasi apatit berbasis natural
Karakterisasi FTIR,AAS, dan UV-Vis Analisis data Penyusunan Laporan Karakterisasi FTIR Kalsinasi presipitat 110, 800 dan 900oC (b) (c)
Kode sampel Ca (% berat) P (% berat) A1 50,90 7,92 A2 54,82 7,96 A3 55,36 8,18 B1 53,62 7,35 B2 61,12 8,40 B3 61,50 8,55 C1 63,16 15,22 C2 67,54 15,93 C3 68,65 17,00
Spektrum spektroskopi FTIR dari cangkang telur yang dikalsinasi pada suhu 10000C menunjukkan transmitansi gugus CO32- semakin rendah dengan semakin lamanya waktu penahanan. Cangkang telur yang ditahan selama 5 jam mempunyai nilai transmitansi paling tinggi dibandingkan cangkang telur yang ditahan 10 jam dan 15 jam. Cangkang telur yang ditahan 5 jam menunjukkan terjadi optimasi pelepasan CO2 ke udara. Spektrum FTIR cangkang telur menunjukkan cangkang telur yang ditahan selama 15 jam mempunyai nilai transmitansi paling rendah. Keadaan ini menunjukkan intensitas pita serapan karbonat dalam sampel meningkat. Jadi cangkang telur yang dikalsinasi pada suhu 1000oC dan ditahan selama 5 jam mempunyai jumlah karbonat yang paling sedikit di dalam sampel.
Analisis Kandungan Ca dan P Menggunakan AAS dan spektrometer UV-Vis
AAS digunakan untuk mengetahui kadar ion Ca2+ yang ada dalam sampel sedangkan spektroskopi UV-Vis digunakan untuk mengetahui kadar ion P5+ dalam sampel. Hasil pengukuran AAS dan UV-Vis tersaji dalam Tabel 5. Variasi suhu mempengaruhi kadar ion Ca2+ dan P5+ dalam sampel.
Tabel 5 Kadar Ca dan P hasil karakterisasi AAS dan UV-Vis
Sampel A mempunyai konsentrasi Ca2+ sebesar 0,01 M dan P5+ sebesar 0,006 M, sampel B mempunyai konsentrasi Ca2+ sebesar 0,05 M dan P5+ sebesar 0,03 M dan sampel C mempunyai konsentrasi Ca2+ sebesar 0,5 M dan P5+ sebesar 0,3 M. Sampel C mempunyai kadar kalsium dan fosfor yang paling tinggi dibandingkan sampel A dan B. Kondisi ini menunjukkan bahwa dengan semakin besarnya konsentrasi Ca2+ dan P5+ dalam presipiat maka jumlah hidroksiapatit yang terbentuk semakin banyak. Kondisi seperti ini dapat terjadi karena semakin besar konsentrasi yang digunakan maka jumlah partikel unsur-unsur pembentuk hidroksiapatit akan semakin banyak.
Sampel A1, A2 dan A3 mempunyai konsentrasi sama tapi suhu kalsinasi berbeda mempunyai kadar ion yang berbeda. Sampel A3 mempunyai kadar kalsium 55,36 %b/b dan fosfor 8,18 %b/b. Kadar ini paling besar dibandingkan A1 dan A2 karena suhu kalsinasinya lebih tinggi dibandingkan sampel A1 dan A2 yaitu pada suhu 900oC. Kondisi yang sama juga dapat dilihat pada sampel B dan C. Sampel B3 yang dikalsinasi pada suhu 900oC mempunyai kadar kalsium dan fosfor lebih besar dibandingkan sampel B1 dan B2. Kadar ion Ca2+ dalam sampel B3 sebesar 61,50 %b/b dan kadar ion P5+ sebesar 8,55 %b/b. Sampel C3 dengan suhu kalsinasi 900oC mempunyai kadar ion Ca2+ sebesar 68,65 %b/b dan kadar P5+ sebesar 15,22 %b/b. Kadar ion sampel C3 lebih besar dibandingkan sampel C1 dan C2.
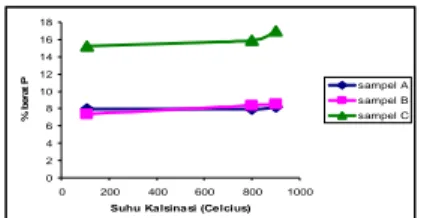
Gambar 4 Hubungan suhu kalsinasi terhadap % berat Ca dalam sampel.
Gambar 5 Hubungan suhu kalsinasi terhadap % berat P dalam sampel.
OH -0 2 4 6 8 10 12 14 16 18 0 200 400 600 800 1000
Suhu Kalsina si (Celcius)
% b e ra t P sampel A sampel B sampel C
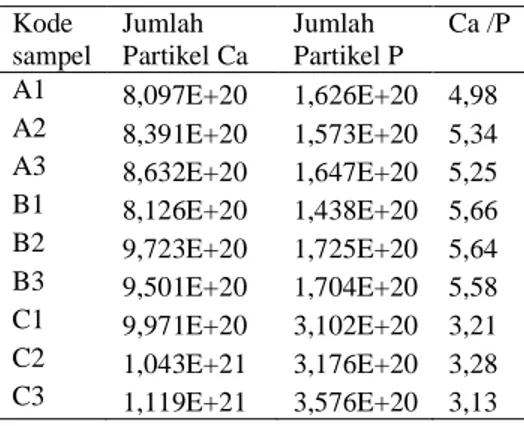
Kode sampel Jumlah Partikel Ca Jumlah Partikel P Ca /P A1 8,097E+20 1,626E+20 4,98 A2 8,391E+20 1,573E+20 5,34 A3 8,632E+20 1,647E+20 5,25 B1 8,126E+20 1,438E+20 5,66 B2 9,723E+20 1,725E+20 5,64 B3 9,501E+20 1,704E+20 5,58 C1 9,971E+20 3,102E+20 3,21 C2 1,043E+21 3,176E+20 3,28 C3 1,119E+21 3,576E+20 3,13 Hasil AAS dan UV-Vis menunjukkan kenaikan suhu tidak mengubah secara signifikan jumlah unsur-unsur yang terdapat dalam sampel. Peningkatan jumlah ion kalsium dan fosfor dalam presipitat lebih dipengaruhi oleh peningkatan konsentrasi kalsium. Gambar 4 dan 5 menunjukkan
Rasio Ca/P HAp murni adalah 1,67. Hasil AAS dan UV-Vis dari sampel menunjukkan nilai Ca/P yang lebih besar dari 1,67. Hal ini kemungkinan besar terjadi karena adanya impuritas pada proses presipitasi. Kemungkinan besar impuritas tersebut disebabkan oleh ion CO32- yang berasal dari cangkang telur. Pernyataan ini diperkuat oleh hasil karakterisasi presipitat dengan FTIR. Ion CO32- dapat menggantikan posisi ion PO43- sehingga kadar P5+ dalam presipitat menurun. Nilai Ca/P yang terdapat pada Tabel 6 bervariasi. Nilai Ca/P dihitung dengan membandingkan jumlah partikel kalsium dan fosfor yang terdapat dalam sampel. Besarnya nilai Ca/P juga dipengaruhi oleh kadar P5+ dalam sampel, semakin kecil kadar P5+ maka akan menghasilkan nilai Ca/P yang semakin besar. Sampel B1 mempunyai nilai Ca/P yang paling besar yaitu 5,66 dengan jumlah fosfor yang paling kecil. Nilai Ca/P yang paling kecil yaitu 3,13 yang terdapat pada sampel C3. Jadi semakin kecil impuritas dalam sampel maka akan menghasilkan rasio Ca/P yang semakin mendekati rasio Ca/P HAp murni sebesar 1,67.
Tabel 6 Rasio Ca/P dalam sampel
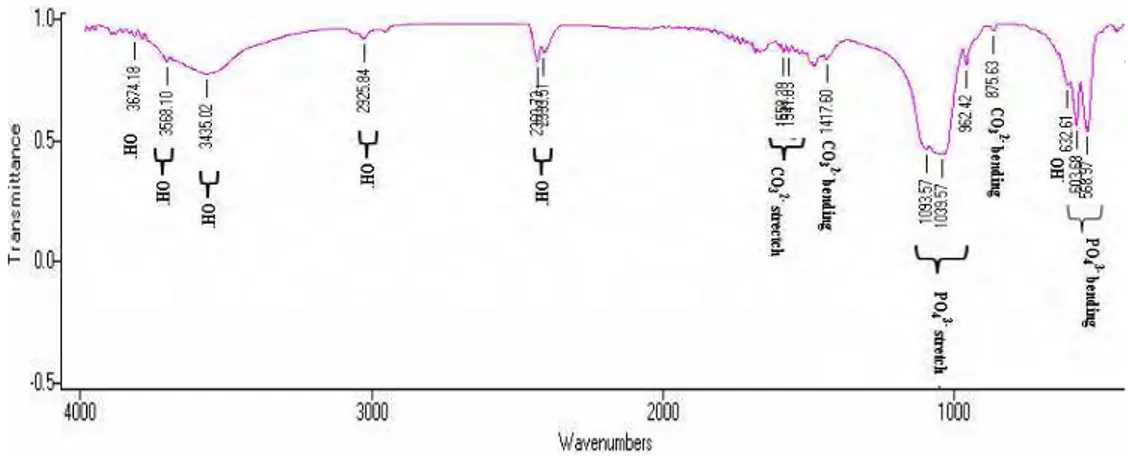
Identifikasi Gugus Anion PO4
3-, CO3
2-dan H2O dengan FTIR
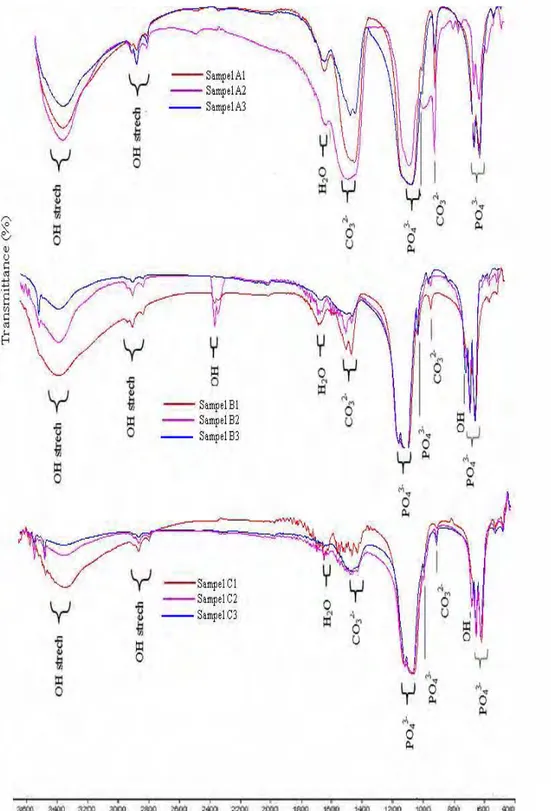
Gugus pembentuk apatit dapat dianalisis dengan FTIR. Spektra FTIR pada Gambar 6 mengidentifikasi hadirnya gugus fungsi OH-, PO4
dan CO3
dalam sampel. Variasi suhu kalsinasi dan konsentrai Ca/P mempengaruhi bentuk pita serapan yang diidentifikasi spektroskopi inframerah. Secara umum semua sampel menunjukkan pita serapan gugus OH- , pita serapan υ1,υ3,
danυ4 PO43-, dan υ2, υ3 gugus CO32-.
Kenaikan konsentrasi mempengaruhi intensitas spektrum inframerah masing-masing gugus fungsi yang hadir dalam sampel. Spektum inframerah pada Gambar 6 menunjukkan semakin besar konsentrasi menyebabkan semakin tajam puncak-puncak gugus fosfat (PO43-) yang hadir dalam sampel. Puncak yang terbentuk juga semakin panjang dengan bertambahnya konsentrasi. Kehadiran gugus fosfat menandakan terbentuknya HAp dalam presipitat. Gugus OH- pada bilangan gelombang 633 cm-1 yang merupakan karakteristik HAp muncul pada sampel B2, B3, C1, C2, dan C3. Kondisi ini menandakan kenaikan konsentrasi akan meningkatkan jumlah hidroksiapatit yang terbentuk. Sampel A1, B1 dan C1 dengan konsentrasi yang berbeda tapi mempunyai suhu yang sama menunjukkan sampel C1 mempunyai nilai transmitansi yang paling tinggi dibandingkan A1 dan B1 untuk gugus karbonat dengan intensitas puncak semakin lemah. Hal ini menunjukkan semakin sedikit ion karbonat yang merupakan inhibitor pada pembentukan HAp sehingga HAp yang terbentuk semakin banyak. Kondisi ini juga berlaku untuk sampel A2, B2 dan C2 serta A3, B3, dan C3.
Sampel A1, A2 dan A3 menunjukkan pita serapan υ1,υ3, danυ4 PO43-. Pita serapan
vibrasi stretching (υ1)PO43- muncul dengan
puncak yang lemah pada bilangan gelombang 962,42 cm-1 untuk sampel A1 dan A3, sedangkan pada sampel A2 muncul pada bilangan gelombang 948,92 cm-1. Pita serapan vibrasi asimetri strectching (υ3)
PO4
yang muncul bentuknya tidak simetri menandakan bahwa terbentuknya kristal HAp pada sampel. Kondisi ini diperkuat oleh bentuk pita serapan vibrasi antisimetri
bending (υ4) PO43- sampel A1, A2 dan A3
membentuk belahan dengan memiliki dua puncak yang tajam pada bilangan gelombang sekitar 567 cm-1 dan 603 cm-1.
Bentuk pita serapan υ3 PO43- sampel A3
lebih tidak simetri dibanding sampel A1 dan A2 menunjukkan kenaikan suhu akan meningkatkan derajat kristalinitas. Pernyataan ini diperkuat dengan bentuk pita serapan υ4 PO43- yang mempunyai derajat
belah yang tinggi dibandingkan sampel A1 dan A2. Pita
serapan υ2 gugus CO32- muncul pada
bilangan gelombang 873,70 cm-1 untuk sampel A1 dan A3, 875,63 cm-1 untuk sampel A2. Puncak pita serapan υ2 gugus
CO32- yang muncul semakin tajam seiring dengan kenaikan suhu.
Sampel A3 mempunyai transmitansi yang lebih tinggi dibandingkan sampel A1 dan A2. Kondisi ini menunjukkan intensitas pita serapan karbonat yang hadir dalam sampel semakin sedikit dengan semakin tingginya suhu kalsinasi.
Pita serapan υ3 CO32- yang muncul tidak
simetri dan terbentuk bahu pada sampel A3 yang menandakan terjadinya pembentukan kristal pada sampel. Ion karbonat merupakan inhibitor pertumbuhan kristal dalam sampel. Ion karbonat dapat menggantikan posisi gugus fosfat membentuk kristal apatit tipe B.
Bilangan gelombang yang muncul pada pita serapan υ2 dan υ3 CO32- sampel A1, A2, dan
A3 merupakan karakter apatit tipe B. Pita serapan gugus OH- sampel A1, A2 dan A3 muncul pada bilangan gelombang sekitar 3435,02 cm-1 dengan bentuk pita yang lebar. Pita serapan OH- pada bilangan gelombang tersebut menunjukkan kondisi H2O pada permukaan sampel. Transmitansi gugus OH- sampel A3 lebih tinggi dibandingkan sampel A1 dan A2 menandakan bahwa H2O yang hadir pada permukaan sampel semakin sedikit dengan semakin besarnya suhu kalsinasi. Pita serapan gugus OH- juga muncul pada bilangan gelombang sekitar 1633 cm-1 yang menunjukkan kehadiran H2O dalam sampel.
Sampel B1, B2 dan B3 juga menunjukkan pita serapan yang hampir sama dengan sampel A1, A2 dan A3. Sampel B1, B2 dan B3 menunjukkan pita serapan υ1 PO43- pada bilangan gelombang
yang sama yaitu 962,42 cm-1. Pita serapan υ3 muncul pada bilangan gelombang
sekitar 1036 cm-1 pada sampel. Pita serapan
υ3 PO43- pada sampel B2 dan B3 terbentuk
bahu (belahan) menandakan mulai terbentuknya kristal pada sampel. Belahan ini semakin jelas terlihat pada pita serapan
υ4 PO43- yang mempunyai dua puncak.
Pita absorbsi PO4 3- (cm-1) Pita absorbsi CO3 (cm-1) Kode sampel υ1 υ3 υ4 υ2 υ3 Pita absorbsi OH- (cm-1) A1 962,42 1039,57 567,04 605,61 873,70 1425,31 1634, 3434 A2 948,92 1053,07 568,96 603,89 875,63 1473,53 1622,99 3434, 3642 A3 962,42 1035,71 565,11 603,89 873,70 1423,38 1635, 3433 B1 962,42 1035,71 565,11 603,68 873,70 1421,45 1456,17 1649, 3435 B2 962,42 1039,57 568,97 603,68 873,70 1419,52 1458,098 1650,98 3435 B3 962,42 1037,64 1093,57 567,03 603,68 891,06 1421,45 1458,098 1650,98 3434-3572 C1 962,42 1043,43 570,89 601,75 875,63 1419,52 1458,091 1650, 3444-3566 C2 962,42 1045,36 1091,64 570,89 603,68 875,63 1459,52 1458,09 1650, 3445-3644 C3 962,42 1033,78 1091 565,11 603,68 875,63 1458,9 1650,98 3445-3645 Tabel 7 Nilai bilangan gelombang setiap pita serapan
Derajat belah sampel B3 lebih tinggi dibandingkan sampel B1 dan B2. Semakin tinggi suhu maka derajat belah pada sampel semakin tinggi yang menunjukkan derajat kristalinitas semakin tinggi. Kondisi ini menandakan sampel semakin kristal yang memperkuat kondisi yang terjadi pada pita serapan υ3 gugus PO43-.
Pita serapan υ2 dan υ3 gugus CO32- juga
muncul pada sampel B1, B2 dan B3. Pita serapan υ2 muncul pada bilangan gelombang
yang sama untuk sampel B1 dan B2 yaitu pada bilangan gelombang 873,70 cm-1, sedangkan untuk sampel B3 terjadi pergeseran pada bilangan gelombang 891,06 cm-1. Puncaknya semakin lemah seiring dengan meningkatnya suhu kalsinasi. Kondisi ini menandakan semakin sedikit gugus karbonat yang ada dalam sampel. Kondisi ini semakin diperkuat oleh pita serapan υ3 yang puncaknya semakin lemah
dan terbentuknya bahu seiring peningkatan suhu. Pita serapan υ3 muncul pada bilangan
gelombang sekitar 1420-1545 cm-1. Bilangan gelombang pita serapan karbonat sampel B1, B2 dan B3 menunjukkan terbentuknya kristal apatit tipe B pada bilangan gelombang 873 cm-1 dan sedikit kristal apatit tipe A pada bilangan gelombang 1541 cm-1 yang terdapat pada sampel B2. Kristal apatit tipe A terbentuk karena ion karbonat menempati posisi ion hidroksil.
Gugus OH- yang muncul pada sampel B1, B2 dan B3 menunjukkan keadaan H2O pada permukaan sampel dengan panjang gelombang sekitar 3434 - 3572cm-1. Puncak gugus OH- pada kondisi ini semakin lemah dengan meningkatnya suhu. Kondisi ini menunjukkan H2O dalam sampel semakin sedikit yang ditunjukkan dengan persen transmitansi gugus OH- semakin tinggi. Pita serapan OH- pada bilangan gelombang sekitar 1633 cm-1 juga menunjukkan hadirnya H2O dalam sampel. Gugus OH
-pada bilangan gelombang 633 cm-1 menunjukkan ion OH- yang terikat dalam HAP dengan puncak yang semakin jelas seiring dengan kenaikan suhu.
Pita serapan υ1 gugus fosfat pada sampel
C1, C2 dan C3 muncul pada bilangan gelombang yang sama yaitu pada bilangan gelombang 962,42 cm-1 dengan puncak yang sangat lemah. Pita serapan υ3 PO4
3-sampel C1, C2 dan C3mempunyai puncak panjang dan tajam. Bentuk pita serapan υ3
yang tidak simetri dan terbentuknya bahu pada sampel C2 dan C3 menunjukkan
terbentuknya fase kristal dalam sampel. Kondisi ini diperkuat oleh bentuk pita serapan υ4 yang menunjukkan terbentuk
belahan yang tajam pada puncak sampel. Belahan yang terbentuk semakin tajam pada sampel C3 dengan suhu kalsinasi 900oC sehingga mempunyai derajat kristalinitas yang lebih tinggi dibandingkan sampel C1 dan C2.
Pita serapan υ2 gugus karbonat sampel
C1, C2 dan C3 muncul pada bilangan gelombang yang sama yaitu 875,63 cm-1. Bilangan gelombang tersebut menunjukkan terbentuknya kristal apatit tipe B. Puncaknya semakin lemah dengan meningkatnya suhu kalsinasi. Kondisi ini menunjukkan gugus karbonat yang ada dalam sampel semakin sedikit. Pita serapan υ3 CO32- juga
menunjukkan puncak yang lemah pada bilangan gelombang sekitar 1459 - 1545 cm -1
dengan persen transmitansi semakin tinggi dengan meningkatnya suhu kalsinasi. Kondisi ini menunjukkan intensitas pita serapan karbonat yang ada dalam sampel semakin sedikit. Sampel C1 dan C2 juga menunjukkan terbentuknya kristal apatit tipe A pada bilangan gelombang 1541 cm-1.
Pita serapan OH- pada sampel C1, C2 dan C3 mempunyai puncak yang lemah dalam bentuk H2O dengan bentuk pita yang lebar. Gugus OH- yang terikat dalam sampel muncul pada bilangan gelombang 1650,96 cm-1. Gugus OH- terikat pada HAp ditunjukkan pada bilangan gelombang 633 cm-1. Awalnya bentuk pita hanya berupa bahu, seiring dengan naiknnya suhu maka puncak yang terbentuk semakin jelas yang menandakan kristalinitas HAp semakin bagus dengan semakin tingginya suhu.
Kenaikan suhu akan mempengaruhi fase sampel. Peningkatan suhu kalsinasi mengubah fase sampel menjadi kristal dan mengalami peningkatan derajat kristalinitas. Sampel yang dikalsinasi pada suhu 900oC mempunyai sifat kristal hidroksiapatit yang lebih bagus dibandingkan sampel yang dikalsinasi pada suhu 110oC dan 800oC.
Pita serapan gugus karbonat menunjukkan terbentuknya dua tipe kristal apatit yaitu apatit karbonat tipe A dan apatit karbonat tipe B. Secara umum dari semua sampel yang paling banyak muncul adlah kristal apatit tipe B. Pada kondisi ini ion CO3
2-
menggantikan posisi ion PO4
3-. Semakin tinggi suhu kalsinasi maka semakin banyak gugus CO3
2-
yang tereliminasi. Semakin kecil kandungan gugus CO32- maka proses pengkristalan akan semakin mudah
karena tidak ada inhibitor bagi PO43- saat presipitasi. Kondisi ini diperkuat berdasarkan hasil AAS dan UV-Vis. Hasil FTIR, AAS dan UV-Vis menunjukkan sampel C3 yang dikalsinasi pada suhu 900oC dengan konsentrasi 0,5 M kalsium, 0,3 M fosfor mengandung kadar kalsium dan fosfor yang paling besar dan jumlah partikel unsur pembentuk kristal hidroksiapatit yang terbentuk paling banyak.
KESIMPULAN
Hidroksiapatit sebagai salah satu biomaterial pengsubstitusi tulang dapat dibuat dari bahan alami. Cangkang telur yang kaya kalsium dapat menjadi starting
material pembuatan hidroksiapatit.
Pembentukan hidroksiapatit dari cangkang telur dapat diperoleh dengan mereaksikan kalsium dari cangkang telur dengan diamonium fosfat dengan metode presipitasi pada suhu 37oC. Pembuatan hidroksiapatit sangat dipengaruhi oleh suhu dan konsentrasi kalsium dan fosfor.
Kenaikan suhu kalsinasi akan meningkatkan derajat kristalinitas HAp yang terbentuk. Spektrum FTIR menunjukkkan terjadinya perubahan fase zat menjadi kristal jika suhu kalsinasi semakin tinggi. Semakin tinggi suhu maka derajat kristalinitas HAp yang terbentuk semakin tinggi.
Konsentrasi kalsium dan fosfat akan mempengaruhi jumlah kalsium dan fosfor sebagai unsur pembentuk HAp. Semakin besar konsentrasi kalsium dan fosfor yang digunakan dengan batas-batas tertentu maka akan meningkatkan jumlah hidroksiapatit yang terbentuk. Hasil FTIR sampel menunjukkan terbentuknya dua tipe kristal apatit yaitu kristal apatit tipe A dan kristal apatit tipe B. Kandungan Ion CO3
dalam sampel semakin kecil mengakibatkan proses pengkristalan akan semakin mudah karena tidak ada inhibitor pada saat presipitasi.
DAFTAR PUSTAKA
1. Dasgupta P, A. Singh, S. Adak and KMPurohit. Syntesis and Characterization of Hidroxyapatite Produced from Eggshell. InternationalSymposium of
Research on Material Science and Engineering. 2004; 20-22
2. [Anonim]. Nutrient Composition of
dried Eggshells
http://en.wikipedia.org/wiki/Eggshell [5 Juli 2007].
3. Aoki H. 1991. Science and Medical
Applications of Hydroxyapatite. Tokyo:
Tokyo Medical and Dental University. 4. Prabakan K, A Balamurugan and S
Rajeswari. 2005. Development of Calcium Phosphate Based Apatite from Hen’s Eggshell. Indian Academy of
science; 28(2): 115-119
5. [Anonim]. Model of Hydroxyapatite
http://www.stolaf.edu/depts/ chemistry/ courses/toolkits/125/mo/apatite/mo.html [4 Juli 2007].
6. Guzman C, Vazquez, CP Barba, and N Munguia. 2005. Stoichiometric hydroxyapatite obtained by precipitation and sol gel processes.
Revista Mexicana de Fisica.;
51(3):284–293
7. Tipler, PA. Fisika Untuk Sains dan
Teknik. Jakarta : Erlangga; 1991
8. Pava DL, GM Lampiran, GS Kriz. 2001. Introduction to spectroscopy 3rd.
Washington: Thomson Learning Inc. 9. Skoog DA, FJ Holler, and
AN Timothy. 200. Principeles of
Instrumental Analysis fifth edition.
Brooks/Cole: Thomson Learning. 10. Leventouri T. 2006. Synthetic and
biological hydroxyapatites: Crystal structure questions. Elsevier.
11. Alicia MW. The Importance of
Calcium in Our Greys’ Diets.
http://www.sabah.org.my/bm/nasihat/art ikel_kesihatan/osteoporosis.htm. [28 Juni 2007]
12. Kartohadiprojo II. 1999. Kimia Fisika
jilid 1 edisi keempat (terjemahan).
Jakarta: Erlangga.
13. Baig AA. 1999. Metasatble Equilibrium Solubility Behavior of Bone Mineral.
Calc Tiss Int; 64:329-339
14. Joel G, Garcia, Ruiz, MT Hincke. 2004. Avian eggshell mineralization: biochemical and functional characterization of matrix proteins.
Instituto Andaluzde Cienciasdela
Tierra-CSIC, Campusd eFuentenueva. 18002 Granada, Spain.
15. Thamaraiselvi, K. Prabakaran and S. Rajeswari. 2006. Synthesis of Hydroxyapatite that Mimic Bone Minerology Department of Analytical
Chemistry University of Madras Guindy Campus, Chennai.
16. Muslich A. 2007. Apatite Growth
Optimation on Chicken Mucouse by Fourier Transform Infrared (FTIR) Characterization. [ Skipsi ]. Bogor: Bogor Agricultural University.
17. Orton. 2002. Thermal Gravimetric Analysis. Servicios e Instrumentos de
México.
18. Hidayat Y. 2005. Pengaruh Ion
Karbonat, Magnesium, dan Fluor
dalam Presipitasi Senyawa Kalsium
Fosfat: Karakterisasi dengan
Menggunakan Atomic Absorption
Spectroscopy(AAS), Spektroskopi UV-Vis, dan Fourier Transform Infrared (FTIR). [ Skipsi ]. Bogor : Institut Pertanian Bogor.
19. Sherman CP. 2000. Infrared Spectroscopy. Separation Sciences Research and Product Development Mallinckrodt, Inc.
20. Halliday dan Resnick. 1985. Fisika jilid
1 edisi ketiga (terjemahan). Jakarta:
Erlangga;
21. [Anonim].Calcination.http://www.wiki pedia.org/the free encyclopedia / calcination.htm. [2 November 2007]
Lampiran 1 Set Alat Percobaan
pH meter dan termometer digital Buret diisi dengan larutan
(NH4)2HPO4
Larutan Kalsium(Ca(OH)2)
Aluminum foil HOT PLATE Magnetic stirrerLampiran 2 Alur Kerja Penelitian
ALUR KERJA PENELITIAN
Persiapan sampel
Presipitasi sampel
Uji AAS untuk menentukan
kadar Ca dalam cangkang
Presipitat di uji dengan
FTIR, AAS dan UV-Vis
Lampiran 3 Kadar usur dalam sampel hasil AAS dan UV-Vis
Perhitungan kadar kalsium dan fosfor dalam sampel
Keterangan:
K = kadar unsur dalam sample (%) V = volume pelarut (ml)
c = konsentrasi unsure (ppm) b = blanko (ppm)
m = massa (gram)
Tabel Hasil AAS cangkang telur yang dikalsinasi pada suhu 1000 0C
Sampel massa sampel (gram) Konsentrasi Ca 2+(ppm)
Blanko 0 0
Cangkang telur 0,2145 4,94
Tabel Hasil AAS dan UV-Vis sampel
Konsentrasi (ppm) Kode Sampel massa (gram) Ca2+ P5+ Blanko 0 0 0 A1 0,1057 5,38 16,748 5,38 16,748 A2 0,1017 5,61 16,182 5,54 16,182 A3 0,1036 5,76 16,951 5,71 16,951 B1 0,1007 5,41 14,804 5,39 14,804 B2 0,1057 6,47 17,757 6,45 17,757 B3 0,1026 6,30 17,539 6,32 17,539 C1 0,1049 6,74 36,143 6,75 36,143 C2 0,1026 7,04 39,956 7,08 39,956 C3 0,1083 7,56 37,330 7,55 37,330
%
100
)
(
x
m
p
b
c
V
K
=
−
Lampiran 4 Tabel Perhitungan rasio Ca/P dalam sampel Kode sampel Kadar Ca2+ (% b/b) Kadar P5+ (% b/b) Massa sampel AAS (gram) Massa sampel UV-Vis (gram) Massa Ca2+ (gram) Massa P5+ (gram) Jumlah partikel Ca A1 50,90 7,92 0.1057 0.1057 0.0538 0.0084 8.097E+20 A2 54,82 7,96 0.1017 0.1017 0.0558 0.0081 8.391E+20 A3 55,36 8,18 0.1036 0.1036 0.0574 0.0085 8.632E+20 B1 53,62 7,35 0.1007 0.1007 0.0540 0.0074 8.126E+20 B2 61,12 8,40 0.1057 0.1057 0.0646 0.0089 9.723E+20 B3 61,50 8,55 0.1026 0.1026 0.0631 0.0088 9.501E+20 C1 63,16 15,22 0.1049 0.1037 0.0663 0.0158 9.971E+20 C2 67,54 15,93 0.1026 0.1037 0.0693 0.0165 1.043E+21 C3 68,65 17,00 0.1083 0.1023 0.0743 0.0174 1.119E+21
Lampiran 5 Hasil karakterisasi sampelA dengan spektroskopi inframerah (FTIR)
Gambar Spektrum FTIR sampel A1 (0,01M/0,006M dan suhu 1100C)
Gambar Spektrum FTIR sampel A2 (0,01M/0,006M dan suhu 8000C)
Lampiran 6 Hasil karakterisasi sampel B dengan spektroskopi inframerah (FTIR)
Gambar Spektrum FTIR sampel B1(0,05M/0,03M dan suhu 1100C)
Gambar Spektrum FTIR sampel B2 (0,05M/0,03M dan suhu 8000C)
Lampiran 7 Hasil karakterisasi sampel C dengan spektroskopi inframerah (FTIR)
Gambar Spektrum FTIR sampel C1 (0,5M/0,3M dan suhu 1100C)
Gambar Spektrum FTIR sampel C2 (0,5M/0,3M dan suhu 8000C)
Lampiran 8 Puncak Spektrum FTIR
Kode sampel
Transmitansi Puncak Database gugus fungsi Fase 0.93 470.6 PO4 3-472 HAP 0.2 567.04 PO4 3-565 HAP 0.25 605.61 PO4 3-603 HAP 0.53 873.7 CO32- 873 AKB 0.63 962.42 PO4 3-960 HAP 0.01 1039.57 PO4 3-1100-1000 HAP 0.13 1425.31 CO32- 1550-1400 AKB 0.63 1633.61 OH- bending 1700-1600 H2O 0.74 2925.84 OH- (ikatan hidrogen) 2400-3400 A1 0.32 3435.02 OH- stretch 3400-3650 H2O 0.73 518.82 PO4 3-520 HAP 0.47 568.97 PO43- 565 HAP 0.56 603.68 PO43- 603 HAP 0.18 875.63 CO32- 873 AKB 0.11 1053.07 PO4 3-1100-1000 HAP 0.04 1473.53 CO32- 1550-1400 AKB 0.63 1622.99 OH- bending 1700-1600 H2O 0.75 2856.41 OH- (ikatan hidrogen) 2400-3400 0.67 2925.84 OH- (ikatan hidrogen) 2400-3400 A2 0.25 3435.02 OH- stretch 3400-3650 H2O 0.92 470.6 PO4 3-472 HAP 0.16 565.11 PO4 3-565 HAP 0.21 603.68 PO43- 603 HAP 0.73 873.7 CO32- 873 AKB 0.5 962.42 PO43- 960 HAP 0.01 1035.71 PO43- 1100-1000 HAP 0.4 1423.38 CO32- 1550-1400 AKB 0.39 1456.17 CO32- 1550-1400 0.68 1635.54 OH- bending 1700-1600 H2O 0.67 2925.84 OH- (ikatan hidrogen) 2400-3400 0.73 2960.56 OH- (ikatan hidrogen) 2400-3400 A3 0.43 3433.09 OH- stretch 3400-3650 H2O 0.81 472.53 PO4 3-472 HAP 0.19 565.11 PO43- 565 HAP 0.27 603.68 PO43- 603 HAP 0.78 873.7 CO32- 873 AKB 0.63 962.42 PO43- 960 HAP 0.01 1035.71 PO4 3-1100-1000 HAP 0.53 1421.45 CO32- 1550-1400 AKB 0.56 1456.17 CO32- 1550-1400 0.62 1650.98 OH- bending 1700-1600 H2O 0.68 2925.84 OH- (ikatan hidrogen) 2400-3400 B1 0.41 3435.02 OH- stretch 3400-3650 H2O 0.18 568.97 PO4 3-565 HAP 0.22 603.68 PO4 3-603 HAP 0.51 632.61 OH- 635 HAP 0.9 875.63 CO32- 873 AKB 0.66 962.42 PO43- 960 HAP B2 0.01 1039.57 PO4 3-1100-1000 HAP
0.05 1093.57 PO4 3-1100-1000 HAP 0.70 1417.6 CO32- 1550-1400 AKB 0.75 1541.03 CO32- 1550-1400 AKA 0.75 1558.39 CO32- 1550-1400 0.81 1650.98 OH- bending 1700-1600 H2O 0.85 2925.84 OH- (ikatan hidrogen) 2400-3400 0.59 3435.02 OH- stretch 3400-3650 H2O 0.68 3568.1 OH- stretch 3400-3650 H2O B2 0.86 3674.18 OH- stretch 3400-3650 H2O 0.94 474.46 PO43- 472 HAP 0.17 567.04 PO43- 565 HAP 0.21 603.68 PO43- 603 HAP 0.41 634.54 OH- 635 HAP 0.91 891.06 CO32- 890 0.65 962.42 PO4 3-960 HAP 0.01 1037.64 PO4 3-960 HAP 0.04 1093.57 PO4 3-1100-1000 HAP 0.74 1415.67 CO32- 1550-1400 AKB 0.82 1633.61 OH- bending 1700-1600 H2O 0.92 2925.84 OH- (ikatan hidrogen) 2400-3400 0.77 3435.02 OH- stretch 3400-3650 H2O B3 0.75 3571.95 OH- stretch 3400-3650 H2O 0.81 470.6 PO4 3-472 HAP 0.18 565.11 PO4 3-565 HAP 0.27 603.68 PO43- 603 HAP 0.71 875.63 CO32- 873 AKB 0.59 962.42 PO43- 960 HAP 0.01 1033.78 PO43- 1100-1000 HAP 0.66 1419.52 CO32- 1550-1400 AKB 0.65 1458.1 CO32- 1550-1400 0.66 1541.03 CO32- 1550-1400 AKA 0.66 1558.39 CO32- 1550-1400 0.63 1650.97 OH- bending 1700-1600 H2O 0.69 1699.19 OH- bending 1700-1600 H2O 0.68 2925.84 OH- stretch 3400-3650 H2O 0.55 3566.17 OH- stretch 3400-3650 H2O C1 0.68 3649.1 OH- stretch 3400-3650 H2O 0.81 470.6 PO43- 472 HAP 0.18 565.11 PO43- 565 HAP 0.27 603.68 PO43- 603 HAP 0.31 632.61 OH- 635 HAP 0.71 875.63 CO32- 873 AKB 0.59 962.42 PO43- 960 HAP 0.01 1033.78 PO43- 1100-1000 HAP 0.66 1419.52 CO32- 1550-1400 AKB 0.65 1458.1 CO32- 1550-1400 0.66 1541.03 CO32- 1550-1400 AKA 0.66 1558.39 CO32- 1550-1400 0.63 1650.97 OH- bending 1700-1600 0.69 1699.19 OH- bending 1700-1600 0.68 2925.84 OH- (ikatan hidrogen) 2400-3400 0.55 3566.17 OH- stretch 3400-3650 H2O C2 0.68 3649.1 OH- stretch 3400-3650 H2O 0.21 472.53 PO43- 472 HAP C3 0.22 570.9 PO43- 565 HAP
0.38 601.75 PO4 3-603 HAP 0.71 632.61 OH- 635 HAP 0.56 875.63 CO32- 873 AKB 0.01 962.42 PO43- 960 HAP 0.05 1043.43 PO43- 1100-1000 HAP 0.59 1091.64 PO43- 1100-1000 HAP 0.7 1421.45 CO32- 1550-1400 0.72 1650.97 OH- bending 1700-1600 H2O 0.75 1699.19 OH- bending 1700-1600 H2O 0.65 2925.84 OH- (ikatan hidrogen) 2400-3400 0.65 3571.95 OH- stretch 3400-3650 H2O C3 0.72 3645.25 OH- stretch 3400-3650 H2O