1 BAB I PENDAHULUAN
A. Latar Belakang Masalah
Kelarutan didefinisikan dalam besaran kuantitatif sebagai konsentrasi zat terlarut dalam larutan jenuh pada suhu tertentu, dan secara kualitatif didefinisikan sebagai interaksi spontan dari dua atau lebih zat untuk membentuk dispersi molekul homogen (Martin dkk., 2009). Kelarutan merupakan salah satu sifat fisikokimia yang penting untuk diperhatikan dalam formulasi suatu bahan obat menjadi sediaan farmasi karena kelarutan mempengaruhi laju disolusi obat dan menentukan ketersediaan hayati obat dalam tubuh. Untuk mencapai ketersediaan hayati yang optimal, obat harus melalui proses absorbsi dan pelarutan. Jika obat sudah berada dalam bentuk dispersi molekuler atau sudah terlarut, maka obat dapat melalui proses absorpsi sehingga pada akhirnya dapat memberikan efek farmakologi yang diinginkan dalam jangka waktu tertentu (Florence dan Attwood, 2006). Kelarutan perlu ditekankan untuk obat-obat yang termasuk dalam biopharmaceutical classification system (BCS) kelas 2 dan 4 yang mempunyai kelarutan rendah (poorly soluble drugs).
Salah satu senyawa yang termasuk dalam BCS kelas 4 adalah senyawa pentagamavunon-0 (PGV-0). Senyawa dengan nama kimia 2,5-bis-(4’-hidroksi-3’-metoksibenzilidin)-siklopentanon ini merupakan senyawa hasil modifikasi kurkumin yang diperoleh dari penelitian yang telah dilakukan oleh Tim Molekul Nasional (MOLNAS) Fakultas Farmasi UGM bekerja sama dengan PT. Indofarma
Tbk. dan PT. Kalbe Farma Tbk. Senyawa PGV-0 sangat potensial untuk dikembangkan sebagai senyawa obat karena diketahui mempunyai aktivitas antioksidan (Da’i, 1998), penghambatan enzim siklooksigenase (Nurrochmad, 1997), dan antiinflamasi (Sardjiman, 2000). Senyawa PGV-0 diketahui tidak menyebabkan ulkus pada tikus (Wahyuni, 1999), pada uji toksisitas akut dan sub kronis tidak menunjukan efek toksik pada kimia darah dan kimia urin (Donatus, 1994; Budisulistyo, 1999). Sementara itu, kendala utama dalam proses formulasi PGV-0 adalah bersifat praktis tidak larut dalam air. Maka dari itu, perlu dilakukan usaha peningkatan kelarutan PGV-0, salah satunya melalui penggunaan sistem hidrotropik.
Sistem hidrotropik merupakan salah satu metode peningkat kelarutan senyawa dalam air yang sederhana, aman dan ekonomis yang baru-baru ini dikembangkan dalam bidang farmasi. Hidrotropik merujuk pada kemampuan agen hidrotrop yang sangat larut dalam air dan memiliki permukaan aktif yang dapat meningkatkan kelarutan obat kurang larut atau bahkan tidak larut dalam air (Dandeeker, 2008). Pada sistem hidrotropik, pelarut yang digunakan adalah larutan agen hidrotrop dalam medium air. Natrium sitrat sebagai salah satu agen hidrotrop telah dilaporkan dapat dengan nyata meningkatkan kelarutan obat griseofulfin (Shete dkk., 2010), halofantrin (Nwodo dkk., 2013) dan asam salisilat hingga lebih dari 85 kali (Aditya dkk., 2013). Peneliti berpendapat bahwa fenomena tersebut berkaitan dengan pembentukan kompleks yang meliputi suatu interaksi lemah antara natrium sitrat dan obat terlarut (Lestari, 2014).
Menurut studi literatur yang telah dilakukan, ditemukan publikasi ilmiah yang mempelajari kelarutan PGV-0. Beberapa metode peningkat kelarutan PGV-0 yang pernah dilakukan antara lain dengan menambahkan kosolven, mengatur pH larutan, memperkecil ukuran partikel bahan obat, menambah surfaktan, dan pembentukan kompleks. Akan tetapi, penelitian tersebut belum memperoleh hasil yang memuaskan dalam meningkatkan kelarutan PGV-0. Oleh sebab itu, perlu dilakukan penelitian kembali terhadap kelarutan PGV-0 dengan metode yang lain yang belum pernah digunakan seperti sistem hidrotropik. Dengan natrium sitrat sebagai agen hidrotrop dalam sistem hidrotropik diharapkan dapat mengetahui pengaruh variasi konsentrasi pelarut larutan natrium sitrat dan peningkatan suhu percobaan terhadap profil kelarutan PGV-0. Nilai kelarutan PGV-0 yang akan diperoleh, diharapkan dapat menjadi data pendukung dalam proses preformulasi dan formulasi sediaan farmasi dengan bahan aktif PGV-0.
B. Rumusan Masalah
Berdasarkan pada latar belakang masalah, maka dapat dirumuskan beberapa masalah:
1. Bagaimanakah pengaruh sistem hidrotropik dengan natrium sitrat sebagai agen hidrotrop terhadap kelarutan PGV-0?
2. Bagaimanakah pengaruh variasi konsentrasi pelarut larutan natrium sitrat pada sistem hidrotropik terhadap kelarutan PGV-0?
3. Bagaimanakah pengaruh variasi suhu percobaan pada sistem hidrotropik terhadap kelarutan PGV-0?
C. Manfaat Penelitian
Penelitian ini akan memberikan informasi dan pengetahuan tentang pengaruh sistem hidrotropik dengan menggunakan natrium sitrat sebagai agen hidrotrop terhadap kelarutan bahan obat pentagamavunon-0.
D. Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Mengetahui pengaruh sistem hidrotropik dengan natrium sitrat sebagai agen hidrotrop terhadap profil kelarutan PGV-0.
2. Mengetahui pengaruh variasi konsentrasi pelarut larutan natrium sitrat dalam sistem hidrotropik terhadap kelarutan PGV-0.
3. Mengetahui pengaruh variasi suhu percobaan dalam sistem hidrotropik terhadap kelarutan PGV-0.
E. Tinjauan pustaka
1. Kelarutan
Kelarutan merupakan salah satu karakteristik fisikokimia yang penting diketahui dalam penelitian preformulasi suatu obat. Kelarutan didefinisikan dalam besaran kuantitatif sebagai konsentrasi zat terlarut dalam larutan jenuh pada temperatur tertentu, dan secara kualitatif didefinisikan sebagai interaksi spontan dari dua atau lebih zat untuk membentuk dispersi molekul homogen (Martin dkk.,
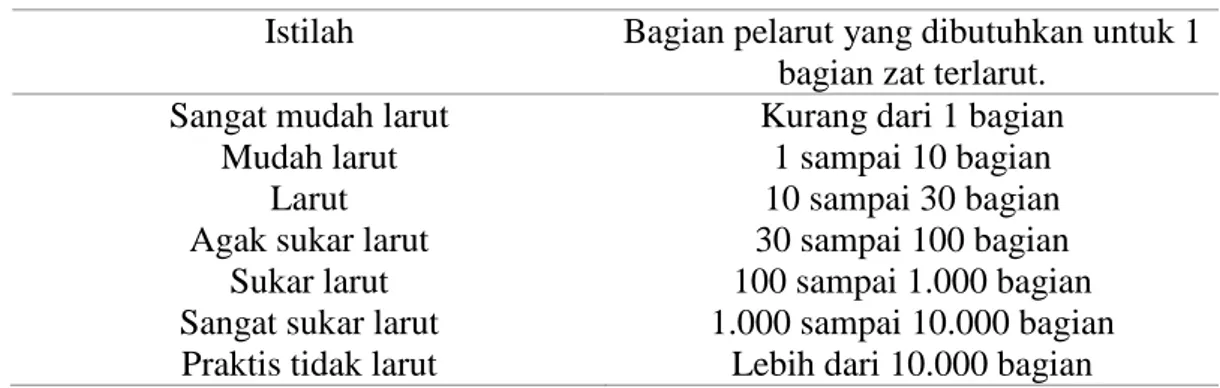
2009). Menurut Farmakope Indonesia jilid IV (1995), kelarutan adalah zat dalam bagian tertentu pelarut, kecuali dinyatakan lain menunjukkan bahwa 1 bagian bobot zat padat atau 1 bagian volume zat cair larut dalam bagian volume tertentu pelarut. Untuk zat yang kelarutannya tidak diketahui pasti, harga kelarutannya digambarkan dalam kompedia farmasi dengan menggunakan istilah umum tertentu, seperti pada tabel I.
Tabel I. Istilah umum perkiraan kelarutan (Martin dkk., 2009)
Istilah Bagian pelarut yang dibutuhkan untuk 1 bagian zat terlarut.
Sangat mudah larut Mudah larut
Larut Agak sukar larut
Sukar larut Sangat sukar larut Praktis tidak larut
Kurang dari 1 bagian 1 sampai 10 bagian 10 sampai 30 bagian 30 sampai 100 bagian 100 sampai 1.000 bagian 1.000 sampai 10.000 bagian
Lebih dari 10.000 bagian
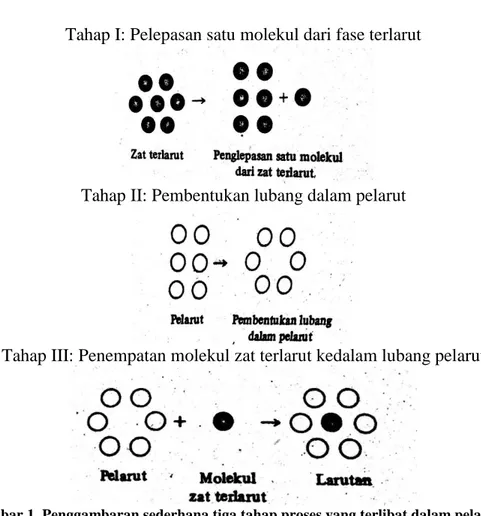
Proses pelarutan suatu bahan obat yang melibatkan interaksi solut-solut, solven-solven dan solut-solven dapat digambarkan menjadi tiga tahap (Martin dkk, 2009), tahap-tahap tersebut adalah sebagai berikut:
a. Tahap I : Pelepasan satu molekul dari fase terlarut
Tahap pertama menyangkut pemindahan satu molekul dari fase terlarut pada temperatur tertentu. Proses pelepasan ini melibatkan energi sebesar 2W22 untuk memecah ikatan antar molekul yang berdekatan dalam kristal. Di mana angka 22 adalah interaksi antara molekul zat terlarut. Pada saat satu molekul melepaskan diri dari zat terlarut, lubang yang
ditinggalkannya tertutup dan setengah dari energi yang diterima kembali. Penerimaan energi potensial untuk proses ini adalah W22..
b. Tahap II: Pembentukan lubang dalam pelarut
Tahap kedua menyangkut pembentukan lubang dalam pelarut yang cukup besar untuk menerima molekul zat terlarut. Energi yang dibutuhkan untuk tahap ini adalah W11 dimana angka tersebut adalah energi interaksi antara molekul pelarut.
c. Tahap III: Penempatan molekul zat terlarut ke dalam lubang pelarut Molekul zat terlarut akhirnya ditempatkan dalam lubang dalam pelarut, dan pertambahan kerja atau penurunan energi potensial dalam langkah ini adalah –W12. Lubang dalam pelarut yang terbentuk sekarang tertutup dan terjadi penurunan energi potensial sebesar –W12. Sehingga tahap ketiga ini melibatkan energi sebesar –2W12. Angka 12 adalah energi interaksi zat terlarut dengan pelarut. Secara keseluruhan, energi (W) yang dibutuhkan untuk semua tahapan proses tersebut dapat dibuat persamaan (1) yaitu:
W= W22 + W11 –2W12 ...(1) dengan W22 adalah interaksi antara molekul zat terlarut, W11 adalah energi interaksi antara molekul pelarut dan W12 adalah energi interaksi zat terlarut dengan pelarut. Semakin besar W atau selisih energi yang dibutuhkan pada tahap I dan II dengan energi yang dilepaskan pada tahap III, maka akan semakin kecil kelarutan zat. Ketiga tahap proses tersebut secara sederhana dapat dilihat pada gambar 1.
Jika suatu solut dilarutkan dalam zat cair, ada dua kemungkinan larutan yang dapat terjadi, yaitu: larutan ideal dan non ideal. Larutan ideal adalah larutan yang interaksi solut-solut, solut-solven, dan solven-solven sama besar, sehingga pada proses pelarutannya tidak mengabsorbsi atau pun melepaskan energi yang berupa kalor. Sebaliknya larutan non ideal memerlukan dan menyerap energi kalor dari atau keluar sistem (Martin dkk., 2009).
Tahap I: Pelepasan satu molekul dari fase terlarut
Tahap II: Pembentukan lubang dalam pelarut
Tahap III: Penempatan molekul zat terlarut kedalam lubang pelarut
Gambar 1.Penggambaran sederhana tiga tahap proses yang terlibat dalam pelarutan (Martin dkk., 2009)
Jenis-jenis solven (pelarut) yang biasanya digunakan untuk melarutkan obat antara lain:
a. Pelarut polar
Kelarutan obat sebagian besar disebabkan oleh polaritas dari pelarut, yaitu oleh dipol momennya. Pelarut polar melarutkan zat terlarut ionik dan zat polar lain. Hildebrand telah membuktikan bahwa pertimbangan tentang dipol momen saja tidak cukup untuk menerangkan kelarutan zat polar dalam air. Kemampuan zat terlarut membentuk ikatan hidrogen lebih merupakan faktor yang jauh lebih berpengaruh dibandingkan polaritas yang direfleksikan dalam dipol momen yang tinggi. Air melarutkan fenol, alkohol, aldehid, keton, amina dan senyawa lain yang mengandung oksigen dan nitrogen, yang dapat membentuk ikatan hidrogen di dalam air. Perbedaan sifat keasaman dan kebasaan dari konstituen dalam hal donor akseptor elektron Lewis juga memberikan andil untuk interaksi spesifik dalam larutan (Martin dkk., 2009).
b. Pelarut nonpolar
Aksi pelarut dari cairan nonpolar, seperti hidrokarbon, berbeda dengan zat polar. Pelarut nonpolar tidak dapat mengurangi gaya tarik menerik antar ion-ion elektrolit kuat dan lemah, karena tetapan dielektrik pelarut yang rendah. Pelarut juga tidak dapat memecahkan ikatan kovalen dan elektrolit yang berionisasi lemah karena pelarut nonpolar termasuk dalam golongan pelarut aprotik, dan tidak dapat membentuk jembatan hidrogen dengan nonelektrolit. Oleh karena itu zat terlarut ionik dan polar tidak larut atau hanya dapat larut sedikit dalam pelarut nonpolar (Martin dkk., 2009).
c. Pelarut semi polar
Pelarut semi polar seperti keton dan aklohol dapat menginduksi suatu derajat polaritas tertentu dalam molekul pelarut nonpolar, sehingga dapat larut dalam alkohol. Kenyataannya, senyawa semi polar dapat bertindak sebagai pelarut perantara yang dapat menyebabkan bercampurnya cairan polar dan non polar (Martin dkk., 2009).
Kelarutan suatu obat pada umumnya dapat diperkirakan hanya dalam cara kualitatif, setelah mempertimbangkan hal-hal seperti polaritas, tetapan dielektrik, asosiasi, solvasi, tekanan dalam, reaksi asam basa, dan faktor-faktor lainnya. Singkatnya, kelarutan bergantung pada pengaruh kimia, listrik, struktur yang menyebabkan interaksi timbal balik antara zat terlarut dan pelarut. Peningkatan kelarutan senyawa yang sukar larut dapat dilakukan dengan penambahan kosolven, pengaturan pH larutan, pembentukan kompleks, modivikasi kristal, penambahan surfaktan dan pembentukan prodrug (Martin dkk., 2009). Sistem hidrotropik yang memiliki mekanisme mirip dengan surfaktan dan bahan pembentuk kompleks dapat digunakan untuk menurunkan W11 atau untuk meningkatkan W12 sehingga solut menjadi lebih mudah terlarut dalam solven (Yalkowsky, 1993).
2. Hidrotropik
Hidrotropik merupakan metode pelarutan yang unik dimana senyawa kimia tertentu yang disebut sebagai agen hidrotrop digunakan untuk meningkatkan kelarutan obat sukar larut dalam air. Mekanisme bagaimana terjadinya efek ini sampai saat ini belum terpecahkan sepenuhnya, bebarapa peneliti berpendapat
bahwa hidrotropik hanyalah tipe lain dari solubilisasi, dengan zat terlarut yang melarut dalam kumpulan-kumpulan terarah dari agen hidrotrop. Peneliti lain merasa bahwa fenomena ini berkaitan dengan pembentukan struktur molekul dalam bentuk kompleks yang didorong oleh interaksi lemah antara agen hidrotrop dan zat terlarut pada konsentrasi kritis (Dharmendira dkk., 2000).
Sistem hidrotropik memiliki kelebihan dari teknik peningkatan kelarutan yang lainnya karena memiliki selektivitas tinggi dan tidak memerlukan modifikasi kimia obat hidrofobik. Sistem hidrotropik hanya membutuhkan pencampuran obat dengan agen hidrotrop dalam air dan tidak menggunakan pelarut organik. Dengan demikian sistem hidrotropik dapat menghindari masalah toksisitas residual, kesalahan karena volatilitas, polusi, biaya dan sebagainya (Jayakumar dkk., 2014). Berdasarkan penelitian terdahulu, beberapa senyawa yang telah ditingkatkan dengan sistem hidrotropik diantaranya: halofantrin (Nwodo dkk., 2013) griseovulfin (Shete dkk., 2010), asam salisilat (Aditya dkk., 2013) cefixime (Maheshwari, 2005), frusemide (Maheshwari, 2005), ketoprofen (Maheshwari, 2006). Belum ada penelitian tentang peningkatan kelarutan PGV-0 dengan menggunakan metode hidrotropik.
3. Agen hidrotrop
Agen hidrotrop secara umum adalah senyawa larut dalam air yang biasanya berupa garam organik ampifilik. Komponen ampifilik pada agen hidrotrop berupa alkali rantai pendek yang larut dalam air, yang dihasilkan dari sulfonasi hidrokarbon aromatik. Agen hidrotrop memiliki dua gugus yakni gugus hidrofob
dan hidrofil. Bagian dari agen hidrotrop yang bersifat hidrofob adalah benzene tersubtitusi yang bersifat non polar. Sementara bagian hidrofil yang bersifat polar adalah gugus sulfonat anionik yang terikat pada ion-ion seperti natrium, amonium, kalsium dan kalium (Kurniasari, 2012).
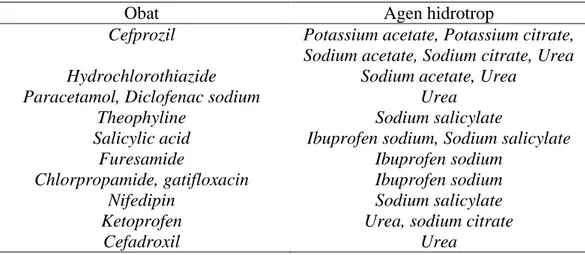
Agen hidrotrop telah banyak digunakan dalam solubilisasi obat, formulasi deterjen, perawatan kesehatan dan aplikasi rumah tangga serta menjadi agen ekstraksi untuk wewangian (Gaspar, 2000). Beberapa contoh agen hidrotrop yang sering digunakan untuk meningkatkan kelarutan obat yang sukar larut dapat dilihat pada tabel II (Maheshwari, 2007).
Agen hidrotrop dapat bekerja optimal ketika ditambahkan dalam konsentrasi kritis atau MHC (Minimum Hydrotrope Concentration). Konsentrasi kritis didefinisikan sebagai konsentrasi dimana molekul agen hidrotrop mulai beragregat, yaitu membentuk mikro baru peningkat kelarutan zat terlarut dalam air secara signifikan. Nilai MHC suatu agen hidrotrop diperkirakan sebesar 0,8 - 0,9 M (Jayakumar dkk., 2014).
Tabel II. Daftar obat dan agen hidrotrop yang digunakan dalam meningkatkan kelarutan
Obat Agen hidrotrop
Cefprozil Potassium acetate, Potassium citrate, Sodium acetate, Sodium citrate, Urea Hydrochlorothiazide Sodium acetate, Urea
Paracetamol, Diclofenac sodium Urea
Theophyline Sodium salicylate
Salicylic acid Ibuprofen sodium, Sodium salicylate
Furesamide Ibuprofen sodium
Chlorpropamide, gatifloxacin Ibuprofen sodium
Nifedipin Sodium salicylate
Ketoprofen Urea, sodium citrate
4. Natrium sitrat
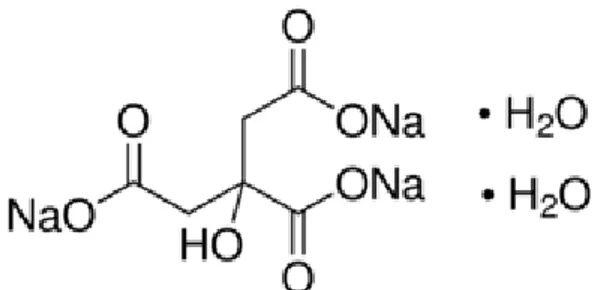
Gambar 2. Struktur kimia senyawa natrium sitrat (Depkes RI, 1995)
Natrium sitrat atau trinatrium 2-hidroksipropanan-1,2,3-trikarboksilat merupakan suatu serbuk kristal putih, tidak berbau, atau tidak berwarna. Senyawa ini memiliki rumus molekul C6H5Na3O7 dan struktur kimia yang digambarkan pada gambar 2 dengan bobot molekul 294,10 g/mol (Rowe, 2009). Natrium sitrat larut dalam 1 : 1,5 air, 1 : 0,6 air panas, dan sukar larut dalam etanol 95%. Natrium sitrat merupakan suatu bahan pengkompleks untuk besi dan kalsium dalam makanan serta dapat mencegah pembekuan darah. Natrium sitrat juga merupakan salah satu agen hidrotrop dalam sistem hidrotropik yang telah dilaporkan dapat meningkatkan kelarutan obat sukar larut melalui reaksi kompleksasi dengan interaksi lemah antara natrium sitrat dan obat yang sukar larut. Penelitian terdahulu telah membuktikan keberhasilan natrium sitrat sebagai peningkatan kelarutan griseofulvin (Shete dkk., 2010) asam salisilat (Aditiya dkk., 2013) halofantrin (Nwodo dkk., 2013). Belum ditemukan penelitian pengaruh sistem hidrotropik terhadap PGV-0. Oleh karena itu, penggunaan natrium sitrat sebagai agen hidrotrop diharapkan dapat meningkatkan kelarutan PGV-0.
5. Pentagamavunon-0 (PGV-0)
Pentagamavunon-0 (PGV-0) atau 2,5-bis-(4’-hidroksi-3’-metoksibenzilidin)-siklopentanon merupakan senyawa hasil modifikasi struktur kurkumin yang dilakukan untuk meningkatan efek farmakologinya serta menurunkan toksisitas dan efek sampingnya. Senyawa PGV-0 memiliki aktivitas antiinflamasi (telah dipatenkan oleh Fakultas Farmasi UGM, Nomor Paten: US 6.777.447 B2) yang bersifat non ulserogenik. Selain itu, PGV-0 telah diketahui mempunyai aktivitas antioksidan, antifungi, antibakteri, antiinflamasi, aktivitas sitotoksik dan analgetik (Wahyuni, 1998).
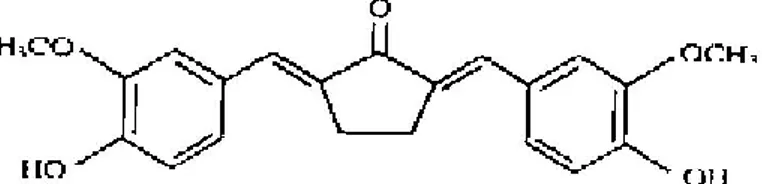
Gambar 3. Struktur kimia senyawa PGV-0 (Sardjiman, 2000).
Senyawa PGV-0 dengan struktur kimia yang dapat dilihat pada gambar 3, telah berhasil disintesis dari vanillin dan siklopentanon dengan katalis asam sulfat dengan proses reaksi yang sederhana, murah, dan cepat pada kondisi ruangan. Senyawa PGV-0 memiliki BM 352,13 g/mol dengan jarak lebur 212-214 0C (Sardjiman, 2000). Senyawa PGV-0 larut dalam metanol, etanol, dimetil sulfoksida (DMSO) dan etil asetat namun praktis tidak larut dalam air. Upaya peningkatkan kelarutan PGV-0 telah dilakukan dengan beberapa cara seperti pengaruh solven dan variasi pH (Maria, 2004), penggunaan kosolven kombinasi etanol-PEG 400 (Pratami, 2008), penambahan tween 80 (Tuloli, 2004), pembentukan kompleks
dengan maltodextrin (Siagian, 2008), β-siklodekstrin (Novidya, 2004), dan polivinilpirolidon (Fauzia, 2004) yang dapat meningkatkan kelarutan PGV-0. Belum ditemukan penelitian kelarutan PGV-0 dengan menggunakan sistem hidrotropik. Oleh karena itu, perlu dilakukan uji kelarutan untuk mengetahui pengaruhnya.
6. Termodinamika
Pengetahuan mengenai parameter termodinamika suatu proses pelarutan dapat membantu dalam memahami mekanisme interaksi yang terjadi pada proses tersebut (Bustamante dan Bustamante, 1996). Bila proses dalam kesetimbangan maka tetapan termodinamika dapat ditentukan (Suwaldi, 2016). Pelarutan PGV-0 merupakan proses kesetimbangan yang terjadi antara keadaan larut dan tidak larut, sehingga paremeter termodinamika proses pelarutan dapat dihitung.
Penentuan parameter termodinamika beda energi bebas (ΔF) dari proses pelarutan dapat dihitung dengan persamaan (2) (Martin dkk., 2009):
ΔF = RT ln X2 ...(2) dimana R, T dan X2 berturut-turut adalah tetapan gas yang besarnya 1,987 kal/mol derajat, suhu percobaan (K) dan fraksi mol solut. Beda entalpi (ΔH) dari proses pelarutan dapat dihitung dengan persamaan (3) (Martin dkk., 2009):
Log X2 = −𝛥𝐻
2,303 R 𝑥 ( 𝑇𝑜−𝑇)
To T ...(3)
dimana To adalah suhu mutlak (K). Beda entropi (ΔS) dari proses pelarutan dapat dihitung dengan persamaan (4) (Martin dkk., 2009):
ΔS = 𝛥𝐻− ΔG
F. Landasan Teori
Senyawa PGV-0 merupakan bahan obat yang memiliki aktivitas antiinflamasi tetapi bersifat praktis tidak larut dalam air, sehingga mengakibatkan laju disolusi dan ketersediaan hayatinya rendah. Akibatnya tidak dapat memberikan efek farmakologis yang diinginkan. Untuk itu, penelitian peningkatan kelarutan PGV-0 perlu dilakukan. Salah satu metode yang dapat digunakan adalah sistem hidrotropik. Metode tersebut memiliki keuntungan: sederhana (tidak memerlukan modifikasi kimia obat hidrofobik), aman (tidak menggunakan pelarut organik sehingga lebih ramah lingkungan) dan ekonomis. Dengan menggunakan agen hidrotrop yang sangat larut dalam air, memiliki permukaan aktif yang dapat meningkatkan kelarutan obat kurang larut atau bahkan tidak larut dalam air. Maka dari itu, perlu dilakukan penelitian pengaruh sistem hidrotropik terhadap kelarutan PGV-0.
Sistem hidrotropik dengan menggunakan natrium sitarat sebagai agen hidrotrop dapat meningkatkan kelarutan obat sukar larut dengan cara membentuk kompleks antara natrium sitrat dan obat sukar larut ketika ditambahkan agen hidrotrop pada konsentrasi kritis atau MHC (Minimum Hydrotrope Concentration). Konsentrasi kritis didefinisikan sebagai konsentrasi dimana molekul agen hidrotrop mulai beragregat, yaitu membentuk mikro baru peningkat kelarutan obat terlarut. Pada penambahan agen hidrotrop pada konsentrasi kritis dapat meningkatkan kelarutan obat sukar larut dalam air secara signifikan. Nilai konsentrasi kritis suatu agen hidrotrop diperkirakan sebesar 0,8 - 0,9 M. Maka dari itu, dilakukan uji kelarutan dengan menggunakan variasi konsentrasi pelarut larutan natrium sitrat
disekitar konsentrasi kritis tersebut untuk mampu meningkatkan kelarutan PGV-0 dalam air.
Kelarutan juga dipengaruhi oleh suhu percobaan. Kenaikan suhu percobaan akan meningkatkan energi kinetik molekul obat dan tetapan difusi, sehingga dapat mempercepat reaksi pelarutan obat dan meningkatkan kelarutan obat. Peningkatan kelarutan PGV-0 ditandai dengan meningkatnya konsentrasi PGV-0 terlarut dalam berbagai pelarut pada suhu percobaan yang semakin meningkat. Oleh karena itu, akan diteiti juga pengaruh variasi suhu percobaan dalam sistem hidrotropik terhadap kelarutan PGV-0.
G. Hipotesis
Berdasarkan pada rumusan masalah, maka dapat dirumuskan hipotesis yang akan diuji keluarannya yaitu:
1. Sistem hidrotropik dapat meningkatkan kelarutan PGV-0 (salting in) dengan natrium sitrat sebagai agen hidrotrop.
2. Penambahan berbagai konsentrasi pelarut larutan natrium sitrat dapat meningkatkan kelarutan PGV-0 dalam sistem hidrotropik.
3. Peningkatan suhu percobaan dapat meningkatkan kelarutan PGV-0 dalam sistem hidrotropik.