BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Morfologi rumput laut Gracilaria sp. tidak memiliki perbedaan antara akar, batang dan daun. Tanaman ini berbentuk batang yang disebut talus dengan berbagai bentuk percabangannya. Secara alami, Gracilaria sp. hidup dengan melekatkan holdfast pada substrat yang berupa pasir, lumpur, karang, kulit kerang, karang mati, batu maupun kayu, pada kedalaman sekitar 10 sampai 15 meter di bawah permukaan air (Angkasa, dkk., 2011).
Ciri-ciri dari Gracilaria verrucosa, yaitu talus silindris, licin dan berwarna kuning coklat atau kuning hijau. Percabangan berseling tidak beraturan, memusat ke arah pangkal. Cabang lateral memanjang menyerupai rambut, ukuran panjang sekitar 25 cm dengan diameter talus 0,5 - 1,5 mm (Anggadiredja, dkk., 2006).
2.1.1 Habitat dan Sebaran Rumput Laut
Rumput laut jenis Gracilaria sp. juga sudah dibudidayakan di beberapa daerah, seperti di sepanjang Pantai Utara Jawa, antara lain daerah Serang, Bekasi, Karawang, Indramayu, Brebes, Tegal, Pemalang, Jepara dan Lamongan. Di daerah Nusa Tenggara Barat, antara lain Sekotong, Lombok Barat dan Teluk Cempi, serta Dompu. Di daerah Sulawesi Selatan meliputi Jeneponto, Takalar, Maros, Bulukumba, Sinjai, Bone, Wajo dan Palopo. Selain itu, di daerah Lampung juga telah banyak dibudidayakan. Jenis Gracilaria yang telah dibudidayakan, antara lain Gracilaria verrucosa, Gracilaria chilensis, Gracilaria gigas dan Gracilaria lichenoides (Murdinah, 2012).
2.1.2 Perkembangbiakan Rumput Laut
Perkembangbiakan rumput laut dapat terjadi melalui dua cara, yaitu secara vegetatif dengan talus dan secara generatif dengan talus diploid yang menghasilkan spora. Perbanyakan secara vegetatif dikembangkan dengan cara stek, yaitu potongan talus yang kemudian tumbuh menjadi tanaman baru. Sementara, perbanyakan secara generatif dikembangkan melalui spora, baik alamiah maupun melalui budidaya. Pertemuan dua gamet membentuk zigot yang selanjutnya berkembang melalui pembelahan dalam sporogenesis menjadi gametofit (Anggadiredja, dkk., 2006).
Sifat-sifat oseanografi, seperti sifat kimia-fisika air dan substrat, macamnya substrat serta dinamika/pergerakan air, merupakan faktor-faktor yang sangat menentukan pertumbuhan Gracilaria sp. (Angkasa, dkk., 2011).
2.1.3 Sistematika Tumbuhan
a. Divisi : Rhodophyta b. Kelas : Florideophyceae c. Bangsa : Gracialariales d. Suku : Gracilariaceae e. Marga : Gracilaria
f. Jenis : Gracilaria verrucosa (Hudson) Papenfus 2.1.4 Nama Daerah
Gracilaria verrucosa dikenal dengan nama daerah bulung rambu (Bali) atau sango-sango (Sulawesi) (Anggadiredja, dkk., 2006).
2.2 Kandungan Kimia
Rumput laut Gracilaria verrucosa menghasilkan metabolit primer senyawa hidrokoloid yang disebut agar. Jenis rumput laut yang termasuk dalam kelas Rhodophyceae (alga merah) mengandung pigmen antara lain adalah klorofil a, klorofil d, α dan β karoten, lutein, zeaxanthin, fikosianin, dan fikoeritrin. Fikoeritrin merupakan pigmen yang dominan yang menyebabkan warna merah (Anggadiredja, dkk., 2006).
2.3 Agar
2.3.1 Struktur Agar
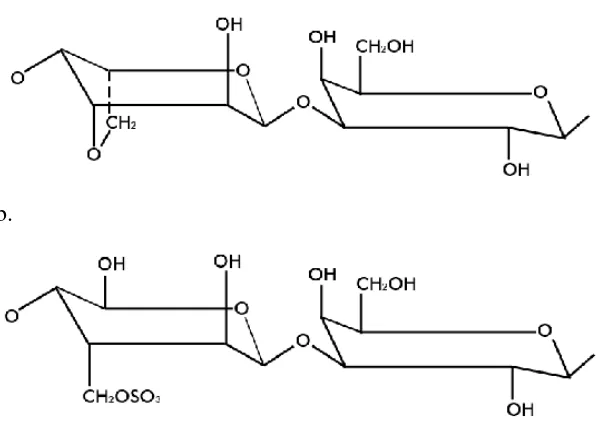
Agar terdiri atas dua fraksi polimer yaitu agarosa dan agaropektin. Fraksi agarosa merupakan polimer netral bebas sulfat mampu membentuk gel. Agarosa terdiri atas rantai D-galaktosa yang berikatan secara posisi α-1,4 dan posisi 3,6-anhidro-L-galaktosa dan rantai D-galaktosa yang berikatan secara β-1,4 dengan rantai 3,6-anhidro-L-galaktosa. Sementara itu, fraksi agaropektin merupakan polimer bermuatan mengandung sulfat sekitar 3-10% dan tidak mempunyai kemampuan untuk membentuk gel (Glicksman, 1983).
Struktur kedua jenis galaktan penyusun agar menurut ini diilustrasikan pada Gambar 2.1 berikut (Winarno, 1990):
a.
b.
Gambar 2.1. Struktur galaktan penyusun agar
Keterangan:
2.3.2 Sifat Fisiko-Kimia Agar
Sifat fisika dari agar yaitu tidak berbau atau berbau lemah, tidak berwarna sampai kuning pucat, bening. Agar dapat berbentuk gumpalan potongan memanjang dengan lebar 2 mm sampai 5 mm, kadang-kadang dalam bentuk kepingan, agak liat dan sukar dipatahkan (Depkes RI, 1995).
Agar tidak larut dalam air dingin, tetapi larut dalam air panas. Pada temperatur 32º-39° C berbentuk bekuan (solid) dan tidak mencair pada suhu di bawah 85º C (Aslan, 1998).
Agar sangat stabil dalam keadaan kering, tetapi pada suhu tinggi dan pH rendah agar akan mengalami degradasi yaitu pecahnya polimer galaktosa menjadi monomer yang sederhana (Winarno, 1990).
2.4 Tumbuhan Penghasil Agar
Agarophyte adalah kelompok rumput laut yang dapat digunakan sebagai bahan-bahan baku pembuatan agar. Sedangkan Agaroidophyte merupakan kelompok ganggang merah yang memproduksi senyawa yang mempunyai sifat seperti agar, tetapi dengan daya gelasi dan viskositas yang berbeda. Dari kelompok Agarophyte yang terkenal adalah spesies dari genus Gracilaria, Pterocladia sp., spesies Acanthopeltis japonica dan Ahnfeltia plicata (Aslan, 1998).
murah harganya, jenis rambukasang mampu menghasilkan agar tiga kali lipat dari jenis lainnya (Winarno, 1990).
Berbagai negara memiliki sumber rumput laut yang berbeda bagi produksi agar. Di Jepang, rumput laut utama yang digunakan dalam produksi agar adalah Gelidium amansii yang mengandung rendemen agar 25-30% dari berat kering. Di Amerika Serikat, untuk produksi agar digunakan ganggang Gelidium cartilaginerum sebagai bahan baku. Sedangkan di Filipina, agar-agar untuk makanan diproduksi dari Gracilaria verrucosa. Walaupun demikian, biasanya dalam produksi agar, ganggang yang digunakan tidak hanya ganggang sejenis, tetapi merupakan campuran dari beberapa jenis ganggang. Campuran yang biasanya dilakukan di Jepang dengan mutu produk yang baik adalah Gelidium amansii (45%), Gelidium japanicum (10%), Acanthopeltis (5%), Campylaephora (10 %), Gracilaria (15 %), Ceramium (5 %) dan Gelidium sp. (10%) (Winarno, 1990).
2.5 Penggunaan Agar
pangan dan sisanya 20% pada bidang non-pangan termasuk aplikasi yang berkaitan dengan farmasi dan bioteknologi (Armisen & Galatas, 2000).
Dalam industri pangan, agar digunakan sebagai bahan pengental pada industri es krim, jeli, permen dan pastry. Agar juga digunakan dalam pembuatan shorbat, es krim, dan keju untuk pembentukan emulsi/stabilizer. Di Jepang, agar digunakan sebagai fortifikasi untuk serat pangan sehingga lebih menguntungkan bagi kesehatan. Agar juga digunakan sebagai penjernih pada berbagai industri minuman seperti bir, anggur, kopi dan sebagai penstabil pada minuman cokelat. Pada konsentrasi 0,1-1%, agar biasa digunakan sebagai penstabil pada yoghurt, keju, permen dan produk bakery (Murdinah, dkk., 2012).
Pemanfaatan agar dalam industri nonpangan, antara lain untuk kebutuhan industri farmasi sebagai obat pencahar, pembungkus kapsul untuk antibiotik dan vitamin, atau campuran bahan pencetak contoh gigi. Dalam industri kosmetik agar dimanfaatkan dalam pembuatan krem, lotion, lipstik dan sabun. Pada industri tekstil, agar bermutu tinggi digunakan untuk melindungi kemilau sutera. Sementara pada industri kulit, agar berguna sebagai pengilap permukaan yang halus dan kekakuan kulit sebagai campuran pembuatan pelekat kayu lapis. Agar juga dimanfaatkan dalam pembuatan pelat film, pasta gigi, semir sepatu dan kertas. Selain dimanfaatkan pada industri-industri tersebut, agar juga bermanfaat dalam bidang bioteknologi dan mikrobiologi (Murdinah, dkk., 2012).
pada proses pemurnian dan isolasi protein. Agarosa merupakan matriks yang idela bagi difusi dan pergerakan elektrokinetik biopolimer, dan gelnya merupakan medium antikonveksi, yang secara biologi stabil dengan sifat ionik yang terkontrol (Murdinah, dkk., 2012).
Dalam dunia kromatografi, kolom yang berisi partikel gel agarosa sudah diproduksi komersial dan dipasarkan dengan merek dagang Sepharose (dari Pharmacia) dan Bio-Gel A (Bio-Rad). Agarosa tersebut telah digunakan secara luas sebagai media untuk pemisahan berat molekul dengan berat lebih dari 250.000 DA atau disebut kromatografi eksklusi dan untuk pemisahan campuran protein, virus dan ribosom (Murdinah, dkk., 2012).
Dalam bidang mikrobiologi, agar digunakan dalam bentuk bakto agar. Bakto agar merupakan agar yang telah dimurnikan dengan mereduksi kandungan pigmen, pengotor dan kandungan bahan-bahan asing (organik dan anorganik) serendah mungkin sehingga dapat mendukung pertumbuhan mikroba secara umum (Abdullah, 2004).
2.6 Cara Ekstraksi Agar di Berbagai Negara
Cara ekstraksi agar yang dilakukan berbeda-beda di berbagai negara yaitu: a. Di negara Selandia Baru
Ekstraksi agar dilakukan selama 4 jam pada suhu 95-100° C dan perendaman dilakukan selama 1 jam pada suhu 20-24°C dalam asam asetat 0,2% (Winarno, 1990).
b. Di negara Australia
Ekstraksi agar dilakukan selama 2-4 jam menggunakan larutan asam fosfat dengan pH 5 (Winarno, 1990).
c. Di negara Amerika Serikat
Ekstraksi agar dilakukan selama 6 jam menggunakan larutan asam fosfat dengan pH 6-8 (Winarno, 1990).
d. Di negara Filipina
Ekstraksi agar dilakukan selama 4 jam menggunakan air suling dan asam sulfat (Trono dan Fortes, 1988).
2.7 Sterilisasi
Sterilisasi merupakan suatu proses yang dilakukan untuk tujuan membunuh atau menghilangkan mikroorganisme yang tidak diinginkan pada suatu objek atau spesimen.
Cara-cara sterilisasi yaitu (Beisher, 1991): a. Sterilisasi dengan bahan kimia
b. Sterilisasi kering
Digunakan untuk alat-alat gelas misalnya cawan petri, tabung reaksi. Cara ini cocok untuk alat-alat gelas karena tidak ada pengembunan dan tetes air. c. Sterilisasi basah
Biasanya menggunakan uap panas bertekanan dalam autoklaf. Media biakan, larutan dan kapas dapat disterilkan dengan cara ini. Autoklaf merupakan suatu alat pemanas bertekanan tinggi, dengan meningkatnya suhu air maka tekanan udara akan bertambah dalam autoklaf yang tertutup rapat. Sejalan dengan meningkatnya tekanan di atas tekanan udara normal, titik didih air meningkat. Biasanya pemanasan autoklaf berada pada suhu 121° C selama 15 menit.
d. Filtrasi bakteri
Digunakan untuk mensterilkan bahan-bahan yang terurai atau tidak tahan panas. Metode ini didasarkan pada proses mekanik yaitu menyaring semua bakteri dari bahan dengan melewatkan larutan tersebut melalui lubang saringan yang sangat kecil.
e. Incenerasi
Sterilisasi dengan pemanasan atau pembakaran pada api langsung. Misalnya untuk sterilisasi jarum ose dan pinset.
2.8 Bakteri
mikroorganisme yang bersel satu, berbiak dengan pembelahan diri, serta demikian kecilnya sehingga hanya tampak dengan mikroskop (Dwidjoseputro, 1987).
Pertumbuhan dan perkembangan bakteri dipengaruhi oleh (Pratiwi ,2008): a. Temperatur
Pertumbuhan bakteri sangat dipengaruhi oleh temperatur. Setiap mikroorganisme mempunyai temperatur optimum yaitu temperatur di mana terjadi kecepatan pertumbuhan optimal dan dihasilkan jumlah sel yang maksimal. Temperatur yang terlalu tinggi dapat menyebabkan denaturasi protein sedangkan temperatur yang sangat rendah aktivitas enzim akan terhenti. Berdasarkan batas temperatur dibagi atas tiga golongan:
- Psikrofil, tumbuh pada temperatur -5 sampai 30oC dengan optimum 1 sampai 20o
- Mesofil, tumbuh pada temperatur 10 sampai 45 C.
o
C dengan optimum 20 sampai 40o
- Termofil, tumbuh pada termperatur 25 sampai 80 C.
pH optimum bagi kebanyakan bakteri terletak antara 6,5 dan 7,5. Namun ada beberapa mikroorganisme yang dapat tumbuh pada keadaan yang sangat asam atau alkali (Pelczar dan Chan, 2006).
c. Tekanan osmosis
baik untuk pertumbuhan sel adalah medium isotonis terhadap sel tersebut. Dalam larutan hipotonik air akan masuk ke dalam sel sehingga menyebabkan sel membengkak, sedangkan dalam larutan hipertonik air akan keluar dari sel sehingga membran plasma mengerut dan lepas dari dinding sel (plasmolisis) (Pratiwi, 2008; Lay, 1996).
d. Oksigen
Berdasarkan kebutuhan oksigen di kenal mikroorganisme di bagi menjadi 5 golongan yaitu (Pratiwi, 2008):
- Anaerob obligat, hidup tanpa oksigen, oksigen toksik terhadap golongan ini.
- Anaerob aerotoleran, tidak mati dengan adanya oksigen.
- Anaerob fakultatif, mampu tumbuh baik dalam suasana dengan atau tanpa oksigen.
- Aerob obligat, tumbuh subur bila ada oksigen dalam jumlah besar. - Mikroaerofilik, hanya tumbuh baik dalam tekanan oksigen yang
rendah. e. Nutrisi
Nutrisi merupakan substansi yang diperlukan untuk biosintesis dan pembentukan energi. Berdasarkan kebutuhannya, nutrisi dibedakan menjadi dua yaitu makroelemen (elemen yang diperlukan dalam jumlah banyak) dan mikroelemen (trace element yaitu elemen nutrisi yang diperlukan dalam jumlah sedikit) (Pratiwi, 2008).
2.8.1 Morfologi Bakteri
a. Golongan basil
Golongan basil berbentuk serupa tongkat pendek, silindris. Basil dapat bergandengan dua-dua, atau terlepas satu sama lain, yang bergandeng-gandengan panjang disebut streptobasil, yang dua-dua disebut diplobasil. b. Bentuk kokus
Golongan kokus merupakan bakteri yang bentuknya serupa bola-bola kecil. Golongan ini tidak sebanyak golongan basil. Kokus ada yang bergandeng-gandengan panjang serupa tali leher, disebut streptokokus, ada yang bergandengan dua-dua, disebut diplokokus, ada yang mengelompok berempat, disebut tetrakokus, kokus yang mengelompok serupa kubus disebut sarsina.
c. Golongan spiril
Golongan spiril merupakan bakteri yang bengkok atau berbengkok-bengkok serupa spiral. Bakteri ini tidak banyak terdapat, karena itu merupakan golongan yang paling kecil, jika dibandingkan dengan golongan kokus maupun golongan basil.
2.8.2 Bakteri Staphylococcus aureus
Sistematika bakteri Staphylococcus aureus menurut Bergey edisi ke-7 (Dwidjoseput ro, 1987) adalah sebagai berikut:
Staphylococcus aureus merupakan bakteri gram positif, aerob atau anaerob fakultatif berbentuk bola atau kokus berkelompok tidak teratur, diameter 0,8 – 1,0 μm, tidak membentuk spora dan tifak bergerak, koloni berwarna kuning. Bakteri ini tumbuh cepat pada suhu 370C tetapi paling baik membentuk pigmen pada suhu 20-250
2.8.3 Bakteri Escherichia coli
C. koloni pada pembenihan padat berbentuk bulat halus, menonjol dan berkilau membentuk berbagai pigmen. Bakteri ini terdapat pada kulit, selaput lendir, bisul dan luka. Dapat menimbulkan penyakit melalui kemampuannya berkembang biak dan menyebar luas dalam jaringan (Jawetz, 2001).
Sistematika bakteri Escherichia coli menurut Bergey edisi ke-7 (Dwidjoseputro, 1987) adalah sebagai berikut :
a. Divisi : Protophyta b. Kelas : Schizomycetes c. Bangsa : Eubacteriales d. Suku : Enterobacteriaceae e. Marga : Escherichia
f. Jenis : Escherichia coli
sebagai flora normal. Bakteri ini dapat menjadi patogen bila berada diluar usus atau dilokasi lain dimana flora normal jarang terdapat (Jawetz, 2001).
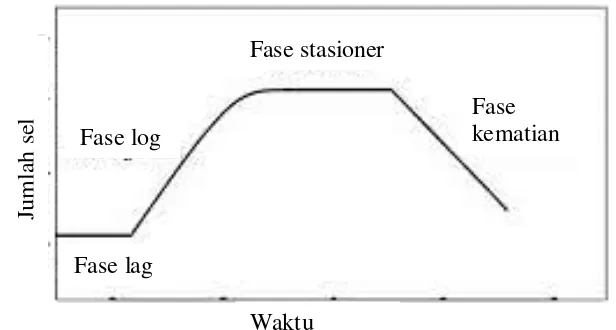
2.8.4 Fase Pertumbuhan Bakteri
Bakteri mengalami pertumbuhan yang dapat dibagi dalam 4 fase menurut (Pratiwi, 2008; Dwidjoseputro, 1998) yaitu:
1. Fase lag
Pada saat dipindahkan ke media yang baru, bakteri tidak langsung tumbuh dan membelah, meskipun kondisi media sangat mendukung untuk pertumbuhan. Bakteri biasanya akan mengalami masa penyesuaian untuk menyeimbangkan pertumbuhan.
2. Fase log
Selama fase ini, populasi meningkat dua kali pada interval waktu yang teratur. Jumlah koloni bakteri akan terus bertambah seiring lajunya aktivitas metabolisme sel.
3. Fase tetap
Pada fase ini terjadi kompetisi antara bakteri untuk memperoleh nutrisi dari media untuk tetap hidup. Sebagian bakteri mati sedangkan yang lain tumbuh dan membelah sehingga jumlah sel bakteri yang hidup menjadi tetap.
4. Fase kematian
Gambar 2.2. Kurva Fase Pertumbuhan Bakteri 2.8.5 Media Pertumbuhan Bakteri
Media biakan dapat dikelompokkan dalam beberapa kategori, yaitu: a. Berdasarkan asalnya, media dibagi atas:
1) Media sintetik
Media yang kandungan dan isi bahan yang ditambahkan diketahui secara terperinci. Contoh: glukosa, kalium fosfat, magnesium fosfat.
2) Media non-sintetik
Media yang kandungan dan isinya tidak diketahui secara terperinci dan menggunakan bahan yang terdapat di alam. Contohnya: ekstrak daging, pepton (Lay, 1996).
b. Berdasarkan kegunaannya, dapat dibedakan menjadi: 1) Media selektif
2) Media diferensial
Media ini digunakan untuk menyeleksi suatu mikroorganisme dari berbagai jenis dalam suatu lempengan agar.
3) Media diperkaya
Media ini digunakan untuk menumbuhkan mikroorganisme yang diperoleh dari lingkungan alami karena jumlah mikroorganisme yang ada terdapat dalam jumlah sedikit (Irianto, 2006).
c. Berdasarkan konsistensinya, dibagi atas (Irianto, 2006): 1) Media padat/ solid
2) Media semi solid 3) Media cair
2.8.6 Metode Isolasi Biakan Bakteri a. Cara gores
Ose yang telah steril dicelupkan ke dalam suspensi mikroorganisme yang diencerkan, lalu dibuat serangkaian goresan sejajar yang tidak saling menutupi di atas permukaan agar yang telah padat.
b. Cara sebar
Suspensi mikroorganisme yang telah diencerkan diinokulasikan secara merata dengan menggunakan hockey stick pada permukaan media padat. c. Cara tuang
2.8.7 Pewarnaan Gram
Mikroorganisme dapat dilihat dengan mikroskop biasa, tanpa diwarnai; yakni dengan cara-cara khusus misalnya menggunakan kondesor medan gelap. Tetapi pengamatan yang demikian lebih sulit dan tidak dapat dipakai untuk melihat bagian-bagian sel dengan seksama karena umumnya sel mikroorganisme bersifat transparan. Hal ini karena sitoplasma sel mikroba memiliki indeks bias yang hampir sama dengan indeks bias lingkungannya yang bersifat cair dan mikroba tidak mengabsorbsi atau membiaskan cahaya. Kontras antara sel dan latar belakangnya dapat diperjelas dengan cara mewarnai sel-sel mikroba tersebut dengan zat-zat warna (Waluyo, 2010).
Pewarnaan Gram memilahkan bakteri menjadi 2 kelompok, yakni bakteri Gram positif dan Gram negatif. Bakteri Gram positif berwarna ungu yang disebabkan kompleks warna kristal violet-iodium tetap dipertahankan meskipun diberi larutan pemucat. Sedangkan bakteri Gram negatif berwarna merah karena kompleks warna tersebut larut sewaktu pemberian larutan pemucat dan kemudian mengambil zat warna yang kedua yang berwarna merah. Perbedaan hasil dalam pewarnaan tersebut disebabkan perbedaan struktur, terutama dinding sel kedua kelompok bakteri tersebut. Karena kemampuannya membedakan suatu kelompok bakteri tertentu dengan kelompok lainnya, pewarnaan Gram juga disebut pewarnaan diferensial (Waluyo, 2010).
mencegah larutnya kompleks zat warna ungu kristal-iodium pada langkah pemucatan. Sedangkan bakteri Gram negatif memiliki kandungan lipid yang lebih tinggi pada dinding sel dan lipid tersebut dapat larut dalam alkohol dan aseton. Larutnya lipid oleh zat pemucat yang digunakan dalam pewarnaan Gram diduga memperbesar pori-pori dinding sel dan inilah penyebab proses pemucatan antara dinding sel Gram negatif lebih cepat (Waluyo, 2010).