SISTEM TERMODINAMIKA SEDERHANA RESUME
Disusun untuk memenuhi salah satu tugas mata kuliah Termodinamika, Dosen Pengampu :
Dr. Hj. Ade Yeti Nuryantini, S.Pd., M.MPd., M.Si
Disusun oleh :
Agung Santoso (1162070005)
Dewi Damayanti (1162070020) Hawinda Restu Putri (1162070033)
Iis Rahmawati (1162070034)
Kelompok 2/Semester 4A
PROGRAM STUDI PENDIDIKAN FISIKA JURUSAN PENDIDIKAN FISIKA IPA FAKULTAS TARBIYAH DAN KEGURUAN
PEMBAHASAN
SISTEM TERMODINAMIKA SEDERHANA A. Kesetimbangan Termodinamik
Kesetimbangan yaitu kondisi benda yang resultan gaya dan resultan momen gaya sama dengan 0, dengan syarat : ⃗F=0 ; ⃗F
Ydan ∑τ=0.
Termodinamika, yaitu menghubungkan sifat-sifat sistem satu dengan yang lain secara makro, yang memiliki tinjauan seperti pengaruh rata-rata oleh seluruh molekul yang dapat dirasakan oleh indra, terkait sifat, skala, dan besar sehingga dapat diukur (empiris) oleh alat ukur. Perubahan keadaan adalah jika sistem mengalami perubahan koordinat secara spontan atau karena ada pengaruh luar. Sistem terisolasi, bila sistem tidak dipengaruhi oleh sekelilingnya.
Lingkungan dapat memberikan gaya pada sistem atau sentuhan antara sistem dengan benda pada temperatur tertentu, jika keadaan sistem berubah maka akan terjadi interaksi antara sistem dengan lingkungan.
o Setimbang mekanis: bila tidak ada gaya yang takberimbang dibagian dalam sistem dan juga tidak ada antara sistem dengan lingkungan.
o Setimbang kimia: bila sistem yang ada dalam kesetimbangan mekanis tidak cenderung mengalami perubahan spontan dari stuktur internalnya, seperti reaksi kimia, atau perpindahan materi dari satu bagian sistem ke bagian lainnya seperti difusi, ataupun pelarutan.
o Kesetimbangan termal: terjadi bila tidak ada perubahan spontan dalam koordinat sistem yang ada dalam kesetimbangan mekanis dan kimia bila sistem itu dipisahkan dari lingkungannya oleh dinding diaterm.
Bila persyaratan untuk semua jenis kesetimbangan tercapai, maka sistem dikatakan setimbang termodinamika (dimana temperatur sama di semua titik).
Keadaan setimbang termodinamika dapat diperikan dengan memakai koordinat makroskopik yang tidak mengandung waktu yaitu memakai koordinat termodinamika.
Keadaan taksetimbang yaitu bila salah satu persyaratan dari tiga jenis kesetimbagan yang merupakan komponen dari kesetimbangan termodinamik tidak terpenuhi. Jadi jika ada gaya yang tak berimbang di bagian-dalam sistem atau antara sistem dengan lingkungan maka akan terjadi gejala seperti: percepatan, pusaran, gelombang, dll.
sejumlah besar momen massa yang kecil, dapat ditemukan koordinat termodinamik, untuk hampiran pemerian makroskopik pada masing-masing elemen, ada metode khusus untuk mengani sistem dalam mekanis dan termal, tetapi tidak dalam kesetimbanagn kimia.
Persamaan keadaan yaitu persamaan kesetimbangan yang menghubungkan koordinat termodinamik yang mencabut kebebasan salah satu koordinat antara:
1. Jika V dan θ dipilih, harga P pada kesetimbagan diperoleh secara alami. 2. Jika P dan θ dipilih sembarang, maka harga V, pada kesetimbangan tertentu
Di antara ketiga koordinat termodinamika P,V, dan θ hanya dua yang merupakan perubahan bebas. Persamaan keadaan mengungkapkan keistimewaan setiap sistem dibandingkan dengan sistem lainnya, sehingga harus ditentukan oleh percobaan atau teori molekul, akan tetapi persamaan ini bukan merupakan deduksi teoritis dari termodinamika, tetapi hasil percobaan yang ditambahkan pada termodinamika.
Misalkan : jika gas dalam keadaan silinder memuai dan mengakibatkan piston bergerak dipercepat, setiap saat gas akan memiliki volume dan temperatur tertentu, tetapi tekanan yang bersesuaian tidak dapat dihitung dari persamaan keadaan.Tekanan bukan koordinat termodinamik Karena tekanan tidak hanya bergantung pada kecepatan dan percepatan piston tetapi adapula yang memiliki variasi dari satu titik ke titik lainnya.
Sistem hidrostatik, jika sistem dengan massa tetap yang melakukan tekanan hidrostatik sama dengan lingkungannya, tanpa efek permukaan, gravitasi, listrik, dan magnetik. Sistem hidrostatik dibagi menjadi tiga kategori yakni:
1. Zat murni, yaitu zat yang hanya terdiri atas satu bahan kimia yang berbentuk padat, cair, gas, atau campuran, dari dua atau tiga bentuk tersebut;
2. Campuran serba sama dari bahan yang berbeda, seperti campuran gas lembam, campuran gas aktif kimiawi, campuran cairan atau larutan;
3. Campuran serba beda, seperti campuran beberapa macam gas yang bersentuhan dengan campuran beberapa macam cairan.
Percobaan menunjukan keasaan kesetimbangan, sistem hidrostatik dapat diperikan dengan tiga koordinat yaitu tekanan (P), yang ditimbulkan sistem pada lingkungan, volume (V), dan temperature ( θ¿ . Tekanan diukur dalam newton per meter kuadrat (pascal) dan volume dalam meter kubik; skala temperature yang paling mudah dipakai yaitu temperature gas ideal. Satuan tekanan yang lain yaitu pound per inci kuadrat, atmosfer, dan milimeter air raksa.
Jika 1 kg air dengan temperatur 98˚ C dimasukan kedalam bejana yang volumnya sekitar 2 meter kubik dan udaranya telah dikeluarkan semuanya, air akan menguap seluruhnya, dan sistem ada dalam kondisi yang disebut uap takjenuh dengan tekanan uap kurang dari pada tekanan atmosfer baku. Dalam diagram PV yang ditunjukan pada gambar, keadan ini digambaran dengan titik A. Jika selanjutnya uap dimampatkan secara perlahan dan secara isoterm tekanannya akan naik sampai mencapai titik jenuh pada titik B. Jika kemampetan itu diteruskan maka akan menjadi pengembunan dengan tekanan tetap (proses isobar) dengan syarat temperatur nya tetap. Daris lurus BC memperhatikan pengembunan isobar-isoterm dari uap air, tekanan tetap itu disebut dengan tekanan uap. Pada setiap titik antar B dan C air dan uap berada dalam kesetimbangan, sedangkan pada titik C hanya terdapat air dalam bentuk cairan yang disebut dengan cairan jenuh. Karena pertambahan tekanan yang besar diperlukan untuk memampatkan cairan, garis CD hampir vertikal. Pada setiap titik pada CD, air berada dalam fase cair, sedangkan pada setiap titik AB dalam fase uap, dan pada setiap titik BC terdpat kesetimbangan antara fase cair dan fase uap. ABCD
merupakan isoterm khas suatu zat murni pada diagram PV.
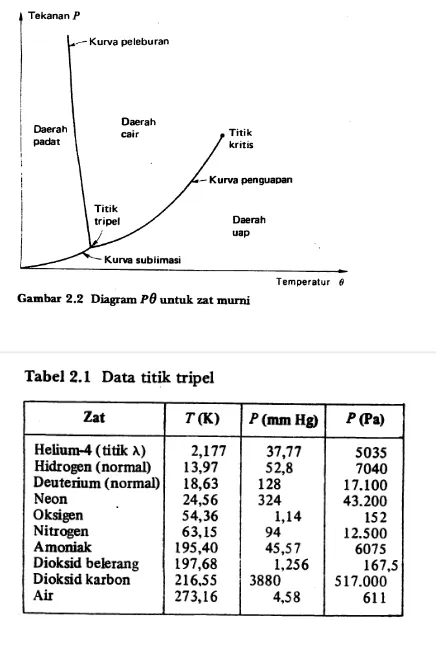
Diagram PV pada gambar diatas tidak memperlihatkan daerah temperatur rendah yang menggambarkan fase padat. Daerah padatan dan daerah kesetimbangan antara padat dan uap diperlihatkan oleh isoterm yang ciri umumnya sama seperti yang terdapat pda gambar diatas. Bagian datar salah satu isoterm ini menggambarkan peralihan dari padatan jenuh menuju uap jenuh atau dikenal dengan sebutan sumblimasi. Jelas bahwa ada garis serupa yang merupakan batas antara daerah cair-uap dan daerah padat-uap. Garis ini berkaitan dengan titik tripel.
C. Diagram Pθ Untuk Zat Murni
Jika tekanan uap suatu zat padat diukur pada berbagai temperatur hingga titik tripelnya tercapai dan tekanan zat cairnya diukur hingga titik kritisnya tercapai, lalu hasilnya dirajah pada diagram P , Titik yang menggambarkan keadaan berdampingan dariϑ
2. Cairan dan uapterletak pada kurva penguapan 3. Cairan dan padatan terletak pada kurva peleburam.
Khusus untuk air, kurva sublimasi disebut juga frost line, kurva penguapan disebut juga garis uap, dan kurva peleburan disebut juga guris es Kemiringan kurva sublimasi dan kurva penguapan untuk semua zat berharga positif. Namun kemiringan kurva peleburan dapat positif atau negatif. Untuk kebanyakan zat, kurva.
Dalam penelitian garis es dari air pada tekanan tinggi, Bridgman dan Tamman menemukan lima modifikasi baru dari es yang diberi tanda es II, III, V, VI, dan VII. Es biasa diberi tanda II Dua modifikasi lain dari es, IV dan VIII, ternyata tak mantap. Kondisi kesetimbangan di antara bentuk es dan cairan menghasilkan enam titik tripel lain yang bersama dengan titik tripel tekanan rendah disenarai- kan dalam tabel 2.2.
D. Permukaan PVθ
Semua informasi yang digambarkan dalam diagram PV dan Pθ dapat diperlihatkan pada satu diagram jika ketiga koordinat P,V, dan θ dimasukan pada sepanjang sumbu koordinat cartesius. Hasilnya disebut permukaan PV θ. Dua permukaan seperti itu ditunjukkan dalam gambar 2.3 dan 2.4 ; yang pertama untuk zat seperti H2O yang menyusut ketika mencair dan yang kedua zat seperti CO2 yang memuai ketika mencair.
E. Persamaan Keadaan
Terdapat lebih dari enam puluh persamaan keadaan untuk menggambarkan cairan, uap, dan cairan-uap, mulai dari persamaan gas ideal.
Pv=Rθ (2.1)
Pada tekanan rendah dalam daerah uap dan gas, hingga persamaan Beattie-Brigman:
P=Rθ(1−ϵ)
v2 (v+B)− A
v2 (2.2)
Dengan A=A0
(
1−av
)
B=B0(
1−b v
)
ϵ=c V θ3
Persaman terakhir ini mempunyai 5 tetapan yang dapat disesuaikan, dapat menggambarkan seluruh jangka titik tripel dengan kecermaytan tertentu.
Beberapa persaman dirumuskan secara empiris untuk menggambarkan sedekat mungkin harga
P, V dan θ yang terukur dan dirumuskan secara teoritis berdasarkan teori kinetik gas. Persamaan keadaan teoritis yang paling terkenal yakni persamaan keadaan Van der Waals:
(
P+ av2
)
(v−b)=Rθ (2.3)Persamaan ini berlaku dalam daerah cair, daerah uap, dan didekat serta di atas titik kritis. R
tetap, disebut tetapan gas sementara, v adalah volum molar, (V/n) dan n menyatakan banyaknya mol gas.
Jika V merupakan kuantitas geometris yang menyatakan volum ruang maka dV dapat dipakai untuk menyatakan bagian kecil ruang bersangkutan. V adalah koordinat makroskopik menyatakan volum materi, agar memiliki arti dV harus cukup besar sehingga mengandung jumlah molekul cukup banyak untuk menjamin boleh dipakainya pandangan makroskopik.Begitupula dengan P kecil dibandingkan dengan P sangat besar dibandingkan dengan fluktuasi molokuler, digambarkan oleh diferensial dP. Setiap infinitesimal dalam termodinamika harus memenuhi persyaratan bahwa ia menggambarkan perubahan kuantitas yang kecil terhadap kuantitasnya sendiri tetapi besar terhadap efek ditimbulkan oleh kelakuan beberapa molekul
Persamaan keadaan dapat dipecahakan untuk menyatakan setiap koordinatnya dalam dua koordinat lainnya, jadi
V=fungsi(θ , P)
Perubahan infitesimal keadaan setimbang ke keadaan lain, dV, d θ , dan dP . Suatu teorema dalam kalkulus diferensial parsial menuliskan
dV=
(
∂ V∂ θ
)
Pdθ+
(
∂V∂ p
)
θdP
Kuantitas yang disebut koefisien muai volum rata-rata, atau kemuaian volum, didefinisikan:
Muai volum rata-rata = perubahan volum per satuan volume
perubahan temperatur
Pada kondisi tekanan tetap perubahan temperatur dibuat sangat kecil maka perubahan volum juga menjadi sangat kecil maka kita akan mendapatkan kemuaian volume sesaat atau kemuaian volum, yang diberi tanda β jadi:
β=1
V
(
∂ V∂ θ
)
P(2.4)
Efek perubahan tekanan pada volum sistem hidrostatik bila temperatur dibuat tetap dinyatakan oleh kuantitas yang disebut ketermampatan isoterem dan dilambangkan oleh k (huruf Yunani kappa).
k=−1
V
(
∂V ∂ P)
θ(2.5) Dimensi ketermampatan adalah kebalikan tekanan yang dapat diukur dalam satuan
Jika persamaan keadaan dipecahkan untuk P, maka
Akhirnya, jika θ
dibayangkan sebagai fungsi dari
P
dan
V
dθ=
(
∂θ∂ P
)
V dP+(
∂θ ∂ v)
P dVJika dz suatu diferensial seksama dari suatu fungsi, katakanlah x dan y, maka dz dapat ditulis
dz=
(
∂ z∂ x
)
y dx+(
∂ z ∂ y)
x dySuatu infinitesimal yang bukan merupakan diferensial fungsi yang sebenarnya disebut diferensial taksaksama dan tidak dapat diungkapkan oleh jenis persamaan yang ditunjukan di atas.
G. Teorema Matematis
Dalam kalkulus diferensial parsial ada dua teorema sederhana yang dipakai. Andaikan ada hubungan antara ketiga koordinat x, y, z,
f(x , y , z)=0
Kemudian x dapat dinyatakan sebagai fungsi y dan z
dx=
(
∂ x∂ y
)
zdy+
(
∂ x∂ z
)
ydz
y dapat dinyatakan sebagai fungsi x dan z
dy=
(
∂ y∂ x
)
zdx+
(
∂ y∂ z
)
xdz
Dengan menyulihkan persamaan (2.13) ke dalam (2.12) diperoleh :
dx=
(
∂ x(
∂ xDalam hal sistem hidrostatik, teorema kedua menghasilkan :
(
∂ PKemudian volum β dan ketermampatan isotherm k didefinsikan sebagai
β=1
Sekarang perubahan tekanan infinitesimal dapat diungkapkan dalam kuantitas fisis ini, jadi
dP=
(
∂ Pi=¿
∫
θi
θf
β K d θ Pf−P¿
Jika perbedaan antara θi dan θf kecil dan diibaratkan keduanya tetap, maka
i=¿ β
K
(
θf−θi)
Pf−P¿ H. Kawat Teregang
Percobaan kawat teregang dilakukan dengan kondisi tekanan tetap pada tekanan atmosfer baku dan perubahan volumenya dapat diabaikan. Koordinat termodinamik dalam kawat teregang ini dinyatakan dalam tiga koordinat yaitu :
a. Gaya tegang kawat , dalam newton (N);Ɉ b. Panjang kawat L, dalam meter (m) c. Temperature gas ideal θ.
Keadaan setimbang termodinamika terhubungkan oleh persamaan keadaan yang biasanya tidak dapat diungkapkan oleh persamaan sederhan. Untuk kawat pada temperature tetap, dalam batas kelenturannya, hukum hooke berlaku,
yaitu ;
,dengan L0 = Panjang ketika gaya tegangannya nol
Jika suatu kawat mengalami perubahan infinitesimal dari keadaan setimbang ke keadaa setimbang lain, maka perubahan infinitesimal panang adalah diferensial daripada :
Dengan kedua diferensial itu sebagai fungsi θ dan . Diferensial ini berkaitan dengan kuantitas fisis yang penting. Kita definisikan kemuaian linear α sebagai
α=1
L
(
dL dθ)
Ɉ(2.9)
α hanya bergatung sedikit pada dan berubah terutama pada θ dan . Namun dalam jangkaɈ temperature yang kecil, kita boleh menganggapnya tetap. Α dinyatakan dalam kebalikan derajat
menurut definisi modulus Young isotherm, yang lambingnya Y
(2.10) Dengan, A = Luas penampang kawat
I. Selaput Permukaan
Penelitian selaput permukaan merupakan cabang kimia fisika yang menarik, terdapat 3 contoh penting dari selaput itu, seperti
2. Gelembung sabun, atau selaput sabun yang teregang pada suatu kerangka kawat, yang terjadi dari dua selaput permukaan dengan sedikit cairan di antaranya;
3. Selaput minyak tipis (kadang kadang monomolekul) pada permukaan air.
Selaput permukaan mirip dengan membran yang teregang. Permukaan di sebelah garis khayal yang menarik garis ini tegak lurus dengan gaya yang sama, tetapi berlawanan arah dengan yang ditimbulkan oleh permukaan di sebelah lain garis itu. Gaya yang beraksi tegak lurus persatuan panjang garis disebut tegangan permukaan.
Pemerian termodinamik yang memadai untuk selaput permukaan diberikan melalui perincian tiga koordinat, yaitu:
1. Tegangan permukaan , yang di ukur dalam N/m 2. Luas selaput A, diukur dalam m².
3. Temperatur gas ideal ϑ
Menangani selaput permukaan, cairan yang menyertainya harus selalu dianggap sebagai bagian dari sistem. Hal ini dapat dilakukan tanpa memasukan tekanan dan volum dari sistem gabungan, karena biasanya tekanan tetap dan perubahan volumnya dapat diabaikan. Permukaan cairan murni dalam kesetimbangan dengan uapnya memiliki persamaan keadaan yang sederhana. Untuk hampir semua cairan murni, persamaan keadaannya dapat ditulis sebagai berikut:
J. Sel Terbalikan
Sel terbalikkan terdiri atas dua elektrode yang masing-masing dibenamkan dalam elektrolit yang berbeda. Elektromotansinya bergantung pada sifat bahan, konsentrasi elektrolit, dan temperatur.
seng sulfat terbentuk, tembaga diendapkan, dan tembaga sulfatnya terpakai. Perubahan ini diungkapkan oleh reaksi kimia
Zn + CuSO4 Cu + ZnSO4
Bila muatan positif dipindahkan dalam arah yang berlawanan, yaitu secara eksternal dari seng ke tembaga, reaksi ini berlangsung dalam arah sebaliknya,
Cu + ZnSO4 Zn + CuSO4
Sifat penting sel terbalikkan ialah bahwa perubahan kimia yang menyertai pe-mindahan muatan listrik dalam satu arah teriadi dengan besar yang sama dalam arah sebaliknya ketika jumlah muatan listrik yang sama dipindahkan dalam arah sebaliknya.
Pemindahan jNF coulomb muatan listrik, dengan į menyatakan valensi dan Nr tetapan Faraday, atau 96.500 C. kita bisa mendefinisikan suatu kuantitas Z, yang disebut muatan sel, sebagai bilangan yang harga mutlaknya tidak ber- pengaruh tetapi perubahannya secara numerik sama dengan jumlah muatan listrik yang dipindahkan ketika teriadi reaksi kimia perubahannya negatif bila muatan positif dipindahkan secara eksternal dari elektrode positif ke elektrode negatif. Jadi, jika An mol seng lenyap dan An mol tembaga diendapkan, muatan sel berubah dari Zi ke Zf’ dengan
Zf – Zi = -∆njNF
Bila kita membatasi diri pada sel terbalikkan yang berlangsung tanpa ada gas yang terbebaskan, dan bekerja pada tekanan atmosfer tetap; kita boleh melupakan tekanan dan volumnya dan memerikan sel itu dengan memakai tiga koordinat saja, yaitu
1. elektromotansi E, diukur dalam V 2. Muatan Z. diukur dalam C: 3. Temperatur gas ideal ϑ
Bila sel itu dipasang pada rangkaian terbuka, akan cenderung terjadinya difusi yang berlangsung lambat dan selnya tidak dalam kesetimbangan. Namun, jika sel itu dihubungkan dengan potensiometer, dan rangkaian diatur sehingga tidak ada arus, maka elektromotansi sel diimbangi dan sel berada dalam ke- setimbangan mekanis dan kimia. apabila kesetimbangan termal juga dipenuhi, maka sel dalam kesetimbangan termodinamik.
Keadaan setimbang termodinamik dari sel terbalikkan berkaitan dengan persamaan keadaan antara koordinat , Z dan . Jika elektrolitnya merupakan larutan jenuh, makaƐ ϑ pemindahan muatan listrik yang menyertai berlangsungnya reaksi kimia pada temperatur tetap dan tekana tetap tidak akan mengubah konsentrasi elektrolit.
=
Ɛ Ɛ20 + χ (t – 20o) + β(t – 20o)2 + γ(t – 20o)3
K. Lempengan Dielektrik
Dielektrik adalah sejenis bahan isolator listriik yang dapat dikutubkan dengan cara menempatkan bahan dielektrik dalam medan listrik. Medan listrik adalah efek yang ditimbulkan oleh keberadaan muatan listrik, seperti elektron, ion, atau proton dalam ruangan yang ada disekitarnya.
Tinjaulah sebuah kapasitor yang terdiri atas dua keping penghantar sejajar yang luasnya A dan dimensi liniernya besar dibandingkan dengan jarak l antara kedua keping tersebut. Ruang diantara kedua keping di isi dengan dielektrik padat isotropik atau cair. Jika beda potensial diberikan diantara kedua keping, medan listrik E akan timbul dalam dielektrik antara kedua keping itu. Jika pusat gravitasi muatan positif tan negatif masing-masing molekul mula-mula berimpit seperti molekut dielektrik yang mula-mula nonpolar,
efek medan listrik akan memisahkan setiap molekul sehingga masing-masing molekul polah dalam arah yang sama dengan arah medan listrik. Jika molekul polar secara ilmiah dengan sumbu polar terdistribusi rambang, maka efek medan listrik akan menimbulkan orientasi parsial dari sumbu polar molekul dalam arah medan listrik. Kedua efek sama dalam kedua hal ini, derajat orientasi molekul polar terimbas dalam arah medan yang dapat dihitung dari muatan listrik yang terimbas pada salah satu permukaan dielektrik dikaitkan dengan tebal dielektrik, sehingga menghasilkan kuantitas yang disebut momen listrik total atau polarisasi listrik total yang diberi lambang � (huruf kapital pi). Jika volume dielektrik itu V, maka
perpindahan listrik dielektrikD, yang besarnya dapat dihitung dengan persamaan :
D=∈0E=Π
V
Polarisasi � yang ditimbulkan oleh medan listrik E bergantung pada sifat dielktrik dan temperatur. Biasa nya, zat dielektrik mengalami perubahan volume yang sangat kecil dalam percobaan yang dilakukan pada atmosfer tetap. Jadi tekanan dan volume nya dapat kita lupakan dan kita dapat memberikan dielektrik dengan pertolongan koordinat termodinamika berikut :
1. Intensitas listrik E, yang diukur dalam V/m, 2. Polarisasi �, yang diukur dalam C.m, 3. Temperatur gas ideal θ.
Π eksternal, zat paramagnetik bukan lah merupakan magnet. Setelah dimasukan kedalam medan magnetik zat itu sedikit termagnetisasi dalam arah medan. Namun permeabilitasnya masih hampir sama dengan satu (rendah), berlainan dengan zat feromagnetik seperti besi yang permeabilitasnya sangat besar. Namun, kristal paramagnetik tertentu memainkan peranan yang sangat penting dan menarik dalam kajian fisika modern, terutama pada temperatur yang sangat rendah.
Percobaan modern mengenai bahan paramagnetik biasanya dilakukan pada cuplikan dalam bentuk silinder, elipsoid, atau bola. Dalam hal ini medan intensitas magnetik � didalam bahan lebih kecil dari pada medan intensitas magnetik � yang ditimbulkan oleh arus listrik dalam lilitan yang melengkunginya, karena ada medan balik (medan demagnetisasi) yang ditimbulkan oleh kutub magnetik longitudinal efek demagnetisasi dapat diabaikan dengan memakai silinder yang panjangnya jauh melebihi diameternya atau dapat dikoreksi dengan cara yang sederhana. Dalam medan magnetik tranversal faktor koreksi harus dipakai. Disini kita akan membatasi diri dari silinder ramping yang sangat panjang dalam medan longitudinal dengan medan intensitas magnetik � internal dan eksternal sama besar.
Bila batang paramagnetik diletakkan dalam selenoid yang intensitas magnetiknya
�, pada batang itu timbul momen magnetik total M yang di sebut magnetisasi, dan besarnya bergantung pada komposisi kimia dan temperatur. Imbas magnetik dalam batang �, diberikan rumus :
β=µ0
(
ϰ+MV
)
Hampir semua percobaan pada batang magnetik dilakukan pada tekanan atmosfer tetap, dan perubahan volume yang kecil. Akibatnya kita bisa melupakan tekanan dan volume, dan memerikan padatan paramagnetikhanya dengan pertolongan tiga koordinat termodinamika, yaitu :
1. Intensitas magnetik �myang diukur dalam A/m, 2. Magnetisasi M yang diukur dalam A. M2, 3. Temperatur gas ideal θ
M = C 'Cϰ θ
(2.13)
yang dikenal sebagai persamaan Curie - C 'C disebut tetapan Curie. Jadi satuan untuk tetapan Curie adalah :
Karena ketetapan Curie bergantung pada banyaknya bahan, satuannya boleh merupakan salah satu dari empat satuan yang terdapftar dalam tabel berikut ini.
Satuan tetapan Curie
Terdapat suatu sistem dalam kesetimbangan yang dibagi menjadi dua bagian yang sama, masing-masing dengan massa yang sama. Kuantitas dalam bagian sistem yang tepat sama disebut intensif, sedangkan kuantitas yang menjadi separuhnya disebut ekstensif. Koordinat intensif sistem, seperti temperatur dan tekanan, tidak bergantung pada massa. Koordinat ekstensif berbanding lurus dengan massa. Koordinat termodinamika yang telah diperkenalkan dalam bab ini di senaraikan dalam tabel sebagai berikut :