Indri Rahmithasuci, 2013
KERAGAMAN BAKTERI ENDOFIT PADA KULTIVAR NANAS
(Ananas comosus (L.) Merr) SIMADU DAN BIASA DI KABUPATEN SUBANG
SKRIPSI
Diajukan untuk Memenuhi Sebagian dari Syarat Memperoleh Gelar Sarjana Sains Program Studi Biologi
Jurusan Pendidikan Biologi
Oleh:
Indri Rahmithasuci
0907165
PROGRAM STUDI BIOLOGI
JURUSAN PENDIDIKAN BIOLOGI
FAKULTAS PENDIDIKAN MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS PENDIDIKAN INDONESIA
KERAGAMAN BAKTERI ENDOFIT PADA
KULTIVAR NANAS
(
Ananas comosus
(L.) Merr) SIMADU DAN
BIASA DI KABUPATEN SUBANG
Oleh
Indri Rahmithasuci
Sebuah skripsi yang diajukan untuk memenuhi salah satu syarat memperoleh gelar Sarjana pada Fakultas Pendidikan Ekonomi dan Bisnis
© Indri Rahmithasuci 2013 Universitas Pendidikan Indonesia
November 2013
Hak Cipta dilindungi undang-undang.
Indri Rahmithasuci, 2013
INDRI RAHMITHASUCI
KERAGAMAN BAKTERI ENDOFIT PADA KULTIVAR NANAS
(Ananas comosus (L.) Merr) SIMADU DAN BIASA DI KABUPATEN SUBANG
DISETUJUI DAN DISAHKAN OLEH:
Pembimbing I
Dr. Topik Hidayat, M.Si.
NIP. 197004101997021001
Pembimbing II
Dr., Hj. Widi Purwianingsih, M.Si
NIP. 196209211991012001
Mengetahui,
Ketua Jurusan Pendidikan Biologi FPMIPA UPI
Dr. Riandi, M.Si.
Indri Rahmithasuci 0907165. 2013. Identifikasi Bakteri Endofit pada Kultivar Nanas (Ananas comosus (L.) Merr) Simadu dan Biasa di Kabupaten Subang. Di bawah bimbingan Topik Hidayat dan Widi Purwianingsih.
ABSTRAK
Proses pematangan pada buah ditandai dengan adanya perubahan karakteristik buah meliputi warna, aroma, tekstur dan rasa. Perubahan karakteristik buah tersebut salah satunya dipengaruhi oleh bakteri endofit yang dapat hidup berasosiasi dalam jaringan tanaman yang mampu menghasilkan enzim dan hormon tertentu sehingga dapat mengubah sifat kimia yang akan mempengaruhi sifat fisik suatu buah. Penelitian mengenai bakteri endofit pada buah telah banyak dilakukan, namun bakteri endofit pada buah nanas belum diidentifikasi. Buah nanas kultivar Simadu dan Biasa merupakan buah nanas yang banyak dikonsumsi masyarakat dan diolah sebagai bahan baku industri makanan yang berasal dari Kabupaten Subang. Penelitian ini bertujuan untuk mengetahui keragaman jenis bakteri endofit pada kultivar nanas Simadu dan Biasa. Metode yang digunakan dalam penelitian ini yaitu metode deskriptif dan Identifikasi bakteri dengan menggunakan karakterisasi morfologi, pewarnaan Gram dan uji biokimiawi. Isolasi bakteri dari kedua kultivar dilakukan dengan teknik pengenceran, yaitu pada seri pengenceran ke- 10-2, 10-3, dan 10-4. Bakteri-bakteri yang ditemukan pada kultivar Simadu diduga mempunyai kemiripan dengan jenis Bacillus sp, Pseudomonas sp, Enterobacter sp, Pediococcus sp, Acinetobacter sp, Lactobacillus sp, Gluconobacter sp dan Acetobacter sp. Sedangkan pada kultivar Biasa ditemukan bakteri yang diduga mempunyai kemiripan dengan jenis Bacillus sp, Pseudomonas sp, Enterobacter sp, Pediococcus sp, Acetobacter sp dan Micrococcus sp. Perbedaan keragaman bakteri pada kedua kultivar tersebut diikuti dengan perbedaan hasil uji organoleptik bahwa warna, rasa, aroma dan tekstur pada nanas Simadu lebih baik dibandingkan dengan nanas Biasa. Hal tersebut menunjukkan bahwa perbedaan bakteri endofit yang terdapat pada setiap kultivar diduga mempengaruhi karakteristik buah nanas (warna, rasa, aroma dan tekstur).
Indri Rahmithasuci, 2013
Indri Rahmithasuci 0907165. 2013. Diversity of Endophytic Bacteria From Cultivars of Pineapple (Ananas comosus (L.) Merr) Simadu and Biasa in Subang. Advisory Committee : Topik Hidayat and Widi Purwianingsih.
ABSTRACT
The fruit ripening process is characterized by a change in fruit characteristics include color, aroma, texture and flavor. Changes in the characteristics of the fruit is influenced by endophytic bacteria that can live associated in the cell plant that can produce a particular enzymes and hormones that can alter the chemical properties that will affect the physical properties of the fruit. Research on endophytic bacteria on the fruit has a lot to do, but endophytic bacteria on pineapple fruit has not been identified. Pineapple cultivars Simadu and Biasa is widely consumed by people as fresh fruit and processed fruit from Subang district. This study aims to determine the endophytic bacteria from pineapple cultivars Simadu and Biasa from Subang. The method used in this research is descriptive method, by using the characterization of morphology, Gram staining and biochemical tests. Isolation of bacteria from pineapple Simadu and Biasa cultivars were conducted by dilution technique, namely the serial-dilution to 10-2, 10-3, and 10-4. The bacteria found in Simadu cultivar alleged resemblance to the type of Bacillus sp, Pseudomonas sp, Enterobacter sp, Pediococcus sp, Acinetobacter sp, Gluconobacter sp and Acetobacter sp. While the Biasa cultivar alleged resemblance to the type of Bacillus sp, Pseudomonas sp, Enterobacter sp, sp Pediococcus, Acetobacter sp and Micrococcus sp. Differences in the composition of the bacteria in both cultivars followed by organoleptic test results that the difference of color, texture and flavor at Simadu cultivar superior compared to Biasa cultivar. It shows that there are differences in endophytic bacteria on each cultivar is thought to affect the characteristics of pineapple fruit (color, texture and flavor).
DAFTAR ISI
C. Tujuan Penelitian... 3
D. Manfaat Penelitian... 3
E. Batasan Masalah... 3
BAB II BAKTERI ENDOFIT, KARAKTERISASI, DAN IDENTIFIKASI PADA BUAH NANAS A. Nanas (Ananas comosus (L.) Merr) ... 4
1. Klasifikasi Ilmiah... 4
2. Deskripsi Tanaman... 4
3. Jenis atau Kultivar Nanas... 5
4. Karakteristik Buah Nanas... 6
B. Bakteri Endofit... 8
1. Bakteri Endofit pada Buah... 9
2. Bakteri Endofit pada Buah Segar dan Buah Pascapanen... 10
a. Bakteri Endofit pada Buah Segar... 10
b. Bakteri Endofit pada Buah Pascapanen... 10
vi
Indri Rahmithasuci, 2013
.
a. Faktor Intrinsik... 11
b. Faktor Ekstrinsik... 12
c. Faktor Implisit... 13
C. Isolasi dan Identifikasi Bakteri... 14
1. Isolasi Bakteri... 14
a. Nutrien Mikroorganisme... 14
b. Media Pertumbuhan... 14
2. Klasifikasi Mikroorganisme... 17
BAB III METODE PENELITIAN A. Jenis Penelitian... 18
B. Populasi dan Sampel... 18
C. Waktu dan Lokasi Penelitian... 18
D. Alat dan Bahan... 18
1. Alat... 18
2. Bahan... 19
E. Langkah Kerja... 19
1. Tahap Persiapan... 19
2. Tahap Penelitian... 19
a. Pengambilan Sampel... 19
b. Pengujian Organoleptik... 20
c. Pembiakan Isolat Bakteri... 20
1) Sterilisasi Permukaan... 20
2) Pengenceran Sampel... 21
d. Pengamatan Morfologi dan Isolasi Biakan Murni Bakteri... 21
e. Pewarnaan Gram... 22
f. KOH String Test... 22
g. Uji Biokimiawi... 22
1) Uji Fermentasi Karbohidrat... 22
2) Uji Hidrolisis Pati... 23
4) Uji Hidrolisis Gelatin... 23
5) Ujji Hidrolisis Kasein... 23
6) Uji Katalase... 23
c) Uji Voges-Proskauer... 25
d) Uji Simmon’s Sitrat... 26
F. Identifikasi Bakteri... 26
G. Alur Penelitian... 27
BAB IV HASIL DAN PEMBAHASAN A. Isolasi Bakteri... 28
B. Karakterisasi Morfologi Koloni Bakteri dari Dua Kulitivar Buah Nanas... 29
C. Karakterisasi Bakteri dari Dua Kultivar Buah Nanas Berdasarkan Pewarnaan Gram dan KOH String Test... 36
1. Pewarnaan Gram... 36
2. KOH String Test... 38
D. Uji Biokimia... 39
1. Uji Hidrolisis (Pati, Kasein, Lipid, Gelatin) ... 40
a. Hidrolisis Pati... 40
b. Hidrolisis Kasein... 40
c. Hidrolisis Lipid... 41
d. Hidrolisis Gelatin... 42
2. Uji Motilitas... 43
viii
Indri Rahmithasuci, 2013
4. Uji Reduksi Nitrat... 45
5. Uji Katalase... 46
6. Uji Oksidase... 47
7. Uji Urease... 48
8. Uji IMViC (Indol, Methyl-Red, Voges-Proskauer,Sitrat)... 49
a. Uji Indol... 49
b. Uji Methyl Red (MR)... 50
c. Uji Voges-Proskauer (VP) ... 51
d. Uji Sitrat... 52
9. Fermentasi Karbohidrat (Dekstrosa, Sukrosa, dan Laktosa)... 53
E. Identifikasi Bakteri... 55
F. Uji Organoleptik... 62
G. Karakteristik Buah dengan Keragaman Bakteri... 64
BAB V KESIMPULAN DAN SARAN A. Kesimpulan... 68
B. Saran... 69
DAFTAR PUSTAKA... 70
LAMPIRAN... 77
DAFTAR TABEL
Tabel Halaman
2.1 Kandungan Gizi Buah Nanas Segar Tiap 100 gram Bahan... 7
3.1 Form Uji Organoleptik... 20
3.2 Keterangan Untuk Pengisian Form Pengujian Organoleptik... 20
4.1 Jumlah Koloni Bakteri Pada Medium KNA umur 1x24 jam... 29
4.2 Hasil Pengamatan Morfologi Bakteri Kultivar Nanas Simadu dan Nanas Biasa... 32
4.3 Hasil Pewarnaan Gram dan KOH String Test... 39
4.4 Hasil Uji Aktivitas Biokimiawi dan Identifikasi 9 Isolat Bakteri dari Dua Kultivar Nanas Terpilih (Nanas Simadu dan Nanas Biasa) ... 61
x
Indri Rahmithasuci, 2013
DAFTAR GAMBAR
Gambar Halaman
2.1 Tanaman Nanas... 4
2.2 Empat Kultivar Nanas Menurut Rukmana (1995) ... 6
2.3 Uji Aktivitas Biokimia Mikroorganisme... 16
3.1 Bagan Alur Penelitian... 27
4.1 Keragaman Morfologi Koloni Bakteri Nanas Simadu... 30
4.2 Keragaman Morfologi Koloni Bakteri Nanas Biasa... 30
4.3 Koloni Dalam Agar Miring pada Biakan Murni... 31
4.4 Persentase Bentuk Koloni, Persentase Warna Koloni, Persentase Tepian Koloni, Persentase Elevasi Koloni, Persentase Kenampakan Koloni, Persentase Kepekatan Koloni... 35
4.5 Persentase Bentuk Sel dan Jenis Gram... 36
4.6 Hasil Pewarnaan Gram 9 Isolat Bakteri dari Dua Kultivar Buah Nanas, Umur Kultur 24 Jam Perbesaran 1000x... 37
4.7 Hasil Uji Hidrolisis Pati pada Medium Agar Pati... 40
4.8 Uji Hidrolisis Kasein pada Medium Agar Kasein... 41
4.9 Hasil Uji Hidrolisis Lipid pada Medium Agar Lipid... 42
4.10 Hasil Uji Hidrolisis Gelatin pada Medium Agar Lipid... 43
4.11 Hasil Uji Motilitas pada Medium SIM Agar... 44
4.12 Hasil Uji Produksi H2S pada Medium SIM Agar... 45
4.13 Uji Reduksi Nitrat pada Medium Kaldu Nitrat... 46
4.14 Uji Katalase pada Medium Nutrient Agar... 47
4.15 Hasil Uji Urease pada Medium Urea Broth... 48
4.16 Hasil Uji Urease pada Medium Urea Broth... 49
4.17 Hasil Uji Indol pada Medium Trypthone Broth... 50
4.18 Hasil Uji Methyl Red pada Medium MR-VP Broth... 51
4.20 Hasil Uji Sitrat pada Medium Simmon’s Sitrat... 53
4.21 Hasil Uji Fermentasi Dekstrosa pada Medium Kaldu Dekstrosa... 54
4.22 Hasil Uji Fermentasi Sukrosa pada Medium Kaldu Sukrosa... 54
4.23 Hasil Uji Fermentasi Laktosa pada Medium Kaldu Laktosa... 54
xii
Indri Rahmithasuci, 2013
DAFTAR LAMPIRAN
Lampiran Halaman
1 Pengambilan Sampel... 78
.2 Protokol Pembuatan Reagen dan Medium yang Digunakan Dalam
BAB I
PENDAHULUAN
A. Latar Belakang
Nanas (Ananas comosus (L.) Merr) merupakan salah satu buah tropis yang memiliki nilai ekonomi yang cukup tinggi dengan produksi ketiga terbesar di dunia setelah pisang dan jeruk (Bartholomew et al., 2003). Selain digemari masyarakat untuk konsumsi buah segar, nanas juga merupakan bahan baku industri buah kalengan dan olahan (Irfandi, 2005)
Berdasarkan habitus tanaman, terutama bentuk daun dan buah, nanas dapat dibedakan menjadi empat kelompok, yaitu: Spanish, Queen, Abacaxi, dan Cayenne. Kultivar nanas yang paling banyak ditanam di Indonesia adalah
Cayenne dan Queen. Kultivar Cayenne dikenal dengan nama lokal nanas Subang
dan nanas Minyak (Bogor), sedangkan kultivar Queen dikenal dengan nama lokal seperti nanas Bogor dan Blitar (Rukmana, 1996). Perbedaan penampilan tanaman nanas dapat disebabkan oleh perbedaan genotipe, lingkungan, atau interaksi keduanya (Zhikry et al., 2012). Kultivar nanas Cayenne telah berkembang menjadi beberapa kultivar baru, diantaranya kultivar nanas Simadu dan kultivar nanas Biasa. Kedua kultivar nanas tersebut telah banyak ditanam dan menyebar di daerah Subang. Buah nanas kultivar Simadu dan Biasa merupakan buah nanas yang banyak dikonsumsi masyarakat dan telah banyak dijadikan sebagai bahan baku untuk diolah dalam industri makanan. Perbedaan yang menonjol dari kedua kultivar tersebut dapat dilihat dari fisik buahnya. Nanas Simadu mempunyai ukuran buah yang lebih besar dengan bentuk buah yang sedikit lonjong, sedangkan nanas Biasa mempunyai ukuran buah yang lebih kecil dengan bentuk buah yang bulat.
2
Indri Rahmithasuci, 2013
diubah menjadi gula dan terjadi peningkatan jumlah asam-asam seperti asam sitrat yang menjadikan buah nanas memiliki perpaduan rasa antara gula dan asam. Pektin dan lignin sebagai komponen dari dinding sel dipecah menjadi molekul yang lebih sederhana, sehingga terjadi pelunakan jaringan buah (Irfandi, 2005). Perubahan karakteristik buah tersebut salah satunya dipengaruhi oleh flora mikroba termasuk bakteri yang hidup di dalam jaringan tumbuhan yang dikenal sebagai bakteri endofit. Bakteri endofit yang awalnya berada di luar organ tumbuhan masuk ke dalam jaringan tumbuhan melalui lubang alami dan jika terjadi luka pada tumbuhan (Hidayah dan Titiek, 2008).
Bakteri endofit merupakan bakteri yang berasosiasi dengan jaringan atau sel tanaman tingkat tinggi dan tidak memberikan kerugian pada tanaman tersebut (Khairani, 2010). Bakteri endofit telah banyak ditemukan pada tanaman dan buah-buahan. Contoh bakteri endofit yang telah ditemukan pada tanaman tomat adalah dari genus Pseudomonas dan Bacillus. Bakteri tersebut mempunyai pengaruh positif terhadap pertumbuhan tanaman karena dapat menginduksi hormon pertumbuhan (Hartini, 2004). Selain dapat mempercepat pertumbuhan tanaman, bakteri endofit dapat menghidrolisis berbagai senyawa kimia yang terkandung dalam tanaman tersebut. Herlina (2012) menyatakan bahwa bakteri asam laktat yang diisolasi dari buah jeruk dapat berperan dalam pembentukan aroma dan rasa masam buah. Bakteri asam laktat tersebut menguraikan glukosa menjadi asam laktat yang menimbulkan rasa masam.
B. Rumusan Masalah
Berdasarkan latar belakang yang telah dijelaskan, maka rumusan masalah dari penelitian ini adalah Bagaimana keragaman jenis bakteri endofit pada kultivar nanas Simadu dan Biasa.
C. Tujuan Penelitian
Tujuan dilakukannya penelitian ini adalah sebagai berikut:
1. Mengetahui keragaman jenis bakteri endofit pada kultivar nanas Simadu dan Biasa.
2. Melihat hubungan antara keragaman bakteri endofit dengan karakteristik buah nanas yang meliputi rasa, aroma, warna, dan tekstur.
D. Batasan Masalah
Agar penelitian ini memiliki arah dan ruang lingkup yang jelas, maka perlu adanya pembatasan masalah. Adapun batasan-batasan dalam penelitian ini yaitu:
1. Sampel nanas yang akan digunakan merupakan dua kultivar terpilih yaitu, nanas Biasa dari jenis Cayenne dan nanas Simadu dari jenis Smooth Cayenne yang berasal dari Kabupaten Subang, Jawa Barat.
2. Buah nanas yang akan digunakan adalah buah nanas yang matang, dengan umur tanaman yang sama (2 tahun 1 minggu) dan diambil pada satu lahan yang sama.
3. Penelitian hanya mengidentifikasi hingga tingkat genus dari keragaman bakteri endofit.
4. Identifikasi bakteri berpedoman pada buku Bergey’s Manual Of Systematic Bacteriology Ninth Edition (1994).
E. Manfaat Penelitian
Penelitian ini diharapkan mempunyai manfaat sebagai berikut:
1. Memberikan informasi tentang bakteri endofit pada buah nanas yang biasa dikonsumsi masyarakat.
4
BAB III
METODE PENELITIAN
A. Jenis Penelitian
Penelitian ini merupakan jenis penelitian dasar dengan menggunakan metode deskriptif.
B. Populasi dan Sampel
1. Populasi yang digunakan dalam penelitian ini adalah bakteri endofit yang berasal dari dua kultivar buah nanas (Simadu dan Biasa).
2. Sampel yang digunakan dalam penelitian ini adalah semua bakteri yang tumbuh pada medium NA melalui pengenceran dari dua kultivar buah nanas (Simadu dan Biasa).
C. Waktu dan Lokasi Penelitian
Penelitian ini dimulai pada bulan Maret sampai dengan Juli 2013 yang dilaksanakan di Laboratorium Mikrobiologi Jurusan Pendidikan Biologi Fakultas Pendidikan Matematika dan Ilmu Pengetahuan Alam Universitas Pendidikan Indonesia, Jalan Dr. Setiabudhi No.229 Bandung.
D. Alat dan Bahan
1. Alat
Alat-alat yang digunakan adalah mikroskop (22.103 BI.J07), hot plate and magnetic stirer (EYELA), autoclave (Hirayama Mode HC36At), Vorteks
(SIBATA), timbangan analitik (AND,HF 300), spatula, cawan petri, tabung reaksi, lup inokulasi, rak tabung, gelas ukur 10ml, gelas ukur 500ml, gelas kimia 1000ml, mikropipet 5ml, inkubator, tips 5ml, 10ml, kamera digital (Canon Ixus 115), plastik tahan panas, kain kasa, kapas, label, object glass, tissue, kertas saring, dan alat tulis menulis.
2. Bahan
a. Bahan Segar
19
red, reagen Barritt’s A, reagen Barritt’s B. c. Bahan Media
Bahan media yang diperlukan adalah, akuades, kaldu laktosa, kaldu sukrosa, kaldu dekstrosa, phenol red, pati agar, lipid agar, kasein agar, gelatin agar, urea broth, Tryptone broth, Nitrate broth, SIM (Sulfide Indole Motily) agar, MRVP broth, Simmon’s sitrat agar.
E. Langkah Kerja
Penelitian ini dibagi menjadi 2 tahap yaitu tahap persiapan dan tahap penelitian.
1. Tahap Persiapan
Alat-alat kaca dan plastik yang akan digunakan dicuci terlebih dahulu dan dikeringkan. Alat kemudian dibungkus dengan kertas pembungkus setelah itu dilakukan sterilisasi panas lembab dengan cara dimasukkan ke autoklaf selama 15-20 menit pada suhu 121oC dan tekanan 2 atm.
Pemeringkatan dilakukan dengan menyusun data dari nilai terbesar pada setiap panelis (Gagung, 2012).
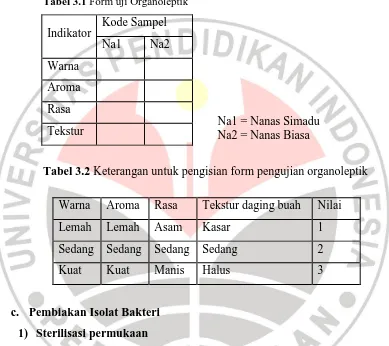
Form uji yang akan digunakan dalam pengujian organoleptik tetera pada tabel 3.1 dengan Na1 sebagai nanas Simadu dan Na2 sebagai nanas biasa dan keterangan untuk pengisian form tertera pada tabel 3.2.
Tabel 3.1 Form uji Organoleptik
Indikator Kode Sampel
Na1 Na2
Warna Aroma Rasa Tekstur
Tabel 3.2 Keterangan untuk pengisian form pengujian organoleptik
Warna Aroma Rasa Tekstur daging buah Nilai
Lemah Lemah Asam Kasar 1
Sedang Sedang Sedang Sedang 2
Kuat Kuat Manis Halus 3
c. Pembiakan Isolat Bakteri
1) Sterilisasi permukaan
Sampel berupa buah nanas dibersihkan dari kotoran dengan cara dicuci dengan air mengalir, kemudian merendamnya dengan alkohol 75% selama 2 menit dan dibilas dengan akuades steril sebanyak dua kali. Selanjutnya, sterilisasi permukaan dengan menggunakan larutan alkohol 75% selama 1 menit, Bayclin 25% selama 5 menit. Lalu membilas sampel dengan air steril sebanyak dua kali. Sampel direndam kembali dengan alkohol 75% selama 30 detik dan dibilas kembali dengan akuades steril sebanyak tiga kali.
21
Indri Rahmithasuci, 2013
2) Pengenceran Sampel
Sampel berupa irisan daging buah dan kulit buah nanas dijus dengan cara mencuplik bagian daging dan kulit buah sebanyak 20 gram. Lalu ditambahkan akuades 180 ml. Lalu diencerkan menggunakan metode pengenceran, pada pengenceran ke- 10-2,10-3 dan 10-4 sampel diambil masing-masing sebanyak 1 ml lalu di tuang ke media KNA dan diinkubasi pada suhu 37 oC selama 1x24 jam. Tahap selanjutnya, yaitu pemurnian Isolat dilakukan pada medium KNA yang baru. Lalu diinkubasi pada suhu 37 oC selama 2x24 jam.
Metode pengenceran dilakukan dengan mengencerkan larutan sampel sampai empat kali pengenceran. Pengenceran sampel secara bertingkat dilakukan dengan memindahkan 1 ml larutan sampel secara aseptik ke dalam larutan pengencer (9 ml akuades). Dari pengenceran pertama didapatkan pengenceran 10-2, kemudian 1 ml sampel dari 10-2 dipindahkan ke dalam 9 ml larutan pengencer sehingga didapatkan pengenceran 10-3 dan 1 ml sampel diambil kembali sampai pada pengenceran 10-4.
d. Pengamatan Morfologi dan Isolasi Biakan Murni Bakteri
e. Pewarnaan Gram
Pewarnaan gram dilakukan untuk melihat karakteristik dan bentuk sel bakteri. Sebuah koloni tunggal bakteri diambil dari slide culture dibuat sediaan mikroskopiknya. Preparat kemudian ditetesi kristal violet selama 1 menit. Preparat kemudian ditetesi dengan lugol selama 45-60 detik. Selanjutnya, proses dekolorisasi dengan menggunakan alkohol 96% sampai tidak ada sisa warna yang keluar dari preparat. Lalu bilas dengan akuades dan dikeringkan dengan kertas isap. Selanjutnya, preparat ditetesi safranin selama 1 menit, dicuci dengan akuades dan dibiarkan kering. Sebelum diamati dibawah mikroskop cahaya 1000x, preparat ditetesi minyak imersi. Untuk hasil, warna ungu menunjukkan bakteri gram positif dan warna merah menunjukkan bakteri gram negatif (Cappuccino & Sherman, 2005).
f. KOH string test
KOH string test dilakukan untuk memastikan kebenaran dari hasil uji pewarnaan Gram. Kaca objek ditetesi 3% KOH cair, kemudian pindahkan sejumlah sel dari biakan ke tetesan KOH menggunakan jarum inokulum (jumlah ini jangan terlalu sedikit), aduk sampai merata sempurna, jika suspensi menjadi berlendir maka dinyatakan sebagai Gram negatif. Untuk mengetahuinya ujung inokulum diangkat-angkat kurang lebih 1 cm dari kaca objek. Jika tidak terdapat lendir dinyatakan sebagai Gram positif (Cappuccino & Sherman, 2005).
g. Uji Biokimiawi
Uji biokimiawi yang dilakukan merujuk pada Cappuccino & Sherman (2005). Adapun uraian dari uji biokimiawi yang digunakan, antara lain:
1) Uji Fermentasi Karbohidrat
masing-23
Indri Rahmithasuci, 2013
masing medium. Inkubasi 1-2 x 24jam pada suhu 37oC (Cappuccino & Sherman, 2005).
2) Uji Hidrolisis Pati
Menyiapkan medium agar pati dalam cawan petri. Lalu menginokulasi bakteri dan diinkubasi selama 1-2 x 24 jam pada suhu 22-37 oC selama 24 jam (Cappuccino & Sherman, 2005).
3) Uji Hidrolisis Lipid diinkubasi dalam lemari es pada suhu 4°C selama kurang lebih 30 menit (Cappuccino & Sherman, 2005).
5) Uji Hidrolisis Kasein
Uji ini dapat digunakan untuk mendeteksi adanya enzim protease. Medium susu skim dicairkan lalu didinginkan sampai suhu 45oC dan dituang ke cawan petri. Mikroorganisme diinokulasi dan diinkubasi selama 1-2 x 24 jam pada suhu 22-37oC (Cappuccino & Sherman, 2005). 6) Uji Katalase
Uji ini dapat digunakan untuk mendeteksi keberadaan enzim katalase. Isolat bakteri diinokulasikan ke dalam medium NA dan diinkubasi pada suhu 22-37oC selama 24 jam. Setelah terlihat adanya pertumbuhan, larutan H2O2 (hidrogen peroksida) 3% diteteskan di atas permukaan
koloni. Gelembung yang muncul menunjukkan hasil yang positif (Cappuccino & Sherman, 2005).
7) Uji Oksidase
perubahan warna. Pembentukkan warna ungu kebiruan yang secara bertahap menjadi warna ungu menunjukkan hasil positif dan tidak ada perubahan warna menunjukkan hasil negatif (Cappuccino & Sherman, 2005).
8) Uji Reduksi Nitrat
Mikroorganisme ditumbuhkan dalam kaldu nitrate broth. Inkubasi selama 1-2 x 24 jam pada suhu 37oC. Teteskan reagen A (sulfanilic acid) dan reagen B ( -naphthylamine), jika terbentuk warna jingga menunjukkan hasil positif. Biakan yang tidak berubah warna diteteskan kembali dengan zinc powder, jika berubah warna menjadi jingga maka hasil positif (Cappuccino & Sherman, 2005).
9) Uji Urease
Uji ini bertujuan untuk mengetahui adanya urease. Medium yang digunakan adalah bacto urea agar base. Semua bahan medium dilarutkan, tidak boleh dipanaskan dan disterilkan dengan cara menyaring dengan filter Seitz. Kemudian dilarutkan bacto agar 15 gram dalam akuades 900
ml dan disterilkan dalam otoklaf. Larutan pertama dicampur dengan larutan kedua secara aseptik pada suhu 50-55 oC. Kemudian tuang dalam tabung steril 3-5 ml dan diletakan dalam posisi miring (Tim Praktikum POLTEKES Bandung, 2005).
10) Uji Motilitas
Isolat bakteri diinokulasikan pada medium Sulfate Indol Motily (SIM)
dan diinokulasikan menggunakan ose lurus dengan posisi lurus.
(Raihana,2011).
11)Uji Produksi H2S
Uji ini dilakukan pada medium Sulfate Indol Motily (SIM). Bakteri diinokulasikan menggunakan ose lurus dengan posisi lurus. Hasil uji positif bila terdapat gelembung (Raihana,2011).
25
Indri Rahmithasuci, 2013
Uji IMViC digunakan untuk membedakan bakteri enterik (Family Enterobacteriaceae seperti Enterobacter). Terdiri dari Uji Indol, Uji Methyl Red dan Uji Voges-Proskauer (MR-VP), serta Uji Simmon’s sitrat. Uji IMViC tersebut dipaparkan sebagai berikut:
a) Uji Indol
Uji Indol dilakukan untuk mengetahui apakah bakteri dapat membentuk indole dari degradasi asam amino tryptophan. Satu ose bakteri ditanam dalam media SIM, diinkubasi pada suhu 37⁰C selama 24
jam. Lalu diteteskan reagen Kovacks (terdiri dari dimetil
aminobenzaldehid, n-amyl alkohol & HClp), hasil positif menunjukkan
terbentuknya cincin merah pada permukaan medium dan hasil negatif
menunjukkan warna kuning atau coklat pada permukaan medium
(Cappuccino & Sherman, 2005). b) Uji Methyl Red
Uji ini bertujuan untuk menentukan adanya fermentasi asam campuran. Kaldu VP disiapkan, lalu dimasukkan 5 mL kaldu MR-VP dalam tabung reaksi dan diinokulasikan biakan bakteri. Kemudian diinkubasi pada suhu 37oC selama 24 jam. Hari berikutnya ditambahkan reagen methyl red 5 tetes, jika kaldu berwarna merah setelah penambahan reagen methyl red maka menunjukan hasil uji positif, dan jika warna kaldu berwarna kuning maka hasil uji negatif. c) Uji Voges-Proskauer
d) Uji Simmon’s Sitrat
Digunakan untuk mengenali mikroba yang mampu memanfaatkan sitrat sebagai sumber karbon. Media ini mengandung indikator pH. Jika sitrat digunakan oleh bakteri dalam media, maka pH menjadi lebih alkalin sehingga media berubah dari hijau ke biru (basa). Sebuah koloni bakteri tunggal digoreskan ke medium Simmon’s sitrat agar dan diinkubasi pada suhu 37°C selama 48 jam. Hasil positif menunjukkan jika media berubah menjadi warna biru sementara hasil negatif menunjukkan bahwa tidak ada perubahan warna. F. Identifikasi Bakteri
27
Indri Rahmithasuci, 2013
G. Alur Penelitian
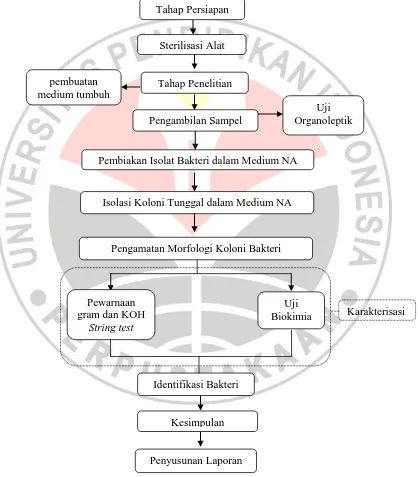
Alur penelitian dapat dilihat pada Gambar 3.1.
Gambar 3.1 Bagan Alur Penelitian Tahap Persiapan
pembuatan medium tumbuh
Sterilisasi Alat
Pembiakan Isolat Bakteri dalam Medium NA
Pewarnaan gram dan KOH
String test
Uji Organoleptik
Uji Biokimia
Identifikasi Bakteri
Penyusunan Laporan
Pengamatan Morfologi Koloni Bakteri Tahap Penelitian
Pengambilan Sampel
Isolasi Koloni Tunggal dalam Medium NA
Kesimpulan
Indri Rahmithasuci, 2013
BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Dari hasil penelitian yang dilakukan, terdapat sembilan genus bakteri yang berbeda yang ditemukan pada kedua kultivar nanas Simadu dan Biasa. Genus bakteri yang diduga sama-sama ditemukan pada kedua kultivar nanas (Simadu dan Biasa) antara lain Bacillus, Pseudomonas, Enterobacter, Pediococcus, dan Acetobacter. Terdapat bakteri spesifik yang hanya ditemukan pada salah satu
kultivar nanas saja. Pada kultivar Simadu ditemukan genus yang diduga Acinetobacter, Lactobacillus, dan Gluconobacter, yang mana bakteri tersebut
tidak ditemukan pada kultivar Biasa, sedangkan pada kultivar Biasa ditemukan genus yang diduga Micrococcus yang tidak ditemukan pada kultivar Simadu.
B. Saran
Berdasarkan hasil penelitian dan kesimpuulan di atas, terdapat beberapa saran agar lebih banyak mengenai penelitian yang terkait, yaitu :
1. Perlu dilakukan analisis spesies secara molekuler sehingga identitas spesies bakteri yang diteliti lebih akurat.
Indri Rahmithasuci, 2013
DAFTAR PUSTAKA
Adams, M.R., & Moss, M.O. (1995). Food Microbiology. New Delhi: New Age International Publishers.
Annous, B.A., Kozempel, M.F., & Kurantz, M.J. (1999). “Changes in Membrane Fatty Acid Composition of Pediococcus sp. Strain NRRL B-2354 in Response to Growth Conditions and Its Effect on Thermal Resistance”. Appl Environ Microbiol. 65(7): 2857–2862.
Arwiyanto, T., Maryudani., & Prasetyo, A. (2007). “Karakterisasi Dan Uji Aktivitas Bacillus Spp. Sebagai Agensia Pengendalian Hayati Penyakit Lincat Pada Tembakau Temanggung”. Berk. Penel. Hayati: 12 (93–98), 2007
Austin, B., & Austin, D.A. (2012). Bacterial Fish Pathogens Disease of Farm and Wild Fish Fifth Edition. UK: Springer.
Bartholomew, D.P., Paull, R.E., & Rochbach, K.G. (2003). The Pineapple Botani Production and Uses. UK: CABI Publishing.
Bastian, F. (2011). Teknologi Pati Dan Gula. Hibah Penulisan Buku Ajar Bagi Tenaga Akademik. Universitas Hasanudin
Campbell, N.A., Reece, J.B., & Mitchell, L.G. (2002). Biologi Jilid 1. Jakarta: Erlangga
Cappuccino, J.G., & Sherman, N. (2005). Microbiology : A Laboratory Manual, New York: The Benjamin Cummings Publishing Company.
Inc.
Cronquist, A. (1981). An Integrated System Of Classification Of Flowering Plants. New York: Columbia University Press.
Dinas Pertanian Tanaman Pangan Propoinsi Jawa Barat. (2008). Standar Operasional Prosedur (SOP) Nenas Kabupaten Subang Revisi I.
Dwiari, S, R., Asadayanti, D., Nurhayati., Sofyaningsih, M., Yudhanti, S., & Yoga, I. (2008). Teknologi Pangan Jilid 1. Jakarta: Direktorat Pembinaan Sekolah Menengah Kejuruan.
Farah, N. (2012). Comparative Bacterial Composition Between Buloh And Sayong River. A thesis of the degree of Bachelor of Science. Faculty
of Bioscience and Bioengineering. Universiti Teknologi Malaysia: tidak diterbitkan.
Fitrasari, R. (2008). Isolasi Dan Karakterisasi Gen Endoglukanase Parsial Famili 5 Dari Metagenom Sumber Air Panas Cimanggu. Thesis pada
Program studi Bioteknologi SITH-ITB: diterbitkan. [Online] Tersedia: http://www.sith.itb.ac.id/abstract/s2/.pdf [5 Juni 2013] Gagung, J., & Sunarto. (2012). “Pengaruh Kosentrasi Gula Terhadap
Karakteristik Sirup Buah Naga”. Makalah STTP Malang. Malang. Hartini, A. (2004). Isolasi Bakteri Endofit Dan Pengujian Potensinya Untuk
Mengendalikan Nematoda Meloidogyne spp. Pada Tanaman Tomat
(Lycopersicon esculentum Mill.). Skripsi Sarjana pada Fakultas
Pertanian Institut Pertanian Bogor: diterbitkan. [Online] Tersedia: http://repository.ipb.ac.id/bitstream/handle/123456789/15435/A04ah a1.pdf?sequence=1 [5 Juni 2013]
Herlina, 2012. “Kualitas Keju Cottage Dengan Bahan Penggumpal Sari Buah Jeruk Keprok (Citrus Reticulata) Pada Level Dan Lama
Penyimpanan Berbeda”. Skripsi Sarjana pada Fakultas Peternakan Universitas Hasanuddin Makassar: diterbitkan. [Online] Tersedia: http://repository.unhas.ac.id/handle/123456789/ 1802 [5 Juni 2013] Hidayah, N., & Titiek, Y. (2008). “Peranan Bakteri Endofit Dalam Reaksi
Ketahanan Tanaman Terhadap Patogen”. Jurnal Pengendalian Hayati. 1, (2), ISSN 1979-2190.
Hidayat, I.S. (2005). Isolasi dan Karakterisasi Bakteri dari Tanah di Sekitar Karat Besi di Kota Bandung. Skripsi Sarjana pada FPMIPA UPI
Indri Rahmithasuci, 2013 Terhadap Kualitas Lembaran Karet. Tesis pada FMIPA: diterbitkan.
[Online] Tersedia:
http://repository.usu.ac.id/xmlui/handle/123456789/306 [5 Juni 2013]
Indriani, A.D. (2011). Identifikasi Bakteri Resisten Logam Krom dari Limbah Cair Industri Penyamakan Kulit Sukaregang Kabupaten Garut.
Skripsi Sarjana pada FPMIPA UPI Bandung: tidak diterbitkan. Irfandi. (2005). Karakterisasi Morfologi Lima Populasi Nanas (Ananas
comosus (L.) Merr.). Skripsi Sarjana pada Fakultas Pertanian Institut
Pertanian Bogor: diterbitkan. [Online] Tersedia: http://repository.ipb.ac.id/handle/123456789 /12566 [5 Juni 2013] Janisiewicz, W.J., & Buyer, J.S. (2010). “Culturable Bacterial Microflora
Associated With Nectarine Fruit And Their Potential For Control Of Brown Rot”. Journal Microbiol NRC Research Press. 56: 480–486. Khairani, G. (2009). Isolasi Dan Uji Kemampuan Bakteri Endofit Penghasil
Hormon IAA (Indole Acetic Acid) Dari Akar Tanaman Jagung (Zea
mays L.). Skripsi Sarjana pada FMIPA Universitas Sumatera Utara:
diterbitkan. [Online] Tersedia:
Krisno, A. (2012). Penggunaan Bakteri Azospirillum sp. sebagai Penghasil Phytohormon dalam Upaya Mempercepat Pematangan Buah
Mangga. Skripsi pada Program Studi Pendidikan Biologi Universitas
Muhammadiyah Malang: diterbitkan. [Online] Tersedia: www.siteglimpse.com/drrajanlaboratories.com[5 Juni 2013]
Kusnadi., Peristiwati., Syulasmi, A., Purwianingsih, W., & Rochintaniawati, D. (2003). Mikrobiologi. Bandung: JICA-IMSTEP.
Kwartiningsih, E., & Mulyati, Ln. (2005). “Fermentasi Sari Buah Nanas Menjadi Vinegar”. Ekuilibrium. 4, (1): 8 – 12
Lay, B.W., & Hatowo, S. (1992) Mikrobiologi. Jakarta: Rajawali Press.
Lay, B.W. 1994. Analisis Mikroba di Laboratorium. Jakarta: PT Raja Grafindo Persada.
Lie, S. (1995). Isolasi dan Seleksi Bakteri Asam Laktat yang Bersifat Antimikroba Dari Pikel Ketimun dan Acar. Skripsi Sarjana pada FTP
IPB Bogor: diterbitkan. [Online] Tersedia:
http://repository.ipb.ac.id/handle/123456789/39954 [5 Juni 2013] Lund, B.M., Tony, C.B., & Grahame, W.G. (2000). The Microbial Safety and
Quality of Food. USA: An Aspen Publication.
Maheshwari, D, K. (2011). Bacteria in Agrobiology: Plant Growth Respone. New York: Springer.
Malihah. (2006). Karakteristik Morfologi dan Kualitas Buah Nenas (Ananas comosus (L.) Merr.) dari Empat Populasi di Kecamatan Cijeruk
Kabupaten Bogor. Skripsi Sarjana pada Fakultas Pertanian Institut
Pertanian Bogor: diterbitkan. [Online] Tersedia: http://repository.ipb.ac.id/bitstream/handle/123456789/50535/A06m al 1.pdf [5 Juni 2013]
Miguel, P., Delvaux, Julio, C.D., Marcelo, N., Larissa, C., Fernanda, S., Mauricio, D., Marcos, R., Celia, A., & Arnaldo, C. (2013).
Indri Rahmithasuci, 2013
canephora”. African Journal of Microbiology Research. 7, (7), pp. 586-594.
Muljoharjo, M. (1984), Nanas dan Teknologi Pengolahannya. Bandung: Liberty,.
Pelczar, M.J. 1977. Microbiology. Fourth Edition. New York: Mc Graw Hill. Pelczar, M.J., & Chan, E.C.S. (1986). Dasar-Dasar Mikrobiologi. Jakarta: UI
Press,.
Paramita, I, A. (2010). Deteksi Koloni Enterobactericeae Pada Susu Sapi Segar Tanpa Melalui Media Selektif Enterobacteriaceae Enrichment
Broth. Sidang Tugas Akhir–SB 091358. Jurusan Biologi FMIPA ITS. [Online]. Tersedia: http://digilib.its.ac.id/public/ITS-Undergraduate-9890-Presentation.pdf
Pratiwi, T.K. (2011). Pengawetan Segar Buah Dan Sayur. [Online] Tersedia: http://beautyramissu.wordpress.com/ [9 September 2013]
Rukmana, R. (1996). Nenas Budidaya Dan Pascapanen. Yogyakarta:.Kanisius.
Raihana, N. (2011). Profil Kultur Dan Uji Sensitivitas Bakteri Aerob Dari Infeksi Luka Operasi Laparatomi Di Bangsal Bedah Rsup Dr. M.
Djamil Padang. Artikel. Program Pascasarjana. [Online]. Tersedia:
http://pasca.unand.ac.id/id/wp-content/uploads/2011/09/artikel5.pdf [20 Juni 2013]
Safrida, Y. D., Cut, Y., & Cut, N. D. (2012). “Isolasi dan Karakterisasi Bakteri Berpotensi Probiotik pada Ikan Kembung (Rastrelliger sp.)”. Depik, 1(3): 200-203.
Sartika, R. (2010). Pengaruh Suhu Dan Kelembaban Udara Terhadap Shelf-Life Dan Karakteristik Buah Manggis (Garcinia mangostana L.)
Selama Penyimpanan. [Online] Tersedia:
Schlegel, H, G. (1994). Mikrobiologi umum. Yogyakarta: Gajah Mada University Press.
Siallagan, J. (2012). Optimasi Teknik Sterilisasi Eksplan Lapang Nanas Asal Sipahutar (Ananas Comosus L.) Secara In Vitro. Undergraduate
Thesis pada Universitas Negeri Medan: diterbitkan. [Online] Tersedia: digilib.unimed.ac.id/UNIMED-Undergraduate-0122212/2276[9 September 2013]
Siddiqui, Z.A. (2006). PGPR: Biocontrol and Biofertilization. Netherlands: Springer.
Sinaga, E. (2009). Isolasi Dan Uji Kemampuan Antifungal Bakteri Endofit Dari Andaliman (Zanthozylum acanthopodium Dc.) Terhadap Fungi
Perusak Makanan. Skripsi Sarjana pada FMIPA UNSU: diterbitkan.
[Online] Tersedia: repository.usu.ac.id/bitstream/123456789/16602/7 [9 September 2013]
Sinha, N., Jiwan, S., Jozsef, B., James, W., & Pilar, C. (2012). Handbook of Fruits and Fruit Processing Second Edition. USA: Willey
Blackwell.
Slamet. (2009). Isolasi dan Identifikasi Bakteri Limbah Cair pada Instalasi Pengolahan Air Limbah (IPAL) Terpadu Cisirung Dayeuh Kolot
Bandung. Skripsi Sarjana pada FPMIPA UPI Bandung : Tidak
diterbitkan.
Siregar, M, W. (2009). Isolasi Dan Uji Kemampuan Bakteri Endofit Penghasil Hormon IAA (Indole Acetic Acid) Dari Akar Tanaman Padi (Oryza
Sativa L.). Skripsi Sarjana pada UNSU Medan: diterbitkan.[Online] Tersedia: repository.usu.ac.id/bitstream/123456789/16624/6 [9 September 2013]
Indri Rahmithasuci, 2013
Sunarjono, H. (2008). Berkebun 21 Jenis Tanaman Buah. Jakarta: Penebar Swadaya.
Sunatmo. (2007). Experimen Mikrobiologi dalam Laboratorium. Jakarta: Ardy Agency.
Susanti, D. (2012). Kajian Pemanfaatan Enzim Bromeilin Dari Limbah Kulit Nanas (Ananas Comosus (L.) Merr.) Untuk Melunakkan Daging.
Undergraduate Theses pada Pendidikan Kimia Universitas Negeri
Medan: diterbitkan. [Online] Tersedia:
digilib.unimed.ac.id/UNIMED-Undergraduate-0122016/22569 [9 September 2013]
Susiwi, S. (2009). Penilaian Organoleptik. Handout mata kuliah Regulasi Pangan (KI 531). FPMIPA UPI.
Suyati. (2010). Identifikasi Dan Uji Antibiotik Bakteri Gram-Negatif Pada Sampel Urin Penderita Infeksi Saluran Kemih (Isk). Skripsi Sarjana
pada FMIPA Universitas Negeri Papua Manokwari: diterbitkan. [Online] Tersedia: http://ebookbrowsee.net/suyati-identifikasi-antibiotik-bakteri-gram-negatif-pd-sample-urin-pdf-pdf-d453553092 [9 September 2013]
Thomas, M., Mardiah., Mustafa., & Abdi, S. (2011). Teknik Isolasi dan Klutur. Laboratorium Terpadu Program Magister Biomedik. UNSU
Widyastuti, Y., Ratnakomala, S., & Ekawati, F. (1998). “Bakteri asam laktat pada buah-buahan tropis”. Pertemuan Ilmiah Tahunan Permi’98. Bandar Lampung.
Winarno, F, G., & Wirakartakusumah, M, A. (1981). Fisiologi lepas panen. Jakarta: Sastra Hudaya.
Zhikry, F., Sukarmin., & Ihsan, F. (2012). Teknik Karakterisasi Kuantitatif Beberapa Aksesi Nenas. Buletin Teknik Pertanian. Balai Penelitian