1 INTISARI
Manggis (Garcinia mangostana L.) diketahui memiliki aktivitas sebagai antioksidan. Ekstrak kulit manggis diformulasikan dalam bentuk sediaan krim. Penelitian ini bertujuan untuk mengetahui pengaruh PEG 4000 sebagai basis dan propilen glikol sebagai humektan terhadap sifat fisik dan stabilitas fisik sediaan krim, komposisi kedua faktor pada daerah optimum, serta aktivitas antioksidan sediaan krim.
Penelitian ini merupakan rancangan eksperimental menggunakan desain faktorial dua faktor (PEG 4000 dan propilen glikol) dan dua level (level tinggi dan level rendah). Optimasi dilakukan pada komposisi PEG 4000 dan propilen glikol dengan parameter sifat fisik meliputi organoleptis, pH, viskositas, daya sebar, pemisahan fase, dan stabilitas sediaan selama uji freeze thaw cycling. Analisis data respon viskositas dan daya sebar serta area optimum dilakukan menggunakan Design Expert 10.0.2 dengan taraf kepercayaan 95%, sedangkan analisis data stabilitas fisik menggunakan RStudio.
Hasil penelitian menunjukkan bahwa PEG 4000 merupakan faktor yang dominan dalam menentukan viskositas sedangkan interaksi antara PEG 4000 dengan propilen glikol merupakan faktor yang dominan dalam menentukan daya sebar. Area optimum tidak dapat ditemukan dalam pembuatan sediaan krim ekstrak kulit manggis. Dari pengujian stabilitas diketahui bahwa sediaan krim ekstrak kulit manggis stabil selama penyimpanan. Ekstrak kulit manggis diketahui memiliki aktivitas antioksidan yang kuat (IC50: 77,767 ppm) sedangkan sediaan krim ekstrak
kulit manggis memiliki aktivitas antioksidan yang sangat lemah (IC50:
2819,788 450,407 untuk formula 1; 2633,214 308,945 untuk formula a; 3650,468 215,020 untuk formula b; 6335,629 1252,760 untuk formula ab).
2 ABSTRACT
Mangosteen (Garcinia mangostana L.) has known to have an activity as antioxidant. In this study, mangosteen pericarp extract formulated into cream formulation. The aims of this study were to determine the effect of PEG 4000 as cream bases and propylene glycol as humectant, composition of the two factors on optimum area, and antioxidant activity of cream.
This study was an experimental using factorial design with two factors (PEG 4000 and propylene glycol) and two levels (high and low). Optimization was done on the composition of PEG 4000 and propylene glycol with physical properties such as organoleptic, pH, viscosity, spreadability, phase separation, and cream stability during freeze thaw cycling test. Viscosity, spreadability, and optimum area were analyzed using Design Expert 10.0.2 with confidence interval 95%, meanwhile physical stability data were analyzed using RStudio.
Results showed that PEG 4000 was a dominant factor in determining the viscosity, and interaction between PEG 4000 and propylene glycol was a dominant factor in determining the spreadability. Optimum area of cream of mangosteen pericarp extract was not found. Cream of mangosteen pericarp extract was stable during stability testing. Mangosteen pericarp extract showed high antioxidant activity (IC50: 77,767 ppm) meanwhile cream of mangosteen pericarp extract had very low antioxidant activity (IC50: 2819,788 450,407 for formula 1; 2633,214 308,945 for formula a; 3650,468 215,020 for formula b; 6335,629 1252,760 for formula ab).
OPTIMASI PEG 4000 SEBAGAI BASIS DAN PROPILEN GLIKOL SEBAGAI HUMEKTAN PADA SEDIAAN KRIM EKSTRAK KULIT MANGGIS
(Garcinia mangostana L.) SERTA UJI AKTIVITAS ANTIOKSIDAN
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh :
Clarisa Dian
NIM : 128114155
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
i
OPTIMASI PEG 4000 SEBAGAI BASIS DAN PROPILEN GLIKOL SEBAGAI HUMEKTAN PADA SEDIAAN KRIM EKSTRAK KULIT MANGGIS
(Garcinia mangostana L.) SERTA UJI AKTIVITAS ANTIOKSIDAN
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh :
Clarisa Dian
NIM : 128114155
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
iv
HALAMAN PERSEMBAHAN
Skripsi ini saya persembahkan untuk:
Tuhan Yesus Kristus
vii
PRAKATA
Puji dan syukur penulis haturkan kepada Tuhan Yang Maha Esa atas segala berkat dan penyertaanNya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Optimasi PEG 4000 Sebagai Basis dan Propilen Glikol Sebagai Humektan
Pada Sediaan Krim Ekstrak Kulit Manggis (Garcinia mangostana L.) Serta Uji Aktivitas Antioksidan” dengan baik. Skripsi ini disusun untuk memenuhi salah satu syarat dalam memperoleh gelar Sarjana Farmasi (S.Farm) pada program studi Farmasi.
Penyelesaian skripsi ini tidak lepas dari dukungan, bantuan, bimbingan, kritik serta saran dari berbagai pihak. Oleh karena itu penulis ingin menyampaikan terimakasih kepada:
1. Ibu Aris Widayati, M.Si., Apt., PH.D., selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Bapak Dr. T.N. Saifullah Sulaiman, M.Si., Apt. selaku dosen pembimbing skripsi atas waktu, dukungan, arahan, dan semangat yang telah diberikan selama penelitian hingga penyusunan skripsi.
3. Ibu Wahyuning Setyani, M.Sc., Apt., selaku dosen penguji yang telah memberikan waktu, arahan, dan masukan yang bermanfaat bagi penulis.
viii
5. Segenap dosen Fakultas Farmasi Universitas Sanata yang telah membagikan ilmunya selama penulis menempuh perkuliahan.
6. Segenap laboran, staf kebersihan, dan staf keamanan atas bantuan dan kerjasamanya selama penelitian berlangsung.
7. Mimi, Linda, dan Vivin selaku rekan skripsi selama penelitian atas dukungan, bantuan, dan kebersamaannya dalam melakukan penelitian.
8. Sahabatku Bonifasia Anna Carissa dan Kresensia T. Hasrat atas kebersamaan, semangat, motivasi, bantuan yang diberikan.
9. Semua teman-teman FST 2012 dan angkatan 2012 atas kebersamaannya selama perkuliahan.
10. Semua pihak dan teman-teman yang telah membantu penulis selama pelaksanaan penelitian dan penyusunan skripsi yang tidak dapat disebutkan satu per satu.
ix
DAFTAR ISI
HALAMAN JUDUL... i
HALAMAN PERSETUJUAN PEMBIMBING... ii
HALAMAN PENGESAHAN... iii
HALAMAN PERSEMBAHAN... iv
PERNYATAAN KEASLIAN KARYA... v
PERSETUJUAN PUBLIKASI... vi
2. Keaslian penelitian... 4
3. Manfaat Penelitian... 5
B. Tujuan Penelitian... 6
1. Tujuan umum... 6
2. Tujuan khusus... 6
BAB II PENELAAHAN PUSTAKA... 7
A. Manggis (Garcinia mangostana L.)... 7
B. Antioksidan... 9
1. Metode ORAC (Oxygen Radical Absorption Capacity)... 10
2. Metode TRAP (Total Radical – Trapping Antioxidant Parameter)... 11
3. Metode ABTS (2,2’-azino-bis(3-ethylbenzthiazoline-6-sulphonic acid))... 11
4. Metode diena terkonjugasi... 12
5. Metode DPPH (1,1-diphenyl-2-picrylhydrazyl)... 12
C. Krim... 13
D. Desain Faktorial... 30
E. Landasan Teori... 31
F. Hipotesis... 33
BAB III METODE PENELITIAN... 34
A. Jenis dan Rancangan Penelitian... 34
B. Variabel Penelitian dan Definisi Operasional... 34
1. Variabel penelitian... 34
2. Definisi operasional... 35
C. Bahan Penelitian... 36
x
E. Tata Cara Penelitian... 37
1. Identifikasi ekstrak kering kulit manggis (Garcinia mangostana L.)... 37
2. Pembuatan ekstrak kental kulit manggis (Garcinia mangostana L.)... 37
3. Uji aktivitas antioksidan ekstrak kulit manggis (Garcinia mangostana L.)... 37
4. Formula sediaan krim ekstrak kulit manggis (Garcinia mangostana L.) 38 5. Pembuatan sediaan krim ekstrak kulit manggis (Garcinia mangostana L.)... 39
6. Uji sifat fisika kimia sediaan krim ekstrak kulit manggis (Garcinia mangostana L.)... 40
7. Uji stabilitas sediaan krim ekstrak kulit manggis (Garcinia mangostana L.)... 41
8. Uji aktivitas antioksidan sediaan krim ekstrak kulit manggis (Garcinia mangostana L.) dengan metode DPPH... 42
F. Analisis Hasil... 43
BAB IV HASIL DAN PEMBAHASAN... 44
A. Identifikasi Ekstrak Kering Kulit Manggis (Garcinia mangostana L.)... 44
B. Pembuatan Ekstrak Kental Kulit Manggis (Garcinia mangostana L.)... 45
C. Uji Aktivitas Antioksidan Ekstrak Kulit Manggis (Garcinia mangostana L.)... 46
1. Penentuan panjang gelombang maksimum DPPH... 46
2. Penetapan operating time... 47
3. Pengukuran aktivitas antioksidan ekstrak kulit manggis... 47
D. Orientasi Level dari Kedua Faktor Penelitian... 48
E. Hasil Pengujian Sifat Fisik Krim Ekstrak Kulit Manggis... 49
1. Organoleptis... 50
2. Uji pH... 50
3. Uji viskositas... 51
4. Uji daya sebar... 55
5. Uji sifat alir... 59
6. Optimasi formula... 60
F. Hasil Pengujian Stabilitas Fisik Krim Ekstrak Kulit Manggis... 62
1. Uji sentrifugasi... 62
2. Uji freeze thaw cycling... 62
G. Hasil Uji Aktivitas Antioksidan Krim Ekstrak Kulit Manggis... 64
BAB V KESIMPULAN DAN SARAN... 68
A. Kesimpulan... 68
B. Saran... 68
DAFTAR PUSTAKA... 69
LAMPIRAN... 75
xi
DAFTAR TABEL
Tabel I. Tingkat aktivitas antioksidan dengan metode DPPH... 13
Tabel II Rancangan percobaan desain faktorial dengan dua faktor dan dua level... 30
Tabel III. Formula acuan sediaan krim... 39
Tabel IV. Formula sediaan krim ekstrak kulit manggis... 39
Tabel V. Hasil identifikasi ekstrak kering kulit manggis... 44
Tabel VI. Hasil penetapan operating time... 47
Tabel VII. Variasi konsentrasi PEG 4000 terhadap respon viskositas dan daya sebar... 48
Tabel VIII. Variasi konsentrasi propilen glikol terhadap respon viskositas dan daya sebar... 49
Tabel IX. Hasil pengujian organoleptis krim ekstrak kulit manggis... 50
Tabel X. Hasil pengujian pH krim ekstrak kulit manggis... 51
Tabel XI. Hasil pengujian viskositas krim ekstrak kulit manggis... 51
Tabel XII. Efek PEG 4000, propilen glikol, dan interaksinya terhadap respon viskositas... 53
Tabel XIII. Hasil pengujian daya sebar krim ekstrak kulit manggis... 55
Tabel XIV. Efek PEG 4000, propilen glikol, dan interaksinya terhadap respon daya sebar... 57
Tabel XV. Hasil pengujian sifat alir krim ekstrak kulit manggis... 60
Tabel XVI. Hasil validasi krim ekstrak kulit manggis... 61
Tabel XVII. Hasil pengujian sentrifugasi krim ekstrak kulit manggis... 62
xii
DAFTAR GAMBAR
Gambar 1. Buah manggis... 7
Gambar 2. Struktur xanton... 8
Gambar 3. Struktur polietilen glikol... 19
Gambar 4. Struktur propilen glikol... 20
Gambar 5. Struktur asam stearat... 20
Gambar 6. Struktur trietanolamin... 21
Gambar 7. Struktur metil paraben... 21
Gambar 8. Struktur setil alkohol... 22
Gambar 9. Kurva sistem Newtonian... 25
Gambar 10. Kurva sistem plastis... 26
Gambar 11. Kurva sistem pseudoplastis... 26
Gambar 12. Kurva sistem dilatan... 27
Gambar 13. Ekstrak kering kulit manggis... 44
Gambar 14. Ekstrak kental kulit manggis... 45
Gambar 15. Hasil penentuan panjang gelombang maksimum larutan DPPH... 46 Gambar 16. Kurva konsentrasi (ppm) vs inhibisi (%)... 47
Gambar 17. Contour plot respon viskositas... 52
Gambar 18. Hubungan PEG 4000 terhadap respon viskositas... 54
Gambar 19. Hubungan propilen glikol terhadap respon viskositas... 54
Gambar 20. Contour plot respon daya sebar... 56
Gambar 21. Hubungan PEG 4000 terhadap respon daya sebar... 58
Gambar 22. Hubungan propilen glikol terhadap respon daya sebar... 58
Gambar 23. Kurva sifat alir krim ekstrak kulit manggis... 59
Gambar 24. Contour plot superimposed sediaan krim... 61
Gambar 25. Grafik perubahan viskositas setelah dilakukan pengujian freeze thaw cycling... 63
Gambar 26. Grafik perubahan daya sebar setelah dilakukan pengujian freeze thaw cycling... 64
xiii
DAFTAR LAMPIRAN
Lampiran 1. Certificate of Analysis ekstrak kering kulit manggis... 76
Lampiran 2. Material Safety Data Sheet ekstrak kering kulit manggis... 77
Lampiran 3. Extraction flow chart ekstrak kering kulit manggis... 79
Lampiran 4. Aktivitas antioksidan ekstrak kulit manggis... 80
Lampiran 5. Orientasi level faktor penelitian... 81
Lampiran 6. Data pengukuran viskositas sediaan krim ekstrak kulit manggis... 83
Lampiran 7. Data pengukuran daya sebar sediaan krim ekstrak kulit manggis... 86
Lampiran 8. Optimasi formula... 89
Lampiran 9. Hasil pengukuran sifat alir... 91
Lampiran 10. Hasil uji stabilitas fisik sediaan krim ekstrak kulit manggis... 93
xiv
INTISARI
Manggis (Garcinia mangostana L.) diketahui memiliki aktivitas sebagai antioksidan. Ekstrak kulit manggis diformulasikan dalam bentuk sediaan krim. Penelitian ini bertujuan untuk mengetahui pengaruh PEG 4000 sebagai basis dan propilen glikol sebagai humektan terhadap sifat fisik dan stabilitas fisik sediaan krim, komposisi kedua faktor pada daerah optimum, serta aktivitas antioksidan sediaan krim.
Penelitian ini merupakan rancangan eksperimental menggunakan desain faktorial dua faktor (PEG 4000 dan propilen glikol) dan dua level (level tinggi dan level rendah). Optimasi dilakukan pada komposisi PEG 4000 dan propilen glikol dengan parameter sifat fisik meliputi organoleptis, pH, viskositas, daya sebar, pemisahan fase, dan stabilitas sediaan selama uji freeze thaw cycling. Analisis data respon viskositas dan daya sebar serta area optimum dilakukan menggunakan Design Expert 10.0.2 dengan taraf kepercayaan 95%, sedangkan analisis data stabilitas fisik menggunakan RStudio.
Hasil penelitian menunjukkan bahwa PEG 4000 merupakan faktor yang dominan dalam menentukan viskositas sedangkan interaksi antara PEG 4000 dengan propilen glikol merupakan faktor yang dominan dalam menentukan daya sebar. Area optimum tidak dapat ditemukan dalam pembuatan sediaan krim ekstrak kulit manggis. Dari pengujian stabilitas diketahui bahwa sediaan krim ekstrak kulit manggis stabil selama penyimpanan. Ekstrak kulit manggis diketahui memiliki aktivitas antioksidan yang kuat (IC50: 77,767 ppm) sedangkan sediaan krim ekstrak kulit manggis memiliki aktivitas antioksidan yang sangat lemah (IC50: 2819,788 450,407 untuk formula 1; 2633,214 308,945 untuk formula a; 3650,468 215,020 untuk formula b; 6335,629 1252,760 untuk formula ab).
xv ABSTRACT
Mangosteen (Garcinia mangostana L.) has known to have an activity as antioxidant. In this study, mangosteen pericarp extract formulated into cream formulation. The aims of this study were to determine the effect of PEG 4000 as cream bases and propylene glycol as humectant, composition of the two factors on optimum area, and antioxidant activity of cream.
This study was an experimental using factorial design with two factors (PEG 4000 and propylene glycol) and two levels (high and low). Optimization was done on the composition of PEG 4000 and propylene glycol with physical properties such as organoleptic, pH, viscosity, spreadability, phase separation, and cream stability during freeze thaw cycling test. Viscosity, spreadability, and optimum area were analyzed using Design Expert 10.0.2 with confidence interval 95%, meanwhile physical stability data were analyzed using RStudio.
Results showed that PEG 4000 was a dominant factor in determining the viscosity, and interaction between PEG 4000 and propylene glycol was a dominant factor in determining the spreadability. Optimum area of cream of mangosteen pericarp extract was not found. Cream of mangosteen pericarp extract was stable during stability testing. Mangosteen pericarp extract showed high antioxidant activity (IC50: 77,767 ppm) meanwhile cream of mangosteen pericarp extract had very low antioxidant activity (IC50: 2819,788 450,407 for formula 1; 2633,214 308,945 for formula a; 3650,468 215,020 for formula b; 6335,629 1252,760 for formula ab).
1
BAB I PENDAHULUAN
A. Latar Belakang
Sumber polusi mengandung senyawa radikal bebas yang berbahaya bagi kulit. Radikal bebas merupakan molekul yang tidak stabil karena kehilangan elektronnya dan akan menyerang tubuh kita terutama merusak protein, sel dan jaringan dalam organ tubuh (Paramawati, 2010).
Pembentukan radikal bebas yang merusak tubuh ini dapat dihambat oleh senyawa antioksidan. Antioksidan merupakan senyawa yang dapat menghambat oksigen reaktif dan radikal bebas dalam tubuh dengan memberikan satu atau lebih elektron kepada radikal bebas sehingga menjadi bentuk molekul yang normal kembali (Dalimartha dan Soedibyo, 1999). Salah satu tanaman yang memiliki aktivitas antioksidan adalah manggis (Garcinia Mangostana L.).
manggis. α mangostin dapat larut dalam alkohol, eter, aseton, kloroform, dan etil asetat (Pothitirat, et al., 2010) serta stabil terhadap cahaya, panas, dan basa hidrolitik (Yodhnu, Sirikatitham, and Wattanapiromsakul, 2009). Berdasarkan penelitian yang dilakukan oleh Li and Xu (2015), ekstrak etanol kulit manggis memiliki nilai IC50 sebesar 75,9 ppm dan bagian dari tanaman manggis yang memiliki aktivitas antioksidan tertinggi adalah kulit manggis (Palakawong, Sophanodora, Pisuchpen, and Phongpaichit, 2010). Menurut Khonkarn, Okonogi, Ampasavate, and
Anuchapreeda (2010), aktivitas antioksidan pada kulit manggis (TEAC: 15 mM/mg) lebih tinggi dibandingkan dengan vitamin E (TEAC: 9 mM/mg).
ketika diformulasikan dalam bentuk sediaan krim memiliki nilai IC50 sebesar 18,234 ppm.
Basis merupakan komponen penting yang dapat mempengaruhi sifat fisik dan pelepasan zat aktif dari sediaan krim yang dihasilkan (Joenoes, 2006). Pada penelitian ini basis yang digunakan adalah PEG 4000 karena toksisitasnya yang rendah, dapat meningkatkan kelarutan bahan obat yang terdispersi dalam sediaan serta meningkatkan stabilitas fisik dan kimia suatu sediaan (Knop, Hoogenboom, Fischer, and Schubert, 2010). Selain itu, PEG 4000 memiliki daya lekat dan distribusi yang
baik pada kulit, tidak menghambat pertukaran gas dan produksi keringat serta memiliki sifat bakterisida sehingga lebih stabil pada saat penyimpanan (Voigt, 1984). Pada sediaan krim, PEG 4000 memiliki sifat melembabkan kulit tanpa meninggalkan rasa lengket atau berminyak (Clariant, 2014).
Dalam formulasi sediaan krim, basis dan humektan memiliki peranan yang penting dalam menentukan sifat fisik dan stabilitas fisik sediaan krim, oleh karena itu perlu dilakukan optimasi terhadap penggunaan PEG 4000 sebagai basis dan propilen glikol sebagai humektan untuk mendapatkan sediaan krim dengan sifat fisik dan stabilitas fisik yang baik.
1. Rumusan masalah
Berdasarkan latar belakang yang telah dipaparkan, terdapat beberapa rumusan masalah yang diteliti, yaitu:
a. Bagaimana pengaruh PEG 4000 dan propilen glikol terhadap sifat fisik sediaan krim ekstrak kulit manggis?
b. Berapa komposisi PEG 4000 dan propilen glikol pada daerah optimum sehingga dihasilkan sediaan krim dengan sifat fisik yang baik?
c. Bagaimana stabilitas fisik sediaan krim ekstrak kulit manggis setelah dilakukan uji sentrifugasi dan freeze thaw cycling?
d. Bagaimana aktivitas antioksidan ekstrak kulit manggis dan sediaan krim ekstrak kulit manggis?
2. Keaslian penelitian
Penelitian lain yang telah dilakukan antara lain:
b. Optimasi Humektan Propilen Glikol dan Gelling Agent Carbopol 940 dalam Sediaan Gel Penyembuh Luka Ekstrak Daun Petai Cina (Leucaena leucocephala (Lam.) de Wit.): Aplikasi Desain Faktorial yang dilakukan oleh Veronica, 2013. Pengaruh Lama dan Suhu Sterilisasi Panas Basah terhadap Viskositas dan Daya Sebar Sediaan Emulgel Anti-Acne Ekstrak Kulit Buah Manggis (Garcinia mangostana L.) yang dilakukan oleh Cahyono, 2014.
c. Kualitas Losion Ekstrak Kulit Buah Manggis yang dilakukan oleh Dewi, 2014. Formulasi Gel Ekstrak Etanol Kulit Buah Manggis (Garcinia mangostana L.) dengan Variasi Gelling Agent Sebagai Sediaan Luka Bakar yang dilakukan oleh Maulina dan Sugihartini, 2015.
Sejauh penelusuran pustaka yang dilakukan peneliti, penelitian mengenai Optimasi PEG 4000 sebagai Basis dan Propilen Glikol sebagai Humektan pada Sediaan Krim Ekstrak Kulit Manggis (Garcinia Mangostana L.) serta Uji Aktivitas Antioksidan belum pernah dilakukan.
3. Manfaat penelitian a. Manfaat teoritis
b. Manfaat praktis
Hasil penelitian ini diharapkan dapat menghasilkan sediaan krim ekstrak kulit manggis yang memiliki sifat fisik dan stabilitas yang baik.
B. Tujuan Penelitian
1. Tujuan umum
Menghasilkan formula sediaan krim antioksidan ekstrak kulit manggis yang memiliki sifat fisik dan stabilitas fisik yang baik.
2. Tujuan khusus
a. Mengetahui pengaruh PEG 4000 dan propilen glikol terhadap sifat fisik sediaan krim ekstrak kulit manggis.
b. Mengetahui komposisi PEG 4000 dan propilen glikol pada daerah optimum sehingga dihasilkan sediaan krim dengan sifat fisik yang baik.
c. Mengetahui stabilitas fisik sediaan krim ekstrak kulit manggis setelah dilakukan uji sentrifugasi dan freeze thaw cycling.
7
BAB II
PENELAAHAN PUSTAKA
A. Manggis (Garcinia mangostana L.)
Gambar 1. Buah manggis (Yaacob and Tindall, 1995)
Manggis (Garcinia mangostana L.) (gambar 1) merupakan tanaman tropis yang berasal dari India, Myanmar, dan Sri Lanka. Tanaman manggis masuk ke dalam famili Guttiferae dan genus Garcinia. Terdapat 400 spesies dalam genus Garcinia dan 77 spesies di antaranya terdapat di Indonesia (Sulassih, Sobir, and Santosa, 2013).
Klasifikasi tanaman manggis adalah sebagai berikut: Kingdom : Plantae
Subkingdom : Tracheobionta Superdivisi : Spermatophyta Divisi : Magnoliophyta Kelas : Magnoliopsida Subkelas : Dilleniidae Ordo : Theales
Genus : Garcinia L.
Spesies : Garcinia mangostana L. (Yaacob and Tindall, 1995) Tanaman manggis merupakan pohon dengan tinggi 7-25 m, memiliki batang berwarna coklat keabu-abuan dengan diameter 40-80 cm. Daunnya berwarna hijau, kaku, mengkilap, berbentuk lonjong, berujung lancip, dan terletak berhadapan. Daun yang kecil berukuran 8 x 4 cm sedangkan daun yang besar berukuran 12 x 5 cm. Bunga manggis berwarna merah muda dan terletak di ujung cabang daun. Buah manggis berwarna ungu tua atau ungu kemerahan dan memiliki diameter 4-6,5 cm. Daging buahnya berwarna putih dan memiliki rasa yang manis. Kulit buah bagian dalam berwarna merah dan tebal (Suhono dan tim peneliti LIPI, 2010).
Kulit buah manggis telah digunakan sejak lama sebagai pengobatan untuk penyembuhan luka dan infeksi kulit, penyakit diare (diare kronis pada anak-anak) dan disentri (Pedrazza-Chaverri et al., 2008). Kulit buah manggis memiliki kandungan xanton yang tinggi serta mengandung zat bioaktif lain seperti tanin, flavonoid, dan polifenol (Pothitirat, Chomnawang, and Gritsanapan, 2010).
Xanton atau xanten-9H-on adalah metabolit sekunder yang umumnya terdapat pada beberapa tanaman dengan tingkat famili yang tinggi, jamur, dan lichens. (Peres, Nagem, and De Oliveira, 2000). Xanton dapat diisolasi dari kulit buah, buah, kulit kayu, dan daun tanaman manggis. Beberapa studi menyatakan bahwa xanton yang berasal dari manggis memiliki aktivitas biologis seperti antioksidan, antiinflamasi, antialergi, antibakteri, antijamur, dan antivirus. Senyawa xanton yang telah diidentifikasi antara lain α mangostin, mangostin, mangostin, garcinon E, dan gartanin (Suksamrarn et al., 2006; Pedraza-Chaverri et al., 2008). Berdasarkan strukturnya, xanton tergolong senyawa aromatik sederhana, seperti dibenzofuran, dibenzopiran, dan griseofulvin. Umumnya xanton berbentuk kristal jarum berwarna kuning dengan titik leleh 173-176oC (Yatman, 2012). α mangostin merupakan senyawa golongan xanton yang memiliki kandungan terbesar dalam kulit manggis. α mangostin dapat larut dalam alkohol, eter, aseton, kloroform, dan etil asetat (Pothitirat, et al., 2010). Berdasarkan penelitian yang dilakukan oleh Yodhnu, Sirikatitham, and Wattanapiromsakul (2009), α mangostin stabil terhadap cahaya, panas, dan basa hidrolitik.
B. Antioksidan
Antioksidan dapat dibagi menjadi 2 golongan yaitu antioksidan primer dan antioksidan sekunder. Antioksidan primer (AH) berperan dalam menghambat tahap inisiasi dengan bereaksi terhadap radikal lipid atau menghambat tahap propagasi dengan bereaksi terhadap peroksil atau radikal alkoksil. Sedangkan antioksidan sekunder berperan dalam memperlambat laju oksidasi (Antolovich, Prenzler, Patsalides, McDonald, and Robards, 2002).
Radikal bebas merupakan molekul yang tidak stabil karena kehilangan elektronnya. Perubahan menjadi stabil dapat dilakukan dengan mengambil elektron dari molekul atau sel lain dalam tubuh kita. Proses pengambilan elektron dari sel-sel tubuh kita menyebabkan kerusakan sel. Radikal bebas akan menyerang tubuh kita terutama merusak protein, sel dan jaringan dalam organ tubuh. Bentuk serangan tersebut sebenarnya merupakan upaya radikal bebas untuk menstabilkan diri (Paramawati, 2010).
Beberapa metode yang dapat digunakan untuk uji aktivitas antioksidan: 1. Metode ORAC (Oxygen Racical Absorption Capacity)
(TE) dalam satuan μmol. Kelebihan metode ORAC adalah metode ini sangat akurat karena menggunakan pengukuran fluoresensi dan juga efisien karena tidak banyak menggunakan reagen. Kekurangannya adalah metode ini hanya menunjukkan aktivitas terhadap radikal bebas tertentu, yaitu radikal peroksil (Prior, Wu, and Schaich, 2005).
2. Metode TRAP (Total Radical –Trapping Antioxidant Parameter)
Metode TRAP memiliki prinsip yaitu pengukuran kemampuan senyawa antioksidan untuk menghambat reaksi antara radikal peroksil AAPH atau ABAP dengan target. Metode TRAP ini biasanya dikombinasikan dengan penggunaan luminol-enhanced chemiluminescence (CL) sebagai marker. Hasil uji ini
diinterpretasikan sebagai jumlah (μmol) radikal peroksil yang terperangkap dalam 1
L plasma. Metode TRAP merupakan metode yang paling banyak digunakan untuk mengukur antioksidan dalam sampel plasma atau serum secara in vivo karena metode ini dapat mengukur antioksidan non enzimatik seperti glutathione, asam askorbat, dan α tokoferol (Pisoschi and Negulescu, 2011).
3. Metode ABTS (2,2’-azino-bis(3-ethylbenzthiazoline-6-sulphonic acid))
sederhana sehingga banyak digunakan untuk mengukur aktivitas antioksidan. (Pisoschi and Negulescu, 2011).
4. Metode diena terkonjugasi
Metode ini merupakan teknik untuk mengetahui oksidasi lipid. Substrat yang digunakan dalam metode pengujian ini adalah senyawa apapun yang mengandung polyunsaturated fatty acid yang dioksidasi dengan penambahan ion tembaga, besi,
AAPH atau DPPH. Selanjutnya lipid akan mengalami pemisahan hidrogen dari gugus CH2 dan produk akan menstabilkan diri dengan membentuk diena terkonjugasi. Penghitungan diena terkonjugasi yang terbentuk dilakukan dengan menghitung peningkatan absorbansi per massa sampel pada suatu waktu tertentu menggunakan spektrofotometri. Kelebihan metode ini adalah metode ini dapat mengukur proses oksidasi pada tahap awal, namun metode ini tidak dapat memberikan informasi mengenai struktur senyawa yang diteliti. Selain itu, metode ini juga tidak dapat dilakukan secara langsung pada jaringan dan cairan tubuh karena banyaknya senyawa yang dapat menggangu pengukuran aktivitas antioksidan (Antolovich et al., 2002). 5. Metode DPPH (1,1-diphenyl-2-picrylhydrazyl)
metode DPPH adalah reduksi larutan metanolik radikal bebas berwarna (DPPH) dengan cara penangkapan radikal bebas (Shivaprasad, Mohan, Kharya, Shiradkar, and Lakshman, 2005). Metode DPPH dapat digunakan baik pada pengujian kualitatif
maupun kuantitatif (Sarker, Latif, and Gray, 2006). Metode DPPH merupakan metode yang sederhana, cepat, sensitif, dan reprodusibel untuk pengujian aktivitas antioksidan (Savatoric, Cetkovic, Canadanovic-Brunet, and Djilas, 2012). Hasil uji diinterpretasikan dalam nilai IC50, konsentrasi antioksidan yang dibutuhkan untuk menurunkan konsentrasi awal DPPH (radikal bebas) sebesar 50% (Shivaprasad, et al., 2005).
Tingkat aktivitas antioksidan menggunakan metode DPPH dapat digolongkan berdasarkan nilai IC50 seperti pada tabel I (Jun, Yu, Fong, Wan, Yang, and Ho, 2003).
Tabel I. Tingkat aktivitas antioksidan dengan metode DPPH (Jun et al., 2003). membutuhkan spektrofotometer UV-vis. Namun interpretasi hasil dapat menjadi sulit apabila senyawa uji memiliki panjang gelombang yang melampaui panjang gelombang DPPH (Prior et al., 2005).
C. Krim
krim larut air (vanishing cream). Krim lebih disukai dibandingkan dengan salep karena sifatnya yang lebih mudah menyebar (Singh and Naini, 2002).
Krim yang dapat dicuci dengan air (M/A) ditujukan untuk penggunaan kosmetik dan estetika (Syamsuni, 2005). Tipe air dalam minyak (A/M) tidak larut dalam air dan tidak dapat dicuci dengan air, sedangkan tipe minyak dalam air (M/A) dapat bercampur dan dapat dicuci dengan air serta tidak berminyak (Allen, 1999). Terdapat berbagai jenis krim, antara lain:
1. Cleansing cream
Cleansing cream digunakan sebagai pembersih untuk make up, minyak, air,
dan kotoran yang menempel pada wajah. Karakteristik cleansing cream yang baik yaitu:
a. Dapat menghilangkan minyak dan air yang menempel pada kulit b. Stabil secara fisika dan kimia
c. Dapat menyebar dengan baik 2. Vanishing cream
Vanishing cream dimaksudkan untuk langsung berpenetrasi ke dalam kulit.
Vanishing cream juga dikenal sebagai krim stearat karena penggunaan asam stearat
3. Foundation cream
Foundation cream digunakan sebagai basis emolien atau dasar untuk aplikasi
bedak wajah dan sediaan make up lainnya sehingga dapat melekat lebih lama pada kulit, umumnya merupakan tipe emulsi M/A.
4. Hand and body cream
Hand and body cream bertujuan untuk melembabkan kulit, memberikan
lapisan untuk memproteksi kulit, dan menjaga agar kulit tetap lembut namun tidak
berminyak. (Pawar, 2013)
Komponen penyusun dalam sediaan krim yaitu: 1. Basis
Basis sediaan krim diklasifikasikan berdasarkan komposisi dan karakteristik fisiknya, antara lain basis hidrokarbon (oleaginous bases), basis absorpsi, basis yang dapat larut dalam air, dan basis yang dapat dicuci dengan air. Pemilihan basis tergantung pada aktivitas yang diinginkan (topikal, perkutan), kompatibilitas dengan senyawa lain, stabilitas fisik dan mikroba sediaan, daya sebar dan daya tuang formula, durasi kontak sediaan terhadap tempat aplikasi, dan kemudahan untuk dihilangkan dari tempat aplikasi.
berminyak. Contoh basis hidrokarbon yaitu Petrolatum USP, white petrolatum USP, yellow ointment USP, dan white ointment USP.
b. Basis absorpsi. Basis ini memiliki sifat yang kurang melembabkan kulit bila dibandingkan dengan basis hidrokarbon karena mengandung air dalam jumlah sedikit. Sama seperti basis hidrokarbon, basis absorpsi juga sulit dihilangkan dari kulit karena sifatnya yang hidrofobik. Contoh basis absorpsi yaitu hydrophilic petrolatum USP dan lanolin USP.
c. Basis cuci air. Basis ini dikenal juga dengan basis M/A. Tidak seperti basis hidrokarbon dan basis absorpsi, basis cuci air mudah dihilangkan dari kulit karena mengandung air dalam jumlah banyak. Contoh basis cuci air yaitu hydrophilic ointment USP.
d. Basis larut air. Basis ini dapat dihilangkan dari kulit karena sama sekali tidak mengandung fase minyak sehingga larut dalam air. Contoh basis larut air yaitu polyethylene glycol (PEG) ointment National Folmulary (NF).
(Mahalingam, Li, and Jasti, 2008) 2. Humektan
humektan yang dapat digunakan dengan konsentrasi sekitar 5% untuk aplikasi eksternal (Billany, 2002).
3. Emulsifying agents
Emulsifying agents (emulgator) dibutuhkan dalam formulasi krim untuk
menstabilkan sediaan krim agar fase minyak dan fase air tidak memisah. Pemilihan emulgator berdasarkan pada tipe emulsi sediaan, tujuan penggunaan, dan toksisitas. Terdapat empat kategori emulgator yang digunakan dalam formulasi krim, yaitu:
a. Anionik. Tipe emulgator ini menurunkan tegangan permukaan dengan menghasilkan ion bermuatan negatif. Penggunaannya terbatas hanya pada pemakaian eksternal karena tipe emulgator ini lebih toksik dibandingkan tipe emulgator lain. Emulgator anionik dapat digunakan untuk tipe emulsi M/A dan A/M. Contoh emulgator anionik yaitu sodium oleat, kalsium stearat, dan trietanolaminstearat.
c. Non ionik. Tipe emulgator ini merupakan tipe yang paling banyak digunakan dalam sediaan emulsi, umumnya digunakan dua emulgator non ionik (hidrofil dan lipofil) untuk menstabilkan tegangan antar permukaan kedua fase. Contoh emulgator non ionik yaitu golongan span, golongan tween, dan setil alkohol. d. Amfoterik. Tipe emulgator ini memiliki ion bermuatan positif dan negatif (berperan sebagai kationik pada pH rendah dan sebagai anionik pada pH tinggi). Contoh emulgator amfoterik adalah lesitin yang berperan dalam pembuatan tipe emulsi M/A.
(Jones, 2008) 4. Viscosity modifiers
Viskositas emulsi dan sediaan krim dapat mempengaruhi stabilitas fisik sediaan dengan menurunkan kecepatan proses terjadinya creaming. Penggunaan polimer hidrofilik seperti metilselulosa, hidroksietilselulosa, asam poliakrilat, dan CMC-Na dapat meningkatkan viskositas pada fase air (Jones, 2008).
5. Pengawet
Pengawet bertujuan untuk mencegah kontaminasi pada sediaan krim terhadap bakteri dan jamur. Dasar pemilihan bahan pengawet adalah iritasi atau toksisitas yang ditimbulkan oleh senyawa terhadap jaringan di mana sediaan diaplikasikan (Premjeet, Ajay, Sunil, Bhawana, Sahil, Divashish, and Sudeep, 2012).
mudah diinaktivasi oleh faktor eksternal seperti pH dan proses pembuatan sediaan. Faktor lainnya yang harus dipertimbangkan adalah pengemasan karena dapat mempengaruhi aktivitas bahan pengawet, kecepatan adsorpsi senyawa dalam formula, dan kelarutan bahan pengawet. Contoh pengawet yang banyak digunakan antara lain paraben (metil paraben, propil paraben), imidazolidinil urea, diazolidinil urea, benzalkonium klorida, dan formaldehida (Siquet and Devleeschouwer, 2001). 6. Antioksidan
Antioksidan merupakan bahan yang digunakan untuk meningkatkan stabilitas senyawa atau zat aktif terhadap oksidasi. Pada emulsi dan sediaan krim, dua komponen utama yang mudah mengalami oksidasi adalah zat aktif dan fase minyak. Untuk mencegah oksidasi pada fase minyak dapat digunakan antioksidan lipofilik seperti butylated hydroxyanisole (BHA), butylated hydroxytoluene (BHT), dan propil galat. Untuk fase air pada emulsi atau sediaan krim, dapat digunakan antioksidan hidrofilik seperti natrium metabisulfit atau natrium sulfit (Jones, 2008).
Bahan-bahan yang digunakan dalam formulasi sediaan krim ekstrak kulit manggis antara lain:
1. Polietilen glikol
Gambar 3. Struktur polietilen glikol (Wallick, 20009)
merupakan cairan jernih, tidak berwarna atau agak kekuningan. PEG >100 berbentuk padatan putih (Wallick, 2009).
2. Propilen glikol (C3H8O2)
Gambar 4. Struktur propilen glikol (Weller, 2009)
Propilen glikol (gambar 4) berbentuk cairan jernih, kental, tidak berwarna, dan tidak berbau. Mempunyai berat molekul 76,09 dengan titik didih sebesar 188oC dan titik lebur sebesar -59oC. Propilen glikol dapat bercampur dengan aseton, kloroform, etanol (95%), gliserin, dan air; larut dalam eter (1:6). Propilen glikol digunakan sebagai humektan, pelarut, dan pengawet. Konsentrasi propilen glikol yang digunakan sebagai humektan pada sediaan topikal adalah 15% (Weller, 2009).
3. Asam stearat (C18H36O2)
Gambar 5. Struktur asam stearat (Allen, 2009)
emulsifying dan solubilizing agent, ketika secara parsial dinetralkan dengan basa atau
trietanolamin, asam stearat digunakan sebagai basis krim. Rentang konsentrasi asam stearat yang digunakan pada sediaan salep dan krim adalah sebesar 1-20% (Allen, 2009).
4. Trietanolamin (C6H15NO3)
Gambar 6. Struktur trietanolamin (Goskonda, 2009)
Trietanolamin (gambar 6) berbentuk cairan jernih, tidak berbau, dan memiliki berat molekul 149,19 dengan titik didih sebesar 335oC dan titik lebur sebesar 20-21oC. Trietanolamin dapat bercampur dengan aseton; larut dalam benzene (1:24) dan etil eter (1:63); tidak dapat bercampur dengan CCl4, metanol, dan air. Ketika dicampur dengan asam lemak seperti asam stearat atau asam oleat, trietanolamin membentuk sabun anionik dengan pH sekitar 8 dan digunakan sebagai emulsifying agent (Goskonda, 2009).
5. Metil paraben (C8H8O3)
Gambar 7. Struktur metil paraben (Haley, 2009)
125-128oC. Metil paraben larut dalam etanol (1:3), eter (1:10), dan air (1:400). Metil paraben digunakan sebagai pengawet antimikroba pada kosmetik, produk makanan, dan formulasi sediaan. Pada sediaan topikal, rentang konsentrasi metil paraben yang digunakan adalah 0,02-0,3% (Haley, 2009).
6. Setil alkohol (C16H34O)
Gambar 8. Struktur setil alkohol (Unvala, 2009)
Setil alkohol (gambar 8) berbentuk kristal putih, mempunyai berat molekul 242,44 dengan titik didih sebesar 344oC dan titik lebur sebesar 49oC. Setil alkohol mudah larut dalam etanol (95%) dan eter; praktis tidak larut dalam air; dapat bercampur jika dilarutkan dengan lemak, parafin solid dan cair, dan isopropil miristat. Pada formulasi emulsi, lotion, krim, dan salep, setil alkohol digunakan sebagai emulsifying agent (rentang konsentrasi 2-5%) dan stiffening agent (rentang
konsentrasi 2-10%) (Unvala, 2009). 7. Kalium hidroksida (KOH)
larutan serta dapat beraksi dengan asam lemah untuk membentuk garam (Kibbe, 2009).
Kontrol kualitas yang dilakukan pada sediaan krim, antara lain: 1. Organoleptis
Pengujian organoleptis bertujuan untuk mengamati adanya perubahan atau pemisahan emulsi, timbul bau, dan perubahan warna (Budiman, 2008).
2. pH
pH merupakan variabel penting yang bertujuan untuk mengukur keasaman suatu sediaan (Allen, Popovich, and Ansel, 2011). Permukaan kulit memiliki pH pada rentang 4,5-6,5, oleh karena itu pH sediaan yang akan dibuat sebaiknya berada pada rentang tersebut (Tranggono dan Latifah, 2007). Pada rentang pH tersebut, sediaan dapat mempertahankan barrier dan flora alami pada kulit, bahan aktif pada sediaan lebih stabil, dan dapat mengurangi penggunaan bahan pengawet (Wiechers, 2013). 3. Viskositas
Viskositas adalah pertahanan dari suatu cairan untuk mengalir pada suatu tekanan yang diberikan, semakin tinggi viskositas maka semakin besar tahanannya sehingga semakin besar pula gaya yang diperlukan untuk membuat cairan tersebut dapat mengalir (Sinko, 2006).
viskositas absolut, namun terkadang lebih mudah untuk menggunakan skala kinematik dalam satuan stoke dan centistoke (Allen et al., 2011).
4. Daya sebar
Daya sebar adalah kemampuan suatu sediaan untuk menyebar di tempat aplikasi dan merupakan salah satu karakteristik yang bertanggung jawab dalam efektivitas dan penerimaan konsumen dalam menggunakan sediaan semisolid. Penentuan daya sebar dilakukan dengan extensometer, yaitu dengan meletakkan sampel dengan volume tertentu di pusat antara dua lempeng gelas, di mana lempeng sebelah atas dalam waktu tertentu dibebani dengan meletakkan anak timbang di atasnya (Voigt, 1984).
Berdasarkan penelitian yang dilakukan oleh Arvouet-Grand (1995), pengujian daya sebar (ϕ) sediaan krim tipe M/A dilakukan dengan meletakkan sampel sebanyak 1 g di antara dua kaca horizontal berukuran 20 x 20 cm lalu diberi beban seberat 125 g selama 1 menit. Istilah semistiff creams ditujukan pada sampel dengan ϕ 50 mm dan istilah semifluid creams ditujukan untuk sampel dengan ϕ 50-70 mm.
5. Sifat alir
Sifat alir atau rheologi merupakan studi mengenai sifat alir dan deformasi suatu bahan. Sifat alir dapat digolongkan dalam dua sistem, yaitu sistem Newtonian dan non Newtonian. Bahan yang termasuk dalam sistem Newtonian memiliki viskositas yang tergantung pada suhu dan tekanan, sehingga mengakibatkan shear stress linear terhadap shear rate (Marriott, 2002).
Pada sistem Newtonian, gradien kecepatan (velocity gradient) atau shear rate (dv/dr), merupakan perbedaan kecepatan (dv) antara dua bidang suatu cairan yang dipisahkan oleh jarak (dr). Persamaannya sebagai berikut:
……...(1) Viskositas (η) dapat digambarkan dalam persamaan:
...(2) di mana F = F’/A dan G = dv/dr (Allen et al., 2011).
Gambar 9. Kurva sistem Newtonian (Allen et al., 2011)
Suatu cairan dengan sistem Newtonian akan menghasilkan kurva dengan garis lurus (Allen et al., 2011).
Bahan yang viskositasnya berubah ketika suatu tekanan diaplikasikan termasuk dalam sistem non Newtonian. Sistem non Newtonian adalah cairan yang tidak mengikuti hukum Newtonian. Sistem non Newtonian dibagi menjadi tiga, yaitu sistem plastis, sistem pseudoplastis, dan sistem dilatan (Allen et al., 2011).
Gambar 10. Kurva sistem plastis (Allen et al., 2011)
Pada kurva sistem plastis, suatu cairan dapat mengalir apabila yield value sudah terlampaui. Senyawa yang mengikuti sistem plastis disebut Bingham bodies (Allen et al., 2011).
Gambar 11. Kurva sistem pseudoplastis (Allen et al., 2011)
Pada kurva sistem pseudoplastis, suatu cairan mulai mengalir ketika shear stress sudah tercapai dan tidak memerlukan adanya yield value. Seiring dengan
Gambar 12. Kurva sistem dilatan (Allen et al., 2011)
Pada kurva sistem dilatan, viskositas cairan meningkat seiring dengan meningkatnya shear rate. Disebut juga sistem shear-thickening. Sistem ini umumnya memiliki jumlah padatan yang tinggi dalam formulasi (Allen et al., 2011).
Viskositas produk cair komersial seperti krim, losion, dispersi, dan emulsi tidak tergantung pada waktu dan umumnya seiring dengan menurunnya viskositas, shear rate atau shear stress akan meningkat sehingga umumnya krim akan memiliki
tipe alir pseudoplastis (Marriott, 2002). 6. Tipe emulsi
Pengujian tipe emulsi dapat dilakukan dengan beberapa cara, antara lain: a. Metode warna. Terdapat dua bahan pewarna yang digunakan dalam metode ini yaitu metilen biru (bahan pewarna larut air) dan sudan III (bahan pewarna larut minyak). Jika sediaan berwarna seragam ketika metilen biru diteteskan, maka sediaan memiliki tipe emulsi M/A karena air merupakan fase luar. Jika sediaan berwarna seragam ketika sudan III diteteskan, maka sediaan memiliki tipe emulsi A/M karena sudan III hanya mampu mewarnai fase minyak.
homogen, maka sediaan memiliki tipe emulsi M/A. Jika sediaan ditambahkan minyak, maka hal ini akan menyebabkan pecahnya emulsi. Pada tipe emulsi A/M akan diperoleh hasil yang sebaliknya.
c. Percobaan pencucian. Hanya sediaan dengan tipe emulsi M/A yang mudah dicuci dengan air.
d. Percobaan cincin. Jika sediaan uji diteteskan pada kertas saring maka sediaan dengan tipe emulsi M/A akan membentuk cincin air di sekeliling tetesan dalam waktu singkat.
(Voigt, 1984) Stabilitas merupakan kemampuan produk obat atau kosmetik untuk bertahan dalam batas spesifikasi yang diterapkan selama periode penyimpanan dan penggunaan untuk menjamin identitas, kekuatan, kualitas, dan kemurnian produk (Harmita, 2006).
Sediaan krim dikatakan tidak stabil apabila fase internal cenderung membentuk agregat, terdapat agregat yang muncul di permukaan sediaan atau mengendap dan membentuk lapisan pada fase internal, atau terjadi pemisahan antara fase internal dan fase eksternal (Allen et al., 2011).
Terdapat empat tanda ketidakstabilan sediaan krim, antara lain: 1. Cracking
Cracking merupakan proses penggumpalan yang terjadi pada fase internal dan
dan dapat terjadi karena pemilihan emulgator yang kurang tepat, adanya eksipien yang tidak kompatibel, penyimpanan sediaan pada suhu yang tidak sesuai, dan adanya kontaminasi mikroba.
2. Flokulasi
Flokulasi merupakan penggabungan globul yang bergantung pada gaya tolak menolak elektrostatis (zeta potensial).
3. Creaming
Creaming merupakan proses pemisahan yang terjadi akibat adanya perbedaan
densitas antara fase air dan fase minyak. Proses ini mengakibatkan adanya pembentukan lapisan pada bagian permukaan maupun pada dasar sediaan. Proses creaming dapat dihindari apabila rata-rata ukuran partikel fase dispersi diperkecil dan
viskositas sediaan ditingkatkan. 4. Inversi
Inversi merupakan perubahan fase dari tipe emulsi A/M menjadi M/A dan sebaliknya.
normal. Penyimpanan sediaan dilakukan pada suhu 40oC selama beberapa jam, setelah itu dilakukan pembekuan hingga muncul tanda-tanda ketidakstabilan. Metode ini dapat digunakan untuk melihat ukuran partikel yang terbentuk dalam sediaan (Billany, 2002). Pengujian lain yang dapat digunakan untuk melihat stabilitas sediaan adalah sentrifugasi. Pengujian ini bertujuan untuk mengetahui terjadinya pemisahan fase dari emulsi. Sampel disentrifugasi pada kecepatan 3750 rpm selama 5 jam. Hal ini dilakukan karena perlakuan tersebut setara dengan besarnya pengaruh gaya gravitasi terhadap penyimpanan sediaan selama setahun (Budiman, 2008).
D. Desain Faktorial
Desain faktorial merupakan aplikasi dari sistem regresi yang membandingkan antara variabel respon dengan variabel bebas (Kurniawan dan Sulaiman, 2009).
Jumlah percobaan untuk penelitian dengan metode desain faktorial yaitu jumlah level yang digunakan dalam penelitian dipangkatkan dengan jumlah faktor dalam penelitian. Apabila dalam percobaan menggunakan dua faktor dan dua level maka jumlah percobaan adalah 22 (4 percobaan). Rancangan percobaan desain faktorial dengan dua faktor dan dua level seperti pada tabel II.
Tabel II. Rancangan percobaan desain faktorial dengan dua faktor dan dua level (Bolton, 1997)
Formula 1: Formula dengan faktor A pada level rendah dan faktor B pada level rendah
Formula a: Formula dengan faktor A pada level tinggi dan faktor B pada level rendah
y : respon hasil atau sifat yang diamati (XA)(XB) : level faktor A dan faktor B
b0, b1, b2, b12 : koefisien, dapat dihitung dari hasil percobaan
Dari rumus dan data yang diperoleh dapat dibuat contour plot suatu respon yang digunakan untuk memilih komposisi campuran yang optimum. Dengan mencari selisih rata-rata antara respon pada level tinggi dan rata-rata respon pada level rendah dapat diperoleh besarnya efek yang dicari (Bolton, 1997).
E. Landasan Teori
yang berbeda. Semakin tinggi viskositas maka kecepatan pemisahan akan semakin berkurang sehingga stabilitas suatu sediaan akan meningkat.
Optimasi terhadap penggunaan PEG 4000 sebagai basis dan propilen glikol sebagai humektan perlu dilakukan untuk mendapatkan sediaan krim dengan sifat fisik dan stabilitas fisik yang baik. PEG 4000 berbentuk solid serta dapat melebur pada suhu 50-58oC dan membeku pada 53-59oC (Wallick, 2009). Oleh karena sifatnya ini setelah PEG 4000 dipanaskan akan menyebabkan pemadatan lagi dengan cepat sehingga komposisi PEG 4000 akan berpengaruh pada viskositas. Berdasarkan penelitian yang dilakukan oleh Salviana (2014), PEG 4000 memiliki rentang penggunaan 2-6 g dan memberikan stabilitas fisik yang baik. Propilen glikol berbentuk cair dan memiliki viskositas 58,1 cP dengan komposisi penggunaan 15% (Weller, 2009). Berdasarkan penelitian yang dilakukan oleh Veronica (2013) diketahui bahwa propilen glikol yang berperan sebagai humektan dapat menarik air (lembab) menyebabkan penurunan viskositas sehingga komposisi propilen glikol akan berpengaruh pada daya sebar dan memberikan stabilitas fisik yang baik.
yang stabil, maka sediaan tersebut stabil pada penyimpanan suhu kamar selama setahun (Budiman, 2008).
Salah satu tanaman yang memiliki aktivitas antioksidan adalah manggis (Garcinia mangostana L.). Di dalam tanaman manggis terdapat suatu metabolit sekunder yaitu xanton (Pedrazza-Chaverri et al., 2008). Berdasarkan penelitian yang dilakukan oleh Li and Xu (2015), ekstrak etanol kulit manggis memiliki nilai IC50 sebesar 75,9 ppm dan bagian dari tanaman manggis yang memiliki aktivitas antioksidan tertinggi adalah kulit manggis (Palakawong et al., 2010).
F. Hipotesis
1. PEG 4000 dan propilen glikol berpengaruh terhadap sifat fisik sediaan krim ekstrak kulit manggis. PEG 4000 dapat meningkatkan viskositas dan menurunkan daya sebar sedangkan propilen glikol memberikan hasil yang sebaliknya.
2. Dapat diperoleh komposisi pada daerah optimum sehingga menghasilkan sediaan krim ekstrak kulit manggis dengan sifat fisik yang baik.
3. Sediaan krim ekstrak kulit manggis memiliki stabilitas fisik yang baik setelah dilakukan uji sentrifugasi dan freeze thaw cycling.
34
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk dalam penelitian eksperimental murni menggunakan metode desain faktorial untuk mengetahui konsentrasi optimum PEG 4000 dan propilen glikol.
B. Variabel Penelitian dan Definisi Operasional 1. Variabel penelitian
a. Variabel bebas. Variabel bebas dalam penelitian ini adalah komposisi PEG 4000 sebagai basis dan propilen glikol sebagai humektan.
b. Variabel tergantung. Variabel tergantung dalam penelitian ini adalah sifat fisik krim (organoleptis, pH, viskositas, daya sebar, dan sifat alir) dan stabilitas fisik krim (perubahan organoleptis, pH, viskositas, dan daya sebar).
c. Variabel pengacau terkendali. Variabel pengacau terkendali dalam penelitian ini adalah kondisi penyimpanan, kecepatan dan lama pengadukan, kondisi alat dan bahan yang digunakan, dan lama penyimpanan selama uji stabilitas.
2. Definisi operasional
a. Ekstrak kulit manggis adalah ekstrak hasil proses maserasi kulit buah manggis dalam pelarut etanol 96%.
b. Krim adalah sediaan semisolid yang ditujukan untuk penggunaan topikal yang mengandung satu atau lebih bahan obat yang terdispersi dalam basis yang sesuai. c. Antioksidan adalah suatu senyawa yang dapat menormalkan kembali radikal bebas.
d. Basis adalah bahan dasar krim yang berfungsi sebagai pembawa zat aktif dalam sediaan. Basis yang digunakan dalam penelitian ini adalah PEG 4000 dengan konsentrasi 4 g sebagai level rendah dan 5 g sebagai level tinggi.
e. Humektan adalah bahan yang memiliki sifat mengikat air dari udara yang lembab serta dapat mempertahankan air yang ada dalam sediaan. Humektan yang digunakan dalam penelitian ini adalah propilen glikol dengan konsentrasi 2 g sebagai level rendah dan 6 g sebagai level tinggi.
f. Viskositas adalah tingkat kekentalan krim ekstrak kulit manggis yang diukur dengan viscometer dan dinyatakan dalam satuan dPa.s.
g. Daya sebar adalah kemampuan penyebaran krim ekstrak kulit manggis yang diukur menggunakan kaca bulat berskala dengan melihat panjang rata-rata diameter setelah diberi beban.
i. Stabilitas fisik adalah parameter yang digunakan untuk melihat kestabilan suatu sediaan.
j. Desain faktorial adalah metode optimasi untuk mengetahui faktor yang dominan dalam menentukan sifat fisik dan stabilitas krim.
k. Formula optimum adalah formula krim ekstrak kulit manggis yang memenuhi sifat fisik yang diingingkan, meliputi viskositas pada rentang 250-380 dPa.s dan daya sebar pada rentang 12,57-19,63 cm2.
C. Bahan Penelitian
Bahan yang dipakai adalah ekstrak kulit manggis (PT. Borobudur Industri Jamu Semarang), akuades, etanol 96% (teknis), DPPH (Aldrich), setil alkohol (farmasetis), asam stearat (farmasetis), propilen glikol (farmasetis), PEG 4000 (farmasetis), KOH (farmasetis), metil paraben (farmasetis), trietanolamin (farmasetis).
D. Alat Penelitian
Alat yang digunakan adalah alat-alat gelas (Pyrex-Germany), viscometer seri VT 04 (Rion-Japan), spektrofotometer UV-Vis (Shimadzu-Japan), waterbath, sentrifuge, tabung sentrifugasi, oven, Rheosys Merlin VR, indikator pH universal,
E. Tata Cara Penelitian
1. Identifikasi ekstrak kering kulit manggis (Garcinia mangostana L.)
Ekstrak kering kulit manggis diidentifikasi dengan membandingkan hasil pengamatan terhadap Certificate of Analysis (CoA).
2. Pembuatan ekstrak kental kulit manggis (Garcinia mangostana L.)
Sebanyak 10,0 g ekstrak kering kulit manggis ditambah dengan etanol 96% 40-60 mL (hingga terendam), diaduk, disaring menggunakan corong dan kertas saring hingga diperoleh filtrat. Ampas hasil penyaringan diekstraksi kembali sebanyak 3 kali. Filtrat kemudian digabungkan dan dipekatkan di atas waterbath pada suhu 60oC hingga diperoleh bobot tetap.
3. Uji aktivitas antioksidan ekstrak kulit manggis (Garcinia mangostana L.) a. Penyiapan ekstrak uji. Sebanyak 100,0 mg ekstrak kulit manggis dilarutkan dengan etanol 96% ke dalam labu ukur 100,0 mL untuk membuat larutan induk dengan konsentrasi 1000 ppm. Selanjutnya diambil sebanyak 0,3; 0,4; 0,5; 0,75 dan 1,5 mL dari 100,0 mL larutan induk yang kemudian dilarutkan dengan etanol 96% ke dalam labu ukur 25,0 mL untuk membuat larutan uji dengan konsentrasi 12; 16; 20; 30 dan 60 ppm.
c. Penentuan panjang gelombang maksimum larutan DPPH. Larutan DPPH 40 ppm sebanyak 4 mL ditambah dengan etanol 96% sebanyak 2 mL, diamati absorbansinya pada panjang gelombang 400-800 nm. Blanko yang digunakan adalah etanol 96% sebanyak 6 mL. Panjang gelombang dengan absorbansi tertinggi yang diperoleh merupakan panjang gelombang maksimum.
d. Penetapan operating time. Larutan DPPH 40 ppm sebanyak 4 mL ditambah dengan ekstrak uji dengan konsentrasi 20 ppm sebanyak 2 mL. Absorbansi diamati pada panjang gelombang maksimum yang telah didapatkan dengan interval waktu yang berbeda (5, 10, 15, 20, 25, dan 30 menit). Blanko yang digunakan adalah larutan DPPH 40 ppm sebanyak 4 mL dan etanol 96% sebanyak 2 mL.
e. Pengukuran aktivitas peredaman radikal bebas DPPH secara spektrofotometri UV-Vis. Larutan uji sebanyak 2 mL ditambah dengan larutan DPPH sebanyak 4 mL, didiamkan selama operating time dan diamati absorbansinya pada panjang gelombang maksimum. Blanko yang digunakan adalah larutan DPPH sebanyak 4 mL ditambah dengan etanol 96% sebanyak 2 mL. Selanjutnya dilakukan perhitungan IC50 dari persamaan regresi yang telah didapatkan dari kurva absorbansi vs persen inhibisi.
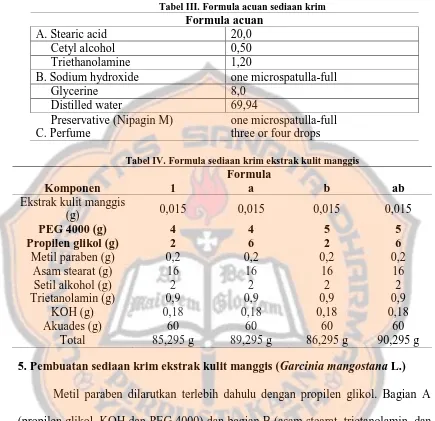
4. Formula sediaan krim ekstrak kulit manggis (Garcinia mangostana L.)
Tabel III. Formula acuan sediaan krim
Tabel IV. Formula sediaan krim ekstrak kulit manggis Formula 5. Pembuatan sediaan krim ekstrak kulit manggis (Garcinia mangostana L.)
6. Uji sifat fisika kimia sediaan krim ekstrak kulit manggis (Garcinia mangostana L.)
a. Uji organoleptis dan pH. Untuk uji organoleptis, dilakukan dengan mengamati bentuk, warna, bau dan homogenitas sediaan krim yang dihasilkan. Untuk uji pH, dilakukan dengan mengukur pH sediaan krim menggunakan indikator pH universal, nilai pH dilihat dengan membandingkan warna yang dihasilkan dengan warna pada standar.
b. Uji viskositas. Pengukuran viskositas dilakukan dengan menggunakan alat Viscometer Rion seri VT 04. Pengukuran viskositas dilakukan dengan
memasukkan sediaan krim ke dalam wadah dan dipasang pada viscometer. Sediaan krim dituang ke dalam wadah viscometer, kemudian rotor nomor 2 dipasang pada alat dan didiamkan terlebih dahulu selama 5 menit. Pendiaman ini dilakukan untuk menyamakan perlakuan dan untuk memastikan jarum penunjuk pada alat menunjukkan angka yang pasti dan tidak naik turun. Nilai viskositas ditunjukkan oleh jarum penunjuk saat viscometer dinyalakan.
didapatkan luas sebaran dengan memasukkan diameter rata-rata ke dalam rumus π.r2
.
d. Uji sifat alir. Pengukuran sifat alir dilakukan dengan menggunakan Rheosys Merlin VR. Pengujian ini dilakukan dengan menggunakan sistem pengukuran
cone and plate 5/30 mm pada temperatur 25oC dengan kecepatan awal 1 rpm dan kecepatan akhir 100 rpm. Terdapat 10 tahap dalam peningkatan kecepatan antara lain 1, 12, 23, 34, 45, 56, 67, 78, 89, dan 100 rpm. Sampel krim diletakkan di tengah plate, kemudian cone diatur hingga berada di atas plate dan mengenai sampel. Sistem cone and plate diputar dengan kecepatan 1 hingga 100 rpm. Ketika pengujian telah selesai dilakukan akan didapatkan rheogram yang menunjukkan sifat alir sampel tersebut.
7. Uji stabilitas sediaan krim ekstrak kulit manggis (Garcinia mangostana L.)
a. Uji sentrifugasi. Masing-masing formulasi sediaan krim diuji sentrifugasi dengan sentrifuge pada kecepatan 3750 rpm selama 5 jam untuk mengetahui adanya pemisahan pada sediaan krim.
dilakukan pada akhir tiap siklus terhadap sediaan, yang meliputi pemeriksaan organoleptis, pH, viskositas, dan daya sebar.
8. Uji aktivitas antioksidan sediaan krim ekstrak kulit manggis (Garcinia mangostana L.) dengan metode DPPH
a. Penyiapan larutan uji. Sebanyak 50,0 mg sediaan dilarutkan dengan etanol 96% ke dalam labu ukur 50,0 mL, disaring, dan digojog hingga homogen untuk membuat larutan induk dengan konsentrasi 1000 ppm. Dari 50,0 mL larutan induk tersebut dibuat sembilan seri larutan uji dengan mengambil sebanyak 0,1; 0,25; 0,5; 0,75; 1; 2,5; 5; 7,5; dan 10 mL yang kemudian dilarutkan dengan etanol 96% ke dalam labu ukur 10,0 mL dengan konsentrasi 10; 25; 50; 75; 100; 250; 500; 750; dan 1000 ppm.
b. Pembuatan larutan DPPH. DPPH sebanyak 2,0 mg dilarutkan dalam etanol 96% ke dalam labu ukur 100,0 mL untuk membuat larutan DPPH dengan konsentrasi 20 ppm. Larutan dijaga agar terhindar dari cahaya dengan menutupi labu ukur menggunakan alumunium foil.
dari persamaan regresi yang telah didapatkan dari kurva absorbansi vs persen inhibisi.
F. Analisis Hasil
Data yang terkumpul dari uji sifat fisik meliputi daya sebar dan viskositas dianalisis menggunakan Design Expert 10.0.2 dengan taraf kepercayaan 95% untuk mendapatkan komposisi optimum kedua faktor, faktor yang dominan terhadap respon, dan interaksi kedua faktor.
Data uji stabilitas fisik meliputi viskositas dan daya sebar setelah pengujian freeze thaw cycling dianalisis menggunakan software RStudio untuk diuji normalitas
data menggunakan Shapiro wilk. Apabila persebaran data normal, dilanjutkan dengan
levene’s test untuk melihat homogenitas data dan dilanjutkan dengan uji ANOVA
44
BAB IV
HASIL DAN PEMBAHASAN
A. Identifikasi Ekstrak Kering Kulit Manggis (Garcinia mangostana L.)
Pada penelitian ini ekstrak kering kulit manggis perlu diidentifikasi terlebih dahulu untuk melihat kesesuaian karakteristik antara ekstrak kering kulit manggis yang digunakan dengan karakteristik yang terlampir pada CoA (lampiran 1). Ekstrak kering kulit manggis yang digunakan dalam pembuatan sediaan krim ekstrak kulit manggis diperoleh dari PT. Borobudur Industri Jamu Semarang (gambar 13).
Gambar 13. Ekstrak kering kulit manggis
Tabel V. Hasil identifikasi ekstrak kering kulit manggis
Karakteristik Hasil CoA
Bentuk Granul Granul
Warna Coklat terang Coklat terang Bau Aromatik (khas) Aromatik (khas)
B. Pembuatan Ekstrak Kental Kulit Manggis (Garcinia mangostana L.)
Gambar 14. Ekstrak kental kulit manggis
Tujuan dilakukan pembuatan ekstrak kental kulit manggis adalah untuk memisahkan eksipien yang ditambahkan dalam ekstrak kering kulit manggis sehingga pada saat dilakukan pengukuran aktivitas antioksidan, hasil yang didapatkan murni hanya dari ekstrak kulit manggis tersebut. Selain itu, dengan digunakannya ekstrak kental, proses pencampuran antara ekstrak dengan bahan lain akan lebih mudah sehingga pencampuran akan lebih homogen. Tujuan digunakannya etanol 96% sebagai pelarut dalam pembuatan ekstrak kulit manggis adalah untuk menghilangkan maltodekstrin karena kelarutannya yang rendah dalam etanol 96% (Parikh, Agarwal, and Raut, 2014). Berdasarkan CoA yang terlampir, ekstrak kering kulit manggis yang
C. Uji Aktivitas Antioksidan Ekstrak Kulit Manggis (Garcinia mangostana L.) Uji aktivitas antioksidan ini bertujuan untuk mengetahui aktivitas antioksidan dari ekstrak kulit manggis. Metode yang digunakan dalam pengujian aktivitas antioksidan adalah metode DPPH. Metode DPPH dipilih karena metode ini merupakan metode yang sederhana, cepat, sensitif, dan reprodusibel (Savatoric et al., 2012).
1. Penentuan panjang gelombang maksimum DPPH
Tujuan dilakukannya penentuan panjang gelombang maksimum adalah untuk mengetahui panjang gelombang maksimum di mana larutan DPPH memberikan serapan yang maksimum.
Gambar 15. Hasil penentuan panjang gelombang maksimum larutan DPPH
2. Penetapan operating time
Tujuan ditetapkannya operating time adalah untuk mengetahui waktu di mana reaksi antara larutan DPPH dengan larutan uji telah berjalan dengan sempurna.
Tabel VI. Hasil penetapan operating time
Waktu (menit) Absorbansi absorbansi yang stabil, oleh karena itu operating time yang dipilih adalah 25 menit. 3. Pengukuran aktivitas antioksidan ekstrak kulit manggis
Pengukuran aktivitas antioksidan bertujuan untuk mengetahui seberapa besar aktivitas antioksidan yang dimiliki oleh ekstrak kulit manggis. Aktivitas antioksidan ini dapat dilihat dari nilai IC50.
Gambar 16. Kurva konsentrasi (ppm) vs inhibisi (%)
Dari kurva pada gambar 16 didapatkan persamaan regresi y = 0,7166x-5,7276 dengan r sebesar 0,9981. Nilai IC50 dihitung dengan memasukkan y = 50 pada persamaan regresi, sehingga nilai IC50 yang didapatkan adalah 77,767 ppm. Ekstrak
kulit manggis memiliki aktivitas antioksidan pada rentang 50-100 ppm, yang menandakan bahwa ekstrak kulit manggis memiliki aktivitas antioksidan yang kuat.
Hasil yang didapatkan pada penelitian ini mendekati hasil penelitian yang dilakukan oleh Li and Xu (2015), yaitu ekstrak kulit manggis dengan pelarut etanol memiliki nilai IC50 sebesar 75,9 ppm yang tergolong memiliki aktivitas antioksidan sangat kuat.
C. Orientasi Level dari Kedua Faktor Penelitian
Orientasi level dari kedua faktor penelitian bertujuan untuk mengetahui level rendah dan level tinggi dari PEG 4000 sebagai basis dan propilen glikol sebagai humektan. Level tinggi dan level rendah dari kedua faktor tersebut dilihat berdasarkan respon viskositas dan daya sebar yang dihasilkan.
Tabel VII. Variasi konsentrasi PEG 4000 terhadap respon viskositas dan daya sebar
diinginkan yaitu 12,57-19,63 cm2, sehingga dipilih PEG 4000 dengan konsentrasi 4 g sebagai level rendah dan konsentrasi 5 g sebagai level tinggi. Rentang viskositas dan daya sebar yang dipilih berdasarkan hasil orientasi yang telah dilakukan sebelumnya.
Tabel VIII. Variasi konsentrasi propilen glikol terhadap respon viskositas dan daya sebar
Propilen glikol (g) Daya Sebar (cm2) Viskositas (dPa.s)
2 15,26 275
4 19,51 255
6 19,34 250
8 22,20 225
10 22,97 225
Variasi konsentrasi propilen glikol yang dipilih untuk orientasi ini adalah 2, 4, 6, dan 8 g. Rentang konsentrasi propilen glikol yang dapat digunakan sebagai humektan adalah 15% (Weller, 2009). Dari tabel VIII diketahui bahwa propilen glikol dengan konsentrasi 2, 4, dan 6 g memberikan hasil daya sebar dan viskositas sesuai dengan yang diinginkan. Oleh karena itu dipilih propilen glikol dengan konsentrasi 2 g sebagai level rendah dan konsentrasi 6 g sebagai level tinggi.
D. Hasil Pengujian Sifat Fisik Krim Ekstrak Kulit Manggis