BAB I DASAR TEORI
1.1 GAS IDEAL
Gas merupakan satu dari tiga wujud zat dan walaupun wujud ini merupakan bagian tak terpisahkan dari studi kimia, bab ini terutama hanya akan membahasa hubungan antara volume, temperatur dan tekanan baik dalam gas ideal maupun dalam gas nyata, dan teori kinetik molekular gas, dan tidak secara langsung kimia. Bahasan utamanya terutama tentang perubahan fisika, dan reaksi kimianya tidak didisuksikan. Namun, sifat fisik gas bergantung pada struktur molekul gasnya dan sifat kimia gas juga bergantung pada strukturnya. Perilaku gas yang ada sebagai molekul tunggal adalah contoh yang baik kebergantungan sifat makroskopik pada struktur mikroskopik.
I. Sifat Gas Ideal
a) Gas bersifat transparan.
b) Gas terdistribusi merata dalam ruang apapun bentuk ruangnya.
c) Gas dalam ruang akan memberikan tekanan ke dinding. d) Volume sejumlah gas sama dengan volume wadahnya. Bila
gas tidak diwadahi, volume gas akan menjadi tak hingga besarnya, dan tekanannya akan menjadi tak hingga kecilnya.
e) Gas berdifusi ke segala arah tidak peduli ada atau tidak tekanan luar.
f) Bila dua atau lebih gas bercampur, gas-gas itu akan terdistribusi merata.
g) Gas dapat ditekan dengan tekanan luar. Bila tekanan luar dikurangi, gas akan mengembang.
h) Bila dipanaskan gas akan mengembang, bila didinginkan akan mengkerut.
Adapun beberapa hukum yang berlaku pada gas ideal adalah:
a) Hukum Boyle
Robert Boyle (1662) :
“Volume suatu gas dengan jumlah tertentu, pada suu konstan berbanding terbalik dengan tekanan gas”
b) Hukum Charle atau Gay Lussac Charles (1787) :
“ Gas hidrogen, udara, karbon dioksida, dan oksigen mengembang dengan jumlah yang sama ketika dipanaskan dari 00 sampai dengan 80o C”
Gay Lussac (1802):
“Untuk semua gas, pertambahan volume untuk kenaikan suhu setiap derajat celcius kira-kira sama dengan 1/273 dari volume gas pada 00 C”
c) Hukum Dalton Mengenai Tekanan Parsial
Pada suhu konstan, tekanan total yang diberikan oleh campuran gas dalam volume tertentu sama dengan jumlah tekanan pada masing-masing gas yang akan diberikan jika gas menempati volume total yang sama sendirian.
Pada sembarang campuran gas, volume total dapat dianggap merupakan jumlah volume parsial masing-masing komponen dalam campuran. Yang dimaksud volume parsial pada hukum Amagat ini adalah suatu volume dimana masing-masing gas akan menempati jika ada sendirian pada suhu dan tekanan total yang diberikan.
Jika hukum gas ideal dapat diberlakukan :
e) Hukum gas gabungan
f) Hukum Graham tentang difusi
1.2 GAS NYATA
Perhitungan pada gas ideal tidak memperhitungkan volume yang ditempati molekul-molekul gas, serta tidak memperhatikan gaya tumbukan antar molekul maupun tumbukan antara molekul dengan dinding. Pada kenyataannya tidak ada satupun gas yang ideal di dunia ini. Sekecil apapun volume yang ditempati molekul pasti akan mempengaruhi perhitungan. Begitu pula aspek tumbukan yang terjadi.
Faktor Kompresibilitas
Faktor kompresibilitas atau faktor pemampatan adalah rasio molar volume gas terhadap volume gas ideal pada tekanan dan temperature yang sama. Faktor ini merupakan salah satu property termodinamika yang berguna untuk memodifikasi hukum gas ideal untuk melihat perilaku gas nyata.
Z= PV
nRT
Gas ideal memiliki Z =1, sedangkan gas nyata memiliki z yang bervariasi.
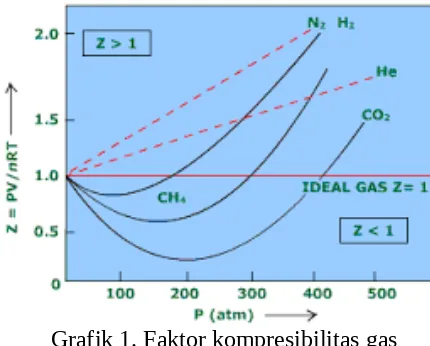
Grafik 1. Faktor kompresibilitas gas
Faktor kompresibilitas sangat bergantung pada suhu dan tekanan. Berikut grafik hubungan tekanan (P) dengan faktor kompresibilitas (Z) pada suhu berbeda.
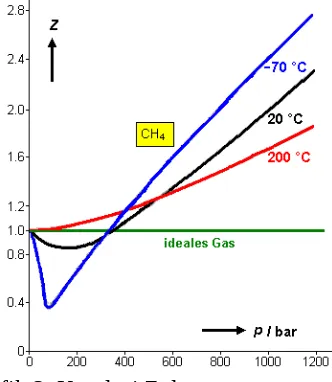
Grafik 2. Korelasi Z dengan temperatur
Semakin tinggi temperatur, maka grafik semakin mendekati garis lurus di sekitar Z = 1. Hal ini menunjukkan bahwa gas akan semakin dianggap ideal pada suhu tinggi.
Temperatur dimana gas masih bisa mempertahankan sifat idealnya pada rentang perubahan tekanan yang cukup besar disebut dengan Temperatur Boyle atau Titik Boyle.
Grafik 3. Titik Boyle
Titik Boyle dapat dijadikan batasan tipe isoterm yang ditunjukkan gas. Diatas titik ini gas menunjukkan penyimpangan positif ( Z > 1), sedangkan dibawah titik Boyle, z turun drastis hingga titik minimumnya kemudian naik drastis diatas Z = 1. Titik minimum gas ditentukan oleh temperatur (semakin rendah suhunya maka semakin rendah titik minimumnya).
2. Gaya antarmolekul amat lemah sehingga dapat diabaikan
3. Tekanan amat rendah (mendekati 0) sehingga perilaku individual gas hilang (z dianggap 1)
Apabila tekanan gas sangat besar, maka kondisi idealnya bergatung pada sifat gas (kemampuannya terkondensasi) dan suhu kritis gas (suhu tertinggi dimana gas bisa dicairkan).
Hukum-hukum gas nyata 1. Persamaan Van der Waals
P=
(
nRTKoefiisien a dan b berbeda-beda pada setip gasnya. Koefisien ini didapat dari hasil penelitian di laboratorium. Semakin kecil nilai a dan b maka gas akan semakin mendekati ideal. A dan b ditentukan berdasarkan tekanan kritis (Pc) dan temperatur kritisnya (Tc).
Persamaan ini akan akurat untuk gas pada tekanan atmosfer atau lebih kecil.
P=RT
dimana Pc = tekanan kritis; Tc = temperatur kritis 3. Persamaan Kamerlingh Onnes
Persamaan ini dapat digunakan untuk menghitung PV yang sangat besar PVm=A+BP+C P2+D P3+… dimana Vm = volume molar
Pada tekanan rendah, koefisien virial yang digunakan hanya A (nilainya sebanding dengan RT). Seiring bertambahnya tekanan, maka semakin banyak koefisien viriala yang harus diperhitungkan. Koefisien tiap gas bervariasi tergantung jenis gas dan temperaturnya.
4. Persamaan Beattie-Bridgeman
Persamaan ini memiliki akurasi tinggi dan dapat digunakan untuk range T dan P yang besar.
Gas dalam suatu ruang/ wadah akan mengalami tumbukan dengan dinding wadah yang menyebabkan terjadinya perubahan momentum. Dimana total perubahan momentum yang terjadi pada n molekul dinyatakan oleh rumus:
f=2n 'mu2
l
Selain itu akibat adanya tumbukkan dengan dinding menyebabkan terjadinya tekanan pada dinding sehingga diperoleh persamaan:
PV=1
3m n '
u2
Dengan P adalah tekanan, V adalah volume wadah, m adalah massa molekul, n’ adalah jumlah molekul, dan u adalah kecepatan rms
Dalam kasus gas, kecepatan yang sering digunakan untuk menyatakan
Akibat adanya gerakan molekul yang bergerak dengan kecepatan tertentu,
Dengan T adalah suhu, N adalah bilangan avogadro, dan k adalah tetapan boltzman
Molekul penyusun gas dalam suatu ruang tidak bergerak dengan kecepatan yang sama akibat adanya tumbukan dengan molekul dan dinding sehingga menyebabkan terjadinya distribusi kecepatan. Selain kecepatan rms, untuk kasus molekul gas dikenal juga istilah kecepatan rata-rata (v) dan kecepatan yang paling mungkin (α) tekanan atau tegangan. Aliran fluida di setiap posisi dalam satu ruang alir tidak pernah sama, karena kecepatan aliran cairan di dinding mengalami gaya friksi dengan dinding sehingga kecepatannya menjadi lebih kecil dan menimbulkan viskositas cairan.
b. Pengukuran Viskositas
Koefisien viskositas secara umum diukur dengan Viskometer Oswald.
Viskositas biasanya disimbolkan dengan lambang ( μ )
μ=π(∆ ρ)R
4 t
8Vl
Umumnya, koefisien viskositas dihitung dengan membandingkannya dengan koefisien viskositas yang lainnya
μ1 μ2
=d1t1 d2t2
1) Gaya Intermolekuler
Jika gaya intermolekuler kuat, maka viskositas cairannya akan tinggi. Contohnya adalah air yang mempunyai viskositas yang lebih tinggi daripada metanol karena gaya intermolekuler air lebih besar daripada metanol.
2) Temperatur
Kenaikan temperatur menyebabkan turunnya viskositas dan begitu juga sebaliknya. Hal ini disebabkan karena pemanasan tersebut menyebabkan molekul-molekul memperoleh energi sehingga cairan bergerak dan gaya intermolekuler melemah.
3) Tekanan
Viskositas cairan naik dengan naiknya tekanan, sementara viskositas gas tidak dipengaruhi oleh tekanan
4) Kehadiran Zat Lain
Adanya bahan tambahan seperti bahan suspensi dapat menaikkan viskositas air.
Contoh: Air dengan air + susu mempunyai viskositas yang berbeda
d. Tabel Viskositas Cairan pada Berbagai Suhu
Menurut referensi (Bird, 1987), inilah viskositas cairan beberapa zat pada berbagai suhu
Cairan 00C 100C 200C 300C
Air 0,0179 0,013 0,0101 0,008
Gliserin 105,9 33,4 13,4 6,29
Anilin 0,102 0,065 0,044 0,0316
Bensin 0,0091 0,0076 0,0065 0,0056
Etanol 0,0177 0,0147 0,012 0,01
Minyak Lobak 25,3 3,85 1,63 0,96
e. Manfaat Viskositas
Di dunia keteknikan, viskositas berguna untuk mengukur koefisien gliserin, oli, atau minyak.
1.5KONDISI KRITIS DAN SUPERKRITIS GAS
Kondisi Kritis Cairan , Fluida Kritis, dan Fluida Superkritis
Cairan mempunyai volume tetap dan hanya sedikit dipengaruhi oleh tekanan
Dari Teori Kinetik dapat dianggap bahwa cairan adalah kelanjutan dari fase gas, molekul-molekulnya mempunyai gaya tarik yang kuat sehingga dapat menahan volume menjadi tetap
A. Pengertian Kondisi Kritis
Kondisi / titik kritis adalah sebuah titik dimana fase cairan dan uap tidak bisa dibedakan
Pada saat mendekati tenperatur titik kritis, properti gas dan cairan menjadi sama, dan fase ini disebut dengan fluida superkritikal.
Misalkan bila air diletakkan dalam bejana tertutup, air mempunyai tekanan uap tertentu. Tekanan uap ini bergantung pada temperatur, misalnya :
Pada T = 250C P = 23,76 mmHg
Pada T = 1000C P = 760 mmHg
Jika temperatur dinaikkan terus, tekanan uap juga bertambah. Tetapi selalu ada kesetimbangan antara :
Air Uap
Pada temperatur 374.40C, batas antara air dan uap menghilang. Air dalam
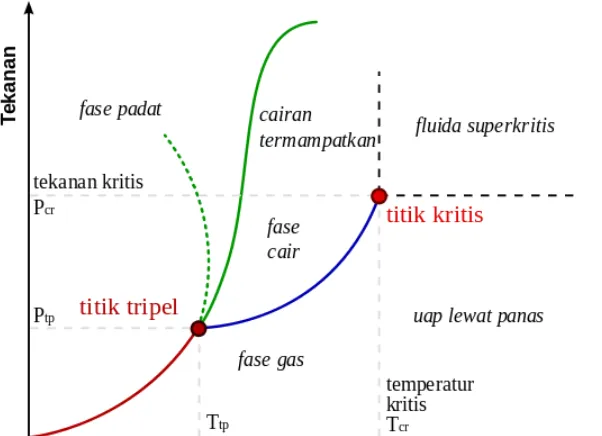
Grafik 4. Kondisi Kritis dan Superkritis Gas
Pada diagram di atas, terdapat titik tripel dan titik kritis. Pada titik tripel, fase padat, cair dan gas ada secara bersamaan dengan porsi yang sama. Apabila dari titik tripel,sepanjang kurva batas fase cair dan gas, temperatur dan tekanan dinaikan makacairan akan semakin berkurang kerapatannya karena ekspansi termal, dan sebaliknya, kerapatan gas akan meningkat karena naiknya tekanan. Akibatnya akan didapatkan kondisi dengan kerapatan yang sama dan tidak ada batas antara cair dan gas. Pada kondisi ini, kurva mencapai titik kritis, zat tidak lagi berwujud gas atau cair tetapi disebut sebagai fluida superkritis.Fluida ini memiliki sifat mirip gas dan juga mirip cair. Sifat solvasinya miripseperti zat cair, namun sifat mobilitas partikelnya mirip seperti gas, misalnyakemudahan berdifusi dan viskositas yang rendah. Pada daerah ini, sifat kepolaran fluida superkritis juga bisa diatur dengan mengubah suhu dan tekanan.Salah satu fluida superkritis yang memiliki nilai komersial tinggi adalah karbondioksida superkritis. Karbon dioksida memiliki nilai Pc = 7,4 MPa (kira-kira 73kali tekanan atmosfer) dan Tc = 30oC. kondisi seperti ini termasuk relatif mudah
untuk dicapai karena tidak terlalu banyak energi yang dibutuhkan.
Berikut manfaat-manfaat dari fluida superkritis (CO2 sebagai salah satu
Sebagai pelarut pada ekstraksi, misalnya pada ekstraksi kafein dari kopi bebas kafein
Sebagai fase gerak pada kromotografi (super critical fluid
chromatography)
Dry cleaning
Media pada sintesis polimer dari nano material
BAB II penyimpanan gas tersebut. Untuk memudahkan dalam pembagian tugas nantinya, maka mahasiswa dibagi dalam kelompok yang diberi nama berdasarkan wujud materi, yaitu Kelompok Padat, Kelompok Cair, dan Kelompok Gas. Seperti yang telah kita pelajari dalam kuliah Kimia Dasar, wujud materi padat, cair, dan gas memiliki sifat-sifat yang berbeda, sehingga ini juga membedakan fungsi mereka. Kelompok Gas paling semangat mengikuti kegiatan ini, sesuai sifat gas yang lebih mudah bergerak dibandingkan dengan wujud materi yang lain.
Pertanyaan:
1. Tugas pertama yang diberikan kepada tiap kelompok mahasiswa adalah menjelaskan perbedaan sifat wujud materi, seperti nama kelompok mereka. Jika Anda adalah anggota dari Kelompok Gas, jelaskan sifat dari gas, dan kemudian bandingkan dengan sifat cair dan padat.
SIFAT GAS CAIR PADAT
Volume Tidak tetap Tetap Tetap
Bentuk Tidak tetap Tetap Tidak
an Jarak antar
molekul
Lebih besar dibanding
ukuran molekul
2. Di industri ini, mereka diperkenalkan dengan istilah faktor kompresibilitas yang menunjukkan bahwa gas tersebut bukanlah gas ideal. Jelaskan apa yang Anda ketahui tentang gas ideal. Berdasarkan faktor kompresibilitas ini, bagaimana Anda dapat membedakan bahwa gas tersebut merupakan gas ideal atau gas nyata. Jelaskan apa yang anda ketahui tentang gas nyata.
JAWAB:
Faktor kompresibilitas (Z) ialah suatu Rasio volume molar aktual suatu gas dibandingkan terhadap volume molar gas tersebut pada suhu & tekanan yang sama dimana, Z =
Vm
V0m , dengan Vm= V
n , menggunakan gas ideal, berlaku :
PVm=RTZ atau PV=nRTZ
Z=P Vm
nRT
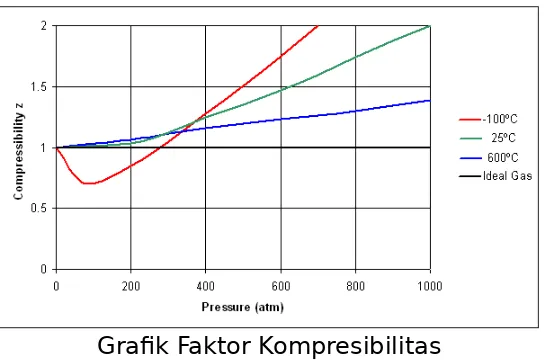
Faktor kompresi suatu gas merupakan ukuran penyimpangan dari keadaan ideal. Faktor kompresibiltas tergantung pada tekanan (pengaruh gaya tolakan atau tarik), yaitu apabila :
a) z = 1 pada tekanan rendah, berkelakuan secara ideal b)z < 1 pada tekanan sedang maka gaya tarikan dominan dan mudah dimampatkan
Grafik Faktor Kompresibilitas
3. Sebuah tabung 12 L akan diisi dengan gas N2, dengan cara mengalirkan gas
tersebut dari tabung 1 L dengan tekanan 20 atm. Dengan mengasumsikan bahwa gas tersebut adalah gas ideal, hukum siapakah yang bisa anda
gunakan dalam menentukan tekanan akhir dari gas N2 ini? Jika gas nyata,
bagaimanakah caranya kita mendapatkan tekanan akhir gas tersebut? Terangkan juga hukum-hukum gas yang lain, baik untuk gas ideal ataupun hukum gas nyata.
JAWAB
Pada kasus tersebut diasumsikan temperatur gas tetap, yang berubah hanya volume dan tekanan. Apabila gas tersebut adalah gas ideal, maka perhitungan dapat menggunakan Hukum Boyle, yaitu
P1V1=P2V2
Dimana:
P1 = Tekanan awal P2 = Tekanan akhir
V1 = Volume awal V2 = Volume akhir
Sehingga didapatkan:
P1V1=P2V2
20atm .1L=P2.12L
P2=1,67atm
Untuk gas nyata bisa menggunakan persamaan Van der Waals yaitu:
(
P+a n2
V2
)
(V−nb)=RT(
P1+a n2
V12
)
(
V1−nb)
=(
P2+ a n2Hukum gas ideal yang lain: a) Hukum Charles – Gay Lussac
Untuk semua gas, pertambahan volume untuk kenaikan suhu setiap derajat celcius kira-kira sama dengan 1/273 dari volume gas pada 00 C
T1 = Temperatur awal gas ; T2 = Temperatur akhir gas
b) Hukum Dalton Mengenai Tekanan Parsial
Pada suhu konstan, tekanan total yang diberikan oleh campuran gas dalam volume tertentu sama dengan jumlah tekanan pada masing-masing gas yang akan diberikan jika gas menempati volume total yang sama sendirian.
Ptotal=P1+P2+P3+¿ ...
c) Hukum Amagat Mengenai volume Parsial
Pada sembarang campuran gas, volume total dapat
d) Hukum Graham tetang difusi
u1
dimana, u = laju difusi gas ρ = densitas gas
a.) Persamaan Berthelot (akurat untuk gas pada tekanan atmosfer atau lebih Tc = temperatur kritis
b.) Persamaan Kamerlingh Onnes (digunakan untuk menghitung PV yang sangat besar)
PVm=A+BP+C P2+D P3+… dimana Vm = volume molar A, B, C, D = koefisien virial
Pada tekanan rendah, koefisien virial yang digunakan hanya A (nilainya sebanding dengan RT). Seiring bertambahnya tekanan, maka semakin banyak koefisien viriala yang harus diperhitungkan. Koefisien tiap gas bervariasi tergantung jenis gas dan temperaturnya.
c.) Persamaan Beattie-Bridgeman (memiliki akurasi tinggi dan dapat digunakan untuk range T dan P yang besar)
P=RT
4. Salah satu persamaan gas nyata yang banyak digunakan adalah persamaan Van der Waals. Dengan berdasarkan kepada persamaan gas ideal, terangkan bagaimana kita bisa mendapatkan persamaan Van der Waals. Dalam persamaan Van der Waals, terdapat dua konstanta yang sangat tergantung kepada karakteristik masing-masing gas. Terangkan bagaimana cara menentukan nilai konstanta Van der Waals tersebut.
JAWAB
volume yang ditempati molekul dan gaya interaksi antarmolekul dan molekul dengan dinding. Van der Waals meninjukkan bahwa gas tidak bergerak dalam volume V, namun dalam volume V-nb, dengan nb adalah volume yang ditempati molekul gas.
Tekanan gas bergantung pada frekuensi dan gaya tumbukan antara molekul dengan dinding. Tumbukan dengan dinding dapat dikurangi dengan meningkatkan konsentrasi molar gas (n/V). Hal ini disebabkan karena
Koefiisien a dan b berbeda-beda pada setip gasnya. Koefisien ini didapat dari hasil penelitian di laboratorium. Semakin kecil nilai a dan b maka gas akan semakin mendekati ideal. A dan b ditentukan berdasarkan tekanan kritis (Pc) dan temperatur kritisnya (Tc), secara matematis adapt dirumuskan
5. Selain gas murni, industri tersebut juga menjual gas dalam bentuk campuran. Jika industri tersebut mendapatkan pesanan campuran gas yang terdiri dari 30% vol N2, 50% vol CO, 15% vol H2, dan 5% O2, bantulah industri tersebut
untuk menentukan fraksi berat, fraksi mol, berat molekul rata-rata, tekanan parsial, dan densitas campuran. Buatlah asumsi yang logis jika dibutuhkan.
JAWAB:
Basis 100 m3 campuran
Volume N2 = 30 m3, ρ = 1.2506 kg/m3 (STP), Mr = 28.02
Volume CO = 50 m3, ρ = 1.250 kg/m3 (STP), Mr = 28.01
Volume H2 = 15 m3, ρ = 0.0899 kg/m3 (STP), Mr = 2.016
Volume O2 = 5 m3, ρ = 1.4290 kg/m3 (STP), Mr = 32
Jumlah volume campuran = 100 m3
Massa N2 = 30 m3 (1.2506 kg/m3) = 37.518 kg
Massa CO = 50 m3 (1.250 kg/m3) = 62.5 kg
Massa H2 = 15 m3 (0.0899 kg/m3) = 1.3485 kg
Massa O2 = 5 m3 (1.4290 kg/m3) = 7.145 kg
Jumlah massa campuran = 108.5115 kg
Fraksimassa N2=
37.518
37.528+62.5+1.3485+7.145=0.345751
Fraksimassa CO= 62.5
37.528+62.5+1.3485+7.145=0.575976
Fraksimassa H2= 1.3485
37.528+62.5+1.3485+7.145=0.012427
Fraksimassa O2= 7.145
37.528+62.5+1.3485+7.145=0.065846
Mol N2 = 37.518 kg / 28.02 = 1.338972 mol
Mol CO = 62.5 kg / 28.01 = 2.231346 mol Mol H2 = 1.3485 kg / 2.016 = 0.668899 mol
Mol O2 = 7.145 kg / 32 = 0.223281 mol
Jumlah mol campuran = 4.462498 mol
Fraksimol N2= 1.338972
1.338972+2.231346+0.668899+0.223281=0.30005
Fraksimol CO= 2.231346
1.338972+2.231346+0.668899+0.223281=0.500022
Fraksimol H2=
0.668899
1.338972+2.231346+0.668899+0.223281=0.149893
Fraksimol O2=
0.223281
1.338972+2.231346+0.668899+0.223281=0.050035
Berat molekul rata−rata= jumlah massacampuran
jumlah mol campuran
¿108.5115
4.462498=24.31631
Tekanan parsial N2=nRT
V =
Tekanan parsial CO=nRT
V =
Tekanan parsial H2=nRT
Tekanan parsial O2=nRTV =0.223281mol ×8.314m 3
K−1 mol−1
×273K
5m3
¿101.3572Pa
Densitas campuran= massa campuran
volume campuran=
108.115kg
100m3 =1.08115kg m
−3
6. Dalam kunjungan ini, mahasiswa juga belajar mengenai gas cair, salah satu produk dari PT X Indonesia ini. Berdasarkan keterangan yang sudah diperoleh dari industri tersebut, jelaskan bagaimana suatu gas bisa dicairkan.
JAWAB:
Liquifikasi gas alam terdiri dari berbagai macam proses, dengan urutan sebagai berikut:
1. Treating
Treating dilakukan sebagai penghilang impuritis dan fraksi berat dengan menggunakan solvent sebagai pelarut ataupun penyerap. Zat yang impuritisnya dihilangkan yaitu zat-zat berbahaya.
2. Pengeringan Air
Air akan membeku pada suhu 00C. Suhu tersebut jauh lebih besar
daripada suhu untuk mencairkan suatu gas sehingga apabila gas dicairkan maka uap air yang terkandung di gas tersebut akan membeku dan menyumbat berbagai alat-alat proses pencairan gas. Untuk itu, dilakukan pengeringan uap air dengan menggunakan molecular sieve adsorbtion.
3. Fraksinasi
Setelah uap air pada gas hilang, gas akan dipisahkan komponen-komponen penyusunnya, lalu dikelompokkan ke tahap prosesnya masing-masing. Proses ini dapat disebut juga proses fraksinasi.
Setelah dikelompokkan, gas yang ingin kita gunakan akan didinginkan hingga gas tersebut mulai mengembun. Hal ini dapat dibantu degan menaikkan tekanannya. Setelah itu gas akan mulai mencair dan menjadi
liquid.
7. Dari hasil kunjungan pabrik yang sudah dilakukan, berikanlah keterangan sinngkat tentang gas O2, H2, dan N2 yang anda ketahui, tentang proses
pembuatan, penyimpanan, dan pemanfaatannya.
JAWAB: a. Oksigen
Pembuatan
Pembuatan gas oksigen dilakukan dengan cara distilasi udara cair. Udara yang mngandung 21% oksigen dan 78% nitrogen didinginkan hingga suhu -200°C dengan tekanan tinggi sehingga udara mencair. Kemudian, udara cair tersebut secara berangsur-angsur dipanaskan. Pada suhu -183°C, oksigen cair akan menguap sehingga dapat dipisahkan dari gas lainnya.
Penyimpanan
Oksigen dapat ditemukan secara bebas di udara, akan tetapi penyimpananya dapat ditempatkan di botol dengan syarat sebagai berikut
a. Dalam penyimpanan botol baja kosong semua valve harus tertutup.
b. Botol baja harus disimpan dalam ruangan yang kering dan vetilasi yang baik dan dijauhkan dari zat-zat yang bersifat korosif.
c. Tutup valve harus selalu terpasang dengan baik.
d. Botol baja harus di simpan di tempat yang aman terhadap getaran atau penyebab-penyebab lain yang mengakibatkan terjatuhnya botol baja.
e. Penyimpanan botol baja kosong dan botol berisi harus dipisahkan.
Pemanfaatan
a. Untuk pernafasan para penyelam, angkasawan, atau penderita penyakit tertentu
b. Dalam industri baja, untuk mengurangi kadar karbon dalam besi gubal
c. Bersama-sama dengan gas asetilena, digunakan untuk mengelas baja
d. Oksigen cair bersama dengan hydrogen cair digunakan sebagai bahan bakar roket untuk mendorong pesawat ruang angkasa
e. Dalam berbagai industri kimia, untuk mengoksidasikan berbagai zat
f. Digunakan dalam pengolahan besi menjadi baja di tanur terbuka (tanur oksigen)
g. Berperan dalam aerasi limbah industri b. Hidrogen
Pembuatan
Dalam skala industri, hydrogen dihasilkan dari uap air dengan metana atau hidrokarbon ringan dengan katalis nikel pada suhu 75°C menghasilkan campuran karbon monoksida dan hydrogen. Campuran gas ini disebut “synthesis gas” atau “syngas”.
Penyimpanan
a. Tangki bertekanan tinggi
b. Cyrogenic
c. Logam dan alloy
d. Kimiawi, dengan kondisi hidrogen yang disimpan dalam bentuk senyawa lain seperti metanol, ammonia, dan hibrida logam. e. Fisisorpsi, dengan mengadsorpsi hidrogen pada permukaan
bahan berpori
Pemanfaatan
b. Pembentukan logam dai oksidanya c. Hydrogen sebagai bahan baker d. Untuk hidrogenasi lemak dan minyak e. Sebagai bahan baker roket
f. Mereduksi bijih-bijih besi g. Sebagai gas pengisi balon c. Nitrogen
Pembuatan
Pembuatan gas nitrogen dilakukan bersamaan dengan pembuatan gas oksigen karena sumbernya juga sama, yaitu udara. Udara yang mengandung 78 % gas nitrogen, didinginkan sehingga diperoleh nitrogen dan oksigen cair. Selanjutnya, cairan tersebut didistilasi pada suhu -195,8°C. Nitrogen cair akan menguap dan terpisah dengan oksigen cair. Uap nitrogen ini, kemudian ditampung dan dapat digunakan sesuai keperluan.
Penyimpanan
Untuk penyimpanan nitrogen, penyimpanan hampir sama dengan hidrogen, hanya berbeda di tekanan dan faktor-faktor lainnya.
Pemanfaatan
a. Untuk pembuatan ammonia
b. Untuk membuat atmosfer inert dalam berbagai proses yang terganggu oleh oksigen, misalnya dalam industri elektronika
c. Sebagai atmosfer inert dalam makanan kemasan untuk memperpanjang masa penggunaannya
d. Nitrogen cair digunakan sebgai pendingin untuk menciptakan suhu yang sangat rendah
2.2 Problem B
penataan rute baru atau juga penambahan rambu-rambu lalu lintas. Untuk keperluan ini, sekelompok mahasiswa yang sedang belajar teori kinetik gas membantu pihak Jasa Marga melakukan pengamatan untuk menghitung volume kendaraan yang lewat di jalan tol Jagorawi ke arah Jakarta (J) dan ke arah Bogor (B). Mereka menggunakan sensor yang diletakkan di dua titik, arah Jakarta dan arah Bogor. Sensor kemudian dihubungkan dengan PC yang akan memproses data dan menampilkan data dalam bentuk kecepatan (km/jam) dan volume kendaraan. Data yang didapatkan adalah sebagai berikut:
J Kecepatan(km/jam
1. Untuk dapat memahami teori kinetika gas, kelompok mahasiswa mengasumsikan bahwa setiap mobil yang melaju adalah suatu molekul gas yang berada dalam suatu ruangan dengan volume V. Jika anda adalah mahasiswa tersebut, jelaskan postulat yang mendasari teori kinetika gas, dan bagaimana Anda dapat menerangkan distribusi kecepatan molekul gas berdasarkan data yang ada di tabel.
JAWAB:
Postulat teori kinetik gas:
Gas dianggap tersusun atas partikel kecil yang disebut molekul dan setiap gas tersusun atas molekul yang memiliki massa dan ukuran sama
Molekul dalam wadah bergerak secara tidak beraturan dan setiap molekul bertumbukkan satu sama lain dan bertumbukkan dengan dinding wadah
Selama tekanan gas dalam wadah tidak berubah maka tumbukkan antar molekul tidak melibatkan perubahan energi akibat gesekan, atau semua tumbukkan molekul bersifat elastik
Temperatur absolut sebanding dengan energi kinetik rata-rata dari semua molekul pada sistem
Pada tekanan yang relatif rendah jarak antar molekul lebih besar dibanding dengan diameter molekul, sehingga gaya tarik antar molekul yang bergantung pada jarak antar molekul dapat diabaikan
Ukuran molekul kecil dibanding dengan jarak antar molekul sehingga volumenya dapat diabaikan dibanding total volume gas.
Dari data tabel di atas, sesuai dengan teori distribusi kecepatan Maxwell-Boltzman bahwa molekul-molekul suatu gas bergerak dengan kecepatan yang bervariasi, molekul yang bergerak pada kecepatan sangat rendah dan sangat tinggi sedikit jumlah nya. Menurut teori distribusi kecepatan terdapat 3 jenis kecepatan pada molekul gas, yaitu: kecepatan rata-rata v, kecepatan root mean square (rms) u, dan kecepatan yang paling mungkin (most probable velocity) α, dimana:
Berdasarkan data tabel diperoleh bahwa kecepatan yang paling banyak dimiliki oleh kendaraaan adalah 85 km/jam yaitu sebanyak 121 kendaraan. Jika kendaraan dianggap sebagai molekul gas, maka kecepatan yang paling mungkin (most probable velocity) pada gas tersebut adalah 85 km/jam.
Kecepatan rata-rata (v) dapat dihitung dengan merata-rata data tabel, yaitu: perbandingan dengan kecepatan rata-rata v. Nilai perbandingan u : v yaitu 1,224 : 1,128
Sehingga diperoleh nilai u = 1,224
1,128×86,235=93,574
km jam
2. Bayangkan mobil-mobil yang melaju di jalan tersebut adalah molekul-molekul gas yang berada dalam suatu ruangan, dengan diameter s, jelaskan bagaimana anda dapat menentukan jumlah tumbukan yang terjadi antar mobil per volume per jam. Jelaskan juga bagaimana cara menentukan jalan bebas rata-rata dan viskositas gas!
JAWAB:
Jumlah tumbukan pada molekul gas dapat dihitung dengan persamaan
Nc= 1
√
2πv σ2 n2
Dimana v kecepatan rata-rata molekul, σ diameter molekul, n jumlah molekul (mobil).
Jalan bebas rata-rata dapat dihitung dengan persamaan
l= 1
Sehingga pada kasus ini l= 1
√
2π s2.328=6,86.10−4s−2m
Dan untuk menghitung viskositas gas dapat digunakan persamaan berikut:
η=1 3vlρ
Dimana η adalah viskositas, v kecepatan rata-rata, l jalan bebas rata-rata, dan ρ adalah massa jenis gas
2.3 Problem C
Green Chemistry ‘kimia hijau’, adalah suatu istilah yang saat ini sedang menjadi topik hangat untuk dikembangkan dan diaplikasikan dalam dunia industri. Berbagai usaha untuk menerapkan Green Chemistry telah dilakukan oleh beberapa institusi
maupun negara. Pada tahun 1995, dilakukan inisiasi Presidential Green Chemistry
Challenge Awards di US untuk mendorong pengembangan dari “teknologi hijau” melalui sisi akademis maupun komersialitas. Disamping itu, pada awal abad ke-21, diterbitkannya jurnal Green Chemistry oleh The Royal Society of Chemistry dan
diadakannya kerjasama antara American Chemical Society dengan Green Chemistry
Institute dalam rangka mencegah polusi di masa mendatang melalui penelitian dan
juga pendidikan kimia ataupun teknik kimia. Salah satu penerapan Green Chemistry
di industri adalah penggunaan cairan superkritis. Cairan ini digunakan sebagai pelarut untuk menggantikan pelarut yang mudah menguap. Cairan superkritis mempunyai sifat-sifat gas dalam kaitannya sebagai zat pengangkut. Beberapa contoh dari cairan superkritis adalah xenon, karbon dioksida, etana, propana, amonia, pentana, etanol, toluena, 1,2-etandiamin, dan juga air.
Pertanyaan:
1. Pada kondisi kritis, sifat fisik cairan dan uap menjadi identik dan tidak ada perbedaan yang dapat diamati diantara mereka. Jadi masing-masing temperatur, tekanan uap jenuh dan volume molar yang berhubungan pada titik ini disebut sebagai temperatur kritikal (TC), tekanan kritikal (PC), dan volume
cairan dan berikan contoh. Jelaskan bedanya dengan cairan superkritis. Berikanlah penjelasan singkat tentang fungsi dan manfaat cairan pada kondisi kritis ataupun superkritikal berbanding dengan cairan pada kondisi STP.
JAWAB
Jika cairan seperti air dan disegel pada tabung tertutup, sejumlah air tersebut akan menguap membentuak sebuah uap. Uap ini akan mendesak tekanan, sama seperti gas dan lainnya. Dengan temperatur konstan, kesetimbangan akan terbentuk antara fase cair dan uap. Tekanan uap yang dibentuk adalah karakteristik untuk setiap cairan dan konstan pada setiap temperatur tertentu dan dikenal sebagai tekanan uap jenuh dari cairan. Tekanan uap jenuh meningkat sebanding dengan suhu. Kondisi dimana fluida ini berganti fasa dari cairan ke uap disebut titik kritis. Suhu, tekanan uap jenuh, dan volume molar pada titik ini disebut dengan temperatur kritis, tekanan kritis, dan volume kritis. Nilai-nilai mereka yang konstan dan berciri khas pada karakteristik yang berbeda dalam setiap bahan dikenal sebagai konstanta kritis. Manfaat cairan pada kondisi kritis dibandingkan dengan cairan pada kondisi STP, apabila kita mengambil contoh CO2, yaitu dipakai sebagai pelarut
pada ekstraksi, misalkan ekstraksi kafein dari kopi, sebagai fase gerak pada kromatografi, dry cleaning, dan juga sebagai media pada sintesis polimer dan monomaterial.
2. Salah satu cairan superkritis yang banyak digunakan sebagai pelarut adalah
CO2 superkritis. Carilah satu referensi yang menjelaskan penggunaan CO2
dengan slogan Green Chemistry di bidang lainnya, sertakan dengan referensi yang mendukung.
JAWAB
Beberapa manfaat CO2 superkritis adalah, dry cleaning yang aman dengan
menggunakan superkritis CO2. Pada sistem dry cleaning ini, proses
pembersihan dilakukan dengan prinsip ekstraksi atau pemisahan dengan superkritis CO2 sebagai pelarut. Superkritis CO2 menggantikan
tetrachloroethylene yang digunakan sebagai pelarut dalam proses dry cleaning. Tetrachloroethylene memiliki daya pembersih yang sangat bagus, stabil, dan tidak mudah terbakar. Namun, senyawa tersebut merupakan kelompok senyawa karsinogenik. Pada industri makanan, superkritis CO2 juga dapat
digunakan untuk memisahkan senyawa-senyawa yang tidak diperlukan oleh tubuh manusia. Superkritis CO2 dapat memisahkan cafein dari kopi tanpa
mengurangi kekhasan dari aroma kopi sendiri. Pada bidang – bidang biomedis, Pemanfaatan pada bidang ini didasarkan pada sifat superkritis CO2 yang
memiliki karakteristik gas. Dalam biomedis, diperlukan material berpori yang dapat menjadi media tumbuh dari sel dalam tubuh manusia. Dengan kemampuan difusi / penetrasi seperti gas, superkritis CO2 dapat dengan mudah
masuk ke dalam bahan polimer sehingga terbentuk pori-pori.
Kelebihan CO2 superkritis dibanding pelarut lain dapat dilihat dari titik
kritis yang dimiliki, CO2 dapat mencapai kondisi superkritis pada temperatur
dan tekanan yang relatif rendah (304,2 K dan 72,9 atm) sehingga secara operasional hanya memerlukan biaya yang relatif sedikit. Superkritis CO2
memiliki karakteristik yang sangat unik: memiliki kerapatan seperti cairan sekaligus memiliki kemampuan difusi seperti gas dan juga memiliki nilai tegangan permukaaan nol. Dari keunikan inilah superkritis CO2 dapat
dimanfaatkan sebagai alternatif pelarut dalam berbagai proses. Dengan kerapatan seperti cairan, superkritis CO2 dapat digunakan sebagai pengganti
pelarut organik.
yang mendorong untuk mendisain suatu proses dan produk yang meminimalisasir penggunaan subtansi yang berbahaya. Pada green chemistry CO2 digunakan sebagai pelarut yang murah dan ramah lingkungan. Green
DAFTAR PUSTAKA
Anonim. Maxwell-Boltzman Distribution. http://chemwiki.ucdavis.edu/Physical_ Chemistry/Kinetics/Rate_Laws/Gas_Phase_Kinetics/Maxwell-Boltzmann_ Distributions.
Atkins Peter dan Paula, Julio. 2006. Physical Chemistry. 8th edition. New York: W. H.
Freeman and Company
Perry, Robert H. dan Don W. Green. 2008. Perry’s Chemical Engineers’ Handbook. 8thEdition. United States of America : The McGraw-Hill Companies, Inc.
Maron, Samuel H dan Lando, Jerome B. 1974. Fundamentals of Physical Chemistry.