3.1. Waktu dan Lokasi Penelitian
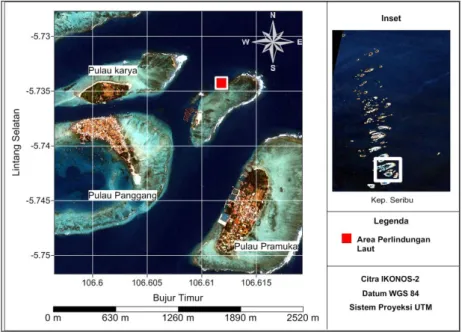
Pengambilan sampel karang lunak dilakukan pada bulan Juli dan Agustus 2010 di Area Perlindungan Laut Pulau Pramuka, Kepulauan Seribu, DKI Jakarta pada koordinat 106˚ 36’ 42,5” BT dan 5˚ 44’ 3,7” LS. Lokasi pengambilan sampel dapat dilihat di Gambar 4.
Gambar 4. Lokasi Pengambilan Sampel Karang Lunak Sarcophyton sp. Alami dan Hasil Transplantasi di Area Perlindungan Laut Pulau Pramuka,
Kepulauan Seribu
Kegiatan transplantasi dilakukan oleh Hakim (2010) pada bulan September 2008 pada dua kedalaman, yaitu 3 dan 12 meter di Area Perlindungan Laut, Pulau Pramuka, Kep. Seribu. Sampel karang lunak Sarcophyton sp. yang digunakan dalam penelitian ini adalah karang lunak Sarcophyton sp. yang berada di
mendapatkan sinar matahari yang cukup sehingga karang lunak Sarcophyton sp. dapat tumbuh secara optimal.
Penelitian laboratorium dilakukan pada bulan Juli-November 2010 bertempat di Laboratorium Kering Hidrobiologi Departemen Ilmu dan Teknologi Kelautan IPB, Laboratorium Produktivitas Lingkungan Departemen Manajemen
Sumberdaya Perairan, Laboratorium Mikrobiologi Hasil Perairan, dan
Laboratorium Bioteknologi Hasil Perairan Departemen Teknologi Hasil Perairan IPB.
3.2. Alat dan Bahan
Alat yang digunakan untuk mengambil sampel karang lunak adalah peralatan SCUBA, cool box, alat tulis, dan pisau selam untuk mengambil sampel. Bahan yang digunakan selama kegiatan laboratorium yaitu karang lunak Sarcophyton sp. alami dan hasil transplantasi, pelarut metanol p.a., pelarut etil asetat p.a., pelarut heksana p.a., aquades, larutan DPPH, dan berbagai pereaksi uji fitokimia. Alat yang digunakan diantaranya orbital shaker, kertas saring kasar dan whatman, spektrofotometer, labu erlenmeyer, timbangan digital, freezer, tabung reaksi, gelas ukur, vacuum evaporator, pipet tetes, dan pipet mikro.
3.3. Metode Penelitian
3.3.1. Pengambilan Sampel Alami dan Transplantasi
Pengambilan sampel karang lunak dilakukan pada kedalaman 3 meter di Area Perlindungan Laut Pulau Pramuka Kepulauan Seribu, tepatnya pada 106˚ 36’ 42,5” BT dan 5˚ 44’ 3,7” LS. Pengambilan sampel menggunakan alat SCUBA
dan pisau untuk memotong karang lunak dari substratnya dan ditempatkan di keranjang jaring. Karang lunak Sarcophyton sp. yang berada di Area
Perlindungan Laut tersebut diambil sebanyak 300 g untuk sampel alami dan 300 g untuk sampel hasil transplantasi. Kemudian sampel dipindahkan ke cool box yang telah diisi dengan es batu dan blue ice sehingga suhunya tetap rendah agar enzim dan bakteri pembusuk yang mempercepat pembusukan menjadi tidak aktif. Sampel dibawa ke laboratorium dan dimasukkan ke dalam freezer agar sampel tetap berada pada suhu rendah sehingga tidak terjadi pembusukan sebelum dilakukan tahap selanjutnya yaitu ekstraksi senyawa aktif.
3.3.2. Ekstraksi Senyawa Bioaktif
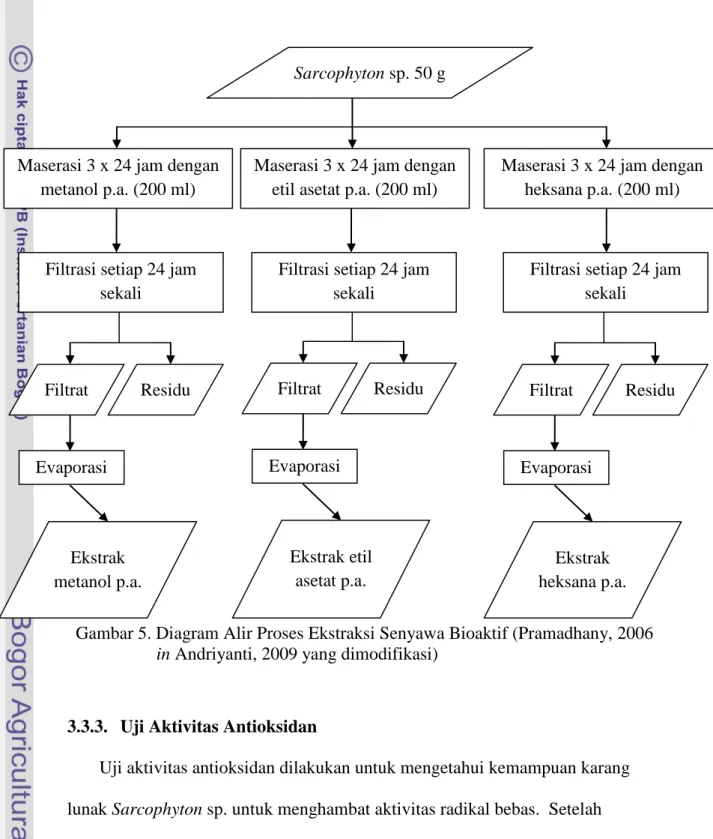
Sampel Sarcophyton sp. dipotong kecil-kecil dan kemudian ditimbang masing-masing 50 g untuk dimaserasi dengan perbandingan sampel dan pelarut 1:4 selama 3 x 24 jam. Ekstraksi ini menggunakan metode ekstraksi tunggal, yaitu setiap pelarut dicampurkan dengan sampel yang belum pernah dilarutkan dengan pelarut lain sebelumnya. Pada setiap sampel (50 g) ditambahkan pelarut (200 ml) dengan tujuan agar komponen bioaktif pada sampel karang lunak
Sarcophyton sp. terlarut dalam pelarut tersebut. Masing-masing pelarut mewakili senyawa dengan tingkat kepolaran yang berbeda, metanol p.a. sebagai pelarut polar, etil asetat p.a. sebagai pelarut semi polar, dan heksana p.a. sebagai pelarut non polar. Kemudian hasil maserasi dari masing-masing pelarut disaring
menggunakan kertas saring kasar dan whatman hingga diperoleh filtrat dan residu. Penyaringan ini dilakukan setiap 24 jam sekali dari maserasi. Filtrat hasil
menggunakan vacuum evaporator hingga didapatkan pelarut dan ekstrak yang terpisah. Diagram alir proses ekstraksi senyawa bioaktif menggunakan pelarut metanol p.a, etil asetat p.a, dan heksana p.a dapat dilihat pada Gambar 5.
Gambar 5. Diagram Alir Proses Ekstraksi Senyawa Bioaktif (Pramadhany, 2006 in Andriyanti, 2009 yang dimodifikasi)
3.3.3. Uji Aktivitas Antioksidan
Uji aktivitas antioksidan dilakukan untuk mengetahui kemampuan karang lunak Sarcophyton sp. untuk menghambat aktivitas radikal bebas. Setelah didapatkan ketiga jenis ekstrak maka langkah selanjutnya ialah melakukan uji
Sarcophyton sp. 50 g
Maserasi 3 x 24 jam dengan metanol p.a. (200 ml)
Filtrasi setiap 24 jam sekali Residu Evaporasi Filtrat Ekstrak metanol p.a.
Maserasi 3 x 24 jam dengan etil asetat p.a. (200 ml)
Filtrasi setiap 24 jam sekali Residu Evaporasi Filtrat Ekstrak etil asetat p.a.
Maserasi 3 x 24 jam dengan heksana p.a. (200 ml)
Filtrasi setiap 24 jam sekali Residu Evaporasi Filtrat Ekstrak heksana p.a.
aktivitas antioksidan dengan menggunakan DPPH (2,2 diphenyl 1-picrylhydrazil). Larutan DPPH yang digunakan, dibuat dengan melarutkan kristal DPPH sebanyak 0,0197 gram dalam pelarut metanol p.a. dengan konsentrasi 1 mM. Larutan induk dari masing-masing ekstrak kasar dibuat dengan mencampurkan ekstrak kasar tersebut dengan metanol p.a. sebanyak 50 ml. Setelah itu diencerkan
konsentrasinya menjadi 200 ppm, 400 ppm, 600 ppm, dan 800 ppm. Kemudian dari masing-masing konsentrasi tersebut diambil 4 ml dan dicampurkan dengan larutan DPPH 1 ml. Campuran tersebut diinkubasi pada suhu 37°C selama 30 menit, kemudian diukur absorbansinya dengan menggunakan spektrofotometer pada panjang gelombang 517 nm. Pengujian ini dilakukan dari konsentrasi 200 ppm berurutan hingga 800 ppm. Diagram alir proses uji DPPH dapat dilihat pada Gambar 6.
Gambar 6. Diagram Alir Uji Aktivitas Antioksidan Karang Lunak
Sarcophyton sp. Alami dan Hasil Transplantasi (Blois, 1958 in Hanani et al., 2005 yang dimodifikasi)
Diagram alir pada Gambar 6 berlaku untuk setiap ekstrak dari sampel karang lunak alami dan transplantasi dengan pelarut metanol p.a., etil asetat p.a., dan heksana p.a. Pengujian kualitatif dari metode DPPH yaitu dengan melihat warna larutan sampel ketika dicampurkan dengan DPPH. Adanya perubahan warna ungu pada DPPH menjadi ungu yang lebih muda atau adanya warna kuning ketika pencampuran dilakukan menandakan terdapatnya aktivitas antioksidan pada larutan sampel karang lunak tersebut. Pengujian kuantitatif metode DPPH dilakukan dengan cara menghitung nilai persen inhibisi dan dilanjutkan dengan perhitungan nilai IC50. Persen inhibisi adalah nilai penghambatan radikal bebas
Ekstrak 0,05 gram
Larutan sampel 4 ml dicampurkan dengan larutan DPPH 1 ml Pengenceran dengan metanol p.a.
400 ppm (10 ml) 200 ppm (10 ml) 600 ppm (10 ml) 800 ppm (10 ml)
Inkubasi 30 menit pada suhu 37˚C
Ukur absorbansi dengan panjang gelombang 517 nm
sedangkan IC50 atau Inhibitor Concentration 50% menyatakan konsentrasi larutan
sampel yang dibutuhkan untuk mereduksi DPPH sebesar 50%. Semakin kecil nilai IC50 maka semakin besar aktivitas antioksidan pada suatu bahan.
Molyneux (2004) menyatakan bahwa metode uji aktivitas antioksidan dengan DPPH merupakan yang metode yang paling banyak digunakan. DPPH
(diphenylpicrylhydrazyl) merupakan senyawa radikal bebas yang larut dalam pelarut polar seperti metanol dan etanol. DPPH merupakan radikal yang stabil yang dapat diukur intensitasnya pada panjang gelombang 515 nm (Rohman dan Riyanto, 2005).
3.3.4. Uji Fitokimia (Harbonne, 1987)
Sampel yang diambil untuk diuji fitokimia adalah ekstrak karang lunak dari pelarut yang memiliki nilai IC50 paling besar. Uji fitokimia bertujuan untuk
menentukan komponen bioaktif yang terkandung dalam suatu bahan. Identifikasi kandungan bioaktif dalam karang lunak Sarcophyton sp. dilakukan dengan pengujian berikut:
a. Uji Alkaloid
Sejumlah sampel dilarutkan dalam beberapa tetes asam sulfat 2 N kemudian diuji dengan tiga pereaksi alkaloid, yaitu pereaksi Dragendroff, Meyer dan Wagner. Hasil uji dinyatakan positif bila dengan pereaksi Meyer membentuk endapan putih kekuningan, dengan pereaksi Wagner membentuk endapan cokelat dan dengan pereaksi Dragendroff membentuk endapan merah sampai jingga. Berikut ini prosedur dalam pembuatan pereaksi Meyer, Wagner, dan Dragendroff:
1. Pereaksi Meyer dibuat dengan cara menambahkan 1,36 gram HgCl2 dengan
0,5 gram kalium iodida lalu dilarutkan dan diencerkan dengan akuades menjadi 100 ml dengan labu takar. Pereaksi tidak berwarna.
2. Pereaksi Wagner dibuat dengan cara 10 ml akuades dipipet kemudian 2,5 gram iodin dan 2 gram kalium iodida lalu dilarutkan dan diencerkan dengan akuades menjadi 200 ml dalam labu takar. Pereaksi ini berwarna coklat. 3. Pereaksi Dragendroff dibuat dengan cara 0,8 bimut subnitrat ditambahkan 10
ml asam asetat dan 40 ml air. Larutan ini dicampur dengan larutan yang dibuat dari 8 gram kalium iodida dalam 20 ml air. Sebelum digunakan, 1 volume campuran ini diencerkan dengan 2,3 volume campuran 20 ml asam asetat glacial dan 100 ml air. Pereaksi berwarna jingga.
b. Uji Steroid
Sebanyak 0,5 gram sampel dilarutkan dalam 2 ml kloroform dalam tabung reaksi. Anhidrida asetat sebanyak 10 tetes dilanjutkan dengan asam sulfat pekat sebanyak 3 tetes ditambahkan ke dalam campuran tersebut. Hasil uji positif sampel mengandung steroid yaitu terbentuknya larutan berwarna merah untuk pertama kali kemudian berubah menjadi biru dan hijau.
c. Uji Flavonoid
Sebanyak 0,05 gram sampel ditambah serbuk magnesium 0,1 mg dan 0,4 ml amil alkohol (campuran asam klorida 37% dan etanol 95% dengan volume yang sama) dan 4 ml alkohol 70%, kemudian campuran dikocok. Hasil uji positif sampel mengandung flavonoid yaitu terbentuknya warna merah, kuning atau jingga pada lapisan amil alkohol.
d. Uji Saponin (uji busa)
Saponin dapat dideteksi dengan uji busa dalam air panas. Busa yang stabil selama 30 menit dan tidak hilang pada penambahan 1 tetes HCl 2 N menunjukkan sampel mengandung saponin.
e. Uji Fenol Hidrokuinon (pereaksi FeCl3)
Sebanyak 1 gram sampel karang lunak diekstrak dengan 20 ml etanol 70%. Larutan yang dihasilkan diambil sebanyak 1 ml kemudian ditambahkan 2 tetes larutan FeCl3 5%. Hasil uji positif sampel mengandung senyawa fenol yaitu
terbentuknya larutan berwarna hijau atau hijau biru. f. Uji Molisch
Sebanyak 1 ml larutan sampel ditambahkan 2 tetes pereaksi molisch dan 1 ml asam sulfat pekat melalui dinding tabung. Hasil uji positif sampel mengandung karbohidrat ditandai oleh terbentuknya kompleks berwarna ungu diantara 2 lapisan cairan.
g. Uji Benedict
Larutan sampel sebanyak 8 tetes dimasukkan ke dalam 5 ml pereaksi benedict. Campuran dikocok dan dididihkan selama 5 menit. Hasil uji positif sampel mengandung gula pereduksi yaitu terbentuknya larutan berwarna hijau, kuning atau endapan merah bata.
h. Uji Biuret
Larutan sampel sebanyak 1 ml ditambahkan pereaksi biuret sebanyak 4 ml. campuran dikocok dengan seksama. Hasil uji positif sampel mengandung senyawa peptida yaitu terbentuknya larutan berwarna ungu.
i. Uji Ninhidrin
Larutan sampel sebanyak 2 ml ditambahkan beberapa tetes larutan ninhidrin 0,1%. Campuran dipanaskan dalam penangas air selama 10 menit. Hasil uji positif sampel mengandung asam amino yaitu terbentuknya larutan berwarna biru.
3.4. Analisis Data 3.4.1. Rendemen Ekstrak
Rendemen ekstrak adalah perbandingan antara bobot ekstrak yang dihasilkan (gram) dengan bobot sampel awal sebelum diekstraksi (gram). Rendemen ekstrak digunakan untuk menentukan berapa persen kandungan bioaktif yang terdapat pada suatu bahan. Persentase rendemen ekstrak dihitung dengan rumus berikut:
... (1) Keterangan:
Pr : Persen rendemen Be : Bobot ekstrak Bs : Bobot sampel awal
3.4.2. Persen inhibisi dan IC50
Persen inhibisi adalah perbandingan antara selisih dari absorbansi blanko dan absorbansi sampel dengan absorbansi blanko. Persen inhibisi digunakan untuk menentukan persentase hambatan dari suatu bahan yang dilakukan terhadap senyawa radikal bebas. Persen inhibisi dihitung dengan rumus berikut:
Keterangan:
Pi : Persen inhibisi Ab : Absorbansi blanko As : Absorbansi sampel
Nilai persen inhibisi yang telah dihitung dari setiap konsentrasi
(200-800 ppm) selanjutnya digunakan untuk perhitungan IC50. IC50 atau Inhibitor
Concentration 50% adalah nilai konsentrasi suatu bahan untuk menghambat aktivitas DPPH sebesar 50%. Nilai konsentrasi dari larutan yang telah diencerkan dari ekstrak dan persen inhibisi diplotkan masing-masing pada sumbu x dan y. Kemudian nilai IC50 dihitung dengan regresi linear y = a(x) + b, dengan
menyatakan nilai y sebesar 50 dan nilai x sebagai IC50.
3.4.3. Pengaruh Transplantasi terhadap Kandungan Antioksidan
Perlakuan pada penelitian ini adalah sampel jenis alami dan transplantasi. Semua perlakuan dilakukan sebanyak dua kali ulangan. Rancangan percobaan yang digunakan untuk menganalisis data hasil uji kandungan antioksidan dengan DPPH adalah Rancangan Acak Faktorial (RAF) dengan model sebagai berikut:
Yijk = μ + αi + βj + (αβ)ij + εijk ………. (3) Keterangan:
Yijk = Pengamatan pada satuan percobaan ke-k yang memperoleh kombinasi perlakuan taraf ke-I dari faktor A dan taraf ke-j dari faktor B
μ = Mean populasi
βj = Pengaruh taraf ke-j dari faktor B
(αβ)ij = Pengaruh taraf ke-i dari faktor A dan taraf ke-j dari faktor B
εijk = Pengaruh acak dari satuan percobaan ke-k yang memperoleh kombinasi perlakuan ij
Hipotesis Rancangan Acak Faktorial terhadap hasil uji kandungan antioksidan dengan DPPH adalah sebagai berikut:
H0 = perlakuan transplantasi tidak berpengaruh nyata H1 = perlakuan transplantasi berpengaruh nyata
Apabila hasil analisis ragam (ANOVA) pada hasil uji kandungan antioksidan dengan DPPH berbeda nyata pada selang kepercayaan 95%, maka dilanjutkan dengan uji Beda Nyata Terkecil dengan rumus sebagai berikut:
T(α,dbs) x
……… (4)
Keterangan:
T = nilai table T-Student pada taraf nyata α dengan derajat bebas sisa dbs α = taraf nyata
kts = kuadrat tengah sisa r = ulangan