BAHAN DAN METODE PENELITIAN
Waktu dan Tempat
Penelitian dilakukan pada bulan Juni 2008 sampai Februari 2009. Tahapan penelitian, dibagi dua tahap. Tahap I, meliputi; 1) Sampling hewan uji, 2) Koleksi testes dan penghitungan konsentrasi spermatofor, 3) Pengukuran diameter dan koleksi spermatofor, 4) Penghitungan jumlah spermatozoa dalam spermatofor, dan 5) Preservasi spermatofor. Tahap II, preparasi Scanning Electron Microscope (SEM). Penelitian dilakukan di Laboratorium Embriologi, Laboratorium Unit Rehabilitas Reproduksi (URR) dan Laboratorium Histologi FKH-IPB. Pengamatan morfologi spermatofor dan spermatozoa (Scylla olivacea) dengan SEM dilakukan di Lembaga Ilmu Pengetahuan Indonesia (LIPI), Cibinong.
Hewan Uji
Hewan uji yang digunakan dalam penelitian ini adalah kepiting bakau merah jantan (Scylla olivacea) sebagai sumber testes, spermatofor, dan spermatozoa yang berasal dari tiga lokasi pengambilan sampel (Jawa Barat, Sulawesi Selatan, dan Papua Barat) yang memiliki kisaran ukuran karapas berkisar 8-15 cm dan bobot tubuh 200-500 gr.
Tahapan Penelitian I Sampling Hewan Uji
Pengambilan hewan uji dari tiga daerah, yaitu; Jawa (Blanakan, Jawa Barat), Sulawesi (Maros, Sulawesi Selatan) dan Papua (Fak-Fak, Papua Barat), yang diperoleh dari pengumpul lokal. Pemilihan spesimen berdasarkan morfologi tubuh yang normal, sehat, serta kondisi badan yang lengkap. Spesimen yang diambil sebanyak ± 16 ekor tiap lokasi penelitian. Spesimen ditampung sementara untuk adaptasi di URR-FKH IPB. Pengukuran karakteristik morfometrik kepiting bakau merah mengikuti petunjuk Warner (1977), pengukuran panjang dan lebar karapas menggunakan mikrometer dengan
29 ketelitian 0.05 mm. Pengukuran karapas diukur dari letak antara gigi median sampai tepi posterior karapas dalam bentuk garis lurus, sedangkan lebar karapas diukur dari kedua gigi anterolateral. Berat kepiting secara individual dihitung dengan menggunakan timbangan.
Koleksi Testes dan Penghitungan Konsentrasi Spermatofor
Kepiting bakau terlebih dahulu dibersihkan, selanjutnya dipingsankan dalam freezer (-30oC). Setelah pingsan, kepiting dibedah pada bagian cefalatorak untuk pengambilan jaringan testes. Jaringan testes, ditimbang dengan timbangan elektrik (Electonic Analytical Balance, ANDGR-200). Setelah itu dicuci dalam larutan NaCl fisiologis 0.82 %, dan dikeringkan dengan kertas saring.
Untuk penghitungan konsentrasi spermatofor, testes dicacah dengan gunting steril, cairan yang keluar diambil dengan mikropipet sebanyak 10 μL dan dilarutkan dengan 990 μL larutan Ca ++Saline (1:10) dalam mikrotube 1.5 mL. Kedua larutan dihomogenkan, sebanyak 10 μL dari campuran tersebut diteteskan ke gelas objek dan dilakukan penghitungan seluruh spermatofor yang terlihat dibawah mikroskop dan dilakukan pengulangan sebanyak tiga kali. Penghitungan konsentrasi spermatofor per individu menggunakan rumus : (∑ spermatofor yang teramati X 10 μL larutan yang diambil dari mikrotube berisi kedua larutan yang telah dihomogen tersebut).
Pengukuran Diameter dan Koleksi Spermatofor
Pengukuran diameter spermatofor kepiting bakau merah menggunakan mikroskop yang dilengkapi mikrometer okuler. Spermatofor yang diukur berkisar ± 250 buah untuk tiap individu. Setiap spermatofor diukur berdasarkan ukuran terbesar sampai terkecil, hal ini dilakukan untuk mengetahui kisaran ukuran diameter spermatofor.
Koleksi spermatofor dilakukan dengan mengambil spermatofor segar dari bagian tengah vas deferen pada jaringan testes dengan cara menusuk dinding tipis dari bagian tengah vas deferen, seminal plasma yang mengandung spermatofor dikoleksi dalam petri dish (Bhavanishankar & Subramonian 1997; Sato et al. 2004), menggunakan mikroskop stereo (Nikon, SMZ-2T, Japan).
Penghitungan Jumlah Spermatozoa
Penghitungan konsentrasi spermatozoa dilakukan dengan cara mengeluarkan spermatozoa dari spermatofor (Bhavanishankar & Subramonian 1997). Pengeluaran spermatozoa dari spermatofor dilakukan dengan pronase dengan prosedur, sebagai berikut; 1) Spermatofor dikoleksi sesuai dengan klasifikasi ukuran yang telah ditentukan, diletakkan dalam objek gelas dan diteteskan dengan 2 μL pronase 0.05 % dan ditambahkan 8 μL larutan medium spermatozoa (Ca++ free saline). 2) Didiamkan selama 15-20 menit kemudian dihomogenkan 3) Larutan yang berisi spermatozoa diambil menggunakan pipet sebanyak 5 μL, kemudian diteteskan pada Neubauer Chamber untuk dilakukan penghitungan sel spermatozoa.
Preservasi Spermatofor
Preservasi spermatofor dengan memberikan perlakuan pada lama penyimpanan spermatofor (0,5,10,15, dan 20 hari) dalam refreigator 4◦ C untuk menguji viabilitas dari spermatofor Scylla olivacea.
Tahapan Penelitian II
Pengamatan Struktur dan Morfologi Spermatozoa Dengan SEM
Pengamatan SEM untuk melihat morfologi permukaan spermatofor dan spermatozoa secara detail dari kepiting bakau merah menggunakan SEM mengikuti prosedur standar yang ada.
Rancangan Penelitian dan Analisis Data
Data yang diperoleh disajikan dalam bentuk tabel, histogram, grafik, dan scaterplot menggunakan program Excell untuk melihat rataan dan sd dari masing-masing karakteristik umum Scylla olivacea yang berasal dari tiga lokasi, konsentrasi spermatofor per individu, viabilitas spermatofor, kisaran ukuran spermatofor, konsentrasi spermatozoa per spermatofor. Untuk gambar morfologi spermatofor dan spermatozoa dianalisis secara deskriptif
HASIL DAN PEMBAHASAN
Karakteristik Umum Kepiting Bakau Merah Jantan Scylla olivacea
Gambar 13 Karakteristik umum Scylla olivacea, Keterangan; A = Blanakan, Jawa Barat B = Maros, Sulawesi Selatan dan C = Fak-Fak, Papua Barat
Berdasarkan pengamatan diperoleh hasil yang menunjukkan kepiting bakau merah jantan (Scylla olivacea) yang berasal dari tiga lokasi pengambilan sampel penelitian, memiliki perbedaan morfometrik yang cukup signifikan ini terlihat dari ukuran dan warna tubuh (Gambar 13). Kepiting bakau merah jantan yang berasal dari Blanakan, Jawa Barat memiliki ukuran tubuh yang relatif lebih kecil dibandingkan dengan kepiting bakau merah jantan dari Maros, Sulawesi Selatan dan Fak-Fak, Papua Barat. Selain itu, memiliki warna tubuh yang lebih terang dibandingkan dengan kepiting dari kedua daerah lainnya. Hal ini disebabkan perbedaan hábitat yang berhubungan langsung dengan wilayah geografi masing-masing lokasi, sehingga merupakan suatu indikator yang dapat digunakan dalam pencirian morfometrik dari kepiting bakau itu sendiri. Perbedaan
morfologi pada Scylla spp sangat dipengaruhi oleh lingkungan hidupnya, walaupun berbeda morfologinya tetap spesies Scylla spp yang sama. Kondisi lingkungan yang spesifik bisa menghasilkan bentuk morfologi yang berbeda (Stephenson & Campbell 1960; Fuishimi & Watanabe 2000).
Gambar 14 Ciri Karakteristik Scylla olivacea, Keterangan; a = duri pada corpus dan b = bentuk frontal teeth yang pendek dan tumpul
Untuk membedakan Scylla olivacea dari ketiga spesies Scylla spp yang lain, dapat dilihat dari karakteristik morfologi; bentuk dari frontal teeth, duri pada bagian corpus, propodus dari chelipid serta warna tubuh (Keenan et al. 1998). Scylla olivacea, memiliki ciri karakteristik dengan bentuk frontal teeth yang lebih rendah (tumpul) dibandingkan dengan ketiga spesies Scylla spp lainnya, terdapat satu duri pada bagian corpus dan memiliki warna tubuh yang bervariasi dari hijau, orange kemerahan sampai coklat kehitaman, sehingga Scylla olivacea lebih dikenal dengan nama kepiting bakau merah (Gambar 14).
Kepiting bakau ini memiliki keunggulan dari spesies kepiting bakau lainnya, yaitu memiliki siklus reproduksi yang lebih singkat dan untuk individu betina lebih cepat bertelur. Selain itu kepiting ini mampu bertahan dalam kondisi kekurangan air dalam jangka waktu lama asal dalam keadaan lembab.
Umumnya kepiting bakau merah lebih sering ditemukan di daerah mangrove dan muara sungai. Sebagian besar siklus hidup kepiting bakau dilalui di sekitar muara sungai dan hutan bakau (Sulaeman 1992). Kepiting ini lebih
33
menyukai salinitas air yang rendah. Ukuran tubuh dari kepiting bakau merah ini lebih kecil dibandingkan spesies kepiting bakau lainnya. Ukuran yang paling besar bisa mencapai 18 cm.
Tabel 2 Karakteristik Umum Reproduksi Scylla olivacea Jantan Asal Blanakan (Jawa Barat), Maros (Sulawesi Selatan) dan Fak-Fak (Papua Barat)
Daerah Karakteristik Umum Mean ± Sd
Bobot Tubuh (g) 208.1 ± 59.7 Panjang Karapas (mm) 6.8 ± 0.8 Lebar Karapas (mm) 10.0 ± 1.0 Gonad (g) 0.8 ± 0.5 Blanakan, Jabar GSI (%) 0.06-0.82 (0.4 ± 0.24) Bobot Tubuh (g) 486.9 ± 100.6 Panjang Karapas (mm) 8.4 ± 0.6 Lebar Karapas(mm) 11.9 ± 0.9 Gonad (g) 1.9 ± 0.8 Maros, Sulsel GSI (%) 0.12 - 0.72 (0.4 ± 0.19) Bobot Tubuh (g) 566.3 ± 138.1 Panjang Karapak (cm) 8.9 ± 0.5 Lebar Karapak (cm) 12.3 ± 0.8 Gonad (g) 2.3 ± 0.9 Fak-Fak, Pabar GSI (%) 0.13 – 1.07 (0.44 ± 0.23)
Blanakan, Jawa Barat
Pengambilan sampel dilakukan pada bulan Juli – Desember 2008. Untuk kepiting bakau merah jantan melakukan aktivitas reproduksi sepanjang tahun. Aktivitas reproduksi dari kepiting bakau dimulai pada akhir musim panas hingga memasuki musim penghujan atau musim hujan, dimana perairan mangrove pada daerah tropis kaya akan nutrisi (Heasman et al. 1985; Sara et al. 2006).
Nilai bobot tubuh Scylla olivacea jantan asal Jawa Barat (Tabel 2) adalah 208.1 ± 59.7 g, dengan panjang dan lebar karapas masing-masing adalah 6.8 ± 0.8 mm dan 10.0 ± 1.0 mm. Distribusi ukuran panjang dan lebar karapas yang beragam dari sampel Jawa, mengindikasikan bahwa daerah tempat pengambilan sampel tersebut merupakan feeding ground dan nursery ground bagi kepiting bakau, ukuran sampel yang relatif lebih kecil dan jumlah sangat terbatas
dibandingan dengan spesies kepiting bakau lainnya yang berada pada lokasi penelitian, yakni Scylla paramamosain dan Scylla serrta yang jumlah sangat melimpah dengan nilai kisaran bobot tubuh yang lebih besar.
Berdasarkan pengalaman pribadi di lapangan untuk spesies Scylla olivacea agak sulit ditemukan di daerah Jawa, jika ada jumlahnya pun sangat terbatas. Hal in disebabkan oleh pola distribusi dari kepiting bakau itu sendiri. Umumnya di daerah Jawa untuk spesies kepiting bakau yang distribusinya melimpah adalah spesies Scylla paramamosain. Scylla paramamosain memiliki penyebaran mulai dari; Laut Cina Selatan, Vietnam, Singapura, Cina, Taiwan, Hongkong, Laut Jawa, Kalimantan dan Jawa. Sedangkan untuk Scylla olivacea sendiri, pola distribusinya, yakni; Samudera Indian, Pakistan sampai Australia Barat, Laut Cina Selatan, Thailand, Singapura, Vietnam, Sarawak, Samudera Pasifik, Filipina, dan Timor (Keenan et al. 1998).
Selain pola distribusi dari kepiting bakau merah itu sendiri, ini juga berkaitan dengan ekosistem mangrove tempat hidupnya. Berdasarkan pengalaman di lapangan di daerah Blanakan, Jawa Barat kondisi ekosistem mangrove disana sangat memprihatikan. Banyaknya pembukaan lahan budidaya yang tidak memperhatikan keseimbangan ekosistem mangrove dan masyarakat sekitar juga menggunakan bakau sebagai bahan kayu bakar untuk kegiatan rumah tangga. Hutan mangrove sebagai habitat kepiting bakau, sudah mengalami degradasi. Umumnya mangrove yang ada di daerah Jawa mengalami kerusakan karena aktivitas manusia, seperti; pembukaan pemukiman, lahan budidaya, dan lainnya.
Pertambahan penduduk, penebangan hutan dan pertambakan merupakan tiga ancaman utama kelestarian hutan mangrove di Jawa (Hasmonel et al. 2000), Jawa merupakan kawasan dengan penduduk paling padat di dunia (Ligtvoet et al. 1996), dimana 60% peduduk Indonesia yang jumlahnya lebih dari 200 juta tinggal di pulau yang luasnya hanya seperlima luas negeri (Hadianto 1998), sehingga tingkat perubahan habitat alami sangat tinggi, termasuk untuk permukiman (Silvius et al. 1987). Hutan mangrove di pulau Jawa, pada tahun 1985 seluas 170.500 ha, namun pada tahun 1997 tinggal 19.077 ha (11.19%). Penyusutan terbesar terjadi di Jawa Timur, dari luasan 57.500 ha tinggal 500 ha (8%), di Jawa Barat dari 66.500 ha tinggal kurang dari 5.000 ha (7.5%), dan di Jawa Tengah dari
35
46.500 ha tinggal 13.577 ha (29%). Sementara luas tambak di pulau Jawa adalah 128.740 ha yang tersebar di Jawa Barat (50.330 ha), Jawa Tengah (30.497 ha), dan Jawa Timur (47.913 ha). Apabila ekstensifikasi tambak dengan mengubah hutan mangrove terus dilakukan, maka kemungkinan besar akan sangat sulit menemukan hutan mangrove di Jawa (Giesen 1993; Republika 23/7/2002).
Mangrove merupakan habitat alam dari kepiting bakau (Scylla spp). Kepiting bakau hidup pada berbagai habitat dan sebagian besar hidup di laut, sebagian hidup di perairan bakau, atau di estuari. Pada masa juvenil sampai menjelang dewasa atau dewasa, kepiting hidup di pantai, muara-muara sungai dan hutan bakau dengan cara membuat lubang (Kasri 1982).Sekitar 80% dari jenis – jenis ikan laut daerah tropika menghabiskan masa hidupnya paling tidak satu fase dalam daur hidupnya, di daerah pesisir berhutan mangrove.
Untuk nilai bobot gonad Scylla olivacea jantan adalah 0.8 ± 0.5 g, berdasarkan hasil bobot badan dan bobot gonad tersebut dapat dihitung nilai Gonad Stomatik Indeks (GSI) sebagai berikut; 0.06 - 0.82 % (0.4 ± 0.24). Nilai kisaran GSI tertinggi yang diperoleh untuk sampel Jawa, yakni; 0.82 % lebih tinggi dibandingkan dengan nilai kisaran GSI untuk sampel Sulawesi, yakni; 0.72%. Hal ini sebabkan karena GSI tidak saja dipengaruhi oleh ukuran tubuh dan bobot dari kepiting tetapi lebih dipengaruhi oleh tingkat kematangan gonad. Walaupun ukuran dan bobot tubuh dari kepiting lebih kecil tetapi jika testis dalam kondisi matang maka nilai GSI besar begitupun sebaliknya. Gonad stomatik indeks sangat dipengaruhi oleh faktor internal dan eksternal. Faktor- faktor yang mempengaruhi adalah; ukuran tubuh, umur, ketersediaan pakan, lingkungan fisik, sifat biokimia air, dan faktor neuroendokrin (Rukminasari 1999).
Maros, Sulawesi Selatan
Nilai bobot tubuh Scylla olivacea jantan asal Sulawesi Selatan (Tabel 2) adalah 486.9 ± 100.6 g. Nilai kisaran bobot tubuh yang relatif lebih tinggi dibandingkan dengan sampel dari Jawa bisa diasumsikan kepiting bakau asal Sulawesi memiliki morfologi fisik yang lebih besar dibandingkan dengan kepiting bakau asal Jawa, diduga hal ini disebabkan oleh habitat dari kepiting bakau tersebut. Mengacu pada lokasi sampel, yakni; daerah Sulawesi yang memiliki kondisi mangrove yang masih bagus dibandingkan dengan daerah Jawa.
Mangrove dengan kondisi fisik yang menyusunnya berupa substrat yang liat berlumpur dan dengan adanya guguran daun mangrove serta dinamika pergerakan air yang fluktuatif menyebabkan tinggi kandungan bahan organik yang menentukan tingkat produktivitas perairan tersebut. Produktivitas perairan yang tinggi menyokong semua komunitas yang berada dalam wilayah tersebut. Kepiting bakau merupakan organism bentik pemakan serasah dan habitatnya adalah perairan intertidal (mendekati daerah mangrove) yang bersubstrat lumpur (Moosa et al. 1985). Kondisi ekosistem mangrove yang masih terjaga di daerah Sulawesi, menyokong segala aspek kehidupan yang berada dalam ekosistem tersebut, termasuk kepiting bakau. Kepiting bakau, khusus Scylla olivacea yang siklus hidupnya lebih banyak berada di daerah mangrove. Mangrove sebagai feeding ground dan nursery ground, yang menyokong siklus hidup dari kepiting bakau salah satunya siklus reproduksi.
Untuk nilai panjang dan lebar karapas masing-masing adalah 8.4 ± 0.6 mm dan 11.9 ± 0.9 mm. Distribusi ukuran panjang dan lebar karapas yang seragam dari sampel Sulawesi, mengindikasikan bahwa kepiting bakau yang terambil adalah kepiting bakau yang dewasa siap memijah karena ukuran tubuhnya relatif besar. Nilai bobot gonad menunjukkan nilai 1.9 ± 0.8 g, dengan nilai GSI yang diperoleh sebesar 0.12 - 0.72 % (0.4 ± 0.19). Proses reproduksi pada hewan air, sebagian besar hasil metabolisme tertuju pada perkembangan gonad. Hal ini yang menyebabkan terjadinya perubahan dalam gonad itu sendiri. Umumnya pertambahan bobot gonad pada ikan betina 10-25% dan pada ikan jantan hanya 5-10% dari bobot tubuh. Kematangan gonad pertama kali pada spesies ikan berbeda, ukuran tubuh untuk matang gonad juga bervariasi antara spesies ikan. Hal ini juga berlaku pada tiap individu walaupun satu spesies. Faktor utama yang mempengaruhi kematangan gonad hewan air, antara lain: suhu, makanan dan hormonal.
Fak-Fak, Papua Barat
Nilai bobot tubuh Scylla olivacea jantan asal Papua (Tabel 2) adalah 566.3 ± 138.1 g. Mayoritas sampel dari Papua Barat memiliki ukuran dan bobot tubuh yang besar bahkan ada yang hampir mencapai 1 kg, lebih tinggi dibandingkan dengan sampel dari Jawa Barat maupun Sulawesi Selatan. Mengacu pada lokasi
37
pengambilan sampel, yakni; daerah Papua yang memiliki kondisi mangrove yang masih bagus dibandingkan dengan daerah Jawa dan Sulawesi. Dari 2,4 juta hektar mangrove yang kondisinya baik, menurut Departemen Kehutanan, sebagian besar berada di daerah yang jauh dari permukiman masyarakat seperti di Papua. Papua merupakan salah satu provinsi yang memiliki mangrove terluas di Indonesia yaitu; 1.438.421 hektar dan dalam kondisi yang baik.
Panjang dan lebar karapas Scylla olivacea jantan asal Fak-Fak, Papua Barat masing-masing adalah 8.9 ± 0.5 mm dan 12.3 ± 0.8 mm. Distribusi ukuran panjang dan lebar karapas yang seragam dari sampel Papua sama halnya dengan sampel dari Sulawesi. Sedangkan untuk bobot gonad diperoleh nilai 2.3 ± 0.9 g dan nilai GSI adalah 0.13 – 1.07 % (0.44 ± 0.23), tertinggi dibandingkan kedua daerah lainnya Jawa Barat dan Sulawesi Selatan.
Konsentrasi Spermatofor Kepiting Bakau Merah Scylla olivacea
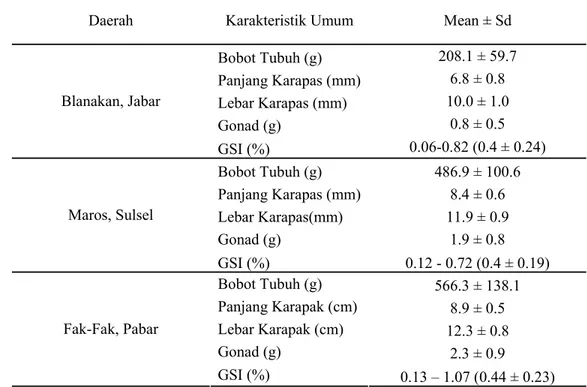
Gambar 15 Grafik Konsentrasi Spermatofor per Individu Scylla olivacea Keterangan; a= Blanakan, Jawa Barat, b = Maros, Sulawesi Selatan dan c = Fak-Fak,
Berdasarkan hasil penghitungan konsentrasi spermatofor per individu dari masing-masing daerah menunjukkan nilai regresi yang berbeda (Gambar 15). Untuk daerah Jawa Barat dengan nilai regresi, y = 0.016x4 - 0.591x3 + 6.717x2 - 26.3x + 46.04 dengan nilai koefesien determinasi (R²) sebesar 0.357, yang menunjukkan korelasi konsentrasi spermatofor dengan individu membentuk persamaan nonlinear. Sama halnya dengan sampel dari Jawa, sampel dari Sulawesi Selatan, memiliki nilai regresi y = 0.002x5 - 0.085x4 + 1.151x3 - 5.530x2 + 3.304x + 39.34 dengan koefesien determinasi (R²) adalah 0.335. Sedangkan untuk Papua Barat nilai regresinya, y = 0.004x5 - 0.177x4 + 2.852x3 - 20.01x2 + 56.77x - 20.82 dengan R² = 0.218, juga menunjukkan persamaan regresi nonlinear. Jadi dapat dikatakan setiap individu dari satu populasi yang sama memiliki konsentrasi spermatofor yang berbeda, bergantung lagi pada siklus reproduksi yang berlangsung pada individu tersebut.
Konsentrasi spermatofor dari Scylla olivacea yang tertinggi diperoleh dari sampel Papua Barat yang memiliki nilai kisaran konsentrasi spermatofor dari 7.37 x 10 ³ - 61.63 x 10 ³, kemudian diikuti sampel dari Jawa Barat 1.67 x 10 ³ - 52. 40 x 10 ³ dan Sulawesi Selatan 5.53 x 10 ³ - 45.13 x 10 ³. Konsentrasi spermatofor ini berkaitan dengan kisaran nilai Gonad Stomatik Indeks (GSI) pada tiap individu dari tiga lokasi pengambilan sampel penelitian. Dimana kisaran nilai GSI untuk sampel dari Jawa Barat memiliki nilai yang lebih tinggi dibandingkan dengan kisaran nilai GSI untuk sampel dari Sulawesi Selatan. Sehingga konsentrasi spermatofor dari sampel Jawa Barat lebih tinggi jumlahnya dibandingkan dengan konsentrasi spermatofor sampel dari Sulawesi Selatan. Sedangkan untuk sampel dari Papua Barat, menunjukkan konsentrasi spermatofor yang tertinggi dibandingkan dengan kedua daerah lainnya. Konsentrasi spermatofor dari sampel Papua berbanding lurus dengan nilai kisaran bobot gonad dan GSI yang juga tertinggi dari kedua daerah lainnya, yakni; 2.3 ± 0.9 g dan 0.13 – 1.07 %.
39
Viabilitas Spermatofor Scylla olivacea
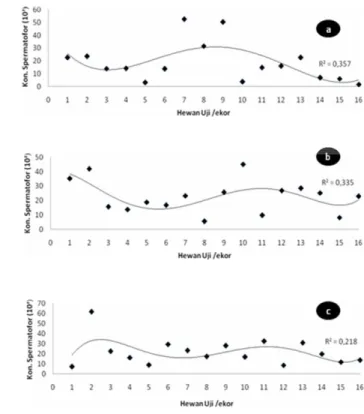
Gambar 16 Preservasi Spermatofor Scylla olivacea pada hari ke-0 sampai dengan hari ke-20. Keterangan; A = Blanakan, Jawa Barat B = Maros, Sulawesi Selatan dan C = Fak Fak, Papua Barat
Hasil preservasi spermatofor yang diperoleh dari ketiga lokasi pengambilan sampel, yaitu; Jawa Barat, Sulawesi Selatan dan Papua Barat menunjukkan adanya penurunan viabilitas spermatofor seiring dengan waktu preservasi atau penyimpanan spermatofor. Penurunan viabilitas spermatofor dari hari ke - 0 sampai ke - 20 untuk sampel dari Blanakan, Jawa Barat dapat lihat pada Gambar 16A, menunjukkan pada 0 hari viabilitas spermatofor sebesar
50.73 ± 10.31% dan banyak spermatofor berukuran besar yang masih viable. Preservasi hari ke - 5 dengan viabilitas spermatofor sebesar 15.34 ± 5.22%, banyak spermatofor berukuran besar yang terwarnai. Viabilitas spermatofor pada preservasi hari ke - 10 sebesar 11.46 ± 2.14. Preservasi hari ke - 15, spermatofor yang masih viable 10.41 ± 2.23% dan terlihat pada preparat ulas zat warna masuk dengan sempurna kedalam spermatofor dan pada preservasi hari ke - 20, viabilitas spermatofor menurun sangat dratis yakni; sebesar 5.50 ± 4.02. Selain viabilitas spermatofor yang menurun, juga ditandai dengan warna larutan medium pada preservasi spermatofor mengalami perubahan semakin keruh dan berbau. Ini merupakan indikator bahwa semakin banyak spermatofor yang telah rusak dan mati sehingga menghasilkan sisa metabolit yang akhirnya berdampak pada spermatofor lainnya yang masih viable. Selain itu pada preservasi spermatofor ini juga tidak ditambahkan penisilin yang berfungsi sebagai anti mikroba atau bakteri.
Preservasi spermatofor untuk daerah Maros, Sulawesi Selatan (Gambar 16B) menunjukkan nilai viabilitas yang lebih tinggi daripada sampel yang berasal dari Jawa Barat. Preservasi spermatofor 0 hari untuk sampel Sulawesi, viabilitas spermatofor sebesar 76.71 ± 23.67% terlihat spermatofor yang berukuran besar masih viable dan belum terwanai. Preservasi spermatofor pada hari ke -5, terjadi penurunan viabilitas spermatofor yang dratis sebesar 32.38 ± 13.29%. Preservasi spermatofor hari ke -10, viabilitas spermatofor yang masih hidup sebesar 21.05 ± 7.05%. Viabilitas spermatofor pada preservasi hari ke -15, diperoleh nilai sebesar 20.98 ± 2.88% dan terdapat beberapa spermatofor berukuran besar yang masih viable. Viabilitas spermatofor antara preservasi hari ke - 10 dan hari ke - 15, tidak jauh berbeda. Dan pada preservasi spermatofor pada hari ke -20, viabilitas spermatofor hanya sebesar 18.76 ± 4.73% namun nilai ini lebih tinggi dibandingkan dengan viabilitas spermatofor dari sampel Jawa Barat pada hari ke - 20.
Preservasi spermatofor untuk daerah Fak – Fak, Papua Barat (Gambar 16C), menunjukkan nilai viabilitas yang lebih rendah dibandingkan dengan kedua sampel yang berasal dari Jawa Barat dan Sulawesi Selatan. Preservasi spermatofor 0 hari untuk sampel Papua, viabilitas spermatofor hanya mencapai 28.17 ± 12.87%. Preservasi spermatofor pada hari ke -5, viabilitas spermatofor
41
yang diperoleh sebesar 16.44 ± 9.33 %, preservasi hari ke - 10, viabilitas spermatofor mengalami penurunan yang sangat dratis yaitu; 9.06 ± 1.59%, preservasi spermatofor pada hari - 15 sebesar 8.74 ± 1.65% dan pada preservasi spermatofor pada hari ke -20, diperoleh nilai viabilitas spermatofor sebesar 1.87 ± 0.62%. Nilai viabilitas yang lebih rendah ini, diduga karena sampel yang berasal dari Papua Barat ini sudah mengalami penurunan kualitas pada individu jantannya yang pada akhirnya mempengaruhi performans reproduksi khususnya untuk viabilitas spermatofor. Hal ini berkaitan dengan faktor luar yang sangat mempengaruhi kualitas dari kepiting bakau merah jantan, dimana sampel dari Papua Barat telah mengalami proses perjalanan yang sangat jauh dan memakan waktu yang lebih lama untuk sampai di Laboratorium, sehingga mempengaruhi fisiologi dari individu tersebut yang berdampak pada kualitas spermatofornya.
Kisaran Diameter Spermatofor Scylla olivacea
Blanakan, Jawa Barat
Gambar 17 Scatterplot Kisaran Diameter Spermatofor Scylla olivacea Blanakan, Jawa Barat
Diameter spermatofor sangat bervariasi baik antar individu, antar sampel maupun antar lokasi pengambilan sampel. Berdasarkan hasil pengamatan, spermatofor Scylla olivacea asal Jawa Barat, menunjukkan diameter terkecil 33.75µm dan terbesar 210µm (Gambar 17), hal ini menunjukkan bahwa kisaran ukuran diameter spermatofor berhubungan pula dengan tingkat kematangan gonad (TKG), untuk daerah Jawa memiliki kisaran nilai bobot gonad yang relatif lebih kecil dibandingkan dengan kedua daerah lainnya (Sulawesi Selatan dan Papua
Barat). Distribusi spermatofor terpusat pada ukuran diameter ≤ 50 sampai dengan ≤ 150µm, spermatofor yang memiliki ukuran diameter yang sama dan jumlahnya diatas ± 20 buah, adalah sebagai berikut; 72.5µm (n=20), 75µm (n=29), 77.5µm (n=30), 82.5µm (n=33), 85µm(n=34), 86.25µm (n=25), 87µm(n=27), 88.75µm (n=21), 90 µm(n=36), 92.5 µm(n=30), 93.75µm (n=27), 95µm (n=35), 96.25µm (n=22), 97.5µm (n=25), 98.75µm (n=21),100µm (n=24), 102.5µm (n=25), 110µm (n=21), 112.5µm (n=28), 115µm (n=26) dan 120µm (n=20). Jadi dapat dikatakan pada sampel Jawa Barat, ukuran spermatofor yang paling banyak ditemukan adalah 72.5µm sampai dengan 120µm.
Maros, Sulawesi Selatan
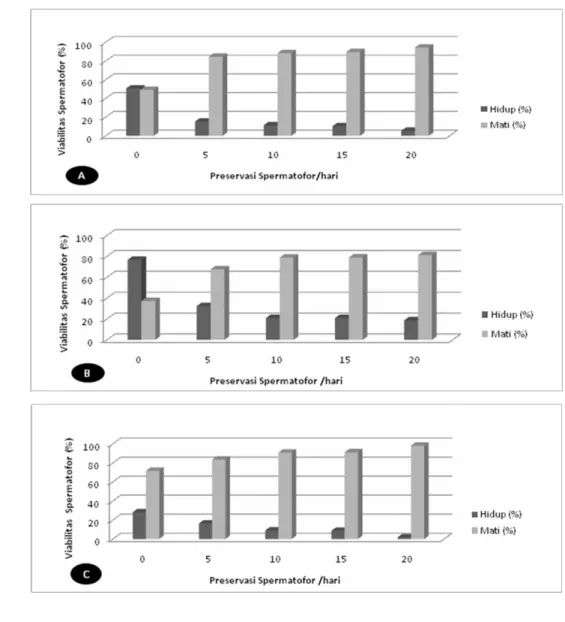
Gambar 18 Scatterplot Kisaran Diameter Spermatofor Scylla olivacea Jantan Asal Sulawesi Selatan, Maros
Berbeda dengan sampel dari Jawa Barat spermatofor dari Scylla olivacea asal Sulawesi Selatan, menunjukkan diameter yang lebih kecil yaitu 18.75µm tetapi ditemukan spermatofor dengan diameter sampai 362.5µm (Gambar 18), hal ini menunjukkan bahwa kisaran diameter spermatofor bervariasi untuk tiap lokasi pengambilan sampel. Untuk distribusi spermatofor pada sampel dari Sulawesi, yaitu terpusat pada ukuran diameter ≤ 50 sampai dengan ≤ 250µm, Spermatofor yang memiliki ukuran diameter yang sama dan jumlahnya diatas ± 20 buah, adalah sebagai berikut; 87.5µm (n=26), 90µm (n=21), 100µm (n=21), 101.25µm (n=23), 102.5µm (n=29),103.75µm (n=26), 105µm (n=26), 106.25µm (n=21), 107.5µm (n=24) dan 125µm (n=20). Jumlah diameter yang paling banyak ditemukan antara 87.5µm sampai dengan 125µm.
43
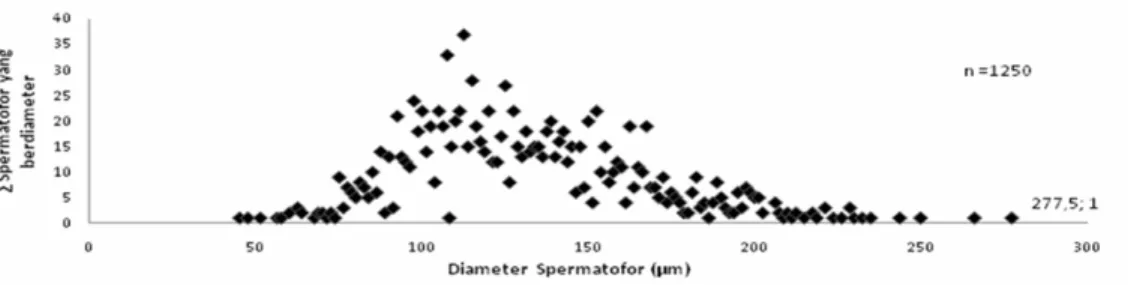
Fak-Fak, Papua Barat
Gambar 19 Grafik Kisaran Diameter Spermatofor Scylla olivacea Jantan Asal Papua Barat, Fak-Fak
Dibandingkan dengan dua sampel sebelumnya, diameter spermatofor Scylla olivacea asal Papua Barat, menunjukkan diameter terkecil 45µm dan spermatofor terbesar hanya 277.5µm (Gambar 19). Pada sampel ini, menunjukkan range nilai diameter spermatofor yang sama dengan sampel dari Sulawesi yaitu terpusat pada diameter ≤ 50 sampai dengan ≤ 250µm.
Spermatofor yang memiliki ukuran diameter yang sama dan jumlahnya diatas ± 20 buah, adalah sebagai berikut; 92.5µm (n=21), 97.5µm (n=24), 100µm (n=22), 105µm (n=22), 107.5µm (n=33), 110µm (n=20), 111.25µm (n=22), 112.5µm (n=37), 115µm (n=28), 120µm (n=22), 125µm (n=27), 127.5µm (n=22), 138.75µm (n=20), 150µm (n=20), dan 152.5µm (n=22). Dengan proporsi diameter spermatofor yang paling sering ditemukan adalah 92.5µm – 152.5µm, yang mana lebih tinggi kisarannya dari sampel asal Jawa dan Sulawesi.
Konsentrasi Spermatozoa Dihubungkan dengan Ukuran Spermatofor Spermatofor berperan penting dalam transfer dan penyimpanan spermatozoa pada Crustacea. Spermatofor memberikan proteksi pada spermatozoa saat pemindahan ke individu betina dan memberikan substrat yang kaya energi untuk memperpanjang penyimpanan spermatozoa dalam betina. Spermatozoa crustacea, memiliki kemampuan untuk disimpan dalam jangka waktu yang lama pada spermatofor (Sasikala & Subramoniam 1987; Hinsch 1991).
Tabel 3 Rataan Konsentrasi Spermatozoa per Spermatofor Scylla olivacea
Diameter Spermatofor (μm) Konsentrasi Spermatozoa per Spermatofor (10⁶)
1 40-70 6.67 ± 3.22 a
2 70-100 10.12 ± 2.26 ab
3 100-130 15.96 ± 2.43 bc
4 130-160 15.88 ± 2.78 bc
5 160-190 16.14 ± 4.32 c
Supercript yang berbeda pada kolom yang sama menunjukkan perbedaan yang nyata
(p<0.05) antara diameter spermatofor
Konsentrasi spermatozoa per spermatofor Scylla olivacea menunjukkan hasil yang secara nyata, jumlah spermatozoa meningkat seiring dengan bertambahnya ukuran diameter spermatofor (P>0.05). Kisaran diameter spermatofor 40-70 μm, diperoleh konsentrasi spermatozoa sebesar 6.67 x 10⁶ ± 3.22 sedangkan untuk spermatofor dengan diameter 160-190 μm, diperoleh konsentrasi spermatozoa 16.14 x 10⁶ ± 4.32. Spermatofor yang bagus ditentukan dari tingginya jumlah spermatozoa di dalam spermatofor dan kualitas spermatofor
bergantung pada individu jantan itu sendiri. Spermatofor mempertahankan kemampuan fertilisasi spermatozoa
sehingga angka pembuahan yang tinggi dapat tercapai, yang berpengaruh pada kemampuan bagi embrio bertahan hidup, menetas dan hidup sebagai larva (Akarasanon et al. 2004). Produksi, pembentukan spermatofor, dan kualitas spermatozoa merupakan variabel penting dalam reproduksi jantan (Leung-Trujillo & Lawrence 1987; Jerry 2001).
45
Morfologi Spermatofor dan Spermatozoa Scylla olivacea
Gambar 20 Morfologi Spermatofor dan Spermatozoa Scylla olivacea Ket: A= spermatofor dengan berbagai ukuran, B = spermatofor, C dan D = spermatozoa, NA = nuklear arm
Pengamatan menggunakan SEM, menunjukkan spermatofor Scylla olivacea memiliki bentuk dan ukuran bervariasi serta termasuk dalam golongan crustacea yang memiliki spermatofor terpisah dan tidak memiliki stalk (Gambar 20 A dan B), terlihat ukuran spermatofor yang bervariasi dari kecil sampai yang berukuran diatas ≥ 55 µm. Spermatofor crustacea memiliki bentuk yang bervariasi dan beberapa spesies menghasilkan spermatofor tunggal dan terpisah satu sama yang lain dan berada dalam medium cair dari seminal plasma (Jeyalectumie & Subramoniam 1997).
Spermatofor Scylla olivacea sangat keras dan kuat diduga tersusun dari mucopolysaccharide, karena untuk memecahkan dinding spermatofor diperlukan enzim dan bahan kimia. Saat ini penelitian yang meneliti komposisi spermatofor masih sedikit sehingga informasi mengenai komposisi kimiawi dari spermatofor masih sangat minim. Beberapa peneliti memberikan pernyataan bahwa dinding dari spermatofor tersusun dari chittin (Spalding 1942), sedangkan Uma dan Subramoniam (1979) tidak menemukan kittin pada spermatofor Scylla serrata.
Pengamatan menggunakan SEM, spermatozoa dari Scylla olivacea seperti halnya spermatozoa dari golongan crustacea (udang dan kepiting), memiliki aflagellate, tidak memiliki midpiece, dan tidak bergerak (non-motile), dapat dilihat pada Gambar 20 C dan D. Pada gambar, terlihat nuklear arm yang berfungsi untuk mencengkram sel telur. Beberapa peneliti melaporkan morfologi dari spermatozoa Echinodermata, Mollusca, Polychaetes dan Crustacea sangat bervariasi dalam morfologinya, dan semua golongan crustacea memiliki akrosom yang khas (Gwo 2000).