IDENTIFIKASI KOMPOSISI BIOFLOKULAN
DARI ISOLAT KH-3
PUTRI SWADIASTUTI
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2008
IDENTIFIKASI KOMPOSISI BIOFLOKULAN
DARI ISOLAT KH-3
PUTRI SWADIASTUTI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2008
ABSTRAK
PUTRI SWADIASTUTI. Identifikasi Komposisi Bioflokulan dari Isolat KH-3.
Dibimbing oleh LAKSMI AMBARSARI dan SURYANI.
Flokulan sintetik pada umumnya bersifat neurotoksik, karsinogenik kuat,
dan tidak mudah didegradasi oleh mikroba. Oleh karena itu, penggunaannya
dalam berbagai bidang industri dapat menimbulkan dampak terhadap lingkungan
dan kesehatan manusia. Kebutuhan akan flokulan yang aman bagi manusia dan
ramah terhadap lingkungan mendorong ditelitinya bioflokulan sebagai salah satu
alternatif solusinya.
Penelitian ini menggunakan isolat KH-3 yang berasal dari kawah Gunung
Pancar, Bogor. Bioflokulan yang diproduksi dari isolat ini diidentifikasi
komposisi biokimianya karena setiap mikroorganisme memproduksi bioflokulan
dengan komposisi yang berbeda-beda. Jenis bioflokulan penting diketahui agar
dapat dimanfaatkan secara tepat. Isolat KH-3 diremajakan dan diproduksi dalam
media fermentasi dengan menggunakan variasi sumber karbon dan nitrogen.
Bioflokulan yang diperoleh selanjutnya dimurnikan melalui pengendapan etanol
dan diidentifikasi komposisinya melalui tahapan analisis biokimia.
Berdasarkan hasil penelitian, glukosa dan sukrosa 1% merupakan sumber
karbon yang paling baik untuk menunjang pertumbuhan isolat KH-3 dan produksi
bioflokulan. Peran bioflokulan dalam aktivitas flokulasi dibantu oleh komponen
media, seperti NaCl dan MgSO
4. Aktivitas flokulasi kultur bioflokulan lebih
tinggi daripada aktivitas flokulasi bioflokulan murni (hasil pengendapan etanol).
Bioflokulan dari isolat KH-3 mengandung polisakarida (0.43 mg/mL) dan protein
(0.09 mg/mL).
ABSTRACT
PUTRI SWADIASTUTI. Identification Bioflocculant’s Composition from KH-3
Isolate. Under the direction of LAKSMI AMBARSARI and SURYANI.
Generally, the characteristics of synthetic flocculants are unbiodegradable,
neurotoxic, and strong carcinogenic. Therefore, their applications in industrial
fields can endanger environment and human health. The necessity of flocculant
that is not only safe for human being, but also it has to be friendly to environment
has supported a research of bioflocculant as an alternative solution.
This research used KH-3 isolate from the crater of Mount Pancar, Bogor.
Bioflocculant from this isolate is identified its biochemical composition because
each microorganism produces bioflocculant with different compositions. Its
composition is very important to be known so that it can be applied properly.
KH-3 isolate was regenerated and produced in fermentation medium within
variations of carbon and nitrogen sources. Bioflocculant was purified through
ethanol precipitation and its composition was identified through biochemical
analysis.
Results showed that glucose and sucrose 1% are the most favorable carbon
sources for growth of KH-3 isolate and bioflocculant production. Part of
bioflocculant in flocculating activity was helped by medium components, such as
NaCl and MgSO
4. Flocculating activity from bioflocculant culture was higher
than purified bioflocculant. Bioflocculant from KH-3 isolate contains
polysaccharide (0.43 mg/mL) and protein (0.09 mg/mL).
Judul Skripsi : Identifikasi Komposisi Bioflokulan dari Isolat KH-3
Nama
: Putri Swadiastuti
NIM
: G44104015
Disetujui
Komisi Pembimbing
Dr. Laksmi Ambarsari, MS
Dr. Suryani, MSc
Ketua
Anggota
Diketahui
Dr.drh. Hasim, DEA.
Tanggal Lulus:
PRAKATA
Alhamdulillah, segala puji bagi Allah karena hanya dengan nikmat dan
karuniaNya penulis dapat menyelesaikan penelitian dan penulisan karya ilmiah
yang berjudul Identifikasi Komposisi Bioflokulan dari Isolat KH-3. Karya ilmiah
ini berdasarkan hasil penelitian di Laboratorium Biokimia selama bulan Maret
sampai Juli 2008 sebagai prasyarat untuk memperoleh gelar sarjana Sains
Program Studi Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Proses menuju keberhasilan yang harus dilalui penulis selama penelitian dan
penyusunan karya ilmiah ini tidak terlepas dari bantuan berbagai pihak. Oleh
karena itu, penulis mengucapkan terima kasih kepada Dr. Laksmi Ambarsari, MS
dan Dr.Suryani, MSc selaku pembimbing yang telah memberikan saran, kritik,
dan dukungannya. Ucapan terima kasih penulis sampaikan kepada seluruh staf
pegawai Biokimia, antara lain Bu Iis, Bu Merry, Bu Tuti, Mba’ Martini, Pak Edi,
Pak Arya, Pak Nana, Pak Yadi, dan Mas Eka atas fasilitas dan kemudahan yang
diberikan.
Penulis juga ingin mengucapkan terima kasih kepada ayah, ibu, adik di
Bekasi atas dorongan dan semangat yang diberikan serta kepada Juliana, Bembi,
Iros, Intan, Fitri, Idha, atas bantuan dan dukungannya. Semoga karya ilmiah ini
bermanfaat. Amin.
Bogor, Oktober 2008
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 29 Desember 1985, dari ayahanda
Subekti Setiabudhi dan ibunda Retno Hastuti. Penulis merupakan putri pertama
dari dua bersaudara.
Penulis lulus dari SMUN 1 Bekasi pada tahun 2004 dan di tahun yang sama
penulis lolos seleksi masuk IPB melalui jalur undangan seleksi masuk IPB
(USMI) pada Program Studi Biokimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis aktif di organisasi kemahasiswaan
CREBs (
Community of Research and Education in Biochemistry
) pada tahun
2005/2006 dan 2006/2007. Selain itu, penulis juga pernah menjadi asisten
praktikum mata kuliah Biologi Dasar untuk mahasiswa TPB pada tahun
2006/2007, Biokimia Umum untuk mahasiswa S1-FKH, dan Struktur dan Fungsi
Biomolekul untuk S1-Biokimia pada tahun 2007/2008. Penulis mengikuti praktik
lapangan di Laboratorium Mikroba dan Bioproses, Balai Penelitian Bioteknologi
Perkebunan Indonesia, Bogor, dari bulan Juli sampai Agustus 2007 dan menulis
karya ilmiah berjudul Deodorisasi Limbah Lateks Pekat Menggunakan
DAFTAR ISI
Halaman
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Bioflokulan dan Jenisnya ... 1
Pemanfaatan Bioflokulan ... 2
Koagulasi dan Flokulasi ... 2
Medium Produksi Bakteri Bioflokulan ... 3
Aktivitas dan Sifat Flokulasi Bioflokulan ... 4
BAHAN DAN METODE
Bahan dan Alat ... 5
Metode Penelitian ... 5
HASIL DAN PEMBAHASAN
Isolat Hasil Peremajaan ... 7
Bioflokulan Hasil Produksi Isolat KH-3 ... 7
Hasil Aktivitas Flokulasi ... 9
Bioflokulan Hasil Pengendapan Etanol ... 11
Hasil Analisis Komposisi Bioflokulan ... 12
SIMPULAN DAN SARAN
Simpulan ... 13
Saran ... 13
DAFTAR PUSTAKA ... 13
DAFTAR TABEL
Halaman
1 Optimasi waktu produksi ... 7
2 Data OD λ 550 nm setelah kultivasi selama 70 jam ………. 9
3 Hasil pengukuran aktivitas flokulasi KH-3 ... 9
4 Pengaruh bioflokulan terhadap aktivitas flokulasi ……….. 11
5 Data bobot kering bioflokulan hasil pengendapan etanol ... 11
6 Aktivitas flokulasi bioflokulan hasil pengendapan etanol ...
12
7 Aktivitas flokulasi bioflokulan selama optimasi waktu produksi ... 19
8 Aktivitas flokulasi supernatan dan pellet ... 20
9 Aktivitas flokulasi media produksi ...
21
10 Pembuatan kurva standar BSA ...
21
11 Pembuatan kurva standar glukosa ...
22
DAFTAR GAMBAR
Halaman
1 Tahapan terjadinya koagulasi-flokulasi ...
3
2 Hasil peremajaan isolat KH-3 ... 7
3 Kultivasi KH-3 pada media 1 ...
9
4 Aktivitas flokulasi isolat KH-3 ...
10
5 Aktivitas flokulasi media produksi ...
10
6 Pengendapan bioflokulan ... 11
7 Bioflokulan murni setelah dikeringkan ...
11
8 Aktivitas flokulasi bioflokulan hasil pengendapan etanol ...
12
9 Uji kualitatif bioflokulan ...
13
10 Aktivitas flokulasi supernatan dan pellet ...
20
11 Kurva standar BSA ...
21
DAFTAR LAMPIRAN
Halaman
1 Strategi penelitian ... 17
2 Alur kerja penelitian ...
18
3 Aktivitas flokulasi bioflokulan selama optimasi waktu produksi ...
19
4 Aktivitas flokulasi supernatan dan pellet ...
20
5 Aktivitas flokulasi media produksi ...
21
6 Pembuatan kurva standar BSA ...
21
1
PENDAHULUAN
Flokulan merupakan senyawa kimia berupa polimer yang berfungsi untuk menggabungkan flok-flok yang telah terbentuk sehingga lebih besar dan siap mengendap (Lachhwani 2005). Flokulan digolongkan menjadi tiga bagian, yaitu flokulan anorganik (aluminium sulfat, feri sulfat, dan feri klorida), flokulan organik (poliakrilamida), dan flokulan alami yang disebut bioflokulan (Dermlim et al. 1999). Flokulan tersebut banyak digunakan pada pengolahan limbah, proses fermentasi, pengolahan bahan makanan, farmasi, dan industri air minum (Salehizadeh et al. 2002). Tujuan penambahan flokulan adalah menetralisasi muatan dalam suspensi melalui koagulasi dan flokulasi yang kemudian membentuk ukuran yang lebih besar dan mempercepat terjadinya sedimentasi.
Flokulan organik banyak digunakan di berbagai industri karena mempunyai sifat yang kuat dan ekonomis jika dibandingkan flokulan anorganik (Lu et al. 2005), akan tetapi polimer organik tersebut pada umumnya bersifat unbiodegradable sehingga tidak mudah pembuangannya dan meninggalkan residu di lingkungan. Monomer akrilamida juga diketahui bersifat neurotoksik dan karsinogenik kuat pada tubuh manusia (Vanhorick & Moens 1983). Selain itu, juga mempunyai efek yang buruk terhadap kehidupan flora dan fauna. Kandungan aluminium pada polielektrolit juga dapat menyebabkan penyakit Alzheimer (Master et al. 1985; Kowall et al. 1989). Oleh karena itu, banyak masalah muncul akibat penggunaan flokulan sintetik.
Adanya dampak negatif yang timbul akibat penggunaan flokulan sintetik mendorong kebutuhan akan flokulan yang
biodegradable, yang disebut bioflokulan, bersifat lebih aman bagi manusia juga ramah terhadap lingkungan. Bioflokulan merupakan polimer ekstraseluler yang diproduksi oleh mikroorganisme selama pertumbuhan dengan komposisi yang berbeda-beda (Jie et al. 2006). Komposisi (jenis) bioflokulan ini sangat dipengaruhi oleh komposisi dalam media, terutama oleh sumber karbon dan nitrogen yang digunakan selama produksi. Mikroorganisme yang diketahui sebagai penghasil bioflokulan, diantaranya (Rhodococcus erythropolis,Aspergillus sojae,
Bacillus sp, Arcuadendron sp (Kurane et al. 1986; Nakamura et al. 1976; Suh et al. 1997; Lee et al. 1995). Flokulan yang dihasilkan
dapat berupa polisakarida, protein, lipid, glikoprotein, maupun asam poliglutamat. Keuntungan bioflokulan bila dibandingkan dengan flokulan sintetik, yaitu lebih aman, mudah terurai di lingkungan (biodegradable), tidak memerlukan dosis yang besar dalam pemakaiannya (hanya sekitar 1-5 ppm), flok yang terbentuk lebih besar dan kuat (Singh et al. 2000).
Penelitian Susanti (2007) telah berhasil mengisolasi dan mengkarakterisasi isolat penghasil bioflokulan yang berasal dari berbagai sumber, beberapa diantaranya berasal dari sumber perairan di daerah Bogor. Isolat-isolat yang diperoleh menunjukkan aktivitas flokulasi yang cukup tinggi (> 65%) pada kisaran pH yang cukup luas (pH 2-8), namun belum diketahui jenis bioflokulannya. Hal ini penting karena setiap mikroorganisme memproduksi bioflokulan dengan komposisi yang berbeda-beda. Dengan demikian, jenis bioflokulan yang diproduksi dapat diaplikasikan secara tepat, terutama untuk industri pengolahan makanan.
Penelitian ini menggunakan isolat KH-3 yang berasal dari kawah hitam Gunung Pancar, Bogor. Isolat KH-3 ini dipilih karena setelah melalui beberapa tahap penumbuhan, produksi, pengujian aktivitas, dan pemurnian menunjukkan hasil yang lebih stabil (konstan) dibandingkan isolat lain. Penelitian bertujuan mengidentifikasi komposisi bioflokulan dari isolat KH-3. Hipotesis penelitian adalah bioflokulan yang telah dimurnikan memiliki komposisi polisakarida atau protein. Hasil penelitian ini diharapkan dapat diaplikasikan pada bidang industri dan dapat memberikan kontribusi bagi perkembangan bioteknologi di Indonesia dalam menghasilkan bioflokulan yang biodegradable.
TINJAUAN PUSTAKA
Bioflokulan dan Jenisnya
Bioflokulan merupakan hasil proses dinamik dari sintesis polimer ekstraseluler oleh organisme hidup dan memiliki komposisi yang bervariasi (Jie et al. 2006). Pemanfaatan bioflokulan yang dihasilkan oleh mikroorganisme telah banyak dilakukan pada beberapa tahun terakhir karena sifatnya yang aman dan biodegradable (Yokoi et al. 1995). Beberapa bakteri yang ditemukan dapat menghasilkan bioflokulan, diantaranya
Aspergillus sojae, Paecilomyces sp,
Agrobacterium sp, dan Rhodococcus
2
(Farah R dan Richard F 1976), Bacillus sp AS-101 (Salehizadeh et al. 1999),
Myxobacterium nannocystis sp NU-2, Bacillus
sp DP-152 (Suh et al. 1997), Bacillus licheniformis (Shih et al. 2001), Nocardia
amarae YK1 (Takeda et al. 1992),
Arcuadendron sp TS-4 (Lee et al. 1995). Bioflokulan terdiri atas beberapa jenis, seperti bioflokulan protein, polisakarida, lipopolisakarida, lipid, lipoprotein, glikoprotein, dan asam poliglutamat.
Rhodococcus erythropolis S-1 memproduksi bioflokulan protein (Kurane et al. 1986).
Alcaligenes sp B-18 dan Bacillus sp DP-152 menghasilkan bioflokulan polisakarida (Suh et al. 1997). Bioflokulan glikoprotein dihasilkan oleh Arcuadendron sp TS-4 (Lee et al. 1995).
Bacillus subtilis memproduksi bioflokulan asam poliglutamat (Mahmoud 2006).
Berdasarkan hasil penelitian Nakamura et al. (1976) ditemukan sebanyak 19 strain yang meliputi fungi, bakteri, Actinomycetes, dan ragi yang dapat menghasilkan bahan-bahan yang dapat memflokulasikan ragi roti (Saccharomyces cerevisiae), diantaranya adalah Aspergillus sojae, Anixiella reticulate,
Geotrichum candidum, Eupenicillum
crusteceaus, Monascus anka, Sordia fimicoal,
Pseudomonas fluorescence, Staphylococcus aureus, Corynebacterium brevicule, dan
Streptomyces vinaceus. Hasil penelitian Parwono (1998) menunjukkan bahwa dari 26 isolat yang diuji kemampuan aktivitas flokulasinya terhadap suspensi kaolin ditentukan lima isolat yang mampu memflokulasikan suspensi kaolin dengan cairan kulturnya. Lima isolat tersebut adalah
Pseudomonas aeruginosa, Bacillus cereus, Listeria monocytogenes, Streptococcus, thermophillus, dan Lactobacillus acidophillus. Sampai saat ini, bioflokulan merupakan produk baru maka untuk membuktikan hasil identifikasinya masih terus dilakukan pengujian dan penelitian di beberapa laboratorium di Jepang.
Pemanfaatan Bioflokulan Spektrum penggunaan bioflokulan sangatlah luas, seperti pada industri pengolahan limbah, fermentasi, dan industri gula. Pada industri gula, biasa digunakan flokulan organik dalam pemurnian gula, sedangkan pada industri fermentasi, contoh yang sudah diketahui adalah pada industri minuman bir. Satu tahapan yang penting dalam industri pembuatan minuman bir adalah terbentuknya etanol dan komponen penyedap
yang pada akhirnya harus dipisahkan dari bahan khamir (Sumarno 2000). Pada industri makanan, bioflokulan dapat mencegah terjadinya sineresis (keluarnya air dari struktur gel) yang merupakan tanda awal terjadinya kerusakan makanan (Broadbent et al. 2003). Penggunaan bioflokulan dalam bidang farmasi, antara lain sebagai antitumor, antiviral, dan antiinflamasi (Wiley 2003).
Selain sebagai agen flokulasi, bioflokulan juga dapat berfungsi sebagai penstabil emulsi (bioemulsifier) dan penjerap logam berat. Bioflokulan dari Bacillus subtilis dan
Enterobacter agglomerans mampu menjerap logam berat, seperti nikel dan kadmium dengan konsentrasi optimum sebesar 60 ppm (Kaewchai & Prasertsan 2002). Bioflokulan dari Pseudomonas sp mampu menstabilkan emulsi minyak-air selama 10 hari. Bioflokulan tersebut diuji terhadap berbagai jenis minyak, seperti minyak bunga matahari, minyak biji kapas, minyak jagung, dan minyak zaitun. Kemampuannya sebagai penstabil emulsi terbukti lebih baik jika dibandingkan dengan
emulsifier lain, seperti xanthan gum, Arabic gum, pullulan, dan dekstran (El Tayeb & Khodair 2007).
Penelitian bioflokulan di Indonesia sudah dilakukan, yaitu dengan mengaplikasikannya pada limbah cair industri tapioka di Lampung (Achyani 1999) serta industri kertas di Bekasi (Suryadarma 1997). Achyani (1999) menggunakan jenis bakteri Alcaligenes latus
dan alum (Al2SO4) sebagai bahan koagulan
sedangkan penelitian Suryadarma (1997) menggunakan jenis bakteri yang sama dan CaCl2 sebagai koagulannya. Penentuan
aktivitas flokulasi dan koagulasi dalam kedua penelitian tersebut menggunakan jar test. Aplikasi bioflokulan pada industri di Indonesia hanya terbatas pada pengolahan limbah cair saja sedangkan pada bidang industri lainnya belum dilakukan.
Koagulasi dan Flokulasi Koagulasi merupakan suatu proses destabilisasi partikel koloid dengan adanya bahan-bahan kimia yang berlawanan muatannya sehingga terbentuk gumpalan (flok). Bahan-bahan kimia itu dinamakan koagulan dan biasanya digunakan untuk mengendapkan padatan yang secara normal tidak dapat mengendap. Partikel koloid umumnya bermuatan negatif. Penambahan koagulan yang bermuatan positif akan menetralkan muatan tersebut. Tujuan dari koagulasi adalah untuk menurunkan energi
3
penghalang hingga bernilai nol, sehingga partikel-partikel tidak lagi saling tolak-menolak. Penambahan kation multivalen ke dalam air adalah suatu cara untuk mengurangi nilai energi penghalang ini. Dengan demikian, partikel-partikel koloid akan saling berikatan dan bergabung membentuk flok (Shuval 1977).
Koagulasi terpenuhi dengan penambahan ion-ion yang mempunyai muatan yang berlawanan dengan partikel koloid. Kekuatan koagulasi ion-ion tersebut bergantung pada bilangan valensi atau besarnya muatan. Ion bivalen (+2) 30-60 kali lebih efektif dari ion monovalen (+1) dan ion trivalen (+3) 700-1000 kali lebih efektif dari ion monovalen. Proses koagulasi dipengaruhi oleh muatan ion yang berasal dari larutan elektrolit yang ditambahkan. Efek penambahan ion tersebut akan semakin meningkat tergantung pada jumlah muatan (jenis ion) yang dimilikinya (Sawyer et al. 1994).
Metcalf dan Eddy dalam Achyani (1999) menyatakan bahwa untuk mendorong pembentukan agregat partikel harus diambil langkah-langkah tertentu guna mengurangi muatan atau mengatasi pengaruh muatan partikel. Menurut Tebbut (1990) pada pengendapan suspensi secara alami hanya terjadi penggabungan dan agglomerasi yang relatif terbatas serta pengadukan tidak dapat meningkatkan karakteristik pengendapan suspensi secara nyata.
Setelah koagulasi terjadi flokulasi, yaitu penggabungan flok-flok hasil koagulasi untuk membentuk agregat yang lebih besar dan akhirnya mengendap. Flokulasi terjadi dengan bantuan flokulan (senyawa kimia berupa polimer berbobot molekul tinggi) (Mujiadi & Nieke 2001). Polimer disebut juga polielektrolit jika monomernya mengandung gugus fungsi yang dapat terionisasi. Flokulan biasanya digolongkan menjadi tiga bagian, yaitu flokulan anorganik (aluminium sulfat, feri sulfat, polialuminium klorida), flokulan organik sintetik (asam poliakril, turunan poliakrilamida), dan flokulan alami yang disebut bioflokulan (kitosan, natrium alginat, gelatin, dan polimer mikroba) (Dermlim et al.
1999).
Menurut Kennedy et al. (1994), mekanisme terjadinya koagulasi-flokulasi terdiri atas empat tahapan umum (Gambar 1). Tahapan-tahapan tersebut, diantaranya (1) dispersi (penyebaran) polielektrolit dalam suspensi, (2) adsorpsi antarpermukaan padatan-cairan, (3) kompresi (pelingkupan) dari polielektrolit yang teradsorpsi, (4)
agregasi (penggabungan) masing-masing polielektrolit yang telah terlingkupi oleh partikel-partikel koloid untuk membentuk flok, lalu agregat yang lebih besar, dan akhirnya mengendap.
Koagulasi dan flokulasi merupakan proses yang sangat erat dan keberhasilan proses flokulasi sangat bergantung dari proses koagulasi yang merupakan rangkaian proses pembentukan flok-flok. Proses koagulasi dan flokulasi dipengaruhi oleh beberapa faktor, seperti komponen pembentuk warna limbah cair, pH, kekeruhan, kadar dan komponen mineral, suhu, kecepatan dan lama pengadukan, serta sifat koagulan dan flokulan yang digunakan (Sumarno 2000). Proses flokulasi yang tidak efisien dapat terjadi akibat dosis bioflokulan yang berlebih atau pengadukan yang terlalu cepat atau lama. Jika hal ini terjadi, molekul polimer akan menutupi seluruh permukaan partikel koloid sehingga tidak ada lagi situs aktif yang dapat digunakan untuk membentuk jembatan flok. Hal ini mengakibatkan partikel restabil atau mungkin terjadi perubahan muatan (Benefield et al.
1982).
Gambar 1 Tahapan terjadinya koagulasi-flokulasi (Kennedy et al. 1994).
Medium Produksi Bakteri Bioflokulan Medium kultur yang digunakan merupakan faktor penting untuk memperoleh inokulum dan hasil kultivasi yang baik. Medium ditentukan selain untuk memenuhi kebutuhan nutrisi bagi mikroorganisme, juga digunakan untuk memenuhi kebutuhan bagi pembentukan produk bioflokulan yang maksimum. Jika lebih dari 80% hasil aktivitas metabolik dilepaskan ke medium, maka bioflokulan yang dihasilkan merupakan produk ekstraseluler (Lu et al. 2005).
Pembentukan bioflokulan diawali pada fase pertumbuhan logaritmik, mencapai maksimum pada awal fase stasioner (60 jam). Hal tersebut menandakan bahwa bioflokulan diproduksi melalui biosintesis selama pertumbuhan dan bukan hasil autolisis sel (Jie
et al. 2006). Produksi akan menurun pada fase kematian karena autolisis sel dan penurunan aktivitas enzim. Bioflokulan yang terbentuk ditandai dengan peningkatan viskositas kultur.
4
Dengan demikian, kandungan bioflokulan berbanding lurus dengan viskositas kultur sehingga viskositas dapat dijadikan indeks produksi bioflokulan (Nohata dan Kurane 1994). Kultur akan menunjukkan viskositas tinggi apabila sumber karbonnya berisi glukosa, sukrosa, silosa, fruktosa, ramnosa, dan selobiosa. Ini mengindikasikan bahwa monosakarida dan disakarida sesuai untuk memproduksi bioflokulan (Nohata & Kurane 1994).
Produksi bioflokulan dipengaruhi oleh rasio sumber karbon dan nitrogen dalam medium kultur. Penambahan glukosa sebagai sumber karbon memberikan nilai viskositas terbesar dibandingkan dengan yang lain. Penggunaan glukosa dengan konsentrasi tinggi (lebih dari 2 g/L) akan menghambat pertumbuhan sel dan produksi bioflokulan, sedangkan dalam konsentrasi rendah, penggunaan glukosa akan menstimulasi produksi bioflokulan dalam jumlah besar (Zhang et al. 2002).
Lain halnya dengan hasil penelitian Songklanakarin et al. (2002), galaktosa dan sukrosa memberikan hasil produksi bioflokulan yang tinggi terhadap isolat
Enterobacter sp, masing-masing 2.50 dan 2.45 g/L. Peningkatan produksi dicapai dengan penambahan sukrosa setiap tiga hari kultivasi. Hasil produksi meningkat sebanyak 2.5 kali volume awal, yaitu menjadi 6.1 g/L. Selain itu, polisakarida seperti pati juga dapat digunakan sebagai sumber karbon untuk bioflokulan yang diproduksi dari
Myxobacterium nannocystis sp NU-2.
Substansi flokulasi yang dihasilkan mencapai 14.8 g/L (Zhang et al. 2002). Pati juga digunakan sebagai sumber karbon untuk
Sorangium cellulosum untuk menghasilkan bioflokulan dalam jumlah yang sama dengan kandungan pati sebesar 30 g/L pada medium. Namun, dengan penambahan 30 g/L pati dan 2 g/L glukosa dapat meningkatkan produktivitas bioflokulan hingga mencapai 17.5 g/L (Zhang et al. 2002).
Ekstrak khamir merupakan sumber nitrogen organik yang paling baik untuk pembentukan bioflokulan dibanding dengan sumber nitrogen lainnya. Menurut Nohata dan Kurane (1994), penambahan konsentrasi ekstrak khamir yang paling sesuai untuk menghasilkan bioflokulan adalah sebesar 0.5%. Namun, glisin dapat digunakan sebagai pengganti ekstrak khamir karena harganya yang relatif murah dan dapat menghasilkan viskositas yang lebih besar dibanding ekstrak khamir (Nohata & Kurane 1997). Produksi
bioflokulan dari Sorangium cellulosum
menggunakan NaNO3 sebagai sumber
nitrogen yang paling efektif (Zhang et al.
2002).
Sumber nitrogen anorganik dapat berasal dari urea dan potasium nitrat, sedangkan amonium klorida, amonium sulfat, dan amonium nitrat tidak baik digunakan sebagai sumber nitrogen anorganik (Nohata dan Kurane 1994). Kemungkinan adanya urea dalam medium dapat mempengaruhi laju konsumsi substrat (karbon/nitrogen). Rasio konsumsi C/N dalam sel yang meningkat akan menstimulasi pembentukan bioflokulan.
Aktivitas dan Sifat Flokulasi Bioflokulan Kaolin digunakan sebagai bahan uji standar untuk mengetahui kemampuan aktivitas flokulasi (Kurane et al. 1986). Selain kaolin, aktivitas flokulasi juga dapat diuji menggunakan diatomit, bentonit, karbon aktif, dan lumpur aktif. Pengukuran aktivitas flokulasi berdasarkan pada tingkat kejernihan larutan yang mengandung tanah kaolin 5500 ppm yang ditambahkan cairan kultivasi. Setelah dibiarkan selama lima menit akan terbentuk agregat-agregat yang lebih besar yang mampu mempercepat terjadinya pengendapan. Lalu, kerapatan optis (OD) lapisan atas campuran (supernatan) diukur dengan spektrofotometer pada panjang gelombang 550 nm. Nilai aktivitas flokulasi dihitung menggunakan persamaan : (A-B)/A x 100%, A merupakan OD kontrol dan B adalah OD sampel (Kurane et al. 1991).
Menurut Kurane et al. (1986), distribusi aktivitas flokulasi dalam kultur diuji menggunakan filtrat kultur dan sel-sel tercuci. Sekitar 90% aktivitas flokulasi diperoleh dari kultur dan 10% dari sel bakteri. Kultur bakteri dipanen dan disentrifugasi pada 11000 x g selama 10 menit. Supernatan yang diperoleh digunakan sebagai filtrat kultur. Presipitatnya dibilas dengan air destilasi dan disentrifugasi kembali. Presipitat yang dihasilkan dari sentrifugasi kedua digunakan sebagai sel-sel tercuci. Aktivitas flokulasi diperoleh dari kedua fraksi (filtrat kultur dan sel-sel tercuci). Yang dimaksud dengan kultur adalah hasil kultivasi bakteri yang belum dipisahkan antara sel-sel bakteri dan filtrat kulturnya, sedangkan yang dimaksud dengan sel-sel tercuci adalah sel-sel bakteri utuh yang telah dipisahkan dari filtrat kulturnya. Filtrat kultur yang telah dipisahkan berisi berbagai komponen media dan hasil metabolisme bakteri yang terdapat di luar sel, termasuk bioflokulan yang
5
merupakan polimer ekstrasel. Mikroorganisme yang dapat memflokulasikan suspensi kaolin hanya dengan filtrat kulturnya akan memiliki potensi yang lebih besar sebagai penghasil bioflokulan. Kemampuan flokulasinya disebabkan oleh adanya bahan-bahan tertentu di dalam kultur atau filtrat kultur yang mampu memflokulasikan kaolin, bukan karena adanya interaksi elektrostatik antara permukaan sel-selnya dengan partikel-partikel kaolin (Parwono 1998).
Flokulasi suspensi kaolin oleh kultur bakteri mengubah sifat partikel-partikel kaolin dalam suspensi dari partikel diskrit menjadi partikel flokulan. Pada partikel diskrit, kecepatan pengendapannya bersifat konstan terhadap kedalaman sementara pada partikel flokulan terjadi peningkatan kecepatan pengendapan terhadap kedalaman akibat meningkatnya ukuran partikel individual melalui penggabungan dengan partikel yang mengendap lebih lambat. Parameter yang diamati pada sifat karakteristik isolat meliputi sifat flokulasi, pH kultur, pertumbuhan sel-sel bakteri dalam kultur, dan kecepatan pengendapan dari flok yang terbentuk.
Karakterisasi yang sudah banyak dilakukan berdasarkan aktivitas flokulasi meliputi penentuan dosis flokulan, pH, suhu, dan pengaruh ion-ion logam terhadap aktivitas flokulasi isolat potensi. Contohnya, pada
Bacillus sp AS-101, aktivitas maksimum diamati pada pH 3.5 dan distimulasi oleh penambahan Al3+, Fe2+, Ca2+, dengan konsentrasi bioflokulan optimum 0.2 sampai 25.8 mM (Salehizadeh et al. 1999),
Corynebacterium xerosis menghasikan flok dengan kualitas tinggi yang diperoleh melalui penggunaan konsentrasi sel sebesar 40 mg/L pada pH 7 (Hass et al. 1999). Aktivitas flokulasi pada Myxobacterium nannocystis
NU-2 dapat mencapai 90% dengan pengaruh kation seperti Fe2+ dan Al3+ serta tidak banyak berubah pada kisaran pH 2-13 (Zhang et al.
2002).
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan, diantaranya spektrofotometer Genesys,vortex, Erlenmeyer, pH meter, rotary shaker, gelas piala, pipet Mohr, tabung reaksi, gelas ukur, waterbath shaker, pipet volumetrik, magnetic stirrer, autoklaf, laminar air flow, oven, cawan Petri,
waterbath, dan sentrifus Beckman JA-20.
Bahan-bahan yang digunakan, diantaranya suspensi kaolin, isolat KH-3, AlCl3, glukosa,
sukrosa, MgSO4, K2HPO4, KH2PO4,
(NH4)2SO4, NaCl, urea, pepton, ekstrak
khamir, bakto agar, gelrite, akuades, etanol absolut, pereaksi Molisch (larutan 5% αnaftol dalam alkohol 95%), larutan ninhidrin 0.1%, larutan NaOH 10%, larutan CuSO4 0.1%,
reagen Bradford, asam sulfat 96%, fenol 4%, standar glukosa, dan standar bovine serum albumin (BSA).
Metode Penelitian
Peremajaan Isolat
Sebanyak 1 ose isolat KH-3 dalam stok gliserol diinokulasi pada media Thermus agar ((NH4)2SO4 0.01%, MgSO4 0.025%, CaCl2
0.0125%, KH2PO4 0.02%, NaCl 0.1%, ekstrak
khamir 0.2%, pepton 0.4%, bakto agar 0.8%, dan gelrite 0.4%) (Susanti 2007). Lalu, koloni tunggal yang terbentuk diinokulasi ke dalam 10 mL media Thermus cair. Kultur diinkubasi pada waterbath shaker suhu 55 0C, 120 rpm selama 16 jam. Setelah inkubasi, kultur siap digunakan untuk percobaan selanjutnya.
Produksi Bioflokulan
Sebanyak 1% dari kultur dipindahkan ke dalam 100 mL media produksi (glukosa 10 g, sukrosa 10 g, KH2PO4 1.5 g, K2HPO4 4.5 g,
(NH4)2SO4 1.5 g, NaCl 0,1 g, urea 1 g, pepton
0.5 g, MgSO4 0.2 g, ekstrak khamir 0.5 g
dalam 1 L akuades dan diatur pHnya 7.3) dalam Erlenmeyer 500 mL. Optimasi waktu produksi dilakukan dengan pengambilan kultur bioflokulan per 24 jam selama 70 jam. Kultur tersebut diukur ODnya dan diuji aktivitas flokulasinya.
Variasi sumber karbon dilakukan terhadap empat macam media sedangkan variasi sumber nitrogen dilakukan hanya pada media keempat, yaitu tanpa penambahan pepton 0.05%. Media pertama mengandung glukosa 1%, sukrosa 1%, KH2PO4 0.15%, K2HPO4
0.45%, (NH4)2SO4 0.15%, NaCl 0.01%, urea
0.1%, pepton 0.05%, MgSO4 0.02%, dan
ekstrak khamir 0.05%. Komposisi media kedua sama dengan media pertama, namun sumber karbon yang digunakan berupa glukosa 2%. Komposisi media ketiga sama dengan media pertama, hanya sumber karbonnya diganti dengan glukosa 1% dan fruktosa 1%. Komposisi media keempat sama dengan media ketiga, tapi tanpa penambahan pepton 0.05%. Kultur dalam media produksi
6
selanjutnya diinkubasi pada rotary shaker
suhu ruang dengan kecepatan 120 rpm selama 70 jam. Bioflokulan hasil produksi diuji aktivitas flokulasinya.
Aktivitas Flokulasi terhadap Kaolin Sebanyak 80 mL suspensi kaolin (5.5 g/L) dicampur dengan 10 mL AlCl3 0.05%, 1 mL
kultur bioflokulan, dan ditambahkan akuades hingga volumenya 100 mL. Kemudian, campuran diaduk dan dibiarkan selama 5 menit. Supernatan ditentukan absorbansinya pada λ = 550 nm dengan spektrofotometer. Untuk kontrol dilakukan dengan kondisi yang sama, hanya tanpa penambahan bioflokulan. Nilai aktivitas flokulasi dihitung menggunakan rumus: (A-B)/A x 100%, dengan A adalah absorbansi kontrol dan B adalah absorbansi sampel (Kurane et al. 1986 yang dimodifikasi).
Pemurnian Bioflokulan
Kultur dari media produksi dipisahkan melalui sentrifugasi pada 6000 x g selama 10 menit. Supernatan hasil sentrifugasi dipekatkan dengan penambahan etanol absolut dingin sebanyak dua kali volume secara bertahap. Campuran dibiarkan setimbang selama 2 jam dan disentrifugasi pada 12000 x g selama 15 menit. Endapannya dikeringkan hingga diperoleh bioflokulan hasil pengendapan etanol yang akan dianalisis lebih lanjut (Zhang et al. 2002).
Identifikasi Komposisi Bioflokulan
Identifikasi komposisi bioflokulan meliputi analisis secara kualitatif maupun kuantitatif. Sebelumnya, bioflokulan hasil pengendapan etanol diuji kelarutannya dalam akuades. Jika larut dalam air, bioflokulan diperkirakan mengandung polisakarida atau protein atau keduanya dalam jumlah yang berbeda. Jika tidak larut dalam air, kemungkinan bioflokulan mengandung lipid. Selain akuades, bioflokulan tersebut juga diuji kelarutannya dalam pelarut organik, seperti etanol.
Analisis kualitatif yang dilakukan, yaitu uji Molisch, uji Ninhidrin, dan uji Biuret. Uji Molisch merupakan uji umum untuk karbohidrat, sedangkan uji Ninhidrin dan Biuret dilakukan untuk mengetahui adanya protein dalam sampel. Analisis kuantitatif meliputi penentuan kandungan protein (Bradford 1976) dan kadar gula total (Chaplin & Kennedy 1986). Sampel yang digunakan
untuk analisis merupakan bioflokulan hasil pengendapan etanol yang dilarutkan dalam akuades dengan konsentrasi 0.1%.
Prosedur uji Molisch, yaitu sebanyak 5 mL larutan sampel dipipet ke dalam tabung reaksi dan ditambahkan dua tetes pereaksi Molisch, kemudian dicampur rata. Selanjutnya, ditambahkan 3 mL asam sulfat pekat perlahan-lahan melalui dinding tabung. Warna ungu kemerahan yang terbentuk pada batas kedua cairan menunjukkan reaksi positif. Uji ninhidrin dilakukan dengan mereaksikan 3 mL larutan sampel dengan 0.5 mL larutan ninhidrin 0.1%. Larutan dipanaskan dalam penangas air mendidih selama 10 menit. Warna biru yang terbentuk menunjukkan reaksi positif. Uji Biuret dilakukan dengan mencampurkan 1 mL larutan NaOH 10% ke dalam 3 mL larutan sampel, lalu dikocok. Selanjutnya, ditambahkan satu tetes larutan CuSO4 0.1%
hingga terbentuk warna biru (Wharton & Mac Carty 1972).
Kadar protein ditentukan dengan metode Bradford (1976). Langkah pertama adalah pembuatan kurva standar. Prosedurnya, yaitu sebanyak 0-100 µL standar BSA (1 mg/mL) dipipet ke dalam tabung reaksi (interval 10 µL) dan ditambahkan NaCl 0.9% hingga volumenya menjadi 0.1 mL, lalu ditambah 5 mL reagen Bradford dan dicampur rata. Untuk blanko, larutan standar diganti dengan NaCl 0.9%. Sampel yang digunakan sebanyak 100 µL dan diberi perlakuan yang sama seperti standar. Absorbansi dibaca pada λ = 595 nm dengan spektrofotometer. Kadar protein diketahui menggunakan persamaan dari kurva standar.
Kandungan gula total ditentukan berdasarkan metode fenol-asam sulfat (Chaplin & Kennedy 1986). Langkah pertama adalah pembuatan kurva standar. Prosedurnya, yaitu sebanyak 0-50 μL standar glukosa (1 mg/mL) dipipet ke dalam tabung reaksi (interval 5 μL) dan ditambahkan akuades hingga volumenya 0.05 mL. Selanjutnya, ditambahkan 500 μL larutan fenol 4% dan 2.5 mL asam sulfat 96%. Untuk blanko, standar diganti dengan akuades. Sampel yang digunakan sebanyak 20 dan 50 μL, ditambahkan akuades hingga volumenya 0.05 mL, serta diberi perlakuan yang sama seperti standar. Setelah dibiarkan selama 5-10 menit, absorbansi dibaca pada λ = 490 nm dengan spektrofotometer. Kadar gula total dihitung menggunakan persamaan kurva standar.
7
HASIL DAN PEMBAHASAN
Isolat Hasil Peremajaan
Isolat yang digunakan dalam penelitian ini adalah KH-3 yang berasal dari kawah Gunung Pancar, Bogor. Isolat tersebut merupakan salah satu isolat hasil penapisan penelitian Susanti (2007). Isolat KH-3 diremajakan dalam media Thermus, yaitu media khusus untuk mikroorganisme termofilik.
Tujuan peremajaan isolat adalah mengaktivasi dan mempersiapkan sel sampai fase eksponensial (tahap propagasi) sehingga dapat mempercepat fase adaptasi pada waktu produksi. Pada tahap propagasi, mikroorganisme mengatur metabolisme berupa sintesis enzim dan aktivitasnya sehingga mampu tumbuh lebih efisien dalam kondisi baru.
Teknik peremajaan isolat menggunakan metode cawan gores. Prinsipnya adalah untuk mengisolasi mikroba sehingga suatu spesies dapat dipisahkan antara satu dengan yang lain sehingga dapat tumbuh menjadi biakan murni. Oleh karena itu, faktor-faktor fisik yang menyediakan kondisi optimum, seperti suhu dan pH perlu diperhatikan. Hal ini penting agar mikroorganisme dapat tumbuh secara baik. Suhu dan pH optimum untuk pertumbuhan isolat KH-3 adalah 55 0C dan 7 (Susanti 2007).
Penumbuhan bakteri pada media agar melalui proses yang berulang-ulang karena sulitnya tumbuh dan beradaptasi. Hasil peremajaan isolat KH-3 pada media agar diperoleh tiga koloni tunggal berbentuk bulat dan berwarna putih (Gambar 2). Koloni-koloni tersebut memiliki bentuk, ukuran, dan warna yang sama antara satu dengan yang lainnya.
Gambar 2 Hasil peremajaan isolat KH-3.
Bioflokulan Hasil Produksi Isolat KH-3
Isolat hasil peremajaan ditumbuhkan dalam media produksi bioflokulan. Tujuannya adalah menstimulasi mikroorganisme untuk mengeluarkan bioflokulannya yang merupakan polimer esensial yang diproduksi pada masa pertumbuhan (Jie et al. 2006). Komposisi bahan dalam media merupakan
faktor penting dalam produksi bioflokulan. Desain media ini tidak hanya ditujukan untuk memenuhi kebutuhan nutrisi mikroorganisme, tapi juga untuk menstimulasi pembentukan produk bioflokulan yang optimum. Hasil produksi yang baik juga dipengaruhi oleh lamanya waktu yang dibutuhkan untuk produksi. Oleh karena itu, dalam penelitian ini juga ditentukan waktu optimum untuk produksi bioflokulan.
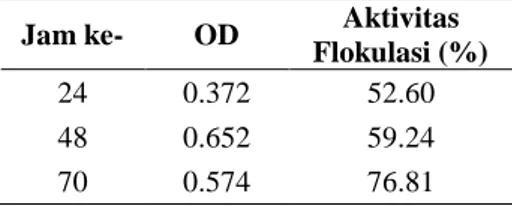
Waktu yang dibutuhkan agar hasil produksi mencapai optimum dinamakan waktu produksi optimum. Penentuan waktu tersebut dalam penelitian ini berdasarkan pada nilai OD dan aktivitas flokulasi. Optimasi produksi dilakukan per 24 jam dalam jangka waktu 70 jam. Kultur diambil setiap 24 jam untuk diukur ODnya dan diuji aktivitas flokulasinya. Sel tumbuh dengan cepat yang ditunjukkan oleh peningkatan nilai OD pertumbuhan hingga jam ke-48, yaitu dari 0.372 menjadi 0.652. Saat memasuki jam ke-70, pertumbuhan mikroorganisme menurun, tetapi aktivitas flokulasinya terus meningkat dan menunjukkan nilai yang paling tinggi, yaitu sebesar 76.81% (Tabel 1), yang berarti produksi bioflokulan optimum pada saat itu. Berdasarkan hasil tersebut, jam ke-70 dapat dikatakan sebagai waktu optimum produksi bioflokulan.
Peningkatan massa sel hingga jam ke-48 menunjukkan pertumbuhan bakteri mencapai fase log (eksponensial). Pada fase ini, mikroorganisme telah mampu beradaptasi dan melakukan aktivitas metabolisme secara optimum sehingga terbentuk metabolit primer. Metabolit ini dapat digunakan sebagai substrat bagi aktivitas metabolisme selanjutnya. Substrat berlebih dan energi dari metabolisme pertama dapat digunakan untuk membentuk produk bioflokulan, yang merupakan metabolit sekunder. Proses ini terjadi saat pertumbuhan mikroorganisme mengalami penurunan. Pembentukan bioflokulan diawali pada fase pertumbuhan logaritmik, mencapai maksimum pada awal fase stasioner (Jie et al. 2006). Dengan demikian, jam ke-70 merupakan saat pertumbuhan mikroorganisme memasuki awal fase stasioner.
Tabel 1 Optimasi waktu produksi bioflokulan dari isolat KH-3 per 24 jam
Jam ke- OD Aktivitas Flokulasi (%)
24 0.372 52.60
48 0.652 59.24
8
Selama produksi, peningkatan nilai aktivitas flokulasi berbanding lurus dengan peningkatan jumlah sel (nilai OD pertumbuhan) dan lamanya waktu produksi. Hal ini mengindikasikan bahwa bioflokulan diproduksi selama pertumbuhan melalui biosintesis sel, bukan hasil autolisis sel (Jie et al. 2006). Penggunaan waktu yang lebih lama untuk produksi dimaksudkan untuk memperoleh bioflokulan dalam jumlah lebih banyak.
Produksi bioflokulan dilakukan dalam media menggunakan rotary shaker dengan kecepatan 120 rpm. Kecepatan tersebut digunakan dalam produksi agar bakteri memperoleh aerasi yang baik, mengingat kemungkinan bakteri tersebut bersifat aerob atau aerob fakultatif. Selain itu, juga agar kultur homogen dan dapat menyeragamkan kondisi.
Selain waktu optimum dan aerasi, sumber karbon dan nitrogen dalam media juga memiliki peran penting dalam produksi. Kedua komponen tersebut berpengaruh terhadap jenis bioflokulan yang dihasilkan. Menurut Nohata dan Kurane (1994), penambahan sukrosa dan glukosa sebagai sumber karbon akan menunjukkan viskositas yang tinggi. Selain itu, mikroorganisme akan terus mengkonsumsi sumber karbon tersebut sekaligus akan mengeluarkan produk-produk metabolisme dalam jumlah yang tinggi. Ekstrak khamir merupakan sumber nitrogen organik yang paling baik untuk pembentukan bioflokulan dibandingkan sumber yang lainnya, seperti polipepton dan asam aspartat. Penambahan yang paling sesuai adalah sebesar 0.5 gram (Nohata & Kurane 1994). Urea dan (NH4)2SO4 merupakan sumber
nitrogen anorganik. Penambahan urea pada media kultivasi selain sebagai sumber amino juga akan meningkatkan rasio konsumsi C/N. Rasio C/N yang tinggi dalam media mampu menginduksi pertumbuhan dan menstimulasi pembentukan bioflokulan (Dermlim et al.
2006).
Derajat keasaman (pH) pada media juga perlu diperhatikan selain nutrisi. Nilai pH media yang sesuai untuk produksi bioflokulan adalah 7.3. Seiring dengan peningkatan waktu produksi, perubahan pH dalam media sangat mungkin terjadi akibat adanya senyawa-senyawa asam atau basa yang dihasilkan dari proses metabolisme sehingga menghambat pertumbuhan isolat KH-3. Akibatnya, jumlah sel yang tumbuh akan berkurang dan ini akan mempengaruhi produksi bioflokulan. Oleh karena itu, dalam penelitian ini digunakan
bufer fosfat (KH2PO4 dan K2HPO4) yang
selain berfungsi sebagai sumber energi, juga mampu menjaga pH media selama kultivasi agar selalu berkisar pada pH netral.
Variasi sumber karbon dan nitrogen dilakukan untuk memperoleh komposisi media yang tepat untuk produksi bioflokulan. Variasi sumber karbon dilakukan terhadap empat macam media sedangkan variasi sumber nitrogen dilakukan hanya pada media keempat, yaitu tanpa penambahan pepton 0.05%. Hal ini dilakukan untuk mengetahui pengaruh pepton dalam produksi bioflokulan. Penggunaan pepton dalam media produksi dapat menghambat pertumbuhan bakteri dan menurunkan produksi bioflokulan (Qin et al.
2004; Kurane et al. 1986). Hasil penelitian menunjukkan sumber karbon yang sesuai dapat mempengaruhi peran pepton dalam produksi. Hal ini ditandai oleh peningkatan produksi bioflokulan saat pepton digunakan bersama-sama dengan glukosa dan sukrosa 1%. Proses sebaliknya akan terjadi jika sumber karbon diganti dengan glukosa dan fruktosa 1% serta glukosa 2%.
Tingkat produksi yang baik dalam penelitian ini dapat dilihat dari keruhnya media pertama setelah produksi 70 jam (Gambar 3). Oleh karena itu, nilai ODnya paling tinggi dibandingkan media lainnya, yaitu sebesar 0.685 (Tabel 2). Penggunaan tiga macam sumber karbon, yaitu dua glukosa dan satu fruktosa (lebih banyak daripada media lain), memungkinkan berlimpahnya persediaan nutrisi untuk mendukung pertumbuhan mikroorganisme. Pertumbuhan mikroorganisme secara baik akan mempengaruhi tingkat produksi bioflokulannya. Dengan demikian, dapat pula dikatakan glukosa 1% dan sukrosa 1% merupakan sumber karbon yang paling optimal bagi produksi bioflokulan dari isolat KH-3 dengan waktu produksi optimum selama 70 jam.
Penggunaan media kompleks memungkinkan salah satu komponen substrat dapat menekan aktivitas katabolik substrat lain. Ini karena enzim katabolik untuk substrat tersebut akan terinduksi hanya setelah substrat pertama digunakan. Glukosa lebih disukai sebagai substrat pertama karena mudah diserap oleh sel bakteri. Oleh karena itu, penggunaan fruktosa dan sukrosa sebagai sumber karbon biasanya digabungkan dengan glukosa. Walaupun sukrosa menyediakan sumber karbon lebih banyak, sukrosa perlu dihidrolisis dahulu menjadi glukosa dan fruktosa untuk dapat dikonsumsi oleh bakteri.
9
Gambar 3 Kultivasi KH-3 pada media 1 selama 70 jam pada suhu ruang dengan kecepatan 120 rpm.
Tabel 2 Data OD λ 550 nm setelah kultivasi selama 70 jam Media OD (λ 550 nm) 1 0.685 2 0.081 3 0.027 4 0.034
Hasil Aktivitas Flokulasi terhadap Kaolin
Aktivitas flokulasi bioflokulan ditentukan dengan metode Kurane et al. (1986), menggunakan suspensi kaolin sebagai bahan uji standar. Prinsipnya adalah pengukuran tingkat kejernihan larutan yang diukur pada panjang gelombang 550 nm. Volume kultur bioflokulan yang efektif digunakan dalam aktivitas flokulasi adalah sebanyak 1 mL (Parwono 1998). Uji aktivitas dilakukan pada kaolin yang mengandung kation dengan konsentrasi 0.05%. Sumber kation berdasarkan hasil optimasi penelitian Susanti (2007), yaitu AlCl3. Kation ini berfungsi
sebagai koagulan yang dapat menetralkan muatan antarpartikel koloid sehingga masing-masing partikel dapat bergabung membentuk flok. Semakin besar muatan koagulan (semakin positif), semakin efektif proses koagulasi (Sawyer et al. 1994). Flok-flok yang telah terbentuk akan dipercepat pengendapannya melalui penambahan bioflokulan.
Berdasarkan hasil percobaan, diperoleh nilai aktivitas flokulasi isolat KH-3 dari masing-masing variasi media, yaitu 70.58% (media 1), 59.94% (media 2), 39.36% (media 3), dan 46.87% (media 4) (Tabel 3). Media
pertama menunjukkan nilai aktivitas flokulasi tertinggi. Nilai ini berbanding lurus dengan nilai OD setelah produksi 70 jam (awal fase stasioner). Pertumbuhan mikroorganisme yang tinggi pada media pertama didukung oleh tingkat produksi bioflokulan yang maksimum. Peningkatan aktivitas pertumbuhan (ditunjukkan oleh nilai OD) dapat pula dikatakan berbanding lurus dengan peningkatan produksi bioflokulan (ditunjukkan oleh nilai aktivitas flokulasi). Peningkatan aktivitas flokulasi juga sebanding dengan peningkatan waktu kultivasi (Jie et al.
2006). Semakin banyak bioflokulan yang diproduksi, semakin tinggi aktivitas flokulasi. Dengan demikian, media pertama dengan sumber karbon glukosa dan sukrosa 1% merupakan media yang optimal, baik untuk pertumbuhan isolat KH-3 maupun produksi bioflokulan.
Kemampuan isolat KH-3 dalam memflokulasi dapat dilihat pada Gambar 4. Pada menit ke lima, aktivitas flokulasi sampel menunjukkan perbedaan jika dibandingkan dengan kontrol. Flok-flok yang terbentuk ini merupakan ikatan antara bioflokulan dengan AlCl3 0.05% dalam mengikat padatan koloid
(kaolin). Proses flokulasi menghasilkan partikel dengan ukuran yang jauh lebih besar sehingga dapat mempercepat pengendapan. Semakin besar agregat yang terbentuk, semakin banyak kaolin yang terflokulasi sehingga bobotnya lebih besar. Akibatnya, supernatan tampak lebih jernih dibandingkan kontrol dan hasilnya dapat dilihat ketika diukur absorbansinya pada λ 550 nm. Misalnya, pada Gambar 4(a) yang menunjukkan aktivitas flokulasi dari kultur media 1, pengendapan terjadi lebih cepat karena banyaknya bioflokulan yang berperan dalam aktivitas flokulasi. Semakin banyak partikel kaolin yang teradsorpsi pada permukaan bioflokulan, semakin besar ukuran molekul. Hal inilah yang menyebabkan nilai OD sampel lebih rendah dibandingkan kontrol sehingga nilai aktivitasnya menjadi tinggi.
Tabel 3 Hasil pengukuran aktivitas flokulasi KH-3 Media OD supernatan (λ 550 nm) Aktivitas flokulasi (%) 1 0.423 70.58 2 0.576 59.94 3 0.872 39.36 4 0.764 46.87 Kontrol 1.438 -
10
(a) (b)
(c) (d)
Gambar 4 Aktivitas flokulasi kultur hasil produksi isolat KH-3 dari empat variasi media: (a) media 1, (b) media 2, (c) media 3, dan (d) media 4.
Media produksi tanpa biakan diketahui memiliki aktivitas flokulasi meskipun nilainya lebih rendah daripada aktivitas flokulasi kultur. Walaupun aktivitas flokulasi antara kontrol dengan sampel tidak berbeda jauh (Gambar 5), hasil perhitungan setelah pengukuran OD menunjukkan nilai yang signifikan (Tabel 4). Hal ini menunjukkan ada komponen dalam media produksi yang turut berperan dalam aktivitas flokulasi, seperti NaCl dan MgSO4. Garam-garam ini dapat
berperan sebagai koagulan yang membantu proses flokulasi oleh bioflokulan. Hal ini dikarenakan kation dari garam-garam tersebut (Na+ dan Mg2+) ketika terdisosiasi dalam suspensi mampu mengikat partikel kaolin yang memiliki muatan negatif sehingga terjadi pembentukan flok. Nilai aktivitas flokulasi yang rendah disebabkan oleh kemampuan komponen media hanya terbatas pada pembentukan flok-flok, namun tidak dapat menggabungkan flok tersebut, memperbesar ukuran, dan mempercepat pengendapannya.
Kemampuan bioflokulan dalam aktivitas flokulasi ditunjukkan oleh nilai ∆ aktivitas flokulasi yang terdapat pada Tabel 4. Nilai tersebut diperoleh dari hasil pengurangan nilai aktivitas kultur dengan nilai aktivitas media produksi tanpa biakan. Sebagai contoh, pada media 1 yang memiliki aktivitas kultur sebesar 70.58% dan komponen media berperan sebesar 46.21% dalam aktivitas flokulasi. Hasil pengurangan kedua angka tersebut, yaitu sebesar 24.37% menunjukkan peran bioflokulan dalam aktivitas flokulasi. Berdasarkan hasil percobaan, di antara keempat variasi media, media 1 menunjukkan hasil pengurangan paling tinggi. Hal ini berarti bioflokulan yang diproduksi pada media 1 lebih banyak bila dibandingkan dengan media lainnya. Semakin banyak bioflokulan yang diproduksi, semakin besar perannya dalam aktivitas flokulasi sehingga nilainya makin tinggi. Dengan demikian, dari data-data yang ada menunjukkan kultur bioflokulan dari media 1 memiliki aktivitas flokulasi yang paling tinggi dibandingkan media lain. Peran bioflokulan dalam aktivitas flokulasi dibantu oleh komponen media yang berfungsi sebagai koagulan.
(a) (b)
(c) (d)
Gambar 5 Aktivitas flokulasi media produksi tanpa biakan, dari empat variasi media: (a) media 1, (b) media 2, (c) media 3, dan (d) media 4.
11
Tabel 4 Pengaruh bioflokulan terhadap aktivitas flokulasi Media Aktivitas Flokulasi Kultur (%) Aktivitas Flokulasi Media (%) Δ Aktivitas Flokulasi (%) 1 70.58 46.21 24.37 2 59.94 48.50 11.44 3 39.36 31.87 7.49 4 46.87 26.93 19.94
Bioflokulan Hasil Pengendapan Etanol Kultur bioflokulan hasil produksi dimurnikan melalui tahap sentrifugasi dan pengendapan etanol. Tujuan pemurnian adalah untuk memperoleh bioflokulan murni yang dapat digunakan untuk analisis komposisi selanjutnya.
Sentrifugasi pertama (6000 x g selama 10 menit) bertujuan memisahkan bioflokulan dari sel bakteri. Karena bioflokulan merupakan polimer ekstraseluler, kemungkinan bioflokulan dikeluarkan dari sel ke media. Pengendapan etanol bertujuan memisahkan bioflokulan dari pengotornya, seperti komponen-komponen media. Pemurnian dengan etanol dilakukan dalam kondisi dingin dan secara bertahap untuk memperoleh hasil endapan yang banyak (Gambar 6). Pengadukan dengan magnetic stirrer
dilakukan agar etanol yang ditambahkan dapat tersebar merata dalam larutan. Hasil pengendapan etanol disentrifugasi kembali (12000 x g selama 15 menit) dan dikeringkan hingga diperoleh bioflokulan murni (Gambar 7).
Banyaknya bioflokulan hasil pemurnian (g) dalam 100 mL kultur dinyatakan sebagai
yield. Endapan hasil sentrifugasi kedua yang telah dikeringkan menunjukkan yield 0.23% (kultur 30 mL menghasilkan bioflokulan sebanyak 0.0703 g) dan 0.25% (kultur 100 mL menghasilkan bioflokulan sebanyak 0.2534 g) (Tabel 5). Banyaknya endapan ditentukan oleh banyaknya jumlah mikroorganisme yang tumbuh (nilai OD), jumlah bioflokulan yang diproduksi (nilai aktivitas flokulasi), pelarut organik yang digunakan, dan metode pemurniannya. Keempat faktor tersebut saling mempengaruhi satu sama lain. Walaupun pertumbuhan mikroorganisme dan produksi bioflokulan menunjukkan hasil yang baik, pemilihan pelarut dan metode untuk pemurnian yang tidak tepat akan mempengaruhi jumlah endapan yang diperoleh.
Gambar 6 Pengendapan bioflokulan oleh etanol absolut.
Gambar 7 Bioflokulan murni setelah dikeringkan.
Tabel 5 Data bobot kering bioflokulan hasil pengendapan etanol Volume kultur (mL) Bobot kering bioflokulan (g) Yield (%) 30 0.0703 0.23 100 0.2534 0.25
Bioflokulan murni yang telah melalui tahap sentrifugasi dan pengendapan etanol juga diuji aktivitas flokulasinya. Nilai aktivitasnya lebih rendah bila dibandingkan dengan kultur bioflokulan (Tabel 6). Kemampuannya yang rendah dalam memflokulasi kaolin menyebabkan pengendapan menjadi lebih lambat sehingga antara kontrol dengan sampel tidak terlihat jelas perbedaannya (Gambar 8). Hal ini mungkin disebabkan oleh hilangnya substansi dalam bioflokulan yang dapat berperan dalam aktivitas flokulasi selama pemurnian. Kandungan bioflokulan dan persentase dari komponen utama sangat bergantung pada metode pemurnian (Sheng et al. 2005).
Berdasarkan data-data yang diperoleh, bioflokulan hasil produksi isolat KH-3 telah berhasil dimurnikan melalui pengendapan etanol. Kultur bioflokulan memiliki aktivitas yang lebih tinggi daripada bioflokulan hasil
12
pengendapan etanol. Dengan demikian, untuk pemanfaatan bioflokulan selanjutnya disarankan menggunakan bentuk kulturnya.
Tabel 6 Aktivitas flokulasi bioflokulan hasil pengendapan etanol Larutan OD supernatan λ 550 nm Aktivitas flokulasi (%) Kontrol 1.033 - Sampel 1.014 1.84
Gambar 8 Aktivitas flokulasi bioflokulan hasil pengendapan etanol.
Hasil Analisis Komposisi Bioflokulan Bioflokulan yang telah dimurnikan selanjutnya diuji kelarutannya dalam akuades dan diidentifikasi komposisinya melalui tahapan analisis biokimia. Jenis (komposisi) bioflokulan umumnya tergantung pada komponen dalam media produksi, terutama sumber karbon dan nitrogen yang digunakan. Analisis yang dilakukan meliputi analisis kualitatif dan kuantitatif. Analisis kualitatif diperlukan untuk mengetahui adanya komponen biomolekul dalam bioflokulan sedangkan analisis kuantitatif untuk mengetahui seberapa besar kadar komponen tersebut (dari hasil uji kualitatif) dalam bioflokulan. Analisis kualitatif yang dilakukan, yaitu uji umum untuk karbohidrat dan protein (uji Molisch, uji Ninhidrin, dan uji Biuret) sedangkan analisis kuantitatif meliputi penentuan kadar protein dengan metode Bradford (1976) dan penentuan kadar gula total dengan metode fenol-asam sulfat (Chaplin & Kennedy 1986).
Hasil uji kelarutan menunjukkan bahwa bioflokulan murni larut dalam akuades, namun tidak larut dalam pelarut organik, seperti etanol. Oleh karena itu, kemungkinan bioflokulan mengandung polisakarida atau
protein atau keduanya dalam jumlah yang berbeda. Kelarutan terjadi karena gugus hidroksi dalam bioflokulan memungkinkan terbentuknya ikatan hidrogen dengan molekul air. Ikatan hidrogen yang sangat kuat juga dibentuk oleh molekul-molekul dalam bioflokulan yang sulit diputus oleh pelarut organik, seperti etanol sehingga menyebabkan ketidaklarutan (Dermlim et al. 2006).
Hasil uji Molisch menunjukkan reaksi positif, yang ditandai oleh terbentuknya cincin ungu pada perbatasan kedua cairan (Gambar 9). Hal ini menunjukkan bioflokulan terbukti mengandung karbohidrat (polisakarida). Prinsip uji Molisch, yaitu pembentukan kompleks warna hasil reaksi antara turunan-turunan karbohidrat dalam sampel dengan α -naftol dalam pereaksi Molisch.
Uji Ninhidrin sifatnya umum karena protein yang mengandung sedikitnya satu gugus karboksil dan gugus amino bebas (asam
α-amino) akan bereaksi dengan ninhidrin. Uji ninhidrin menunjukkan hasil reaksi negatif (tidak terbentuk warna). Namun, uji Biuret menunjukkan hasil yang sebaliknya, yang ditandai oleh terbentuknya larutan berwarna biru setelah penambahan CuSO4 0.1%
(Gambar 9). Perbedaan hasil tersebut dikarenakan jumlah protein yang terdapat dalam sampel sangat sedikit. Prinsip uji Biuret, yaitu pembentukan senyawa kompleks Cu2+, gugus karboksil, dan gugus amino dari rantai peptida dalam suasana basa. Uji Biuret dilakukan untuk mengetahui adanya ikatan peptida. Hasil uji kualitatif menunjukkan bahwa pada bioflokulan terdapat polisakarida dan protein. Namun, hasil uji ini perlu diperkuat lagi oleh hasil uji kuantitatif.
Kurva standar uji Bradford dibuat dari larutan standar bovine serum albumin (BSA) dengan konsentrasi 0.1-1.0 mg/mL. Persamaan kurva standar yang diperoleh, yaitu y = 0.431x + 0.1321, R2 = 0.9849. Konsentrasi sampel yang diperoleh dari persamaan kurva standar sebesar 0.099 mg/mL. Nilai ini tidak masuk dalam kisaran konsentrasi standar karena jumlah protein dalam bioflokulan sangat sedikit. Metode Bradford dipilih karena sensitivitasnya tinggi, cepat, dan praktis bila dibandingkan dengan uji Lowry dan Biuret (Alexander & Joan 1932). Prinsip ujinya, yaitu perubahan warna merah menjadi biru karena adanya ikatan antara protein dalam sampel dan Coomasie Brilliant Blue dalam pereaksi Bradford. Kompleks warna ini diukur absorbansinya pada panjang gelombang 595 nm.
13
Kurva standar untuk uji fenol-asam sulfat dibuat dari standar glukosa dengan konsentrasi 0.1-1.0 mg/mL. Persamaan kurva standar yang diperoleh, yaitu y = 1.2418x -0.1737, R2 = 0.9836. Konsentrasi sampel yang diperoleh dari persamaan kurva standar sebesar 0.27-0.43 mg/mL. Metode ini dipilih karena sederhana, cepat, praktis, dan sensitivitasnya tinggi serta dapat diaplikasikan pada berbagai jenis karbohidrat, baik yang sederhana (monosakarida), oligosakarida, polisakarida, maupun turunannya dengan sifat pereduksi ataupun nonpereduksi. Prinsip ujinya, yaitu pemutusan ikatan glikosidik dan pembentukan kompleks warna jingga kemerahan dari hasil reaksi antara karbohidrat dalam sampel dan fenol yang dikatalisis oleh asam sulfat pekat, yang diukur absorbansinya pada panjang gelombang 490 nm (Hodge & Hofreiter 1962). Berdasarkan hasil uji kualitatif dan kuantitatif, bioflokulan diketahui mengandung polisakarida dan protein, dengan kadar polisakarida lebih tinggi daripada protein.
Data komposisi yang diperoleh dari hasil analisis dapat menentukan pemanfaatan bioflokulan selanjutnya. Misalnya, bioflokulan polisakarida dapat digunakan sebagai bioemulsifier dan penjerap logam berat (El Tayeb & Khodair 2007; Kaewchai & Prasertsan 2002). Selain itu, bioflokulan yang mengandung sulfat digunakan dalam bidang farmasi, yaitu sebagai antiviral, antitumor, dan antikoagulan (Okutani 1992). Namun, bioflokulan dari isolat KH-3 ini belum diketahui potensi dalam pemanfaatan selanjutnya dan belum tentu pula dapat diaplikasikan pada bidang yang telah disebutkan di atas. Walaupun jenis bioflokulannya sama, belum tentu dalam pemanfaatannya juga akan memiliki fungsi yang serupa.
(a) (b) (c)
Gambar 9 Uji kualitatif bioflokulan: (a) uji Molisch, (b) uji Ninhidrin, (c) uji Biuret.
SIMPULAN DAN SARAN
Simpulan
Media 1 yang mengandung glukosa 1% dan sukrosa 1% sebagai sumber karbon merupakan media paling optimal bagi pertumbuhan isolat KH-3 dan produksi bioflokulan. Hal ini ditunjukkan dengan tingginya nilai OD dan aktivitas flokulasi. Waktu produksi optimum bioflokulan adalah 70 jam dan aktivitas flokulasi kultur bioflokulan lebih tinggi daripada bioflokulan murni. Oleh karena itu, pemanfaatan bioflokulan selanjutnya dapat menggunakan bentuk kulturnya. Peran bioflokulan dalam aktivitas flokulasi dibantu oleh komponen media produksi. Jenis bioflokulan yang dihasilkan tergantung pada komposisi media produksi yang digunakan, terutama sumber karbon dan nitrogennya. Bioflokulan dari isolat KH-3 mengandung polisakarida (0.43 mg/mL) dan protein (0.09 mg/mL).
Saran
Variasi pelarut organik dalam pemurnian diperlukan untuk membandingkan efektivitas pengendapan dan jumlah bioflokulan murni yang diperoleh. Identifikasi terhadap isolat KH-3 lebih lanjut dapat menggunakan analisis filogenetik berdasarkan sekuens 16S-rRNA. Uji lanjutan diperlukan untuk mengetahui potensi pemanfaatannya dalam bidang industri.
DAFTAR PUSTAKA
Achyani. 1999. Pengaruh dosis bioflokulan bakteri Alcaligenes latus dan alum Al2SO4 terhadap proses flokulasi
limbah cair pabrik tapioka.[tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Alexander RR, Joan MG. 1932. Basic Biochemical Methods. Ed ke-2. New York: Wiley-Liss.
Benefield DL, Indkinds FJ, Weand LB. 1982.
Process Chemistry for Water and Wastewater Treatment. New Jersey: Prentice Hall.
Bradford MM. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye
14
binding. J Analytical Chemistry
72:248-254.
Broadbent et al. 2003. Biochemistry, genetics, and applications of exopolysaccharide production in Streptococcus thermophilus. J Dairy Sci 86:407-323.
Butterfield CT. 1935. Studies of sewage purification Zoogloea-forming bacterium isolated from activated sludge. Public Health Rep 50:671-681.
Chaplin MF, Kennedy JF. 1986.
Carbohydrate Analysis: A Practical Approach. Washington: IRL.
Dermlim W, Prasertsan P, Doelle H, Kennedy JF. 2006. Screening, characterization, and flocculating property of carbohydrate polymer from newly isolated Enterobacter cloacae WD7. J Carbohydrate Polymers 66:289-297.
El Tayeb TS, Khodair TA. 2007. Production and purification of a bioemulsifier and flocculating agent produced by
Pseudomonas sp UBF2. J Applied Sciences Research 3(11):1564-1570.
Farrah SR, Richard FU. 1976. Isolation of exocellular polymer from Zoogloea
strain MP6 and 106 and from activated sludge. Appl Environ Microbiol 32:33-37.
Hass et al. 1999. Flocculation of fine fluorite particles with Corynebacterium xerosis.Microbiol Lett 30:225-233.
Hodge JE, Hofreiter BT. 1962. Determination of reducing sugar and carbohydrates. J Food Chem 1:380-394.
Jie et al. 2006. Characterization of bioflocculant from a newly isolated
Vagococcus sp W31. J Zhejiang Univ Science B 7:186-192.
Kaewchai S, Prasertsan P. 2002. Biosorption of heavy metal by thermotolerant polymer producing bacterial cells and the bioflocculant. J Sci Technol 24(3):421-430.
Kennedy J, Marion P, David T, Marisa. 1994.
Recovery of Protein from Whey Using
Chitosan as A Coagulant. New York: Plenum Publishing.
Kowall et al. 1989. Aluminium-induced neurofibrillary degeneration affects a subset of neurons in rabbit cerebral cortex, basal forebrain, and upper brain stem. Neuroscience 29:329-337.
Kurane R, Takeda K, Tomo S. 1986. Screening and characteristic of microbial flocculants. Agric Biol Chem
50:2301-2307.
Kurane R, Hatamochi K, Kakuno T. 1994. Purification and characterization of lipid bioflocculant produced by
Rhodococcus erythropolis. Bioscience Biotechnol Biochem 58:1977-1982.
Lachhwani P. 2005. Studies on polymeric
bioflocculant producing
microorganisms.[tesis]. Patiala: Thapar Institute of Engineering and Technology.
Lee SH, Lee SO, Jang KL, Lee TH. 1995. Microbial flocculant from
Arcuadendron sp TS-49. Biotechnol Lett 17:95-100.
Lu et al. 2005. A novel bioflocculant produced by Enterobacter aerogenes
and its use in defecating the trona suspension. JBiochemical Engineering
27:1-7.
Master et al. 1985. Neuronal origin of a cerebral amyloid: neurofibrillary tangles of Alzheimer’s disease contain the same protein as the amyloid of plaque cores and blood vessels. EMBO Journal 4:2757-2763.
Nakamura J, Miyashiro S, Hirose Y. 1976. Screening, isolation and some properties of microbial cell flocculants.
Agric Biol Chem 40:377-383.
Nohata Y, Kurane R. 1994. Culture condition for production and purification of bioabsorbent from Alcaligenes latus B-16. J Fermentation Bioengineering
77(4):390-393.
Okutani K. 1992. Antiviral activities of sulfated derivatives of a fucosamine containing polysaccharide of marine