BAB 3 METODE PENELITIAN 3.1 Alat-Alat - Hotplate Gallenkamp - Blender Philiphs - Oven Memmert
- Neraca analitis Shimadzu
- Gelas beaker Pyrex
- Gelas ukur Pyrex
- Gelas Erlenmeyer Pyrex
- Termometer France
- Alat Spektrofotometer FT-IR Shimadzu - Alat SEM (Scanning Electron Microscope) JSM-6360 - Alat Uji Tarik ASTM D638 Gotech - Jangka Sorong - Plat Akrilik - Spatula - Pipet Tetes - Ayakan - Botol Reagen - Botol Aquades - Magnetik Stirer
- Pipet Volumetrik Pyrex
- Inkubator - Cawan petri - Tabung reaksi - Rak tabung - Cawan porselen - Desikator - Alat soklet - Buret - Labu khedjal - Tanur - Kaca arloji - Plastik 3.2 Bahan
- Biji Buah Nangka
- Kitosan % DD 90,2%
- Tepung Tapioka Sanghee
- Gliserin p.a (E-Merk)
- CH3COOH(aq) p.a (E-Merk)
- Aquadest(l)
- H2SO4 (p) p.a (E-Merk)
- Selenium p.a (E-Merk)
- N-Heksan p.a (E-Merk)
- NaOH(aq) p.a (E-Merk)
- HCl(l) p.a (E-Merk)
- Escherichia coli - Staphylococcus aureus - Nutrien agar (NA)
- Mueller Hinton Agar (MHA) - Larutan standar McFarland - Plate Count Agar (PCA)
3.3 Prosedur Penelitian 3.3.1 Pengambilan Sampel
Sampel berupa biji buah nangka yang diperoleh dari pajak gambir tembung. Biji buah nangka memiliki nama latin (Artocarpus heterophyllus)
3.3.2 Pembuatan Larutan Pereaksi
3.3.2.1 Pembuatan Larutan CH3COOH 1% (w/v)
Dipipet 1 ml larutan CH3COOH(aq) kemudian dimasukkan kedalam labu takar 100 ml. Diencerkan dengan akuades hingga garis batas.
3.3.2.2 Pembuatan Larutan Kitosan2% (w/v)
Ditimbang 1 g kitosan kemudian dimasukkan ke dalam gelas beaker.Ditambahkan 50 ml larutan CH3COOH 1% (V/V). Didiamkan selama ± 1 jam hingga seluruh kitosan larut.
3.3.3 Cara Kerja
3.3.3.1 Preparasi Sampel
Buah nangka dikupas kemudian dipisahkan daging dengan biji.Lalu biji nangka di cuci bersih.Kemudian biji dipotong tipis-tipis, lalu di jemur selama 2 hari pada panas matahari, setelah kering dimasukkan didalam blender.Setelah halus diperas, lalu hasil perasan di saring dengan saringan. Kemudian hasil saringan di diamkan hingga 12 jam untuk mengendapkan pati yang terbentuk, kemudian filtrat dan endapan di pisahkan pelan-pelan. Kemudian endapan pati dikeringkan dengan oven mengunakan suhu ± 70º C sampai 10 jam.Setelah kering diayak pati menggunakan ayakan 200 mesh.Didapat hasil pati biji nangka.
3.3.3.2Pembuatan Edible Film
Pembuatan edible film pati biji nangka ini mengacu pada penelitian pembuatan edible film dari komposit karaginan, tepung tapioka dan lilin lebah yang dilakukan oleh (Irianto dkk., 2006). Dalam beker gelas di buat campuran antara pati biji nangka dan agar-agar (pektin) dengan berbagai variasi berat dalam 100 ml aquades, campuran tersebut dipanaskan menggunakan pemanas sampai mendidih yang dilengkapi pengaduk, setelah itu pemanas dimatikan, tambahkan gliserol 1 ml, kemudian pemanas dinyalakan kembali yang di lengkapi pengaduk sampai suhu 50º Celsius, kemudian tambahkan pati tapioka 1,5 gram sampai suhu 60º Celsius sambil terus diaduk menggunakan pengaduk, terbentuklah larutan edible film, kemudian di cetak dengan menggunakan cetakan plastik , setelah itu di keringkan ke dalam oven pada suhu 60ºC selama 24 jam, terbentuklah edible film. Kemudian edible film dilepaskan dari dalam cetakan.dilakukan uji karakterisasi.
Sebanyak 2 gram tepung tapioka dimasukkan kedalam gelas beaker yang telah diisi dengan 90 ml akuades. Ditambahkan 0,5 gram pati biji nangka sambil diaduk dan dipanaskan di atas hotplate pada suhu ± 650C hingga mengental. Ditambahkan kitosan 2% (w/v).Kemudian ditambahkan 1 ml gliserin.Diaduk hingga homogen dan dibiarkan mengental. Campuran dituang di plat akrilik dan diratakan. Dikeringkan didalam oven pada suhu ± 300C selama ± 2 hari. Dilakukan prosedur yang sama untuk sampel pati biji nangka dengan variasi 1 gram; 1,5 gram; 2 gram; 2,5 gram.
3.3.4 Pengukuran Ketebalan Edible Film
Edible film yang diperoleh dipotong dengan ukuran 10 cm x 10 cm, kemudian dilakukan pengukuran dengan menggunakan jangka sorong sebanyak dari lima sisi, yaitu sudut sisi kiri atas, sudut sisi kanan atas, sudut sisi kiri bawah, sudut sisi kanan bawah dan tengah. Kemudian, dicari rata-rata dari ketebalan tersebut.
3.3.5 Pengukuran Kuat Tarik dan Kemuluran
Kekuatan tarik adalah salah satu sifat dasar dari bahan polimer yang terpenting dan sering digunakan untuk karakteristik suatu bahan polimer.Kekuatan tarik suatu bahan didefinisikan sebagai besarnya beban maksimum (Fmax) yang digunakan untuk memutuskan spesimennya bahan dibagi dengan luas penampang awal (A0).
Perhitungan Uji Kuat Tarik :
Kekuatan tarik(σ) = Fmaks 𝐴𝐴𝑜𝑜 =
𝐿𝐿𝑜𝑜𝑚𝑚𝐿𝐿 𝐴𝐴𝑜𝑜 Keterangan : Load = Tegangan (KgF) Ao = Luas specimen (mm2)
σ = Kekuatan tarik bahan (KgF/mm2)
Bila suatu bahan dikenakan beban tarik yang disebut tegangan, maka bahan akan mengalami regangan. Kurva tegangan terhadap regangan merupakan karakteristik dari sifat mekanik suatu bahan.
Spesimen yang digunakan untuk uji kekuatan tarik berdasarkan ASTM D 638 seperti terlihat pada gambar 3.2.rangkaian alat uji tarik diset sesuai dengan yang diperlukan. Kecepatan tarik 100 mm/menit dan beban maksimum 100 kgf.Sampel yang sudah berbentuk dumbbell dijepitkan pada alat uji tarik, kemudian alat dijalankan dan didata yang dihasilkan diamati pada monitor.
Disamping uji sifat mekanik kekuatan tarik (σ), juga diamati kemuluran (ԑ) yang didefinisikan sebagai perubahan panjang specimen (I0) dengan perubahan panjang specimen setelah diberi beban (It) maupun terhadap regangan (stroke).
Kemuluran(ԑ) =
𝑆𝑆𝑡𝑡𝑆𝑆𝑜𝑜𝑚𝑚𝑆𝑆
𝐼𝐼0 x 100%
Keterangan: ԑ = kemuluran (%)
Stoke = Regangan (mm/menit)
I0= Panjang specimen mula-mula (mm)
It = Panjang specimen setelah diberi beban (mm)
3.3.6 Analisa SEM ( Scanning Electron Microscope)
Analisa SEM (Scanning Electron Microscope) merupakan pemeriksaan dan analisa permukaan serta mempelajari sifat morfologi sampel.Dalam hal ini, dilihat dari permukaan edible film hasil campuran tepung tapioca dengan kitosan, ekstrak buah naga merah, dan gliserin berdasarkan sifat mekanik edible film yang optimal.
3.3.7 Analisa FT-IR (Fourier Transform Infra Red)
Analisa FT-IR (Fourier Transform Infra Red) merupakan analisa terhadap interaksi senyawa-senyawa yang terkandung dalam edible film berupa uluran atau lekukan gugus fungsi yang ditampilkan dalam bentuk spectrum gelombang.Dalam hal ini, dilihat dari spectrum interaksi gugus fungsi dari edible film hasil campuran tepung tapioca dengan kitosan, ekstrak buah naga merah, dan gliserin berdasarkan sifat mekanik edible film yang optimal.
3.3.8 Penentuan Kadar Nutrisi 3.3.8.1 Penentuan Kadar Air
Edible film dari ekstrak buah naga merah ditimbang sebanyak 1-2 g dalam cawan yang telah diketahui beratnya.Dikeringkan di dalam oven pada suhu 1050 C
selama 3 jam.Didinginkan di dalam desikator.Kemudian ditimbang hingga diperoleh bobot tetap.
Kadar air = 𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃
𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃
x
100 %
3.3.8.2 Penentuan Kadar Abu
Edible film ditimbang sebanyak 2 g dalam sebuah cawan porselen yang telah diketahui beratnya.Dikeringkan di dalam oven.Diabukan di dalam tanur pengabuan pada suhu maksimum 6000 C selama 3 jam.Didinginkan dalam desikator.Kemudian ditimbang hingga diperoleh bobot tetap.
𝐾𝐾𝑚𝑚𝐿𝐿𝑚𝑚𝑆𝑆𝑚𝑚𝐾𝐾𝐾𝐾 =𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃 𝑥𝑥 100 %𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃𝒃
3.3.8.3 Penentuan Kadar Lemak
Edible film ditimbang sebanyak 2 g, dimasukkan kedalam selongsong kertas yang dialasi dengan kertas.Dikeringkan dalam oven pada suhu tidak lebih dari 800 C selama lebih kurang 1 jam.Kemudian dimasukkan kedalam alat soklet yang telah dihubungkan dengan labu alas yang telah berisi batu didih. Diekstraksi dengan heksan atau pelarut lemak lainnya selama lebih kurang 6 jam.Disuling heksan dan dikeringkan ekstrak lemak dalam oven pada suhu 1050 C. Dinginkan dan timbang hingga bobot tetap.
3.3.8.4 Penentuan kadar protein
Edible film ditimbang sebanyak 2 g dan dimasukkan kedalam labu kjeldhal 100 ml. tambahkan 2 g selenium dan 25 ml H2SO4(p). dipanaskan di atas pemanas listrik atau api pembakar sampai mendidih dan larutan menjadi jernih kehijau-hijauan (sekitar 2 jam). dibiarkan dingin, kemudian dimasukkan kedalam labu ukur 100 ml dan diencerkan dengan aquades hingga garis tanda. Dipipet 50 ml NaOH(aq) 40 % dan 1-2 tetes indikator campuran. disuling selama lebih kurang 10 menit. ditampung NH3(g) di dalam gelas Erlenmeyer yang berisi 10 ml larutan borat 2 % yang telah dicampur indikator. Bilas ujung pendingin dengan aquadest.Titrasi dengan larutan HCl 0,1 N.
𝑚𝑚𝑚𝑚𝐿𝐿𝑚𝑚𝑆𝑆𝑘𝑘𝑆𝑆𝑜𝑜𝑡𝑡𝑆𝑆𝑘𝑘𝑘𝑘 =(𝑽𝑽𝟏𝟏 − 𝑽𝑽𝟐𝟐) × 𝑵𝑵 × 𝟎𝟎. 𝟎𝟎𝟏𝟏𝟎𝟎 × 𝒇𝒇. 𝒃𝒃 × 𝒇𝒇. 𝒃𝒃𝑾𝑾 × 100 %
3.3.8.5 Penentuan kadar karbohidrat (by difference)
Penentuan karbohidrat (termasuk kadar serat) secara by difference dihitung sebagai 100 % dikurangi kadar air, abu, protein, dan lemak(Winarno F.G., 1992).
𝑚𝑚𝑚𝑚𝐿𝐿𝑚𝑚𝑆𝑆𝑚𝑚𝑚𝑚𝑆𝑆𝐾𝐾𝑜𝑜ℎ𝑘𝑘𝐿𝐿𝑆𝑆𝑚𝑚𝑡𝑡 = 100 % − % (𝑘𝑘𝑆𝑆𝑜𝑜𝑡𝑡𝑆𝑆𝑘𝑘𝑘𝑘 + 𝑘𝑘𝑆𝑆𝑚𝑚𝑚𝑚𝑚𝑚 + 𝑚𝑚𝐾𝐾𝐾𝐾 + 𝑚𝑚𝑘𝑘𝑆𝑆)
3.3.9 Uji Aktivitas Antibakteri
3.3.9.1 Uji Aktivitas dengan Metode Kirby Bauer
Dituang media MHA (Mueller Hinton Agar) steril kedalam cawan petri secara aseptis dan biarkan hingga memadat. Dibuat suspensi bakteri uji dengan cara mengambil biakkan bakteri tersebut untuk selanjutnya dihomogenkan kedalam 10 mL garam fisiologis (0,9 %). Konsentrasi bakteri uji selanjutnya disamakan dengan konsentrasi larutan McFarland (108 CFU/mL). Suspensi bakteri uji tersebut selanjutnya diinokulasikan dengan cara menggoresnya menggunakan
cotton bud steril hingga merata pada media MHA yang telah memadat. Dimasukkan potongan edible film kedalam media uji untuk selanjutnya diinkubasi pada suhu 34 oC.Diamati dan diukur hasil uji antimikroba yang dihasilkan edible film dimulai dari hari pertama, ketiga dan kelima setelah masa inkubasi.
3.3.9.2 Uji Aktivitas dengan Metode Total Plate Count
Disiapkan 5 buah tabung reaksi yang masing-masing berisi 9 mL akuades steril.Selanjutnya ditimbang sebanyak 1 g sampel uji untuk dimasukkan kedalam tabung reaksi pertama. Dari hasil homogenisasi antara 9 mL akuadest steril dengan 1 g sampel uji diperoleh faktor pengenceran dengan konsetrasi 10-1. Dari hasil pengenceran 10-1 diambil sebanyak 1 mL untuk dimasukkan kedalam tabung ke 2. Hasill homogenisasi pada tabung ke dua akan memperoleh faktor pengenceran dengan konsentrasi 10-2 begitu seterusnya hingga diperoleh faktor pengenceran 10-5. Diambil masing-masing sebanyak 0,1 mL dari pengenceran 10-4 dan 10-5 untuk diinokulasikan kedalam 2 cawan petri yang berbeda. Dituangkan media PCA (Plate Count Agar) pada kisaran suhu ±36 oC kedalam cawan petri yang telah berisi 0,1 mL larutan dari hasil faktor pengenceran 10-4 dan 10-5. Diinkubasi hasil TPC dengan metode cawan tuang tersebut pada suhu 34 oC selama 1 x 24 jam.Dihitung jumlah koloni yang tumbuh setelah masa inkubasi.
3.4 Bagan Penelitian 3.4.1 Preparasi Sampel
Dikupas Dibersihkan Diiris tipis-tipis
Di jemur selama 2 hari dengan sinar matahari
Diblender
Dikeringkan dengan oven pada suhu ±70ºC selama 10 jam
Di ayak dengan ayakan 200 mesh
Biji Buah Nangka
Hasil di iris kecil-kecil
Diperas dengan kain saring
Ampas Filtrat
3.4.2 Pembuatan Edible Film
Ditimbang sebanyak 2 g
Dimasukkan ke dalam gelas beaker Ditambahkan 90 ml akuades
Ditambahkan 0,5 gram pati biji nangka
Dipanaskan diatas hotplate (± 65oC) Ditambahkan larutan kitosan 2% Ditambahkan 1 ml gliserin
Diaduk hingga homogen dan mengental
Dituang di plat akrilik dan diratakan Dikeringkan didalam oven (± 30oC) selama 2 hari
Dilakukan perlakuan yang sama untuk variable pati biji nagka 1 gram; 1,5 gram; 2 gram; 2,5 gram
Tepung Tapioka
3.4.3 Karakterisasi dan Pengujian Edible Film
Edible Film
Uji Fisik Uji Nutrisi
Pengukuran
Ketebalan Kadar Air
Kuat Tarik dan Kemuluran
Kadar Abu
Uji FT-IR Kadar Protein
Uji SEM Kadar Lemak
Uji aktivitas Antibakteri
Metode Kirby Bauer
Metode Standart Plate Count
3.4.4 Uji Kadar Nutrisi 3.4.4.1 Penentuan Kadar Abu
Dimasukkan kedalam cawan porselen yang telah diketahui
beratnya
Dipanaskan dalam tanur pada suhu 6000C selama 3 jam hingga diperoleh abu berwarna keputih-putihan
Didinginkan dalam desikator Ditimbang
Diulangi sampai diperoleh berat konstan Dihitung kadar abunya
2 g edible film
Abu
Hasil
3.4.4.2 Penentuan Kadar Air
Dimasukkan kedalam cawan porselen yang telah diketahui berat Dikeringkan dalam oven pada suhu 1050C selama 3 jam
Didinginkan di dalam desikator selama 20 menit Ditimbang berat sampel kering
Diulangi sampai berat konstan Dihitung kadar airnya
3.4.4.3 Penentuan Kadar Protein
Dimasukkan kedalam labu kjeldhal 100 ml
Ditambahkan 2 g campuran selenium dan 25 ml H2SO4 Dipanaskan diatas pemanas listrik atau api pembakar sampai mendidih dan larutan menjadi jernih kehijauan
Ditunggu Sampai
larutan dingin Dimasukkan kedalam labu ukur 100 ml dan diencerkan dengan aquadest
Dipipet 5 ml larutan yang telah diencerkan dan dimasukkan ke dalam alat destilasi
Ditambahkan 5 ml NaOH(aq) 30% Didestilasi selama lebih kurang 10 menit Ditampung destilat di dalam 10 ml larutan asam borat 2% yang telah dicampur dengan indikator
Dibilas ujung pendingin dengan aquadest Dititrasi dengan larutan HCL(aq) 0,1 N
Dihitung % N
2 g edible film
Larutan jernih kehijau-hijauan
Destilat dalam asam borat 2%
3.4.4.4Penentuan Kadar Lemak
Dimasukkan ke dalam gelas beaker
Ditambahkan 30 ml HCL(aq) 25% dan 20 ml aquadest serta beberapa butir batu didih
Ditutup gelas beaker dengan kaca arloji dan didihkan selama 15 menit Disaring dalam keadaan panas dan cuci dengan aquadest panas hingga tidak bereaksi asam lagi
Dikeringkan kertas saring berikut isinya pada suhu
100-1050 C
Dibungkus dengan paper thimbal Dimasukkan ke dalam alat soxlet
Diekstraksi dengan larutan heksana selama 2-3 jam pada
suhu 800C
Didestilasi larutan heksana dari ekstrak lemak pada suhu 100-1050C
Didinginkan di dalam desikator
Ditimbang sampai berat konstan Dihitung kadar lemaknya
2 g edible film
Lemak
3.4.5 Pengujian Aktivitas Antibakteri Edible Film
3.4.5.1 Uji Aktivitas Antibakteri Edible Film dengan Metode Kirby Beuer
Biakan bakteri Escherichia coli dan Staphylococcus aureus
disuspensikan dalam aquadest steril di homogenkan dengan vortex dibandingkan dengan kekeruhan
Suspensi bakteri
di encerkan dengan aquadest steril sampai kekeruhan 106 CFU/ml
Suspensi bakteri
di inokulasi di atas media MHA
Media MHA
di inokulasi di atas media MHA
Cakram edible film Media MHA
di letakkan cakram edible film diatas media MHA di inkubasi secara terbalik dalam inkubator pada suhu 32-34oC selama 24 jam
di ukur diameter zona antibakteri
3.4.5.2 Aktivitas Antibakteri Edible Film dengan Metode Standart Plate Count (SPC) pada Dodol
Dodol
dibungkus dengan edible film dan dodol yang tanpa pembungkus sebagai kontrol diletakkan pada suhu kamar
dipotong seberat 1 g
dihaluskan dan dimasukkan dalam tabung reaksi ditambah akuades steril sebanyak 9 ml
Kultur awal pengenceran 10-1
diencerkan hingga 10-5
dimasukkan 0,1 ml ke dalam media PCA padat didalam cawan petri diratakan dengan hockey stick
Media PCA dan kultur
diinkubasi pada suhu 32-34oC selama 24 jam
dihitung isolat bakteri pada selang waktu 1, 2, dan 3 hari
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
Dari hasil penelitian pembuatan dan uji aktivitas edible film dari pati biji nangka (Artocarpus heterophyllus) dengan penambahan tepung tapioka,kitosan dan gliserin sebagai pemlastis yang telah dilakukan, diperoleh karakteristik dan kandungan nutrisi edible film sebagai berikut :
Tabel 4.1 Hasil Analisa Karakteritik Edible film dari Tepung Tapiokadengan Penambahan Pati Biji Nangka (Artocarpus heterophyllus) Kitosan dan Gliserin Sebagai Pemlastis
No . Parameter Penambahan Pati Biji Nangka 2 gram
1. Kuat tarik 0,322 KgF/mm2
2. Ketebalan 0,16 mm
3. Kemuluran 11 %
Tabel 4.2 Hasil Analisa Kandungan Nutrisi Edible film dari Tepung Tapiokadengan Penambahan Pati Biji Nangka (Artocarpus heterophyllus) Kitosan dan Gliserin Sebagai Pemlastis
No . Parameter Penambahan Pati Biji Nangka 2 gram
4.1.1 Hasil Analisa Kuat Tarik Edible film dari Tepung Tapiokadengan Penambahan Pati Biji Nangka (Artocarpus heterophyllus) Kitosan dan Gliserin Sebagai Pemlastis
Penentuan kuat tarik Edible film dari 2 grampati biji nangka (Artocarpus heterophyllus) dengan penambahan tepung tapioka kitosan dan gliserin dapat dihitung sebagai berikut :
Kuat Tarik = A o L o a A o F m a k s = Kemuluran = lo Stroke Dimana: Load : 0,31 KgF Stroke : 12,903 mm/menit
Panjang sampel mula-mula (lo) : 110 mm
Lebar sampel : 6,0 mm
Tebal sampel : 0,16 mm
Ao = Lebar sampel x Tebal sampel = 6,0 mm x 0,16 mm = 0,96 mm2 Kuat Tarik = 96 , 0 31 , 0 = 0,322 KgF/mm2 = 3,22 Mpa
Kemuluran = lo stroke = 110 903 , 12 = 11 %
4.1.2 Hasil Analisa Kadar Air Edible film dari Tepung Tapiokadengan Penambahan Pati Biji Nangka (Artocarpus heterophyllus) Kitosan dan Gliserin Sebagai Pemlastis
Penentuan kadar air Edible film dari 2 grampati biji nangka (Artocarpus heterophyllus) dengan penambahan tepung tapioka kitosan dan gliserin dapat dihitung sebagai berikut :
Kadar Air = 100% basah sampel Berat n pengeringa selama hilang yang uap Berat × Dimana :
Berat cawan kosong : 74,3660 g
Berat Edible Film basah : 2,0017 g
Berat cawan + berat sampel edible film basah : 76,3677 g Berat cawan + berat sampel edible film setelah kering : 76,2051 g
Berat uap air yang hilang = (Berat cawan + Berat edible film dari ekstrak kulit manggis) – (Berat cawan + Berat sampel setelah pengeringan)
Kadar air = 100% 2
0,1626 ×
= 8,13 %
4.1.3 Hasil Analisa Kadar Abu Edible film dari Tepung Tapiokadengan Penambahan Pati Biji Nangka (Artocarpus heterophyllus) Kitosan dan Gliserin Sebagai Pemlastis
Penentuan kadar abu edible filmdari 2 grampati biji nangka (Artocarpus heterophyllus) dengan penambahan tepung tapioka kitosan dan gliserin dapat dihitung sebagai berikut :
Kadar abu = 2− 1×100% Mo M M Dimana : Mo : Berat Sampel (g)
M1 : Berat Crusible Kosong (g) M2 : Berat Crusible + Abu (g)
Berat Sampel (Mo) : 2 g Berat Crusible Kosong (M1) : 17,6654 g Berat Crusible + Abu (M2) : 17,5182 g
Kadar Abu = 100% 2 17,5182 -17,6654 × = 7,36 %
4.1.4 Hasil Analisa Kadar Protein Edible film dari Tepung Tapiokadengan Penambahan Pati Biji Nangka (Artocarpus heterophyllus) Kitosan dan Gliserin Sebagai Pemlastis
Penentuan kadar proteinEdible film dari 2 grampati biji nangka (Artocarpus heterophyllus) dengan penambahan tepung tapioka kitosan dan gliserin dapat dihitung sebagai berikut :
%P = . 14,008 . . 100% 1000 Vb Vs px kxf xf HClx N Wx × − Keterangan : %P : Persentase/kadar protein f.p : Faktor Pengali protein f.k : Faktor konfersi
Vs : Volume sampel setelah dititrasi Vb : Volume blanko N.HCl : Normalitas HCl W : Berat sampel Dimana : Vs : 5 mL Vb : 0,1 mL W : 2 g NHCl : 0,1 N
%P = 100% 50 100 25 , 6 008 , 14 1 , 0 1000 2 1 , 0 5 x x x x × − = 17,51 100% 2000 9 , 14 x × = 4,29 %
4.1.5 Hasil Analisa Kadar Lemak Edible film dari Tepung Tapiokadengan Penambahan Pati Biji Nangka (Artocarpus heterophyllus) Kitosan dan Gliserin Sebagai Pemlastis
Penentuan kadar Edible film dari 2 grampati biji nangka (Artocarpus heterophyllus) dengan penambahan tepung tapioka kitosan dan gliserin dapat dihitung sebagai berikut :
Kadar lemak = 1− 2×100% W W W Keterangan : W = Berat sampel
W1 = Berat sampel + labu setelah ekstraksi W2 = Berat labu kosong
Berat Sampel : 2 g
Berat Sampel + labu setelah ekstraksi : 137,7476g
Berat Labu kosong : 137,6166 g
Kadar Lemak = 100% 2 137,6166 137,7476 × − = 6,55%
4.1.6 Hasil Analisa Kadar Karbohidrat Edible film dari Tepung Tapiokadengan Penambahan Pati Biji Nangka (Artocarpus heterophyllus) Kitosan dan Gliserin Sebagai Pemlastis (by difference)
Penentuan Kadar KarbohidratEdible film dari 2 grampati biji nangka (Artocarpus heterophyllus) dengan penambahan tepung tapioka kitosan dan gliserin dapat dihitung sebagai berikut :
% Karbohidrat = 100% - (% Protein + % Lemak + % Air + % Abu) % Karbohidrat = 100% - (4,29 %+6,55 %+8,13%+7,36 %)
= 100% - 26,33 % = 73,67 %
4.1.7 Hasil Analisa SEM (Scanning Electron Microscopy)
Hasil pemeriksaan SEM menunjukkan bentuk permukaan dari edible film dari pati biji nangka (Artocarpus heterophyllus) dengan penambahan tepung tapioka, kitosan 2% dan gliserin sebagai plastisizer. Dari karakterisasi uji tarik dan kadar nutrisi menunjukkan hasil terbaik dengan 2 g pati biji nangka dengan penambahan 2 g tepung tapioka, kitosan 2% sebanyak 2 ml dan 1 ml gliserin sebagai plastisizer, sehingga dilakukan uji fisik SEM ( Scanning Electron Microscopy) yang menunjukkan hasil permukaan yang rata serta kompatibel dengan tipe bentuk morfologi yang tidak begitu teratur. Hasil SEM dapat dilihat pada lampiran 2.
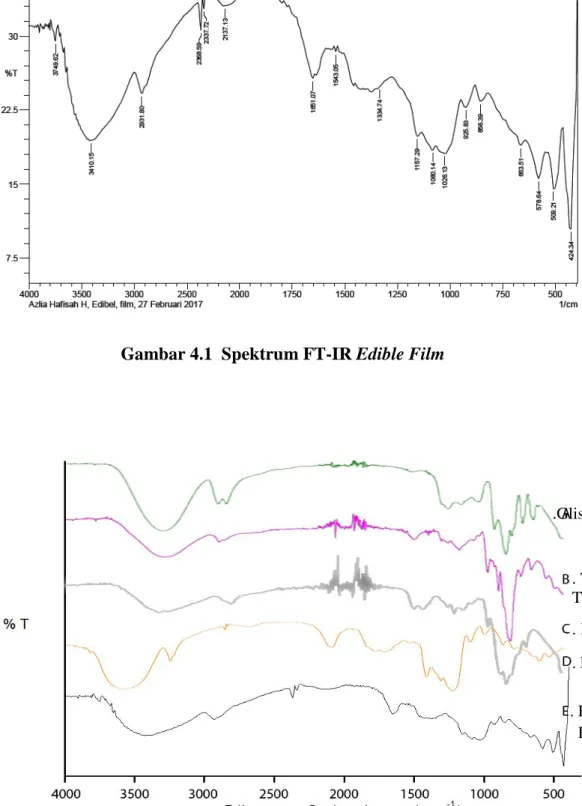
filmdan spektrum FT-IR dari semua senyawa ditunjukan pada Gambar 4.1 dan Gambar 4.2
Gambar 4.1 Spektrum FT-IR Edible Film
Gambar 4.2 Spektrum Senyawa Hasil Penelitian dengan FT-IR
.Gliserin . Tepung Tapioka . Kitosan . Pati . Edible Film
Table 4.3 Interpretasi Gugus Fungsi Senyawa Hasil Analisis FT-IR Gugus Fungsi Frekuensi (cm-1) Hasil Frekuensi (cm-1) Teori
CH 2931,95 (T) 2841-2967 2931,80 (E) 2935,13 (G) 2931,80 (P) OH 3297,98 (T) 3200-3500 3387,00 (P) 3294,29 (G) 3361,17 (K) 3410,15 (E) OH Free 3361,17 (K) 3571-3636
Keterangan: T = Tepung tapioka ;P = Pati ; G= Gliserin ; E = Edible ; K = Kitosan
1.1.9 Hasil Uji Aktivitas Antibakteri Edible Film dengan Metode Kirby Bauer
Pada edible film dilakukan uji aktivitas antibakteri dengan menggunakan Metode Kirby Bauer.Aktivitas antibakteri edible film menunjukkan zona hambat pada pertumbuhan beberapa bakteri patogen yaitu Escherichia coli dan Staphylococcus aureus. Hasil uji aktivitas antibakteri dapat dilihat pada table 4.4
Tabel 4.4 Hasil pengukuran diameter zona hambat beberapa kultur bakteri oleh edible film
No Spesies Bakteri Bahan Uji Diameter Zona Hambat (mm)
Indeks
Antimkrobial
1 Escherichia
coli Edible film 1,1 mm 0,83
(Gram negatif)
2 Staphylococcus
aureus Edible film 1,2 mm 1
(Gram positif)
1.1.10 Pertumbuhan Koloni Bakteri pada Dodol yang di bungkus Edible Film, Dibungkus Plastik, dan Pembungkus Daun Pinang dengan Metode Standart Plate Count
Dengan menggunakan metode Standard plate count (SPC) pada media plate count agar (PCA), jumlah koloni yang tumbuh pada Dodol yang telah dibungkus edible film dapat dihitung. Penghitungan jumlah koloni dilakukan dengan menggunakan counter pada hari ke 1, 2 dan hari ke 3. Sebagai kontrol penghitungan jumlah koloni juga dilakukan terhadap dodol tanpa pembungkus dan pembungkus daun pinag. Berikut hasil penghitungan jumlah koloni yang tumbuh pada media PCA dapat dilihat pada table 4.5.
Tabel 4.5 Hasil pengamatan pertumbuhan koloni pada dodol yang di bungkus edible film, Pembungkus Plastik dan Pembungkus Daun Pinang
No Pengamatan hari
Jumlah koloni Dodol yang
dibungkus edible film
Dodol dibungkus plastik Dodol dibungkus daun pinang 1 1 0 28 x 104 71 x 104 2 2 5 x 104 43 x 104 106 x 104 3 3 13 x 10 4 61 x 104 183 x 104
4.2 Pembahasan Penelitian 4.2.1 Analisa Kuat Tarik
Kuat tarik dan kemuluran berhubungan dengan sifat kimia film.Pengujian kekuatan tarik dilakukan dengan alat uji tarik terhadap spesimen dengan ketebalan dan ukuran yang sesuai dengan spesimen uji kekuatan tarik. Alat uji tarik terlebih dahulu dikondisikan pada beban 100 kgf dengan kecepatan tarik 5 mm/menit, kemudian spesimen dijepit kuat dengan penjepit dan alat. Lalu mesin dihidupkan dan spesimen akan tertarik ke atas dan diamati sampai putus. Berdasarkan hasil pengukuran kuat tarik, edible film yang dihasilkan dari penelitian dengan variasi penambahan 2 g pati biji nangka, 2g tepung tapioka, kitosan 2% dan 1 ml gliserin, uji tarik yang diperoleh sebesar 0,322 KgF/mm2.
Dari hasil tersebut dapat dilihat bahwa edible film dengan penambahan 2 g pati biji nangka memberikan hasil kuat tarik yang bagus. Hal ini dikarenakan semakin banyak pati biji nangka yang ditambahkan maka gaya interaksi antar matriks molekul yang terdapat dalam edible film semakin kuat, sehingga meningkatkan kekuatan dari edible film yang dihasilkan dan menyebabkan edible film yang dihasilkan lebih kuat dan tidak mudah patah ketika ditarik.
4.2.2 Persen Kemuluran dan Ketebalan
Berdasarkan hasil uji kemuluran, edible film dengan variasi 2 g pati biji nangka, 2 g tepung tapioka, kitosan 2% dan 1 ml gliserin dihasilkan persen kemuluran sebesar 11 %. Dari hasil tersebut dapat dilihat bahwa edible film dengan penambahan 2 g pati biji nangka menghasilkan % kemuluran yang lebih tinggi. Hal ini dikarenakan semakin tinggi kuat tarik dari edible film maka akan semakin
4.2.3 Analisa Kadar Air
Kadar air edible film yang dihasilkan pada variasi 2 g pati biji nangka, 2 g tepung tapioka, kitosan 2%, dan 1 ml gliserin yaitu sebesar 8,13 %.
Kandungan air suatu bahan menentukan penampakan, tekstur, dan kemampuan bahan tersebut terhadap kerusakan yang disebabkan oleh mikroba yang dinyatakan dengan Aw, yaitu jumlah air bebas yang dapat dimanfaatkan oleh mikroba untuk pertumbuhannya. Nilai kadar air yang tinggi akan menyebabkan mudahnya bakteri untuk berkembang biak dan mengakibatkan kontaminasi sehingga akan terjadi perubahan pada bahan pangan dan edible film tidak layak pakai.
4.2.4 Analisa Kadar Abu
Abu adalah zat organik sisa hasil pembakaran suatu bahan organik. Kadar abu ada hubungannya dengan mineral suatu bahan. Kadar abu yang dihasilkan pada edible film yang dihasilkan pada variasi 2 g pati biji nangka, 2 g tepung tapioka, kitosan 2%, dan 1 ml gliserin yaitu sebesar 7,36 %.
Dari hasil penelitian dapat dilihat bahwa pada edible film yang dihasilkan pada variasi 2 g pati biji nangka, 2 g tepung tapioka, kitosan 2%, dan 1 ml gliserin yaitu sebesar 8,13 % yang mengahasilkan kadar abu lebih banyak. Hal ini dikarenakan semakin banyak tepung tapioka yang ditambahkan maka semakin banyak pula kandungan mineral yang dihasilkan.
4.2.5 Analisa Kadar Protein
Kadar protein yang dihasilkan pada edible film yang dihasilkan pada variasi 2 g pati biji nangka, 2 g tepung tapioka, kitosan 2%, dan 1 ml gliserin yaitu sebesar 4,29 %. Kadar protein diperoleh dari kandungan protein yang ada pada tepung tapioka yang ditambahkan kedalam pati biji nangka yang akan dijadikan edible film. Kadar protein ini dapat dipengaruhi oleh suhu, pH, dan kelembaban udara.
Dari hasil yang diperoleh kadar protein dengan variasi 2 g pati biji nangka, 2 g tepung tapioka, kitosan 2%, dan 1 ml gliserin yaitu sebesar 4,29 %. Hal ini dikarenakan kadar protein yang terdapat pada pati biji nangka dan tepung tapioka yang digunakan .
4.2.6 Analisa Kadar Lemak
Kadar lemak yang dihasilkan pada variasi 2 g pati biji nangka, 2 g tepung tapioka, kitosan 2%, dan 1 ml gliserin yaitu sebesar 6,55 %. Hal ini dikarenakan pati biji nangka dan tepung tapioka mengandung lemak sehingga semakin banyak ditambahkan keduanya maka komposisi lemak pada edible film juga semakin banyak pula.
4.2.7 Analisa Kadar Karbohidrat
Kadar karbohidrat yang dihasilkan pada variasi 2 g pati biji nangka, 2 g tepung tapioka, kitosan 2%, dan 1 ml gliserin yaitu sebesar 73,67 %.Kadar karbohidrat yang diperoleh cukup tinggi.Hal ini dikarenakan semakin banyak penambahan pati biji nangka dan tepung tapioka maka semakin banyak kandungan karbohidrat pada edible film yang dihasilkan.
4.2.8 Analisa SEM (Scanning Electron Microscopy)
Hasil SEM dengan perbesaran 2000 kali memperlihatkan permukaan edible film, hasil yang didapatkan dipengaruhi oleh bahan-bahan penyusun dari edible film tercampur secara merata atau tidak, baik matriks, filler maupun
gliserinmemperlihatkan morfologi permukaan dari edible film yang cukup teratur dan compatiblenamun struktur dari edible film masih kelihatan tidak begitu rata. Hal ini disebabkan proses pencampuran yang tidak merata karena filler dari pati biji nangka tidak tercampur sempurna
4.2.9 Analisa FTIR (Fourier Transform Infra Red)
Dari lampiran 3. memberikan spektrum dengan serapan pada daerah 3297,98 cm-1 menunjukkan adanya gugus hidroksil (OH) yang berasal dari unit α-glukosa serta spektrum dengan serapan pada daerah bilangan gelombang 2931,95 cm-1 menunjukkan adanya CH alifatis. Pada lampiran 4. memberikan spektrum dengan serapan pada daerah 3294,29 cm-1 menunjukkan adanya gugus hidroksil (OH) yang berasal dari gliserin serta serapan pada daerah 2935,13 cm-1 menunjukkan adanya CH alifatis. Pada lampiran 5.memberikan spektrum dengan serapan pada daerah 3361,17 cm-1 menunjukkan adanya gugus hidroksil (OH) atau gugus –NH yang berasal dari kitosan. Pada lampiran 6. memberikan spektrum dengan serapan pada daerah 2931,80 cm-1 menunjukkan adanya CH alifatis yang berasal dari pati serta serapan pada daerah 3387,00 cm-1menunjukkan adanya gugus hidroksil (OH). Dan pada lampiran 7. memberikan spektrum dengan serapan pada daerah 2931,80 cm-1 menunjukkan adanya CH alifatis serta spektrum dengan serapan pada daerah 3410,15 cm-1 menunjukkan adanya gugus hidroksil (OH) atau gugus –NH yang berasal dari edible film.Hal ini menunjukkan adanya interaksi antara pati, tepung tapioka, kitosan dan gliserin pada edible film yang dibuat.
4.2.10 Uji Aktivitas Antibakteri Edible Film
4.2.10.1 Uji Aktivitas Antibakteri Edible Film dengan Metode Kirby Bauer Pengujian aktivitas aktibakteri dari edible film dapat dilihat pada tabel 4.4 terhadap bakteri Staphylococcus aureus dan Eschercia coli menunjukkan hasil yang positif, ini ditandai dengan terbentuknya larutan bening disekitar film. Senyawa antimikroba dapat menyebabkan kerusakan sel bakteri dengan beberapa
cara. Secara umum mekanisme kerja antimikroba dalam menghambat mikroba adalah : (1). Bereaksi dengan membran sel, (2) inaktivasi enzim esensial, dan (3) mendetstruksi atau menginaktivasi fungsi materi genetik.
Berdasarkan hasil pengujian diketahuiedible film yang dibuat dengan campuran pati biji nangka, tepung tapioka, kitosa dan gliserin menunjukkan adanya zona hambat.Hal ini disebabkan oleh adanya gugus amina pada kitosan yang mempunyai muatan kationik yang dapat mengikat sumber makanan sehingga bisa menghambat pertumbuhan bakteri.
4.2.10.2 Pertumbuhan Koloni Bakteri pada dodol yang di bungkus Edible Film,Pembungkus Plastik dan Pembungkus Daun Pinang dengan Metode Standart Plate Count
Perhitungan jumlah koloni bakteri diambil dari potongan dodol yang telah dibuat pengenceran 10-1 lalu diinokulasikan pada media PCA. Tabel 4.5 menunjukkan hasil perhitungan jumlah koloni dimana terlihat perbedaan pertumbuhan koloni antara dodol yang dibungkus dengan edible film, dodol yang dibungkus dengan plastik dan dodol yang dibungkus dengan daun pinang. Perlakuan pada sampel dodol yang dibungkus dengan edible film lebih memiliki sedikit pertumbuhan koloni yang terlihat dibandingkan dengan sampel dodol yang dibungkus dengan plastik dan dodolyang dibungkus dengan daun pinang. Sehingga ediblefilmdari dari pati biji nangka ( Arthocapus Heterophyllus ) dengan penambahan tepung tapioka, kitosan, dan gliserin sebagai plastisizer efektif dalam mengurangi pertumbuhan bakteri atau mikroba pada dodol. Sehingga cocok untuk dijadikan bahan pembungkus makanan.
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Berdasarkan hasil penelitian dan pembahasan, maka dapat disimpulkan bahwa edible film yang akan diaplikasikan memiliki :
1. Karakterisasi edible film pati biji nangka (Arthocapus Heterophyllus )yang dihasilkan yaitu memiliki ketebalan 0,16 mm, dengan nilai kuat tarik 0,322 KgF/mm2 dan nilai elongsi sebesar 11 %. Hasil uji SEM (Scanning Electron Microscopy) menghasilkan hasil permukaan yang rata serta kompatibel dengan tipe bentuk morfologi yang tidak begitu teratur. Hasil uji FTIR (Fourier Transform Infrared) menunjukan spektrum edible film pada daerah 2931,80 cm-1 menunjukkan adanya gugus alkana (CH) dan 3410,15 cm-1 menunjukkan adanya gugus hidroksil (OH).
2. Kandungan gizi yang dihasilkan dari edible filmyaitu sebagai berikut : kadar karbohidrat 73,67 %, kadar protein 4,29 %, kadar lemak 6,55%, kadar abu 7,36 % dan kadar air 8,13 %.
3. Hasil uji aktivitas antibakteri edible film menghasilkan uji positif terhadap bakteri Escherichia coli dengan indeks antimikrobial sebesar 0,83 mm dan Staphylococcus aureussebesar 1 mm dan Standart Count Plate pada edible film sebagai pembungkus dodol meghasilkan jumlah koloni yang lebih sedikit dibandingkan dodol dibungkus plastik dan dodol dibungkus daun pinang.
5.2. Saran
Berdasarkan penelitian yang telah dilakukan, diharapkan pada peneliti selanjutnya sebaiknya dilakukan sampel yang lain dan diaplikasikan sebagai pembungkus atau pengemas bahan makanan lainnya agar lebih bervariasi.