DENGAN BERBAGAI CARA PREPARASI:
METODE RADIKAL BEBAS 1,1 DIPHENYL-2-PICRYLHYDRAZIL (DPPH)
SKRIPSI
OLEH : HONDY HARTANTO
6103008026
PROGRAM STUDI TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
UNIVERSITAS KATOLIK WIDYA MANDALA SURABAYA SURABAYA
IDENTIFIKASI POTENSI ANTIOKSIDAN MINUMAN COKELAT DARI KAKAO LINDAK (THEOBROMA CACAO L.)
DENGAN BERBAGAI CARA PREPARASI:
METODE RADIKAL BEBAS 1,1 DIPHENYL-2-PICRYLHYDRAZIL (DPPH)
SKRIPSI
Diajukan Kepada Fakultas Teknologi Pertanian,
Universitas Katolik Widya Mandala Surabaya untuk Memenuhi Sebagian Persyaratan Memperoleh Gelar Sarjana Teknologi Pertanian
Program Studi Teknologi Pangan
OLEH : HONDY HARTANTO
6103008026
PROGRAM STUDI TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
UNIVERSITAS KATOLIK WIDYA MANDALA SURABAYA SURABAYA
i
Minuman Cokelat dari Kakao Lindak (Theobroma cacao L.) dengan Berbagai Cara Preparasi: Metode Radikal Bebas 1,1 Diphenyl-2-Picrylhydrazil (DPPH)”.
Di bawah bimbingan: 1. Prof. Dr. Ir. Y. Marsono, MS.
2. Maria Matoetina Suprijono, SP., M.Si. ABSTRAK
Kakao terbukti merupakan sumber antioksidan. Salah satu produk pemanfaatan kakao adalah minuman berbasis cokelat. Beragam cara preparasi berkembang di masyarakat dalam penyajian minuman cokelat. Tujuan penelitian ini adalah mengetahui potensi antioksidan yang dapat dipertahankan selama proses pembuatan minuman cokelat dari bubuk kakao dengan berbagai cara preparasi serta menentukan cara preparasi yang paling dapat mempertahankan aktivitas antioksidan.
Penelitian ini menggunakan Rancangan Acak Kelompok dengan faktor Cara Preparasi Minuman Cokelat (P) terdiri dari empat perlakuan, yang diulang sebanyak dua kali. Parameter penelitian yaitu aktivitas antioksidan minuman cokelat dalam menangkap radikal bebas DPPH dengan data pendukung yaitu kadar lemak pada bubuk kakao serta total fenol dan total flavonoid pada bubuk kakao dan minuman cokelat. Pengaruh faktor penelitian dianalisa dengan ANAVA pada α= 5% dan apabila hasil uji ANAVA menunjukan adanya pengaruh nyata, maka dilanjutkan dengan DMRT pada α= 5% untuk mengetahui taraf perlakuan yang memberikan perbedaan nyata.
Perbedaan cara preparasi mempengaruhi kadar total fenol, tapi tidak berpengaruh nyata pada kadar total flavonoid minuman cokelat. Pembuatan minuman cokelat dengan pengadukan (P1) memiliki kadar total fenol paling rendah (16 ± 2 mg GAE/g), sedangkan minuman cokelat yang diseduh dengan air mendidih (P2) memiliki kadar total fenol paling tinggi (29 ± 1 mg GAE/g). Perlakuan perebusan hingga mendidih (P3) dan pemanasan dengan microwave (P4) memiliki kadar total fenol yang tidak berbeda nyata, namun lebih tinggi dibandingkan P1, masing-masing adalah 24 ± 3 mg GAE/g dan 21 ± 1 mg GAE/g.
Hasil penelitian menunjukkan aktivitas scavenging minuman cokelat tidak nyata dipengaruhi oleh berbagai cara preparasi. Scavenging
activity minuman cokelat dengan berbagai cara preparasi tidak berbeda
nyata dibandingkan vitamin E (sebagai kontrol). Kadar total fenol dan total flavonoid tidak berhubungan nyata dengan aktivitas scavenging minuman cokelat.
ii
Hondy Hartanto (6103008026). “Identification of Antioxidant Potential in Cacao Lindak (Theobroma cacao L.) Chocolate Beverages by Different Preparation Methods: Free Radicals 1,1-Diphenyl-2-Picrylhydrazil (DPPH) Method”.
Advisory Committee: 1. Prof. Dr. Ir. Y. Marsono, MS.
2. Maria Matoetina Suprijono, SP., M.Si. ABSTRACT
Cacao has proven to be source of antioxidants. One of cacao utilization-products is chocolate beverages. Various preparation methods has been used in the process of making chocolate beverages. Experimental research towards effect of various preparation methods on chocolate beverages antioxidant potential has been done. This research aimed to determine antioxidant potential that could be preserved after the making of chocolate beverages from cocoa powder by different preparation methods, and also choose which preparation method could preserve the most antioxidant activity.
This research used a Randomized Block Design with Various Preparation Method as factor (P), which consisted of four treatments and was repeated two times. Research parameter was chocolate beverages scavenging activity with supportive data, which are cocoa powder fat content, and also total phenol and flavonoid content of cocoa powder and chocolate beverages. The factor’s effects were analyzed with ANOVA on α= 5%, then followed with DMRT on α= 5% to determine which treatment shows significant effect.
All preparation methods affected total phenol content, but they did not affect total flavonoid of chocolate beverages. Chocolate beverage made by dissolving cocoa powder in water (P1) has the lowest total phenol content (16 ± 2 mg GAE/g), while on the other hand, beverage made by dissolving cocoa powder in a boiled water has the highest total phenol content (29 ± 1 mg GAE/g). Beverages made by heated until boiled (P3) and heated in microwave (P4) have common total phenol content, but higher than P1, which are 24 ± 3 mg GAE/g and 21 ± 1 mg GAE/g.
Research result showed that scavenging activity of chocolate beverages did not affected significantly by various preparation methods. Chocolate beverages scavenging activity did not differ significantly towards vitamin E (control). Total phenol and flavanoid content did not correlate significantly on chocolate beverages scavenging activity. Keywords: antioxidant, cacao lindak, DPPH method
iii
Puji syukur kepada Tuhan Yang Maha Esa karena atas berkat, rahmat serta penyertaan-Nya penulis dapat menyelesaikan Makalah Skripsi dengan judul: Identifikasi Potensi Antioksidan Minuman Cokelat dari Kakao Lindak (Theobroma cacao L.) dengan Berbagai Cara Preparasi: Metode Radikal Bebas 1,1 Diphenyl-2-Picrylhydrazil (DPPH). Penyusunan Skripsi ini merupakan salah satu syarat untuk menyelesaikan program Strata 1 (S1) di Program Studi Teknologi Pangan, Fakultas Teknologi Pertanian, Universitas Katolik Widya Mandala Surabaya.
Pada kesempatan ini penulis ingin mengucapkan terima kasih kepada:
1. Prof. Dr. Ir. Y. Marsono, MS. dan Maria Matoetina S., SP., M.Si. selaku dosen pembimbing yang telah membantu memberikan pengarahan, bimbingan, dan semangat dalam menyelesaikan penulisan tugas ini.
2. Dr. Paini Sri Widyawati, S.Si., M.Si. selaku dosen penguji yang telah memberikan pengarahan dan masukan dalam bagi penulisan tugas ini.
3. Para staf Ketua Laboratorium dan Laboran Fakultas Teknologi Pertanian.
4. Pusat Penelitian Kopi dan Kakao Indonesia PTP XII Jember yang telah memberikan dukungan berupa penyediaan bubuk kakao sehingga penelitian dapat dilaksanakan dengan lancar.
Penulis menyadari laporan ini masih jauh dari sempurna maka penulis mengharapkan adanya kritik dan saran dari pembaca. Akhir kata
iv
penulis mengharapkan semoga laporan ini dapat memberikan manfaat bagi pembaca.
Surabaya, September 2012
v
Halaman
ABSTRAK ... i
ABSTRACT ... ii
KATA PENGANTAR ... iii
DAFTAR ISI ... v
DAFTAR GAMBAR ... vii
DAFTAR TABEL ... viii
DAFTAR LAMPIRAN ... ix
BAB I PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Rumusan Masalah ... 4
1.3 Tujuan Penelitian... 4
BAB II TINJAUAN PUSTAKA 2.1 Kakao (Theobroma cacao). ... 5
2.1.1 Senyawa Antioksidan Kakao. ... 6
2.1.2 Proses Pengolahan Biji Kakao... 8
2.2 Antioksidan ... 11
2.2.1 Klasifikasi Senyawa Antioksidan ... 12
2.2.2 Mekanisme Antioksidan ... 14
2.3 Metode Pengujian Aktivitas Antioksidan ... 15
BAB III METODE PENELITIAN 3.1 Bahan Penelitian ... 19
3.2 Alat Penelitian ... 19
3.3 Waktu dan Tempat Penelitian... 20
3.4 Rancangan Penelitian ... 20
3.5 Pelaksanaan Penelitian ... 21
3.5.1 Pembuatan Minuman Cokelat ... 21
3.5.2 Metode Analisa ... 25
BAB IV HASIL DAN PEMBAHASAN 4.1 Pengaruh Pemanasan terhadap Kadar Total Fenol Minuman Cokelat ... 26
vi
4.2 Pengaruh Pemanasan terhadap Kadar Total
Flavonoid Minuman Cokelat ... 29 4.3 Aktivitas Scavenging Metode Penghamabatan
DPPH dari Minuman Cokelat ... 31 4.4 Hubungan Senyawa Fenolik dengan Aktivitas
Antioksidan ... 33 BAB V KESIMPULAN DAN SARAN ... 34 DAFTAR PUSTAKA ... 35
vii
Halaman Gambar 2.1 Struktur Bangun (-)-Epikatekin, (+)-Epikatekin,
(-)-Katekin dan (+)-Katekin. ... 9 Gambar 2.2 Diagram Alir Proses Pengolahan Biji Kakao
menjadi Beberapa Macam Produk Intermediet ... 10 Gambar 2.3 Mekanisme Reaksi Senyawa Antioksidan ... 14 Gambar 2.4 Struktur Molekul DPPH sebelum dan setelah
Menerima Donor Atom H ... 17 Gambar 3.1 Diagram Alir Proses Pembuatan Minuman
Cokelat ... 22 Gambar 4.1 Kadar Total Fenol Minuman Cokelat ... 27 Gambar 4.2 Kadar Total Flavonoid Minuman Cokelat ... 30 Gambar 4.3 Grafik Waktu Vs % Penghambatan DPPH pada
viii DAFTAR TABEL
Halaman Tabel 2.1 Komposisi Kimia Bubuk Kakao Lindak Bebas Lemak ... 6 Tabel 2.2 Jenis-Jenis Klon Kakao Lindak ... 7 Tabel 2.3 Klasifikasi Jenis Antioksidan berdasarkan Struktur
Kimia...13 Tabel 3.1 Desain Rancangan Penelitian ... 20 Tabel 3.2 Formulasi Minuman Cokelat ... 21 Tabel 4.1 Hubungan Senyawa Fenolik dengan Aktivitas
ix
Halaman Lampiran 1 Analisa Kadar Lemak Bubuk Coklat dengan
Metode Soxhlet ... 43 Lampiran 2 Analisa Kadar Total Fenol dengan Metode
Kolorimetri Folin-Ciocalteu ... 45 Lampiran 3 Analisa Kadar Total Flavonoid berdasarkan
Aluminium Klorida Kolorimetri ... 47 Lampiran 4 Analisa Aktivitas Antioksidan dengan
Spektrofotometri Metode Peredaman Warna
DPPH ... 50 Lampiran 5 Data Kadar Lemak Bubuk Cokelat... 52 Lampiran 6 Data Kadar Total Fenol dan Total Flavonoid
Minuman Cokelat ... 53 6.1. Kadar Total Fenol ... 53 6.2. Kadar Total Flavonoid (dihitung sebagai
(+)-(katekin) ... 54 6.3. Kadar Total Flavonoid (dihitung sebagai
(-)-(epikatekin) ... 55 Lampiran 7 Data Aktivitas Antioksidan Minuman Cokelat
1 BAB I PENDAHULUAN
1.1. Latar Belakang
Beragam sumber radikal bebas dapat ditemui dalam kehidupan sehari-hari, seperti asap kendaraan bermotor, asap pabrik, radiasi, makanan, dan juga dari hasil proses oksidasi dalam tubuh. Radikal bebas merupakan ion/atom/gugus atom/molekul yang memiliki satu atau lebih elektron tak berpasangan (Bowen, 2003). Radikal bebas yang berlebih dapat memacu timbulnya berbagai macam penyakit degeneratif, seperti kanker dan penyakit jantung (kardiovaskular). Penyakit kardiovaskular diketahui merupakan salah satu penyakit paling mematikan di Indonesia (Setiabudi, 2009). Timbulnya penyakit degeneratif oleh radikal bebas dapat dihambat ataupun dicegah oleh senyawa antioksidan.
Berdasarkan perannya, antioksidan dibedakan dalam sistem pangan dan biologis. Antioksidan dalam sistem pangan berperan untuk menghambat atau mencegah proses oksidasi lemak/minyak sehingga mempunyai fungsi sebagai pengawet. Sedangkan dalam sistem biologis, antioksidan berperan menangkal radikal bebas dalam tubuh sehingga diharapkan dapat mencegah timbulnya berbagai macam penyakit degeneratif. Antioksidan dalam tubuh seringkali tidak mampu mengatasi kerusakan oksidatif yang berlebih sehingga diperlukan antioksidan dari luar. Antioksidan dari luar dapat diperoleh dengan mengkonsumsi makanan maupun minuman yang kaya akan antioksidan.
Salah satu sumber antioksidan yang bersifat menyehatkan adalah produk berbasis cokelat yang diolah dari biji kakao. Kakao seperti yang dilaporkan oleh Crozier dkk. (2011) diketahui memiliki kandungan
polifenol yang tinggi, terutama golongan flavanol. Kadar dan aktivitas antioksidan yang tinggi pada kakao membuatnya berpotensi untuk dikembangkan menjadi produk yang menyehatkan. Selain kaya akan antioksidan, alasan kakao perlu dilirik untuk dikembangkan karena Indonesia merupakan salah satu negara terbesar penghasil kakao sehingga potensinya lebih menjanjikan.
Indonesia merupakan negara penghasil kakao terbesar ketiga di dunia dengan pangsa pasar sebesar 13,6% (Rohman, 2009). Volume ekspor produk kakao olahan masih relatif kecil dibandingkan dengan volume ekspor biji kakao. Data BPS yang diolah Kementerian Perindustrian menunjukkan volume ekspor kakao olahan Indonesia pada tahun 2009 hanya mencapai 115.170 ton dengan perincian produk intermediet (cocoa liquor, cocoa cake, cocoa butter, cocoa powder) sebanyak 83.642 ton dan produk akhir sebanyak 31.528 ton. (Media Industri, 2010). Data tersebut menunjukkan bahwa sebagian besar komoditi yang diekspor masih dalam bentuk raw material. Indonesia sebagai negara penghasil kakao memiliki peluang besar untuk mengembangkan lebih lanjut komoditi kakao dalam negeri menjadi produk jadi sehingga tidak hanya berhenti menjadi bahan mentah yang diekspor ke luar negeri.
Kajian terhadap bubuk kakao yang diperoleh dari Pusat Penelitian Kopi dan Kakao Indonesia di Jember, Jawa Timur akan dilakukan dalam penelitian ini. Bubuk kakao kemudian akan diolah menjadi bentuk minuman. Diduga akan terjadi penurunan kadar dan aktivitas antioksidan kakao selama proses pengolahan dikarenakan berbagai faktor, seperti suhu dan lama pemanasan. Oleh karena itu, akan diteliti pengaruh berbagai cara preparasi terhadap tingkat aktivitas
3 antioksidan minuman cokelat. Proses preparasi akan dilakukan dengan empat cara sesuai dengan kebiasaan yang berkembang di masyarakat pada umumnya, yaitu: melarutkan bubuk cokelat dengan air mendidih (100oC), menambahkan bubuk cokelat dengan air bersuhu ruang kemudian dipanaskan hingga mendidih (100oC), menambahkan bubuk cokelat dengan air bersuhu ruang kemudian dipanaskan dalam microwave hingga mendidih dan melarutkan bubuk cokelat dalam air bersuhu ruang (sebagai kontrol).
Manfaat produk berantioksidan ditentukan oleh tingkat aktivitas antioksidannya. Pengukuran aktivitas antioksidan perlu dilakukan untuk mengetahui seberapa besar potensi antioksidan dari produk intermediet sebelum dan setelah diolah menjadi minuman fungsional. Beragam metode pengukuran telah dikembangkan untuk mengukur karakteristik total antioksidan, tetapi tidak ada yang benar-benar ideal (Erel, 2004 dalam Hassanbaglou dkk. 2012). Metode pengukuran aktivitas antioksidan tersebut akan mendeteksi karakteristik yang berbeda dari antioksidan dalam sampel Hal ini menjelaskan mengapa metode pengukuran aktivitas yang berbeda akan mengacu pada pengamatan mekanisme kerja antioksidan yang berbeda pula (Hasannbaglou dkk. 2012). Pengukuran aktivitas antioksidan dalam menangkal radikal bebas dapat dilakukan dengan bermacam metode seperti DPPH, ORAC, dan ABTS (TEAC). Dalam penelitian ini digunakan pengukuran aktivitas antioksidan dengan metode analisa DPPH.
Kelebihan dari metode pengujian DPPH adalah telah banyak digunakan di dunia dan mudah diterapkan karena senyawa radikal yang digunakan bersifat relatif stabil dibanding metode lainnya. Prinsip dari uji
ini adalah adanya donasi atom hidrogen dari substansi yang diujikan kepada radikal DPPH yang ditunjukkan oleh perubahan warna. Menurut Karadag dkk. (2009), penentuan aktivitas antioksidan berdasarkan perubahan absorbansi DPPH harus diperhatikan karena absorbansi radikal DPPH setelah bereaksi dengan antioksidan dapat berkurang oleh cahaya, oksigen dan tipe pelarut.
1.2. Rumusan Masalah
Seberapa banyak kadar dan aktivitas antioksidan yang dapat dipertahankan selama proses pengolahan bubuk kakao hingga menjadi minuman cokelat dengan berbagai cara preparasi?
Bagaimana pengaruh cara preparasi terhadap tingkat aktivitas antioksidan minuman cokelat?
1.3. Tujuan Penelitian
Mengetahui kadar dan aktivitas antioksidan yang dapat dipertahankan selama proses pengolahan bubuk kakao hingga menjadi minuman cokelat dengan berbagai cara preparasi.
Menentukan cara preparasi manakah yang paling dapat mempertahankan aktivitas antioksidan minuman cokelat.
5 BAB II
TINJAUAN PUSTAKA
2.1. Kakao (Theobroma cacao)
Produk olahan coklat telah menjadi salah satu jenis makanan yang digemari oleh masyarakat modern. Coklat dihasilkan dari biji tanaman kakao yang telah mengalami serangkaian proses pengolahan. Tanaman kakao (Theobroma cacao) penghasil biji kakao terdiri dari empat jenis varietas utama, yaitu Criollo, Nacional, Forastero dan Trinitario (COUNET dkk. 2004 dalam Redovnikovic dkk. 2009). Criollo jarang dibudidayakan secara luas sebab jenis rentan ini terhadap penyakit dan hama. Nacional merupakan jenis kakao yang dibudidayakan di Ekuador.
Forastero dibudidayakan di daerah Amazon dan jenis ini paling banyak
dibudidayakan dan digunakan untuk menghasilkan berbagai permen coklat. Sedangkan Trinitario merupakan persilangan antara Forastero dan Criollo.
Kakao sebagai komoditas perdagangan biasanya dibedakan menjadi dua kelompok besar (Departemen Perindustrian, 2007), yaitu:
a. Kakao mulia (fine cocoa)
Secara umum, kakao mulia diproduksi dari varietas criollo. Di Indonesia, kakao mulia dihasilkan oleh beberapa perkebunan tua di Jawa, seperti di Kabupaten Jember yang dikelola oleh PTPN (Perusahaan Perkebunan Negara).
b. Kakao curah (bulk ordinary cocoa)
Kakao curah diproduksi dari varietas forastero dan dihasilkan oleh sebagian besar produsen kakao di Indonesia. Kualitas kakao curah biasanya rendah, meskipun produksinya lebih tinggi.
Indonesia merupakan produsen kakao terbesar ketiga di dunia setelah negara Pantai Gading dan Ghana. Jenis tanaman kakao yang
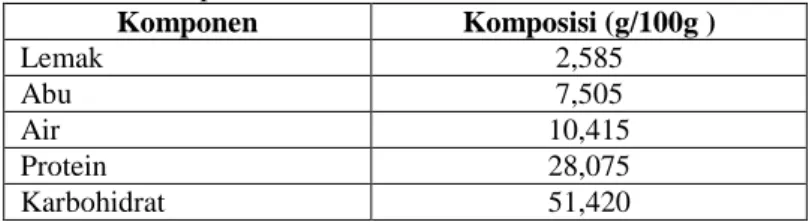
diusahakan sebagian besar adalah jenis kakao curah (lindak) dengan sentra produksi utama di daerah Sulawesi Selatan, Sulawesi Tenggara, dan Sulawesi Tengah (Departemen Perindustrian, 2007). Sedangkan jenis kakao mulia dibudidayakan oleh perkebunan besar negara di Jawa Timur dan Tengah. Kakao mulia umumnya memiliki keunggulan dalam aroma dan cita rasa, sedangkan kelebihan kakao lindak adalah memiliki produktivitas yang tinggi dan relatif mudah dibudidayakan (ICN, 2010). Komposisi kimia bubuk kakao lindak bebas lemak dari Pusat Penelitian Kopi dan Kakao di Jember disajikan pada Tabel 2.1. Klon kakao lindak yang dibudidayakan di Pusat Penelitian Kopi dan Kakao Indonesia, Jember disajikan pada Tabel 2.2. Bubuk kakao lindak yang diperoleh dari Pusat Penelitian Kopi dan Kakao Indonesia, Jember merupakan campuran dari semua jenis klon kakao lindak yang dibudidayakan.
Tabel 2.1 Komposisi Kimia Bubuk Kakao Lindak Bebas Lemak
Komponen Komposisi (g/100g ) Lemak 2,585 Abu 7,505 Air 10,415 Protein 28,075 Karbohidrat 51,420
Sumber: Yuliatmoko (2007), Hasanah (2007), Amri (2007) dan Kusumantias (2007) dalam Yuliatmoko (2007) 2.1.1. Senyawa Antioksidan Kakao
Kakao diketahui memiliki kadar antioksidan cukup tinggi. Kelompok senyawa polifenol yang paling banyak terdapat pada kakao adalah flavonoid golongan flavanol (Yuliatmoko, 2007). Jenis antioksidan yang terkandung dalam biji kokoa antara lain adalah katekin, epikatekin, prosianidin yang merupakan jenis polifenol.
7 Tabel 2.2. Jenis-Jenis Klon Kakao Lindak
Klon Deskripsi Keunggulan/Kelemahan
GC 7
Biji berwarna ungu
Produktivitas mencapai 2,0 ton/ha Kadar lemak 55%
Rentan penyakit busuk buah, VSD dan hama PBK
ICS 60
Biji bewarna ungu
Produktivitas mencapai 1,5 ton/ha Kadar lemak 54%
Moderat tahan penyakit busuk buah
Rentan penyakit VSD dan hama PBK
TSH 858
Biji berwarna ungu
Produktivitas mencapai 1,76 ton/ha Kadar lemak 56%
Moderat tahan penyakit busuk buah
Rentan penyakit VSD dan hama PBK
ICS 13
Biji berwarna ungu
Produktivitas mencapai 1,83 ton/ha Kadar lemak 52%
Moderat tahan penyakit busuk buah
Rentan penyakit VSD dan hama PBK
NIC 7
Biji berwarna ungu
Produktivitas mencapai 1,65 ton/ha Kadar lemak 53%
Moderat tahan penyakit busuk buah dan VSD Rentan hama PBK PA 300
Biji berwarna ungu
Produktivitas mencapai 1,40 ton/ha Kadar lemak 54%
Moderat tahan penyakit busuk buah dan VSD
RCC 70
Biji berwarna ungu
Produktivitas mencapai 2,28 ton/ha Kadar lemak 57%
Moderat tahan penyakit busuk buah
Rentan penyakit VSD dan hama PBK
ICCRI 03
Biji berwarna ungu
Produktivitas mencapai 2,19 ton/ha Kadar lemak 55%
Tahan penyakit busuk buah Moderat tahan penyakit
VSD ICCRI
04
Biji berwarna ungu
Produktivitas mencapai 2,16 ton/ha Kadar lemak 55%
Tahan penyakit busuk buah Moderat tahan penyakit
VSD Benih Hibrida F1 Produktivitas mencapai 1–1,5 ton/ha
Perbanyakan relatif mudah
Toleran terhadap serangan hama dan penyakit Sumber: Pusat Penelitian Kopi dan Kakao Indonesia (2011)
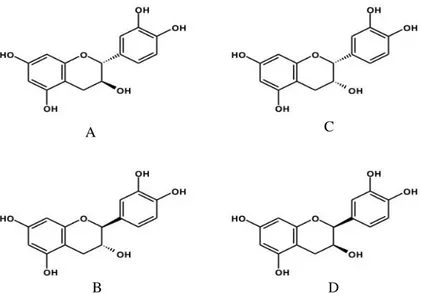
Menurut Misnawi dkk. (2002) dalam Yuliatmoko (2007), kandungan polifenol pada bubuk kakao tanpa fermentasi adalah sebesar 120-180 g/kg, 37% di antaranya dalam bentuk monomer flavan-3-ol, 58% dalam bentuk oligomer dan 5% sisanya berupa antosianin dan polifenol lainnya. Senyawa monomer flavanol terutama (-)-epikatekin pada kakao memiliki efek menguntungkan bagi kesehatan kardiovaskular (Hurst dkk. 2011). Donovan dkk. (2006) dalam Hurst dkk. (2011) melaporkan urutan bioavailabilitas monomer flavan-3-ol dari yang tertinggi sampai terendah adalah (-)-epikatekin, (+)-katekin dan (-)-katekin.
Biji kakao mengandung 12,8-43,2 mg/g (-)-epikatekin bergantung pada varietasnya. Akan tetapi, penelitian yang dilakukan oleh Hurst et al. (2011) menunjukkan bahwa pemanasan pada proses fermentasi, pengeringan dan pemanggangan dapat menyebabkan berkurangnya kandungan (-)-epikatekin, (+)-katekin serta mendorong terbentuknya stereoisomer baru katekin (Hurst dkk. 2011). Struktur bangun (-)-epikatekin, (+)-(-)-epikatekin, (-)-katekin dan (+)-katekin ditunjukkan pada Gambar 2.1. Proses pemanasan yang dilakukan dalam penelitian ini memungkinkan terjadinya perubahan struktur stereoisomer flavanol yang dapat berakibat pada perubahan aktivitas antioksidan.
2.1.2. Proses Pengolahan Biji Kakao
Proses pengolahan biji kakao di Pusat Penelitian Kopi dan Kakao Indonesia yang berpusat di Jember diawali dengan sortasi untuk memisahkan biji kakao dari kotoran-kotoran yang mungkin terikut. Biji kakao yang diolah adalah biji yang telah difermentasi selama lima hari. Selanjutnya, dilakukan tahap penyangraian untuk membentuk aroma dan citarasa khas coklat dari biji kakao dengan perlakuan panas. Penyangraian
9 dilakukan pada suhu 105-120oC selama 20-35 menit. Setelah disangrai, biji kakao dihilangkan kulitnya secara mekanis hingga diperoleh daging biji (nib).
Gambar 2.1 Struktur Bangun A (+)-Katekin, B (-)-Katekin, C (-)-Epikatekin dan D (+)-Epikatekin
Sumber: Hurst dkk. (2011)
Nib kemudian dihancurkan hingga mencapai ukuran 20m.
Penggilingan nib menggunakan panas menyebabkan lemak kakao meleleh dan membentuk pasta yang selanjutnya disebut dengan kakao liquor. Pasta ini dapat langsung dimurnikan dan dijual sebagai coklat tanpa pemanis (unsweetened baking chocolate). Pasta kakao kemudian dikempa untuk mengeluarkan lemak kakao. Sisa hasil tempaan adalah bungkil padat dengan kandungan lemak berkisar antara 10-22% bergantung pada permintaan konsumen.
A
B
C
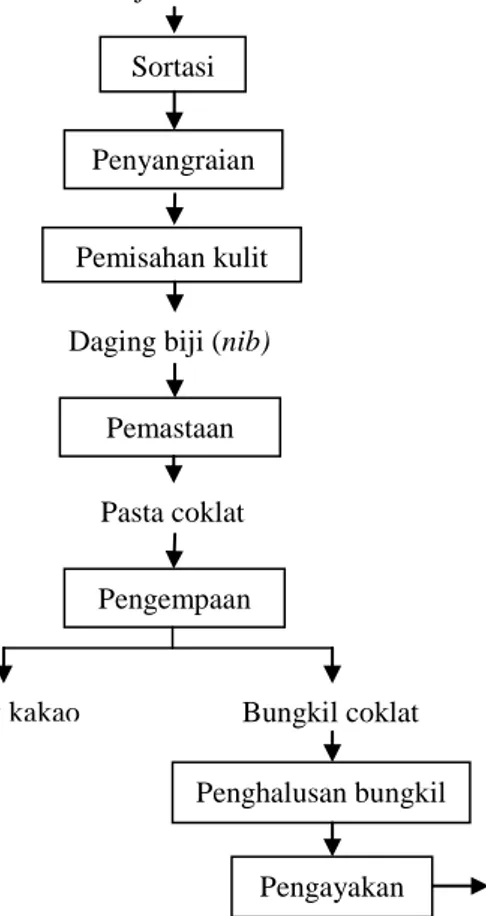
Bungkil merupakan bahan baku utama dalam pembuatan bubuk coklat setelah melalui proses penghalusan pada suhu antara 34-40oC dan pengayakan dengan mesin pengayak 120 mesh. Gambar 2.2 adalah diagram alir proses pengolahan biji kakao menjadi beberapa macam produk antara (intermediet) di Pusat Penelitian Kopi dan Kakao Indonesia.
Gambar 2.2 Diagram Alir Proses Pengolahan Biji Kakao menjadi Beberapa Macam Produk Intermediet
Sumber : Pusat Penelitian Kopi dan Kakao Indonesia (2008) Bubuk coklat Biji Kakao
Sortasi
Penyangraian
Pemisahan kulit Daging biji (nib)
Pemastaan Pasta coklat Pengempaan Bungkil coklat Lemak kakao Pengayakan Penghalusan bungkil
11 2.2. Antioksidan
Antioksidan adalah substansi yang mampu menetralkan radikal bebas dengan cara mengorbankan dirinya agar teroksidasi. Radikal bebas merupakan atom atau gugus atom yang memiliki satu atau lebih elektron tak berpasangan (Bowen, 2003). Hal ini menyebabkan radikal bebas bersifat sangat reaktif dan dapat bereaksi dengan protein, lipida, karbohidrat dan DNA (Vijithahh dan Nizar, 2009). Radikal bebas akan mengambil elektron dari molekul stabil terdekat sehingga mengakibatkan munculnya reaksi berantai pembentukan radikal bebas (Shenoy dan Shirwaikar, 2002 dalam Vijithahh dan Nizar, 2009). Radikal bebas dapat bersumber dari polutan, makanan dan minuman, radiasi, pestisida serta hasil proses oksidasi dalam tubuh. Kelebihan radikal bebas dalam tubuh dapat memicu timbulnya berbagai macam gangguan kesehatan degeneratif, seperti kanker dan penyakit jantung (kardiovaskular).
Antioksidan mempunyai peran yang berbeda dalam sistem pangan dan biologis. Antioksidan berperan untuk menghambat proses oksidasi lemak/minyak sehingga mempunyai fungsi sebagai pengawet. Sedangkan dalam sistem biologis, antioksidan berperan menangkal radikal bebas dalam tubuh sehingga dapat melawan kerusakan oksidatif.
Ada dua cara dalam mendapatkan antioksidan, yaitu dari luar tubuh (eksogen) dan dalam tubuh (endogen). Antioksidan eksogen didapat dengan mengkonsumsi makanan dan minuman yang mengandung vitamin C dan E, β-karoten maupun antioksidan sintetik seperti BHA, BHT dan TBHQ. Sedangkan contoh antioksidan endogen adalah enzim superoksida dismutase (SOD), glutation peroksidase (GSH.Px) dan katalase. Antioksidan endogen seringkali tidak mampu mengatasi stres oksidatif yang
berlebih sehingga diperlukan antioksidan eksogen untuk mengatasinya (Halliwel dkk. 1995). Stress oksidatif merupakan keadaan saat mekanisme antioksidan tidak cukup untuk mencegah spesi oksigen reaktif.
2.2.1. Klasifikasi Senyawa Antioksidan
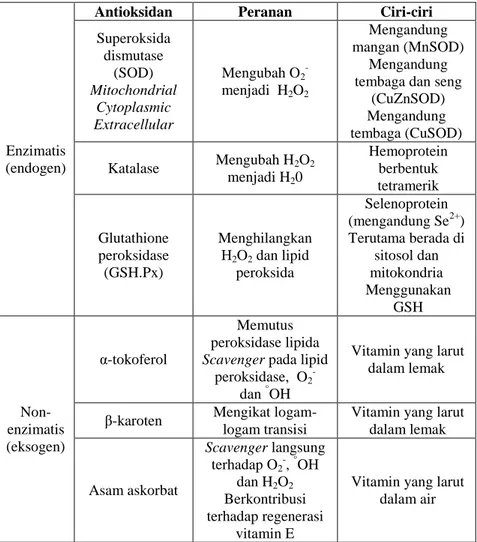
Senyawa antioksidan digolongkan menjadi berbagai macam kategori berdasarkan jenisnya. Bentuk klasifikasi dari jenis-jenis antioksidan disajikan pada Tabel 2.3.
Berdasarkan sumbernya, antioksidan dibedakan dalam dua kelompok, yaitu:
1) Antioksidan alami
Antioksidan alami merupakan antioksidan yang diperoleh dari hasil ekstraksi bahan alami atau terbentuk dari reaksi-reaksi kimia selama proses pengolahan (Trilaksani, 2003 dalam Santoso, 2005). Antioksidan alami dapat diperoleh dari beragam sumber bahan pangan, seperti sayur-sayuran, buah-buahan, rempah-rempah, dan lain-lain. Contoh dari antioksidan alami adalah vitamin C, vitamin E, dan β-karoten.
Menurut Sahidi dan Naczk (1950) dalam Santoso (2005), senyawa antioksidan alami dalam tumbuhan umumnya adalah senyawa fenolik dan polifenolik, seperti golongan flavonoid, turunan asam sinamat, kumarin, tokoferol, dan asam-asam organik polifungsional. Golongan flavonoid yang memiliki fungsi sebagai antioksidan meliputi flavon, flavanol, isoflavon, katekin dan kalkon, sedangkan turunan asam sinamat meliputi asam kafeat, asam ferulat, asam klorogenat, dan lain-lain (Santoso, 2005).
13 2) Antioksidan sintetik
Menurut Trilaksani (2003) dalam Santoso (2005), antioksidan sintetik merupakan antioksidan yang diperoleh sebagai hasil dari sintesa reaksi kimia. Contoh dari antioksidan sintetik adalah BHA, BHT dan TBHQ.
Tabel 2.3 Klasifikasi Jenis Antioksidan Berdasarkan Struktur Kimia
Enzimatis (endogen)
Antioksidan Peranan Ciri-ciri
Superoksida dismutase (SOD) Mitochondrial Cytoplasmic Extracellular Mengubah O2 -menjadi H2O2 Mengandung mangan (MnSOD) Mengandung tembaga dan seng
(CuZnSOD) Mengandung tembaga (CuSOD) Katalase Mengubah H2O2 menjadi H20 Hemoprotein berbentuk tetramerik Glutathione peroksidase (GSH.Px) Menghilangkan H2O2 dan lipid peroksida Selenoprotein (mengandung Se2+) Terutama berada di sitosol dan mitokondria Menggunakan GSH Non-enzimatis (eksogen) α-tokoferol Memutus peroksidase lipida
Scavenger pada lipid
peroksidase, O2-
dan °OH
Vitamin yang larut dalam lemak
β-karoten Mengikat logam-logam transisi
Vitamin yang larut dalam lemak Asam askorbat Scavenger langsung terhadap O2-, °OH dan H2O2 Berkontribusi terhadap regenerasi vitamin E
Vitamin yang larut dalam air
2.2.2. Mekanisme Antioksidan
Menurut Eskin dan Przybylski (2001) dalam Sari (2005), mekanisme kerja senyawa antioksidan adalah mengkelat ion logam, menghilangkan oksigen radikal, memecah reaksi rantai inisiasi, menyerap energi oksigen singlet, mencegah pembentukan radikal, menghilangkan dan atau mengurangi jumlah oksigen yang ada. Mekanisme reaksi senyawa antioksidan pada Gambar 2.3.
AH + ROO. A. + ROOH AH + RO. A. + ROH A. + ROO. AOOH A. + RO. AOH A. + A. AA A. +O2 AOO. A. +RH AH +R. Keterangan :
AH = antioksidan ROO. = radikal peroksil
RH = lemak atau minyak tak jenuh R. = radikal asam lemak tak jenuh Gambar 2.3 Mekanisme Reaksi Senyawa Antioksidan
Sumber: Gordon (1990) dalam Sari (2005)
Berdasarkan fungsinya, antioksidan dibedakan menjadi tiga, yaitu: a. Antioksidan primer
Antioksidan primer berperan dalam menghentikan reaksi rantai radikal bebas dengan berfungsi sebagai pendonor atom H atau elektron pada radikal bebas dan berdampak pada pembentukan produk yang lebih stabil. Antioksidan primer (AH) dapat memutuskan tahap inisiasi dengan bereaksi dengan sebuah radikal bebas atau menghambat reaksi propagasi dengan cara bereaksi dengan radikal peroksil atau alkoksida (Madhavi dan Salmakhe, 1995 dalam Sari, 2005). Contoh antioksidan yang memiliki mekanisme ini adalah tokoferol, flavonoid dan asam askorbat (Sies dalam
15 Halim, 2011). Sedangkan BHA, BHT dan TBHQ merupakan contoh antioksidan primer yang dibuat secara sintetik.
b. Antioksidan sekunder
Antioksidan sekunder berperan dalam mengikat atau mengkelat ion logam, sebagai penangkal oksigen, mengubah hidroperoksida menjadi molekul non-radikal, menyerap radiasi UV, dan menginaktifkan oksigen singlet (Pokorny dkk. 2001 dalam Sari, 2005)
c. Antioksidan tersier
Menurut Pribadi (2009), antioksidan tersier adalah antioksidan yang berfungsi memperbaiki kerusakan sel dan jaringan yang disebabkan oleh radikal bebas. Contoh dari antioksidan tersier adalah enzim
DNA-repair dan metionin sulfoksida reduktase yang berperan dalam perbaikan
biomolekul yang disebabkan oleh radikal bebas (Winarsi, 2005 dalam Pribadi, 2009).
2.3. Metode Pengujian Aktivitas Antioksidan
Pengukuran aktivitas antioksidan dalam menangkal radikal bebas dapat dilakukan dengan bermacam metode, seperti DPPH, ORAC, dan ABTS (TEAC).
a) ORAC (oxygen radical absorbance capacity)
Metode ORAC menggunakan senyawa radikal peroksil yang dihasilkan melalui larutan cair dari 2,2’-azobis-2-metil-propanimidamida. Antioksidan akan bereaksi dengan radikal peroksil dan menghambat degradasi pendaran zat warna (Teow dkk. 2007). Kelebihan metode pengujian ORAC adalah kemampuannya dalam menguji antioksidan hipofilik dan lipofilik sehingga akan menghasilkan pengukuran lebih baik terhadap total aktivitas antioksidan (Prior dkk. 2003 dalam Teow dkk. 2007).
Kelemahan dari metode ini adalah membutuhkan peralatan yang mahal (Awika dkk. 2003 dalam Thaipong dkk. 2005) dan metode ORAC hanya sensitif terhadap penghambatan radikal peroksil (Cronin, 2004).
b) ABTS (TEAC)
Metode ini menggunakan prinsip inhibisi, yaitu sampel ditambahkan pada sistem penghasil radikal bebas dan pengaruh inhibisi terhadap efek radikal bebas diukur untuk menentukan total kapasitas antioksidan dari sampel (Wang dkk. 2004). Metode TEAC menggunakan senyawa 2,2’-azino-bis (3-ethylbenzthiazoline-6-sulfonic acid) sebagai sumber penghasil radikal bebas. Kelebihan metode ini dibandingkan metode DPPH adalah dapat digunakan di sistem larutan berbasis air maupun organik, mempunyai absorbansi spesifik pada panjang gelombang dari region visible, dan membutuhkan waktu reaksi yang lebih sedikit (Lee dkk. 2003). Selain itu, kelebihan metode ABTS dibandingkan dengan metode DPPH adalah tidak adanya intervensi warna saat mengukur sampel berantosianin (Arnao, 2000 dalam Teow dkk. 2007). Menurut MacDonald-Wicks dkk. (2006) dalam Karadag dkk. (2009), kelemahan dari metode ini adalah radikal ABTS yang digunakan pada metode TEAC tidak ditemukan dan tidak serupa dalam sistem biologis.
c) DPPH
Uji peredaman warna radikal bebas DPPH merupakan uji untuk menentukan aktivitas antioksidan dalam sampel yang akan diujikan dengan melihat kemampuannya dalam menangkal radikal bebas DPPH. Sumber radikal bebas dari metode ini adalah senyawa 1,1-difenil-2-pikrilhidrazil. Prinsip dari uji ini adalah adanya donasi atom hidrogen dari substansi yang diujikan kepada radikal DPPH menjadi senyawa non radikal
17 difenilpikrilhidrazin yang akan ditunjukkan oleh perubahan warna (Molyneux, 2004). Gambar 2.4 menunjukkan struktur molekul DPPH sebelum dan setelah menerima donor atom H.
Gambar 2.4 Struktur Molekul DPPH Sebelum dan Setelah Menerima Donor Atom H
Sumber: Molyneux (2004)
Perubahan warna yang akan terjadi adalah perubahan dari larutan yang berwarna ungu menjadi berwarna kuning (Pauly, 2001 dalam Rahayu dkk. 2009). Intensitas perubahan warna ini kemudian diukur pada spektrum absorpsi antara 515-520 nm pada larutan organik (metanol atau etanol) (Molyneux, 2004). Pemilihan penggunaan metanol yang bersifat lebih polar dibandingkan etanol sebagai pelarut diharapkan lebih dapat mempertahankan kestabilan DPPH.
Kelebihan dari metode DPPH adalah secara teknis simpel, dapat dikerjakan dengan cepat dan hanya membutuhkan spektrofotometer UV-Vis (Karadag dkk. 2009). Sedangkan kelemahan dari metode ini adalah radikal DPPH hanya dapat dilarutkan dalam media organik (terutama media alkoholik), tidak pada media aqueous sehingga membatasi kemampuannya dalam penentuan peran antioksidan hidrofilik. Penentuan aktivitas antioksidan berdasarkan perubahan absorbansi DPPH harus diperhatikan karena absorbansi radikal DPPH setelah bereaksi dengan antioksidan dapat berkurang oleh cahaya, oksigen dan tipe pelarut. Telah diketahui bahwa
terjadi pengurangan kapasitas antioksidan ketika kadar air pelarut melebihi batas tertentu dikarenakan terkoagulasinya DPPH (Magalhaes dkk. 2008).
19 BAB III
METODE PENELITIAN
3.1 Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini adalah sebagai berikut:
1. Bahan utama untuk pembuatan minuman cokelat adalah Air Minum dalam Kemasan (AMDK) dan bubuk kakao rendah lemak tanpa proses alkalisasi yang didapatkan dari Pusat Penelitian Kopi dan Kakao Indonesia, Jember, Jawa Timur. Bahan pendukung yang digunakan adalah gula pasir ”Gulaku” dan garam ”Dolphin”.
2. Bahan yang digunakan untuk analisa adalah akuades, akuabides, n-heksana (Merck 104367), asam galat (Merck 842649), reagen Folin-Ciocalteu (Merck UN 3264), Na2CO3 anhidrat (Merck 106393), NaNO2
(Merck 106549), AlCl3 (Merck 801081), NaOH (Mallincrodkt T108),
radikal DPPH (Sigma Aldrich D 9132), metanol p.a (Merck 106009), etanol p.a (Merck 100983), kertas saring kasar, kertas saring Whatman 40, aluminium foil, standar berupa asam galat (Merck 159630), (+)-katekin (Sigma Aldrich C 1251), (-)-epi(+)-katekin (Sigma Aldrich E 4018), dan α-tokoferol (Sigma Aldrich T 3251).
3.2. Alat Penelitian
Alat yang digunakan dalam pembuatan minuman cokelat adalah panci, pengaduk kaca, kompor, bunsen, kaki tiga, korek api, gelas ukur, kertas aluminium foil, gelas piala, toples, microwave ”National” dan termometer. Sedangkan alat yang digunakan untuk melakukan analisa adalah sentrifus ”Hettich”, spektrofotometer UV-Vis ”Shimadzu”, neraca analitis ”Top Loading METTLER TOLEDO”, neraca analitis ”Sartorius”,
kuvet, Soxhlet apparatus, labu takar, botol semprot, beaker glass, corong, oven, water bath ”Buchi”, eksikator, vacutiner, pengaduk kaca, dan mikro pipet.
3.3. Waktu dan Tempat Penelitian
Penelitian dilakukan di Laboratorium Fakultas Teknologi Pertanian Unika Widya Mandala Surabaya, yaitu: Laboratorium Kimia-Biokimia Pangan dan Gizi, Laboratorium Analisa Pangan dan Laboratorium Penelitian. Penelitian utama dilaksanakan pada bulan Mei-September 2012. 3.4. Rancangan Penelitian
Penelitian yang dilakukan adalah penelitian eksperimental dengan faktor tunggal, yaitu Cara Preparasi Minuman Cokelat (P) yang dibagi menjadi empat perlakuan, yaitu (P1) melarutkan bubuk cokelat dalam air bersuhu ruang, (P2) melarutkan bubuk cokelat dengan air mendidih (100oC), (P3) menambahkan bubuk cokelat dengan air bersuhu ruang kemudian dipanaskan hingga mendidih (100oC), (P4) menambahkan bubuk cokelat dengan air bersuhu ruang kemudian dipanaskan dalam microwave dengan mode HIGH (1000 W) selama 1 menit atau hingga timbul gelembung. Masing-masing perlakuan dilakukan ulangan sebanyak empat kali. Percobaan kemudian diacak dengan Rancangan Acak Kelompok (RAK) faktor tunggal, yaitu cara preparasi minuman cokelat. Desain rancangan penelitian cara preparasi minuman cokelat pada Tabel 3.1.
Tabel 3.1. Desain Rancangan Penelitian Ulangan Cara Preparasi Minuman Cokelat
P1 P2 P3 P4
1 P1 1 P2 1 P3 1 P4 1
2 P1 2 P2 2 P3 2 P4 2
Keterangan:
P1 1 adalah cara preparasi dengan melarutkan bubuk cokelat dalam air bersuhu ruang dan merupakan ulangan ke-1 dari empat ulangan.
21 Pengaruh faktor dianalisa menggunakan analisa varians (ANAVA) pada α = 5%. Apabila hasil uji ANAVA menunjukan adanya pengaruh nyata, maka dilanjutkan dengan Uji Beda Nyata Duncan pada α = 5% untuk mengetahui taraf perlakuan yang memberikan perbedaan nyata.
Parameter penelitian yaitu aktivitas antioksidan minuman cokelat dalam menangkap radikal bebas DPPH. Penelitian ini menggunakan data pendukung yaitu kadar lemak/minyak pada bubuk kakao, serta kadar antioksidan (Total Fenol dan Total Flavonoid) pada bubuk kakao dan minuman cokelat.
3.5. Pelaksanaan Penelitian 3.5.1 Pembuatan Minuman Cokelat
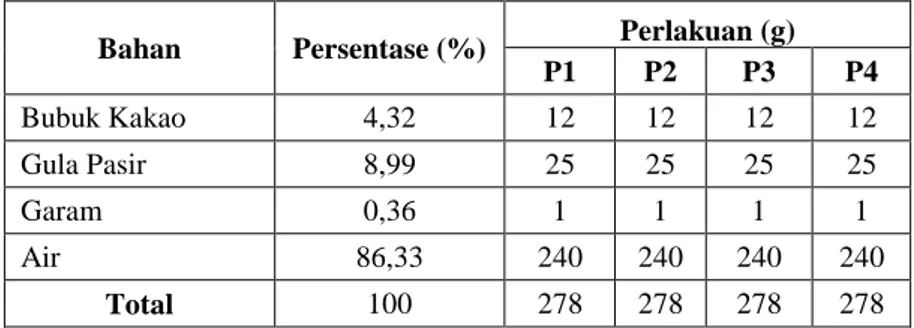
Bahan-bahan yang digunakan dalam proses pembuatan minuman cokelat adalah gula pasir, bubuk cokelat dan air. Formulasi minuman cokelat pada Tabel 3.2. Sedangkan diagram alir proses pembuatan minuman cokelat pada Gambar 3.1.
Tabel 3.2 Formulasi Minuman Cokelat
Bahan Persentase (%) Perlakuan (g)
P1 P2 P3 P4 Bubuk Kakao 4,32 12 12 12 12 Gula Pasir 8,99 25 25 25 25 Garam 0,36 1 1 1 1 Air 86,33 240 240 240 240 Total 100 278 278 278 278 Sumber: Crozier dkk. (2011)
Gambar 3.1 Diagram Alir Proses Pembuatan Minuman Cokelat Sumber: a) Lee dkk. (2003); b) Hershey’s (2010)
Tahapan proses pembuatan minuman cokelat terdiri atas beberapa tahap sebagai berikut:
a) Preparasi Bubuk Kakao
Preparasi bubuk kakao meliputi penimbangan dan pengemasan ulang bubuk kakao ke dalam kemasan yang lebih kecil untuk menjaga keseragaman sampel saat dilakukan analisa. Bubuk kakao yang diperoleh dari Pusat Penelitian Kopi dan Kakao adalah sebesar 2,5 kg. Bubuk kakao kemudian dipindahkan ke dalam toples dan dihomogenisasi dengan cara diaduk dengan sendok kayu selama 2 menit. Bubuk kakao sebanyak 2 kg
P1
Minuman cokelat
P2 a) P3 b) P4b)
Preparasi Bubuk Kakao
Preparasi Minuman Cokelat
Analisa:
- Total Fenol - Total Flavanoid - Uji DPPH Bubuk Kakao Rendah Lemak
Penimbangan Bahan Bubuk Kakao dalam
kemasan sebesar 50 g Analisa:
- Total Fenol - Total Flavanoid - Kadar Lemak - Uji DPPH Gula Pasir Garam Air
23 yang telah homogen dilakukan pengemasan ulang dengan cara menimbang bubuk kakao sebesar 50 g langsung ke dalam plastik PE dan kemudian dikemas rapat dan dilapisi dengan aluminium foil. Bubuk kakao yang telah dikemas berjumlah 40 bungkus dengan berat tiap kemasan sebesar 50 g. Kemasan yang digunakan ialah plastik PE yang kemudian dilapisi dengan
aluminium foil. Bubuk kakao yang telah dikemas ulang disimpan dalam
toples kedap udara yang dilapisi aluminium foil dan diberi silica gel di dalamnya.
b) Penimbangan Bahan
Bahan – bahan yang digunakan dalam pembuatan minuman cokelat antara lain bubuk kakao yang telah dikemas tiap 50 g, gula pasir, air mineral dan garam. Penimbangan bahan-bahan untuk membuat minuman cokelat tersebut ditimbang sesuai dengan formulasi yang ada. Penimbangan bubuk kakao yang digunakan untuk analisa total fenol tiap ulangan adalah sebesar 2 gram, analisa total flavonoid 2 gram, dan analisa kadar lemak sebesar 2 gram.
Gula pasir ditimbang sebesar 25 gram tiap perlakuan. Penimbangan gula dilakukan langsung ke dalam gelas piala 500 mL yang akan digunakan membuat minuman cokelat. Penimbangan bubuk kakao dilakukan dengan cara menimbang 12 gram bubuk kakao dari kemasan 50 gram untuk setiap perlakuan dengan kertas timbang yang telah diketahui beratnya. Bubuk kakao kemudian dituang ke dalam gelas piala 500 mL yang berisi gula pasir. Kertas timbang yang digunakan untuk menimbang bubuk kakao ditimbang kembali untuk mengetahui berat bubuk kakao yang tertinggal pada kertas timbang.
Penimbangan garam dilakukan dengan cara menimbang 1 gram garam untuk tiap perlakuan menggunakan kertas timbang dan kemudian dituang
pada gelas piala berisi gula pasir dan bubuk kakao. Kertas timbang yang digunakan untuk menimbang garam ditimbang kembali untuk mengetahui berat garam yang tertinggal pada kertas timbang. Air sebesar 240 mL diukur menggunakan gelas ukur 500 mL.
c) Preparasi Minuman Cokelat
Preparasi minuman cokelat meliputi pencampuran bahan yang telah ditimbang sesuai dengan perlakuan yang ada. Cara preparasi minuman cokelat sesuai dengan tiap perlakuan antara lain:
Perlakuan 1 (P1) : Air bersuhu ruang (±28,5ºC) yang telah diukur sebesar 240 mL menggunakan gelas ukur 500 mL dicampurkan ke dalam gelas piala ukuran 600 mL yang berisi bubuk kakao, garam dan gula, kemudian dilakukan pengadukan menggunakan pengaduk kaca hingga homogen. Perlakuan 2 (P2) : Air 500 mL dimasukkan ke dalam gelas piala dan kemudian dididihkan langsung menggunakan bunsen hingga mendidih. Air yang telah mendidih kemudian diukur sebesar 240 mL menggunakan gelas ukur 600 mL dan dicampurkan dalam gelas piala 500 mL berisi bubuk kakao, garam dan gula, kemudian dilakukan pengadukan menggunakan pengaduk kaca hingga homogen.
Perlakuan 3 (P3) : Air bersuhu ruang diukur sebesar 240 mL menggunakan gelas ukur 500 mL dan dicampurkan ke dalam gelas piala 600 mL yang telah berisi bubuk kakao, garam dan gula, kemudian diaduk menggunakan pengaduk kaca hingga homogen. Campuran tersebut kemudian dididihkan langsung di atas pemanas bunsen yang telah diberi alas kasa hingga mendidih.
Perlakuan 4 (P4) : Air bersuhu ruang dicampurkan dalam gelas piala 600 mL yang telah berisi bubuk kakao, garam dan gula, kemudian diaduk menggunakan pengaduk kaca hingga homogen. Campuran tersebut
25 kemudian dimasukkan ke dalam microwave kemudian dilakukan pemanasan dengan pengaturan mode HIGH (1000 W) selama 1 menit hingga muncul gelembung pada minuman cokelat.
3.5.2 Metode Analisa a) Preparasi Sampel
Sampel minuman cokelat yang telah dibuat didinginkan dan disentrifugasi pada 10.000 rpm pada suhu 5oC selama 15 menit. Supernatan yang dihasilkan digunakan sebagai sampel.
b) Analisa Kadar Lemak Bubuk Cokelat dengan Metode Soxhlet ditunjukkan pada Lampiran 1.
c) Analisa Kadar Antioksidan
a. Analisa Kadar Total Fenol dengan metode kolorimetri Folin-Ciocalteau Fenol (Lee dkk. 2003) ditunjukkan pada Lampiran 2. b. Analisa Kadar Total Flavonoid berdasarkan aluminium klorida
kolorimetri (Zhishen dkk. 1999 dalam Lee dkk. 2003) terdapat pada Lampiran 3.
d) Analisa Aktivitas Antioksidan dengan Metode Penangkapan Radikal Bebas DPPH (Holliday, 2006 dalam Mediyaningsih, 2009) terdapat pada Lampiran 4.
26
HASIL DAN PEMBAHASAN
Antioksidan dibutuhkan oleh tubuh untuk menangkal radikal bebas sehingga diharapkan dapat mencegah timbulnya berbagai macam penyakit degeneratif. Antioksidan dalam tubuh seringkali tidak mampu mengatasi kerusakan oksidatif yang berlebih sehingga diperlukan antioksidan dari luar. Antioksidan dari luar dapat diperoleh dengan mengkonsumsi makanan maupun minuman yang kaya akan antioksidan.
Salah satu sumber antioksidan yang bersifat menyehatkan adalah produk berbasis cokelat yang diolah dari biji kakao. Kakao, seperti yang dilaporkan oleh Crozier dkk. (2011), diketahui memiliki kandungan polifenol yang tinggi, terutama golongan flavanol. Salah satu produk berbasis cokelat yang cukup digemari oleh masyarakat adalah minuman cokelat.
Dalam penyajiannya, minuman cokelat diproses dengan berbagai cara preparasi yang berbeda. Oleh karena itu, berikut ini dibahas pengaruh berbagai proses preparasi terhadap kadar dan aktivitas antioksidan minuman cokelat. Analisa kadar antioksidan meliputi analisa kadar total fenol dan total flavonoid. Aktivitas antioksidan pada minuman cokelat dianalisa menggunakan sistem pengujian metode radikal bebas DPPH berdasarkan metode yang diterapkan oleh Holliday (2006) dalam Mediyaningsih (2009). 4.1 Pengaruh Pemanasan terhadap Kadar Total Fenol Minuman
Cokelat
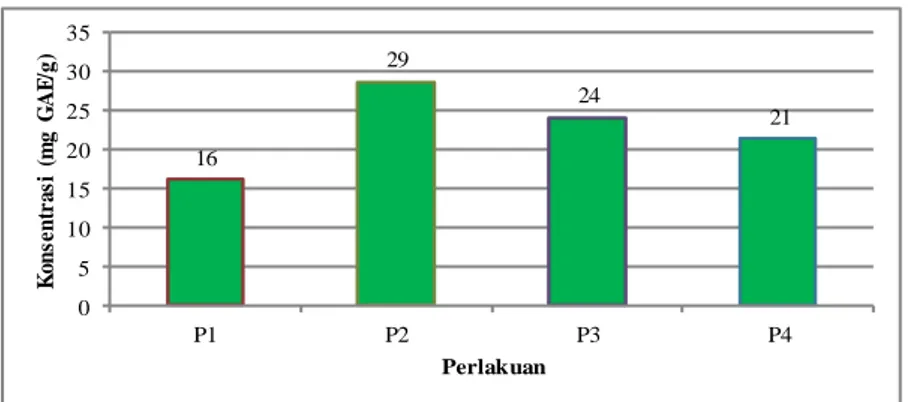
Kadar total fenol minuman cokelat setelah mengalami berbagai proses preparasi dapat dilihat pada Gambar 4.1. Berdasarkan Gambar 4.1, kadar total fenol minuman cokelat dari empat perlakuan berkisar antara 402-716 mg GAE/gram bubuk cokelat.
27 16 29 24 21 0 5 10 15 20 25 30 35 P1 P2 P3 P4 K on se n tr as i (m g G A E /g ) Perlakuan
Gambar 4.1 Kadar Total Fenol Minuman Cokelat
Penentuan kadar total fenol minuman cokelat dilakukan dengan metode Folin-Ciocalteu. Penggunaan asam galat yang merupakan komponen fenol sebagai standar akan memprediksi kadar komponen fenol dalam minuman cokelat. Berdasarkan hasil uji ANAVA (α = 0,05) diketahui bahwa berbagai cara preparasi yang dilakukan nyata mempengaruhi kadar total fenol dalam minuman cokelat. Minuman cokelat tanpa proses pemanasan (P1) memiliki kadar total fenol paling rendah. Sedangkan minuman cokelat yang diseduh dengan air mendidih (P2) memiliki kadar total fenol paling tinggi. Kadar total fenol minuman cokelat P2 meningkat 78%, P3 meningkat 50% dan P4 meningkat 32% dibandingkan P1. Hasil serupa pernah dilaporkan oleh Dewi dan Dominika (2008) yang menemukan bahwa pemanasan pada serbuk sarang semut yang diseduh pada suhu 100oC, menghasilkan kadar total fenol yang lebih besar dibandingkan dengan suhu 60 dan 80oC.
Menurut Yuliatmoko dkk. (2007), bubuk kakao lindak bebas lemak mengandung protein dalam kadar yang cukup besar, yaitu 28,075%. Haslam dkk. (1999) dalam Ali (2002) mengemukakan bahwa interaksi antara protein dengan komponen fenolik dapat terjadi akibat ikatan hidrogen
antara gugus hidroksil fenolik dengan gugus NH- dan CO- pada protein. Bartolome dkk. (2000) dalam Ali (2002) menyatakan bahwa interaksi hidrofobik antara bagian non polar dari molekul fenolik dengan bagian non polar dari protein mampu menghasilkan interaksi lemah antara komponen fenolik dengan protein. Peningkatan kadar total fenol minuman cokelat setelah mengalami perlakuan panas pada P2, P3 dan P4 diduga akibat terjadinya denaturasi protein sehingga komponen fenolik yang semula terikat dengan protein menjadi lepas. Selain itu, peningkatan kadar total fenol diduga juga terjadi akibat degradasi senyawa fenol kompleks menjadi fenol sederhana (Pujimulyani dkk. 2010). Larrauri dkk. (1997) dalam Akowuah dkk. (2009) melaporkan adanya dekomposisi signifikan terhadap antioksidan fenolik pada suhu di atas 60oC.
Perlakuan perebusan hingga mendidih (P3) menghasilkan minuman cokelat dengan kadar total fenol yang lebih rendah dibandingkan dengan minuman cokelat yang diseduh (P2). Hal ini diduga akibat fenol yang telah terekstrak mengalami kerusakan karena dipanaskan dengan waktu kontak yang lebih lama (± 10 menit). Hasil serupa dilaporkan oleh Turkmen dkk. (2004) yang mengemukakan bahwa perebusan menyebabkan penurunan kadar total fenol pada kacang polong, bawang bombay dan gambas.
Perlakuan pemanasan dengan microwave (P4) menghasilkan kadar total fenol yang tidak berbeda nyata dengan P3 diduga akibat proses pemanasan tersebut kurang mampu mendenaturasi protein dalam minuman cokelat dikarenakan waktu kontak pemanasan yang relatif singkat (satu menit) serta suhu pemanasan minuman cokelat yang lebih rendah (± 88-89oC) bila dibandingkan dengan suhu pemanasan P2 dan P3 (± 98-99oC). Gelombang energi yang dipancarkan oleh microwave akan diteruskan ke
29 dalam sistem melalui air yang bersifat polar menuju komponen-komponen polar lain, seperti senyawa-senyawa fenolik dan katekin (Kaufmann dkk. 2001 dalam Pak-Dek dkk. 2011). Diduga lemak dalam minuman cokelat (26,67 %) yang bersifat non-polar menghambat transfer panas sampel sehingga menyebabkan proses ekstraksi senyawa fenolik kurang berjalan baik. Berdasarkan Heldman dan Singh (2001) konduktivitas panas dari bubuk kakao sebesar 0,188 W/m°C sedangkan konduktivitas panas air pada suhu 25°C adalah sebesar 0,606 W/m°C. Koefisien konduktivitas panas lemak yang lebih rendah dibandingkan dengan air yang terkandung dalam bubuk cokelat akan menghambat transfer panas gelombang microwave ke dalam sampel..
4.2 Pengaruh Pemanasan terhadap Kadar Total Flavonoid Minuman Cokelat
Penentuan kadar total flavonoid dilakukan dengan menggunakan metode aluminium klorida kolorimetri. Dalam penelitian ini, kadar total flavonoid minuman cokelat dianalisa menggunakan (+)-katekin dan (-)-epikatekin sebagai standar. Total flavonoid minuman cokelat dinyatakan sebagai mg katekin ekivalen/gram (mg CE/g) dalam penentuan kadar (+)-katekin. Sedangkan dalam penentuan kadar (-)-epikatekin, total flavonoid dinyatakan sebagai mg epikatekin ekivalen/gram (mg ECE/g).
Kadar total fenol sampel minuman cokelat yang lebih rendah dibandingkan kadar total flavonoid diduga disebabkan adanya senyawa fenolik dalam lemak cokelat yang tidak terekstrak sehingga hasil analisa tidak menggambarkan total fenol sampel minuman cokelat secara utuh. Hasil ini didukung oleh hasil penelitian Othman dkk. (2007) yang menunjukkan bahwa kadar total fenol biji kakao yang diekstrak dengan pelarut etanol lebih tinggi dibandingkan biji kakao yang diekstrak dengan
pelarut air. Selain itu, waktu ekstraksi yang dilakukan oleh Othman dkk. (2007) yang lebih lama (dua jam) dibandingkan dengan waktu ekstraksi yang dilakukan dalam penelitian ini (15 menit) diduga juga mempengaruhi banyaknya senyawa fenolik yang terekstrak.
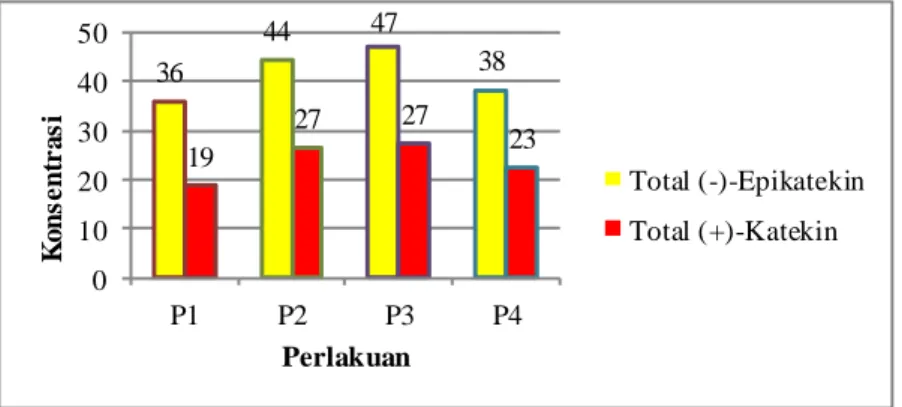
Terjadi peningkatan kadar total flavonoid minuman cokelat, baik total (+)-katekin maupun (-)-epikatekin setelah dilakukan proses preparasi. Berdasarkan Gambar 4.2, kadar (-)-epikatekin dari empat perlakuan berkisar antara 360-473 mg ECE/gram bubuk cokelat, sedangkan kadar (+)-katekin berkisar antara 188-274 mg CE/gram bubuk cokelat.
36 44 47 38 19 27 27 23 0 10 20 30 40 50 P1 P2 P3 P4 K o n s e n tr a s i Perlakuan Total (-)-Epikatekin Total (+)-Katekin
Gambar 4.2 Kadar Total Flavonoid Minuman Cokelat
Kadar total (-)-epikatekin minuman cokelat lebih tinggi dibandingkan kadar total (+)-katekin. Hal ini sesuai dengan teori yang dikemukakan oleh Kwik-Uribe dan Bektash (2008) yang mengatakan bahwa monomer flavanol dalam cokelat didominasi oleh (-)-epikatekin dan juga (+)-katekin dalam jumlah yang jauh lebih kecil. Cooper dkk. (2007) dalam Jalil dan Ismail (2008) mengemukakan bahwa keberadaan epikatekin dominan pada semua cokelat dengan rasio 1:0,1 dibandingkan katekin. Rasio katekin yang lebih besar dari 0,1 disebabkan oleh epimerasi dari
(-)-31 epikatekin menjadi (+)-katekin setelah kakao mengalami proses pemanggangan (Caligiani dkk. 2007 dalam Hurst dkk. 2011).
Berdasarkan uji ANAVA (α = 0,05), diketahui bahwa perbedaan proses preparasi tidak memberikan pengaruh nyata pada kadar total flavonoid minuman cokelat, baik total (+)-katekin maupun (-)-epikatekin. Gotti et al. (2006) dan Kofink dkk. (2007) dalam Hurst dkk. (2011) melaporkan bahwa proses pemanggangan atau Dutch processing menghasilkan pembentukan stereoisomer baru, (-)-katekin yang tidak ditemukan pada biji kakao segar. Kadar total flavonoid yang tidak berbeda nyata antar perlakuan diduga disebabkan akibat terjadinya epimerisasi dari (-)-epikatekin menjadi (-)-katekin. Hurst dkk. (2011) mengemukakan bahwa epimerisasi dari (-)-epikatekin menjadi (-)-katekin terjadi akibat pemanasan pada proses pemanggangan dan akibat Dutch processing.
4.3 Aktivitas Scavenging Metode Penghambatan DPPH dari Minuman Cokelat
Karakteristik antioksidan berpengaruh terhadap mekanisme kerja antioksidan dalam tubuh manusia. Karakteristik antioksidan yang diukur dalam penelitian ini adalah scavenging activity. Scavenging activity menunjukkan kemampuan antioksidan dalam minuman cokelat untuk menurunkan konsentrasi radikal bebas murni DPPH
(1,1-diphenyl-2-picrylhydrazil). Prinsip dari uji ini adalah adanya donasi atom hidrogen dari
substansi yang diujikan kepada radikal DPPH menjadi senyawa non radikal difenilpikrilhidrazin yang akan ditunjukkan oleh perubahan warna (Molyneux, 2004). Perubahan warna yang akan terjadi adalah perubahan dari larutan yang berwarna ungu menjadi berwarna kuning (Pauly, 2001 dalam Rahayu dkk. 2009). Dengan demikian aktivitas penangkalan radikal bebas dapat dihitung dari peluruhan radikal DPPH. Intensitas perubahan
warna ini kemudian diukur pada spektrum absorpsi antara 515-520 nm pada larutan organik (metanol atau etanol) (Molyneux, 2004). Waktu inkubasi selama 20 menit diperlukan untuk memastikan radikal DPPH bekerja.
Berdasarkan Gambar 4.3, dapat dilihat bahwa aktivitas scavenging vitamin E dan minuman cokelat dari empat perlakuan berada pada kisaran 80-90%. Hasil uji ANAVA menunjukkan tidak ada perbedaan nyata pada aktivitas scavenging minuman cokelat, baik yang berasal dari minuman cokelat tanpa pemanasan, maupun yang mengalami perlakuan dipanaskan hingga mendidih, dicampur dengan air mendidih dan dipanaskan dengan
microwave. Hasil ini berlawanan dengan hipotesa awal, yaitu perbedaan
cara preparasi dalam pembuatan minuman cokelat akan menghasilkan minuman cokelat dengan aktivitas scavenging yang berbeda nyata. Hasil penelitian ini menyerupai hasil penelitian yang dilakukan oleh Dewi dan Dominika (2008) pada serbuk sarang semut yang menyimpulkan bahwa waktu dan suhu penyeduhan tidak mempengaruhi aktivitas antioksidan. Penelitian yang dilakukan oleh Zhang dan Hamauzu (2004) dalam Turkmen dkk. (2004) menyimpulkan bahwa metode pemasakan konvensional dengan
microwave tidak menunjukkan perbedaan signifikan terhadap aktivitas
antioksidan.
Aktivitas penangkalan radikal bebas DPPH minuman cokelat dari keempat cara preparasi dibandingkan dengan α-tokoferol (vitamin E) sebagai standar. Vitamin E merupakan antioksidan alami yang banyak digunakan sebagai penghambat reaksi oksidasi lipida dalam bahan makanan (Suryanto dkk. 2011). Konsentrasi yang digunakan adalah 200 ppm berdasarkan jumlah maksimum dalam makanan yang diperbolehkan dalam peraturan Uni Eropa (Pokorny dkk. 2001 dalam Alfarabi, 2010). Berdasarkan hasil penelitian, minuman cokelat yang diperoleh dari berbagai
33 cara preparasi memiliki aktivitas penangkalan radikal bebas DPPH yang tidak berbeda nyata dibandingkan dengan vitamin E (α 0,05).
78,000 80,000 82,000 84,000 86,000 88,000 90,000 92,000 0 5 10 15 20 25 % P en gh am bat an D P P H Menit ke-
Grafik Waktu Vs % Penghambatan DPPH pada Konsentrasi 200 ppm α-tokoferol P1 P2 P3 P4
Gambar 4.3 Grafik Waktu Vs % Penghambatan DPPH pada Konsentrasi 200 ppm
4.4 Hubungan Senyawa Fenolik dengan Aktivitas Antioksidan Tabel 4.1 menunjukkan hubungan antara senyawa fenolik dengan aktivitas antioksidan minuman cokelat. Total fenol, (-)-epikatekin dan (+)-katekin tidak berkorelasi secara signifikan terhadap aktivitas scavenging minuman cokelat. Hasil ini berbeda dengan hasil penelitian Pujimulyani dkk. (2010) yang menunjukkan bahwa senyawa fenolik dan flavonoid berhubungan nyata terhadap aktivitas scavenging. Senyawa fenolik yang tidak berhubungan nyata dengan aktivitas scavenging diduga disebabkan adanya komponen fenolik yang belum terekstrak dari lemak minuman cokelat.
Tabel 4.1 Hubungan Senyawa Fenolik dengan Aktivitas Antioksidan Minuman Cokelat
Senyawa Fenolik Aktivitas Antioksidan (DPPH)
Total fenol -0,269
(-)-epikatekin -0,738
(+)-katekin -0,654
35 BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Proses penyeduhan, perebusan sampai mendidih dan pemanasan dengan microwave pada pembuatan minuman cokelat meningkatkan kadar total fenol secara nyata, tapi tidak berpengaruh nyata terhadap kadar total flavonoid bila dibandingkan dengan pembuatan minuman cokelat tanpa perlakuan pemanasan. Perlakuan perebusan sampai mendidih dan pemanasan dengan microwave menghasilkan minuman cokelat dengan kadar total fenol yang tidak berbeda nyata, sedangkan perlakuan penyeduhan menghasilkan kadar total fenol paling tinggi.
Perbedaan cara preparasi tidak berpengaruh nyata terhadap aktivitas scavenging minuman cokelat. Scavenging activity minuman cokelat dengan berbagai cara preparasi tidak berbeda nyata dibandingkan dengan vitamin E.
5.2 Saran
Perlu dilakukan penelitian lebih lanjut terhadap kadar (-)-katekin dan prosianidin dalam minuman cokelat sehingga dapat diketahui hubungannya dengan aktivitas scavenging.
36
Akowuah, G. A., Mariam, A. dan Chin, J. H. 2009. The Effect of Extraction Temperature on Total Phenols and Antioxidant Activity of Gynura procumbens Leaf, Pharmacognosy Magazines Vol. 5
(17): 81-85.
Alfarabi, M. 2010. Kajian Antidiabetogenik Ekstrak Daun Sirih Merah
(Piper crocatum) IN VITRO. Tesis S-2.
http://repository.ipb.ac.id/bitstream/handle/123456789/41142/2010 mal.pdf (18 September 2012)
Ali, H. 2002. Protein-Phenolic Interactions in Food. Tesis S-2. http://digitool.library.mcgill.ca/view/action/singleViewer.do?dvs=13 48620653722~352&locale=en_US&show_metadata=false&VIEWE R_URL=/view/action/singleViewer.do?&DELIVERY_RULE_ID=6
&adjacency=N&application=DIGITOOL-3&frameId=1&usePid1=true&usePid2=true(26 September 2012). Astawan, M. 2011. Pangan Fungsional untuk Kesehatan yang Optimal.
http://www.pdgi-online.com/v2/index.php?option=com_ content&task=view&id=607&Itemid=1 (18 Februari 2012)
Badan Standarisasi Nasional (BSN). 2011. Konsumsi Coklat Rendah Hambat Industri Kakao. http://www.bsn.go.id/news_detail.php? news_id=3276 (15 Januari 2012)
Bansode, R. R., Xu, Z. M. dan Losso, J. N. 2002. Thermal Degradation of (±)-Catechin: Implications in Tea Brewing and Functional Foods. Abstrak. http://ift.confex.com/ift/2002/techprogram/paper_12611 .htm (20 September 2012)
Bowen, R. 2003. Free Radicals and Reactive Oxygen. http://www.vivo.colostate.edu/hbooks/pathphys/misc_topics/radicals .html (18 Februari 2012)
Chen, Z., Zhu, Q. Y., Tsang, D., Huang, Y. 2011. Degradation of Green Tea Catechins in Tea Drinks. Abstrak, Journal of Agricultural Food
37 Cronin, J. R. 2004. Comparing Antioxidant Values with The ORAC
Method. Alternative and Complementary Therapies Vol. 10 (3):
167-170.
Crozier, S. J., Preston, A. G., Hurst, J. W., Payne, M. J., Mann, J., Hainly, L. dan Miller, D. L.. 2011. Cacao Seeds are A “Super Fruit”: A Comparative Analysis of Various Fruit Powders and Products.
Chemistry Central Journal Vol. 5: 5.
Dai, J. dan Mumper, R. J. 2010. Plant Phenolics: Extraction, Analysis and Their Antioxidant and Anticancer Properties, Molecules Vol. 15:
7313-7352.
Dangles, O., Dufour, C. 2005. Flavonoids-Proteins Interactions. Flavonoids Chemistry, Biochemistry and Applications. New York: CRC Press. http://www.crcnetbase.com/doi/abs/10.1201/ 9781420039443.ch9 (25 September 2012)
Departemen Perindustrian. 2007. Gambaran Sekilas Industri Kakao. Artikel. https://www.kemenperin.go.id/PaketInformasi/Kakao/kakao .pdf (31 Januari 2012)
Dewi, Y. S. K. dan Dominika. 2008. Aktivitas Antioksidasi Ekstrak Fenol Umbi Sarang Semut (Hydnophytum Sp.) pada Berbagai Suhu Penyeduhan, Jurnal Agritech Vol. 28 (2): 91-96.
Fardaniah, R. 2011. Menyongsong Era Coklat Indonesia. Artikel. http://www.phinisinews.com/read/2011/6/27/3592-menyongsong_ era_cokelat_indonesia (15 Januari 2012)
Halim, F. 2011. Peran Senyawa Antioksidan dalam Permen Cokelat terhadap Pengaturan Tekanan Darah Manusia. Penulisan dan Seminar Ilmiah S-1. Surabaya: Fakultas Teknologi Pertanian, Universitas Katolik Widya Mandala Surabaya.
Halliwell, B., Aeschbach, R., Lolinger, J., Auroma, O. I. 1995. Toxicology, Journal of Food Chemistry Vol. 33: 601
Hassanbaglou, B., Hamid, A. A., Roheeyati, A. M., Saleh, N. M., Abdulamir, A. S., Khatib, A., Sabu, M. C. 2012. Antioxidant Activity of Different Extracts From Leaves of Pereskia bleo (Cactaceae), Journal of Medicinal Plants Research Vol. 6 (15):
2932-2937
Heldman, D. R., Singh, P. R.. 1984. Introduction to Food Engineering. London: Academic Press, Inc.
Hershey’s. 2010. Recipes by Product. Artikel. http://www.hersheys.com/recipes/recipe-search.aspx?cid=7&url Beverages.aspx&ICID=KH1427& ICID=KH1427 (2 Juni 2012) Hurst, W. J., Krake, S. H., Bergmeier, S. C., Payne, M. J., Miller, K. B.,
Stuart, D. A. 2011. Impact of Fermentation, Drying, Roasting and Dutch Processing on Flavan-3-ol Stereochemistry in Cacao Beans and Cocoa Ingredients, Chemistry Central Journal Vol. 5:53 Indonesian Commercial Newsletter (ICN). 2010. Perkembangan
Agribisnis Kakao di Indonesia. Artikel.
http://www.datacon.co.id/Agri-2010Kakao.html (12 Maret 2012) Irina, I., Mohamed, G. 2010. Biological Activities and Effects of Food
Processing on Flavanoids as Phenolic Antioxidants. France: Nancy University-ENSAIA.
http://www.intechopen.com/download/pdf/pdfs_id/26397 (15 Maret 2012)
Jalil, A. M. M., Ismail, A. 2008. Polyphenols in Cocoa and Cocoa Product: Is There a Link between Antioxidant Properties and Health?, Molecules Vol. 13: 2190-2219.
Karadag, A. Ozcelik, B., Saner, S. 2009. Review of Methods to Determine Antioxidant Capacities, Food Analytical Methods Vol.
2:41-60.
Kwik-Uribe, C., Bektash, R. M. 2008. Cocoa Flavanols: Measurement, Bioavailability and Bioactivity, Asia Pacific Journal Clinical
39 Lee, K. W., Kim, W. J., Lee H. J., Lee, C. Y. 2003. Cocoa Has More
Phenolic Phytochemicals and a Higher Antioxidat Capacity than Teas and Red Wine, Journal of Agricultural Food Chemistry Vol.
51: 7292-7295.
Li, N., Taylor, L. S., Mauer, L. J. 2011. Degradation Kinetics of Catechin in Green Tea Powder : Effects of Temperature and Relative Humidity. Abstrak, Journal of Agricultural Food Chemistry Vol. 59
(11): 6082-6090.
Medyaningsih, E. 2009. Potensi Ampas Nanas Sebagai Sumber Antioksidan: Karakterisasi Antioksidan Ampas Nanas dari Nanas yang telah Mendapat Perlakuan Blanching. Skripsi S-1. Surabaya: Fakultas Teknologi Pertanian, Universitas Katolik Widya Mandala Surabaya.
Molyneux, P. 2004. The Use of The Stable Free Radical Diphenylpicryl-hydrazyl (DPPH) for Estimating Antioxidant Activity. Journal of
Science and Technology Vol. 26 (2): 211-219.
Ortega, N., Romero, M., Macia, A., Reguant, J., Angles, N., Morello, J., Motilva, M. 2008. Obtention and Characterization of Phenolic Extracts from Different Cocoa Sources, Journal of Agricultural.
Food Chemistry Vol. 56: 9621-9627.
Othman, A., Ismail, A., Ghani, N. A., Adenan, I. 2007. Antioxidant Capacity and Phenolic Content of Cocoa Beans, Journal of Food
Chemistry Vol. 100: 1523-1530.
Othman, A., Jalil, A. M. M., Weng, K. K.., Ismail, A., Ghani, N. A., Adenan, I. Epicatehin Content and Antioxidant Capacity of Cocoa Beans From Four Different Countries, African Journal of
Biotechnology Vol. 9(7): 1052-1059.
Petry, R. D., Ortega, G. G., Silva, W. B. 2011. Flavonoid Content Assay: Influence of the Reagent Concentration and Reaction Time on the Spectrophotometric Behavior of the Aluminium Chloride-Flavonoid Complex. Abstrak, Pharmazie Vol. 56 (6): 465-470.
Pomeranz, Y, Meloan, C. E. 1971. Food Analysis: Theory and Practice. 3rd edition. USA: Chapman and Hall