Fitria Afrianty Ramadhaniah, 2013
KERAGAMAN BAKTERI ENDOFIT PADA KULTIVAR NANAS
(Ananas comosus (L.) Merr.) LEOR DAN DURI DI KABUPATEN SUBANG
SKRIPSI
Diajukan untuk Memenuhi Sebagian dari Syarat untuk Memperoleh Gelar Sarjana Biologi Jurusan Pendidikan Biologi
Oleh
Fitria Afrianty Ramdhaniah
0902068
PROGRAM STUDI BIOLOGI
JURUSAN PENDIDIKAN BIOLOGI
FAKULTAS PENDIDIKAN MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS PENDIDIKAN INDONESIA
Fitria Afrianty Ramadhaniah, 2013
Keragaman Bakteri Endofit Pada Kultivar Nanas (Ananas comosus (L.) Merr.) Leor Dan Duri Di Kabupaten Subang
Oleh
Fitria Afrianty Ramdhaniah
Sebuah skripsi yang diajukan untuk memenuhi salah satu syarat memperoleh gelar Sarjana pada Fakultas Pendidikan Matematika dan Ilmu Pengetahuan Alam
© Fitria Afrianty Ramdhaniah 2013
Universitas Pendidikan Indonesia
September 2013
Hak Cipta dilindungi undang-undang.
Skripsi ini tidak boleh diperbanyak seluruhya atau sebagian,
LEMBAR PENGESAHAN
KERAGAMAN BAKTERI ENDOFIT PADA KULTIVAR NANAS (Ananas comosus (L.) Merr.) LEOR DAN DURI DI KABUPATEN SUBANG
Oleh:
Fitria Afrianty Ramdhaniah 0902068
DISETUJUI DAN DISAHKAN OLEH:
PEMBIMBING I,
Dr. Topik Hidayat M.Si 197004101997021001
PEMBIMBING II,
Dr. Hj. Any Fitriani M.Si 196502021991032001
Mengetahui,
Fitria Afrianty Ramadhaniah, 2013
KERAGAMAN BAKTERI ENDOFIT PADA KULTIVAR NANAS (Ananas comosus (L.) Merr.) LEOR DAN DURI DI KABUPAEN SUBANG
ABSTRAK
Nanas (Ananas comosus (L.) Merr.) merupakan salah satu komoditas buah tropis dengan produksi terbesar kedua setelah pisang di Indonesia. Pada proses pematangan buah nanas terjadi perubahan fisiologi dan kimia. Perubahan kimia yang terjadi meliputi perubahan kandungan karbohidrat, etilen, asam, lipid dan protein. Sedangkan perubahan fisik meliputi perubahan warna, tekstur, dan perubahan citarasa. Kondisi ini juga dipengaruhi oleh adanya bakteri endofit. Penelitian ini bertujuan untuk mengetahui keragaman jenis bakteri endofit pada kultivar nanas Leor dan Duri. Metode yang digunakan, yaitu metode deskriptif, dengan menggunakan karakterisasi morfologi, pewarnaan Gram dan uji biokimiawi. Isolasi bakteri dari kultivar nanas Leor dan Duri dilakukan dengan teknik pengenceran, yaitu pada seri pengenceran ke- 10-2, 10-3, dan 10-4. Bakteri-bakteri yang ditemukan pada kultivar Leor Duri diduga mempunyai kemiripan dengan jenis Bacillus, Pseudomonas, Enterobacter, Citrobacter, Klebsiella, Pantoea, Erwinia, Acetobacter, Gluconobacter, Lactococcus dan Lactobacillus. Selain itu, diduga terdapat bakteri spesifik dari kedua kultivar tersebut. Pada nanas Duri diduga terdapat bakteri spesifik dari genus Gluconobacter, Lactocccus dan Lactobacillus, sedangkan pada nanas Leor diduga terdapat bakteri spesifik Citrobacter dan Pantoea. Hasil organoleptik menunjukkan nanas Duri memiliki aroma, rasa, tekstur dan warna yang lebih unggul dibandingkan dengan nanas Leor. Perbedaan keragaman bakteri dari kultivar Leor dan Duri berkesinambungan dengan hasil organoleptik. Sehingga hal ini dapat menunjukkan bahwa perbedaan bakteri endofit antara kultivar nanas Leor dan Duri diduga memiliki hubungan dengan karakteristik buah nanas dari warna, rasa, aroma dan tekstur.
DIVERSITY OF ENDOPHYTIC BACTERIA FROM PINEAPPLE (Ananas comosus (L.) Merr.) CULTIVARS LEOR AND DURI IN SUBANG
ABSTRACT
Pineapple (Ananas comosus (L.) Merr.) is one commodity tropical fruit with banana production in the second largest after Indonesia. In the process of fruit ripening pineapple physiological and chemical changes. Chemical changes that occur include changes in carbohydrate content, ethylene, acids, lipids and proteins. While the physical changes include changes in color, texture, and flavour. This condition is also influenced by the presence of endophytic bacteria. This study aims to determine the diversity of endophytic bacteria on pineapple cultivars Leor and Duri. The method used in this research is descriptive method, by using the characterization of morphology, Gram staining and biochemical tests. Isolation of bacteria from pineapple cultivars Leor and Duri cultivars were conducted by dilution, namely the serial-dilution to 10-2, 10-3, and 10-4. The bacteria found in the cultivar Leor Duri allegedly has some similarities with the type of Bacillus, Pseudomonas, Enterobacter, Citrobacter, Klebsiella, Pantoea, Erwinia, Acetobacter, Gluconobacter, Lactococcus and Lactobacillus. In addition, there are specific bacteria suspected of both the cultivars. At pineapple Duri allegedly contained the specific bacteria of the genus bacteria Gluconobacter, Lactobacillus and Lactocccus, while the pineapple Leor allegedly contained the specific Citrobacter and Pantoea. Organoleptic results indicate Duri have pineapple aroma, flavor, texture and color are superior to Leor pineapple. Differences in bacterial diversity of cultivars Leor and Duri continuous with organoleptic results. So that it can be shown that the difference between the endophytic bacteria pineapple cultivars Leor and Duri allegedly had a relationship with pineapple fruit characteristics of color, flavor, aroma and texture.
DAFTAR ISI
ABSTRAK ... i
DAFTAR ISI ... ii
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
BAB I PENDAHULUAN ... 1
A. Latar Belakang Masalah ... 1
B. Rumusan Masalah ... 3
C. Tujuan Penelitian ... 4
D. Batasan Masalah ... 4
E. Manfaat Penelitian ... 4
BAB II BAKTERI ENDOFIT, KARAKTERISASI DAN IDENTIFIKASI PADA BUAH NANAS ... 5
A. Bakteri ... 5
1. Morfologi Bakteri ... 5
2. Persyaratan Nutrisi dan Fisiologi Bakteri ... 7
a. Persyaratan Nutrisi Bakteri ... 7
b. Fisiologi Bakteri ... 10
B. Isolasi dan Identifikasi Bakteri ... 12
C. Deskripsi Umum Nanas (Ananas comosus (L.) Merr.) ... 13
1. Klasifikasi Nanas (Ananas comosus (L.) Merr.) ... 13
2. Morfologi Nanas (Ananas comosus (L.) Merr.) ... 14
3. Kultivar Nanas Ananas comosus (L.) Merr.) ... 14
D. Karakteristik Buah Nanas Ananas comosus (L.) Merr.) ... 16
E. Bakteri Endofit ... 17
B. Populasi dan Sampel ... 19
C. Lokasi dan Waktu Penelitian ... 19
D. Alat dan Bahan Penelitian ... 19
E. Langkah Kerja ... 21
1. Tahap Persiapan ... 21
2. Tahap Penelitian ... 21
a. Pengambilan Sampel Buah Nanas ... 21
b. Pengujian Organoleptik ... 21
c. Isolasi Bakteri dari Buah Nanas ... 22
d. Isolasi Biakan Murni Bakteri Hasil Kultivasi ... 24
e. Tahap Karakterisasi dan Identifikasi Bakteri ... 24
1) Pembuatan Preparat dengan Metode Pewarnaan Gram ... 24
a) Membuat Olesan Bakteri ... 24
b) Melakukan Pewarnaan Terhadap Olesan Bakteri ... 25
2) Uji Aktivitas Biokimia ... 25
a) Uji Hidrolisis Pati ... 25
b) Uji Hidrolisis Lipid ... 26
c) Uji Hidrolisis Kasein ... 26
d) Uji Hirolisis Gelatin ... 26
e) Uji Fermentasi Karbohidrat ... 27
f) Uji Produksi H2S ... 27
g) Uji Motilitas ... 27
h) Uji Reduksi Nitrat ... 27
i) Uji Reaksi Katalase ... 28
j) Uji Urease ... 28
k) Uji Oksidase ... 28
l) Uji IMVIC ... 29
1) Uji Indol ... 29
2) Uji Metil Merah ... 29
3) Uji Voges Proskauer ... 29
f. Identifikasi Bakteri ... 30
g. Alur Penelitian ... 31
BAB IV HASIL DAN PEMBAHASAN ... 32
A. Penanaman Sampel ... 32
B. Karakterisasi Bakteri Dua Kultivar Nanas Leor dan Duri ... 35
C. Karakterisasi Bakteri dari Dua Kultivar Nanas Leor dan Duri Berdasarkan Pewarnaan Gram dan KOH String Test ... 39
1. Pewarnaan Gram ... 39
2. KOH String Test ... 43
D. Uji Biokimia ... 50
1. Uji Hidrolisis (Pati, kasein, Lipid, Gelatin) ... 50
a. Hidrolisis Pati ... 50
b. Hidrolisis Kasein ... 50
c. Hidrolisis Lipid ... 51
d. Hirolisis Gelatin ... 51
2. Uji Motilitas ... 52
3. Uji Produksi H2S ... 52
4. Uji Reduksi Nitrat ... 53
5. Uji Reaksi Katalase ... 53
6. Uji Oksidase ... 54
7. Uji Urease ... 54
8. Uji IMVIC (Indol, Methyl-Red, Voges-Proskauer,Sitrat) ... 55
a. Uji Indol ... 55
b. Uji Metil Merah (MR) ... 55
c. Uji Voges Proskauer (VP) ... 55
d. Uji Sitrat ... 56
9. Uji Fermentasi Karbohidrat ... 56
a. Uji Fermentasi Karbohidrat Dekstrosa ... 56
b. Uji Fermentasi Karbohidrat Sukrosa ... 56
E. Identifikasi Bakteri ... 58
1. Bacillus ... 58
2. Pseudomonas ... 58
3. Enterobacter ... 59
4. Gluconobacter ... 59
5. Citrobacter ... 59
6. Lactococcus ... 60
7. Klebsiella ... 60
8. Erwinia ... 60
9. Pantoea ... 61
10. Acetobacter ... 61
11. Lactobacillus ... 61
F. Uji Organoleptik ... 62
G. Hubungan Karakteristik Buah dengan Keragaman Bakteri ... 64
BAB V KESIMPULAN ... 68
1. Kesimpulan ... 68
2. Saran ... 68
DAFTAR PUSTAKA ... 69
LAMPIRAN-LAMPIRAN 1. Lampiran 1 : Sampel Buah Nanas ... 75
2. Lampiran 2 : Protokol Pembuatan Reagen dan Medium yang Digunakan dalam Penelitian ... 76
A. Medium Biakan Bakteri ... 76
1. Medium Nutrien Agar (NA) ... 76
B. Medium Uji Aktivitas Biokimia ... 76
1. Medium Lipid ... 76
2. Medium Kasein ... 76
3. Medium Gelatin ... 76
4. Medium Kaldu Laktosa ... 77
5. Medium Kaldu Dekstrosa ... 77
7. Medium Uji Katalase ... 78
8. Medium Uji Reduksi Nitrat ... 78
9. Medium Uji Urease ... 78
10. Medium Uji MR-VP Broth ... 78
11. Medium Uji Sitrat ... 79
C. Reagen ... 79
1. Pembuatan Reagen Pewarnaan Gram ... 79
2. Pembuatan Larutan H202 3% ... 79
3. Pembuatan Reagen Uji Reduksi Nitrat ... 80
4. Pembuatan Reagen Uji Hidrolisis Pati (Larutan Lugol) ... 80
5. Pembuatan Reagen Kovac’s ... 80
6. Pembuatan Reagen Barrit’s ... 80
DAFTAR TABEL
Tabel 2.1 Fase Pertumbuhan pada Bakteri ... 11
Tabel 2.2. Kandungan Gizi Buah Nanas (Ananas comosus (L.) Merr.) ... 17
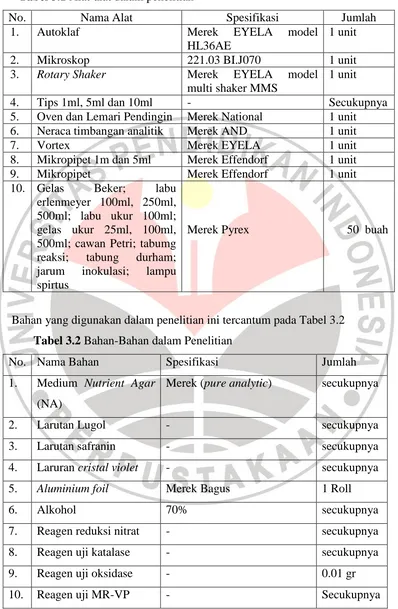
Tabel 3.1 Alat-alat dalam penelitian ... 20
Tabel 3.2 Bahan-Bahan dalam Penelitian ... 20
Tabel 3.3 Format Uji Organoleptik ... 22
Tabel 3.4 Keterangan Pengisian Form Pengujian Organoleptik ... 22
Tabel 4.1 Hasil Pengamatan Koloni Bakteri Kultivar Nanas Duri dan Nanas Leor . 33 Tabel 4.2 Hasil Uji Aktivitas Biokimia Dan Identifikasi 11 Bakteri Kultivar Nanas Leor Dan Nanas Duri ... 34
Tabel 4.3 Hasil Pewarnaan Gram dan KOH String Test ... 43
DAFTAR GAMBAR
Gambar 2.1. Struktur Dasar Sel Bakteri ... 6
Gambar 2.2 Bentuk Sel Bakteri ... 7
Gambar 2.3 Uji Aktivitas Biokimia pada Mikroorganisme ... 13
Gambar 2.4. Ananas comosus (L.) Merr.) ... 13
Gambar 2.5 Nanas Cayenne ... 15
Gambar 2.6 Nanas Queen ... 15
Gambar 2.7 Nanas Red Spanish ... 15
Gambar 2.8 Nanas Abacaxi ... 16
Gambar 3.1 Bagan Alur Penelitian ... 31
Gambar 4.1 Keragaman Morfologi Koloni Bakteri Nanas Duri ... 37
Gambar 4.2 Keragaman Morfologi Koloni Bakteri Nanas Leor ... 38
Gambar 4.3 Persentase Warna Koloni ... 39
Gambar 4.4 Hasil Pewarnaan Gram 11 Isolat Bakteri dari Kultivar Nanas Leor dan Nanas Duri, Umur Kultur 24 Jam Perbesaran 1000x ... 41
DAFTAR LAMPIRAN
Lampiran 1 Sampel Buah Nanas ... 75 Lampiran 2 Protokol Pembuatan Reagen dan Medium yang Digunakan dalam
1
BAB I
PENDAHULUAN
A.Latar Belakang Masalah
Nanas (Ananas comosus (L.) Merr.) merupakan salah satu tanaman buah tropika dengan produksi terbesar kedua setelah pisang dan menjadi komoditas buah yang penting di Indonesia (Hadiati et al., 2003). Nanas memiliki banyak kultivar, yang bervariasi dalam ukuran tanaman, buah, warna dan rasa daging buah, serta ada atau tidaknya duri pada daun. Menurut Nakasone dan Paull (Sari, 2002) berdasarkan karakteristik daun dan buah, nanas dapat dibedakan menjadi lima kelompok, yaitu: (1) Spanish (daun panjang kecil, berduri halus, buah bulat dengan mata datar), (2) Queen (daun pendek berduri tajam, buah lonjong mirip kerucut), (3) Abacaxi (daun panjang berduri kasar, buah silindris atau seperti piramida), (4) Cayenne (daun halus tidak berduri, buah besar) dan (5) Maipure (buah silinder, warna daging buah putih atau kuning tua, rasa lebih manis daripada Cayenne).
Kultivar nanas yang paling banyak ditanam di Indonesia adalah Cayenne dan Queen. Kultivar Cayenne dikenal dengan nama lokal nanas subang dan nanas minyak (bogor), sedangkan kultivar Queen dikenal dengan nama lokal seperti nanas bogor, palembang, pemalang, dan blitar (Meinarti, 2011). Perbedaan fisik tanaman nanas dapat disebabkan oleh perbedaan genotip, lingkungan atau interaksi keduanya (Hadiati et al., 2003). Di Kabupaten Subang, kultivar nanas Cayenne telah dikembangkan menjadi beberapa kultivar baru, salah satunya
adalah nanas Leor dan nanas Duri. Nanas Leor dan nanas Duri ini banyak digemari dan dikonsumsi oleh masyarakat sebagai konsumsi buah segar dan dijadikan sebagai bahan baku olahan dalam industri makanan dan minuman.
2
Fitria Afrianty Ramadhaniah, 2013
dan buah berwarna oranye sedangkan kultivar nanas Leor memiliki bentuk yang lonjong dan buah berwarna kuning.
Menurut Whiting (1970) rasa pada buah nanas merupakan perpaduan antara gula dan asam. Gula yang terkandung dalam nanas yaitu glukosa 2.32%, fruktosa 1.42%, dan sukrosa 7.89%. Asam-asam yang terkandung dalam buah nanas adalah asam sitrat, asam malat, dan asam oksalat. Jenis asam yang paling dominan yakni asam sitrat 78% dari total asam. Selama proses pematangan, buah nanas mengalami peningkatan bobot kotor maupun bersih, total padatan terlarut pada daging buah, peningkatan jumlah asam-asam dan penurunan kandungan air.
Buah nanas berdasarkan kegunaannya dibagi menjadi dua golongan, yaitu buah nanas konsumsi segar dan olahan atau buah kalengan. (Sudibyo et al., 1992) mengungkapkan standar buah olahan kandungan airnya 78.6-86.4%, kandungan asamnya 0.64-1.18% dan untuk buah konsumsi segar Padatan Terlarut Total di atas 12% dengan kandungan asam 0.5-0.6%. Buah nanas mempunyai nilai ekonomi penting, selain dapat dikonsumsi sebagai buah segar juga dapat diolah menjadi berbagai macam makanan dan minuman, seperti selai, sirup, buah kalengan, dan sebagainya (Dalimunthe, 2008).
3
Beberapa bakteri seperti Curtobacterium, Pseudomonas, Microbacterium dan Clavibacter ditemukan pada buah plum. Bakteri ini dapat menghambat bakteri lain yang merugikan pada buah plum (Janisiewicz et al., 2013). Menurut Steve (2004), bakteri Lactococcus menggunakan sitrat untuk memproduksi CO2
aseton dan diasetil. Diasetil inilah yang dapat menentukan rasa dan aroma pada sebuah produk.
Dewasa ini informasi mengenai bakteri endofit dan pengetahuan mengenai keragaman bakteri masih kurang, hal ini sangat penting dalam menunjang karakteristik buah nanas dalam memahami aktivitas metabolisme dan fungsional mikroba yang terkandung didalamnya. Untuk itu telah dilakukan penelitian mengenai identifikasi dan keragaman bakteri endofit pada kultivar nanas Leor dan Duri. Hasil penelitian yang diperoleh ini diharapkan dapat memberikan informasi mengenai bakteri endofit pada kultivar nanas Leor dan Duri yang dapat dimanfaatkan menjadi suatu pembanding dalam menentukan kualitas dari buah nanas tersebut.
B.Rumusan Masalah
Rumusan masalah dalam penelitian ini adalah:
“Bagaimana keragaman jenis bakteri endofit pada kultivar nanas Leor dan Duri?”. Berdasarkan rumusan masalah tersebut, maka dapat dibuat
menjadi beberapa pertanyaan penelitian, yaitu:
1. Bagaimana keragaman jenis bakteri endofit pada kultivar nanas Leor dan nanas Duri?
2. Apakah terdapat bakteri spesifik pada salah satu kultivar nanas Leor dan nanas Duri?
3. Bagaimana karakteristik buah nanas Leor dan nanas Duri yang meliputi rasa, aroma, warna, dan tekstur?
4
Fitria Afrianty Ramadhaniah, 2013 C.Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Untuk mengetahui keragaman bakteri endofit pada kultivar nanas Leor dan nanas Duri dari kebun nanas Pak Toto Mariuk di Jalan Cagak Kabupaten Subang, Jawa Barat.
2. Untuk melihat hubungan antara keragaman bakteri endofit dengan karakteristik buah nanas yang meliputi rasa, aroma, warna, dan tekstur.
D.Batasan Masalah
Agar penelitian ini memiliki arah dan ruang lingkup yang jelas, maka perlu adanya batasan masalah. Adapun batasan-batasan masalah dalam penelitian ini, yaitu:
1. Sampel nanas yang digunakan merupakan dua kultivar nanas Cayenne, yaitu kultivar nanas Leor dan nanas Duri yang berasal dari kebun nanas Pak Toto Mariuk di Jalan Cagak Kabupaten Subang, Jawa Barat.
2. Buah nanas yang akan digunakan adalah buah nanas yang matang, dilihat dari warna buah kuning kehijauan, aromanya tajam dan tekstur buah yang lunak. Umur tanaman (2 tahun 1 minggu) dan diambil pada satu lahan yang sama. 3. Bakteri yang akan diidentifikasi adalah sampai tahap genus.
4. Identifikasi bakteri berpedoman pada buku Bergey’s Manual Of Systematic Bacteriology Ninth Edition (1994).
E.Manfaat Penelitian
19
BAB III
METODE PENELITIAN
A.Jenis Penelitian
Penelitian yang dilakukan adalah penelitian dengan menggunakan metode deskriptif untuk mengidentifikasi keragaman bakteri endofit pada kultivar nanas (Ananas comosus (L.) Merr.) Leor dan Duri di Kabupaten Subang.
B.Populasi dan Sampel
1. Populasi yang digunakan dalam penelitian ini adalah bakteri endofit yang berasal dari dua kultivar buah nanas (Leor dan Duri).
2. Sampel yang digunakan dalam penelitian ini adalah semua bakteri yang tumbuh pada medium NA melalui pengenceran dari dua kultivar buah nanas (Leor dan Duri).
C.Lokasi dan Waktu Penelitian
Lokasi penelitian dilakukan di Laboratorium Mikrobiologi Jurusan Pendidikan Biologi FPMIPA Universitas Pendidikan Indonesia, Jl. Dr. Setiabudhi, No.229 Bandung. Penelitian dimulai dari bulan Maret sampai dengan bulan Juli 2013.
D.Alat dan Bahan Penelitian
20
Fitria Afrianty Ramadhaniah, 2013
Tabel 3.1 Alat-alat dalam penelitian
No. Nama Alat Spesifikasi Jumlah
1. Autoklaf Merek EYELA model
HL36AE
1 unit
2. Mikroskop 221.03 BI.J070 1 unit
3. Rotary Shaker Merek EYELA model
multi shaker MMS
1 unit
4. Tips 1ml, 5ml dan 10ml - Secukupnya
5. Oven dan Lemari Pendingin Merek National 1 unit
6. Neraca timbangan analitik Merek AND 1 unit
7. Vortex Merek EYELA 1 unit
8. Mikropipet 1m dan 5ml Merek Effendorf 1 unit
9. Mikropipet Merek Effendorf 1 unit
10. Gelas Beker; labu erlenmeyer 100ml, 250ml, 500ml; labu ukur 100ml; gelas ukur 25ml, 100ml, 500ml; cawan Petri; tabumg reaksi; tabung durham; jarum inokulasi; lampu spirtus
Merek Pyrex 50 buah
Bahan yang digunakan dalam penelitian ini tercantum pada Tabel 3.2
Tabel 3.2 Bahan-Bahan dalam Penelitian
No. Nama Bahan Spesifikasi Jumlah
1. Medium Nutrient Agar (NA)
Merek (pure analytic) secukupnya
2. Larutan Lugol - secukupnya
3. Larutan safranin - secukupnya
4. Laruran cristal violet - secukupnya
5. Aluminium foil Merek Bagus 1 Roll
6. Alkohol 70% secukupnya
7. Reagen reduksi nitrat - secukupnya
8. Reagen uji katalase - secukupnya
9. Reagen uji oksidase - 0.01 gr
21
E.Langkah Kerja
Adapun prosedur kerja yang dilakukan dalam setiap kegiatan adalah sebagai berikut:
1. Tahap Persiapan
Dalam tahap persiapan, yang dilakukan dalam setiap pengecekan alat dan bahan yang digunakan selama penelitian. Setelah lengkap semua kebutuhan penelitian, maka dilakukan sterilisasi botol sampel, beaker glass, labu Erlenmeyer, labu ukur, gelas ukur, cawan Petri, dan tabung reaksi serta peralatan lain yang harus disterilisasi untuk menghindari kontaminasi. Setelah sterilisasi selesai, maka dilakukan pembuatan medium NA untuk menumbuhkan bakteri dari buah nanas. Tiap tabung reaksi masing-masing berisi 5-7 medium NA untuk agar miring sebanyak 40 tabung. Tabung reaksi diisi 12-15 ml medium NA untuk pertumbuhan bakteri melalui cawan tuang.
2. Tahap Penelitian
Dalam tahap penelitian ini, dilakukan beberapa kegiatan yaitu pengambilan sampel buah nanas, isolasi bakteri dari buah nanas, isolasi biakan murni bakteri, dan identifikasi atau karakterisasi bakteri dari buah nanas yang berasal dari kebun nanas Pak Toto Mariuk di Jalan Cagak, Kabupaten Subang, Jawa Barat.
a. Pengambilan Sampel Buah Nanas
22
Fitria Afrianty Ramadhaniah, 2013 b. Pengujian Organoleptik
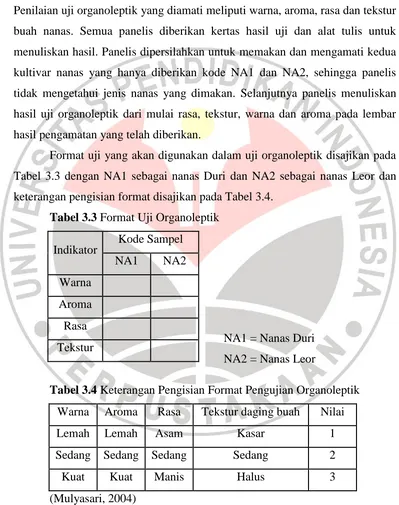
Uji organoleptik dilakukan terhadap 15 orang panelis yang berasal dari mahasiswa Universitas Pendidikan Indonesia untuk mengetahui respon terhadap tingkat kesukaan buah nanas dari kultivar nanas Leor dan nanas Duri. Penilaian uji organoleptik yang diamati meliputi warna, aroma, rasa dan tekstur buah nanas. Semua panelis diberikan kertas hasil uji dan alat tulis untuk menuliskan hasil. Panelis dipersilahkan untuk memakan dan mengamati kedua kultivar nanas yang hanya diberikan kode NA1 dan NA2, sehingga panelis tidak mengetahui jenis nanas yang dimakan. Selanjutnya panelis menuliskan hasil uji organoleptik dari mulai rasa, tekstur, warna dan aroma pada lembar hasil pengamatan yang telah diberikan.
Format uji yang akan digunakan dalam uji organoleptik disajikan pada Tabel 3.3 dengan NA1 sebagai nanas Duri dan NA2 sebagai nanas Leor dan keterangan pengisian format disajikan pada Tabel 3.4.
Tabel 3.3 Format Uji Organoleptik
Indikator Kode Sampel
NA1 NA2
Warna Aroma Rasa Tekstur
Tabel 3.4 Keterangan Pengisian Format Pengujian Organoleptik
Warna Aroma Rasa Tekstur daging buah Nilai
Lemah Lemah Asam Kasar 1
Sedang Sedang Sedang Sedang 2
Kuat Kuat Manis Halus 3
(Mulyasari, 2004)
23
c. Isolasi Bakteri dari Buah Nanas
Isolasi bakteri diambil dari bagian endofit buah nanas pada kedua kultivar nanas Leor dan nanas Duri. Sebelum dilakukan isolasi bakteri, kedua kultivar nanas melalui tahap sterilisasi permukaan. Sterilisasi permukaan ini dilakukan untuk untuk menghindari adanya kontaminasi dari bakteri atau jamur lain yang tidak diharapkan terbawa saat isolasi bakteri. Tahapan pertama, buah nanas dibersihkan dari kotoran dengan cara dicuci dengan air mengalir, kemudian merendamnya dengan alkohol 75% selama 2 menit dan dibilas dengan aquades steril sebanyak dua kali. Selanjutnya, sterilisasi permukaan dengan menggunakan larutan alkohol 75% selama 1 menit, Bayclin 25% selama 5 menit. Lalu membilas sampel dengan air steril sebanyak dua kali. Sampel direndam kembali dengan alkohol 75% selama 30 detik dan dibilas kembali sampel dengan aquades steril sebanyak tiga kali. Buah nanas yang telah melewati tahap sterilisasi permukaan, kemudian di jus secara aseptik dengan cara mencuplik bagian endofit (kulit dan daging) buah nanas menggunakan pisau dan ditimbang sebanyak 20 gram. Lalu ditambahkan 180 ml aquades dan diblender hingga halus, kemudian dimasukkan ke dalam erlenmeyer. Selanjutnya dilakukan metode pengenceran bertingkat.
24
Fitria Afrianty Ramadhaniah, 2013
d. Isolasi Biakan Murni Bakteri Hasil Kultivasi
Koloni bakteri yang telah tumbuh pada cawan Petri hasil kultivasi merupakan biakan umum yang hidup pada buah nanas. Setiap koloni diambil 1 ose yang ditumbuhkan pada medium NA miring agar dihasilkan biakan murni sehingga memudahkan tahap identifikasi selanjutnya. Proses ini dapat berulang beberapa kali untuk peremajaan kultur. Koloni yang telah terbentuk setelah masa inkubasi selama 24 jam pada suhu 30oC kemudian diamati pertumbuhannya dan karakterisasi bakteri dapat digunakan untuk proses pewarnaan Gram dan uji biokimia.
e. Tahap Karakterisasi dan Identifikasi Bakteri
Pada tahap ini, langkah penelitian yang dilakukan adalah pewarnaan Gram dan uji aktivitas biokimia sebagai tahap utama dalam identifikasi bakteri aerob yang ditemukam pada buah nanas. Identifikasi dilakukan dengan berbagai macam metode, yaitu membuat preparat dengan metode pewarnaan Gram dan melakukan uji aktivitas biokimia terhadap bakteri hasil isolasi (Kusnadi et al., 2003). Tahapan identifikasi dalam penelitian ini meliputi pembuatan preparat dengan metode pewarnaan Gram dan uji aktivitas biokimia bakteri.
1) Pembuatan Preparat dengan Metode Pewarnaan Gram
Pembuatan preparat dengan metode pewarnaa Gram dilakukan melalui dua tahap yaitu membuat olesan bakteri dan melakukan pewarnaan Gram terhadap olesan bakteri.
a) Membuat Olesan Bakteri
25
dengan garis tengah ± 2 cm dan dikeringkan diudara lalu difiksasi panas dengan melewatkan sediaan tersebut pada api sebanyak tiga kali.
b) Melakukan Pewarnaan terhadap Olesan Bakteri
Sediaan bakteri yang telah difiksasi, kemudian ditetesi pewarna karbol kristal violet dan didiamkan selama 3 menit. Kelebihan zat warna dibuang dan ditambahkan larutan lugol, didiamkan selama 45-60 detik. Selanjutnya, sediaan bakteri dialiri dengan larutan alkohol 96% selama 1 menit, lalu dibilas sediaan tersebut dengan botol semprot dan dikeringkan olesan tersebut dengan kertas isap. Kemudian ditambahkan larutan safranin O dan dibiarkan selama 3 menit, lalu dicuci dengan aquades dan dikeringkan di udara. Sebelum diamati di bawah mikroskop cahaya dengan menggunakan lensa obyektif 100x, sediaan tersebut ditetesi minyak imersi. Apabila warna koloni bakteri menunjukkan merah maka bakteri tersebut termasuk bakteri Gram negatif dan jika menunjukkan warna biru/ungu maka bakteri tersebut termasuk menunjukkan bakteri Gram positif.
2) Uji Aktivitas Biokimia
Uji aktiitas biokimia yang dilakukan dalam penelitian ini adalah uji hidrolisis pati, hidrolisis lipid, hidrolisis kasein, hidrolisis gelatin, uji fermentasi karbohidrat, uji produksi H2S, uji reduksi nitrat, uji reaksi
katalase, uji urease, uji oksidase dan uji IMVIC yang terdiri dari uji Indol, uji Metil merah, uji Voges Proskeur dan uji sitrat. Uji aktivitas biokimia ini berpedoman pada buku (Cappuccino & Sherman, 2005).
a) Uji Hidrolisis Pati
26
Fitria Afrianty Ramadhaniah, 2013
perubahan warna yang terjadi pada sekitar koloni. Hasil positif ditunjukkan dengan terbentuknya zona bening disekitar koloni setelah diteteskan iodium.
b)Uji Hidrolisis Lipid
Bakteri yang telah diisolasi dari buah nanas dalam cawan Petri yang berisi medium agar pati diinokulasi lalu diinkubasi selama 1x24 jam pada suhu 37oC, kemudian diamati perubahan daerah suram/merah pada medium lipid menjadi daerah bening/terang di sekitar pertumbuhan koloni diakibatkan oleh reaksi kemampuan bakteri menghidrolisis lipid agar menjadi asam lemak dan gliserol (Syulasmi et al., 2009).
c) Uji Hidrolisis Kasein
Bakteri yang telah diisolasi dari buah nanas dalam cawan Petri yang berisi medium agar kasein diinokulasi lalu diinkubasi selama 1x24 pada suhu 37oC, kemudian diamati perubahan warna yang terjadi pada sekitar koloni. Hasil positif ditunjukkan dengan adanya area bening di sekitar koloni.
d)Uji Hidrolisis Gelatin
27
e) Uji Fermentasi Karbohidrat
Bakteri yang telah diisolasi dari buah nanas dalam 1 tabung reaksi yang berisi medium fenol red laktosa dan tabung Durham, 1 tabung reaksi berisi medium fenol red sukrosa dan tabung Durham dan 1 tabung reaksi berisi medium fenol red destroksa dan tabung Durham. Semuanya diinokulasi lalu diinkubasi selama 1x24 jam pada suhu 37oC, kemudian diamati perubahan warna pada medium dan ada atau tidaknya gelembung udara pada tabung Durham.
f) Uji Produksi H2S
Bakteri yang telah diisolasi dari buah nanas dalam tabung reaksi yang berisi medium Sulfate Indol Motily (SIM) dengan menggunakan ose lurus ditusukkan pada medium dan diinokulasi lalu diinkubasi selama 1x24 jam pada suhu 37oC, dan disimpan pada inkubator suhu 4oC selama 30 menit. Kemudian diamati perubahan warna medium dari kuning menjadi kehitaman.
g) Uji Motilitas
Bakteri yang telah diisolasi dari buah nanas dalam tabung reaksi yang berisi medium SIM agar dan diinokulasi lalu diinkubasi selama 1x24 jam pada suhu 37oC, lalu disimpan pada inkubator suhu 4oC selama 30 menit. Kemudian diamati perubahannya, jika timbul kekeruhan seperti kabut menandakan hasil positif.
h)Uji Reduksi Nitrat
28
Fitria Afrianty Ramadhaniah, 2013
medium yang tidak mengalami perubahan warna, selanjutnya ditambahkan zinc powder secukupnya dan diamati perubahan yang terjadi. Jika terjadi perubahan warna medium putih kekuningan menjadi merah, maka reaksi menunjukkan hasil negatif dan bila tidak menunjukkan perubahan warna, maka reaksi menunjukkan hasil positif.
i) Uji Reaksi Katalase
Bakteri yang telah diisolasi dari buah nanas dalam tabung reaksi yang berisi 7 ml medium NA diinokulasi lalu diinkubasi selama 1x24 jam pada suhu 37oC, lalu ditetesi H2O2 3% dan diamati ada atau tidak
adanya gelembung udara di atas permukaan kultur bakteri. Munculnya gelembung-gelembung gas menunjukkan hasil positif.
j) Uji Urease
Bakteri yang telah diisolasi dari buah nanas dalam tabung reaksi yang berisi medium urea diinokulasi lalu diinkubasi selama 1x24 pada suhu 37oC, kemudian diamati perubahan warna pada medium. Hasil positif ditunjukkan dengan perubahan warna pada medium menjadi merah muda.
k)Uji Oksidase
29
l) Uji IMVIC
Uji IMVIC digunakan untuk membedakan bakteri enterik (Family Enterobacteriaceae seperti Enterobacter). Terdiri dari Uji Indol, Uji Methyl Red dan Uji Voges-Proskauer (MR-VP), serta Uji Simmon’s sitrat. Uji IMVIC tersebut sebagai berikut:
a) Uji Indol
Bakteri yang diisolasi dari buah nanas dalam tabung reaksi yang berisi medium tryptone broth diisolasi lalu diinkubasi selama 1x24 jam pada suhu 37oC, kemudian diteteskan 3-5 tetes reagen Kovacks dengan menggunakan pipet tetes dan diamati ada atau tidaknya pembentukkan cincin pada medium. Hasil positif menunjukkan terbentuknya cincin merah pada permukaan medium dan hasil negatif menunjukkan warna kuning atau coklat pada permukaan medium.
b) Uji Metil Merah
Menginokulasi bakteri yang diisolasi dari buah nanas dalam tabung reaksi yang berisi medium MR-VP broth dan diinkubasi selama 24 jam pada suhu 37oC. Lalu hari berikutnya diteteskan 3-5 tetes methyl red pada tabung dan dihomogenkan. Diamati perubahan warna pada medium, jika medium berwarna merah setelah penambahan reagen methyl red maka menunjukkan hasil positif sedangkan jika medium berwarna kuning maka menunjukkan hasil negatif.
c) Uji Voges Proskauer
30
Fitria Afrianty Ramadhaniah, 2013
reagen VP B (yang mengandung KOH), lalu dikocok hingga homogen dan didiamkan selama 15-20 menit. Selanjutnya diamati perubahan warna pada medium kultur bakteri, reaksi positif ditunjukkan dengan adanya perubahan warna menjadi pink atau merah yang mengindikasikan adanya aseton. Sedangkan reaksi negatif ditunjukkan dengan tidak berubahnya warna medium menjadi warna tembaga.
d) Uji Simmon’s Sitrat
Menginokulasi bakteri yang diisolasi dari buah nanas dalam
tabung reaksi yang berisi medium Simmon’s sitrat agar dan diinkubasi
selama 24 jam pada suhu 37oC. Kemudian diamati perubahan pada medium, reaksi positif ditunjukkan dengan perubahan warna hijau medium menjadi warna biru. Sedangkan reaksi positif ditunjukkan dengan tidak adanya perubahan warna pada medium (tetap hijau).
f. Identifikasi Bakteri
Setelah sampling buah nanas dilakukan dan dihasilkan kultur bakteri biakan murni pada medium agar miring, maka kultur bakteri dari buah nanas akan diidentifikasi melalui reaksi pewarnaan Gram, KOH string test dan uji biokimia agar diketahui karakteristik bakteri sebagai tahap identifikasi yang diharapkan. Karakteristik bakteri tersebut kemudian dicocokkan dengan
31
g. Alur Penelitian
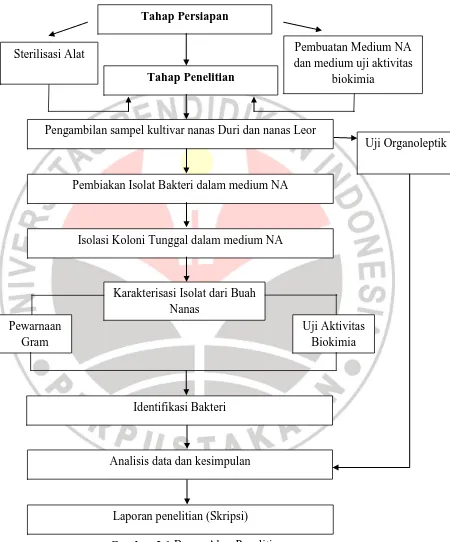
[image:32.595.115.565.126.668.2]Bagan alur penelitian dapat dilihat pada Gambar 3.1.
Gambar 3.1 Bagan Alur Penelitian Tahap Persiapan
Sterilisasi Alat Pembuatan Medium NA
dan medium uji aktivitas biokimia
Tahap Penelitian
Pengambilan sampel kultivar nanas Duri dan nanas Leor
Pembiakan Isolat Bakteri dalam medium NA
Karakterisasi Isolat dari Buah Nanas
Isolasi Koloni Tunggal dalam medium NA
Analisis data dan kesimpulan
Laporan penelitian (Skripsi)
Uji Organoleptik
Identifikasi Bakteri Pewarnaan
Gram
69 Fitria Afrianty Ramadhaniah, 2013
BAB V
KESIMPULAN
1. Kesimpulan
Hasil pengamatan keragaman bakteri endofit pada dua kultivar nanas (Ananas comosus (L.) Merr.) Leor dan nanas Duri diduga menghasilkan 11 isolat bakteri. Diduga bakteri-bakteri itu adalah dari genus Bacillus, Pseudomonas, Enterobacter, Gluconobacter, Citrobacter, Lactococcus, Klebsiella, Erwinia,
Pantoea, Acetobacter dan Lactobacillus. Selain itu, diduga terdapat bakteri
spesifik dari masing-masing kultivar nanas Leor dan nanas Duri. Pada nanas Duri diduga terdapat bakteri spesifik dari genus Gluconobacter, Lactocccus dan Lactobacillus, sedangkan pada nanas Leor diduga terdapat bakteri spesifik
Citrobacter dan Pantoea. Perbedaan keragaman bakteri dari kultivar nanas Leor
dan nanas Duri tersebut berkesinambungan dengan hasil organoleptik yang menunjukkan bahwa nilai uji pada nanas Duri lebih unggul dibandingkan dengan nanas Leor, yaitu karakteristik warna sebesar 2,7 atau 90%, aroma sebesar 2,53 atau 84,3%, rasa 2,6 atau 86,67%, dan tekstur 2,4 atau 80%. Sehingga hal ini dapat menunjukkan bahwa perbedaan bakteri endofit antara kultivar nanas Leor dan Duri diduga memiliki hubungan dengan karakteristik buah nanas dari warna, rasa, aroma dan tekstur.
2. Saran
70
DAFTAR PUSTAKA
Anwar, N. (2007). Pengaruh Media Multiplikasi Terhadap Pembentukan Akar pada Tunas In Vitro Nenas ( Ananas comosus (L.) Merr.) cv. Smooth Cayenne di Media Pengakaran. Skripsi Sarjana Pertanian pada Fakultas Pertanian. Institut Pertanian Bogor. [Online]. Tersedia: http://repository.ipb.ac.id/bitstream/handle/123456789/44695/A07nan.pdf (12 Juli 2013).
Birana, S., Baharuddin., Rahim, D. (2012). Keragaman Bakteri Antagonis Di Lahan Pertanian Tana Toraja Dan Uji Kemampuan Menekan Ralstonia Solanacearum Penyebab Penyakit Layu Bakteri Pada Kentang Secara In-Vitro. Skripsi Sarjana Pertanian pada Fakultas Pertanian. Universitas Hasanuddin Makassar. [Online]. Tersedia: http://unhas.ac.id/pertanian/index (05 April 2013).
Campbell NA, Reece JB, Mitchell LG. 2002. Biologi Jilid 1. Jakarta: Erlangga
Cappucino, J.G., Sherman, N (2005). Microbiology: A Laboratory Manual. (Seventh Edition). New York: Addison-Wesley Publishing company.
Cronqruist, A. (1981). An Integrated System Of Classification Of Flowering Plants. Columbia: Columbia University Press. New York.
Cyberbiology. (2008). Asosiasi Isolat-isolat Bakteri Pereduksi Nitrat Indigenous yang Diisolasi dari Waduk Sutami. [Online]. Tersedia: http//www.cyberbiology.livejournal.com/bio-cyber.htm. (21 Juli 2013).
Dalimunthe, F. S. (2002). Analisis Usaha Tani Nenas (Ananas comosus (L.) Merr) Dengan Standar Prosedur Operasional (SPO) (Kasus: Desa Cipelang Kecamatan Cijeruk Kabupaten Bogor). Skripsi Sarjana Pertanian pada Fakultas Pertanian. Institut Pertanian Bogor. [Online]. Tersedia: http://repository.ipb.ac.id/bitstream/handle/123456789/2850/A08sfd.pdf (13 Mei 2013).
Departemen Pertanian. (2004). Pedoman Sistem Jaminan Mutu Melalui Standar Prosedur Operasional (SPO) Nenas Kabupaten Subang. Direktorat Jenderal
Tanaman Buah. Jakarta. [Online]. Tersedia:
http://ditbuah.hortikultura.deptan.go.id. pdf (05 April 2013).
Dwidjoseputro, D. (1982). Dasar-dasar Mikrobiologi. Malang: FPP Universitas Brawijaya. Djambatan.
71
Fitria Afrianty Ramadhaniah, 2013
Utara. [Online]. Tersedia: http://library.usu.ac.id/download/fp/hutan-deni%20elfiati.pdf (12 April 2013).
Hadiati, S., S. Purnomo, Y. Meldia, I. Sukmayadi, Kartono. (2003). “Karakterisasi dan Evaluasi Beberapa Aksesi Nanas”. J. Hort 13(3): 157-168. [Online]. Tersedia:http://www.pustaka.litbang.deptan.go.id/bptpi/lengkap/IPTANA/fu llteks/JHORTI/2003/13303_2.pdf (13 Mei 2013).
Hartini, A. (2004). Isolasi Bakteri Endofit Dan Pengujian Potensinya Untuk Mengendalikan Nematoda Meloidogyne spp. Pada Tanaman Tomat (Lycopersicon esculentum Mill.). Skripsi Sarjana. Fakultas Pertanian Institut Pertanian Bogor: Diterbitkan
Hung, P. Q, and K. Annapurna. (2004). “Isolation and Characterization of Endophytic Bacteria in Soybean (Glycine sp.)”. Omonrice 12: 92-101 [Online]. Tersedia: http://www.clrri.org/ver2/uploads/noidung/12-13.pdf (05 Mei 2013).
Iday, S. (2005). Isolasi dan Karakterisasi Bakteri Besi di Sekitar Wilayah Kota Bandung. Skripsi Sarjana Sains Biologi pada Fakultas Pendidikan dan Ilmu Pengetahuan Alam. Universitas Pendidikan Indonesia. Bandung. Tidak diterbitkan.
Irfandi. (2005). Karakterisasi Morfologi Lima Populasi Nanas (Ananas comosus (l.) Merr.). Skripsi Sarjana Pertanian pada Program Studi Hortikultura. Fakultas Pertanian. Institut Pertanian Bogor. [Online]. Tersedia: http://repository.ipb.ac.id/bitstream/handle/123456789/12566/A05irf.pdf?se quence=1.pdf (17 Juni 2013).
Janisiewicz, W, J,. Jurick, W, M,. Vico, I,. Peter, K, A,. Buyer, J, S,. (2013). “Culturable Bacteria From Plum Fruit Surfaces And Their Potential For Controlling Brown Rot After Harvest”. Postharvest Biology And
Technology. Volume 76. [Online]. Tersedia:
http://www.sciencedirect.com/science/article/pii/S0925521412002335 (05 Mei 2013).
Kaga, H., Mano, H., Tanaka, F., Watanabe, A., Kaneko, S dan Morisaki, H. (2009). “Rice Seeds as Sources of Endophytic Bacteria”. Microbes Environ. Vol. 24, No. 2, 154–162. [Online]. Tersedia: http://wwwsoc.nii.ac.jp/jsme2/. (17 Juni 2013).
72
Kobayashi D.Y., J.D.Palumbo. (2000). “Bacterial Endophytes And Their Effects On Plants And Uses In Agriculture”. In: Bacon CW, White JF (eds) Microbial Endophytes. Marcel Dekker, New York, pp 199–233 [Online] Tersedia: http://www.bashanfoundation.org.pdf (20 Agustus 2013).
Kurnianto, A. (2013). Bakteri-bakteri Baik Sahabat Manusia. [Online]. Tersedia: http;//sains.me/70/bakteri-bakteri-baik-sahabat-manusia.html/ (17 Juli 2013).
Kusnadi., Peristiwati., Syulasmi, A., Purwianingsih, W., Rochintaniawati, D. (2003). Mikrobiologi. Bandung: JICA-IMSTEP.
Malihah. (2006). Karakteristik Morfologi dan Kualitas Buah Nenas (Ananas comosus (L.) Merr.) dari Empat Populasi di Kecamatan Cijeruk Kabupaten Bogor. Skripsi Sarjana Pertanian pada Fakultas Pertanian. Institut Pertanian
Bogor. [Online] Tersedia:
http://repository.ipb.ac.id/handle/123456789/50535 (05 April 2013).
Meinarti, C. (2011). Analisis Keragaman Genetik Nenas (Ananas comosus (L.) Merr.) Berdasarkan Penanda Morfologi dan Penanda RAPD. Tesis pada Program Sekolah Pascasarjana. Institut Pertanian Bogor. [Online] Tersedia: http://repository.ipb.ac.id/bitstream/handle/123456789/56662/.pdf (12 Juli 2013).
Morton, J.F. (1987). “Fruits of Warm Climates”. [Online] Tersedia: http://www.hort.purdue.edu/newcrop/ morton/pineapple/html#description# (13 Juli 2013).
Mulyasari, Y. (2004). Evaluasi Sifat Kimiawi dan Organoleptik Beberapa Varietas Apel (Malus sylvestris sp.). Skripsi Sarjana Teknik Pertanian pada Fakultas Teknik. Universitas Pasundan. Bandung. Tidak diterbitkan.
Murtiyono, E. (2011). Peran Mikrobiologi Dalam Penanaman, Pasca Panen Dan Pengolahan Limbah Nanas (Ananas Comosus (L.) Merr). Fakultas Pertanian. Universitas Kristen Satya Wacana. Salatiga. [Online] Tersedia: http://ekomurtiyono.files.mikrobiologi.nanas1.doc (13 Juli 2013).
Nani, R. (2010). Faktor-Faktor Yang Mempengaruhi Pertumbuhan Mikroba Pada Bahan Pangan. Bahan Ajar Mikrobiologi Pangan. Fakultas Teknik. Universitas Negeri Yogyakarta. [Online]. Tersedia : http://staff.uny.ac.id/ (21 Juli 2013).
73
Fitria Afrianty Ramadhaniah, 2013
Peleczar, M.J. & Chan., E.C.S. (1988). Dasar-dasar Mikrobiologi. Jakarta: Universitas Indonesia Press.
Raihana, N. (2011). Profil Kultur Dan Uji Sensitivitas Bakteri Aerob Dari Infeksi Luka Operasi Laparatomi Di Bangsal Bedah Rsup Dr. M. Djamil Padang. Program Pascasarjana. Universitas Andalas Padang. Padang. [Online]. Tersedia:http://pasca.unand.ac.id/id/wp-ontent/uploads/2011/09/artikel5.pdf (13 Juli 2013).
Poedjiadi, A. (1994). Dasar-dasar Biokimia. Jakarta: Universitas Indonesia Press.
Purwoko, Tjahjadi. 2009. Fisiologi Mikroba. Bumi Aksara : Jakarta.
Santoso, B, B. 2006. Standarisasi Mutu Produk Pasca Panen. Handout Mata Kuliah Pertanian. Fakultas Pertanian. Universitas Mataram. [Online]. Tersedia:http://fp.unram.ac.id/data/DR.BambangBSantoso/BahanAjarPasca panenHortikultura/Bab-5StandarisasiMutuProduk-b.pdf (13 Juli 2013).
Santoso, B. B. 2006. Fisiologi dan Biokimia Pada Komoditi Hortikultura Panenan. Handout Mata Kuliah Pertanian. Fakultas Pertanian. Universitas Mataram. [Online]. Tersedia:http://fp.unram.ac.id/data/.pdf (13 Juli 2013).
Santoso, B. B. 2006. Penanganan Pascapanen Buah. Handout Mata Kuliah Pertanian. Fakultas Pertanian. Universitas Mataram [Online]. Tersedia:http://fp.unram.ac.id/data/.pdf (13 Juli 2013).
Sari, N. F. (2002). Analisis Keragamaan Morfologi dan Kualitas Buah Populasi Nenas (Ananas comosus (L.) Merr.) Queen di Empat Desa Kabupaten Bogor. Skripsi Sarjana Pertanian pada Program Studi Budi Daya Pertanian. Fakultas Pertanian. Institut Pertanian Bogor. [Online]. Tersedia: http://repository.ipb.ac.id/bitstream/handle/123456789/23244/A02rns_abstr act.pdf (21 Juli 2013).
Schlegel, H, G. (1994). Mikrobiologi umum. Gajah Mada University Press.
Siagian A. (2002). Mikroba Patogen pada Makanan dan Sumber Pencemarannya. Sumatera Utara: USU digital library. [Online]. Tersedia: http://repository.usu.ac.id/bitstream/123456789/3672/1/fkm-albiner3.pdf (21 Juli 2013).
74
http://ditbuah.hortikultura.deptan.go.id/admin/layanan/SOP_Nenas_Subang. pdf (18 April 2013).
Suriaman, E. (2010). Potensi Bakteri Endofit Dari Akar Tanaman Kentang (Solanum Tuberosum) Dalam Memfiksasi N2 Di Udara Dan Menghasilkan Hormon IAA (Indole Acetid Acid) Secara In Vitro. Skripsi Sarjana Sains pada Program Studi Biologi. Fakultas Sains Dan Teknologi. Universitas Islam Negeri Malang (Uin). Maulana Malik Ibrahim. Malang. [Online]. Tersedia: http://lib.uin-malang.ac.id/files/thesis/fullchapter/05520040.pdf (01 Agustus 2013).
Susanti, D. (2012). Kajian Pemanfaatan Enzim Bromeilin dari Limbah Kulit Nanas (Ananas Comosus (L) Merr) Untuk Melunakkan Daging. Skripsi Sarjana Sains pada Program Studi Kimia. Jurusan Kimia. Fakultas Matematika Dan Ilmu Pengetahuan Alam. Universitas Negeri Medan. Medan. [Online]. Tersedia: http://digilib.unimed.ac.id/public/UNIMED-Undergraduate-22569.pdf (01 Agustus 2013).
Susilowati D.N., Saraswati, R., Elsanti., Yuniarti E. 2003. Isolasi dan Seleksi Mikroba Diazotrof Endofitik dan Penghasil Zat Pemacu Tumbuh pada
Tanaman Padi dan Jagung. [Online]. Tersedia:
http://biogen.litbang.deptan.go.id/terbitan/prosiding/fulltext_pdf/prosiding2 003_ 128-144_susilowati_isolasi.pdf. (5 April 2013)
Susiwi, S. (2009). Penilaian Organoleptik. Handout mata kuliah Regulasi Pangan
(KI 531). FPMIPA UPI [Online]. Tersedia:
http://file.upi.edu/Direktori/FPMIPA/JUR._PEND._KIMIA/195109191980 032-SUSIWI/SUSIWI-32)._Penilaian_Organoleptik.pdf (23 Juni 2013).
Syulasmi, A., Hamdiyanti, Y., Kusnadi. (2012). Petunjuk Praktikum Mikrobiologi. Bandung: FPMIPA UPI.
Steve T. (2004). Advances in Food and Nutrition Research, Vol. 50. Academic
Press. ISBN 978-0-12-016450-9. [Online]. Tersedia:
http://id.wikipedia.org/wiki/Bakteri_asam_laktat diakses (17 Agustus 2013).
Tarigan, J. (1988). Pengantar Mirobiologi. Jakarta. Departemen Pendidikan dan Kebudayaan. Direktorat Jenderal Pendidikan Tinggi.
Tjitrosoepomo, G. (1993). Taksonomi Tumbuhan Berbiji (Spermatophyta). Yogyakarta: Gadjah Mada University Press.
75