UJI STABILITAS FERRAT TERHADAP BEBERAPA KONDISI FISIKOKIMIAWI
Armando F. Sembiring1, Roto1* dan Nurul Hidayat A.1
1Laboratorium Kimia Analitik, Jurusan Kimia, Fakults MIPA
Universitas Gadjah Mada, SekipUtara, Yogyakarta 55281
*Contact person : tel/fax : (0274)545188 ; email : roto05@ugm.ac.id
INTISARI
Dalam upaya mengetahui pengaruh kondisi fisikokimiawi terhadap stabilitas ferrat telah dilakukan uji pengaruh perubahan pH, temperatur, paparan sinar UV, dan pengaruh kondisi udara luar terhadap absorbansi ferrat.
Penelitian ini diawali dengan sintesis ferrat lalu dilanjutkan dengan karakterisasi menggunakan spektrofotometer UV-Vis, Inframerah, dan difraktometer sinar X. Uji pengaruh kondisi fisikokimiawi terhadap stabilitas ferrat dilakukan dengan cara mengamati perubahan absorbansi ferrat sebagai fungsi waktu. Uji pengaruh kondisi udara dilakukan dalam 3 kondisi, yaitu wadah terbuka, tertutup, dan atmosfir nitrogen. Dalam uji pengaruh paparan sinar UV, ferrat diletakkan di dalam reaktor UV sedangkan untuk pengujian pengaruh pH dilakukan dengan mengatur pH larutan ferrat dengan menggunakan larutan buffer pada pH 6, 7, 8, 9, 10.
Hasil penelitian menunjukkan bahwa ferrat hasil sintesis memiliki serapan
maksimum (λmaks) pada panjang gelombang 505 nm. Stabilitas optimum ferrat didapatkan
pada pH 9 dan temperatur 27 °C. Dengan menggunakan persaman laju reaksi orde 2
didapatkan nilai k dalam reaksi ferrat yang terpapar sinar UV adalah 3 x 10-4 s-1
sedangkan dalam kondisi udara terbuka didapatkan nilai k sebesar 2 x 10-5 s-1. Ferrat
memiliki kestabilan yang baik dalam atmosfir nitrogen sedangkan dengan paparan sinar UV, ferrat akan tereduksi secara cepat.
Kata kunci : ferrat, stabilitas, fisikokimiawi, absorbansi, reduksi
PENDAHULUAN
Oksidasi merupakan salah satu reaksi kimia penting. Contoh oksidator yang banyak dipakai adalah Cr2O72- (Cr6+), MnO4- (Mn7+), dan
lain-lain. Namun demikian, kebutuhan akan oksidator-oksidator baru dan mulai diperhatikannya penggunaan senyawa kimia yang ramah lingkungan menyebabkan banyaknya penelitian yang dilakukan untuk menemukan spesies-spesies baru yang dapat berfungsi sebagai oksidator yang baik dan juga ramah lingkungan.
Besi (Fe) mulai diteliti untuk dapat digunakan sebagai oksidator. Pada umumnya, Fe
banyak di temukan dengan bilangan oksidasi +2 dan +3. Namun demikian, pada kondisi tertentu dapat terbentuk spesies Fe dengan bilangan oksidasi +5 atau + 6 (Turova, 1997). Spesies Fe dengan bilangan oksidasi +6 yang dikenal
sebagai ion ferrat ( ) merupakan oksidator
yang kuat. Hal ini dapat dilihat melalui nilai potensial reduksi yang memiliki nilai yang lebih besar daripada oksidator permanganat dan bikromat (Tabel 1.1). Ferrat, menurut Carr (1985), memiliki serapan pada panjang gelombang 505 nm dan memiliki absorbtivitas
serapan pada panjang gelombang tersebut, maka ferrat akan memiliki warna merah-keunguan yang cukup pekat (warna komplemennya). Warna merah-keunguan inilah yang menjadi ciri khas dari larutan ferrat.
Metode yang digunakan untuk mensintesis ferrat adalah dengan cara
mengoksidasi garam Fe3+ dengan menggunakan
NaOCl pada kondisi basa (Li, et al., 2005). Reaksi dalam sintesis ferrat dengan menggunakan metode basah dapat dilihat pada reaksi 1.
Selain bersifat sebagai oksidator kuat, ferrat juga memiliki sifat lainnya yang tidak dimiliki oleh oksidator-oksidator pada umumnya, yaitu sifat ramah lingkungan. Hasil akhir dari reaksi oksidasi oleh ferrat adalah berupa garam
sukar larut, Fe(OH)3, yang akan segera
terendapkan dan tidak bersifat toksik (Sharma, 2007).
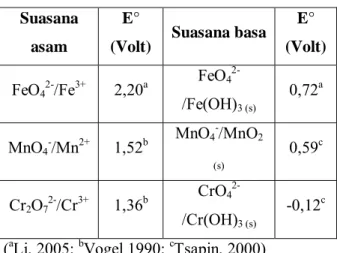
Tabel I.1 Potensial reduksi ferat dan oksidator lainnya dalam suasana asam dan basa
Suasana asam
E°
(Volt) Suasana basa
E° (Volt) FeO42-/Fe3+ 2,20a FeO4 2-/Fe(OH)3 (s) 0,72a MnO4-/Mn2+ 1,52b MnO4-/MnO2 (s) 0,59c Cr2O72-/Cr3+ 1,36b CrO4 2-/Cr(OH)3 (s) -0,12c
(aLi, 2005; bVogel 1990; cTsapin, 2000)
Namun demikian, di samping sifatnya sebagai oksidator yang ramah lingkungan, ferrat memiliki kestabilan yang rendah (dapat tereduksi
dengan mudah). Ferrat yang telah tereduksi akan memiliki warna larutan yang kekuning-kuningan yang merupakan tanda bahwa ferrat telah tereduksi menjadi Fe(III). Hal ini disebabkan karena ferrat merupakan oksidator kuat dan akan sangat mudah untuk mengoksidasi spesies-spesies kimia di sekitarnya sehingga menyebabkan ferrat cepat untuk tereduksi bila tidak disimpan dalam kondisi yang sesuai. Stabilitas ferrat ditentukan oleh beberapa faktor lingkungan, antara lain tingkat keasaman, keberadaan reduktor, dan juga perubahan temperatur media. Oleh karena itu dengan mempelajari stabilitas ferrat, kita dapat menggunakan ferrat dalam suatu reaksi kimia secara lebih tepat dan lebih baik.
Aplikasi ferrat selain sebagai oksidator adalah sebagai material baru yang akan digunakan sebagai baterai dengan kapasitas besar. Ferrat digunakan sebagai katoda. Namun demikian, sifat ferrat yang cenderung kurang stabil menjadi masalah baru dalam hal ini. Pengembangan terhadap penelitian ini masih dilakukan.
METODE PENELITIAN Bahan
Bahan yang digunakan dalam penelitian ini adalah natrium hipoklorit (NaOCl) teknis, ferri klorida (FeCl3.6H2O), natrium hidroksida
pelet (NaOH), kalsium klorida (CaCl2), natrium
tetraborat (Na2B4O7.10 H2O), natrium hidrogen
fosfat (Na2HPO4), dan natrium dihidrogen fosfat
(NaH2PO4) yang kesemuanya buatan Merck
dengan kualitas reagent grade, gas nitrogen buatan PT. Samator, dan akuades.
Peralatan
(1)
2Fe
3++ 3ClO
-+ 10OH
-2FeO
2-4+ 3Cl
-+ 5H
2O
Peralatan yang digunakan antara lain gelas beker, labu takar, pipet ukur, pipet tetes, dan pipet gondok, timbangan digital Mettler dengan nomor seri AE-200, pemanas listrik,
glass wool, alat penggerus, pengaduk kaca, dan magnetic stirrer. Instrument yang digunakan
dalam analisis berupa pH meter buatan TOA Electronics, Ltd., Spectronic 20D+, dan UV-16101-Shimadzu.
PROSEDUR KERJA
Sintesis dan karakterisasi ferrat ( )
Sebanyak 12,0 gram NaOH digerus dengan menggunakan alat penggerus kemudian ditambahkan ke dalam larutan NaOCl 5,25% sebanyak 40,0 ml. Selanjutnya diaduk dengan menggunakan pengaduk kaca hingga larut. Larutan besi (III) klorida kemudian ditambahkan sebanyak 20 tetes dengan menggunakan pipet tetes dan diaduk hingga larutan berwarna ungu. Larutan yang terbentuk kemudian disimpan dalam lemari gelap selama ± 24 jam. Setelah disimpan akan terbentuk larutan ferrat yang berwarna merah-keunguan. Larutan ferrat tersebut kemudian disaring dengan menggunakan
glass wool untuk menghilangkan
pengotor-pengotornya. Larutan ferrat hasil
Uji stabilitas ferrat terhadap beberapa
kondisi fisikokimiawi
Uji stabilitas ferrat dilakukan dengan
memvariasi kondisi fisikokimiawi, yaitu suhu, pH, kondisi udara, dan paparan sinar UV. Dalam setiap proses uji stabilitas ini, dilakukan variasi pada masing-masing kondisi. Hal ini dilakukan agar didapatkan pemahaman yang lebih baik mengenai pengaruh perubahan kondisi fisikokimiawi.
Sebelum dilakukan uji stabilitas ferrat, maka pertama-tama dilakuan serangkain proses persiapan (preparasi). Sebanyak 10,0 mL ferrat hasil sintesis dimasukkan ke dalam labu takar 100 mL kemudian ditambahkan dengan akuades hingga mencapai batas. Preparasi ini dilakukan untuk setiap proses pengujian. Setelah itu, larutan ferrat tersebut dimasukkan ke dalam 4 gelas beker ukuran 50 mL masing-masing sebanyak 25 mL. Gelas beker tersebut kemudian diletakkan di atas pemanas untuk dipanaskan. Proses pemanasan dilakukan dengan variasi temperatur, yaitu temperatur kamar, 50, 75, dan 100 ºC. Setelah itu, masing-masing ferrat yang telah dipanaskan dimasukkan ke dalam kuvet untuk diukur absorbansinya dengan mengunakan spektrofotometer UV-Vis. Hasil dari pengukuran absorbansi masing-masing variasi kemudian dibandingkan dengan absorbansi ferrat pada saat suhu kamar (27 ºC).
Pada uji stabilitas ferrat terhadap kondisi udara, ferrat yang telah dipreparasi tersebut kemudian diperlakukan dalam 3 kondisi udara yang berbeda, yaitu dalam kondisi wadah terbuka, kondisi wadah tertutup (ditutup dengan aluminium foil), dan dalam atmosfer nitrogen (pada wadah tertutup). Pada masing-masing kondisi stabilitas ferrat diukur melalui perubahan absorbansinya. Pengukuran absorbansi dilakukan pada ½, 1, 1½, 2, dan 2½ jam setelah ferrat dimasukkan ke dalam wadah pada masing-masing kondisi.
Uji stabilitas ferrat pada kondisi terpapar sinar UV dilakukan dengan cara memasukkan ferrat ke dalam reaktor UV. Dalam uji stabilitas ini, ferrat juga diperlakukan dalam kondisi yang berbeda, yaitu dengan salah satu gelas beker
ditutup dengan menggunakan plastik sedangkan yang lainnya dibiarkan dalam kondisi wadah terbuka. Hal ini dilakukan untuk mengetahui pengaruh sinar UV secara langsung dan tidak langsung terhadap stabilitas ferrat. Sebelum dimasukkan ke dalam reaktor, ferrat diukur terlebih dahulu absorbansinya untuk kemudian dibandingkan dengan kondisi setelah terpapar sinar UV. Ferrat kemudian di ukur absorbansinya masing-masing pada 1,2,3, dan 4 jam setelah ferrat dimasukkan ke dalam reaktor UV.
Pengaruh stabilitas ferrat terhadap pH
dilakukan dengan menambahkan 1,0 mL ferrat hasil sintesis ke dalam 10,0 mL buffer pH 6-10. Setelah itu dari masing-masing campuran larutan buffer dan ferrat diukur absorbansinya. Proses penambahan ferrat ke dalam buffer dilakukan hanya pada saat ferrat tersebut akan diukur absorbansinya. Hal ini dilakukan untuk mengurangi pengaruh reaksi yang terjadi antara ferrat dengan buffer yang dapat mempengaruhi absorbansi ferrat. Selain itu, hal ini dilakukan agar ferrat yang akan diukur absorbansinya, masih berada dalam kondisi yang baik.
HASIL DAN PEMBAHASAN
Sintesis dan karakterisasi Ferrat ( )
Proses sintesis ferrat dilakukan dengan menambahkan NaOH yang berbentuk pelet ke dalam larutan NaOCl 5,25%. Spesies besi (Fe) yang akan dioksidasi terdapat dalam larutan
FeCl3 yang ditambahkan kemudian. Reaksi yang
terjadi dalam sintesis ferrat adalah reaksi oksidasi-reduksi dan dapat dilihat pada reaksi (1). Ferrat hasil sintesis memiliki warna spesifik, yaitu merah-keunguan. Oleh karena ferrat
merupakan larutan berwarna, maka salah satu uji karakterisasi ferrat adalah dengan menggunakan spektrofotometer UV-Vis.
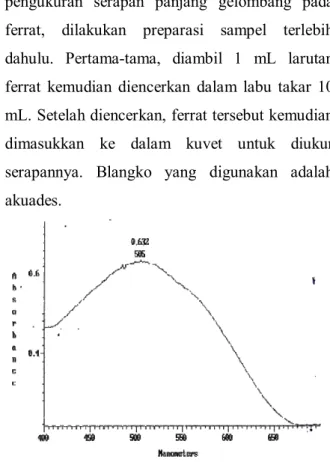
Pada penelitian ini, sebelum dilakukan pengukuran serapan panjang gelombang pada ferrat, dilakukan preparasi sampel terlebih dahulu. Pertama-tama, diambil 1 mL larutan ferrat kemudian diencerkan dalam labu takar 10 mL. Setelah diencerkan, ferrat tersebut kemudian dimasukkan ke dalam kuvet untuk diukur serapannya. Blangko yang digunakan adalah akuades.
Gambar I.1 Serapan panjang gelombang ferrat hasil sintesis
Serapa panjang gelombang ferrat hasil sintesis adalah 505 nm. Hal ini sesuai dengan referensi-referensi yang ada, yaitu bahwa ferrat memiliki serapan panjang gelombang antara 505-510 nm (Tsapin, 2000). Grafik serapan panjang gelombang ferrat disajikan pada gambar I.1.
Uji stabilitas Ferrat terhadap paparan sinar UV
Prosedur preparasi ferrat pada uji stabilitas ferrat terhadap stabilitas UV telah dipaparkan pada bagian cara kerja. Pembahasan ini akan menyajikan data dan usulan reaksi oleh peneliti mengenai hasil dari uji stabilias ini.
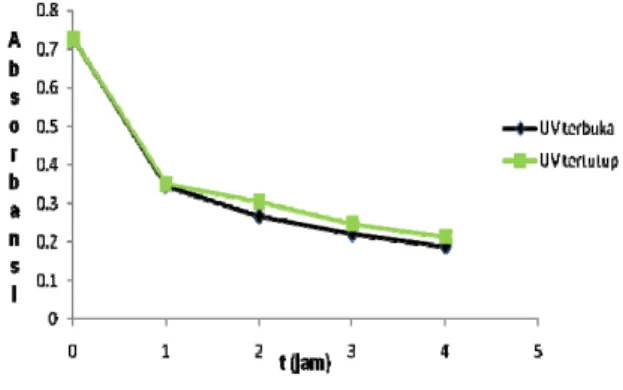
Usulan reaksi pada pembahasan ini bersifat sementara, artinya tidak menutup kemungkinan apabila ada peneliti lain yang mampu menjelaskan reaksi yang terjadi pada uji stabilitas ferrat ini dengan mekanisme reaksi yang berbeda. Dalam uji stabilitas ini, dilakukan variasi terhadap kondisi ferrat, yaitu dalam keadaan tertutup dan terbuka. Tujuan dari perlakuan pada kondisi tertutup adalah untuk meminimalkan pengaruh udara luar terhadap ferrat. Uji pengaruh penyinaran sinar UV terhadap stabilitas ferrat ini dilakukan di dalam reaktor UV selama 4 jam. Panjang gelombang sinar UV yang digunakan adalah 290 nm. Ferrat yang diuji Pada tiap-tiap jam tersebut, absorbansi ferrat diukur sehingga dapat diketahui perubahan absorbansinya dari waktu ke waktu. Sebelum dimasukkan ke dalam reaktor UV, ferrat terlebih dahulu diukur absorbansi mula-mulanya Hal ini dilakukan untuk membandungkan absorbansi yang terukur saat pengamatan dengan absorbansi mula-mula. Grafik hasil pengukuran absorbansi ferrat terhadap paparan sinar UV dapat dilihat pada gambar I.2.
Hasil pengukuran absorbansi ferrat menunjukkan bahwa tidak terdapat perbedaan yang signifikan antara kondisi tertutup dan terbuka. Pada kedua kondisi tersebut, ferrrat mengalami proses reduksi yang cepat. Reduksi ferrat yang terjadi dalam kondisi ini
dimungkinkan terjadi akibat reduksi oleh H2
sebagai hasil dari reaksi pemecahan air (water
splitting) yang ditunjukkan oleh reaksi 2.
Hasil pengukuran absorbansi ferrat menunjukkan bahwa tidak terdapat perbedaan yang signifikan antara kondisi tertutup dan
terbuka. Pada kedua kondisi tersebut, ferrrat mengalami proses reduksi yang cepat
Gambar 1.2 Hasil pengukuran absorbansi ferrat pada kondisi terpapar sinar UV
Reduksi ferrat yang terjadi dalam kondisi ini dimungkinkan terjadi akibat reduksi oleh H2
sebagai hasil dari reaksi pemecahan air (water
splitting) yang ditunjukkan oleh reaksi 2.
(2) Reaksi pemecahan air ini dapat berlangsung apabila terdapat sejumlah energi yang dapat
digunakan untuk memutuskan ikatan ikatan H2O
yang terdiri dari ikatan OH-H dan O-H. Energi yang dibutuhkan untuk memutuskan ikatan tersebut dimungkinkan berasal dari paparan sinar UV.
Uji pengaruh perubahan temperatur terhadap stabilitas ferrat
Sebelum dilakukan uji stabilitas ferrat terhadap pengaruh temperatur, ferrate hasil sintesis diencerkan terlebih dahulu seperti pada uji stabilitas ferrate terhadap penyinaran sinar UV. Setelah diencerkan, ferrat sebanyak 25 mL dimasukkan ke dalam Erlenmeyer ukuran 50 mL yang berjumlah 4 buah. Masing-masing Erlenmeyer tersebut mewakili 4 variasi temperatur yang akan diteliti, yaitu pada temperatur kamar, 50, 75, dan 100 °C. Grafik
pengukuran terhadap absorbasi ferrat dapat dilihat pada gambar I.3.
Penurunan nilai absorbansi ferrat yang diiringi dengan meningkatnya temperatur dapat dijelaskan denga menggunakan persamaan Arrhenius Berdasarkan persamaan Arrhenius, maka dengan semakin meningkatnya temperatur akan mengakibatkan meningkatnya laju reaksi. Dalam hal ini laju reaksi yang dimaksudkan adalah laju reaksi antara ferrat dengan air (3). Apabila reaksi antara ferrat dengan air berlangsung semakin cepat, maka akibatnya adalah reduksi ferrat akan semakin cepat terjadi.
(3) Reduksi ferrat dapat diamati dari penurunan absorbansinya yang teramati pada panjang gelombang 505 nm. Penurunan nilai absorbansi ferrat terjadi dengan semakin meningkatnya temperatur pada lingkungan di sekitarnya. Penurunan nilai absorbansi ini dapat dijadikan sebagai indikasi bahwa ferrat telah mengalami reduksi. Nilai absorbansi ferrat yang semakin menurun disebabkan karena reduksi ferrat yang semakin besar sebagai akibat dari peningkatan temperatur.
Gambar I.3 Hasil pengukuran absorbansi ferrat terhadap perubahan temperatur
Uji pengaruh kondisi udara terhadap stabilitas ferrat
Untuk mempelajari pengaruh kondisi udara terhadap stabilitas ferrat maka dilakukan tiga jenis pengujian, yaitu pengujian ferat dalam wadah terbuka, wadah tertutup, dan wadah
tertutup yang diberi gas nitrogen (N2). Pada
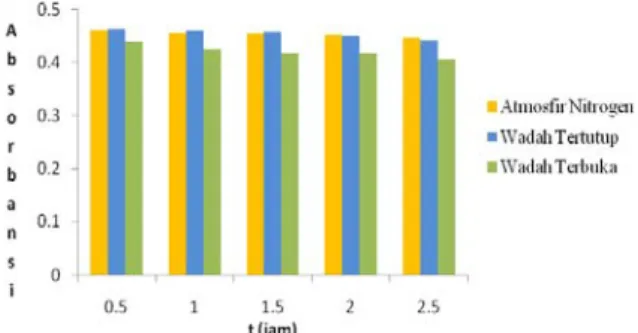
pengujian terhadap kondisi udara, ferrat hasil pengenceran dimasukkan ke dalam gelas beker. Pengukuran absorbansi dilakukan pada waktu-waktu yang telah ditentukan, yaitu pada ½, 1, 1½, 2, dan 2½ jam. Grafik absorbansi ferrat dalam wadah terbuka terhadap waktu dapat dilihat pada gambar I.4.
Ferrat yang berada dalam wadah terbuka mengalami penurunan absorbansi secara signifikan pada tiap-tiap waktu pengukuran. Hal ini disebabkan ferrat mengalami kontak langsung dengan udara sekitar tanpa adanya perlindungan sehingga menyebabkan ferrat akan dengan mudah tereduksi oleh reduktor-reduktor yang ada di udara. Contoh reduktor yang berada di udara, antara lain adalah uap air, atau senyawa-senyawa organik yang berada di udara. Pada uji stabilitas selanjutnya, ferrat dalam wadah tertutup mengalami penurunan nilai absorbansi yang tidak signifikan (cenderung stabil).
Gambar I.4 Hasil pengukuran absorbansi ferrat terhadap waktu pada berbagai kondisi udara
2FeO
42-+ 5H
-Hal ini dapat dijelaskan, bahwa wadah tertutup mengurangi keberadaan reduktor-reduktor yang berada di udara. Dalam atmosfir nitrogen, ferrat cenderung stabil. Hal ini dapat dilihat pada nilai absorbansinya yang cenderung lebih stabil apabila dibandingkan dengan ferrat dalam kondisi tertutup. Stabilitas ferrat dalam atmosfer nitrogen disebabkan karena gas nitrogen
(N2) bersifat inert sehingga ferrat tidak akan
bereaksi dengan udara di lingkungannya
Uji pengaruh pH terhadap stabilitas ferrat
Mula-mula disiapkan larutan buffer pH 6-10. Penggunaan larutan dengan pH dalam rentang ini dimaksudkan untuk melihat stabilitas ferrat dalam rentang pH tertentu . Pada larutan pH rendah tidak diteliti karena dalam kondisi asam, ferrat tidak stabil. Buffer pH 6-9 dibuat
dengan campuran NaH2PO4 dan Na2HPO4
sedangkan untuk pH 10 dibuat dengan campuran NaOH dan Na2B4O7.
Uji stabilitas pH terhadap stabilitas ferrat dilakukan dengan mencampurkan 10 mL buffer dan 1 mL ferrat hasil sintesis. Ferrat yang ditambahkan tidak dalam jumlah yang besar karena dikhawatirkan dapat mempengaruhi pH larutan buffer dan ferrate. Grafik absorbansi ferrat pada berbagai pH dapat dilihat pada gambar I.5
Gambar I.5 Hasil pengukuran absorbansi ferrat terhadap perubahan pH
Pada pH 6, ferrat memiliki absorbansi yang lebih rendah apabila dibandingkan dengan absorbansi pada pH lainnya. Hal ini disebabkan karena pada pH 6 masih bersusana asam sehingga
spesies FeO42- menjadi kurang dominan. Dalam
suasana asam spesies yang dominan adalah
HFeO4- (Li, 2005). Dengan semakin
meningkatnya pH, spesies ferat juga akan semakin dominan yang akan berakibat pada meningkatnya absorbansi pada panjang gelombang 505 nm. Dalam pengukuran absorbansi ini, pH 9 memiliki nilai absorbansi maksimum sehingga dapat dikatakan bahwa pada pH 9, ferrat memiliki stabilitas yang paling baik. Namun demikian, pada pH 10, ferrat mengalami penurunan nilai absorbansi. Hal ini disebabkan karena dengan semakin meningkatnya pH lingkungan, ferrat akan tereduksi melalui suatu mekanisme yang berbeda menjadi spesies
Fe(OH)4- atau sebagai ganti produk
hasil reduksi, Fe(OH)3 (Sharma et al., 2000).
Oleh karena itu, pada pH 10 absorbansi ferrat menurun dengan cukup signifikan. Uji pengaruh pH terhadap stabilitas pH ini dapat digunakan sebagai acuan dalam penyimpanan ferrat berdasarkan kondisi pH lingkungannya.
Dalam penelitian ini juga dihitung konstanta laju reaksi ferrat pada kondisi terpapar sinar UV dan kondisi udara terbuka sebagai data tambahan untuk menunjukkan bahwa kondisi lingkungan di sekitar ferrat menentukan laju reduksi ferrat. Pada perhitungan konstanta laju reaksi (k) ferrat ini, digunakan persamaan orde 2 dan didapatkan nilai k sebesar 3 x 10-4 s-1 dalam
keadaan terpapar sinar UV sedangkan dalam kondisi udara terbuka didapatkan nilai k sebesar 2 x 10-5 s-1.
KESIMPULAN
Ferrat hasil sintesis memiliki serapan
maksimum (λmaks) pada panjang gelombang 505
nm. Stabilitas optimum ferrat didapatkan pada pH 9 dan temperatur 27 °C. Dengan menggunakan persaman laju reaksi orde 2 didapatkan nilai k dalam reaksi ferrat yang terpapar sinar UV adalah 3 x 10-4 s-1 sedangkan
dalam kondisi udara terbuka didapatkan nilai k sebesar 2 x 10-5 s-1. Ferrat memiliki kestabilan
yang baik dalam atmosfir nitrogen sedangkan dengan paparan sinar UV, ferrat akan tereduksi secara cepat.
DAFTAR PUSTAKA
Carr, J. D., Keller, P. B., Tabatabai, A., Spichal, D., Erickson, J., dan McLaughlin, C. W., 1985, Properties of ferrate(VI) in aqueous solution: An alternative oxidant in wastewater treatment, Water
Chlorination, 5, 1285–1298.
Li, C., Li, X. Z., dan Graham, N., 2005, A Study of The Preparation and Reactivity of Potassium Ferrate, Chemosphere, 61, 537-543.
Sharma, V. K., 2007, Disinfection Performance of Fe(VI) in Water and Wastewater: A Review. Water Science & Technology, 55, 225–232.
Tsapin, A. I., Goldfield, M. G., McDonald, G. D., dan Nealson, K. H., 2000, Iron(VI): Hypothetical Candidate for the Martian Oxidant, Icarus, 147, 68-78.
Turova, N. Ya., 1997, Inorganic Chemistry in
Tables, Higher College of Chemistry,
Moskow, Rusia.
Vogel, A. I., 1990, Buku Teks Analisis Anorganik
Kualitatif Makro dan Semimikro
(diterjemahkan oleh Setiono, L., dan Pudjaatmaka, A. H.), edisi 5, PT. Kalman Media Pustaka, Jakarta.