IV HASIL DAN PEMBAHASAN
Perancangan proses pada penelitian ini mengacu pada Seider et al. (1999) yang terdiri atas tiga tahap yaitu 1) analisis peluang dan permasalahan, 2) kreasi proses dan 3) pengembangan proses.
4.1. Analisis Peluang dan Permasalahan 4.1.1 Analisis peluang
Peluang usaha produksi biodiesel cukup baik karena adanya Program Pengembangan Bahan Bakar Nabati oleh Pemerintah Rebublik Indonesia sesuai dengan Instruksi Presiden No. 1 tahun 2006 tentang penyediaan dan pemanfaatan bahan bakar nabati (biofuel) dan Peraturan Presiden No 5 tahun 2006 tentang kebijakan energi nasional. Departemen Energi dan Sumber Daya Mineral (ESDM) menargetkan produksi biodiesel Indonesia pada tahun 2009, 2010, 2015 dan 2025 masing-masing adalah 0,568, 0,720, 1,500 dan 4,700 milyar liter. Peluang usaha produksi biodiesel juga dapat dilihat dari harga biodiesel. Harga biodiesel berdasarkan Harga Patokan Ekspor (HPE) yang dikeluarkan oleh Departemen Perindustrian mencapai 1035 US $/mt (http://www.depperin.go.id, 25 April 2008). Salah satu bahan baku biodiesel potensial adalah biji nyamplung dengan kandungan minyak mencapai 75% (Dweek dan Meadows 2002) dan taksiran produksi minyak per hektar per tahun mencapai 2,45 ton melebihi tanaman jarak pagar.
4.1.2 Analisis Permasalahan
Tanaman nyamplung hanya berproduksi setahun dua kali (Joker 2004; Friday dan Okano 2005; Sutarno 2008, komunikasi pribadi). Karena kondisi demikian, maka untuk memenuhi kebutuhan industri harus dilakukan penyimpanan akibatnya terjadi peningkatan kadar asam lemak bebas (ALB) yang cukup tinggi. Kondisi ALB yang tinggi disebabkan pula oleh karakteristik biji nyamplung itu sendiri. Untuk dapat diambil minyaknya dengan pengepresan, inti
nyamplung harus dikeringkan terlebih dahulu (Dweek dan Meadows 2002; Friday dan Okano 2005). Pada saat pengeringan terjadi peningkatan kadar asam lemak bebas yang cukup besar. Minyak biji nyamplung secara sederhana diproduksi oleh petani dari Kecamatan Ambal Kabupaten Kebumen Jawa Tengah yang mempunyai kenampakan hijau gelap kotor serta kadar asam lemak bebas (ALB) sangat tinggi mencapai 30%. Minyak nabati dengan kadar ALB tinggi tidak dapat diproses menjadi biodiesel dengan transesterifikasi karena akan terbentuk emulsi sabun yang menyulitkan pemisahan metil ester (Canakci dan Van Gerpen, 2001; Lele 2005, Tyson 2005). Persyaratan minyak nabati pada transesterifikasi dengan katalis basa adalah ≤ 5% (Canakci dan Van Gerpen, 1999). Dengan kondisi demikian maka rumusan masalahanya adalah bagaimana rancangan proses produksi biodiesel dari minyak biji nyamplung yang mempunyai kenampakan kotor dan kadar ALB sangat tinggi ?
4.2 Kreasi Proses 4.2.1 Pengepresan dan Degumming
Analisis Biji Nyamplung. Hasil analisis komposisi biji nyamplung tanpa kulit (inti atau kernel) dapat dilihat pada Tabel 22.
Tabel 22 Komposisi inti nyamplung
No. Komponen Hasil analisis (%)
1. Minyak 49,43 2. Protein 7,49 3. Karbohidrat 5,38 4. Air 23,04 5. Serat kasar 13,26 6. Abu 1,4
Inti nyamplung apabila dikonversi pada kondisi kering dengan kadar air 3,3 % maka kandungan minyak mencapai 61,20%. Kandungan minyak tersebut jauh lebih kecil dari informasi pustaka yang menyebutkan bawa biji nyamplung yang kering dengan kadar air 3,3% mempunyai kandungan minyak 71,4% Heyne (1987),
namun sesuai dengan Soerawidjaja et al. (2005) yang menyatakan bahwa kadar minyak inti (kernel) biji nyamplung antara 40-73%. Perbedaan kandungan minyak pada inti kemungkinan disebabkan oleh perbedaan cara budidaya, perbedaan varietas, iklim, curah hujan dan sebab-sebab lainnya. Berdasarkan pengujian laboratorium, pemilihan biji nyamplung sebagai bahan baku biodiesel adalah tepat mengingat kadar minyak inti nyamplung mencapai 49,43% pada kadar air 23,4% atau 61,20% pada kadar air 3,3 %.
Pengepresan. Proses pengepresan dilakukan dengan menggunakan alat pres hidrolik berkekuatan 20 ton. Rendemen minyak nyamplung dari proses pengepresan tersebut adalah 17,5 % dari bobot biji atau 48,6% dari bobot inti kering. Rendemen tersebut masih relatif rendah dibandingkan dengan potensi yang ada yaitu mencapai 61,20% (analisis dengan pelarut hexan metode soxhlet). Rendahnya rendemen minyak nyamplung kemungkinan disebabkan oleh sifat fisis dari minyak dalam biji nyamplung itu sendiri. Minyak dalam biji nyamplung tergolong kental dan mempunyai sifat lengket (melekat cukup kuat pada inti) sehingga saat dilakukan pengepresan masih banyak minyak yang tertingggal pada bungkil hal itu terbukti pada analisis kadar minyak dalam bungkil menunjukkan bahwa kadar minyak masih relatif tinggi mencapai 19,6%. Rendahnya hasil ekstrak minyak dari inti nyamplung secara mekanis juga dilaporkan oleh Dweek dan Meadows (2002) yang menyatakan bahwa dari 100 kg biji diperoleh 18 kg minyak, dengan kata lain rendemen minyak tersebut adalah 18% dari biji atau sekitar 40 % dari inti. Untuk meningkatkan rendemen minyak nyamplung perlu dilakukan penelitian lanjutan diantaranya adalah dengan cara kombinasi pengepresan dengan ekstraksi dengan menggunakan pelarut.
Degumming. Perlakuan pendahuluan yang diberikan terhadap minyak nyamplung adalah proses degumming dengan menggunakan asam fosfat. Proses degumming
pada penelitian ini dilakukan pada suhu 80 oC selama 15 menit dilanjutkan dengan pencucian dengan air hangat pada suhu 60 oC sampai jernih. Diperlukan air sebanyak 1000 gram dan asam fosfat konsentrasi 20% sebanyak 0,3%. Pengeringan minyak setelah proses degumming dilakukan dengan pengering vakum pada suhu 80 oC untuk menguapkan air sebanyak 20 gram. Warna minyak nyamplung sebelum dan setelah proses degumming sangat berbeda. Perbedaan warna minyak nyamplung hasil proses degumming terhadap minyak awal disajikan pada Gambar 11.
Gambar 11 Foto minyak biji nyamplung.
Minyak nyamplung yang tadinya berwarna hijau gelap berubah menjadi kuning kemerahan hal itu diduga disebabkan karena hilangnya zat warna alami (pigmen) yang dominan pada minyak nyamplung tersebut. Disamping klorofil, minyak nyamplung diduga mengandung pigmen karotenoid sehingga pada waktu pigmen klorofil mengalami kerusakan saat proses degumming pigmen karotenoid menjadi dominan sehingga minyak nyamplung hasil degumming berwarna kuning kemerahan. Menurut Hui (1996) klorofil merupakan pigmen warna hijau yang terdapat pada kloroplas bersama-sama dengan karoten dan xantofil merupakan senyawa yang tidak stabil. Berdasarkan hasil percobaan, dapat disimpulkan bahwa proses degumming efektif untuk menghilangkan kotoran yang ada pada minyak nyamplung sehingga ditetapkan pada perancangan proses.
4.2.2 Karakterisasi Minyak Nyamplung
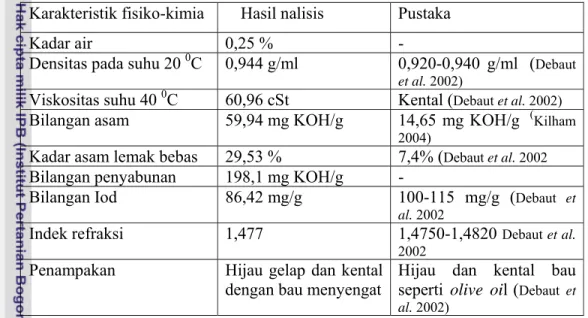
Pengujian Sifat Fisiko Kimia Minyak Biji Nyamplung. Minyak nyamplung yang digunakan dalam percobaan diperoleh dari pengrajin minyak nyamplung dari Kecamatan Ambal Kebumen Jawa Tengah. Hasil analisis sifat fisiko kimia minyak biji nyamplung tersebut disajikan pada Tabel 23.
Tabel 23 Sifat fisiko-kimia minyak biji nyamplung dari Kebumen Karakteristik fisiko-kimia Hasil nalisis Pustaka
Kadar air 0,25 % -
Densitas pada suhu 20 0C 0,944 g/ml 0,920-0,940 g/ml (Debaut et al. 2002)
Viskositas suhu 40 0C 60,96 cSt Kental (
Debaut et al. 2002)
Bilangan asam 59,94 mg KOH/g 14,65 mg KOH/g (Kilham 2004)
Kadar asam lemak bebas 29,53 % 7,4% (Debaut et al. 2002
Bilangan penyabunan 198,1 mg KOH/g -
Bilangan Iod 86,42 mg/g 100-115 mg/g (Debaut et al. 2002
Indek refraksi 1,477 1,4750-1,4820 Debaut et al. 2002
Penampakan Hijau gelap dan kental dengan bau menyengat
Hijau dan kental bau seperti olive oil(Debaut et al. 2002)
Minyak biji nyamplung yang dihasilkan dengan pengepresan menggunakan alat kempa hidrolik di Puslitbang Kehutanan Bogor mempunyai karakteristik fisiko-kimia yang hampir sama dengan minyak nyamplung dari Kebumen. Ada perbedaan karakteristik minyak nyamplung hasil percobaan dengan kajian pustaka khususnya mengenai kadar ALB, hal ini disebabkan karena perbedaan perlakuan penanganan pasca panen. Minyak nyamplung hasil pengepresan mempunyai kategori bermutu rendah dan tidak bisa diproses menjadi biodiesel dengan proses satu tahap (transesterifikasi).
Pengujian Fisiko-Kimia Minyak Biji Nyamplung setelah Degumming.
Walaupun penampakan minyak nyamplung sebelum dan setelah degumming sangat berbeda sekali akan tetapi karakteristiknya tidak jauh berbeda dengan sebelum degumming. Karaktekteristik minyak nyamplung hasil degumming dapat dilihat pada Tabel 24.
Tabel 24 Karakteristik minyak nyamplung hasil degumming Karakteristik Hasil Analisis
Air 0,58 %
Densitas pada suhu 20 0C 0,940 gr/ml Bilangan asam 54,1792mg KOH/g Kadar asam lemak bebas 27,21%
Indek refraksi 1,478 Viskositas suhu 40 0C 57,42 cSt
Proses degumming hanya menghilangkan kotoran yang berupa koloid seperti gum, fosofolipid dan lipoprotein pada minyak sehingga tidak berdampak banyak pada bilangan asam, viskositas dan karakteristik yang lain. Adanya sedikit penurunan viskositas kemungkinan disebabkan oleh hilangnya gum dan kotoran lain karena proses degumming. Sejumlah kecil asam lemak bebas rantai pendek kemungkinan ikut tercuci sehingga terjadi penurunan bilangan asam dalam jumlah yang kecil. Peningkatan kecil terhadap kadar air diduga disebabkan karena pengaruh adanya proses pencucian.
Pengujian Komposisi Asam Lemak Minyak Biji Nyamplung. Minyak nyamplung mengandung asam lemak yang terdiri asam lemak jenuh (tidak mempunyai ikatan rangkap) dan asam lemak tidak jenuh (mempunyai ikatan rangkap). Komposisi asam lemak penyusun minyak nyamplung dibandingkan asam lemak bahan baku biodiesel lain dapat dilihat pada Tabel 25 sedangkan kromatogramnya dapat dilihat pada Gambar 12. Minyak nyamplung tersusun oleh empat jenis asam lemak utama yaitu asam palmitat (14,26%), asam stearat (19,96%), asam oleat (37,57%) dan asam linoleat (26,33%). Total keseluruhan dari empat jenis asam lemak utama tersebut mencapai 98,12%.
Jumlah empat jenis asam lemak utama yaitu asam palmitat, asam stearat, asam oleat dan asam linoleat pada minyak jarak pagar 93,1%, minyak kelapa sawit 97,7% dan minyak kedele 90,4%, dengan demikian minyak nyamplung mempunyai kemiripan dengan minyak-minyak tersebut.
Tabel 25 Komposisi asam lemak minyak nyamplung dibandingkan minyak lain Komponen Minyak Nyamplung (%)a Minyak Jarak Pagar (%)b CPO (%)c Minyak Kedele (%)d Asam Palmitat (C16:0) 14,26 11,9 43,79 10,3 Asam stearat (C18:0) 19,96 5,2 4,42 3,9 Asam Oleat (C 18:1) 37,57 29,9 39,9 22,1 Asam Linoleat (C 18:2) 26,33 46,1 9,59 54,1 Asam Linolenat (C 18:3) 0,27 4,7 0,17 8,3 Asam Arachidat (C20:0) 0,94 0,15 0,38 0,3 Asam Erukat (C20:1) 0,32 - - 0,4 Asam Behenat (C22:0) 0,53
a: hasil analisis b:Haas & Mittelbach 2000, c: Darnoko et al. (2001), d: Hui (1996)
Minyak jarak pagar, CPO dan minyak kedele sudah terbukti dapat digunakan sebagai bahan baku pembuatan biodiesel dan karena minyak nyamplung mempunyai kemiripan sehingga dapat digunakan sebagai bahan baku pembuatan biodiesel.
Gambar 12 Kromatogram metil ester dari analisis GC minyak biji nyamplung.
4.2.3 Pemilihan Proses
Minyak nyamplung dari pengrajin di Kabupaten Kebumen maupun hasil pengepresan di Badan Litbang Hasil Hutan Bogor mempunyai kualitas rendah dilihat dari kadar ALB dan penampakannya. Kadar ALB minyak tersebut sangat tinggi dan mempunyai kenampakan tidak menarik karena adanya kotoran di dalamnya. Oleh karena itu salah satu tahapan proses yang dipilih adalah degumming yang bertujuan menghilangkan kotoran (gum) pada minyak
nyamplung tersebut. Proses bleaching tidak relevan diberikan karena berdasarkan SNI biodiesel, tidak ada persyaratan warna biodesel. Netralisasi dengan basa juga tidak dilakukan karena asam lemak bebas yang terkandung dalam minyak nyamplung justru akan dikonversi menjadi metil ester pada proses esterifikasi dan jika dilakukan netralisasi dengan basa akan merendahkan rendemen karena asam lemak bebas akan dikonversi menjadi sabun. Proses produksi biodiesel dilakukan melalui proses dua tahap yaitu esterifikasi yang bertujuan untuk menurunkan ALB dan sekaligus mengonversi ALB tersebut menjadi metil ester dan transesterifikasi untuk mengubah trigliserida, digliserida dan monogliserida menjadi metil ester. 4.2.4 Optimasi Proses Esterifikasi
Optimasi proses esterifikasi dilakukan dengan percobaan laboratorium untuk menentukan kondisi proses operasi terbaik. Optimasi kondisi proses dilakukan agar diperoleh hasil konversi (yield) yang optimum. Kondisi proses yang paling optimum (respon permukaan optimum) digunakan untuk menentukan kinetika reaksi pada tahapan berikutnya. Optimasi proses esterifikasi dilakukan dengan menggunakan metode permukaan respon (RSM) oleh karena itu sebelum percobaan optimasi dilakukan maka perlu ditetapkan variabel proses yang berpengaruh nyata dan rentang titik-titik optimum pada setiap variabel berpengaruh nyata tersebut.
4.2.4.1 Penentuan Kondisi Operasi
Karena proses esterifikasi dipengaruhi oleh faktor eksternal seperti suhu esterifikasi, nisbah molar metanol terhadap ALB, kecepatan pengadukan, waktu esterifikasi dan konsentrasi katalis, maka untuk keperluan optimasi proses esterifikasi kisaran titik optimum proses tersebut harus ditetapkan. Penentuan kondisi operasi esterifikasi dilakukan dengan percobaan laboratorium.
Penentuan Suhu Esterifikasi. Proses esterifikasi menghasilkan produk dengan dua lapisan yang sangat kontras sehingga mudah dipisahkan. Lapisan atas adalah metanol sedangkan lapisan bagian bawah adalah minyak yang merupakan campuran antara trigliserida, metil ester dan sisa asam lemak bebas. Produk hasil proses esterifikasi minyak nyamplung dapat dilihat pada Gambar 13. Keberhasilan proses esterifikasi ditentukan oleh penurunan ALB, oleh karena itu dilakukan pengukuran kadar ALB hasil esterifikasi pada bagian bawah setelah proses esterifikasi selesai. Agar terjadi proses pemisahan secara sempurna diperlukan pengendapan selama 2 jam.
Gambar 13 Hasil proses esterifikasi minyak nyamplung dengan metanol dan katalis asam klorida.
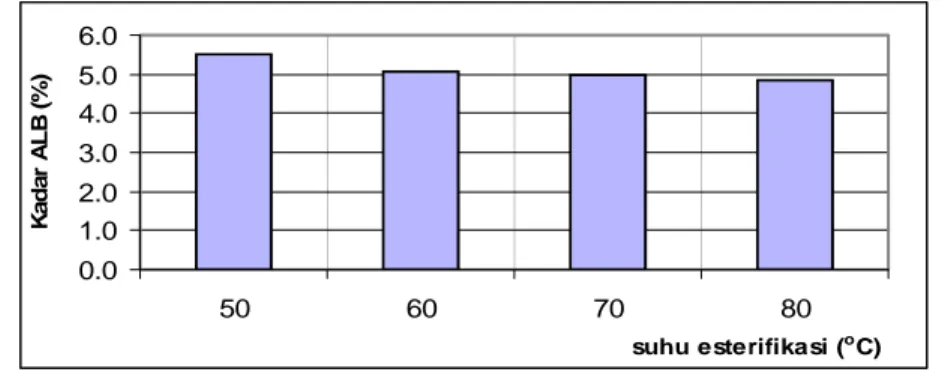
Hasil esterifikasi biji nyamplung dengan kadar ALB awal 28,7% yang dilakukan pada nisbah molar metanol terhadap ALB 30:1, katalis HCl terhadap ALB 6%, waktu 60 menit, kecepatan pengadukan 400 rpm pada berbagai suhu esterifikasi dapat dilihat pada Gambar 14 dan hasil analisis Analisis ragam dan uji Duncan dapat dilihat pada Lampiran 2.
0.0 1.0 2.0 3.0 4.0 5.0 6.0 50 60 70 80 suhu esterifikasi (oC) Ka d a r AL B ( % )
Gambar 14 Kadar ALB akhir esterifikasi rata-rata pada berbagai suhu. Ada kecenderungan semakin tinggi suhu estrifikasi kadar ALB akhir esterifikasi semakin kecil, tetapi perbedaan antara suhu esterifikasi 60, 70 dan 80oC relatif kecil sehingga tidak berbeda nyata perbedaannya. Suhu esterifikasi 60 oC lebih efektif dibandingkan dengan 50 oC namun tidak ada perbedaan yang nyata dengan suhu 70 dan 80oC, dengan demikian suhu esterifikasi 60 oC dipilih untuk optimasi proses esterifikasi. Suhu esterifikasi 60 oC digunakan untuk esterifikasi minyak kedele oleh Canakci dan Van Gerpen (2001), minyak jarak oleh Sudradjat et al. (2005) dan suhu esterifikasi 55-60 oC digunakan untuk esterifikasi minyak kedele dan lemak oleh Canakci dan Van Gerpen (2003).
Penentuan Kecepatan Pengadukan. Kadar ALB akhir esterifikasi yang dilakukan pada nisbah molar metanol 30:1, katalis HCl terhadap ALB 6 %, waktu 60 menit, suhu 60 oC pada berbagai kecepatan pengadukan dapat dilihat pada Gambar 15 sedangkan hasil analisis Analisis ragam dan Uji Duncan dapat dilihat pada Lampiran 3. 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 100 200 300 400 500 Kecepatan pengaduan (rpm) AL B ( % )
Gambar 15 Kadar ALB akhir esterifikasi rata-rata pada berbagai kecepatan pengadukan.
Ada kecenderungan semakin tinggi kecepatan pengaduaan sampai dengan 300 rpm kadar ALB akhir esterifikasi semakin kecil akan tetapi perbedaan antara kecepatan pengadukan 300, 400 dan 500 rpm tidak berbeda nyata (lihat Lampiran 3). Dengan demikian kecepatan pengadukan 300 rpm dipilih untuk optimasi proses esterifikasi. Hasil penelitian Noureddini dan Zhu (1997) menunjukkan bahwa ada perbedaan signifikan terhadap hasil proses transesterifikasi menggunakan kecepatan pengadukan 150 dan 300 rpm akan tetapi antara 300 rpm dengan 600 rpm perbedaannya hanya sedikit bahkan antara 600 dan 900 rpm tidak ada perbedaan sama sekali. Hal tersebut menunjukkan bahwa peningkatan kecepatan pengadukan sampai dengan kecepatan tertentu akan meningkatkan hasil reaksi akan tetapi seteleh itu tidak berpengaruh.
Penentuan Nisbah Molar Metanol. Kadar ALB pada akhir esterifikasi yang dilakukan pada suhu 60 oC, katalis HCl terhadap ALB 6%, waktu 60 menit, kecepatan pengadukan 300 rpm pada berbagai nisbah molar metanol terhadap ALB dapat dilihat pada Tabel 26 sedangkan hasil analisis Analisis ragam dan uji Duncan dapat dilihat pada Lampiran 4.
Perlakuan nisbah molar metanol pada proses esterifikasi yang menghasilkan kadar ALB pada level yang paling rendah menurut uji statistik adalah yang dipilih. Ada kecenderungan semakin tinggi nisbah molar metanol terhadap ALB semakin rendah kadar ALB akhir esterifikasi yang dihasilkan, tetapi apabila diamati secara seksama penurunan kadar ALB setelah nisbah molar metanol terhadap ALB 20:1 tidak berbeda nyata dengan nisbah molar yang lebih besar sehingga digunakan untuk proses optimasi. Kadar ALB akhir esterifikasi pada nisbah molar metanol terhadap ALB 45:1 dan 50:1 tidak nyata dibandingkan dengan nisbah molar yang lebih kecil sehingga kondisi tersebut tidak dipilih. Nisbah molar metanol terhadap ALB 15:1 tidak dipilih karena masih mengahasilkan kadar ALB akhir esterifikasi pada level yang relatif tinggi sehingga belum memenuhi syarat untuk proses transesterifikasi berikutnya.
Penelitian pengaruh nisbah molar metanol terhadap ALB terhadap penurunan kadar ALB akhir esterifikasi dilakukan oleh Oluwaniyi et al. (2003) pada minyak biji Thevetia peruviana dengan menggunakan nisbah molar metanol terhadap ALB terhadap ALB 1:1, 3:1 dan 10:1 yang menunjukkan bahwa semakin besar nisbah molar yang digunakan, penurunan kadar ALB semakin besar.
Tabel. 26 Kadar ALB akhir esterifikasi rata-rata pada berbagai nisbah molar metanol terhadap ALB
No Nisbah molar
metanol akhir esterifikasi Kadar ALB (%) 1. 0 31,0655 2. 5 12,3464 3. 10 9,3171 4. 15 6,0509 5. 20 4,8843 6. 25 4,6457 7. 30 3,9155 8. 35 3,8284 9. 40 3,7254 10. 45 3,2926 11. 50 3,3247
Pengaruh nisbah molar metanol terhadap ALB antara 20:1 sampai dengan 40:1 terhadap proses esterifikasi dipelajari oleh Canakci dan Van Gerpen (2001) menunjukkan bahwa semakin besar nisbah molar metanol terhadap ALB yang digunakan penurunan bilangan asam semakin besar. Berdasarkan kajian pustaka biasanya cukup tinggi, seperti esterifikasi yang dilakukan oleh Canakci dan Van Gerpen (2003) terhadap lemak dengan ALB 39,6% adalah dengan nisbah molar metanol 20:1 kemudian dilanjutkan dengan dengan esterifikasi tahap kedua dengan nisbah molar metanol terhadap ALB 40:1, Zhang et al. (2003) menggunakan nisbah molar metanol terhadap ALB 50:1. Berdasarkan hasil penelitian ini maka nisbah molar metanol terhadap ALB yang dipilih adalah 20:1.
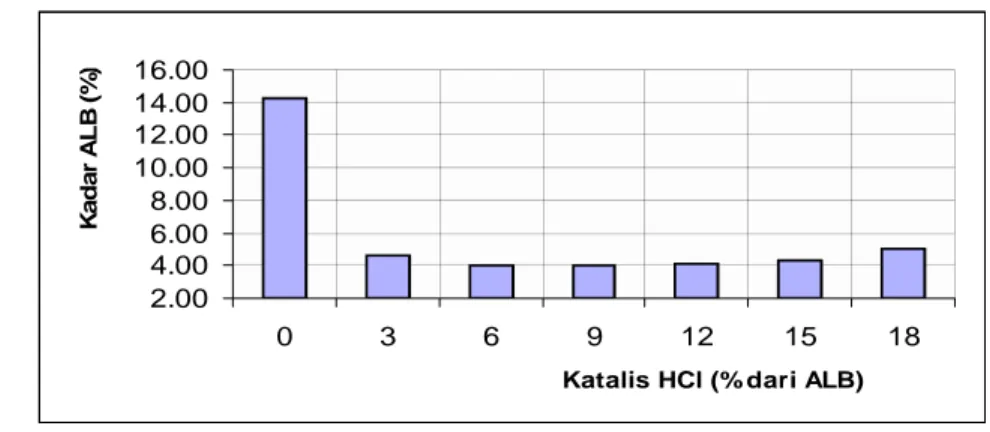
Penentuan Konsentrasi Katalis. Kadar ALB pada akhir esterifikasi yang dilakukan pada suhu 60 oC, nisbah molar metanol terhadap ALB 20:1, waktu 60
menit, dan kecepatan pengadukan 300 rpm pada berbagai konsentrasi katalis dapat dilihat pada Gambar 16 sedangkan hasil analisis Analisis ragam dan uji Duncan dapat dilihat pada Lampiran 5.
2.00 4.00 6.00 8.00 10.00 12.00 14.00 16.00 0 3 6 9 12 15 18
Katalis HCl (% dari ALB)
Ka d a r AL B ( % )
Gambar 16 Kadar ALB akhir esterifikasi rata-rata pada berbagai konsentrasi katalis HCl.
Katalis sangat diperlukan dalam proses esterifikasi dibuktikan dengan perbedaan yang signifikan antara penggunaan katalis 3 % dengan tanpa katalis. Keperluan katalis untuk proses esterifikasi sangat kecil hal itu dibuktikan tidak ada perbedaan yang nyata penggunaan katalis 6 -15 % (lihat Lampiran 5), akan tetapi penggunaan katalis 6 % dari ALB lebih baik dari penggunaan katalis 3 % dan penggunaan katalis 18 % justru menunjukkan kadar ALB akhir esterifikasi yang lebih tinggi. Oleh karena itu penggunaan katalis 6 % dari bobot ALB dipilih untuk optimasi proses esterifikasi. Hasil penelitian ini serupa dengan hasil penelitian Canakci dan Van Gerpen (2001) yang menunjukkan bahwa semakin besar konsentrasi katalis yang digunakan pada proses esterifikasi sampai dengan konsentrasi 15% dari ALB penurunan kadar ALB semakin besar akan tetapi penggunaan konsentrasi katalis 18 % dari ALB untuk esterifikasi minyak dengan kadar ALB 40% selama 30 menit dan 60 menit justru menunjukkan penurunan kadar ALB yang lebih kecil. Esterifikasi terhadap minyak kedele yang
mengandung ALB 20 % dengan menggunakan nisbah molar metanol: ALB = 9:1 yang dilakukan pada suhu 60 oC selama 1 jam dan menggunakan katalis asam sulfat 5 % dari ALB dapat menurunkan bilangan asam 41,33 menjadi 1,77 sedangkan apabila kadar ALB awal 40 % bilangan asam menjadi 18,82 (Canakci dan Van Gerpen 2001).
Toleransi Variasi Kadar ALB Bahan Baku. Nisbah molar metanol yang ditetapkan pada proses esterifikasi untuk menurunkan kadar ALB minyak nyamplung setelah proses degumming adalah 20:1 dan dengan menggunakan BM asam lemak bebas yang paling dominan dalam minyak biji nyamplung yaitu asam oleat (BM = 282) maka gram metanol yang dibutuhkan adalah nisbah molar metanol terhadap ALB dikalikan berat molekul metanol dibagi berat molekul asam lemak sebagai asam oleat dikalikan berat ALB (2,2695 x gram ALB). Katalis asam klorida pekat yang diperlukan adalah 6% dari gram ALB. Proses esterifikasi ditetapkan menggunakan suhu 60oC, kecepatan pengadukan 300 rpm, dan waktu 30 menit. Esterifikasi dengan dengan kondisi tersebut dapat menurunkan kadar ALB dari 27-33.% menjadi sekitar 4,5%. Proses esterifikasi yang dilakukan dengan perhitungan nisbah molar metanol terhadap ALB mempunyai keuntungan yaitu perbedaan kadar ALB bahan baku sampai kadar tertentu (7 %) tidak mempengaruhi hasil esterifikasi secara nyata seperti yang diperlihatkan pada Gambar 17. Sisa (ecsess) reaktan dengan menggunakan perhitungan ini adalah nisbah molar metanol terhadap ALB yang digunakan dikurangi dengan nisbah molar untuk reaksi secara stokiometri (2,156 x gram ALB).
3,00 3,50 4,00 4,50 5,00 5,50 26,8 27,2 28,6 29,9 31,6 33,1
Kadar ALB bahan baku (%)
Kad a r AL B P ro d u k ( % )
Gambar 17 Hubungan antara kadar ALB bahan baku dengan kadar ALB produk esterifikasi pada suhu 60 oC, nisbah molar metanol 20:1, kecepatan
pengadukan 300 rpm dan katalis 6 % dari ALB.
Penelitian ini ada kesesuaian dengan hasil penelitian Canacki dan Van Gerpen (2003) yang menunjukkan bahwa bilangan asam awal lemak sebagai bahan baku sebesar 18,03 KOH/g setelah esterifikasi menjadi 4,26 mg dan pada saat bilangan asam dinaikkan sekitar empat kalinya menjadi 79,2 mgKOH/g setelah esterifikasi dengan waktu, nisbah molar metanol dan konsentrasi katalis yang sama bilangan asamnya menjadi 6,96 mg KOH/g. Hal ini menunjukkan bahwa hasil esterifikasi dengan pendekatan perhitungan nisbah molar metanol terhadap ALB dan konsentrasi katalis terhadap kadar ALB tidak banyak dipengaruhi oleh mutu bahan baku sampai batas tertentu (7%), sehingga cara perhitungan ini dapat digunakan. 4.2.4.2 Optimasi Proses Esterifikasi Menggunakan Respon Surface Method
Optimasi proses esterifikasi diperlukan untuk menentukan kondisi proses yang paling sesuai sehingga diperoleh hasil yang optimum. Tahapan ini merupakan kelanjutan dari sintesis proses khususnya mengenai kondisi proses esterifikasi yang telah dibahas sebelumnya. Optimasi proses esterifikasi dilakukan dengan metode permukaan respon (Respon Surface Method). Dalam optimasi permukaan respon ini digunakan perancangan faktorial (23=8) ditambah titik pusat (6) dan titik observasi (6). Dipilih tiga faktor untuk dioptimasi didasarkan pada tingkat
pengaruh faktor dan pertimbangan ekonomi. Faktor proses optimum digunakan untuk pengukuran kinetika reaksi pada tahap berikutnya. Titik tengah dari masing-masing faktor adalah suhu esterifikasi 60 oC, konsentrasi katalis terhadap ALB 6%, nisbah molar metanol terhadap ALB 20:1, sedangkan faktor lain tetap yaitu kecepatan pengadukan 300 rpm dan waktu esterifikasi 30 menit.
Hasil estimasi koefisien regresi dan analisis varian dari optimasi respon pengukuran kadar ALB akhir esterifikasi oleh tiga input variabel masing-masing yaitu nisbah molar metanol, katalis HCl dan suhu yang dilakukan pada kecepatan pengadukan 300 rpm dan waktu esterifikasi 30 menit disajikan pada Tabel 27, sedangkan respon regresi permukaan ALB versus nisbah molar metanol, konsentrasi katalis dan suhu esterifikasi dapat dilihat pada Lampiran 6. Berdasarkan analisis Analisis ragam menunjukkan bahwa nilai F model kuadratik adalah 28,57 (P-value = 0,000) sehingga signifikan (P-value < α = 0,05), dengan demikian model kuadratik adalah tepat. Adapun persamaan model kuadratik pengaruh nisbah molar metanol, konsentrasi katalis dan suhu esterifikasi terhadap kadar ALB akhir esterifikasi sebagai berikut:
Y = 4,75199 - 0,850067M + 0,187544K + 0,456206S + 0,721867M2 + 0,202320K2 + 0,367783 S2 - 0,197375 MK - 0,0926250 MS + 0,0906250 KS.
dengan :
M = nisbah molar metanol terhadap ALB, K = persentase katalis HCl terhadap ALB dan S = suhu esterifikasi
Hasil uji kesahihan model menunjukkan bahwa model kuadratik mempunyai nilai koefisien determinasi (R2) relatif tinggi yaitu 95,6%. Hal itu menunjukkan bahwa 95,6% dari keragaman pada parameter optimasi dapat dijelaskan dengan model.
Uji lack of fit yang digunakan untuk menguji kecukupan model berdasarkan tabel Analisis ragam menunjukkan bahwa P-value lack of fit = 0,202 > α = 0,05 maka tidak signifikan atau tidak ada lack of fit artinya model yang dibuat telah sesuai dengan data. Hasil uji residual menunjukkan bahwa plot residual menyebar acak sehingga dapat disimpulkan bahwa model regresi cukup tepat dengan data. Disamping itu plot residual mendekati garis lurus sehingga dapat disimpulkan bahwa residual telah terdistribusi normal. Uji kecukupan model juga dilakukan dengan cara menganalisis residual yaitu menguji kenormalan residual dengan menggunakan statistik Kolmogorov-Smirnov. Nilai Statistik Kolmogorov-Smirnov adalah 0,159 < nilai statistik (Tabel Kolmogorov-Smirnov) dengan 20 pengamatan yaitu 0,294. Kesimpulan dari uji kenormalan residual adalah model regresi linier yang dibuat telah mengikuti distribusi normal sehingga kenormalan residual pada suatu model regresi telah dipenuhi sehingga model bisa digunakan.
Uji parameter model menunjukkan bahwa variabel nisbah metanol, konsentrasi katalis, suhu, kuadrat nisbah metanol, kuadrat konsentrasi katalis dan kuadrat suhu memiliki pengaruh penting terhadap penurunan kadar ALB dikarenakan p-value variabel-variabel tersebut cukup kecil. P-value nisbah Metanol =0,000, p- value Katalis = 0,058, p- value Suhu = 0,000, p- value Metanol*Metanol = 0,000, p- value Katalis*Katalis = 0,039 dan p- value Suhu*Suhu =0,002.
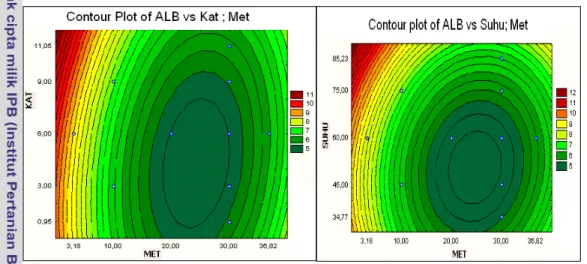
Kontur respon kadar ALB yang merupakan fungsi dari nisbah molar metanol, konsentrasi katalis dan suhu esterifikasi seperti yang ditunjukkan pada Gambar 18 dan 19. Gambar tersebut menunjukkan bahwa kondisi optimum proses esterifikasi dapat diperoleh dengan mengatur suhu, konsentrasi katalis dan nisbah molar metanol.
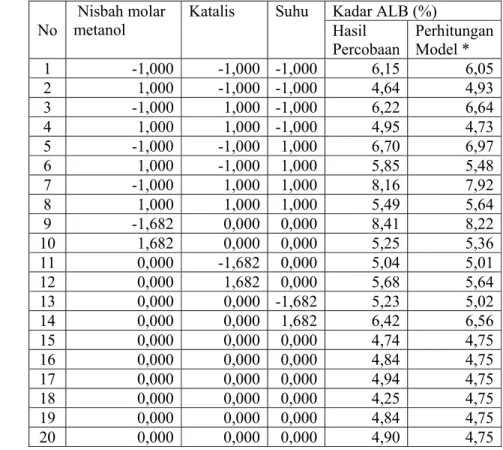
Tabel 27 Hasil optimasi respon permukaan terhadap kadar ALB akhir esterifikasi No Nisbah molar metanol Katalis Suhu Kadar ALB (%) Hasil Percobaan Perhitungan Model * 1 -1,000 -1,000 -1,000 6,15 6,05 2 1,000 -1,000 -1,000 4,64 4,93 3 -1,000 1,000 -1,000 6,22 6,64 4 1,000 1,000 -1,000 4,95 4,73 5 -1,000 -1,000 1,000 6,70 6,97 6 1,000 -1,000 1,000 5,85 5,48 7 -1,000 1,000 1,000 8,16 7,92 8 1,000 1,000 1,000 5,49 5,64 9 -1,682 0,000 0,000 8,41 8,22 10 1,682 0,000 0,000 5,25 5,36 11 0,000 -1,682 0,000 5,04 5,01 12 0,000 1,682 0,000 5,68 5,64 13 0,000 0,000 -1,682 5,23 5,02 14 0,000 0,000 1,682 6,42 6,56 15 0,000 0,000 0,000 4,74 4,75 16 0,000 0,000 0,000 4,84 4,75 17 0,000 0,000 0,000 4,94 4,75 18 0,000 0,000 0,000 4,25 4,75 19 0,000 0,000 0,000 4,84 4,75 20 0,000 0,000 0,000 4,90 4,75 *Y = 4,75199-0,850067M+0,187544K+0,456206S+0,721867M2+ 0,202320K2+ 0,367783S2 -0,197375MK-0,0926250 MS+0,0906250 KS.
M = nisbah molar metanol K = katalis dan S = Suhu esterifikasi
Gambar 18 Plot permukaan optimasi respon kadar ALB akhir esterifikasi antara nisbah molar metanol, katalis dan suhu esterifikasi.
Hasil analisis kanonik yang digunakan untuk menentukan titik optimum adalah penentuan titik stasioner yang terjadi nisbah molar metanol, konsentrasi katalis dan suhu esterifikasi. Hasil analisis kanonik titik optimum diperoleh pada nilai peubah nisbah molar metanol terhadap ALB 22,2:1, konsentrasi katalis HCl terhadap ALB 5,9% dan suhu esterifikasi 58,1oC.
Gambar 19 Plot kontur optimasi respon kadar ALB akhir esterifikasi antara nisbah molar metanol, katalis dan suhu esterifikasi.
Model kadar ALB akhir esterifikasi dilakukan validasi laboratorium sebanyak 5 kali ulangan. pada kondisi nisbah molar metanol, konsentrasi katalis dan suhu esterifikasi optimum. Kadar ALB yang diperoleh dari 5 kali ulangan tersebut adalah 4,74, 4,50, 4,9721, 4,51, dan 4,58% dengan rata-rata 4,67 % berdekatan dengan hasil perhitungan model yaitu 4,75 %. Dengan demikian suhu esterifikasi 58,1 oC, nisbah molar metanol terhadap ALB 22,2:1, konsentrasi katalis HCl terhadap berat ALB 5,9% yang dilakukan pada pengadukan 300 rpm adalah kondisi yang sesuai untuk esterifikasi minyak biji nyamplung .
4.2.5 Analisis Model Kinetika Reaksi Esterifikasi
Kinetika reaksi berguna untuk menetapkan kondisi operasi, metode pengendalian, kebutuhan peralatan dan teknologi dari suatu proses kimia, sehingga dapat dimanfaatkan untuk merancang reaktor (Petrucci, 1992).Pengukuran kinetika reaksi esterifikasi digunakan untuk perancangan reaktor batch khususnya waktu tinggal sesuai dengan Hill (1977); Perry (1988), Richardson and Peacock (1994) yang menyatakan bahwa dalam perancangan reaktor batch harus diketahui waktu yang diperlukan untuk mengkonversi sejumlah bahan pada kondisi reaksi spesifik. Pengukuran kinetika reaksi esterifikasi dilakukan pada kondisi optimum yang diperoleh pada optimasi proses pada tahap sebelumnya yaitu pada nilai peubah nisbah molar metanol terhadap ALB 22,2:1 dan konsentrasi katalis HCl terhadap ALB 5,9%.
4.2.5.1 Tetapan Laju Reaksi Esterifikasi
Penentuan tetapan laju reaksi esterifikasi menggunakan metode isolasi (Atkins 1999) yang dikombinasikan dengan metode integral (Laidler 1979) dengan asumsi reaksi berlangsung secara irreversibel (lihat pada Lampiran 7).
k1
RCOOH + CH3OH RCOO– CH3 + H2O
Hubungan konsentrasi asam lemak bebas dengan waktu esterifikasi ditampilkan pada Gambar 20 dan data konversi (perubahan kadar ALB sebelum dan setelah esterifikasi dibagi kadar ALB awal dinyatakan dalam persen) dapat dilihat pada Tabel 28.
0,00 5,00 10,00 15,00 20,00 25,00 30,00 0 5 10 15 20 25 30 35 40 45 50 55 60 65 Waktu (menit) Kadar ALB (%) 28 oC 45 oC 60 oC 70 oC
Gambar 20 Hubungan antara kadar ALB dengan waktu reaksi pada berbagai suhu esterifikasi.
Tabel 28 Data konversi (bagian) asam lemak bebas menjadi metil ester Waktu
(menit) 28 oC 45 Konversi (bagian) oC 60 oC 70oC
0 0,00 0,00 0,00 0,00 5 0,38 0,35 0,50 0,67 10 0,46 0,61 0,73 0,75 15 0,58 0,67 0,76 0,78 20 0,59 0,73 0,78 0,82 25 0,65 0,78 0,81 0,84 30 0,69 0,79 0,83 0,85 35 0,71 0,80 0,83 0,85 40 0,72 0,81 0,83 0,86 45 0,71 0,81 0,84 0,86 50 0,74 0,81 0,83 0,86 55 0,77 0,81 0,83 0,85 60 0,79 0,82 0,83 0,86
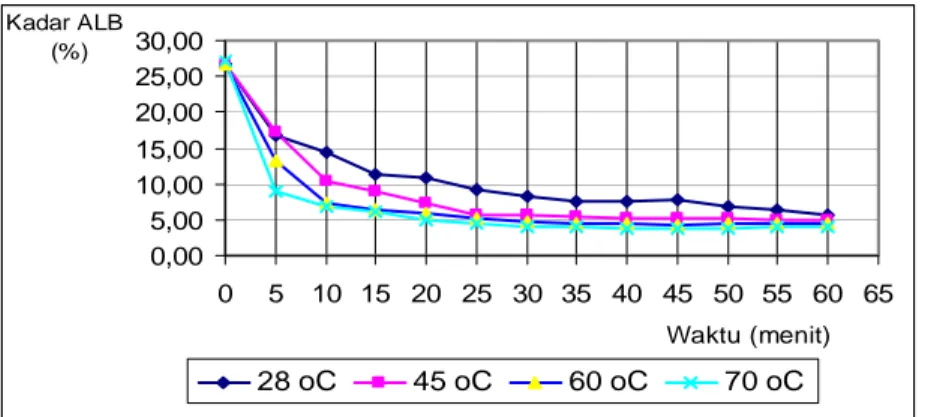
Pola hubungan antara kadar ALB dengan waktu reaksi menyerupai hasil penelitian Guner et al. (1996); Oluwaniyi dan Ibiyemi (2003) dan Sendzikiene et al. (2004). Kadar ALB turun secara bertahap sampai dengan 15 menit pertama kemudian sangat lambat dan setelah 30 menit mendekati konstan. Hubungan antara 1/([ALB]t – 1/ ([ALB]0 dengan waktu pada esterifikasi dengan nisbah molar metanol 22,2:1, katalis HCl 5,9 % keduanya dihitung berdasarkan jumlah ALB,
kecepatan pengadukan 300 rpm, suhu 28 oC, 45 oC, 60 oC dan 70 oC ditampilkan pada Gambar 21. 0,00 1,00 2,00 3,00 4,00 5,00 6,00 7,00 8,00 0 5 10 15 20 25 30 35 40 45 50 55 60 65
Waktu es terifikas i (m enit)
1/[ALBt-1/[ALB]o
28 oC 45 oC 60 oC 70 oC
Gambar 21 Hubungan antara waktu reaksi esterifikasi dengan 1/([ALB]t -1/([ALB]o.
Melihat fenomena hubungan antara t dengan nilai 1/([ALB]t -1/([ALB]o yang tidak linier maka nilai k dihitung berdasarkan slope (kemiringan) garis awal sesui dengan Goud et al. (2006). Nilai k ditentukan dengan metode integral sampai didapat nilai k yang konsisten atau linearitas paling tinggi yaitu pada pseudo orde dua (lihat lampiran 7). Menurut Sanchez et al. (1997) kinetika reaksi esterifikasi mengikuti orde dua semu (pseudo second order). Grafik hubungan antara 1/([ALB]t -1/([ALB]o dengan waktu pada berbagai suhu esterifikasi dapat dilihat pada Gambar 22. 60 oC y = 0,2093x R2 = 0,9215 70 oC y = 0,2515x R2 = 0,9019 45 oC y = 0,1515x R2 = 0,985 28 oC y = 0,0866x R2 = 0,9674 0,0000 1,0000 2,0000 3,0000 4,0000 5,0000 6,0000 7,0000 0 5 10 15 20 25 30 Waktu (menit) 1/[ALB]t- 1/[ALB]o
Gambar 22 Grafik hubungan antara 1/([ALB]t -1/([ALB]o dengan waktu reaksi untuk penentuan nilai k reaksi esterifikasi.
Berdasarkan Gambar 22 maka tetapan laju reaksi esterifikasi pseudo orde dua (k1) pada suhu 343 K, 333 K, 318 K dan 301 K masing-masing berturut-turut adalah 0,252 liter/ mol menit, 0,209 liter/ mol menit, 0,152 liter/ mol menit dan 0,087 liter/ mol menit. Guner et al. (1996) mengukur tetapan laju esterifikasi antara asam oleat dengan gliserol dengan katalis asam sulfat pada suhu 180 oC dengan orde 2 yaitu 1.633 x 10-4 wt%-1menit-1.,
4.2.5.2 Model Kinetika Reaksi Esterifikasi Orde Dua Semu (pseudo second -order) Berdasarkan Persamaan Arhenius
Hubungan antara tetapan laju reaksi dengan energi aktivasi berdasarkan persamaan Arhenius adalah sebagai berikut:
k1 = A exp(Ea/RT) -ln k = (Ea/R) 1/T - ln A Y = a x + b
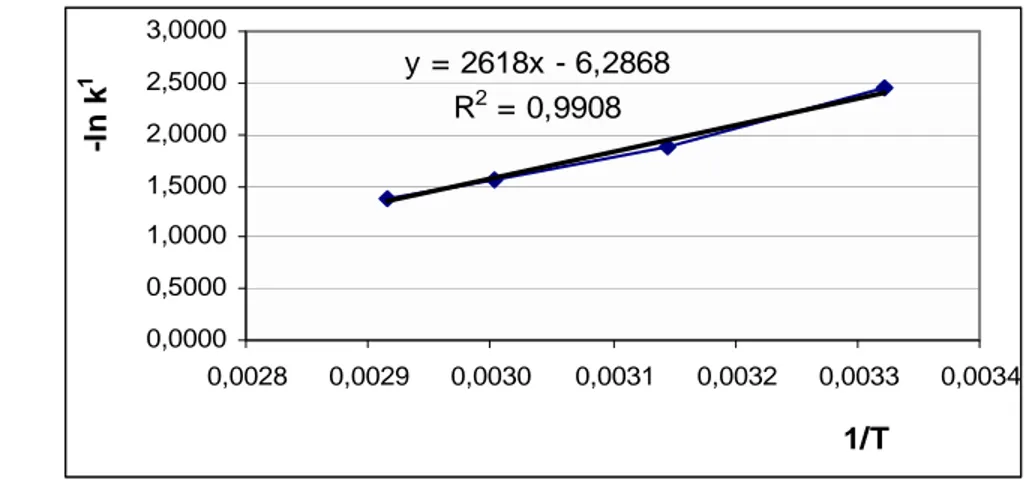
Grafik hubungan antara -ln k1 dengan 1/T proses esterifikasi pada suhu 301 K, 318 K, 333 K dan 343 K dapat dilihat pada Gambar 23 sedangkan penentuan energi aktivasi selengkapnya dapat dilihat pada Lampiran 7.
y = 2618x - 6,2868 R2 = 0,9908 0,0000 0,5000 1,0000 1,5000 2,0000 2,5000 3,0000 0,0028 0,0029 0,0030 0,0031 0,0032 0,0033 0,0034 1/T -l n k 1
Gambar 23 Plot -ln k dengan 1/T pada proses esterifikasi minyak biji nyamplung pada suhu 301 K, 318 K, 333 K dan 343 K.
Dari persamaan -ln k = (Ea/R) 1/T - ln A diperoleh persamaan y = 2618x -6,2868 dengan R2 = 0,9908 dengan demikian :
ln A = 6,2868, A = 537,4 liter / mol menit.
Ea/R = 2618, Ea = 5201,97 cal/ mol K= 5,202 kcal/mol (21,7 kJ/mol).
Hangx et al.(2001) memperoleh energi aktivasi pada reaksi esterifikasi etanol dan asam asetat sebesar 48,3 kJ/mol. Sendzikiene et al. (2004) melakukan esterifikasi asam lemak bebas dengan metanol pada suhu 20-60 oC memperoleh energi aktivasi sebesar 13,3 kJ/mol. Guner et al. 1996 melakukan esterifikasi asam oleat dengan gliserol pada suhu 180-240 oC memperoleh energi aktivasi 21.32 k cal/mol (89,1 kj/mol).
Nilai k1 pada berbagai suhu esterifikasi dapat dinyatakan dengan menggunakan persamaan Arrhenius
k1 = A exp(-Ea/RT)
k1 = 537,4 exp - 5202/1,987T k1 = 537,4 exp - 2618/ T
sehingga model laju reaksi esterifikasi (rEs ) adalah : d[ALB] rEs = _____ = – k1 [ALB]2 dt rEs= –537,4 exp - 2618/ T [ALB]t2 –537,4 exp - 2618/ T ([ALB]0 -x) 2
Dengan model tersebut dapat ditentukan nilai k1 pada berbagai suhu dalam kisaran suhu percobaan (301
–
343 K) misalnya apabila digunakan suhu 340 K maka diperoleh nilai k sebesar 0,243 liter/ mol menit.4.2.5.3 Perancangan Waktu Reaksi Ideal
Waktu reaksi batch ideal proses esterifikasi dihitung berdasarkan neraca massa dalam reaktor batch isotermal (endotermis) mengacu pada Perry (1988); Richardson and Peacock (1994) sebagai berikut:
Laju alir reaktan masuk
− laju alir reaktan keluar
– laju alir penghilangan reaktan
= laju akumulasi
Karena reaktor batch, maka laju alir reaktan masuk dan laju alir reaktan keluar = 0
0 –0 –V.r[ALB] = d [ALB] / dt
d [ALB]
= (–
r
[ALB] ) V dtPada volume (V) konstan: d [ALB] = (–
r
[ALB] ) dt [ALB]t d [ALB] = dt (–r
[ALB] ) [ALB]oWaktu yang dibutuhkan untuk mencapai konsentrasi asam lemak bebas sebesar [ALB]t pada kondisi isotermal adalah:
[ALB]t d [ALB]t t = --- (– r [ALB] ) [ALB]o r [ALB] = k [ALB]2 [ALB]t d [ALB]t t = --- –k [ALB]2 [ALB]o
[ALB]t 1 t = --- d [ALB] –k [ALB]2 [ALB]o 1 1 1 t = --- --- – --- k [ALB]t [ALB]o t = 25,62 menit
Pada kondisi isotermal suhu 60 °C dan harga k = 0,209 liter/ mol menit, untuk mendapatkan kadar ALB minyak nyamplung hasil esterifikasi sebesar 0,154 mol/liter (4,65%) dari bahan baku minyak nyamplung yang mengandung ALB 0,890 mol/liter (26,76%) diperlukan waktu 25,62 menit. Jika menggunakan waktu esterifikasi 25 menit maka diprediksi akan diperoleh minyak nyamplung dengan konsentrasi ALB sebesar 0,157 mol/liter (4,73%). Konsentrasi ALB akhir esterifikasi hasil perhitungan dari model kinetika mendekati hasil validasi melalui percobaan laboratorium seperti ditampilkan pada Tabel 29.
Tabel 29 Kadar ALB minyak biji nyamplung akhir esterifikasi hasil percobaan selama 25 menit dibandingkan prediksi
Ulangan Kadar ALB minyak nyamplung akhir esterifikasi Hasil Percobaan
(% berat) Perhitungan kinetika (% berat) 1 4,86 4,73 2 5,84 3 4,75 4 4,91 5 4,84 6 4,75 Rata-rata 4,99
4.2.6 Optimasi Proses Transesterifikasi
Optimasi proses transesterifikasi dilakukan dengan percobaan laboratorium untuk menentukan kondisi proses operasi terbaik. Optimasi kondisi proses dilakukan agar diperoleh hasil konversi (yield) yang optimum. Kondisi proses yang paling optimum (respon permukaan optimum) digunakan untuk menentukan kinetika reaksi pada tahapan berikutnya. Optimasi proses transesterifikasi dilakukan dengan metode permukaan respon, oleh karena itu faktor eksternal yang meliputi suhu transesterifikasi, nisbah molar metanol, kecepatan pengadukan, waktu transesterifikasi dan konsentrasi katalis, harus ditentukan.
Proses transesterifikasi menghasilkan produk dengan dua lapisan yang sangat kontras sehingga mudah dipisahkan. Lapisan atas adalah metil ester sedangkan lapisan bawah adalah gliserol dan sisa metanol. Produk hasil proses transesterifikasi ditampilkan pada Gambar 24.
Gambar 24 Biodiesel hasil proses transesterifikasi minyak nyamplung (a: minyak hasil esterifikasi dan b: biodiesel setelah pemisahan gliserol, pencucian dan pengeringan).
Diperlukan waktu dua jam agar terjadi pengendapan gliserol secara sempurna hal ini merujuk pada Canakci dan Van Gerpen (2003) yang menyatakan bahwa setelah pengendapan selama 1,2 dan 3 jam total gliserin dalam biodiesel berturut-turut menjadi 1,09%, 0,79% dan 0,69% dari kadar gliserin awal 11.07%. Keberhasilan proses transesterifikasi ditentukan oleh beberapa parameter diantaranya adalah penurunan viskositas, penurunan densitas dan peningkatan kandungan metil ester. Penurunan kadar gliserida berkorelasi positif dengan peningkatan kadar metil ester dan peningkatan kadar metil ester tersebut berkorelasi dengan penurunan viskositas dan densitas (De Filippis et al. 1995). Al-Widyan dan Al-Shyoukh (2002) mengukur keberhasilan proses transesterifikasi berdasarkan penurunan spesific grafity (massa jenis). Beberapa peneliti menggunakan parameter penurunan kadar gliserida dan peningkatan kadar metil ester untuk mengukur keberbasilan proses transesterifikasi (Freedman et al. (1986): Noureddini dan Zhu (1997); Cheng et al. (2004). Pengukuran parameter proses transesterifikasi dilakukan terhadap biodiesel setelah dilakukan pengendapan, pemisahan, pencucian dan pengeringan.
Penelitian pengaruh kondisi proses terhadap hasil transesterifikasi telah banyak dilakukan misalnya Freedman et al. (1986) dan Noureddini dan Zhu (1997) terhadap minyak kedele, Darnoko dan Cheryan (2000) dan Cheng et al. (2004) terhadap minyak kelapa sawit, Sudradjat et al. (2005) terhadap minyak jarak dan Van Garpen et al. (2005) terhadap minyak kedele dan lemak. Penelitian pengaruh kondisi proses transesterifikasi bertujuan untuk memastikan kondisi proses transesterifikasi yang sesuai untuk minyak biji nyamplung, dengan mempertimbangkan kondisi proses transesterifikasi minyak nabati lain hasil kajian pustaka.
4.2.6.1 Penentuan Jenis Kondisi Operasi
Karena proses transesterifikasi dipengaruhi oleh faktor eksternal seperti suhu, nisbah molar metanol terhadap ALB, kecepatan pengadukan, waktu dan konsentrasi katalis, maka untuk keperluan optimasi, kisaran titik optimum kondisi proses tersebut harus diketahui. Penentuan kondisi proses transesterifikasi didasarkan pada viskositas biodiesel sesuai De Filippis et al. (1995) yang menyatakan bahwa peningkatan kadar metil ester selama transesterifikasi berkorelasi positif dengan penurunan viskositas. Penentuan kondisi operasi transesterifikasi dilakukan dengan percobaan laboratorium.
Penetapan Nisbah Molar Metanol. Nisbah molar metanol terhadap minyak pada proses transesterifikasi yang dicobakan mengacu pada penelitian Freedman et al. (1984); Filippis et al. (1995); Karmee dan Chandha (2005) yaitu 2:1, 3:1, 6:1 dan 9:1 dengan waktu transesterifikasi 30 menit, kecepatan pengadukan 400 rpm, suhu 60oC, dan katalis NaOH 1 % terhadap jumlah minyak. Hasil pengukuran viskositas akhir proses transesterifikasi disajikan pada Gambar 25 sedangkan hasil analisis Analisis ragam dilanjutkan dengan Uji Duncan dapat dilihat pada Lampiran 9. Ada perbedaan yang nyata pengaruh penggunaan nisbah molar metanol dalam proses transesterifikasi terhadap kadar ALB dan viskositas produk. 6,00 8,00 10,00 12,00 14,00 2 3 4 5 6 7 8 9
Nisbah m olar m etanol terhadap m inyak sebagai triolein
V isk o si tas ( cS t)
Gambar 25 Rata-rata viskositas biodiesel hasil proses transesterifikasi pada berbagai nisbah molar metanol.
Nisbah molar metanol 2:1 dan 3:1 menghasilkan viskositas produk yang tinggi dibandingkan dengan nisbah molar metanol 6:1 dan 9:1 dengan demikian nisbah molar metanol 6:1 yang dipilih. Hasil penelitian Cheng et al. (2004) menunjukkan bahwa pengaruh perbedaan penggunaan nisbah molar metanol 6:1-10:1 tidak berbeda nyata hal ini sesuai dengan penelitian ini. Hasil penelitian ini serupa dengan penelitian De Fillippis et al. (1995) yang menyatakan bahwa peningkatan nisbah molar metanol sampai dengan 6:1 menyebabkan peningkatan konversi metil ester secara nyata akan tetapi peningkatan nisbah molar 6:1-12:1 tidak mempengaruhi hasil konversi metil ester. Nisbah molar metanol 6:1 digunakan untuk proses transesterifikasi oleh Freedman et al. (1986) dan Noureddini dan Zhu (1997), Darnoko dan Cheryan (2000) dan Cheng et al. (2004).
Penetapan Kecepatan Pengadukan. Kecepatan pengadukan berkaitan dengan kebutuhan energi untuk proses tumbukan agar reaksi dapat berlangsung dengan sempurna. Kecepatan pengadukan yang dicobakan adalah 100 rpm, 200 rpm, 300 rpm, 400 rpm dan 500 rpm pada suhu, waktu reaksi, nisbah molar metanol, dan konsentrasi katalis yang sama masing-masing adalah 60oC, 30 menit, 6:1 dan 1% seperti yang ditunjukkan pada Gambar 26 sedangkan hasil analisis Analisis ragam dilanjutkan dengan Uji Duncan dapat dilihat pada Lampiran 10.
7.60 8.00 8.40 8.80 100 200 300 400 500 Kecepatan pengadukan (rpm) Vi s k o s it as ( c St )
Gambar 26 Rata-rata viskositas biodiesel setelah proses transesterifikasi pada berbagai kecepatan pengadukan.
Pengadukan sampai dengan 400 rpm menghasilkan viskositas biodiesel semakin kecil akan tetapi antara 400 rpm dan 500 rpm tidak ada perbedaan yang nyata. Dengan demikian kecepatan pengadukan 400 rpm dipilih untuk optimasi proses transesterifikasi. Hasil ini serupa dengan hasil penelitian Noureddini dan Zhu (1997) yang menunjukkan bahwa ada perbedaan signifikan terhadap hasil proses transesterifikasi menggunakan kecepatan pengadukan 150 dan 300 rpm akan tetapi antara 300 rpm dengan 600 rpm perbedaannya kecil, bahkan antara 600 dan 900 rpm tidak ada perbedaan sama sekali. Kecepatan pengadukan yang digunakan untuk proses transesterifikasi Cheng et al.(2004) adalah 350 rpm.
Penetapan Konsentrasi Katalis. Konsentrasi katalis yang dicobakan adalah 0,5%, 1%, 1,5%, dan 2% pada suhu, waktu, nisbah molar metanol, kecepatan pengadukan yang sama masing-masing adalah 60oC, 30 menit, 6:1 dan 400 rpm seperti yang ditunjukkan pada Gambar 27, hasil analisis Analisis ragam dilanjutkan dengan Uji Duncan dapat dilihat pada Lampiran 11.
6,0 8,0 10,0 12,0 14,0 0,5 0,75 1 1,25 1,5 1,75 2 Konsentrasi katalis (%) V isko si tas ( cS t)
Gambar 27 Rata-rata viskositas biodiesel setelah proses transesterifikasi pada berbagai konsentrasi katalis.
Ada perbedaan nyata pemakaian katalis NaOH 0,5% dengan pemakaian katalis 1%, 1,5% dan 2% namun pemakaian katalis 1%, 1,5% dan 2 % tidak berbeda. Dengan demikian pemakaian katalis 1% adalah paling sesuai. Hasil
penelitian ini berbeda dengan hasil penelitian Cheng et al. 2004 yang menyatakan bahwa tidak ada perbedaan hasil konversi metil ester terhadap perbedaan penggunaan katalis 0,5%-1% begitu pula Canakci dan Van Garpen (2001) yang menyatakan bahwa tidak ada perbedaan penggunaan katalis KOH 1 % dan 0,5%. Perbedaan hasil penelitian ini kemungkinan disebabkan karena kadar asam lemak bebas bahan baku pada penelitian ini jauh lebih besar. Konsentrasi katalis NaOH 1% disarankan untuk proses transesterifikasi oleh Freedman et al. (1984), Noureddini dan Zhu (1997), Sudradjat et al. (2005), Gerpen et al. (2004) dan Lele (2005).
Penetapan Suhu. Suhu transesterifikasi yang dicobakan mengacu pada Cheng et al. (2004); Noureddini dan Zhu (1997) yaitu 45oC, 60oC dan 75 oC. Konsentrasi katalis, waktu reaksi, nisbah molar metanol, dan kecepatan pengadukan sama masing-masing berturut-turut adalah 1%, 30 menit, 6:1 dan 400 rpm. Rata-rata hasil pengamatan viskositas, ALB dan rendemen yang ditunjukkan pada Tabel 30 dan hasil analisis Analisis ragam dilanjutkan dengan Uji Duncan dapat dilihat pada Lampiran 12.
Tabel 30 Rata-rata kadar ALB, viskositas, bobot jenis dan rendemen biodiesel dari proses transesterifikasi pada berbagai suhu transesterifikasi
Parameter Suhu 45 oC 60 oC 75 oC Viskositas (cSt) 8,9 8,4 10,3 ALB (%) 0,661 0,643 0,615 Massa jenis (g/cm3) 0,889 0,886 0,880 Rendemen (%) 66,4 69,8 68,0
Berdasarkan pengolahan data secara statistik, pengaruh perbedaan suhu transesterifikasi terhadap kadar ALB, bobot jenis dan rendemen tidak nyata. Hasil penelitian ini serupa dengan hasil penelitian Cheng et al. 2004 yang menunjukkan bahwa perbedaan penggunaan suhu transesterifikasi yaitu 50–70 oC tidak berpengaruh terhadap hasil setelah transesterifikasi selama 20 menit begitu
pula hasil penelitian Noureddini dan Zhu (1997) yang menyatakan bahwa ada perbedaan yang nyata pengaruh suhu terhadap hasil metil ester antara 30-60 oC akan tetapi antara 60 - 70 oC tidak ada perbedaan nyata. Sedangkan untuk viskositas ada perbedaan yaitu transesterifikasi suhu 45 oC dan 60 oC menunjukkan perlakuan yang lebih baik dari pada suhu 75 oC.
Berdasarkan hasil penelitian dan kajian pustaka maka suhu 60 oC dipilih sebagai suhu transesterifikasi. Suhu 60oC digunakan untuk transesterifikasi oleh Darnoko dan Cheryan (2000), Cheng et al. (2004), Sudradjat et al. (2005) dan Van Garpen et al. (2005).
4.2.6.2 Optimasi Proses Transesterifikasi
Optimasi proses transesterifikasi diperlukan untuk menentukan kondisi proses yang paling sesuai sehingga diperoleh hasil yang optimum. Tahapan ini merupakan lanjutan sintesis hasil penelitian pengaruh perlakuan terhadap proses transesterifikasi yang telah dibahas sebelumnya. Optimasi proses transesterifikasi dilakukan dengan metode permukaan respon. Pada optimasi respon ini digunakan perancangan faktorial (22=4) ditambah titik pusat (5) dan titik observasi (4). Titik tengah dari konsentrasi katalis terhadap minyak 1%, nisbah molar metanol terhadap minyak ( sebagai triolein) 6:1, sedangkan faktor lain dibuat tetap yaitu kecepatan pengadukan 400 rpm, suhu transesterifikasi 60 oC dan waktu transesterifikasi 30 menit. Dipilih dua faktor yang dioptimasi yaitu nisbah molar metanol terhadap minyak dan konsentrasi katalis didasarkan pada tingkat pengaruh faktor tersebut dan pertimbangan ekonomi. Nisbah molar metanol terhadap minyak dan konsentrasi akan menjadi variabel tetap pada penentuan kinetika reaksi pada tahap berikutnya.
Hasil estimasi koefisien regresi dan analisis varian dari optimasi respon produk oleh dua input variabel yaitu nisbah molar metanol terhadap minyak dan
katalis NaOH terhadap minyak yang dilakukan pada kecepatan pengadukan 400 rpm, suhu 60oC dan waktu 30 menit terhadap parameter kadar ALB, rendemen, viskositas dan kadar metil ester disajikan pada Gambar 28 dan Tabel 31, sedangkan hasil analisis regresi respon permukaan, Analisis ragam dapat dilihat pada Lampiran 13.
Tabel 31 Rata-rata kadar ALB, viskositas, rendemen, dan kadar metil ester hasil percobaan dan perhitungan model pada optimasi proses transesterifikasi
Met Kat Kadar ALB
(%) Viskositas (cSt) Rendemen biodiesel (%) Kadar metil ester (%) Hasil Model*1 Hasil Model*2 Hasil Model*3 Hasil Model*4
-1 -1 1,243 1,292 16,950 16,712 68,40 66,83 71,55 74,04 1 -1 1,332 1,378 20,040 19,151 58,60 60,74 51,43 54,39 -1 1 1,479 1,434 20,600 19,466 66,70 66,03 76,32 73,92 1 1 1,043 0,996 14,600 12,815 60,50 63,55 90,08 88,16 -1,414 0 1,276 1,273 17,900 18,451 64,50 66,39 69,18 69,23 1,414 0 1,023 1,024 14,000 15,472 63,70 60,33 66,03 65,41 0 -1,414 1,552 1,485 18,000 18,378 64,60 64,50 69,77 66,03 0 1,414 1,251 1,316 14,200 15,845 67,30 65,92 86,66 89,83 0 0 0,725 0,831 9,410 11,140 70,40 70,50 93,24 93,12 0 0 0,841 0,831 10,250 11,140 70,00 70,50 95,42 93,12 0 0 0,880 0,831 11,040 11,140 69,10 70,50 91,82 93,12 0 0 0,819 0,831 11,850 11,140 70,10 70,50 90,80 93,12 0 0 0,891 0,831 13,150 11,140 72,90 70,50 94,31 93,12 *1 : Y = 0,831-0,088M-0,059K +0,159M2 +0,285K2 + -0,131MK *2 : Y = 11,140-1,053M -0,896K+2,911M2+2,986K2-2,273MK *3 : Y = 70,500-2,141M +0,502K-3,569M2-2,643K2-0,900MK *4 : Y = 93,118-1,352M +8,413K-12,898M2-7,593K2-8,470MK
Berdasarkan analisis of varians (Analisis ragam) kadar ALB, viskositas, rendemen, dan metil ester khususnya dilihat dari nilai p ternyata model regresi kuadratik menunjukan nilai peluang (p) < 0,05. Nilai p model regresi kuadratik kadar ALB, viskositas, rendemen, dan metil ester masing-masing berturut-turut adalah 0,000, 0,0018, 0,008 dan 0,000, hal tersebut menunjukkan bahwa model regresi kuadratik adalah tepat.
Viskositas
Rendemen
Metil ester Kadar ALB
Gambar 28 Optimasi proses transesterifikasi berdasarkan respon permukaan dan kontur terhadap kadar ALB, viskositas, rendemen dan metil ester.
Adapun persamaan model kuadratik pengaruh nisbah molar metanol dan konsentrasi katalis terhadap kadar ALB, viskositas, rendemen dan kadar metil ester adalah sebagai berikut:
Y1 = 0,831-0,088M-0,059K +0,159M2 +0,285K2 + -0,131MK Y2 = 11,140-1,053M -0,896K+2,911M2+2,986K2-2,273MK Y3 = 70,500-2,141M +0,502K-3,569M2-2,643K2-0,900MK Y4 = 93,118-1,352M +8,413K-12,898M2-7,593K2-8,470MK Dengan :
Y1 = kadar ALB, Y2 = viskositas, Y3 = rendemen, Y4 = kadar metil ester
M = nisbah molar metanol terhadap minyak, K = konsentrasi katalis NaOH terhadap berat minyak
Hasil uji kesahihan model menunjukkan bahwa model kuadratik kadar ALB, viskositas, rendemen dan kadar metil ester mempunyai nilai koefisien determinasi (R2)relatif tinggi masing-masing yaitu 96,0%, 88,3%, 89,7%, dan
97,3%. Hal itu menunjukkan bahwa 96,0%, 88,3%, 89,7%, dan 97,3%.dari keragaman pada parameter optimasi dapat dijelaskan dengan model. Uji lack of fit yang digunakan untuk menguji kecukupan model berdasarkan tabel Analisis ragam menunjukkan bahwa P-value lack of fit kadar ALB, viskositas, rendemen dan metil ester masing masing berturut-turut adalah = 0,383, 0,304, 0,066 dan 0,084 >α = 0,05 maka tidak ada lack of fit artinya model yang dibuat telah sesuai dengan data. Hasil uji residual menunjukkan bahwa plot residual menyebar acak sehingga dapat disimpulkan bahwa model regresi cukup tepat dengan data. Disamping itu plot residual mendekati garis lurus sehingga dapat disimpulkan bahwa residual telah terdistribusi normal. Uji kecukupan model juga dilakukan dengan cara menganalisis residual yaitu menguji kenormalan residual dengan menggunakan
statistik Kolmogorov-Smirnov. Nilai Statistik Kolmogorov-Smirnov untuk kadar ALB, rendemen dan viskositas masing-masing berturut-turut adalah 0,202, 0,110,
0,094 dan 0,0110 < nilai statistik tabel Kolmogorov-Smirnov dengan 13 pengamatan yaitu 0,361. Kesimpulan dari uji kenormalan residual adalah model regresi linier yang dibuat telah mengikuti distribusi normal sehingga kenormalan residual pada suatu model regresi telah dipenuhi sehingga model bisa digunakan.
Uji parameter model menunjukkan bahwa kuadrat nisbah molar metanol dan kuadrat konsentrasi katalis memiliki pengaruh penting terhadap model kadar ALB, viskositas, rendemen dan kadar metil ester dibandingkan dengan variabel nisbah molar metanol dan konsentrasi katalis. Nilai p dari pengaruh variabel kuadrat nisbah molar metanol terhadap kadar ALB, viskositas, rendemen dan metil ester masing-masing berturut-turut adalah 0,001, 0,002, dan 0,006 dan 0,000 sedangkan untuk pengaruh variabel kuadrat katalis masing-masing berturut-turut adalah 0,000, 0,002, 0,025 dan 0,000. Dengan demikian kuadrat varibel mempunyai pengaruh nyata terhadap model persamaan regresi.
Hasil analisis kanonik yang digunakan untuk menentukan titik optimum adalah penentuan titik stasioner terhadap nisbah molar metanol terhadap minyak dan persentase katalis NaOH terhadap minyak. Hasil analisis kanonik titik optimum diperoleh pada nilai kode peubah nisbah molar metanol terhadap minyak 0,1121 atau nilai aktual 6,3 :1 dan kode persentase katalis NaOH terhadap berat minyak 0,1785 atau nilai aktual persentase katalis NaOH terhadap berat minyak sebesar 1,1% dari berat minyak.
Model hasil percoban dilakukan validasi laboratorium dengan cara melakukan proses transesterifikasi sebanyak 5 kali pada kondisi optimum. Hasil pengukuran parameter proses transesterifikasi rata-rata adalah kadar ALB 0,623 % (model 0,831 %), rendemen 70,64% (model 70,50 %), kadar metil ester 95,7% (model 93,12%) dan viskositas 12,3 cSt (model 11,14 cSt). Hal tersebut menunjukkan bahwa hasil validasi model melalui percobaan mendekati hasil perhitungan model.
4.2.6.3 Peningkatan Rendemen Biodiesel
Kadar ALB minyak nyamplung hasil esterifikasi ternyata masih tergolong besar (4,3 % - 4,7%), syarat minyak nabati dapat diproses menjadi biodiesel harus mempunyai kadar ALB yang rendah yaitu ≤ 5 % (Canakci dan Van Gerpen 1999),
≤ 2 % (Lele 2005) bahkan ≤ 1 % Tyson (2005). Berdasarkan hasil penelitian menunjukkan bahwa walaupun minyak nyamplung hasil esterifikasi masih sekitar 4,3% - 4,7%, ternyata dapat diproses menjadi biodiesel dengan proses transesterifikasi pada nisbah molar metanol terhadap minyak 6:1, katalis NaOH 1%, kecepatan pengadukan 400 rpm, dan waktu 30 menit akan tetapi menghasilkan rendemen yang masih relatif rendah seperti ditunjukkan pada Gambar 29. 0,0 10,0 20,0 30,0 40,0 50,0 60,0 70,0 80,0 4,22 4,37 4,47 4,56 4,64 KadarALB (%) R e n d em en ( % )
Gambar 29 Pengaruh kadar ALB awal terhadap rendemen biodiesel pada proses transesterifikasi.
Rendemen biodiesel sangat dipengaruhi oleh kadar ALB sebelum proses transesterifikasi, hal tersebut sesuai dengan Tyson (2005) yang menyatakan bahwa minyak yang mengandung asam lemak bebas 10 % apabila diproses menjadi biodiesel dengan transesterifikasi akan kehilangan rendemen sebesar 30 %. Lee et al. (2002) menyatakan bahwa rendemen transesterifikasi dapat ditingkatkan dari 25% menjadi 96% dengan menurunkan kadar asam lemak bebas dan air masing-masing berturut-turut 10 % menjadi 0,23 % dan 0,2 % menjadi 0,02 %. Usaha meningkatkan rendemen biodiesel dilakukan dengan memperbaiki bahan baku proses transesterifikasi dengan cara melakukan esterifikasi ulang, netralisasi atau dengan transesterifikasi ulang. Esterifikasi ganda dilakukan oleh Canacki dan Van Garven (2003) pada proses pembuatan biodiesel dari lemak.
Dengan melakukan esterifikasi ulang ternyata dapat meningkatkan rendemen biodiesel secara signifikan seperti ditampilkan pada Tabel 32. Rendahnya rendemen biodiesel disebabkan oleh terbentuknya sabun selama proses transesterifikasi. Sabun dalam biodiesel akan menarik metil ester selama proses pencucian. Dengan demikian semakin banyak sabun yang terbentuk, semakin besar penurunan rendemen. Usaha lain untuk meningkatkan rendemen dapat dilakukan dengan dua kali proses transesterifikasi atau dengan proses netralisasi. Transesterifikasi pertama bertujuan untuk mengurangi kadar ALB sekaligus menkonversi sebagian trigliserida menjadi metil ester sedangkan transesterifikasi kedua lebih difokuskan untuk menkonversi sisa trigliserida menjadi metil ester. Proses netralisasi secara laboratorium belum bisa menghasilkan ALB yang rendah kurang dari 1% dan kehilangan selama proses netralisasi cukup besar karena sebagian metil ester yang terbentuk terikut oleh sabun pada saat dilakukan
pencucian. Proses netralisasi untuk meningkatkan rendemen biodiesel kurang efektif dibanding dengan esterifikasi ulang. Esterifikasi ulang dengan nisbah molar metanol terhadap minyak 40:1 dan katalis HCl terhadap minyak 10% dapat meningkatkan rendemen biodiesel dari 71,6% menjadi sekitar 83,4%. Usaha untuk menurunkan kadar ALB dengan melakukan esterifikasi berikutnya dilakukan namun tidak signifkan menurunkan kadar ALB.
Tabel 32 Rendemen dan kadar ALB biodiesel rata-rata dari proses esterifikasi dan transesterifikasi yang dihitung berdasarkan minyak nyamplung kasar
No. Variasi Kondisi Proses Biodiesel
Kadar ALB (%) rata-rata
Rendemen* (%)
1. E T • E : nisbah molar metanol terhadap ALB 20:1, persentase katalis HCL terhadap berat ALB 6 %, suhu 60oC,
pengadukan 300 rpm dan waktu 30 menit.
• T: nisbah molar metanol terhadap minyak 6:1, katalis NaOH terhadap berat minyak 1%, suhu 60 oC,
pengadukan 400 rpm dan waktu 30 menit.
E: 4,45 T: 0,44
71,6
2. E1E2T • E1: nisbah molar metanol terhadap
ALB 20:1, persentase katalis HCL terhadap ALB 6 %, suhu 60 oC,
pengadukan 300 rpm dan lama 30 menit.
• E2: nisbah molar metanol terhadap
ALB 40:1, persentase katalis HCL dari berat ALB 10%, suhu 60 oC,
pengadukan 300 rpm dan lama 30 menit.
• T1: nisbah molar metanol 6:1,
persentase katalis NaOH terhadap minyak 1%, suhu 60 oC, pengadukan
400 rpm dan lama 30 menit.
E1 = 4,65
E2 = 2,32
T = 0,36
83,4
E: Esterifikasi, T: Transesterifikasi
*: Rendemen dihitung berdasarkan bobot minyak kasar
Rendemen tersebut mendekati hasil penelitian Canacki dan Van Garven (2003) yang menyatakan bahwa proses produksi biodiesel dari yellow grease dengan kadar ALB 9% melalui proses esterifikasi pertama dengan katalis asam sulfat 5% dan
nisbah molar metanol 20:1, esterifikasi dua dengan katalis asam sulfat 5 % dan nisbah molar metanol 40:1 berdasarkan jumlah ALB kemudian transesterifikasi dengan katalis NaOCH3 0,82%dan nisbah molar metanol 6:1 berdasarkan jumlah trigliserida menghasilkan biodiesel dengan rendemen 90,2% akan tetapi untuk bahan baku brown grease dengan kadar ALB awal 39,6 % rendemen turun menjadi 73,9%.
4.2.7 Analisis Model Kinetika Reaksi Transesterifikasi
Kinetika reaksi berguna untuk menetapkan kondisi operasi, metode pengendalian, kebutuhan peralatan dan teknologi dari suatu proses kimia, sehingga dapat dimanfaatkan untuk merancang reaktor (Petrucci, 1992). Pengukuran kinetika reaksi transesterifikasi digunakan untuk perancangan reaktor batch khususnya waktu tinggal Hill (1977); Perry (1988), Richardson and Peacock (1994). Pengukuran kinetika reaksi transesterifikasi dilakukan pada kondisi optimum yang diperoleh pada optimasi proses pada tahap sebelumnya yaitu pada nilai peubah nisbah molar metanol terhadap minyak 6,3:1 dan konsentrasi katalis NaOH terhadap minyak 1,1%.
4.2.7.1 Penetapan Model Kinetika Reaksi Transesterifikasi
Penentuan tetapan laju reaksi transesterifikasi menggunakan metode isolasi (Atkins 1999yang dikombinasikan dengan metode integral (Laidler 1979) dengan asumsi reaksi berlangsung secara irreversibel (lihat lampiran 14). Hubungan konsentrasi metil ester hasil transesterifikasi dengan waktu transesterifikasi disajikan pada Gambar 30 sedangkan konversi gliserida menjadi metil ester dapat dilihat pada Tabel 33.
0,00 0,50 1,00 1,50 2,00 2,50 3,00 0 5 10 15 20 25 30 Waktu (menit) K ad a r M et il est e r ( m ol /L 28 oC 45 oC 60 oC 70oC
Gambar 30 Kadar metil ester dari proses transesterifikasi pada berbagai suhu dan waktu.
Tabel 33 Konversi trigliserida menjadi metil ester selama proses transesterifikasi Waktu
(menit) 28oC Konversi (mol/liter) 45 oC 60 oC 70 oC 0 0,000 0,000 0,000 0,000 5 0,089 0,127 0,259 0,323 10 0,236 0,314 0,467 0,560 15 0,359 0,450 0,653 0,668 20 0,494 0,580 0,666 0,679 25 0,588 0,636 0,690 0,687 30 0,622 0,679 0,700 0,696
Pola hubungan peningkatan kadar metil ester selama transesterifikasi menyerupai hasil penelitian Freedman et al. 1986; Sofiah, (1999); Darnoko dan Cheryan, (2000) ; Cheng et al. (2004). Penentuan orde reaksi dilakukan dengan metode integral, merupakan metode trial and error (empiris) yakni perubahan konsentrasi diukur secara periodik selang waktu tertentu dan harga k dihitung dengan menggunakan persamaan terintegrasi berbeda untuk orde reaksi yang berbeda yang memberikan nilai k yang konsisten. Nilai k yang paling konsisten diperoleh pada orde total dua.
Grafik hubungan antara 1/(3[T]o-[Mo]) ln ([M]o[T]/[[M][To]) dengan waktu pada berbagai suhu esterifikasi dapat dilihat pada Gambar 31. Hubungan antara Nilai ln([ME]o /[ME]t) dengan waktu reaksi menunjukkan tidak linier, maka
nilai k diambil pada kemiringan garis awal yang mendekati linier sesuai dengan Goud et al. (2006). 28 oC y = -0,0136x R2 = 0,9395 60 oC y = -0,0251x R2 = 0,9313 45 oC y = -0,0182x R2 = 0,9598 70 oC y = -0,0287x R2 = 0,9185 -0,8000 -0,7000 -0,6000 -0,5000 -0,4000 -0,3000 -0,2000 -0,1000 0,0000 0 5 10 15 20 25 30 35 Waktu (menit) 1/(3[T]o-[Mo]) ln ([M]o[T]/[[M][To])
Gambar 31 Grafik hubungan 1/((3[T]o-[Mo]) ln([M]o[T]/[[M][To] dengan waktu. Tetapan laju reaksi transesterifikasi pada suhu 341 K, 333 K, 318 K dan 301 K masing-masing berturut-turut adalah 0,014 liter /mol menit, 0,018 liter / mol menit, 0,025 liter /mol menit dan 0,029 liter / mol menit. Cheng et al. (2004) mengukur tetapan laju reaksi transesterifikasi pada minyak sawit dengan nisbah molar metanol terhadap minyak 6:1. suhu 60 oC, kecepatan pengadukan 350 rpm dan katalis NaOH 0.125 mol/kg dengan menggunakan orde dua diperoleh nilai k sebesar 0.097 liter /mol menit.
4.2.7.2 Model Kinetika Reaksi Transesterifikasi Orde Dua Berdasarkan Persamaan Arhenius k1 = A exp(-Ea/RT). Ea ln k1 = ln A – RT EA /R -ln k1 = - C T
Y = a x - C dengan gradien (a) = -Ea/R dan x = 1/T. k1 = tetapan laju reaksi
Ea = energi aktivasi
R = tetapan gas= 1,987 cal/ g mol K T = suhu mutlak
A = tetapan proporsionalitas yang besarnya tergantung dari frekuensi tumbukan dan orientasi molekul selama tumbukan
Berdasarkan persamaan di atas maka energi aktivasi suatu reaksi kimia adalah slope (kemiringan) dari grafik linier antara ln k dengan 1/T. Penentuan energi aktivasi proses transesterifikasi antara minyak sawit dan metanol dengan katalis NaOH menggunakan grafik linier hubungan antara ln k dengan 1/T dilakukan oleh Noureddini dan Zhu (1997), Darnoko dan Cheryan, (2000) dan Cheng et al. (2004). Grafik hubungan antara -ln k dengan 1/T proses transesterifikasi pada suhu 303 K, 318 K dan 333 K sebagai berikut:
y = 1879,8x - 1,9355 R2 = 0,9949 0,000 0,500 1,000 1,500 2,000 2,500 3,000 3,500 4,000 4,500 5,000 0,0028 0,0029 0,0030 0,0031 0,0032 0,0033 0,0034 Waktu (menit) -l n k
Gambar 32 Hubungan antara –ln k dengan 1/T pada proses transesterifikasi minyak biji nyamplung.
Berdasarkan gambar tersebut diperoleh persamaan y =1879,8x – 1,9355 dengan R2 = 0,9949 dengan demikian diperoleh ln A = 3,473 dan nilai Ea/R adalah 1879,8 maka:
Ea = 3735,2 cal/ mol K = 3,752 k cal / mol K A = 6,9 liter / mol menit
Sehingga persamaan tetapan laju reaksi (k) dan laju reaksi (r) transesterifikasi minyak nyamplung adalah :
-ln k1 = (Ea/R) 1/T - ln A k1 = A exp(Ea/RT)
k1 = 6,9 exp(-Ea/RT) k1 = 6,9 exp (-1879 ,8 /T) karena rT = k1 [TG] [M]
rT = 6,9 exp (-1879 ,8 /T) [TG] [M]
= 6,9 exp (-1879 ,8 /T) ([TG]o – x) ([M]o-3x)
Dengan model tersebut dapat ditentukan nilai k pada berbagai suhu dalam kisaran suhu percobaan (301 K- 343 K) misalnya apabila digunakan suhu 325 K maka diperoleh nilai k sebesar 0,0213 liter /mol menit.
4.2.7.3 Perancangan Waktu Reaksi Ideal dalam Reaktor Batch
Massa dalam reaktor batch isotermal (endotermis/ eksotermis) digunakan untuk menentukan waktu reaksi batch ideal :
Rate of input – rate out put –rate of reaction = rate of accumulation 0 - 0 - V rT = d [ME]/ dt
Volume (V) konstan, sehingga : d[E] −−−−− = rT, karena d[ME]/dt = dx/dt dt d[x] r = −−−−− = k1 ( [TG]o - x ) ( [M]o-3x ) dt
Waktu reaksi yang dibutuhkan untuk mencapai konsentrasi metil ester [ME] pada kondisi isothermal adalah :
x d[x] t = 1/k1 ( [TG]o - x ) ( [M]o-3x ) 0 -1 1 1 t = 1/k1 ln ln 3 [TG]o -1 [M]o ( [TG]o - x ) ( [M]o - 3x )
Karena [TG = [TG]o –x dan [M] = [M]o – 3 x maka persamaan menjadi: -1 [TG] [M]o
t = 1/k1 ln 3 [TG]o -1[M]o ( [TG]o [M]
t = 21,01 menit.
Pada kondisi isotermal suhu 60 °C, untuk mendapatkan konsentrasi ME sebesar 2,659 mol /liter (95,25 %) dari minyak hasil esterifikasi yang mengandung 0,751 mol/liter (25,339%) metil ester atau untuk menurunkan trigliserida dari 0,791 mol/liter menjadi 0,10 mol/liter diperlukan waktu reaksi sebesar 21,01 menit. Perhitungan waktu ideal reaksi transesterifikasi dapat dilihat pada Lampiran 15. Jika menggunakan waktu esterifikasi 20 menit maka diprediksi konsentrasi trigliserida menjadi 0,105 mol/liter dan konsentrasi metil ester yang diperoleh menjadi 2,53 mol/liter atau 90,7 %. Konsentrasi metil ester akhir transesterifikasi hasil perhitungan menggunakan kinetika reaksi (prediksi) dengan validasi percobaan laboratorium ditampilkan pada Tabel 34 yang menunjukkan bahwa kadar metil ester hasil percobaan mendekati hasil perhitungan.
Tabel 34 Prediksi kadar metil ester minyak biji nyamplung setelah transesterifikasi dibandingkan hasil percobaan
Ulangan Hasil Percobaan (%) Perhitungan kinetika (%) 1 92.17 90,7 2 92.46 3 91,36 4 91.84 5 91.62 Rata-rata 92.02 90,7
4.2.8 Analisis Kualitas Produk
4.2.8.1 Pengujian Komposisi Asam Lemak dengan GC MS
Komposisi kimia biodiesel dari minyak biji nyamplung dianalisis dengan menggunakan kromatografi gas serapan massa atau Gas Chromatography Mass Spectrofotometer (GCMS). Hasil pengujian komposisi kimia biodiesel dari minyak biji nyamplung dengan GCMS ditampilkan Tabel 35 sedangkan kromatogramnya ditampilkan pada Gambar 33. Biodiesel dari minyak biji nyamplung terdiri atas metil ester yang berasal dari asam lemak jenuh dan tidak jenuh (C:8-C:22) dengan metil ester yang dominan adalah metil palmitat, metil stearat, metil oleat dan metil linoleat. Sejumlah kecil metil ester yang berasal dari asam lemak rantai pendek diantaranya adalah metil kaprilat dan metil pelargonat. Metil ester yang berasal dari lemak jenuh rantai panjang diantaranya adalah metil arakhidat, metil erukat, dan metil behenat.
4.2.8.2 Pengujian Sifat Fisiko-Kimia
Uji karakterisitik biodiesel dari minyak biji nyamplung mengacu pada ASTM D6751-3 dan SNI 04-7182-2006. Pengujian karakteristik biodiesel dari minyak biji nyamplung dilakukan di Pusat Pengembangan dan Penelitian Minyak dan Gas Bumi Lemigas Jakarta dan Laboratorium Pengujian Mutu VEDCA (Lampiran 16). Hasil pengujian biodiesel dari minyak biji nyamplung dibandingkan dengan standar ASTM D6751-3 dan SNI 04-7182-2006 disajikan pada Tabel 36 dan Tabel 37.

![Gambar 22 Grafik hubungan antara 1/([ALB] t -1/([ALB] o dengan waktu reaksi untuk penentuan nilai k reaksi esterifikasi](https://thumb-ap.123doks.com/thumbv2/123dok/1999380.2683607/22.918.171.759.114.1179/gambar-grafik-hubungan-waktu-reaksi-penentuan-reaksi-esterifikasi.webp)