BAB 2
TINJAUAN KEPUSTAKAAN 2.1. Otitis Media Supuratif Kronis (OMSK)
Otitis Media Supuratif Kronis (OMSK) adalah radang kronis telinga tengah dengan perforasi membran timpani dan riwayat keluarnya sekret dari telinga (otorea) lebih dari 3 bulan, baik terus menerus atau hilang timbul. Sekret mungkin encer atau kental, bening atau berupa nanah (World Health Organization 2004; Helmi 2005; Chole & Nason 2009
OMSK dibagi menjadi dua tipe yaitu tipe benigna dan tipe bahaya. OMSK tipe bahaya adalah OMSK yang mengandung kolesteatoma,
).
disebut tipe bahaya karena sering menimbulkan komplikasi berbahaya (Helmi 2005; Chole & Nason 2009).
Insidens OMSK tinggi di negara berkembang, karena lingkungan yang padat, pelayanan kesehatan yang tidak memadai, higiene yang buruk, dan infeksi saluran pernafasan atas yang rekuren, nutrisi yang kurang dan polusi (World Health Organization 2004; Chole & Nason 2009).
OMSK tipe bahaya disebut juga tipe atikoantral. Komplikasi umumnya disebabkan jaringan granulasi dan kolesteatoma yang menyebabkan erosi dan nekrosis yang mengenai struktur penting seperti nervus fasialis, telinga dalam dan komponen intrakranial. Dapat terjadi erosi tulang pendengaran dan menyebabkan ketulian (Browning et al. 2008; Rout et al. 2012).
2.1.1.
Faktor risiko pada otitis media adalah disfungsi tuba Eustachius (misalnya rinosinusitis, hipertrofi adenoid, atau karsinoma nasofaring), imunodefisiensi (primer atau didapat), gangguan fungsi silia, anomali midfasial kongenital (cleft palate atau Down syndrome), dan refluks gastroesofageal. Faktor risiko yang menonjol pada OMSK adalah infeksi otitis media yang berulang dan orang tua dengan riwayat otitis media
kronis dengan perawatan yang tidak baik (World Health Organization 2004; Ramakrishnan et al. 2005; Bhat et al. 2009; Chole & Nason 2009). Kuman yang terdapat di telinga tengah dapat masuk dari liang telinga luar melalui perforasi membran timpani ataupun melalui nasofaring.
Streptococcus pneumoniae merupakan bakteri yang terbanyak dijumpai pada otitis media akut. Pada isolasi dari otitis media kronis, kuman aerobik dan anaerobik juga terlibat pada sebagian kasus. Kuman aerob yang sering dijumpai adalah Pseudomonas aeruginosa, Staphylococcus aureus, basil gram negatif seperti Escherichia coli, Proteus species, dan
Klebsiella species. Kuman anaerob yang paling sering dijumpai adalah
Bacteroides spp. dan Fusobacterium spp. (World Health Organization 2004; Chole & Sudhoff 2005; Wright & Valentine 2008; Chole & Nason 2009).
Jamur dapat pula dijumpai pada otitis media kronis khususnya
Aspergillus spp. dan Candida spp. Jamur mungkin dapat tumbuh berlebihan setelah pemakaian obat tetes antibiotika (Chole & Nason 2009).
2.1.2. Patogenesis OMSK
Ada dua mekanisme perforasi kronis yang dapat menyebabkan infeksi telinga tengah yang berlanjut atau berulang: (1) Bakteri dapat mengkontaminasi telinga tengah secara langsung dari telinga luar karena efek proteksi barier fisikal membran timpani telah hilang. (2) Membran timpani yang utuh secara normal menghasilkan bantalan gas, yang menolong untuk mencegah refluks sekresi nasofaring ke dalam telinga tengah melalui tuba Eustachius. Hilangnya mekanisme protektif ini menyebabkan terpaparnya telinga tengah terhadap bakteri patogen dari nasofaring (Yates & Anari 2008).
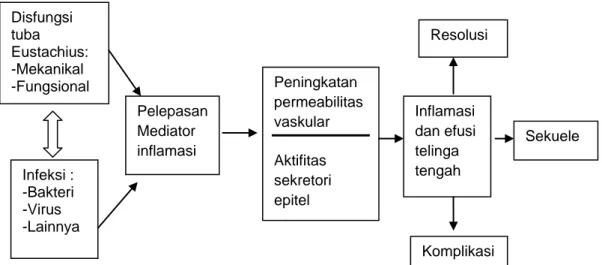
Gambar 2.1. Patogenesis Otitis Media (Juhn et al. 2008)
OMSK ditandai dengan keadaan patologis yaitu inflamasi yang ireversibel di telinga tengah dan mastoid. Disfungsi tuba Eustachius memegang peranan penting pada otitis media akut dan otitis media kronis. Kontraksi muskulus veli palatini menyebabkan tuba Eustachius membuka selama proses menelan dan pada kondisi fisiologik tertentu, mengalirkan sekret dari telinga tengah ke nasofaring, mencegah sekret dari nasofaring refluks ke telinga tengah dan menyeimbangkan tekanan antara telinga tengah dengan lingkungan luar (Chole & Nason 2009). Bila bakteri memasuki telinga tengah melalui nasofaring atau defek membran timpani, terjadi replikasi bakteri di dalam efusi serosa. Hal ini diikuti oleh pelepasan mediator inflamasi ke dalam ruang telinga tengah. Hiperemia dan leukosit polimorfonuklear yang mendominasi fase inflamasi akut memberi jalan pada fase kronis, ditandai dengan mediator selular mononuklear (makrofag, sel plasma dan limfosit), edema persisten dan jaringan granulasi. Selanjutnya dapat terjadi metaplasia epitel telinga tengah, dimana terjadi perubahan epitel kuboidal menjadi epitel kolumnar
pseudostratified yang mampu meningkatkan sekret mukoid. Jaringan granulasi menjadi lebih fibrotik, kadang-kadang membentuk adhesi terhadap struktur penting di telinga tengah. Hal ini akan mengganggu
Infeksi : -Bakteri -Virus -Lainnya Disfungsi tuba Eustachius: -Mekanikal -Fungsional Pelepasan Mediator inflamasi Peningkatan permeabilitas vaskular Aktifitas sekretori epitel Inflamasi dan efusi telinga tengah Resolusi Komplikasi Sekuele
aerasi antrum dan mastoid dengan mengurangi ruang antara osikel dan mukosa yang memisahkan telinga tengah dari antrum. Obstruksi kronis menyebabkan perubahan ireversibel di dalam tulang dan mukosa (Chole & Nason 2009).
2.1.3. Diagnosis OMSK
Diagnosis OMSK dibuat berdasarkan riwayat penyakit dan pemeriksaan fisik. Gejala klinis meliputi tuli, otorea, otalgia, obstruksi hidung, tinitus dan vertigo. Tuli dan otorea merupakan gejala yang paling umum terjadi
(Chole & Nason 2009).
OMSK ditandai oleh otorea yang banyak dan intermiten, bila disertai dengan kolesteatoma yang terinfeksi maka menimbulkan bau busuk. Nyeri dapat terjadi sebagai tanda komplikasi intrakranial dari kolesteatoma. Gejala lainnya adalah otorea yang berdarah, vertigo akibat fistula labirin, paralisis nervus fasialis atau gejala neurologis akibat penyebaran intrakranial. Jaringan granulasi sering yang sering dijumpai pada otitis media kronis disebabkan oleh reaksi inflamasi (Yates & Anari 2008; Chole & Nason 2009).
Diagnosis OMSK dan kolesteatoma telinga biasanya dilakukan dengan pemeriksaan otomikroskopik. Perlu juga untuk mengevaluasi nasofaring karena disfungsi tuba Eustachius sering menyebabkan OMSK pada beberapa kasus. Pemeriksaan dengan mikroskop akan membantu untuk mengidentifikasi perforasi membran timpani, retraction pockets, kolesteatoma, dan jaringan granulasi. Primary acquired kolesteatoma akan terlihat pada daerah posterosuperior membran timpani yang tampak seperti defek mutiara putih yang mengandung debris keratin, sementara
secondary acquired kolesteatoma dapat dilihat di belakang membran timpani (Yates & Anari 2008; Chole & Nason 2009).
Pemeriksaan pencitraan mastoid perlu untuk melihat perluasan penyakit dan untuk mengidentifikasi kolesteatoma. Walaupun Computed Tomography (CT) dianggap merupakan ”gold standard” untuk
mendiagnosis kolesteatoma, namun spesifitasnya kurang untuk membedakan kolesteatoma dengan jaringan granulasi atau edema. Pada
CT, kolesteatoma terlihat sebagai lesi yang halus dan berbatas tajam, umumnya CT dilakukan tanpa kontras (Wright & Valentine 2008; Chole & Nason 2009).
Pada pemeriksaan dengan magnetic resonance imaging (MRI) kolesteatoma terlihat sebagai low signal pada T1-weighted images dan
high signal pada T2-weighted images. MRI dengan gadolinium sangat berguna bila disangkakan terjadi komplikasi intrakranial karena keunggulannya dalam visualisasi densitas jaringan lunak. MRI juga efektif untuk mendiagnosis penyakit yang menyebar ke apeks petrosa (Wright & Valentine 2008;
2.1.4. Penatalaksanaan OMSK
Chole & Nason 2009).
Tujuan penatalaksanaan OMSK adalah untuk menyembuhkan gejala dan meminimalisir risiko komplikasi penyakit. Pembedahan adalah satu-satunya pengobatan yang efektif pada kolesteatoma. Granulasi dan inflamasi mukosa sementara dapat diatasi dengan obat topikal dan aural toilet untuk mengurangi otorea sambil menunggu operasi (Wright & Valentine 2008).
Terdapat berbagai macam teknik operasi untuk menangani kolesteatoma, yang secara umum dapat dibagi atas open cavity (canal wall down) dan closed cavity (intact canal wall) mastoidektomi (Wright & Valentine 2008).
a. Canal wall down procedures
Prosedur ini mengeluarkan dan mengangkat semua kolesteatoma, termasuk dinding posterior liang telinga, sehingga kavum mastoid berhubungan langsung dengan liang telinga luar (Helmi 2005; Merchant, Rosowski & Shelton 2009; Dhingra 2010).
b. Intact Canal Wall Procedures
Keuntungan intact canal wall mastoidectomy adalah anatomi normal dinding posterior liang telinga dapat dipertahankan tanpa perlu membuang dan merekonstruksi skutum.
Prosedur ini sering dilakukan pada kasus primary acquired cholesteatoma bila kolesteatoma terdapat di atik dan antrum. Dilakukan
complete cortical mastoidectomy dan antrum mastoid dapat dilihat. Diseksi matriks kolesteatoma harus dilakukan dengan hati-hati. Rekurensi dapat terjadi bila fragmen kecil dari epitel berkeratinisasi tertinggal. Sering diperlukan “second look operation” setelah 6-12 bulan kemudian disebabkan rekurensi kolesteatoma (Wright & Valentine 2008; Chole & Nason 2009).
2.2. Kolesteatoma
Kolesteatoma adalah suatu kista epitel yang dilapisi oleh stratified squamosa epithelium yang berisi deskuamasi epitel (keratin) yang terperangkap dalam rongga timpanomastoid, tetapi dapat juga terperangkap di bagian manapun dari tulang temporal yang berpneumatisasi (Levine & Souza 2003; Meyer, Strunk & Lambert 2006). 2.2.1. Definisi
2.2.2. Sejarah kolesteatoma
Istilah kolesteatoma pertama sekali dikemukakan oleh Johannes Müller pada tahun 1838 untuk menjelaskan apa yang kita sebut sebagai kista epidermal pada tulang temporal yang berpneumatisasi (Chole & Nason 2009).
Friedmann pada tahun 1959 mendefinisikan kolesteatoma sebagai suatu struktur kistik yang dilapisi oleh stratified squamous cell epithelium,
dapat mengandung beberapa elemen dari mukosa asalnya (Dornelles et al. 2005).
Schuknecht (1974) seperti yang dikutip oleh Dornelles et al. (2005) mendefinisikan kolesteatoma sebagai akumulasi eksfoliasi keratin di dalam telinga tengah atau pada area pneumatisasi tulang temporal, yang berasal dari keratinized squamous epithelium. Secara informal kolesteatoma dapat dikarakteristikkan sebagai “kulit di tempat yang salah” Kolesteatoma telinga tengah yang acquired (didapat) pertama sekali diterangkan oleh Curveilhier (1829) dimana karakteristiknya adalah adanya invasi keratinized squamous epithelium ke kavum timpani, yang berbeda dari columnar pseudostratified ciliated epithelium, dengan sel goblet yang terdapat pada tuba auditorius atau simple, cubic atau columnar squamous cell epithelium pada telinga tengah. Berbeda dari namanya, kolesteatoma tidak mengandung lemak atau kolesterol di dalam matriksnya (Chole & Nason 2009; Vitale et al. 2011).
2.2.3. Epidemiologi
Prevalensi kolesteatoma belum diketahui secara pasti. Chole & Nason (2009) menyebutkan insidens kolesteatoma berkisar antara 3-12 kasus per 100.000 populasi. Tos (1988) seperti yang dikutip oleh Chole & Sudhoff (2005) menemukan insidens tahunan pada anak-anak sebesar 3 per 100.000 sedangkan pada dewasa 12,6 per 100.000 populasi. Harker (1977) di Birmingham seperti yang dikutip oleh Chole & & Sudhoff (2005) mendapatkan insidens tahunan kolesteatoma adalah 6 per 100.000 populasi.
Pada tulang temporal manusia dengan otitis media kronis, didapati kolesteatoma pada 36% telinga dengan perforasi dan 4% tanpa perforasi membran timpani (Chole & Sudhoff 2005). Jenis kelamin pria lebih banyak menderita kolesteatoma (Chole & Nason 2009; Nunes et al. 2009).
Jumlah pasien OMSK dengan kolesteatoma di Departemen THT-KL RSUP H. Adam Malik Medan periode 1 Januari 2006-31 Desember 2010
sebanyak 119 pasien (Siregar 2013), sedangkan Lubis (2010) mendapatkan 38,7% kasus OMSK merupakan OMSK dengan kolesteatoma.
2.2.4. Histopatologi
Berdasarkan histopatologi, kombinasi dari material keratin dan
stratified squamous epithelium merupakan diagnosis patologi untuk kolesteatoma. Adanya epitel skuamosa di telinga tengah adalah abnormal. Pada keadaan normal telinga tengah dilapisi oleh epitel kolumnar bersilia di bagian anterior dan inferior kavum timpani serta epitel kuboidal di bagian tengah dari kavum timpani dan di atik.
Tidak seperti yang terdapat pada epidermis kulit, epitel skuamosa ini tidak mempunyai struktur adneksa. Hal ini mungkin karena letaknya berbatasan dengan jaringan granulasi atau fibrosa yang mengalami inflamasi, dan juga reaksi giant cell pada material keratin (Caponetti, Thompson & Pantanowitz 2009; Mills 2009).
Secara histologis kolesteatoma dapat dibagi dua: matriks (epithelium) dan peri-matriks (underlying connective tissue). Matriks kolesteatoma mempunyai 4 lapisan yang berbeda: basal, spinosus, granulous dan stratum korneum, seperti yang terdapat pada kulit yang tipis. Peri-matriks ditandai oleh adanya jaringan ikat longgar yang terbuat dari kolagen dan
elastic fibers, fibroblas and sel inflamasi (Vitale et al. 2011).
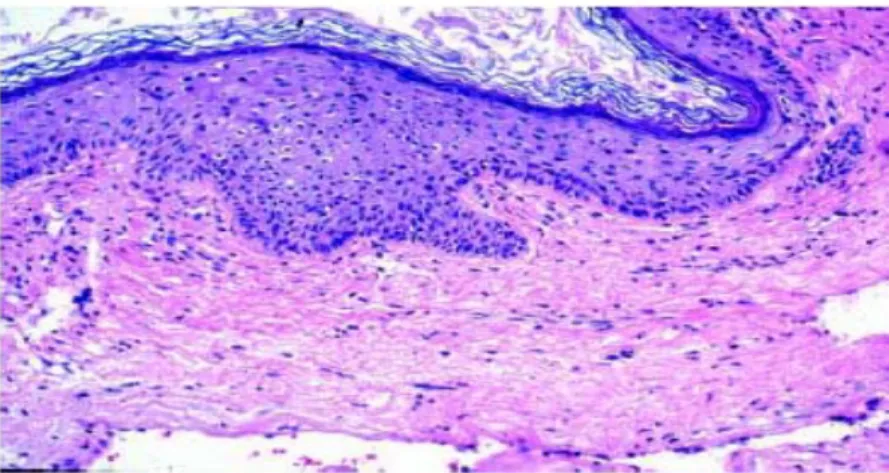
Analisis histologis dari matriks kolesteatoma memperlihatkan pola yang berbeda yaitu atrofi, akantosis, hiperplasia lapisan basal dan
Gambar 2.2. Histopatologi kolesteatoma (Wenig 2009).
2.2.5. Patogenesis kolesteatoma
Kolesteatoma dapat diklasifikasikan menjadi congenital dan acquired.
Kolesteatoma acquired dibagi menjadi primer dan sekunder. Primary acquired cholesteatoma adalah kolesteatoma yang berasal dari retraksi pars flaksida, sedangkan secondary acquired cholesteatoma adalah kolesteatoma yang terjadi akibat perforasi membran timpani, biasanya pada kuadran posterior superior telinga tengah (Chole & Nason 2009). Patogenesis kolesteatoma acquired telah diperdebatkan selama lebih dari satu abad. Ada 4 teori dasar patogenesis kolesteatoma acquired: 1. invaginasi membran timpani (retraction pocket cholesteatoma); 2. hiperplasia sel basal; 3. pertumbuhan epitel melalui perforasi (the
migration theory); dan 4. metaplasia skuamosa dari epitel telinga tengah. Saat ini Sudhoff dan Tos mengemukakan kombinasi dari teori invaginasi dan sel basal sebagai penjelasan dari pembentukan retraction pocket
kolesteatoma (Chole & Sudhoff 2005; Chole & Nason 2009).
a. Teori invaginasi
Teori invaginasi pembentukan kolesteatoma secara umum diterima sebagai salah satu mekanisme primer dalam pembentukan atik kolesteatoma. Retraction pockets dari pars flaksida terjadi karena tekanan negatif telinga tengah dan kemungkinan disebabkan inflamasi berulang.
Ketika retraction pocket membesar, deskuamasi keratin tidak dapat dibersihkan dari reses sehingga terbentuk kolesteatoma. Asal dari
retraction pocket kolesteatoma disangkakan adalah disfungsi tuba Eustachius atau otitis media efusi dengan resultante tekanan telinga tengah (ex vacuo theory). Pars flaksida, yang kurang fibrous dan kurang tahan terhadap pergerakan, biasanya adalah sumber kolesteatoma. Tipe kolesteatoma tersebut terlihat sebagai defek pada kuadran posterior superior membran timpani dan erosi dari dinding liang telinga yang berdekatan. Kegagalan migrasi epitel ini menyebabkan akumulasi keratin dalam retraction pocket. Bakteri dapat menginfeksi matriks keratin, membentuk biofilm yang menyebabkan infeksi kronis dan proliferasi epitel (Chole & Sudhoff 2005; Chole & Nason 2009).
b. Teori invasi epitel
Teori ini menyatakan invasi epitel skuamosa dari liang telinga dan permukaan luar dari membran timpani mempunyai kemampuan bermigrasi ke telinga tengah melalui perforasi marginal atau perforasi atik. Epitel akan masuk sampai bertemu dengan lapisan epitel yang lain, yang disebut dengan contact inhibition (Chole & Nason 2009).
Jika mukosa telinga tengah terganggu karena inflamasi, infeksi atau trauma karena perforasi membran timpani, mucocutaneus junction secara teori bergeser ke kavum timpani. Menyokong teori ini van Blitterswijk dkk menyatakan bahwa cytokeratin (CK) 10, yang merupakan intermediate filament protein dan marker untuk epitel skuamosa, ditemukan pada epidermis liang telinga dan matriks kolesteatoma tetapi tidak ada di mukosa telinga tengah. Perforasi marginal memaparkan mukosa telinga tengah dan struktur tulang liang telinga terhadap liang telinga luar (Chole & Nason 2009).
Palva dan peneliti lain menunjukkan perubahan histologis ini pada tulang temporal manusia. Kolesteatoma yang berasal dari fraktur tulang temporal dapat terjadi dari mekanisme ini. Fraktur liang telinga
menyebabkan pertumbuhan epitel berkeratinisasi dengan mekanisme kontak (Chole & Sudhoff 2005).
Namun perforasi sentral membran timpani tidak bisa di katakan sebagai “safe ears”. Analisis terbaru dari perforasi sentral membran timpani dari pasien otitis media kronis, 38% mengalami pertumbuhan epidermal dengan mucocutaneus junction terletak di luar permukaan dalam dari perforasi (Chole & Nason 2009).
c. Teori hiperplasia sel basal
Pada tahun 1925, Lange mengobservasi bahwa sel epitel berkeratinisasi pada pars flaksida dapat menginvasi ruang sub epitel normal yang akan menyebabkan terbentuknya kolesteatoma di atik. (Chole & Nason 2009).
Sel epitel (prickle cells) dari pars flaksida dapat menginvasi jaringan subepitelial dengan cara proliferasi kolum sel epitel. Epitel yang menginvasi lamina propria, basal lamina (basement membrane) menjadi berubah. Huang dan Masaki meneliti teori ini dengan memperlihatkan bahwa pertumbuhan epitel membran timpani dapat diinduksi dengan meneteskan propylene glycol ke telinga tengah mencit. Kerusakan lamina basalis menyebabkan invasi epitel ke dalam jaringan ikat subepitel dan membentuk mikrokolesteatoma. Mekanisme ini dapat menerangkan beberapa tipe kolesteatoma, termasuk yang terbentuk di belakang membran timpani yang intak. Mikrokolesteatoma membesar dan mengadakan perforasi secara sekunder melalui membran timpani (Chole & Sudhoff 2005).
Perubahan diferensiasi keratinosit dan lapisan sel basal matriks kolesteatoma telah diteliti pada beberapa penelitian. Distribusi abnormal dari marker diferensiasi epidermal, seperti filaggrin dan involucrin, c-jun
dan p53 proteins, dan peningkatan reseptor epidermal growth factor terlihat dalam matriks kolesteatoma telinga tengah. Peningkatan CK 13
mendemonstrasikan peningkatan ekspresi CK 13 dan 16 pada area perifer pars tensa yang diinduksi oleh kolesteatoma oleh ligasi liang telinga dan area perifer dan sentral pars tensa yang diinduksi kolesteatoma oleh obstruksi tuba Eustachius.Peningkatan ekspresi
human intercellular adhesion molecule-1 dan –2 memiliki peran migrasi sel ke jaringan. Adanya heat shock protein 60 dan 70 menunjukkan proliferasi dan diferensiasi aktif dari keratinosit basal yang berhubungan dengan kolesteatoma (Chole & Sudhoff 2005).
Berbagai laporan menyatakan respon imun terlibat pada hiperproliferasi epitel kolesteatoma. Sel Langhan's dapat menyebabkan reaksi imun dan menunjang proliferasi epitel berkeratinisasi oleh IL-1α (Chole & Sudhoff 2005).
d. Teori metaplasia skuamosa
Infeksi atau inflamasi jaringan yang kronis dapat mengalami transformasi metaplasia. Epitel kuboid pada telinga tengah dapat berubah menjadi epitel berkeratinisasi. Epitel skuamosa berkeratinisasi telah ditemukan pada biopsi telinga tengah pada penderita otitis media pada anak. Namun progresivitas dari kolesteatoma masih belum berhasil dipaparkan (Chole & Nason 2009).
2.2.6. Inflamasi dan hiperproliferasi
Epitel kolesteatoma walaupun tidak bersifat neoplastik tetapi bersifat hiperproliferatif. Involucrin adalah prekursor pembentukan lapisan teratas dari epidermis, ditemukan hanya pada high suprabasal layer pada kulit yang normal. Pada kolesteatoma, involucrin ditemukan di semua lapisan suprabasal, yang mengakibatkan peningkatan akumulasi dari keratin di dalam epidermis. Beberapa studi juga menunjukkan peningkatan ekspresi dari marker proliferasi pada lapisan basal dan supra basal dari epidermis, yaitu CK4, CK5/6, CK 10, CK13/16, epidermal growth factor receptor
abnormal dari p-53, c-jun dan ekspresi c-myc juga terlibat dalam proses hiperproliferatif. Studi terbaru menggunakan teknologi cDNA array juga mengidentifikasi ada gen-gen lain yang memegang peranan dalam pembentukan kolesteatoma seperti calgranulin A/B, thymosin dan
extracellular matrix protein-1 (Chole & Nason 2009).
Faktor penting lain yang berperan dalam proses hiperproliferatif adalah inflamasi kronis. Pada stroma dari kolesteatoma terdapat fibroblas, sel-sel Langerhans, sel-sel mast, limfosit yang teraktivasi, makrofag dan keratinosit. Keratinosit memproduksi keratin dalam jumlah yang besar. Inflamasi dengan atau tanpa infeksi merekrut sel-sel tersebut untuk membentuk suatu lingkungan dengan peningkatan konsentrasi dari sitokin proinflamasi. Lingkungan dapat menstimulasi keratinosit basal untuk berproliferasi aktif dan memicu pertumbuhan kolesteatoma (Chole & Nason 2009).
Pada penyakit otitis media kronis dengan kolesteatoma, erosi dari tulang hampir selalu ada dan merupakan penyebab utama dari morbiditas penyakit ini. Tulang merupakan organ dinamis yang secara konstan melakukan remodeling untuk mendapatkan kondisi homeostasis kalsium dan integritas struktural. Sintesa dari matriks dilakukan oleh osteoblas sementara proses resorpsi diatur oleh osteoklas (Chole & Nason 2009). Terdapat konsep yang bertentangan antara nekrosis akibat tekanan atau sekresi enzim proteolitik oleh matriks kolesteatoma. Saat ini diketahui aktifitas osteoklas pada inflamasi akan menyebabkan resorpsi tulang. Pembentukan osteoklas dari sel-sel prekursor dikontrol oleh 2 sitokin esensial yaitu Receptor Activator of Nuclear Factor κB Ligand (RANKL) dan Macrophage Colony Stimulating Factor (M-CSF). Pada keadaan normal, osteoblas memproduksi M-CSF dan RANKL untuk memulai pembentukan osteoklas dengan menarik reseptor- reseptor c-fms dan
Receptor Activator of Nuclear Factor κB (RANK). Pada kondisi patologis, banyak sel yang terlibat untuk menghasilkan sitokin-sitokin tersebut.
Inhibitor yang penting pada proses tersebut yaitu osteoprotegrin (OPG) yang berkompetisi dengan RANK untuk RANKL.
Jeong et al. (2006) seperti yang dikutip oleh Chole & Nason (2009) menemukan peningkatan jumlah RANKL pada kolesteatoma dibandingkan dengan kulit postaurikular yang normal. Hasil ini menyatakan jaringan kolesteatoma meningkatkan rasio RANKL/OPG pada proses inflamasi dan berpotensi untuk proses osteoklastogenesis. Sitokin inflamasi seperti
TNF-α, IL-1 dan IL-6 prostaglandin juga diketahui meningkatkan osteoklastogenesis. Kolesteatoma yang terinfeksi diketahui lebih cepat mendestruksi tulang. Peningkatan level dari virulensi bakteri sepertinya memegang peranan penting terhadap fenomena ini.
2.2.7. Komplikasi OMSK dengan kolesteatoma
Karena kapasitasnya untuk menyebabkan erosi tulang, yang terdapat pada 80% kasus, kolesteatoma bertanggung jawab terhadap komplikasi ekstrakranial dan intrakranial. Bila komplikasi ini muncul, menyebabkan morbiditas dan mortalitas yang tinggi (Vitale & Riberio 2007).
Komplikasi OMSK dengan kolesteatoma dapat berupa (Friedland, Pensak & Kveton 2009):
1. Intratemporal a. Mastoiditis b. Petrositis
c. Paralisis nervus fasialis d. Labirinitis e. Abses subperiosteal f. Fistel retroaurikular 2. Intrakranial a. Abses ekstradural b. Abses subdural c. Meningitis d. Abses otak
e. Tromboflebitis sinus lateralis f. Hidrosefalus otikus.
2.2.8. Stadium dan derajat destruksi tulang akibat kolesteatoma
Belum ada sistem stadium untuk kolesteatoma yang secara luas digunakan. Pada tahun 1986, Meyerhoff et al. seperti dikutip oleh Telmesani, Sayed & Bahrani (2009) telah mengajukan klasifikasi kolesteatoma berdasaran patofisiologi, lokasi, fungsi tuba Eustachius, defek pada tulang, dan ada tidaknya komplikasi. Namun hasil tersebut belum secara luas diadopsi disebabkan kurangnya relevansi klinis yang didapatkan dan beberapa faktor sangat sulit untuk dievaluasi saat preoperatif
Beberapa klasifikasi stadium kolesteatoma yang sudah dipublikasikan adalah:
a. Menurut Saleh & Mills (1999) seperti yang dikutip oleh Nunes et al. (2009) membuat klasifikasi stadium kolesteatoma berdasarkan perluasan lesi, keadaan osikel dan komplikasi pre operasi. Hal ini menunjukkan hubungan antara stadium penyakit, kerusakan osikel dan terjadinya komplikasi.
• Berdasarkan lokasi kolesteatoma:
S1 : Bila kolesteatoma terbatas pada lokasi asal S2 : Bila telah terjadi perluasan lokal
S3 : Bila mengenai tiga lokasi S4 : Bila mengenai 4 lokasi
S5 : Bila mengenai lebih dari 4 lokasi
• Berdasarkan komplikasi sebelum dilakukannya tindakan operasi:
C1 : Bila tidak terdapat komplikasi C2 : Bila terdapat komplikasi
b. Menurut Japan Otological Society (JOS) seperti yang dikutip oleh Hashimoto-Ikehara et al. (2011):
• Stadium I: Kolesteatoma tidak meluas melebihi daerah atik
• Stadium II: Kolesteatoma meluas melebihi daerah atik • Stadium III: Sejumlah kolesteatoma yang menyebabkan
sedikitnya satu komplikasi di bawah ini: Kelumpuhan saraf fasialis
Komplikasi intrakranial Fistel labirin
Defek luas pada liang telinga luar
Ganguan pendengaran sensorineural berat Adhesi total pada membran timpani
c. Menurut Kuczkowski et al. (2011)
• Derajat destruksi tulang akibat kolesteatoma dapat dibagi atas:
Ringan: erosi skutum dan osikel.
Sedang: destruksi tegmen dan seluruh osikel.
Berat: destruksi seluruh osikel, tulang labirin, kanalis fasialis dan liang telinga luar.
• Derajat invasi kolesteatoma dan jaringan granulasi dibagi atas:
Meliputi 1 area: epitimpanum atau mesotimpanum Meliputi 2 area: epitimpanum atau mesotimpanum
dan antrum
Meliputi 3 area: mesotimpanum, epitimpanum dan antrum.
2.3. Tumor Necrosis Factor Alpha (TNF-α)
Terdapat banyak teori yang menerangkan tentang efek destruktif (erosi) dari kolesteatoma. Pada awalnya disebut bahwa penyebab destruksi adalah tekanan yang diakibatkan akumulasi keratin dan produk akhirnya. Teori biokemikal akhirnya diterima sebagai suatu dalil, dimana enzim dan sitokin yang dilepaskan oleh kolesteatoma akan menyebabkan lisis tulang dan destruksi (Chole & Nason 2009).
Sitokin merupakan suatu grup protein sistem imun yang mengatur interaksi antar sel dan memacu reaktifitas imun, baik pada imunitas non spesifik maupun spesifik (Baratawidjaja 2012).
Sesuai dengan daerah kerjanya, sitokin bekerja sebagai autokrin (sewaktu bekerja dalam sel induknya), parakrin (sewaktu bekerja pada sel tetangga) dan endokrin yaitu sewaktu bekerja pada tempat yang jauh (Vitale & Ribeiro 2007; Baratawidjaja 2012).
Sitokin adalah polipeptida yang diproduksi sebagai respon terhadap rangsang mikroba dan antigen lainnya dan berperan sebagai mediator pada reaksi imun dan inflamasi. Kerjanya sering pleiotropik (satu sitokin bekerja terhadap berbagai jenis sel yang menimbulkan berbagai efek) dan
redundant atau berbagai sitokin menunjukkan efek yang sama (Baratawidjaja 2012).
Sitokin juga berpegaruh terhadap sintesis dan efek sitokin yang lain. Respon selular sitokin terdiri atas perubahan ekspresi gen terhadap sel sasaran yang menimbulkan ekspresi fungsi baru dan kadang proliferasi sel sasaran. Sitokin proinflamasi dan inflamasi diinduksi berbagai sel atas pengaruh mikroba, trauma atau kerusakan sel pejamu. Sitokin mengawali, mempengaruhi dan meningkatkan respon imun non spesifik. Makrofag dirangsang oleh Interferon-ɣ (IFN-ɣ), TNF-α dan IL-1 disamping juga memproduksi sitokin-sitokin tersebut. TNF-α, IL-1 dan lL-6 merupakan sitokin proinflamasi dan inflamasi spesifik (Baratawidjaja 2012).
TNF-α ditemukan oleh Carswell et al.pada tahun 1967; yang dianggap merupakan salah satu sitokin utama pada respon inflamasi akut terhadap
bakteri gram negatif dan mikroba lainnya. TNF-α juga mempunyai peranan penting dalam sistem imunitas serta mengontrol proliferasi, diferensiasi, dan apoptosis dari sel (Cho et al. 2003; Van Horssen, Tenhagen & Eggermont 2006).
Penelitian mengenai efek TNF-α dalam kolesteatoma dimulai pada awal 1990-an, dimana TNF-α diperiksa dengan cara menambahkan preparat supernatan fragmen kolesteatoma ke kultur jaringan tulang sehingga menstimulasi pembentukan sel multinukleotida dan munculnya lakuna permukaan tulang. Sel multinukleotida yang sebenarnya adalah osteoklas, ditemukan di lakuna (Howship’s lacunae) dan menyebabkan destruksi
TNF-α memiliki beberapa efek pada tubuh. Sewaktu dikeluarkan pada konsentrasi rendah, TNF-α bekerja pada sel endotel menyebabkan vasodilatasi dan menstimulasi sel ini untuk mensekresi grup leukosit-kemotaksis sitokin yang dinamakan kemokin. Inflamasi lokal yang dihasilkan melawan infeksi. Di hipotalamus TNF-α merupakan pirogen endogen yang menyebabkan demam. Pada hepar, TNF-α menstimulasi produksi acute phase inflammatory proteins dan fibrinogen
tulang (Vitale & Ribeiro 2007).
TNF-α dalam jumlah
besar yang menimbulkan reaksi sistemik (Baratawidjaja 2012).
Pada awal tahun 1990 terdapat publikasi penelitian pertama yang menyebutkan TNF-α merupakan sitokin yang penting pada proses destruksi tulang (Vitale & Ribeiro 2007). Sitokin ini terutama diproduksi oleh makrofag, keratinosit dan osteoblas sebagai respon terhadap antigen bakterial dan menstimulasi makrofag untuk menunjang fibroblas memproduksi prostaglandin E2. Peningkatan level TNF-α juga telah
terlihat pada makrofag, keratinosit dan sel epitel kolesteatoma. Kadar
TNF-α dalam jaringan kolesteatoma lebih tinggi 3,8 kali dibandingkan dengan kulit normal dan hasil ini sesuai dengan penelitian sebelumnya oleh Yetiser et al.(2002). Kolesteatoma melepaskan sitokin proinflamasi
yang bertanggung jawab terhadap proses inflamasi telinga tengah (Kuczkowski et al. 2010; 2011 ).
Sitokin yang dikeluarkan pada proses inflamasi terdapat pada peri-matriks merupakan salah satu faktor yang bertanggung jawab pada destruksi tulang oleh kolesteatoma. Namun TNF-α berkerja sama dengan
RANKL, IL-1 dan IL-6, menyebabkan destruksi dan remodeling tulang. Ada dua reseptor untuk TNF-α, yaitu TNF-R1 dan TNF-R2. Cara kerja masing-masing masih belum jelas diketahui (Vitale et al. 2011).
TNF-α dikeluarkan pada semua infeksi telinga tengah, tidak hanya dalam kolesteatoma. Pada infeksi kronis telinga yang lain tidak terdapat destruksi tulang seperti yang terlihat pada kolesteatoma. Chung & Yoon (1998) sebagaimana dikutip oleh Vitale & Ribeiro (2007) menyimpulkan bahwa interleukin (yang menstimulasi matriks kolesteatoma untuk mendestruksi tulang) dilepaskan dalam perimatriks. Destruksi tulang tidak terlihat ketika jaringan epitel (matriks) dipisahkan dari jaringan subepitel (perimatriks) kolesteatoma. Perbedaan ini dapat diterangkan oleh adanya dan distribusi reseptor TNF-α dalam epitel kolesteatoma atau matriks. Jumlah TNF-α dan jumlah reseptor berhubungan dengan destruksi tulang. Beberapa peneliti telah menghubungkan kadar TNF-α dengan temuan intraoperasi. TNF-α banyak didapati pada kolesteatoma dengan peningkatan destruksi tulang, hal tersebut dapat terlihat pada kolesteatoma congenital maupun acquired. Resorpsi osikel terdapat pada area yang terlokalisir dekat dengan peri-matriks kolesteatoma atau jaringan granulasi (Vitale & Ribeiro 2007).
Peri-matriks kolesteatoma mengandung limfosit, monosit, fibroblas dan sel endotel yang merupakan sumber proinflamasi (TNF-α, IL-1 dan IL-6) dan immunoregulator (IL-2, IL-4, IL-5, IL-10, TGF-ß dan GM-CSF), sitokin dan mediator seperti RANKL (Kuczkowski et al. 2011).
TNF-α menyebabkan destruksi tulang dengan cara bekerja secara langsung dalam diferensiasi dan maturasi osteoklas, dan secara tidak langsung mengekspos matriks tulang. Proses ini terjadi bersamaan
dengan IL-1 dan RANKL yang juga banyak terdapat pada daerah inflamasi yang disertai dengan destruksi tulang. Secara bersama substansi tersebut dapat merekrut, mendiferensiasi dan mengaktivasi osteoklas. Inilah sinergi antara TNF-α dan RANKL yang bekerja sama meningkatkan fungsi osteoklas, di mana dapat ditambahkan IL-1 dan IL-6
(Vitale & Ribeiro 2007).
Osteoklas berasal dari sel hematopoetik yaitu monosit atau makrofag. Hamzei et al. (2003) seperti dikutip olek Kuczkowski et al. (2011) melaporkan tingginya konsentrasi osteoclast progenitor cell lineage dan makrofag dalam kolesteatoma dibandingkan dengan kulit normal liang telinga.
Nason et al. (2009) seperti yang dikutip oleh Kuczkowski et al. (2011) menyatakan bahwa infeksi bakteri telinga tengah berhubungan dengan perkembangan osteolisis tulang. Lipopolisakarida bacterial (LPS) yang merupakan antigen sangat kuat dari Pseudomonas aeruginosa (bakteri yang paling banyak diisolasi dari kolesteatoma yang terinfeksi), telah terlebih dulu diperlihatkan sebagai induktor kuat dari osteoklastogenesis.
LPS menginduksi ekspresi reseptor untuk IL-1 dan TNF dalam RANKL
precursor osteoklas utama yang telah dilakukan dengan RT-PC analisis.
IL-1 menstimulasi limfosit, fibroblas dan keratinosit dan osteoklas tehadap proses resorpsi tulang. Sitokin ini terutama berada pada membran basal dari epitel kolesteatoma dan pada monosit di subepitel.
Perbandingan kadar sitokin proinflamasi dan faktor klinikopatologi mengindikasikan derajat destruksi tulang dan perluasan invasi kolesteatoma yang berkorelasi satu sama lain. Peningkatan kadar sitokin proinfamasi dalam kolesteatoma menyebabkan eksaserbasi inflamasi kronik dan menyebabkan komplikasi. Destruksi tulang yang luas pada pasien otitis media kronik dengan kolesteatoma (sebagai contoh osteolisis labirin atau liang telinga luar) harus dioperasi dengan teknik terbuka dengan sangat hati-hati untuk membersihkan permukaan tulang. Peningkatan aktifitas TNF-α , IL-1 dan IL-6 dalam jaringan patologis yang
dibersihkan mengindikasikan perlunya operasi kedua setelah beberapa bulan. Dengan kata lain, peningkatan kadar sitokin proinflamasi dapat menstimulasi pertumbuhan cepat dari kolesteatoma (Kuczkowski et al. 2011).
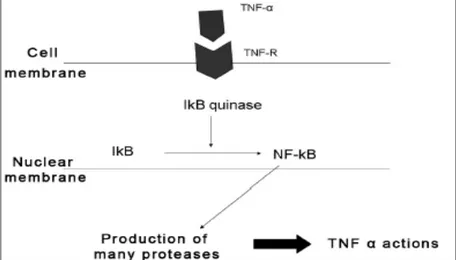
Setelah diproduksi dan dikeluarkan, TNF-α terhubung ke reseptor spesifik yang disebut TNF reseptor I dan II (TNF-R) untuk memproduksi efek biologis. TNF reseptor (khususnya TNF-RII) juga menginisiasi apoptosis. Mekanisme mana yang lebih dominan belum dapat diterangkan sepenuhnya. Efek fisiologis utama dari TNF-α adalah untuk menunjang respon imunologi dan inflamasi dengan cara merekrut dan mengaktivasi neutrofil dan monosit ke tempat infeksi 2007).
TNF-α dapat dihambat oleh cairan antagonis yang dapat memblok reseptornya. Assuma et al. (1998) seperti yang dikutip oleh (2007) meneliti berkurangnya kerusakan tulang sebanyak 60% dengan cara memakai antagonis tersebut. TNF-α juga dapat dihambat oleh anti-TNF-α antibodies. Blokade TNF-α akan mengurangi resorpsi tulang.
Gambar 2.3. Kerja TNF-α di dalam sel. Setelah berikatan dengan reseptornya, TNF-α mengaktivasi NF-κB, yang memproduksi dan mengeluarkan berbagai zat yang terlibat dalam respon inflamasi dan imunologi
2.4. TNF-α Dalam Kolesteatoma Acquired Berbagai penelitian menunjukkan bahwa TNF
-α mempunyai kapasitas
untuk mengerosi tulang.
peningkatan level TNF-α pada pasien dengan destruksi tulang.
Peningkatan ekspresi TNF-α pada otitis media kronik dan adanya hubungan positif yang kuat antara kadar sitokin ini dengan derajat destruksi tulang menunjukkan kolesteatoma mampu mendestruksi tulang. TNF-α dapat menstimulasi diferensiasi dan maturasi osteoklas atau dapat bereaksi pada matriks tulang, memaparkannya terhadap osteoklas. Semua penelitian menunjukkan pentingnya TNF-α pada proses resorbsi tulang di dalam kolesteatoma dan derajat destruksi yang terlihat, namun tidak ada konsensus mengenai lokasinya. Perbedaannya mungkin disebabkan lokasi reseptornya 2007).
(2004) di Zhengzhou-Cina dengan pemeriksaan imunohistokimia dan analisis komputer kuantitatif untuk mendeteksi ekspresi TNF-α pada 22 spesimen kolesteatoma, mendapatkan over ekspresi TNF-α pada sel stroma dan epitel kolesteatoma. Overekspresi
TNF-α pada kolesteatoma berhubungan dengan destruksi osikel, hal ini menunjukkan TNF-α bertanggung jawab terhadap destruksi tulang pada kolesteatoma. Pewarnaan imunohistokimia dari
Yetiser et al. (2002) seperti yang dikutip oleh Vitale & Ribeiro (2007) membandingkan kadar TNF-α dan IL-1 pada 16 pasien otitis media kronis tanpa kolesteatoma dan 20 pasien otitis media kronis dengan kolesteatoma. Mereka menemukan kadar TNF-α dan IL-1 yang lebih tinggi pada grup kedua dan menyimpulkan bahwa destruksi tulang dimediasi oleh sitokin tersebut.
TNF-α yang terlihat dalam sel stroma mengindikasikan bahwa sel stroma memainkan peranan penting pada destruksi tulang.
2.5. Anatomi Telinga Tengah
Telinga tengah adalah suatu ruang antara membran timpani dengan badan kapsul dari labirin pada daerah petrosa dari tulang temporal yang mengandung rantai tulang pendengaran. Telinga tengah berbentuk kubus, terdiri dari membran timpani, kavum timpani, tuba Eustachius, dan prosesus mastoid (Wright & Valentine 2008; Gacek 2009).
2.5.1. Membran timpani
Membran timpani membentuk dinding lateral kavum timpani dan memisahkan telinga luar dan telinga tengah. Membran timpani berbentuk bulat dan mempunyai ukuran vertikal kira-kira 9-10 mm, horizontal 8-9 mm, tebal ± 0,1 mm (Wright & Valentine 2008; Dhingra 2010).
Membran timpani secara anatomi terdiri dari 2 bagian yaitu pars tensa terletak di bagian bawah, tegang dan lebih luas, serta pars flaksida (Shrapnell′s membrane) di bagian atas yang lebih tipis karena mengandung sedikit lapisan fibrosa (Gacek 2009).
Secara histologis membran timpani terdiri dari 3 lapisan, yaitu:
1. Lapisan luar (stratum kutaneum) yaitu: lapisan epitel yang berasal dari liang telinga luar.
2. Lapisan mukosa (stratum mukosum) yang berasal dari mukosa telinga tengah.
3. Lapisan fibrosa (lamina propria) terletak diantara stratum kutaneum dan stratum mukosum (Wright & Valentine 2008; Gacek 2009; Dhingra 2010).
2.5.2. Kavum timpani
Kavum timpani merupakan suatu ruang yang terletak diantara membran timpani dan telinga dalam. Kavum timpani adalah suatu ruang bikonkaf dengan diameter vertikal dan antero-posteriornya sekitar 15 mm dan diameter transversal 2-6 mm, yang mempunyai 6 dinding, yang dibatasi oleh :
1. Dinding atas, dibatasi oleh tulang yang tipis yang disebut tegmen timpani, kadang-kadang mengalami dehisensi.
2. Dinding bawah, dibentuk oleh tulang tipis yang membatasi kavum timpani dari bulbus vena jugularis.
3. Dinding lateral, dibentuk terutama oleh membran timpani.
4. Dinding anterior, berhubungan dengan m. tensor timpani, ostium tuba Eustachius, dan dinding dari karotis.
5. Dinding medial, memisahkan kavum timpani dari telinga dalam. Pada dinding medial terdapat promontorium yang merupakan lingkaran basal koklea. Pada bagian belakang bawah dinding media ini terdapat fenestra koklea (rotundum), dan pada bagian belakang atas terdapat fenestra ovale.
6. Dinding posterior, bagian atas berhubungan dengan sellulae mastoideus melalui aditus ad antrum (Helmi 2005; Wright & Valentine 2008).
Dalam kavum timpani terdapat tulang-tulang pendengaran yang berhubungan satu sama lain terdiri dari maleus, inkus dan stapes yang menghubungkan membran timpani dengan foramen ovale (Helmi 2005; Wright & Valentine 2008; Gacek 2009).
2.5.3. Tuba Eustachius
Tuba Eustachius adalah suatu saluran yang menghubungkan nasofaring dengan telinga tengah, yang bertanggung jawab terhadap proses pneumatisasi pada telinga tengah dan mastoid serta mempertahankan tekanan yang normal antara telinga tengah dan atmosfir. Kestabilannya oleh karena adanya kontraksi muskulus tensor veli palatini dan muskulus levator veli palatini pada saat mengunyah dan menguap. Tiga perempat medial merupakan tulang rawan yang dikelilingi oleh jaringan lunak, jaringan adiposa dan epitel saluran nafas (Wright & Valentine 2008; Gacek 2009).
2.5.4. Prosesus mastoid
Pneumatisasi mastoid ternyata saling berhubungan dan drainasenya menuju aditus ad antrum. Terdapat tiga tipe pneumatisasi, yaitu pneumatik, diploik dan sklerotik. Pada tipe pneumatik, hampir seluruh prosesus mastoid terisi oleh pneumatisasi, pada tipe sklerotik tidak terdapat pneumatisasi sama sekali, sedangkan pada tipe diploik pneumatisasi kurang berkembang. Sel mastoid dapat meluas ke daerah sekitarnya, sampai ke arkus zigomatikus dan ke pars skuamosa tulang temporal (Wright & Valentine 2008; Gacek 2009).
Antrum mastoid adalah suatu rongga di dalam prosesus mastoid yang terletak tepat di belakang epitimpani. Aditus ad antrum adalah saluran yang menghubungkan antrum dengan epitimpani. Lempeng dura merupakan bagian tulang tipis yang biasanya lebih keras dari tulang sekitarnya yang membatasi rongga mastoid dengan duramater, sedangkan yang membatasi rongga mastoid dengan sinus lateralis disebut lempeng sinus. Sudut sinodura dapat ditemukan dengan membuang sebersih-bersihnya sel pneumatisasi mastoid di bagian superior inferior lempeng dura dan posterior superior lempeng sinus (Wright & Valentine 2008; Gacek 2009).
2.5.5. Vaskularisasi kavum timpani
Telinga tengah dan mastoid diperdarahi oleh kumpulan cabang ateri yang berbeda dari sistem karotis eksterna. Cabang arteri ke ruang telinga tengah adalah cabang timpani anterior dari arteri maksilaris interna, yang masuk melalui fisura petrotimpani dan berjalan sepanjang tuba Eustachius dan kanalis semisirkularis menuju tensor timpani. Arteri meningea media bercabang menjadi arteri petrosus superfisialis yang berjalan bersama nervus petrosus superfisialis mayor dan memasuki kanalis fasialis di hiatus. Anastomosis pembuluh darah ini dengan cabang arteri aurikularis posterior, arteri stilomastoideus, yang memasuki kanalis fasialis di bagian inferior melalui foramen stilomastoideus. Cabang arteri stilomastoideus
meninggalkan kanalis Fallopian dan berjalan melalui kanalikulus bersama nervus korda timpani untuk memasuki telinga tengah. Akhirnya, arteri timpani inferior, cabang dari arteri faringeal asenden, memasuki telinga tengah melalui kanalikulus timpani di dalam hipotimpani dengan cabang timpani dari nervus ke sembilan (Gacek 2009).
2.6. Imunohistokimia
Pemeriksaan imunohistokimia dapat memberi informasi mengenai kandungan berbagai unsur molekul di dalam sel normal maupun sel neoplastik. Dasar dari pemeriksaan ini adalah pengikatan antigen (yang terkandung dalam sel) dengan antibodi spesifiknya yang diberi label
chromogen. Teknik ini diawali dengan prosedur histoteknik yaitu prosedur pembuatan irisan jaringan (histologi) untuk diamati di bawah mikroskop. Irisan jaringan yang didapat kemudian memasuki prosedur imunohistokimia (Hardjolukito & Endang 2005).
Imunohistokimia menjadi teknik pilihan untuk menentukan petanda-petanda biologik tersebut karena relatif mudah, murah dan dapat diterapkan pada sediaan rutin histopatologik. Namun demikian perlu diperhatikan sejumlah faktor yang dapat mempengaruhi hasil pemeriksaan, dimana pengaruh faktor-faktor tersebut dimulai dari tahap pembedahan, pengolahan jaringan hingga penilaian hasil pulasan (Hardjolukito & Endang 2005).
2.6.1. Metode pewarnaan imunohistokimia
Prinsip dari metode imunohistokimia adalah perpaduan antara reaksi imunologi dan kimiawi, dimana reaksi imunologi ditandai adanya reaksi antara antigen dengan antibodi, dan reaksi kimiawi ditandai adanya reaksi antara enzim dengan substrat (Sudiana & Ketut 2005).
Pemeriksaan imunohistokimia dimaksudkan untuk mengenali bahan spesifik tertentu didalam jaringan dengan menggunakan antibodi dan
sistem deteksi yang memungkinkan untuk mengenali bahan spesifik tersebut secara visual (Sudiana & Ketut 2005).
Antibodi bereaksi terhadap determinan dari antigen yang berada dalam bahan spesifik yang diperiksa. Antibodi-antibodi ini akan berikatan dengan bahan dalam jaringan, dan antibodi-antibodi ini diketahui dengan menggunakan antibodi-antibodi lain yang dirancang untuk mengenal immunoglobulin tersebut dari spesies-spesies yang terekspos dengan bahan asli atau original (Sudiana & Ketut 2005).
Antibodi-antibodi penentu (anti-antibodi dari spesies lain) ini ditempeli (tagged) dengan beberapa molekul pelapor (reporter molecule) misalnya fluorecein atau enzim yang dapat mengkatalisa reaksi selanjutnya menuju produk yang dapat dilihat (Sudiana & Ketut 2005).
Pewarnaan imunohistokimia pada dasarnya ada dua macam metode yaitu (Sudiana & Ketut 2005):
a. Metode direct
Pada metode ini antibodi monoklonal yang digunakan untuk mendeteksi suatu marker pada sel, langsung di label dengan suatu enzim
b. Metode indirect
Pada metode imunohistokimia indirect, antibodi monoklonal yang digunakan untuk mendeteksi suatu marker pada sel, tidak dilabel dengan suatu enzim. Antibodi ini dikenal dengan sebutan antibodi primer. Namun pada metode ini bukan berarti tidak membutuhkan antibodi yang dilabel enzim. Hal ini tetap dibutuhkan tetapi yang dilabel adalah antiimunoglobulin, dalam imunohistokimia indirect
dikenal dengan sebutan antibodi sekunder. Untuk melabel antibodi sekunder dapat dilakukan secara langsung ataupun tidak langsung. Secara langsung artinya antibodi sekunder telah terlabel oleh suatu enzim. Sedangkan secara tidak langsung artinya pelabelan antibodi sekunder dengan suatu enzim adalah menggunakan suatu bahan perantara (kombinasi) seperti : biotin-streptavidin atau biotin-avidin.
Penilaian pewarnaan imunohistokimia
Penilaian pewarnaan imunohistokimia semikuantitatif dilakukan dengan melihat intensitas pewarnaan yang terdiri dari 0, 1, 2, atau 3 dan luas pewarnaan yaitu 0: 0%, 1: 10%, 2: 10-50%,. 3: 50%. Skor intensitas pewarnaan dan skor luas pewarnaan dikalikan untuk mendapatkan skor imunoreaktifitas dengan nilai maksimum 9. Semua kasus dengan intensitas pewarnaan moderat (2 atau 3) pada minimum 10% sel tumor dikategorikan sebagai ekspresi positif yaitu bila skor >4-9 (Tan & Puti 2005).
2.7. Kerangka Teori
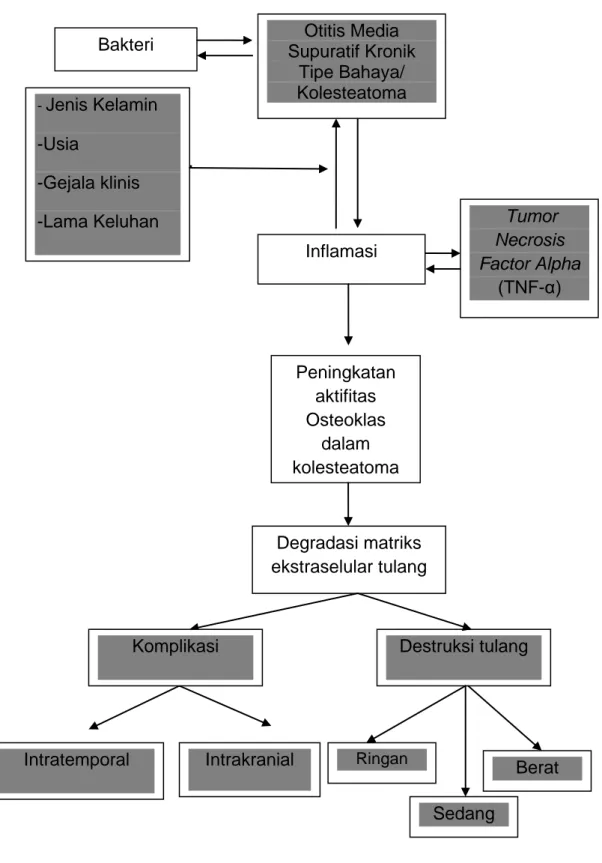
---
Gambar 2.4. Kerangka Teori Bakteri Inflamasi Tumor Necrosis Factor Alpha (TNF-α) Peningkatan aktifitas Osteoklas dalam kolesteatoma Degradasi matriks ekstraselular tulang Destruksi tulang Otitis Media Supuratif Kronik Tipe Bahaya/ Kolesteatoma - Jenis Kelamin -Usia -Gejala klinis -Lama Keluhan Ringan Sedang Berat Komplikasi Intrakranial Intratemporal
Keterangan:
= Variabel penelitian
Pada OMSK dengan kolesteatoma terjadi akumulasi sel debris dan keratinosit diinvasi oleh sel sistem imun termasuk sel Langerhans, sel-T dan makrofag. Proses ini distimulasi oleh proliferasi epitel yang tidak seimbang, diferensiasi dan maturasi keratinosit dan pemanjangan apoptosis. Dalam kondisi inflamasi migrasi sel digantikan oleh hiperplasia. Inflamasi yang mendorong proliferasi epitel berhubungan dengan peningkatan ekspresi enzim litik dan sitokin termasuk asam arakidonat,
Intercellular Adhesion Molecule (ICAM), Receptor Activator Of Nuclear Factor Kappa-β Ligand (RANKL), Interleukin-1, 2 dan 6 (IL-1, IL-2, IL-6),
Matrix Metalloproteinase-2 dan 9 (MMP-2, MMP-9) dan Tumor Necrosis Factor Alpha (TNF-α) yang sebagian diinduksi oleh antigen bakterial
termasuk endotoksin seperti lipopolisakarida. Sel mast banyak terdapat pada jaringan kolesteatoma dan berkontribusi terhadap inflamasi kronis.
TNF-α akan menstimulasi diferensiasi dan maturasi osteoklas atau dapat bereaksi pada matriks tulang, memaparkannya terhadap osteoklas. Hal ini akan menyebabkan degradasi matriks ekstraselular tulang, sehingga terjadi destruksi tulang yang menyebabkan komplikasi OMSK tipe bahaya. Derajat destruksi tulang dapat dibagi menjadi derajat ringan, sedang dan berat.
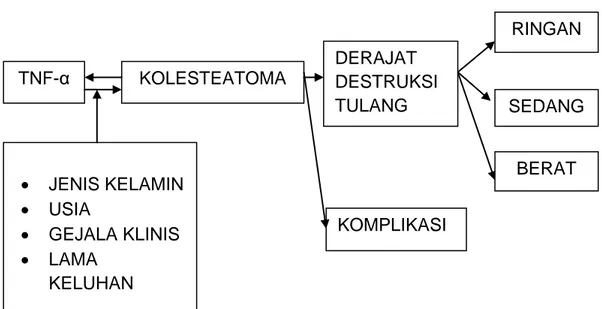
2.8. Kerangka Konsep
Gambar 2.5. Kerangka Konsep • JENIS KELAMIN • USIA • GEJALA KLINIS • LAMA KELUHAN KOLESTEATOMA TNF-α RINGAN SEDANG BERAT DERAJAT DESTRUKSI TULANG KOMPLIKASI