BAB 2
TINJAUAN PUSTAKA
2.1. Kemiri
Kemiri (Aleurites moluccana), juga dikenal dengan candlenut, merupakan tanaman dari famili Euphorbiaceae yang banyak tumbuh di negara-negara yang beriklim tropis, seperti Indonesia, Malaysia, Hawaii, dan Filipina. Di Indonesia, tanaman kemiri banyak tersebar di provinsi Sumatra Utara, Sulawesi Selatan, Nusa Tenggara Timur, dan Daerah Istimewa Aceh. Kemiri tumbuh kira-kira seluas 170.000 ha di Indonesia dan menghasilkan buah kira-kira 60.000 ton per tahun dimana sebesar 40 % lebih banyak tumbuh dan diproduksi di Sulawesi Selatan (Koji, T. 2002).
Pohon kemiri memiliki tinggi kira-kira 20 m dengan diameter 0,9 m. Batang pohon kemiri tidak bercabang dan berwarna abu-abu kecoklatan. Daunnya memiliki panjang 10-20 cm dan berwarna putih keperakan jika masih muda dan akan berwarna hijau jika sudah tua. Bunga kemiri berwarna putih-kehijauan dengan lebar 10-15 cm sedangkan buahnya berbentuk bulat dan berwarna hijau sampai kecoklatan. Di dalam buah berisi 2-3 biji kemiri (Krisnawati et al. 2011). Di dalam biji terdapat daging buah yang mengandung minyak sekitar 55-65 persen. Biji buah ini terlebih dahulu dijemur kemudian, dipecah dengan tangan dan dagingnya dikeluarkan, yang selanjutnya dilakukan pengepresan, baik dengan pengepresan dingin maupun panas. Dengan pengepresan dingin, dapat menghasilkan minyak berwarna kuning sedangkan, dengan pengepresan panas menghasilkan minyak berwarna kuning sampai coklat (Ketaren, S. 2005).
Tanaman kemiri sangat banyak diaplikasikan dalam bidang industri dan bernilai komersial sehingga menjadi salah satu penunjang sektor perekonomian di Indonesia. Kayu kemiri banyak dimanfaatkan sebagai bahan pembuatan perabot rumah tangga, sedangkan minyaknya dapat dijadikan sebagai bahan pembuatan sampo, sabun, moisturizer kulit, dan
obat-obatan (Koji, 2002; Athar dan Nasir, 2005). Minyak kemiri sangat kaya akan kandungan asam lemak tak jenuh seperti asam linoleat 48,5 %, asam linolenat 28,5 %, dan asam oleat 10,5 % serta komponen-komponen minor seperti vitamin A, C, dan E sebagai antioksidan (Morton, J.F. 1992).
2.2. Tokoferol dan Tokotrienol
Vitamin E merupakan senyawa yang memiliki peranan penting bagi kesehatan, yaitu sebagai zat antioksidan yang berfungsi untuk menghambat terjadinya oksidasi asam lemak tak jenuh di dalam tubuh dan melindungi membran sel dari radikal-radikal bebas. Vitamin ini termasuk ke dalam zat antioksidan golongan fenolik dan bersifat larut dalam lemak (Burton dan Traber, 1990). Vitamin E bersifat essensial (tidak dapat disintesis oleh tubuh), sehingga harus diperoleh dari makanan. Secara alami, vitamin ini dapat ditemukan pada tumbuh-tumbuhan, khususnya minyak tumbuhan yang mengandung asam lemak tak jenuh yang tinggi, seperti minyak bunga matahari (asam oleat 40 %, asam linoleat 74 %) (Bailey, S. 2005), minyak kemiri (asam linoleat 48,5 %, asam linolenat 28,5 %, asam oleat 10,5 %) dan minyak jagung (asam oleat 30,1 %, asam linoleat 56,3 %) (Ketaren, S. 2002).
Vitamin E yang diperoleh secara alami terdiri dari tokoferol dan tokotrienol yang sering disebut juga dengan kelompok tokokromanol (Colombo, M.L. 2010). Tokoferol dan tokotrienol masing-masing memiliki isomer, yaitu α (alpha), β (beta), γ (gamma), dan δ (delta) yang dibedakan berdasarkan jumlah dan posisi gugus metil yang terikat. Struktur molekul tokoferol dan tokotrienol hampir mirip, yaitu sama-sama memiliki kepala berupa cincin kromanol, namun perbedaan antara keduanya terletak pada bagian ekor. Tokoferol memiliki ekor berupa rantai hidrokarbon jenuh (tidak mengandung ikatan rangkap), sedangkan tokotrienol memiliki ekor berupa rantai hidrokarbon tak jenuh (mengandung ikatan rangkap).
Perbedaan struktur molekul antara tokoferol dan tokotrienol ini menyebabkan perbedaan aktivitas antioksidan antara keduanya. Beberapa penelitian menunjukkan bahwa tokotrienol memiliki aktivitas antioksidan yang lebih tinggi daripada tokoferol. Hal ini
disebabkan karena tokotrienol memiliki tiga buah ikatan rangkap yang menyebabkan tokotrienol lebih cepat menghambat terjadinya oksidasi asam lemak tak jenuh di dalam tubuh dibandingkan tokoferol (Suzuki et al. 1993). Berdasarkan penelitian, tokotrienol telah terbukti dapat menghambat pertumbuhan sel-sel kanker payudara pada manusia (Nessaretman et al. 1998), menurunkan kadar kolesterol dalam darah (Qureshi et al. 2001), dan dapat menembus jaringan kulit 15 kali lebih cepat dibandingkan tokoferol sehingga memiliki potensi yang lebih baik dalam mencegah terjadinya penuaan dini dan kanker kulit (Podda et al. 1996).
2.2.1. Metode-Metode Memperoleh Tokoferol dan Tokotrienol
Metode memperoleh tokoferol dan tokotrienol dari berbagai bahan nabati telah banyak dilakukan oleh para peneliti, salah satunya adalah metode adsorpsi.
1. Chu (2004) mengadsorpsi vitamin E dari fraksi tidak tersabunkan distilat asam lemak minyak sawit (DALMS) dengan variasi beberapa adsorben (silika gel, alumina oksida, poliaromatik SP 207, dan poliaromatik Dowex Optipore L-285) dan membandingkan kemampuan adsorpsi dan desorpsi adsorben tersebut. Fraksi tidak tersabunkan DALMS dicampurkan dengan masing-masing adsorben pada konsentrasi, suhu, dan waktu yang bervariasi, diaduk dengan shacker, selanjutnya fraksi vitamin E yang terjerap oleh adsorben didesorpsi dengan menggunakan isopropanol, dan dianalisa kadar vitamin E yang berhasil terjerap. Hasil yang diperoleh adalah silika gel memiliki kemampuan adsorpsi dan desorpsi yang lebih baik dibandingkan adsorben yang lain, dengan hasil 89,5 %, diikuti dengan alumina oksida, poliaromatik SP 207, dan poliaromatik Dowex Optipore L-285, yaitu 78,6 %, 60 %, dan 50,4 %.
2. Tandale dan Lali (2004) telah berhasil mengadsorpsi vitamin E dari minyak jagung yang telah mengalami proses deodorasi terlebih dahulu dengan menggunakan beberapa adsorben polimer sintetis (diaion HP20, sepabeads SP700, sepabeads RP-OD, dan sepabeads SP207). Proses adsorpsi dilakukan dengan mencampurkan
minyak jagung yang telah mengalami proses deodorisasi dengan pelarut dimetilformamida (DMF), kemudian ditambahkan masing-masing adsorben. Tokoferol yang terjerap pada adsorben selanjutnya didesorpsi dengan n-heksan, dan dianalisa kadar tokoferolnya dengan metode HPLC. Hasil yang diperoleh adalah adsorben sepabeads RP-OD memiliki kemampuan adsorpsi dan desopsi yang lebih baik dibandingkan dengan adsorben lain, dengan hasil sebesar 85 %.
Metode adsorpsi ini lebih sering digunakan karena memiliki beberapa keuntungan, yaitu peralatan yang digunakan lebih sederhana, pengerjaannya cukup mudah, tidak memerlukan suhu yang tinggi, namun memberikan hasil yang lebih tinggi serta adsorben dapat direcovery sehingga dapat digunakan kembali untuk proses adsorpsi selanjutnya.
2.3. Hidrokarbon Tak Jenuh
Hidrokarbon tak jenuh seperti alkena adalah ligan dihapto yang dapat mendonorkan dua
elektron karena adanya orbital π ligan yang dapat diisi oleh logam dan orbital π*
ligan yang dapat menerima densitas elektron dari orbital d logam yang terisi. Ikatan antara logam dengan hidrokarbon tak jenuh ini terjadi karena adanya donasi elektron dari orbital π ligan
yang terisi ke logam dan penerimaan densitas elektron ke dalam orbital π*
dari ligan tersebut. Model ikatan ini dinamakan model Dewar-Chatt-Duncanson. Donor dan akseptor elektron ini dapat terjadi karena adanya backbonding dari logam dan bergantung pada substituen alkena dan bilangan oksidasi logam. Logam-logam yang memiliki orbital d yang kosong dengan tingkat energi yang tinggi dapat mengalami backbonding karena adanya
kelebihan densitas elektron pada orbital π*
alkena sehingga dapat berikatan dan menghasilkan kompleks metallocyclopropana yang dapat dilihat seperti pada Gambar 2.1 (Shriver et al.1999).
H H H C C π H M
Gambar 2.1. Donasi muatan elektron dari orbital π terisi ke logam
2.4. Kalsium
Pada umumnya, logam golongan IA dan II A sangat sulit untuk membentuk senyawa kompleks. Hal ini disebabkan karena faktor muatan ion logam yang kecil dan memiliki orbital dengan energi yang sangat rendah untuk berikatan dengan ligan membentuk senyawa kompleks. Namun, logam golongan IIA lebih memungkinkan dan lebih mudah untuk membentuk senyawa kompleks dibandingkan logam golongan IA. Dan diantara logam-logam golongan II A, kompleks magnesium dan kalsium lebih banyak ditemukan, dan biasanya berikatan dengan ligan oksigen (Lee, J.D. 1991). Magnesium dapat berikatan dengan 6 buah ligan H2O membentuk kompleks Mg(H2O)6Cl2 (Madan, R.D. 2003), dan
kalsium dapat berikatan dengan ligan oksigen pengkompleks kelat, seperti ligan EDTA membentuk kompleks Ca(EDTA)2 (Cotton et al. 1987).
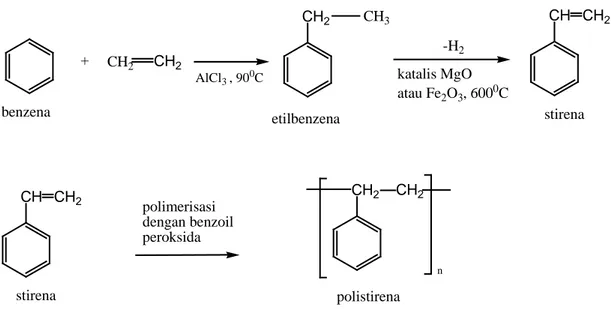
2.5. Polistirena
Polistirena adalah polimer linear yang terbentuk dari monomer stirena melalui reaksi polimerisasi. Monomer stirena dibuat dari reaksi antara benzena dan etilen pada suhu 900C yang dikatalisis oleh AlCl3 sehingga dihasilkan etil benzena, yang selanjutnya
dihidrogenasi ke stirena dengan bantuan katalis besi oksida atau magnesium oksida pada suhu 6000C yang akan menghasilkan stirena. Stirena yang dihasilkan dipisahkan dengan metode destilasi. Polimerisasi stirena menjadi polistirena dapat dilakukan dengan bantuan benzoil peroksida sebagai inisiator. Reaksi pembentukan polimer ini adalah sebagai berikut.
AlCl3 , 900C CH2 CH3 -H2 katalis MgO atau Fe2O3, 6000C CH CH2
benzena etilbenzena stirena
+ CH2 CH2 CH2 polimerisasi dengan benzoil peroksida CH2 n polistirena CH CH2 stirena
Gambar 2.2. Reaksi Pembuatan Polistirena melalui Polimerisasi Stirena
Polistirena merupakan jenis polimer termoplastik yang secara kimia bersifat inert. Polimer ini memiliki suhu transisi gelas 800C, titik lebur 2400C dan gaya tarik mencapai 8000 psi, bersifat kaku, transparan, tahan terhadap zat alkalis, halida asam, dan agen reduksi-oksidasi, serta mudah larut dalam pelarut organik khususnya pelarut hidrokarbon aromatik, seperti benzena, piridin, dan toluena. Karena memiliki indeks bias (1,60) yang tinggi, polistirena dapat berfungsi untuk komponen optik plastik dan sangat baik untuk insulator listrik. Saat ini, polistirena telah banyak dimodifikasi untuk dapat diaplikasikan sebagai resin penukar ion (kation maupun anion). Resin penukar kation dapat dibuat dengan mensulfonasi polistirena dengan suatu agen pensulfonasi seperti asam sulfat untuk mensubstitusi gugus SO3H ke setiap cincin benzena, sedangkan resin penukar anion dapat
dibuat dengan mereaksikan polistirena dengan klorometil eter untuk mensubstitusi gugus klorometil ke setiap cincin benzena (Billmeyer, F.W. 1984).
2.6. Reaksi Sulfonasi
Sulfonasi merupakan reaksi substitusi untuk memasukkan gugus –SO3H ke dalam molekul
organik melalui ikatan kimia pada atom Karbon, atau sangat jarang, pada atom Nitrogen. Reaksi sulfonasi ini adalah reaksi elektrofilik, sehingga sangat bergantung pada jenis gugus
yang terikat pada cincin aromatis. Agen pensulfonasi yang umumnya digunakan adalah H2SO4 dan SO3. Pada umumnya, reaksi sulfonasi ini digunakan untuk memodifikasi bahan
polimer yang memiliki cincin aromatis sebagai rantai utamanya. Sulfonasi polimer aromatik merupakan reaksi yang sangat kompleks karena reversibilitasnya (Pinto et al.
2006).
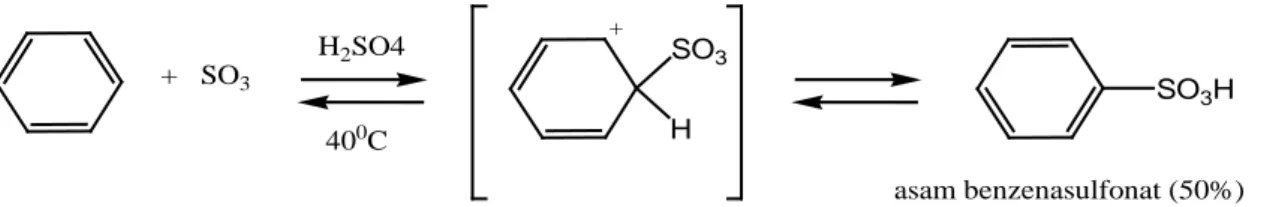
Sulfonasi terhadap senyawa aromatis seperti benzena dengan asam sulfat berasap (H2SO4) menghasilkan asam benzensulfonat dapat ditunjukkan pada Gambar berikut.
+ SO3 H2SO4 400C SO3 H + SO3H asam benzenasulfonat (50%)
Gambar 2.3. Reaksi Pembuatan Asam Benzensulfonat
Reaksi ini dapat mudah balik (reversibel) dan menunjukkan efek isotop kinetik yang sedang dimana, ion benzenonium sebagai zat antara dalam reaksi dapat kembali ke benzena atau terus ke asam benzenasulfonat dengan hampir sama mudahnya. Gugus asam sulfonat mudah digantikan oleh aneka ragam gugus lain. Oleh karena itu, pada reaksi sulfonasi, asam arilsulfonat merupakan zat antara yang bermanfaat dalam sintesis (Fessenden dan Fessenden, 1986).
2.6.1. Reaksi Sulfonasi Polistirena
Sulfonasi polistirena merupakan salah satu penelitian yang telah banyak dipelajari, meskipun sangat sedikit literatur yang membahas tentang reaksi ini dan sifat termal yang dihasilkan. Pada umumnya, sulfonasi senyawa polimer ini dapat dilakukan, baik dengan reaksi heterogen maupun reaksi homogen. Reaksi heterogen dilakukan dengan cara bahan polimer dan agen pensulfonasi dicampur dalam fasa yang berbeda, sedangkan reaksi homogen dilakukan dalam fasa yang sama pada pelarut hidrokarbon atau pelarut
terklorinasi. Agen pensulfonasi selain H2SO4 dan SO3 adalah kompleks dari trietil fosfat
bersama sulfur trioksida dan kompleks asetil sulfat dalam larutan dikloroetana (Martians et al. 2003). Adapun reaksi polistirena dengan agen pensulfonasi asetil sulfat sebagai berikut.
HO- - SO3H+ + asetil sulfat asetat anhidrat asam asetat CH3 C O CH3 C O O CH3 C+ O CH3 C O O -+ SO 3H CH3 C OH O CH3 C O -O CH3 C OSO3H O CH2 CH CH2 CH CH2 CH SO3H SO3H x CH3-CO-OSO3H + + CH3COH O polistirena
asetil sulfat asam asetat
n CH2 CH
asam polistirena sulfonat
Gambar 2.4.Reaksi Sulfonasi Polistirena dengan Agen Pensulfonasi Asetil Sulfat Metode untuk mengisolasi asam polistirena sulfonat bergantung pada derajat sulfonasi asam polistirena sulfonat tersebut. Asam polistirena sulfonat dengan derajat sulfonasi di bawah 30 %, akan larut dalam pelarut semipolar, kemudian pelarut diuapkan hingga terbentuk padatan. Sedangkan, untuk asam polistirena sulfonat dengan derajat sulfonasi diatas 30 %, produk dapat larut dengan baik dengan air dan dapat diisolasi dengan menguapkan pelarut hingga terbentuk padatan, kemudian dimurnikan dengan pencucian menggunakan pelarut non-air, seperti dikloroetana. Asam polistirena sulfonat yang terbentuk dikeringkan pada vakum dengan suhu 500C selama 3 hari (Kucera dan Jancar, 1996).
2.7. Kalsium Polistirena Sulfonat
Kalsium polistirena sulfonat merupakan garam polimer sulfonat berupa padatan berwarna putih sampai krem kecoklatan. Di bidang kesehatan, senyawa ini dapat digunakan sebagai
resin penukar kation, salah satunya adalah untuk menurunkan kadar potassium di dalam darah (hyperkalemia) yang dapat dikonsumsi oral maupun rektal (Laval, R. 2014).
2.8. Asam Lemak
Asam lemak terdiri dari unsur-unsur seperti karbon (C), hidrogen (H), dan oksigen (O), yang tersusun menjadi rantai karbon dengan beragam panjang rantai dan memiliki gugus karboksil pada salah satu ujung rantainya (Chow, C.K. 2007). Asam lemak yang ditemukan di alam, biasanya merupakan asam monokarboksilat dengan rantai yang tidak bercabang dan mempunyai jumlah atom karbon genap dari C2 sampai C30 (Winarno, F.G.
1992). Asam lemak dapat berupa asam lemak saturated (tidak memiliki ikatan rangkap),
monounsaturated (memiliki sebuah ikatan rangkap), dan polyunsaturated (memiliki dua atau lebih ikatan rangkap) (Chow, C.K. 2008).
Asam stearat atau asam oktadekanoat (CH3(CH2)16COOH) adalah asam lemak
berantai panjang yang memiliki 18 atom karbon dan merupakan asam lemak saturated
(tidak memiliki ikatan rangkap) (Beeffact, 2007). Asam stearat ini banyak ditemukan pada biji-bijian tanaman tropis dan lemak cadangan beberapa hewan darat dalam konsentrasi yang cukup tinggi, yaitu sekitar 25 % dari asam-asam lemak yang ada (Winarno, F.G. 1992).
2.9. Adsorpsi
Adsorpsi merupakan peristiwa terikatnya partikel-partikel alir (gas dan cair) di permukaan zat padat atau zat cair lain. Adsorpsi terjadi apabila zat padat bersinggungan dengan gas atau zat cair, pada batas antara dua zat cair, dan pada permukaan larutan. Karena adsorpsi
terjadi di permukaan maka daya adsorpsi suatu adsorben sangat bergantung pada luas permukaannya. Daya adsorpsi akan bertambah besar jika luas permukaan adsorben besar.
Adsorpsi pada fase padat dapat diklasifikasikan ke dalam adsorpsi fisika dan adsorpsi kimia. Dalam adsorpsi fisika, panas yang dihasilkan rendah yaitu sekitar 10000 kalori, kesetimbangannya cepat tercapai, dan bersifat dapat balik (reversibel). Adsorpsi fisis terjadi karena adanya gaya Van der Waals. Jenis adsorpsi fisika dapat terlihat pada penjerapan berbagai gas oleh arang. Dalam adsorpsi kimia, panas yang dihasilkan tinggi dari 10000 – 100000 kalori, kesetimbangan adsorpsi tidak dapat balik (nonreversibel) (Sulaiman, A.H. 1997).
Adsorpsi hidrokarbon tak jenuh dalam substrat logam merupakan sebuah interaksi fisika lemah, yang dipengaruhi oleh adanya gaya van der Waals. Interaksi ini pertama kali dikembangkan oleh DCD (Dewar, Chatt, dan Duncanson) yang didasarkan pada konsep orbital terdepan dimana, akan terjadi donasi muatan dari orbital π tertinggi yang terisi ke logam dan substansi backdonation dari muatan logam yang terisi ke orbital π* terendah yang tidak terisi.(Shriver et al. 1999).