MAKALAH
ATOM DAN PERKEMBANGAN STRUKTUR
ATOM
OLEH : KELOMPOK 2
IQBAL RAMADHAN SUMIATI WULANDARI NETA AMELIA WIWIT OKTAVIANI AMELIA DEVITA M.ABDUL SYUKURXII IPA 2
SMA NEGERI 7 PALEMBANG
TAHUN AJARAN 2015/2016
2
DAFTAR ISI
JUDUL ... i DARTAR ISI ... ii KATAPENGANTAR ... iii BAB I PENDAHULUAN A. Latar Belakang Masalah ... 4B. Tujuan ... 4
C. Rumusan Masalah ... 4
BABII PEMBAHASAN A. Pengertian Atom ... 5
B. Perkembangan Model Atom ... 6
C. Atom Dalton ... 9
D. Atom Thomson ... 12
E. Atom Ruttherford ... 14
F. Atom Neils Bohr ... 22
G. Atom Modern ... 22
H. Pertanyaan dan pembahasan... 27
BAB III PENUTUP KESIMPULAN... ... 28
3
KATA PENGANTAR
Puji syukur atas kehadirat Tuhan Yang Maha Esa yang telah memberikan kesehatan serta rahmatNya,sehingga saya dapat menyelesaikan tugas karya tulis ini yang berjudul “Atom” dengan baik.
Kami ucapkan terima kasih pula kepada Ibu Rahma Virgo Sari, S.Pd yang telah memberikan tugas fisika tentang perkembangan atom ini sebagai media kami belajar dan memperdalam materi mengenai atom. Tak lupa, terima kasih pun kami ucapkan kepada teman-teman yang telah membantu kami dalam mengkritik dan memberikan dukungan kepada kami
Semoga materi-materi yang kami sajikan dalam karya tulis ini dapat bermanfaat bagi teman-teman dan memberikan wawasan yang lebih luas lagi mengenai atom.
Palembang, Januari 2016
Penyusun
4
BAB I
PENDAHULUAN
A.LATAR BELAKANG MASALAH
Atom merupakan spesi yang sangat kecil yang tidak dapat dibagi-bagi menjadi bagian yang lebih kecil atau sederhana.Atom adalah unit strukutural dari sebuah benda yang menyusun benda tersebut.
Dapat dikatakan bahwa atom adalah komponen penyusun terkecil yang menyusun benda dengan struktur tertentu. Struktur inilah yang diteliti oleh banyak ilmuan, yang mengemukakan teori model atom mereka masing-masing.
B.TUJUAN
Makalah ini disusun agar para pembaca lebih mengenal dan mengetahui tentang atom secara terperinci.
C.RUMUSAN MASALAH
1.Apa sebenarnya atom itu?
2.Bagaimana susunan atau struktur dari atom?
3.Bagaimana perkembangan atom menurut para ahli?
4.Apa saja model-model atom yang dicetuskan oleh para ahli?
5
BAB II
PEMBAHASAN
I. Pengertian Atom
Atom adalah spesi terkecil yang tidak dapat dibagi-bagi menjadi bagian yang lebih kecil. Teori atom telah muncul sebelum Masehi. Contohnya adalah definisi
atom menurut Demokretus. Demokritus membuat kesimpulan : Suatu zat dapat dibagi
menjadi yang lebih kecil hingga mendapatkan bagian yang paling kecil dan tidak dapat dibagi lagi dan dinamakan atom. Kata atom ini berasal dari bahasa Yunani “atomos” yang berarti tak dapat dipotong.
II. Struktur Atom
Atom terdiri dari proton, neutron dan elektron. Proton dan neutron berada di dalam inti atom. Sedangkan elektron terus berputar mengelilingi inti atom karena muatan listriknya. semua elektron bermuatan negatif (-) dan semua proton bermuatan bermuatan netral. Elektron bermuatan yang bermuatan negatif (-) ditarik oleh proton yang bermuatan positif (+) pada inti atom.
Dalam hal ini, semua atom di alam semesta akan terjadi bermuatan positif (+) karena ada kelebihan muatan listrik positif (+) di dalam proton. Akibatnya, semua atom akan saling bertolak satu sama lain.
Atom bermuatan netral artinya bahwa atom tidak bermuatan positif (+) maupun bermuatan negatif (-).Jumlah muatan positif dan muatan negatif sama.Apabila ada atom yang kelebihan atau kekurangan elektron,itu dinamakan sebagai ion.
6 III. Perkembangan Teori Atom
Teori atom telah muncul sebelum Masehi. Contohnya adalah definisi
atom menurut Demokretus. Demokritus membuat kesimpulan : Suatu zat dapat dibagi
menjadi yang lebih kecil hingga mendapatkan bagian yang paling kecil dan tidak dapat dibagi lagi dan dinamakan atom. Kata atom ini berasal dari bahasa Yunani “atomos” yang berarti tak dapat dipotong.
Pengembangan konsep atom-atom secara ilmiah dimulai oleh John Dalton (1805), kemudian dilakukan oleh Thomson (1897), Rutherford (1911), dan disempurnakan oleh Bohr (1914)
Hasil ekperimen yang memperkuat konsep atom ini menghasilakn gambaran mengenai susunan parikel-partikel tersebut didalam atom.
A. Model Atom Dalton
Pada tahun 1808, John Dalton (ahli kimia bangsa Inggris) mengemukakan gagasannya tentang atom sebagai partikel penyusun materi. Gagasannya adalah sebagai berikut :
a. Atom merupakan partikel terkecil yang tak dapat dipecah lagi.
b. Atom suatu unsur sama segala sifatnya, sedangkan atom unsur berbeda, berlainan dalam massa dan sifatnya.
c. Senyawa terbentuk bila atom bergabung satu sama lain.
d. Reaksi kimia hanya melibatkan penataulangan atom-atom sehingga tidak atom yang berubah akibat reaksi kimia.
Model atom Dalton, adalah gagasan tentang partikel materi, bahwa materi terdiri atas butiran-butiran yang sangat kecil, yaitu atom. Model ini telah menghapus pendapat yang mengatakan bahwa pembagian materi bersifat kontinu. Walaupun kini ternyata bahwa atom terdiri atas partikel-partikel subatom, tetapi atom adalah partikel
7 terkecil dari suatu unsur yang mempunyai sifat yang sama dengan unsur itu. Atom adalah unit terkecil dari suatu unsur yang terlibat dalam suatu reaksi. Jika suatu atom diuraikan atas proton, neutron dan elektron, maka tidak ada lagi unsur-unsur yang kita kenal sekarang dan kenyataannya tidak mudah menguraikan suatu atom menjadi partikel-partikel subatomnya.
Gambar 1 menunjukkan model atom Dalton. Model ini dianggap sebagai model atom ilmiah yang pertama kali dikemukakan, sebab dilandasi fakta temuan eksperimen, yakni hukum kekekalan massa dan hukum perbandingan tetap.
Sesungguhnya gagasan tentang atom sebagai partikel terkecil materi telah dilontarkan jauh hari sebelum Dalton hidup, misalnya oleh Democritus, seorang filsuf Yunani yang hidup sekitar 400 tahun SM. Namun pandangan Democritus tidak dianggap sebagai pandangan ilmiah karena tidak dilandasi fakta-fakta empiris.
(Gambar 1 :Model atom Dalton)
Kelebihan Dari Teori Atom Dalton
Dalton merupakan salah satu ilmuwan pertama yang melakukan percobaan dan penelitian tentang atom, meskipun sebelumnya ada ilmuwan juga yang bernama Democritus yang menyatakan konsep tentang atom tetapi hasil pemikirannya sama sekali tidak didasari hasil suatu percobaan.
Beberapa teori atom yang dinyatakan John Dalton memiliki beberapa kelebihan, diantaranya yaitu :
Bahwa seperti kenyataannya, dua buah atom atau lebih yang berasal dari unsur-unsur yang sama maupun yang tidak sama dapat membentuk suatu molekul.
8 Contoh : * Untuk unsur-unsur yang sama
O2, H2, N2, O3, dll.
* Untuk unsur-unsur yang berbeda H2O, H2SO4, HCl, dll.
Teori atom yang menyatakan bahwa atom-atom yang bersenyawa membentuk molekul mempunyai perbandingan tertentu, sehingga melahirkan hukum kekekalan massa Lavoiser (jumlah massa sebelum dan sesudah reaksi adalah tetap).
Memotivasi para ilmuwan yang lain untuk mengkaji lebih dalam tentang atom, sehingga muncullah teori-teori atom yang lebih lengkap, seperti : teori atom Thomson, teori atom Rutherford, dan teori atom Niels Bohr.
Dll.
Meskipun kelebihan teori atom Dalton hanya sedikit tetapi teori Dalton dianggap sebagai teori penyulut yang dapat memotivasi para ilmuwan untuk mengkaji lebih dalam lagi tentang atom.
Teori yang belum tarjawab oleh Dalton
Dari teori-teori atom yang dinyatakan John Dalton selain memiliki kebaikan/kelebihan juga memiliki kekurangan/kelemahan, diantaranya yaitu :
Menurut John Dalton atom merupakan bagian terkecil suatu materi yang tidak dapat dibagi lagi, sedangkan pada kenyataannya atom masih dapat dibagi lagi menjadi sub-sub atom yang terdiri (proton, neutron, dan elektron) kenyataan ini dapat dibuktikan oleh Thomson melalui percobaannya.
Dalam teori John Dalton belum dapat menjelaskan gagasan tentang inti atom sesuai/seperti yang dinyatakan Rutherford, dari hasil percobaannya dengan menggunakan sumber partikel Alfa.
9 Teori atom John Dalton belum bisa menjelaskan tentang adanya tingkat-tingkat energi (kulit-kulit) dalam atom, lintasan-lintasan stasioner dalam atom, dan pancaran atau penyerapan energi dari masing-masing lintasan dalam atom.
Tidak dapat menjelaskan sifat listrik materi (hubungan antara larutan senyawa dan daya hantar arus listrik).
Tidak dapat menjelaskan cara atom-atom saling berikatan
Model atom Dalton tidak dapat menjelaskan perbedaan antara atom unsur yang satu dengan unsur yang lain.
Dalam perkembangan zaman dan seiring kemajuan teknologi mungkin akan lebih banyak pembuktian bahwa teori atom yang dinyatakan John Dalton masih sangat sederhana dan masih banyak pula kelemahannya. Contoh dari pendapat Dalton yang salah :
“Atom-atom pada suatu unsur tertentu adalah identik, artinya memiliki massa, ukuran dan sifat-sifat yang sama”, tapi para ilmuwan lain dapat menunjukkan bahwa atom-atom dari unsur yang sama dapat memiliki massa dan ukuran yang berbeda.
B. Model Atom Thomson
Kelemahan Teori Atom Dalton diperbaiki oleh JJ. Thomson. eksperimen yang dilakukannya menggunakan tabung sinar kotoda. Hasil eksperimennya menyatakan bahwa ada partikel bermuatan negatif dalam atom yang disebut elektron. Suatu bola pejal yang permukaannya dikelilingi elektron dan partikel lain yang bermuatan positif sehingga atom bersifat netral.
10 Gambar atom model Thomson :
Dengan berdasar teori ilmuwan lainnya seperti Sir Humphry Davy yang membuktikan bahwa gas menjadi penghantar listrik yang lebih baik pada tekanan rendah, Thomson pun melakukan percobaan menggunakan tabung sinar katoda. Jadi tabung di bawah ini adalah tabung hampa udara, dan di masing-masing ujung tabung diberi tabung sinar katode.
Tabung Sinar Katode
Arus listrik dengan tegangan yang cukup tinggi, ternyata pada tekanan yang rendah dan suhu tinggi, gas dalam tabung akan berpijar tergantung jenis zat dalam tabung. Jika tekanan gas dikurangi, daerah depan katode akan menjadi gelap. Daerah gelap ini terus bertambah jika tekanan gas terus dikurangi. Akhirnya, seluruh tabung menjadi gelap, tetapi bagian tabung depan katode berpendar dengan warna kehijauan. Melalui percobaan, dapat dibuktikan bahwa warna kehijauan itu adalah radiasi partikel. Karena berasal dari katode, maka sinar itu dinamakan sinar katode.
Percobaan lebih lanjut membuktikan bahwa sinar katode merupakan radiasi partikel yang bermuatan listrik negatif yang selanjutnya disebut elektron.
11 Berbagai peristiwa yang terjadi pada percobaan sinar katode :
1. Sinar katode merambat lurus dari permukaan anode menuju katode 2. Sinar katode dapat memutar kincir
3. Sinar katode dibelokkankearah kutub positif
"Atom merupakan bola pejal yang bermuatan positif dan didalamya tersebar muatan negative elektron" atau dikatakan bahwa elektron tertanam dalam awan muatan positif, inilah kesimpulan teori dari Thomson.
Model inilah yang sering disebut ‘plung pudding model’, atau model roti kismis dimana roti adalah muatan positif dan kismis merupakan elektron.
Secara ringkas model ini menyatakan :
1. Atom tersusun atas muatan –muatan positif yang tersebar merata dalam seluruh volume bola.
2. Elektron melekat pada permukaan bola positif pada posisi tertentu. 3. Elektron tidak bergerak mengelilingi inti.
4. Elektron bergetar pada frekuensi tertentu di posisinya.
5. Massa keseluruhan atom terditribusi secara merata dalam seluruh volume bola.
Kelebihan
Membuktikan adanya partikel lain yang bermuatan negative dalam atom. Berarti atom bukan merupakan bagian terkecil dari suatu unsur.
Kelemahan
Model Thomson ini tidak dapat menjelaskan susunan muatan positif dan negative dalam bola atom tersebut, belum dapat menjelaskan reaksi kimia yang terjadi antar atom. Tidak dapat menjelaskan mengapa partikel α yang ditembakkan pada lapisan tipis emas (pada eksperimen Rutheford), banyak menembus lapisan tipis emas. Tidak dapat menjelaskan garis-garis spektrum emisi atom Hidrogen yang jumlahnya banyak, padahal Hidrogen hanya memilki satu elektron.
12 C. Model Atom Rutherford
Pada tahun 1911 Hans William Geiger dan Ernest Marsden di bawah pengawasan Ernest Rutherford melakukan percobaan hamburan sinar alfa untuk menguji kebenaran hipotesis Thomson. Mereka menggunakan pemancar partikel alfa di belakang layar timbal yang berlubang kecil sehingga dihasilkan berkas partikel alfa yang tajam. Berkas ini diarahkan pada selaput emas tipis. Pada sisi lain dipasang layar berlapis seng sulfida (ZnS) yang dapat berpendar bila tertumbuk partikel alfa.
Dari pengamatan mereka, didapatkan fakta bahwa apabila partikel alfa ditembakkan pada lempeng emas yang sangat tipis, maka sebagian besar partikel alfa diteruskan (ada penyimpangan sudut kurang dari 1°), tetapi dari pengamatan Marsden diperoleh fakta bahwa satu diantara 20.000 partikel alfa akan membelok sudut 90° bahkan lebih, atau ada yang dipantulkan. Hal ini pastilah tidak sesuai dengan teori Thomson dimana atom digambarkan bersifat homogen yang padat pada semua bagiannya. Jika atom itu seperti sebuah roti kismis, maka hamburannya akan merata dan tidak mungkin dipantulkan kembali. Jadi hasil dari eksperimen Rutheford menunjukkan bahwa model atom Thomson yang menyatakan bahwa muatan positif tersebar merata didalam atom tidak dapat diterima. Interpretasi Rutheford terhadap hasil percobaan ini adalah bahwa atom harus memilki inti bermuatan positif dan
bermassa besar.
13 Hipotesis Rutherford:
1. Atom sebagian besar tediri dari ruang hampa dengan satu inti yang bermuatan positif dan satu atau beberapa electron yang beredar disekitar inti, seperti planet-planet yang bergerak dalam sistem tata surya. Massa atom sebagian besar terletak pada intinya.
2. Atom secara keseluruhan bersifat netral, muatan positif pada inti sama besarnya dengan muatan elektron yang beredar di sekitarnya. Muatan positif pada inti besarnya sama dengan nomer atom dikalikan dengan muatan elementer.
3. Inti dan elektron tarik-menarik. Gaya tarik menarik ini merupakan gaya sentripetal yang mengendalikan gerak elektron pada orbitnya masing-masing seperti grafitasi dalam tata surya.
4. Pada reaksi kimia, inti atom tidak mengalami perubahan. Yang mengalami perubahan ialah elektron-elektron pada kulit terluar.
Berdasarkan percobaan jeniusnya itulah Rutherford mengemukakan gagasannya tentang inti atom. Menurutnya, sebagian besar massa dan muatan positif atom terkonsentrasi pada bagian pusat atom yang selanjutnya disebut inti atom (pernyataan 1). Elektron beredar mengitari pada jarak yg relative sangat jauh. Jarak antara inti hingga kulit atom dinamakan jari-jari atom.
Dengan model seperti itu, maka penghamburan sinar alfa lempeng emas tipis dapat dijelaskan sebagai berikut:
1. Sebagian besar partikel sinar alfa dapat tembus karena melalui daerah hampa. 2. Partikel alfa yang mendekati inti atom dibelokkan karena mengalani gaya
14 3. Partikel alfa yang menuju inti atom dipantulkan karena inti bermuatan positif
dan sangat pejal.
Kelebihan
Membuat hipotesa bahwa atom tersusun dari inti atom dan elektron yang mengelilingi inti
Kelemahan
a. Tidak dapat menjelaskan stabilitas atom secara keseluruhan, yaitu karena elektron dipercepat maka akan terus menerus memancarkan radiasi gelombang elektromagnetik yang berakibat energi elektron semakin kecil, sehingga elektron akan berspiral menuju inti atau musnah dalam waktu 10-8 detik, namun kenyataanya elektron bergerak stabil dilintasannya.
b. Atom meradiasikan spektrum kontinu, padahal hasil pengamatan spektrum atom hidrogen melalui spektrum spektrometer menunujukkan bahawa spektrum berbentuk garis (deret Balmer).
c. Tidak dapat menjelaskan bagaimana distribusi elektron di luar inti atom.
D. Model Atom Niels Bohr Gagasan Kunci Model atom Bohr Dua gagasan kunci adalah:
1. Elektron-elektron bergerak di dalam orbit-orbit dan memiliki momentum yang terkuantisasi, dan dengan demikian energi yang terkuantisasi. Ini berarti tidak setiap orbit, melainkan hanya beberapa orbit spesifik yang dimungkinkan ada yang berada pada jarak yang spesifik dari inti.
2. Elektron-elektron tidak akan kehilangan energi secara perlahan-lahan sebagaimana mereka bergerak di dalam orbit, melainkan akan tetap stabil di dalam sebuah orbit yang tidak meluruh.
15
Postulat Dasar Model Atom Bohr
Ada empat postulat yang digunakan untuk menutupi kelemahan model atom Rutherford, antara lain :
1. Atom Hidrogen terdiri dari sebuah elektron yang bergerak dalam suatu lintas edar berbentuk lingkaran mengelilingi inti atom ; gerak elektron tersebut dipengaruhi oleh gaya coulomb sesuai dengan kaidah mekanika klasik.
2. Lintas edar elektron dalam hydrogen yang mantap hanyalah memiliki harga momentum angular L yang merupakan kelipatan dari tetapan Planck dibagi dengan 2π.
dimana n = 1,2,3,… dan disebut sebagai bilangan kuantum utama, dan h adalah konstanta Planck.
3. Dalam lintas edar yang mantap elektron yang mengelilingi inti atom tidak memancarkan energi elektromagnetik, dalam hal ini energi totalnya E tidak berubah.
4. Jika suatu atom melakukan transisi dari keadaan energi tinggi EU ke keadaan energi lebih rendah EI, sebuah foton dengan energi hυ=EU-EI diemisikan. Jika sebuah foton diserap, atom tersebut akan bertransisi ke keadaan energi rendah ke keadaan energi tinggi.
Model Atom Bohr
”Bohr menyatakan bahwa elektron-elektron hanya menempati orbit-orbit tertentu disekitar inti atom, yang masing-masing terkait sejumlah energi kelipatan dari suatu nilai kuantum dasar. (John Gribbin, 2002)”
Model Bohr dari atom hidrogen menggambarkan elektron-elektron bermuatan negatif mengorbit pada kulit atom dalam lintasan tertentu mengelilingi inti atom yang bermuatan
16 positif. Ketika elektron meloncat dari satu orbit ke orbit lainnya selalu disertai dengan pemancaran atau penyerapan sejumlah energi elektromagnetik hf.
Menurut Bohr :
” Ada aturan fisika kuantum yang hanya mengizinkan sejumlah tertentu elektron dalam
tiap orbit. Hanya ada ruang untuk dua elektron dalam orbit terdekat dari inti. (John Gribbin, 2005)”
Gambar 1. Model Atom Bohr
Model ini adalah pengembangan dari model puding prem (1904), model Saturnian (1904), dan model Rutherford (1911). Karena model Bohr adalah pengembangan dari model Rutherford, banyak sumber mengkombinasikan kedua nama dalam penyebutannya menjadi model Rutherford-Bohr.
Kunci sukses model ini adalah dalam menjelaskan formula Rydberg mengenai garis-garis emisi spektral atom hidrogen, walaupun formula Rydberg sudah dikenal secara eksperimental, tetapi tidak pernah mendapatkan landasan teoritis sebelum model Bohr diperkenalkan. Tidak hanya karena model Bohr menjelaskan alasan
17 untuk struktur formula Rydberg, ia juga memberikan justifikasi hasil empirisnya dalam hal suku-suku konstanta fisika fundamental.
Model Bohr adalah sebuah model primitif mengenai atom hidrogen. Sebagai sebuah teori, model Bohr dapat dianggap sebagai sebuah pendekatan orde pertama dari atom hidrogen menggunakan mekanika kuantum yang lebih umum dan akurat, dan dengan demikian dapat dianggap sebagai model yang telah usang. Namun demikian, karena kesederhanaannya, dan hasil yang tepat untuk sebuah sistem tertentu, model Bohr tetap diajarkan sebagai pengenalan pada mekanika kuantum.
Keterangan
Gambar 2. Model Bohr untuk atom hydrogen
Lintasan yang diizinkan untuk elektron dinomori n = 1, n = 2, n =3 dst. Bilangan ini dinamakan bilangan kuantum, huruf K, L, M, N juga digunakan untuk menamakan lintasan
Jari-jari orbit diungkapkan dengan 12, 22, 32, 42, …n2. Untuk orbit tertentu dengan jari-jari minimum a0 = 0,53 Å
2 2 0 0 4 me a
18
Jika elektron tertarik ke inti dan dimiliki oleh orbit n, energi dipancarkan dan energi elektron menjadi lebih rendah sebesar
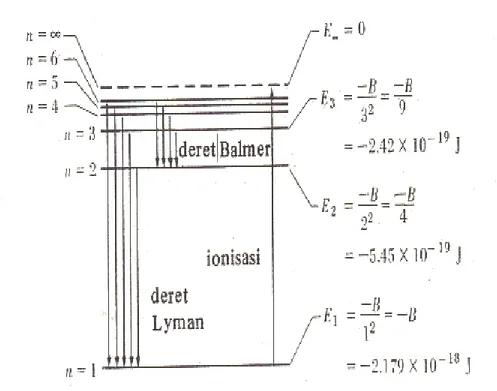
Gambar 3. Tingkat-tingkat energi atom Hydrogen Tingkatan energi elektron dalam atom hidrogen
, 2 n B En eV J 13.6 10 x 2,179 nilai dengan numerik konstanta : B -18
19 Model Bohr hanya akurat untuk sistem satu elektron seperti atom hidrogen atau helium yang terionisasi satu kali. Penurunan rumusan tingkat-tingkat energi atom hidrogen menggunakan model Bohr.
Penurunan rumus didasarkan pada tiga asumsi sederhana:
1) Energi sebuah elektron dalam orbit adalah penjumlahan energi kinetik dan energi potensialnya:
dengan k = 1 / (4πε0), dan qe adalah muatan elektron.
2) Momentum sudut elektron hanya boleh memiliki harga diskret tertentu:
dengan n = 1,2,3,… dan disebut bilangan kuantum utama, h adalah konstanta Planck,
dan .
3) Elektron berada dalam orbit diatur oleh gaya coulomb. Ini berarti gaya coulomb sama dengan gaya sentripetal:
20 Suku di sisi kiri menyatakan energi potensial, sehingga persamaan untuk energi menjadi:
Dengan menyelesaikan persamaan (2) untuk r, didapatkan harga jari-jari yang diperkenankan:
Dengan memasukkan persamaan (6) ke persamaan (4), maka diperoleh:
Dengan membagi kedua sisi persamaan (7) dengan mev didapatkan
Dengan memasukkan harga v pada persamaan energi (persamaan (5)), dan kemudian mensubstitusikan harga untuk k dan , maka energi pada tingkatan orbit yang berbeda dari atom hidrogen dapat ditentukan sebagai berikut:
21 Dengan memasukkan harga semua konstanta, didapatkan,
Dengan demikian, tingkat energi terendah untuk atom hidrogen (n = 1) adalah -13.6 eV. Tingkat energi berikutnya (n = 2) adalah -3.4 eV. Tingkat energi ketiga (n = 3) adalah -1.51 eV, dan seterusnya. Harga-harga energi ini adalah negatif, yang menyatakan bahwa elektron berada dalam keadaan terikat dengan proton. Harga energi yang positif berhubungan dengan atom yang berada dalam keadaan terionisasi yaitu ketika elektron tidak lagi terikat, tetapi dalam keadaan tersebar.
Dengan teori kuantum, Bohr juga menemukan rumus matematika yang dapat dipergunakan untuk menghitung panjang gelombang dari semua garis yang muncul dalam spektrum atom hidrogen. Nilai hasil perhitungan ternyata sangat cocok dengan yang diperoleh dari percobaan langsung. Namun untuk unsur yang lebih rumit dari hidrogen, teori Bohr ini ternyata tidak cocok dalam meramalkan panjang gelombang garis spektrum. Meskipun demikian, teori ini diakui sebagai langkah maju dalam menjelaskan fenomena-fenomena fisika yang terjadi dalam tingkatan atomik. Teori kuantum dari Planck diakui kebenarannya karena dapat dipakai untuk menjelaskan berbagai fenomena fisika yang saat itu tidak bisa diterangkan dengan teori klasik.
Kelebihan dan Kelemahan Teori Bohr
Keberhasilan teori Bohr terletak pada kemampuannya untuk meeramalkan garis-garis dalam spektrum atom hidrogen
22 Salah satu penemuan adalah sekumpulan garis halus, terutama jika atom-atom
yang dieksitasikan diletakkan pada medan magnet
Kelemahan
Struktur garis halus ini dijelaskan melalui modifikasi teori Bohr tetapi teori ini tidak pernah berhasil memerikan spektrum selain atom hydrogen
Belum mampu menjelaskan adanya stuktur halus(fine structure) pada spectrum, yaitu 2 atau lebih garis yang sangat berdekatan
Belum dapat menerangkan spektrum atom kompleks Itensitas relatif dari tiap garis spektrum emisi.
Efek Zeeman, yaitu terpecahnya garis spektrum bila atom berada dalam medan magnet.
E.Teori Atom Modern
Model atom mekanika kuantum modern lahir pada tahun 1925, ketika Werner Karl Heisenberg mengembangkan mekanika matriks dan Erwin Schrödinger menemukan mekanika gelombang dan persamaan Schrödinger. Werner Heisenberg mengembangkan teori mekanika kuantum yang dikenal dengan prinsip ketidakpastian yaitu “Tidak mungkin dapat ditentukan kedudukan dan momentum suatu benda secara seksama pada saat bersamaan, yang dapat ditentukan adalah kebolehjadian menemukan elektron pada jarak tertentu dari inti atom”.Daerah ruang di sekitar inti dengan kebolehjadian untuk mendapatkan elektron disebut orbital. Bentuk dan tingkat energi orbital dirumuskan oleh Erwin Schrodinger. Erwin Schrodinger memecahkan suatu persamaan untuk mendapatkan fungsi gelombang untuk menggambarkan batas kemungkinan ditemukannya elektron dalam tiga dimensi.
Teori kuantum juga telah dikemukakan oleh Max Planck pada tahun 1900 yang menyatakan bahwa atom dapat memancarkan atau menyerap energi hanya dalam jumlah tertentu (kuanta). Jumlah energi yang dipancarkan atau diserap dalam bentuk radiasi elektromagnetik disebut kuantum. Adapun besarnya kuantum dinyatakan dalam persamaan berikut:
23 E= ℎ𝑐
𝜆
Keterangan:
E = energi radiasi (Joule = J)
h = konstanta Planck (6,63 x 10-34 J.s)
c = cepat rambat cahaya di ruang hampa (3 x 108 ms-1) l = panjang gelombang (m)
Dengan teori kuantum, kita dapat mengetahui besarnya radiasi yang dipancarkan maupun yang diserap. Selain itu, teori kuantum juga bisa digunakan untuk menjelaskan terjadinya spektrum atom. Perhatikan spektrum atom hidrogen berikut.
Pada Gambar di atas dapat dilihat bahwa percikan listrik masuk ke dalam tabung gelas yang mengandung gas hidrogen. Sinar yang keluar dari atom H (setelah melalui celah) masuk ke dalam prisma, sehingga sinar tersebut terbagi menjadi beberapa sinar yang membentuk garis spektrum. Ketika sinar itu ditangkap oleh layar, empat garis yang panjang gelombangnya tertera pada layar adalah bagian yang dapat dilihat dari spektrum gas hidrogen.
24 Awan elektron disekitar inti menunjukan tempat kebolehjadian elektron. Orbital menggambarkan tingkat energi elektron. Orbital-orbital dengan tingkat energi yang sama atau hampir sama akan membentuk sub kulit. Beberapa sub kulit bergabung membentuk kulit.
Dengan demikian kulit terdiri dari beberapa sub kulit dan subkulit terdiri dari beberapa orbital. Walaupun posisi kulitnya sama tetapi posisi orbitalnya belum tentu sama.
Karakteristik model atom kuantum :
Gerakan elektron memiliki sifat gelombang, sehingga lintasannya (orbitnya) tidak stasioner seperti model Bohr, tetapi mengikuti penyelesaian kuadrat fungsi gelombang yang disebut orbital (bentuk tiga dimensi darikebolehjadian
25 paling besar ditemukannya elektron dengan keadaan tertentu dalam suatu atom)
Bentuk dan ukuran orbital bergantung pada harga dari ketiga bilangan kuantumnya. (Elektron yang menempati orbital dinyatakan dalam bilangan kuantum tersebut)
Posisi elektron sejauh 0,529 Amstrong dari inti H menurut Bohr bukannya sesuatu yang pasti, tetapi bolehjadi merupakan peluang terbesar ditemukannya elektron.
Bilangan kuantum dan orbital atom
Schrodinger berhasil menyelesaikan seperangkat persamaan matematis yang menghasilkan tiga bilangan kuantum yang menunjukkan daerah kebolehjadian menemukan elektron di sekeliling inti.
Ketiga bilangan kuantum itu adalah bilangan kuantum utama (n), bilangan kuantum azimut (l), dan bilangan kuantum magnetik (ml).
Bilangan kuantum utama (n) menunjukkan tingkat energi.
Bilangan kuantum azimut (l) menentukan bentuk orbital dan sub tingkatan energi.
Bilangan kuantum magnetik (ml) menyatakan orientasi orbital atau sikap orbital terhadap orbital lain.
Selain tiga bilangan kuantum yang berasal dari penyelesaian persamaan Schrodinger, masih ada satu bilangan kuantum, yaitu bilangan kuantum spin (ms).
26
Konfigurasi elektron dan sistem periodik
Menurut prinsip Aufbau, konfigurasi elektron dimulai dari subkulit yang memiliki tingkat energi terendah dan diikuti dengan subkulit yang memiliki tingkat energi lebih tinggi.
Asas larangan Pauli menyatakan bahwa tidak ada dua elektron dalam sebuah atom apa pun dapat mempunyai keempat bilangan kuantum yang sama.
Menurut aturan Hund, dalam subtingkatan energi tertentu, tiap orbitaldihuni oleh satu elektron terlebih dahulu sebelum ada orbital yang memiliki sepasang elektron. Elektron-elektron tunggal dalam orbital itu mempunyai spin searah (paralel).
Dalam sistem periodik unsur, unsur dikelompokkan dalam empat blok, yaitu blok s, blok p, blok d, dan blok f.
27
H. Pertanyaan dan pembahasan tentang teori atom Rhuterford
Kelompok 1Lisye Mela Sari : Adakah rumus yg ditemukan pada percobaan Rhuterford? Keterangan:
k = konstanta = 9 . 〖10〗^(9 )Nm2/C r = Jari-jari lintasan
e = Muatan elektron = 1,6 . 10-19C
Kelompok 3
Nirmala : Mengapa teori atom Rhuterford susunan nya seperti tata surya?
Sebab, menurut atom rutherford ada sebuah pusat masa yg berikatan positif, yang masanya terpusat, dan elektron yg tersebar mengeliling pusat inti ini dengan sebuah lintasan yang tidak stasioner atau dapat dikatakan inti atom ada matahari dan elekron adalah planet yang mengelilingi matahari
Kelompok 4
Dimas Aprianto : Apa saja partikel yang di temukan pada atom rhuterford? Partikel yang di temukan pada percobaan rhuterford yaitu 1. Ada sebuah partikel yang masanya terpusat, dan di sebut inti atom
2. Sebuah partikel ion yang mngelilingi inti atom positif yang di sebut dengan elektron
Kelompok 5
Yunima Hasdaniyanti : Apa kelemahan bentuk spiral pada teori atom rhuterford? Sebab, jika elektron mempunyai bentuk lintasan spiral, maka elektron bergerak menuju inti . Lalu elektron akan jatuh ke inti dan elektron akan musnah
28
BAB III
PENUTUP
A.Kesimpulan
Atom merupakan spesi terkecil yang tersusun atas proton(muatan
positif),neutron,dan elektron(muatan negatif).Pada perkembangannya,ditemukan beberapa model atom serta teori terkait.Adapun model atom antara lain: model atom John Dalton,model atom Thomson,model atom Rutherford,model atom Bohr dan teori atom modern.
Menurut Democritus, atom adalah partikel terkecil yang tidak dapat dibagi lagi. Menurut Dalton, Atom adalah bola pejal yang bermuatan netral. Menurut
JJ.Thomson, atom adalah bola yang bermuatan positif yang disekitarnya terdapat electron yang tersebar (roti kismis). Menurut teori Ruttherford, atom adalah partikel yang bermuatan positif yang dikelilingi oleh elktron pada lintasan tertentu dan tidak tetap. Menurut teori Neils Bohr, atom memunyai lintasan stationer, dimana electron mengelilingi proton pada lintasan dan tingkat energy tertenu. Dan terkahir, menurut teori atom modern, atom adalah partikel yang mempunyai sifat seperti gelombang, yang mampu berubah tiap tingkatan energy tertentu dan electron mengelilingi proton pada lintasan dan sub energi
B.Kritik dan Saran
Demikian makalah yang kami susun. Semoga bermanfaat bagi para pembaca dan dapat menjadi sarana untuk menambah wawasan ataupun pengetahuan mengenai atom.Saya menyadari masih banyak kekurangan dalam penyusunan makalah ini.Sehingga mohon saran dan kritik yang membangun guna memperbaiki dan menyempurnakan isi makalah.
29