KEMAMPUAN PENGHAMBATAN Streptomyces spp.
TERHADAP MIKROBA PATOGEN TULAR TANAH PADA
BEBERAPA KONDISI PERTUMBUHAN: JENIS MEDIA,
WAKTU PRODUKSI, pH, DAN SUHU
JUNDATUL ULYA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2009
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan dengan sebenar-benarnya bahwa tesis yang berjudul Kemampuan Penghambatan Streptomyces spp. terhadap Mikroba Patogen Tular Tanah pada Beberapa Kondisi Pertumbuhan: Jenis Media, Waktu Produksi, pH dan Suhu adalah hasil karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada Perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lainnya telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2009
Jundatul Ulya NRP G 351070081
ABSTRACT
JUNDATUL ULYA. Capability of Streptomyces spp. in Inhibiting Soil Borne Microbial Pathogen at Various Growth Conditions: Media, Incubation Times, pH, and Temperature. Under Direction of YULIN LESTARI and RASTI SARASWATI
Streptomyces spp. have the potency to be used as an agent of biological
control through their capability to produce various anti microbial compounds. The production of anti microbial compounds is influenced by nutrition, culture media, incubation times, pH and temperature. This research aimed to study the capability of Streptomyces spp. in inhibiting soil borne microbial pathogen at several media, incubation times, pH, and temperature. There were two tested media i.e: ISP4 and modified molasses-soy bean meal media; 5, 10, and 15 days of incubation times, three level of pH (5, 7, 9); and five level of temperature (room temperature (24 – 26 0C), 30 0C, 40 0C, and 50 0C). The result showed that three local isolates of
Streptomyces namely LSW05, LBR02 and PS4-16 grew better and produce more
anti microbial activity when they grown using modified molasses-soy bean meal media compared with that using ISP4. The highest anti microbial activity was obtained at 15 days incubation at room temperature. The three selected
Streptomyces isolates was able to produce anti microbial activity under pH 5 – 9,
and room temperature to 40 0C in inhibiting soil borne microbial pathogen (Bacillus subtilis, B. cereus, Xanthomonas axonopodis, X. oryzae, and Ralstonia
solanacearum). LSW05 had an optimum inhibition at pH 7 and room temperature
meanwhile, LBR02 inhibited soil borne microbial pathogen at pH 7 – 9 and room temperature to 40 0C temperature. PS4-16 isolate had the highest inhibition activity at pH 5 – 9 and room temperature to 400C. All isolates tested showed anti fungal inhibition at room temperature and pH 5 – 9 against soil borne fungal pathogen (Fusarium oxysporum, Sclerotium rolfsii, and Rhizoctonia solani). The results indicate that three local isolates of Streptomyces spp. tested have capability to be developed as biocontrol agent for soil borne microbial pathogen, and its production can be stimulated by giving environmental growth conditions i.e: modified molasses-soybean meal media, pH 5 – 9, and room temperature to 400C.
Key words: Streptomyces spp., anti microbial compounds, soil borne microbial
RINGKASAN
JUNDATUL ULYA. Kemampuan Penghambatan Streptomyces spp. terhadap Mikroba Patogen Tular Tanah pada Beberapa Kondisi Pertumbuhan: Jenis Media, Waktu Produksi, pH, dan Suhu. Dibimbing oleh YULIN LESTARI dan RASTI SARASWATI.
Pemanfaatan agen biokontrol sebagai alternatif pengendalian terhadap mikroba patogen semakin berkembang. Hal ini dipicu oleh semakin banyaknya pencemaran yang disebabkan oleh pestisida yang terakumulasi di tanah. Agen biokontrol terhadap penyakit tumbuhan mampu menurunkan populasi patogen penyebab penyakit atau semua aktivitas yang dihasilkannya dalam menyerang tanaman. Namun dengan semakin banyaknya penyebab penyakit yang belum diketahui musuh alaminya, maka sekarang ini pemanfaatan mikroba sebagai agen biokontrol banyak diteliti. Mikroba tersebut dapat menghasilkan berbagai senyawa anti mikroba yang dapat dikembangkan untuk subtitusi senyawa kimia sintetik. Selain itu penggunaan senyawa anti mikroba yang dihasilkan oleh mikroba untuk mengontrol penyakit tanaman dapat diaplikasikan dalam konsentrasi yang rendah, mudah diuraikan oleh mikroba tanah, sehingga tidak terjadi akumulasi residu, serta tidak mengganggu keseimbangan lingkungan.
Salah satu bakteri yang memiliki potensi untuk dikembangkan adalah
Streptomyces spp. Kemampuan Streptomyces spp. dalam menghasilkan berbagai
senyawa metabolik sekunder seperti antibiotik: neomisin, kloramfenikol, streptomisin, nistatin, amfoterisin, dan natamisin yang dapat menghambat pertumbuhan bakteri maupun fungi dengan spektrum penghambatan yang luas merupakan dasar pengembangan Streptomyces spp. sebagai agen biokontrol. Produksi senyawa anti mikroba yang dihasilkan dapat dipengaruhi berbagai faktor pertumbuhan baik internal maupun eksternal. Faktor-faktor inilah yang menjadikan upaya penelitian terus dilakukan, terutama rekayasa faktor eksternal seperti jenis media, waktu produksi, pH, dan suhu sehingga menghasilkan senyawa anti mikroba yang optimum menghambat berbagai mikroba patogen. Penelitian ini bertujuan untuk mengkaji daya hambat senyawa anti mikroba
Streptomyces spp. terhadap mikroba patogen tular tanah pada beberapa kondisi
media, waktu produksi, pH, dan suhu.
Metode yang dilakukan untuk mengetahui kemampuan Streptomyces spp. dalam menghambat mikroba patogen tular tanah dengan memproduksi senyawa anti mikroba yang dioptimasi dengan berbagai faktor eksternal seperti media, waktu produksi, pH, dan suhu. Empat Streptomyces lokal LSW05, LBR02, SSW02 dan PS4-16 digunakan dalam penelitian ini. Media optimasi dilakukan dengan menggunakan dua media uji yaitu ISP4 (Internasional Streptomyces
Project) dan media modifikasi molase-kedelai. Pengaruh waktu produksi
dilakukan dengan menginkubasi biakan pada tiga waktu berbeda yaitu selama 5 hari, 10 hari, dan 15 hari. Pengaruh pH dilakukan dengan menumbuhkan
Streptomyces spp. pada media terpilih dengan pH 5, 7, dan 9 untuk mengetahui
ketahanan senyawa anti mikroba pada media masam, netral dan basa. Optimasi selanjutnya yaitu dengan menguji kemampuan senyawa anti mikroba yang dihasilkan pada berbagai suhu yaitu suhu ruang (24 – 26 0C), suhu 30 0C, suhu
40 0C, dan suhu 50 0C. Filtat kultur yang dihasilkan pada perlakuan tersebut selanjutnya diujikan terhadap bakteri target seperti: Ralstonia solanacearum,
Xanthomonas axonopodis, X. oryzae, Bacillus subtilis dan B. cereus, serta
cendawan target seperti: Fusarium oxysporum, Rhizoctonia solani, dan Sclerotium
rolfsii. Kemampuan isolat dalam menggunakan subtrat media juga diamati dengan
metode DNS Miller (1959) yang diukur dengan spektrofotometer pada panjang gelombang 550 nm. Pertumbuhan diukur berdasarkan berat kering sel.
Streptomyces spp. yang diuji mempunyai pertumbuhan yang berbeda. Isolat
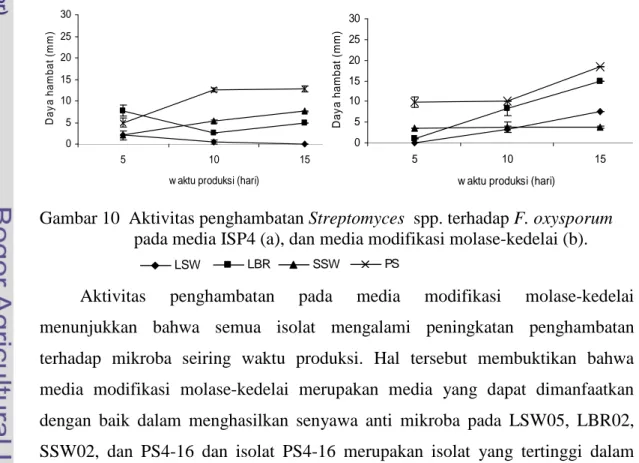
LSW05, LBR02, dan SSW02 mampu tumbuh pada media Yeast Malt Agar, sedangkan PS4-16 tumbuh baik pada media Oatmeal Agar. Perbedaan pertumbuhan tersebut menunjukkan bahwa kemampuan isolat dalam memanfaatkan sumber karbon berbeda. Media modifikasi molase-kedelai mampu meningkatkan pertumbuhan dan aktivitas penghambatan Streptomyces spp. terhadap mikroba patogen tular tanah. Penghambatan tertinggi terlihat pada waktu produksi 15 hari. Hal ini kemungkinan terjadi karena pada hari ke-15 kondisi pertumbuhan yang terbatas sehingga isolat mengeluarkan senyawa anti mikroba untuk mempertahankan diri dari kondisi yang tidak menguntungkan, terutama karena kekurangan nutrisi. Penghambatan tertinggi nampak pada isolat PS4-16 dan LBR02 terhadap semua bakteri patogen pada media modifikasi molase-kedelai. Peningkatan penghambatan tersebut juga terjadi pada cendawan patogen. PS4-16 mempunyai kemampuan tertinggi dalam menghambat semua cendawan patogen, diikuti LBR02. Hal itu membuktikan bahwa media modifikasi molase-kedelai mampu digunakan sebagai media pertumbuhan dan produksi senyawa anti mikroba Streptomyces spp dengan waktu produksi 15 hari sebagai acuan untuk waktu produksi senyawa anti mikroba. Modifikasi molase-kedelai dapat menjadi sumber karbon dan nitrogen bagi isolat-isolat uji. Tiga isolat yang mempunyai penghambatan terbesar (PS4-16, LBR02, dan LSW05) digunakan pada pengujian kemampuan penghambatan pada pH dan suhu.
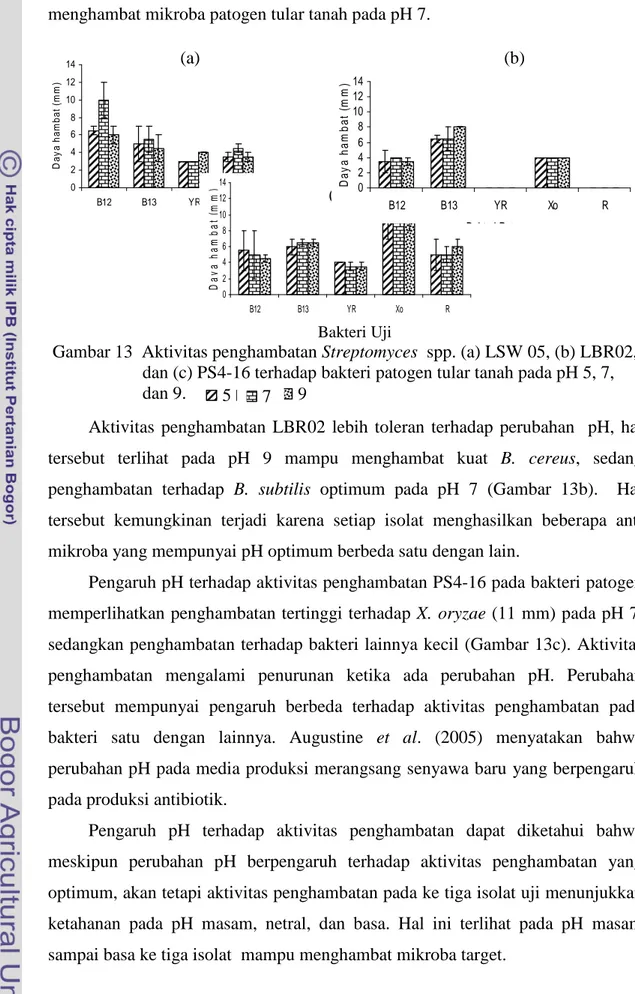
Pengujian terhadap pH 5, 7, dan 9 digunakan untuk mengamati aktivitas anti mikroba pada kondisi masam, netral dan alkali. Pengaruh pH terhadap produksi senyawa anti mikroba diketahui bahwa isolat LSW05, LBR02, dan PS4-16 mampu menghasilkan senyawa anti mikroba pada pH 5 sampai 9. Setiap isolat mempunyai penghambatan yang beragam terhadap bakteri patogen tular tanah. Isolat LSW05 mempunyai penghambatan yang tinggi (10 mm) terhadap
B. subtilis pada pH 7, LBR02 mampu menghambat kuat B. cereus pada pH 9 dan
PS4-16 mampu menghambat kuat X. oryzae (11 mm) pada pH 7. Hal tersebut kemungkinan terjadi karena setiap isolat menghasilkan beberapa anti mikroba yang berbeda sehingga pH optimumnya berbeda. Perubahan pH pada media produksi merangsang senyawa baru yang berpengaruh pada produksi antibiotik.
Hasil produksi pada media modifikasi molase-kedelai, waktu produksi 15 hari, dan pH 7 kemudian diinkubasi pada beragam suhu. Streptomyces spp. yang diuji mampu menghambat mikroba patogen tular tanah pada suhu ruang, 30 0C, dan 40 0C, sedang pada suhu 50 0C tidak terjadi penghambatan. Hasil penghambatan setiap isolat beragam terhadap mikroba patogen. Isolat LSW05 pada suhu ruang dapat menghambat empat bakteri uji (B. subtilis, B. cereus, dan
X. axonopodis). Bacillus subtilis dan B. cereus mempunyai penghambatan
tertinggi (10 mm dan 5.5 mm). Hal tersebut bisa terjadi kemungkinan karena senyawa metabolit yang dihasilkan LSW05 optimum pada suhu ruang. Isolat
LBR02 mampu menghambat kuat B. cereus pada suhu ruang sampai 40 0C, dan pada suhu 30 0C kemampuan senyawa anti mikroba yang dihasilkan mampu menghambat empat mikroba patogen (B. subtilis, B. cereus, X. oryzae, dan
R. solanacearum). Isolat PS4-16 mampu menghambat kuat X. oryzae pada suhu
ruang, dan mampu menghambat semua bakteri patogen pada suhu ruang sampai 400C.
Pengaruh suhu pada aktivitas penghambatan Streptomyces spp. terhadap cendawan patogen target sangat beragam. Isolat LSW05 hanya mampu menghambat S. rolfsii pada suhu ruang dan 30 0C, sedangkan isolat LBR02 dan PS4-16 mampu menghambat F. oxysporum, S. rolfsii dan R. solani pada suhu ruang sampai 40 0C. Namun aktivitas penghambatan pada suhu ruang lebih baik dibandingkan suhu 300C dan 400C. Hal tersebut bisa terjadi karena aktivitas anti fungi oleh Streptomyces spp. umumnya disebabkan oleh produksi antibiotik dan enzim ekstraseluler (kitinase dan glukanase) yang dihasilkan sehingga kenaikan suhu diatas suhu optimum dapat menurunkan aktivitas penghambatannya.
Kemampuan penghambatan tersebut juga dipengaruhi kemampuan isolat dalam menggunakan subtrat dalam media. Hasil pengukuran kadar gula dalam media molase-kedelai menunjukkan bahwa semua isolat Streptomyces spp. mampu memanfaatkan molase sebagai sumber karbon. Hal itu terlihat adanya perubahan kadar gula dan pertambahan berat kering sel pada semua isolat. Kemampuan isolat yang beragam dalam memanfaatkan gula, mempengaruhi kemampuan dalam menghasilkan senyawa anti mikroba. Glukosa merupakan sumber karbon utama dalam pertumbuhan, dan mempengaruhi biosintesis senyawa anti mikroba. Hasil penelitian ini memberikan gambaran bahwa tiga isolat LSW05, LBR02, dan PS4-16 dapat memproduksi senyawa anti mikroba dengan menggunakan media modifikasi molase-kedelai, pH 5 – 9, dan suhu ruang sampai 40 0C. Hasil ini memerlukan tindak lanjut untuk mengetahui efektivitas senyawa anti mikroba yang dihasilkan Streptomyces spp. pada kondisi lapangan, dan formulasinya untuk biokontrol.
Kata kunci: Streptomyces spp., senyawa anti mikroba, mikroba patogen tular tanah, dan faktor eksternal pertumbuhan.
©Hak Cipta milik IPB, tahun 2009
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyususnan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
Dilarang mengumumkan dan memperbanyak sebagian atau keseluruhan Karya tulis dalam bentuk apapun tanpa ijin IPB.
KEMAMPUAN PENGHAMBATAN Streptomyces spp.
TERHADAP MIKROBA PATOGEN TULAR TANAH PADA
BEBERAPA KONDISI PERTUMBUHAN: JENIS MEDIA,
WAKTU PRODUKSI, pH, DAN SUHU
JUNDATUL ULYA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Biologi Mayor Mikrobiologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2009
Judul Tesis : Kemampuan Penghambatan Streptomyces spp. terhadap Mikroba Patogen Tular Tanah pada Beberapa Kondisi Pertumbuhan: Jenis Media, Waktu Produksi, pH, dan Suhu.
Nama : Jundatul Ulya NRP : G 351070081
Disetujui Komisi Pembimbing:
Dr. Ir. Yulin Lestari Dr. Rasti Saraswati
Ketua Anggota
Diketahui
Ketua Mayor Mikrobiologi Dekan Sekolah Pascasarjana
Dr. Ir. Gayuh Rahayu Prof. Dr. Ir. Khairil A. Notodiputro, M.S
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas segala nikmat dan karunia-Nya sehingga karya ilmiah ini dapat diselesaikan. Penelitian yang berjudul Kemampuan Penghambatan Streptomyces spp. terhadap Mikroba Patogen Tular Tanah pada Beberapa Kondisi Pertumbuhan: Jenis Media, Waktu Produksi, pH dan Suhu dilaksanakan sejak bulan Juni 2008 hingga Mei 2009 di Laboratorium Mikrobiologi, Departemen Biologi Fakultas Matematika dan Ilmu Pengtahuan Alam, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Dr. Ir. Yulin Lestari dan Dr. Rasti Saraswati selaku pembimbing atas bimbingan dan saran, serta dukungannya dalam pelaksanaan penelitian dan penyusunan karya ilmiah ini. Terima kasih juga penulis sampaikan kepada Dr. Ir. Suryo Wiyono, MSc. Agr selaku penguji atas koreksi dan sumbang sarannya.
Terima kasih yang sebesar-besarnya penulis sampaikan kepada Departemen Agama Republik Indonesia yang telah mengadakan program beasiswa pascasarjana. Terima kasih juga kepada teman-teman di Laboratorium Mikrobiologi yang kesemuanya tidak dapat saya sebutkan satu persatu, penulis mengucapkan banyak terima kasih atas bantuan dan kebersamaannya.
Akhirnya ucapan terima kasih tak terhingga penulis sampaikan kepada suami tercinta atas kekuatan, kesabaran, pengorbanan, dan ketulusannya dalam memberikan motivasi dan semangat. Kepada Bapak, Ibu serta seluruh keluarga atas doa, kasih sayang, dan dukungannya selama ini.
Penulis menyadari bahwa tesis ini masih jauh dari sempurna, oleh karena itu kritik dan saran sangat diharapkan. Penulis berharap semoga karya ilmiah ini bermanfaat bagi pembaca.
Bogor, Agustus 2009
RIWAYAT HIDUP
Penulis dilahirkan di Lamongan – Jawa Timur pada tanggal 31 Desember 1977. Penulis merupakan anak ketiga dari enam bersaudara, pasangan Bapak Muhtadi dan Ibu Khoitin.
Tahun 1995 penulis lulus dari SMAN I Paciran – Lamongan, dan tahun 1996 penulis diterima di jurusan Ilmu Tanah Fakultas Pertanian Universitas Jember. Penulis lulus dari Universitas Jember pada tahun 2002. Tahun 2003 penulis mulai bekerja sebagai guru Madrasah Aliyah Salafiyah Yayasan Pondok Pesantren Al Fattah Siman, Sekaran Lamongan sampai sekarang.
Saat ini penulis bekerja sebagai staf pengajar Biologi di Madrasah Aliyah Salafiyah Yayasan Pondok Pesantren Al Fattah Siman, Sekaran-Lamongan. Tahun 2007 penulis mendapatkan kesempatan melanjutkan ke Program S2 Pascasarjana Program Mayor Mikrobiologi melalui beasiswa pendidikan pascasarjana dari Departemen Agama Republik Indonesia.
DAFTAR ISI
Halaman
DAFTAR TABEL ... xiv DAFTAR GAMBAR ... xv DAFTAR LAMPIRAN ... xvii PENDAHULUAN
Latar Belakang ... 1 Tujuan Penelitian ... 4 Manfaat Penelitian ... 4
TINJAUAN PUSTAKA
Karakterisasi dan Ekologi Streptomyces spp. ... 5 Potensi Streptomyces spp. dalam Memproduksi Senyawa
Anti Mikroba ... 7 Potensi Streptomyces spp. sebagai Agen Biokontrol Mikroba
Patogen Tular Tanah ... 9 Faktor-Faktor yang Berpengaruh terhadap Produksi
Senyawa Anti Mikroba ... 9 Mikroba Patogen Tular Tanah ... 11
BAHAN DAN METODE
Peremajaan Isolat Streptomyces spp. dan Mikroba Patogen
Tular Tanah ... 14 Pembuatan Stok Inokulum Mikroba Patogen Tular Tanah ... 14 Uji Antagonis Langsung Kemampuan Penghambatan
Streptomyces spp. terhadap Mikroba Patogen Tular Tanah ... 15 Optimasi Produksi Senyawa Anti Mikroba ... 15 Bioesei Filtrat Kultur Streptomyces spp. terhadap Pertumbuhan
Bakteri Patogen Tular Tanah ... 16 Bioesei Filtrat Kultur Streptomyces spp. terhadap Pertumbuhan
Cendawan Patogen Tular Tanah ... 17 Pengukuran Berat Kering Sel dan Kadar Gula dalam Media ... 17
HASIL DAN PEMBAHASAN
Pertumbuhan Streptomyces spp. ... 18 Kemampuan Penghambatan Streptomyces spp. terhadap Mikroba
Patogen Tular Tanah ... 19 Kemampuan Isolat Streptomyces spp. Terpilih dalam
Menghasilkan Senyawa Anti Mikroba pada Media ISP4 dan Media
Kemampuan Isolat Streptomyces spp. Terpilih dalam
Menghasilkan Senyawa Anti Mikroba pada pH 5, 7 dan 9 ... 34
Kemampuan Isolat Streptomyces spp. Terpilih dalam Menghasilkan Senyawa Anti Mikroba pada Suhu Ruang, 300C, 400C, dan 500C ... 37
Pertumbuhan Sel Streptomyces spp. dan Pemanfaatan Subtrat dalam Media ... 40
SIMPULAN DAN SARAN ... 43
DAFTAR PUSTAKA ... 44
DAFTAR TABEL
Halaman
DAFTAR GAMBAR
Halaman
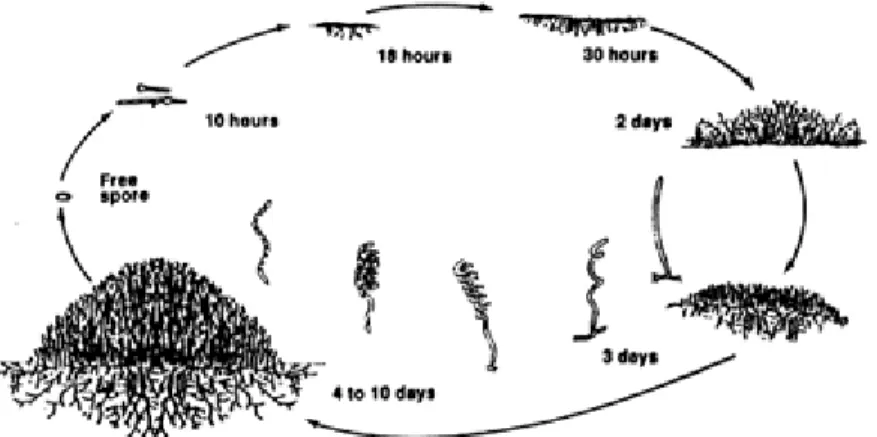
1 Siklus hidup Streptomyces spp. ... 5
2 Streptomyces spp. hasil peremajaan pada media YMA (LSW 05),
LBR02, SSW02, dan media OA PS4-16 (d) ... .... 18
3 Aktivitas penghambatan sel Streptomyces spp. terhadap
bakteri patogen tular tanah ... .... 19
4 Aktivitas penghambatan sel Streptomyces spp. terhadap
cendawan patogen tular tanah ... 20
5 Aktivitas penghambatan Streptomyces spp. terhadap B. subtilis
pada media ISP4 dan modifikasi molase-kedelai... .... 23
6 Aktivitas penghambatan Streptomyces spp. terhadap B. cereus
pada media ISP4 dan modifikasi molase-kedelai ... .... 24
7 Aktivitas penghambatan Streptomyces spp. terhadap X. axonopodis
pada media ISP4 dan modifikasi molase-kedelai ... .... 25
8 Aktivitas penghambatan Streptomyces spp. terhadap X. oryzae
pada media ISP4 dan modifikasi molase-kedelai ... .... 26
9 Aktivitas penghambatan Streptomyces spp. terhadap R. solanacearum
pada media ISP4 dan modifikasi molase-kedelai ... .... 27
10 Aktivitas penghambatan Streptomyces spp. terhadap F. oxysporum
pada media ISP4 dan modifikasi molase-kedelai ... .... 31
11 Aktivitas penghambatan Streptomyces spp. terhadap S. rolfsii dan
R. solani pada media ISP4 dan modifikasi molase-kedelai ... .... 32
12 Berat kering sel Streptomyces spp. pada media ISP4 dan modifikasi
molase-kedelai ... .... 33
13 Aktivitas penghambatan Streptomyces spp. LSW 05, LBR02, dan PS4-16 terhadap bakteri patogen tular tanah pada pH 5, 7,
dan 9 ... 35
dan PS4-16 terhadap cendawan patogen tular tanah pada pH 5, 7,
dan 9 ... 36 15 Berat kering sel Streptomyces spp. pada pH 5, 7, dan 9 ... .... 37
16 Aktivitas penghambatan Streptomyces spp. terhadap bakteri
patogen tular tanah pada suhu ruang, 300C, 400C, dan 500C ... .... 38
17 Aktivitas penghambatan Streptomyces spp. terhadap cendawan
patogen tular tanah pada suhu ruang, 300C, 400C, dan 500C ... .... 39
18 Berat kering sel Streptomyces spp. terhadap suhu ruang, 300C, 400C,
dan 500C ... .... 40
DAFTAR LAMPIRAN
Halaman
1 Komposisi media peremajaan ... 50
2 Komposisi media produksi ... 51
3 Prosedur pengujian kadar gula dalam media ... 52
PENDAHULUAN
Latar Belakang
Pemanfaatan agen biokontrol sebagai alternatif pengendalian terhadap mikroba patogen semakin berkembang. Hal ini dipicu oleh semakin banyaknya pencemaran yang disebabkan oleh pestisida yang terakumulasi di tanah. Pestisida yang digunakan dalam pengendalian patogen tanaman umum digunakan untuk menjaga kestabilan produksi pertanian. Namun penambahan bahan kimia yang terus menerus menyebabkan efek negatif seperti resistensi patogen target untuk pengendalian selanjutnya, dan hilangnya agen-agen pengendali di alam. Pestisida yang bersifat tidak spesifik dapat membunuh tidak hanya patogen yang diinginkan tetapi membunuh semua organisme sehingga dapat mengakibatkan keseimbangan alam terganggu (Prapagdee et al. 2008).
Agen biokontrol terhadap penyakit tumbuhan dapat berupa organisme yang mampu menurunkan populasi patogen penyebab penyakit atau semua aktivitas yang dihasilkan dalam menyerang tanaman. Pada awalnya, pemanfaatan agen biokontrol hanya dengan mencari musuh alami, misalnya serangga hama dikontrol dengan serangga tertentu. Namun dengan semakin banyaknya penyebab penyakit yang belum diketahui musuh alaminya, maka sekarang ini pemanfaatan mikroba sebagai agen biokontrol banyak diteliti. Mikroba tersebut dapat menghasilkan berbagai senyawa anti mikroba yang dapat dikembangkan untuk subtitusi senyawa kimia sintetik (Sylvia et al. 2005).
Mekanisme agen biokontrol dalam menghambat penyakit dapat dengan cara: (1) antibiosis senyawa yang mampu menghambat atau mematikan patogen. Senyawa tersebut merupakan hasil metabolisme seperti antibiotik, enzim, senyawa gas, maupun subtansi lain yang beracun; (2) mampu berkompetisi dengan patogen dalam memanfaatkan sumber bahan organik, non organik, faktor pertumbuhan, oksigen dan tempat hidup yang terbatas; dan (3) bersifat hiperparasit, menyerang patogen dengan menghasilkan enzim-enzim seperti kitinase, selulase, glukanase, dan senyawa yang menyebabkan lisis (Sylvia et al. 2005). Selain itu penggunaan senyawa anti mikroba yang dihasilkan oleh mikroba untuk mengontrol penyakit tanaman, dapat diaplikasikan dalam konsentrasi yang
rendah, mudah diuraikan oleh mikroba tanah, sehingga tidak terjadi akumulasi residu, serta tidak mengganggu keseimbangan lingkungan (Yusnizar 2001).
Salah satu bakteri yang memiliki potensi untuk dikembangkan adalah
Streptomyces spp. Streptomyces spp. merupakan genus bakteri terbesar dari
anggota Aktinomiset yang termasuk bakteri Gram positif, dengan kandungan G+C tinggi (69 dan 78% mol) (Madigan & Martinko 2006). Streptomyces spp. banyak terdapat di tanah dan menghasilkan metabolik sekunder yang beragam seperti antibiotik: neomisin, kloramfenikol, streptomisin, nistatin, amfoterisin, dan natamisin yang secara klinik dapat menghambat pertumbuhan bakteri maupun fungi (Paul & Clark 1996).
Streptomyces spp. telah dikembangkan sebagai agen biokontrol penyakit
akar yang disebabkan oleh mikroba tular tanah (soil borne microbial pathogen) karena kemampuannya menghasilkan antibiotik berspektrum luas (Crawford et al. 1993). Keberadaan Streptomyces spp. yang banyak ditemukan dalam tanah, membuatnya sangat efektif jika dimanfaatkan sebagai anti fungi maupun anti bakteri patogen tular tanah (Yusnizar 2001).
Beberapa patogen penting yang menyerang tanaman pangan seperti
Ralstonia solanacearum yang dapat menyerang 200 jenis lebih tanaman, Xanthomonas sp. yang menyerang kubis, dan beberapa patogen tanah yang
merugikan lainnya seperti Bacillus subtilis, B. cereus, Fusarium sp. dan
Rhizoctonia sp. dapat dikendalikan dengan antibiotik yang di hasilkan oleh Streptomyces sp. (Strange 2003). Bordoloi et al. (2002) menerangkan bahwa Streptomyces spp. dapat menghasilkan senyawa-senyawa asam nikotianat yang
dapat menghambat Rhizoctonia solani dan Fusarium sp. Senyawa bioaktif
Streptomyces spp. diketahui dapat menghambat pertumbuhan Xanthomonas sp.
dan Bacillus sp. (Ifdal 2003; Andri 2004). Streptomyces berinteraksi secara sinergis dalam meningkatkan pertumbuhan bintil akar pada Pisum sativum (Ranjeet et al. 2002) dan kedelai (Ifdal 2003). Hwang et al. (2001) menyatakan bahwa Steptomyces humidus mampu menghambat patogen Phytopthora capsici dan Pseudomonas sp. dengan menghasilkan senyawa asam fenil asetat dan sodium fenil asetat.
Beberapa penelitian dengan menggunakan Streptomyces spp. lokal sebagai biokontrol mikroba patogen tular tanah telah dilakukan. Andri (2004) memanfaatkan Streptomyces sp. PS1-4 dalam mengontrol Xanthomonas axonopodis pv. glycines YR32 yang merupakan penyebab penyakit pustul bakteri
pada kedelai dan Bacillus subtilis yang menyebabkan penyakit busuk benih. Hasil penelitian tersebut menunjukkan bahwa isolat yang digunakan mampu menghambat kedua bakteri dan dapat meningkatkan pertumbuhan kedelai. Ifdal (2003) menyatakan bahwa tujuh isolat Streptomyces sp. (PS1-4, LC2-1, IVF1-2, PS4-12, U22-2, SB8-12 dan SB8-18) mampu menghambat pertumbuhan Bacillus sp. dan Xanthomonas sp. serta tidak menghambat pertumbuhan bakteri bintil akar dan pelarut fosfat. Munthahanas (2004) menyatakan bahwa Streptomyces sp. PD14-19 mampu menghambat perkembangan Ralstonia solanacearum penyebab penyakit layu pada tanaman cabe.
Papuangan (2009) melakukan uji in vitro yang menunjukkan bahwa enam isolat Streptomyces spp. lokal (SSW02, LBR02, LSW1, LSW05, PD2-9, dan PS4-16) mampu menghambat mikroba patogen tular tanah dengan baik. Lima isolat diantaranya (SSW02, LBR02, LSW1, LSW05, dan PS4-16) mampu menghambat kuat terhadap B. subtilis, B. cereus, dan X. axonopodis. Sedangkan
R. solanacearum hanya mampu dihambat oleh dua isolat (PD2-9 dan PS4-16).
Penghambatan yang dilakukan Streptomyces spp. berasal dari kemampuan menghasilkan senyawa anti mikroba, dan produksi anti mikroba dipengaruhi oleh faktor internal seperti fisiologi dan genetika mikroba itu sendiri, tetapi dapat juga dipengaruhi faktor ekternal. Faktor-faktor eksternal yang penting dalam mengontrol pertumbuhan dan aktivitas Streptomyces spp. adalah ketersediaan nutrisi dan bahan organik, serta kondisi fisik dan lingkungan seperti: kadar oksigen, salinitas, kelembaban, temperatur, dan pH (Goodfellow & Williams 1983; Mc Carthy & Williams 1990). Faktor-faktor tersebut dapat mempengaruhi kondisi optimum pertumbuhan Streptomyces spp. dan produksi senyawa anti mikroba. Streptomyces sp. IVNF1-1 yang dioptimasi pada media ISP4, dan pH 7 dapat menghambat E. coli penyebab diare EPEk tiga kali lipat pada hari ke-5 pertumbuhannya (Fadhilah 2007).
Berdasarkan hasil penelitian diatas diketahui bahwa Streptomyces spp. merupakan bakteri yang potensial menghasilkan berbagai senyawa anti mikroba dalam metabolit sekundernya. Optimasi kondisi pertumbuhan untuk meningkatkan produksi metabolit sekunder perlu dilakukan untuk dapat menghasilkan senyawa anti mikroba lebih optimal.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengkaji daya hambat senyawa anti mikroba
Streptomyces spp. terhadap mikroba patogen tular tanah pada beberapa kondisi
media, waktu produksi, pH, dan suhu.
Manfaat Penelitian
Penelitian ini diharapkan dapat menghasilkan kondisi pertumbuhan
Streptomyces spp. yang tepat dalam menghasilkan senyawa anti mikroba
penghambat pertumbuhan mikroba patogen tular tanah, sebagai dasar pengembangan produk biokontrol selanjutnya.
TINJAUAN PUSTAKA
Karakterisasi dan Ekologi Streptomyces spp.
Streptomyces spp. adalah anggota aktinomiset yang merupakan organisme
berfilamen, termasuk bakteri Gram positif, dengan kandungan G+C tinggi sekitar 69 dan 78 mol%. Organisme ini mempunyai filamen yang panjang dan bercabang serta membentuk rantai panjang spora udara yang disebut konidia. Pada media agar berwarna buram atau opak, tidak mengkilat, dan melekat kuat pada medianya. Streptomyces spp. secara umum menyerupai fungi dengan ciri-ciri: membentuk miselium dengan karakter percabangan yang luas (Madigan & Martinko 2006 ).
Gambar 1 Siklus hidup Streptomyces spp. (http://home.hiroshima-u.ac.jp/mbiotech/hosenkin_lab/PDF)
Struktur seluler fungi yang dimiliki Streptomyces sp. menyebabkan
Streptomyces juga mempunyai kemiripan dalam siklus hidupnya. Daur hidup pada
medium padat dimulai dari germinasi spora, ditandai dengan banyak miselium multiseluler, kemudian di atas miselia tumbuh miselia udara yang diikuti fragmentasi hifa yang membentuk cabang-cabang spora (Kluepfel et al. 1993).
Perbedaan dalam bentuk dan pembentukan filamen aerial serta munculnya struktur spora dari beberapa spesies merupakan bagian utama yang digunakan untuk mengklasifikasi spesies Streptomyces spp. Konidia dan spora yang sering berpigmen memberikan peran dalam mengkarakterisasi koloni yang matang (Madigan & Martinko 2006).
Perbedaan karakteristik tersebut menyebabkan genus Streptomyces spp. mempunyai berbagai macam spesies dan telah ditemukan lebih dari 500 spesies, umumnya merupakan organisme dalam tanah. Streptomyces spp. juga ditemukan dalam air, akan tetapi dalam jumlah yang relatif sedikit dibanding dengan spesies yang terdapat dalam tanah. Karakteristik yang umum adalah dengan adanya aroma tanah yang dihasilkan oleh metabolit Streptomyces sp. yang disebut geosmin (Madigan & Martinko 2006).
Streptomyces spp. dapat ditemukan sekitar 70% - 90% dalam tanah di
daerah rizhosfer dibandingkan dengan jenis Aktinomiset yang lain. Hal itu berdasarkan dari sifatnya yang aerobik sehingga sporulasi terjadi hanya pada media agar atau media yang padat lainnya (El Tarabily et al. 2006; Madigan & Martinko 2006).
Umumnya Aktinomiset merupakan kemoorganotrof, aerobik, mesofilik dan tumbuh optimal pada pH netral. Pada pada dasarnya aktivitas dan keberadaanya sangat ditentukan oleh faktor pertumbuhan, ketersediaan makanan, bahan organik yang terkandung di dalam media, salinitas, pH, temperatur serta kelembaban relatif lingkungannya (Goodfellow & Williams 1983).
Streptomyces spp. dapat tumbuh pada beragam sumber karbon. Satu isolat
dapat mendegradasi lebih dari 50 macam sumber karbon yang berbeda. Beberapa
Streptomyces spp. mampu menghasilkan enzim hidrolitik ekstraseluler yang
mampu menggunakan polisakarida seperti pati, selulosa, dan hemiselulosa. Selain itu dapat pula menggunakan hidrokarbon, lignin, tanin dan bahkan senyawa yang mengandung karet (Madigan & Martinko 2006)
Trejo-Estrada et al. (1998) menyatakan bahwa komposisi media fermentasi yang tersedia mempunyai pengaruh terhadap produksi metabolit sekunder. Crowford et al. (1993) melaporkan bahwa media dengan nutrisi anorganik yang rendah sangat bagus untuk mengisolasi beberapa Aktinomiset dalam tanah yang sebagian besar merupakan genus Streptomyces. Crawford et al. (1993) menyatakan bahwa Streptomyces sp yang diamati dapat tumbuh baik pada kisaran pH 6.5–8. Demikian pula hasil penelitian Saosa et al. (2008) menunjukkan bahwa secara umum Streptomyces spp. yang diisolasi dari akar tanaman tomat dapat tumbuh cepat pada pH sekitar 6.5.
Potensi Streptomyces spp. dalam Memproduksi Senyawa Anti Mikroba
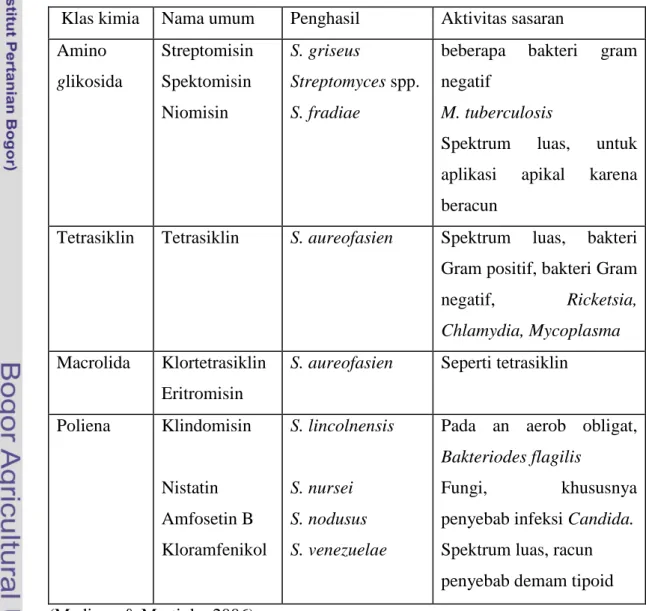
Beberapa mikroba baik bakteri Gram positif dan Gram negatif mampu menghasilkan senyawa anti mikroba hasil metabolit sekunder. Metabolit ini diproduksi dibawah kondisi fisik tertentu, dan tidak esensial dibutuhkan dalam pertumbuhannya (Zahn et al. 2001). Streptomyces spp. diketahui telah menghasilkan lebih dari 500 senyawa anti mikroba yang telah diketahui senyawa penyusunnya. Senyawa anti mikroba ini banyak diaplikasikan untuk kesehatan manusia, kesehatan hewan, di bidang pertanian dimanfaatkan sebagai pestisida hayati, dan beberapa isolat dapat menghasilkan enzim penting untuk pengolahan makanan dan industri lainnya (Madigan & Martinko 2006). Beberapa contoh antibiotik yang dihasilkan oleh Streptomyces spp. dapat dilihat pada Tabel 1.
Tabel 1 Beberapa antibiotik yang dihasilkan Streptomyces spp.
Klas kimia Nama umum Penghasil Aktivitas sasaran Amino glikosida Streptomisin Spektomisin Niomisin S. griseus Streptomyces spp. S. fradiae
beberapa bakteri gram negatif
M. tuberculosis
Spektrum luas, untuk aplikasi apikal karena beracun
Tetrasiklin Tetrasiklin S. aureofasien Spektrum luas, bakteri Gram positif, bakteri Gram negatif, Ricketsia, Chlamydia, Mycoplasma
Macrolida Klortetrasiklin Eritromisin
S. aureofasien Seperti tetrasiklin
Poliena Klindomisin Nistatin Amfosetin B Kloramfenikol S. lincolnensis S. nursei S. nodusus S. venezuelae
Pada an aerob obligat,
Bakteriodes flagilis
Fungi, khususnya penyebab infeksi Candida. Spektrum luas, racun penyebab demam tipoid (Madigan & Martinko 2006)
Menurut Minas et al. (2000), angka pertumbuhan maksimum dan produksi metabolit sekunder berbeda tergantung pada jenis bakterinya dan lingkungannya.
S. coelicolor dapat tumbuh baik pada media MG yang miskin nutrisi dibanding
dengan YEME media sedangkan S. arenae menghasilkan metabolit sekunder tertinggi pada medium TSB. Hwang et al. (2001) menyatakan bahwa secara in
vivo dan in vitro aktivitas anti fungi asam fenil asetat (SH1) dan sodium fenil
asetat (SH2) dari Streptomyces humiditis diketahui dapat melawan Phytophthora
capsici dan Meganoporthe grisea. Senyawa tersebut secara efektif sebagai
fungisida yang mampu menghambat perkecambahan spora dan pertumbuhan hifa dari P. capsici.
Bakteri dapat memproduksi berbagai senyawa anti mikroba seperti produksi ammoniak, butirolakton, 2,4-diasetilfloroglusinol (Ph1), HCN, kanosamin, oligomisin A, oomisin A, fenazin-1 asam karboksilat (PCA), pyoluterin (Plt), pirolnitrin (Pln), viskosinamid, xanthobaksin, dan zwittemisin, dan berbagai senyawa lain yang belum terkarakterisasi (Whipps 2001). Mekanisme penghambatan Streptomyces spp. terhadap fungi dapat terjadi karena kemampuannya dalam menghasilkan antibiotik dan senyawa hidrolitik seperti glukanase, kitinase yang mampu mendegradasi dinding sel fungi (Prapagdee et al. 2008).
Aktivitas penghambatan senyawa anti mikroba secara umum dapat dilakukan dengan berbagai mekanisme, diantaranya adalah: (1) merusak dinding sel dengan cara menghambat pembentukan maupun merubah setelah terbentuk; (2) perubahan permeabilitas sel. Kerusakan pada membran ini berakibat terhambatnya pertumbuhan sel atau matinya sel, karena membran bertujuan memelihara integritas komponen-komponen seluler; (3) perubahan molekul protein dan asam nukleat; (4) penghambatan kerja enzim yang mengakibatkan terganggunya metabolisme sel atau matinya sel; (5) penghambatan sintesa asam nukleat dan protein yang berakibat terganggunya aktivitas metabolisme karena DNA, RNA, dan protein memegang peranan penting dalam mekanisme sel secara normal (Pelczar & Chan 2005).
Potensi Streptomyces spp. sebagai Agen Biokontrol Mikroba Patogen Tular Tanah
Pemanfaatan mikroorganisme tanah dalam mengendalikan mikroba patogen tular tanah merupakan salah satu alternatif pengendalian yang aman karena relatif tidak membahayakan organisme lainnya, serta mempunyai spektrum yang luas sebagai agen biokontrol (Crawford et al. 1993). Streptomyces spp. dapat bersifat saprofit, mampu mendekomposisi bahan organik seperti lignoselulosa, pati dan kitin.
Senyawa anti mikroba yang digunakan dalam biokontrol di bidang pertanian 60% berasal dari Streptomyces spp. (Hwang et al. 2001). Andri (2004) menggunakan Streptomyces sp. PS1-4 dalam mengendalikan Xanthomonas
axonopodis pv. glycines YR 32 penyebab penyakit pustul bakteri pada kedelai dan Bacillus subtilis penyebabkan penyakit busuk benih. Hasil dari penelitian tersebut
bahwa isolat yang digunakan mampu mengontrol kedua bakteri tersebut, serta dapat meningkatkan pertumbuhan kedelai. Ifdal (2003) menyatakan bahwa tujuh isolat Streptomyces spp. lokal yaitu PS1-4, LC2-1, IVF1-2, PS4-12, U22-2, SB8-12 dan SB8-18 mempunyai aktivitas yang baik dalam menghambat pertumbuhan
Bacillus sp. dan Xanthomonas sp. serta tidak menghambat pertumbuhan bakteri
bintil akar dan pelarut fosfat.
Streptomyces sp. Di-994 dapat mengendalikan Rhizoctonia solani yang
merupakan penyebab penyakit rebah kecambah pada tomat (Yusnizar 2001). Hwang et al. (2001) menyatakan bahwa senyawa bioaktif asam fenil asetat dan sodium fenil asetat yang dihasilkan Streptomyces humidus mampu melawan
P. capsici, M. grisea, R. solanacearum, F. oxysporum, F. moniliforme, B. subtilis, P. ultimum, R. solani, Alternaria mali, Colletotrichum orbiculare dan Candida albican. Streptomyces spp. dapat menghambat R. solanacearum penyebab
penyakit layu pada tanaman cabe ( Munthahanas 2004).
Faktor-Faktor yang Berpengaruh terhadap Produksi Senyawa Anti Mikroba
Optimasi senyawa anti mikroba yang dihasilkan Streptomyces spp. tidak terlepas dari faktor pertumbuhan. Faktor-faktor yang penting dalam mengontrol pertumbuhan dan aktivitas Streptomyces spp. adalah ketersediaan nutrisi, bahan organik, serta kondisi fisik dan lingkungan seperti: kadar oksigen, salinitas,
kelembaban, temperatur, dan pH (Goodfellow & Williams 1983; Mc Carthy & Williams 1990). Komposisi media pertumbuhan mempengaruhi hasil metabolisme mikroba, karena media merupakan sumber nutrisi untuk pertumbuhan, sumber energi, pembentukan zat tertentu, dan pembentukan sel. Media pertumbuhan yang baik merupakan media yang mampu menyediakan sumber karbon dan mineral-mineral lain yang dibutuhkan dalam pertumbuhan maupun aktivitasnya (Todar 2007).
Nutrisi yang diperlukan dalam pertumbuhan mikroba diklasifikasikan dalam dua katagori makro nutrien dan mikro nutrien. Makro nutrient terdiri dari elemen yang diperlukan dalam jumlah yang banyak dan penting dalam pertumbuhannya seperti karbon, nitrogen, oksigen, sulfur, pospat, Mg2+, K+, Ca. Mikro nutrient terdiri dari elemen yang diperlukan dalam jumlah sedikit akan tetapi diperlukan dalam proses metabolisme. Mikro nutrien tersebut adalah: Mo2+, Zn2+, Cu2+, Mn2+, Na+, vitamin, hormon pertumbuhan, dan prekusor metabolisme (Shuler & Kargi 2002) .
Selain media, pH dan suhu juga berpengaruh terhadap pertumbuhan mikroba. Streptomyces spp. secara alami dapat tumbuh baik pada kondisi pH tanah netral sampai alkali, dengan drainase yang baik. Streptomyces sp. dalam pertumbuhannya memerlukan potensial air yang rendah dibanding dengan bakteri yang lain (Madigan & Martinko 2006). Aktinomiset dapat hidup pada kisaran pH 5 sampai 9, dan banyak tumbuh pada media yang mengandung bahan organik, dan banyak mengandung sumber karbon seperti gula, alkohol, asam organik, asam amino, dan beberapa senyawa aromatik (Madigan & Martinko 2006).
Menurut Fahrurrozi (2007), reaksi enzimatis sangat dipengaruhi oleh pH sehingga memerlukan buffer dengan pH yang tepat supaya reaksi berjalan optimal. Schopes (1987) menyatakan bahwa protein dalam kondisi terlarut cenderung mudah berinteraksi dengan pelarutnya, sehingga bila terjadi perubahan pH larutan diatas atau dibawah pH optimum akan langsung bersentuhan dengan sisi aktif sehingga akan terjadi penurunan aktivitas enzim dengan cepat. pH mempunyai peran penting terhadap perubahan potensial membran. Perubahan pH berpengaruh terhadap perpindahan proton dalam membran sel. Pada mikroba yang neutrofil mempunyai kontribusi sebesar 20 – 30% terhadap gaya pergerakan
proton. Sedangkan pada mikroba yang asidofil mempunyai peran 80 – 90% dalam proses pergerakan proton. Untuk itu usaha penelitian tentang optimasi produksi senyawa sekunder terhadap berbagai faktor-faktor pertumbuhan penting dilakukan.
Fadhilah (2007), melakukan optimasi Streptomyces sp. IVNF-1 yang menghasilkan senyawa anti β-laktamase pada kondisi media, aerasi, suhu dan pH terbaik dalam menghambat E. coli dan memperoleh hasil bahwa Streptomyces sp. IVNF-1 dapat tumbuh optimal pada medai ISP4, pH 7, aerasi 100 rpm, dan pada suhu ruang (24 – 260C). Hendarwin (2005) melakukan uji terhadap Streptomyces sp. 234p-16 dalam menghasilkan xilanase terhadap suhu dan pH, dan hasil yang diperoleh menunjukkan bahwa Streptomyces sp. 234p-16 dapat menghasilkan xilanase ekstraseluler dengan sifat unik dengan kisaran temperatur yang luas antara 30 0C sampai 90 0C dengan temperatur optimum pada suhu 90 0C dan pH optimum 5. Streptomyces diastaticus dan S. galbus NR menghasilkan α-L arabinfuradanosidase dan β-xilosidase secara optimal pada suhu 50 0C. Sedang pada Streptomyces sp. K-37, Streptomyces no 3137, Streptomyces T-17 dapat menghasilkan β-xilosidase pada suhu optimal 650C, 600C, 650C (Belfaquih et al. 2002).
Suhu mempunyai peran penting dalam proses pertumbuhan maupun pembentukan produksi metabolit. Peningkatan 10 0C pada suhu optimum pertumbuhan dapat meningkatkan kecepatan tumbuh dua kali lipat. Peningkatan suhu tinggi diatas optimum dapat berakibat penurunan dan kemungkinan kematian sel. Suhu juga berpengaruh terhadap proses produksi. Suhu yang tinggi akan mempercepat laju reaksi suatu proses produksi. Suhu yang tinggi juga dapat membatasi suatu produksi karena dapat mengakibatkan pemutusan ikatan ion dan hidrogen pada struktur stabil enzim yang berakibat terjadinya denaturasi (Shuler & Kargi 2002).
Mikroba Patogen Tular Tanah
Target penelitian adalah penyakit yang disebabkan mikroba patogen tular tanah yang seperti bakteri dan cendawan. Beberapa bakteri yang termasuk patogen tular tanah adalah Bacillus subtilis, B. cereus, Xanthomonas axonopodis,
X. oryzae, dan Ralstonia solanacearum. Cendawan yang termasuk patogen tular tanah diantaranya adalah: Fusariun oxysporum, Sclerotium rofsii, dan
Rhizoctonia solani.
Mikroba patogen tular tanah tersebut dapat bertahan lama pada tanah, dapat menyebabkan akumulasi patogen dalam tanah sehingga perlu penangan lebih lanjut. Patogen tular tanah sukar untuk dikontrol dengan berbagai upaya penanganan seperti rotasi tanaman, pemberian pestisida, bibit tahan penyakit karena aktivitas penyerangan dipengaruhi oleh lingkungan. Sejak penggunaan biokontrol 70 tahun lalu, penanganan dititik beratkan pada pemanfaatan mikroba agen biokontrol yang sesuai dengan lingkungan tanah (Haas & Defago 2005).
Bakteri patogen seperti B. subtilis dan B. cereus merupakan bakteri Gram positif, berbentuk batang dan dapat menghasilkan endospora pada kondisi yang tidak menguntungkan. B. subtilis dan B. cereus banyak dikenal sebagai patogen pada makanan akan tetapi sebagian spesiesnya dapat menyebabkan penyakit busuk benih pada tanaman (Ifdal 2003). Bacillus sp. banyak terdapat di tanah, dan penyebaran melalui tanah maka sehingga Bacillus sp. merupakan mikroba patogen tular tanah yang penting.
Xanthomonas sp. merupakan bakteri Gram negatif yang dapat menyebabkan
hawar daun pada tanaman. X. oryzae penyebab penyakit pada padi sedangkan
X. axonopodis yang menyebabkan pustul bakteri pada tanaman jeruk.
X. axonopodis pv. glycines YR32 dapat menyebabkan pustul bakteri pada
tanaman kedelai (Andri 2004). Tanaman yang terserang Xanthomonas sp. mempunyai ciri daun muda berwarna hijau keabu-abuan, menggulung dan jika mengalami infeksi lanjut berubah menjadi kuning dan mati (Suparyono 2007).
Ralstonia solanacearum merupakan mikroba patogen yang penting karena
kemampuannya dalam menyerang berbagai tanaman pertanian. Patogen ini memiliki lebih dari 200 spesies tanaman inang (Munthahanas 2004).
R. solanacearum dapat menyerang tanaman solanceae diantaranya pada tomat,
kentang, tembakau, terung dan cabe. Bakteri R. solanacearum dapat menyebar sangat luas pada daerah yang beriklim tropik dan sub tropik. Penyebarannya dapat dilakukan melalui tanah atau menyebar langsung dari tanaman ke tanaman
melalui udara. Selain itu dapat bertahan pada gulma yang menjadi inang alternatifnya.
Fusarium oxysporum banyak terdapat dalam tanah, saprofit pada bahan
organik, menyebar luas sebagai patogen tanaman dan non patogen tanaman. Patogen tanaman menyebabkan busuk akar, tetapi umumnya merusak pembuluh jaringan yang menyebabkan layu pada berbagai tanaman ekonomi penting. Layu yang disebabkan oleh F. oxysporum dicirikan dengan kemampuannya dalam memasuki tanaman melalui akar dan menyebar menuju sistem pembuluh jaringan, tanaman mengalami nekrosis, layu kemudian mati. F. oxysporum dapat bertahan di tanah sebagai propagul dorman dengan membentuk klamidospora (Olivain et
al. 2005). F. oxysporum dapat menghasilkan mikotoksin fumonisin dan
trikotekanes (Strange 2003).
Rhizoctonia solani merupakan cendawan patogen yang dapat menyebabkan busuk benih, dan busuk bibit pada tanaman jagung. Selain itu dikenal sebagai penyebab penyakit hawar daun pada padi. Cendawan ini penting karena kemampuannya bertahan dalam jangka waktu yang lama pada tanah dan jaringan tanaman dengan menghasilkan sklerotium. R. solani juga bertahan hidup sebagai miselium dengan cara saprofit, yakni mengkolonisasi bahan-bahan organik tanah khususnya hasil aktivitas patogen tanaman (Muis 2007). R. solani merupakan mikroba patogen penyebab damping - off (rebah kecambah) pada beberapa tanaman. Sadeghi et al. (2006) menyatakan bahwa R. solani dapat menyerang tanaman bit gula.
Sclerotium rolfsii dan Rhizoctonia solani merupakan patogen penyebab
rebah kecambah pada tanaman wijen (Yulianti dan Suhara 2006). Gejala yang ditimbulkan adalah benih mati sebelum berkecambah atau muncul ke permukaan tanah atau kecambah rebah/layu. Pada tanaman dewasa, gejala penyakit dimulai dengan munculnya bercak kuning pada pangkal batang dan terus berkembang menjadi coklat kemerahan dan bahkan akan membentuk sklerotium yang mampu bertahan lama di tanah dan sukar dikendalikan secara kimiawi maupun rotasi tanaman (Agrios 1997). Sclerotium rolfsii juga dapat menyebabkan penyakit pada tanaman tomat bahkan dapat menyerang berbagai spesies tanaman pada berbagai tingkat pertumbuhan (Yusniawati 2009).
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilakukan di laboratorium Mikrobiologi Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA), Institut Pertanian Bogor (IPB) mulai bulan Juni 2008 sampai Mei 2009.
Bahan dan Alat :
Bahan yang digunakan ialah isolat Streptomyces LSW05, LBR02, SSW02, dan PS4-16 koleksi Dr. Ir. Yulin lestari dengan bakteri target: Ralstonia
solanacearum, Xanthomonas axonopodis, X. oryzae, Bacillus subtilis dan B. cereus, sedangkan cendawan target: Fusarium oxysporum, Rhizoctonia solani,
dan Sclerotium rolfsii, koleksi Laboratorium Mikrobiologi Departemen Biologi FMIPA IPB. Alat yang digunakan antara lain spektrofotometer, kertas cakram (Φ: 8 mm), sentrifuge, water bath, penggoyang, sedotan plastik (Φ: 8 mm).
Metode Penelitian :
Peremajaan Isolat Streptomyces spp. dan Mikroba Patogen Tular Tanah
Streptomyces LBR02, SSW02, dan LSW05 diremajakan ke dalam media
YMA (Yeast Malt Agar) sedangkan PS4-16 diremajakan pada media OA (Oatmeal Agar) dan diinkubasi selama 10 hari pada suhu ruang (24 – 26 0C)..
Bakteri target diremajakan pada media NA (Nutrient Agar) (Lampiran 1), diinkubasi selama 24 jam. Cendawan target diremajakan pada media PDA (Potato
Dextrosa Agar) (Lampiran 1), diinkubasi selama 2 – 3 hari untuk Rhizoctonia solani dan S. rolfsi dan 5 – 7 hari untuk Fusarium sp. dan semua bakteri maupun
cendawan target diinkubasi dalam suhu ruang (24 – 260C).
Pembuatan Inokulum Mikroba Patogen Tular Tanah
Bakteri patogen tular tanah yang telah diremajakan pada media NA di tumbuhkan pada media NB (Nutrient Broth) (Lampiran 1) selama 14 sampai 18 jam. Absorbansi dukur pada panjang gelombang 620 nm, sampai diperkirakan jumlah sel 106 Cfu/ml (OD Bacillus sp.: 0.223, Xanthomonas sp.: 0.102,
R. solanacearum: 0.352). Inokulum cendawan patogen tular yang telah
diremajakan pada media PDA kemudian diambil dengan menggunakan sedotan plastik steril yang berdiameter 8 mm, dan ditumbuhkan pada media PDA lkemudian digunakan dalam uji lanjut.
Uji Antagonis Langsung Kemampuan Penghambatan Streptomyces spp. terhadap Mikroba Patogen Tular Tanah
Uji antagonis langsung terhadap bakteri target dilakukan dengan metode difusi agar (Madigan & Martinko 2006), dengan mengambil sebanyak masing-masing 100 μl (106 cfu/ml) bakteri patogen yang telah ditumbuhkan pada media NA semi padat (0,85%), disebar merata pada seluruh permukaan media NA padat, dibiarkan mengering 5 – 10 menit. Isolat Streptomyces spp. berumur 10 hari diambil dengan sedotan plastik steril berdiamater 8 mm, diinokulasikan di atas permukaan media NA yang telah di tumbuhi bakteri patogen tersebut. Inkubasi dilakukan selama 24 jam pada suhu ruangan dan pengamatan dilakukan dengan melihat zona yang terbentuk dikurangi dengan diameter pertumbuhan isolat
Streptomyces spp.
Uji antagonis langsung terhadap cendawan patogen target dilakukan dengan menggoreskan Streptomyces spp. pada satu sisi media PDA dalam cawan petri berdiameter 9 cm dan diinkubasi selama 3 – 5 hari (sporanya terlihat), selajutnya dengan sedotan plastik steril cendawan diinokulasikan pada tengah cawan dalam media tersebut, dengan jarak 3 cm dari cendawan. Hambatan pertumbuhan terlihat dengan membandingkan pertumbuhan cendawan yang ditotolkan bersamaan dengan isolat uji dengan cendawan kontrol. Penghambatan terlihat dengan adanya zona bening yang nampak pada sekitar daerah kontak antara Streptomyces spp. dengan cendawan target. Zona bening diukur dengan mengurangkan diameter koloni cendawan yang dihambat dengan diameter koloni cendawan kontrol.
Optimasi Produksi Senyawa Anti mikroba
Optimasi produksi senyawa anti mikroba dari isolat Streptomyces spp. dilakukan terhadap dua macam media tumbuh: media ISP4 (Lampiran 2) dan media modifikasi molase-kedelai (Lampiran 2), pada 3 kondisi pH yaitu: pH 5, pH7, dan pH 9. Kondisi 4 suhu berbeda yaitu: (suhu ruang: 24 – 26 0C), 30 0C,
400C, dan 500C. Optimasi waktu produksi yang digunakan adalah 5 hari, 10 hari, dan 15 hari pertumbuhan.
Isolat diinokulasikan dalam media produksi uji, kemudian ditempatkan pada
rotari shaker selama 5 – 15 hari pada suhu ruang. Selanjutnya biakan
disentrifugasi selama 15 menit dengan kecepatan 10000 rpm pada suhu 40C untuk memisahkan antara pelet dan filtrat kultur. Filtrat kultur yang digunakan untuk uji lanjut.
Optimasi tahap pertama dilakukan terhadap media, dan waktu produksi.
Streptomyces spp. yang ditumbuhkan pada media peremajaan diambil dengan
menggunakan sedotan plastik steril berdiameter 8 mm dan diinokulasikan ke dalam media tumbuh ISP4 dan modifikasi molase dan kedelai. Pada hari ke 5, 10, dan 15 dilakukan panen filtrat yang digunakan dalam uji antagonis terhadap mikroba patogen tular tanah.
Optimasi tahap ke dua yaitu optimasi terhadap pH 5, pH 7, dan pH 9. Hasil dari optimasi media dan waktu poduksi pada tahap pertama digunakan sebagai dasar untuk optimasi selanjutnya. Isolat yang menghasilkan anti mikroba yang optimum pada media terpilih, waktu produksi dan pH optimum hasil dari tahap pertama selanjutnya diinkubasi pada suhu ruang, suhu 30 0C, suhu 40 0C, dan suhu 50 0C. Hasil panen filtrat dari optimasi ini, kemudian di uji antagonis terhadap bakteri dan cendawan patogen target.
Bioesei Filtrat Kultur Streptomyces spp. terhadap Pertumbuhan Bakteri Patogen Tular Tanah
Filtrat kultur isolat Streptomyces spp. terpilih digunakan untuk pengujian daya hambat terhadap bakteri patogen dengan metode difusi agar (Madigan & Martinko 2006). Cara pengujian dilakukan dengan mengambil 100 μl (106cfu/ml) masing-masing biakan bakteri patogen dimasukkan dalam NA semi padat (0.85%), kemudian disebar pada cawan petri yang telah berisi NA padat (1.5%), kemudian media berisi bakteri patogen target tersebut dicampur sampai rata, dan didiamkan 5-10 menit agar mengering. Selanjutnya cakram kertas berdiameter 8 mm diletakkan dengan sedikit ditekan, kemudian pada masing-masing cakram di tetesi 15 μl filtrat kultur Streptomyces spp. yang diujikan. Pengamatan dilakukan
setelah inkubasi 24 jam pada suhu ruang. Besarnya diameter zona bening yang terbentuk diamati berdasarkan diameter seluruh zona hambat dikurangi diameter cakram kertas.
Bioesei Filtrat Kultur Isolat Streptomyces spp. terhadap Pertumbuhan Cendawan Patogen Tular Tanah
Cendawan hasil peremajaan diambil dengan menggunakan sedotan plastik steril dan ditumbuhkan pada media PDA. Kertas cakram diletakkan pada jarak 3 cm dari cendawan tersebut, kemudian pada kertas cakram tersebut ditetesikan 15 μl filtrat kultur Streptomyces spp.Inkubasi dilakukan pada suhu ruang selama 3 – 5 hari. Hambatan pertumbuhan diukur dengan mengurangkan diameter pertumbuhan koloni cendawan yang dihambat filtrat Streptomyces spp. uji dengan pertumbuhan koloni cendawan kontrol.
Pengukuran Berat Kering Sel dan Kadar Gula dalam Media
Berat kering sel diukur berdasarkan berat pelet hasil panen. Pemanenan dilakukan pada hari ke-5, ke-10, dan ke-15 hari pertumbuhan. Pelet hasil panen disentrifugasi 10000 rpm selama 15 menit dengan suhu 4 0C, kemudian disaring dengan kertas saring Whatman dan dikeringkan pada suhu 70 0C selama 24 jam, kemudian ditimbang. Berat kering sel diukur setelah dikurangi dengan berat kertas. Pengukuran dilakukan dengan dua kali ulangan.
Pengukuran kadar gula dalam media produksi terpilih diukur berdasarkan metode DNS (Dinitrosalisilat-Miller 1959) (Lampiran 3). Pengukuran dilakukan dengan spektrofotometer pada panjang gelombang 550 nm. Larutan glukosa digunakan sebagai standar, dan pengukuran dilakukan dengan dua kali ulangan. Kadar gula yang terpakai dihitung dengan menghitung kadar gula dalam media awal dikurangi dengan kadar gula terukur pada waktu pengamatan.
HASIL DAN PEMBAHASAN
Pertumbuhan Streptomyces spp.
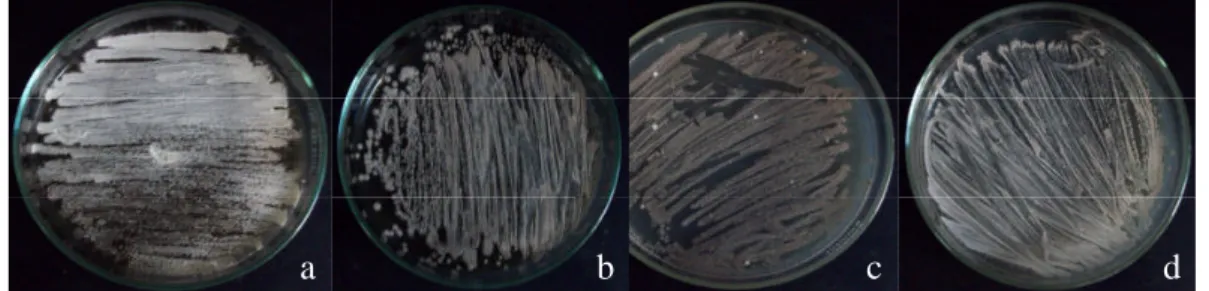
Hasil peremajan empat isolat lokal Streptomyces spp. menunjukkan bahwa LSW05, LBR02, dan SSW02 dapat tumbuh dan bersporulasi pada media YMA, sedangkan PS4-16 pada media OA. Perbedaan karakter pertumbuhan dapat dilihat pada gambar 2 dibawah ini .
a aa
Gambar 2 Streptomyces spp. hasil peremajaan pada media YMA (LSW 05) (a), LBR02 (b), SSW02 (c), dan media OA PS4-16 (d).
Isolat LSW05 merupakan isolat yang paling mudah tumbuh pada media YMA dengan permukaan koloni yang lebih kasar, tebal dan berwarna putih. Isolat LBR02 mempunyai pertumbuhan koloni yang tidak jauh berbeda dengan isolat LSW05, akan tetapi memiliki warna koloni yang lebih tua kecoklatan dan berdebu. Isolat SSW02 mempunyai bentuk permukaan yang lebih tipis dan berdebu dengan warna coklat keabu-abuan. Isolat PS4-16 pertumbuhannya ditandai dengan adanya miselia berwarna putih, kasar dan agak tipis. Koloni dewasa Streptomyces spp. ditandainya dengan adanya spora yang berwarna, dan sporulasi memerlukan waktu 7 – 10 hari.
Media YMA merupakan media yang mengandung ekstrak malt, ragi, dan glukosa, merupakan media yang kaya sumber karbon yang diperlukan dalam pertumbuhan Streptomyces spp. Media OA merupakan media untuk menstimulir sporulasi Streptomyces spp., media ini mengandung sumber karbon dari gandum. Perbedaan kemampuan tumbuh Streptomyces spp isolat uji pada media YMA dan OA menunjukkan bahwa kemampuan isolat-isolat tersebut dalam memanfaatkan sumber nutrisi juga berbeda.
Perbedaan warna koloni ini dapat membedakan streptomyces satu dengan lainnya. Perbedaan dalam bentuk dan pembentukan filamen aerial serta
munculnya struktur spora dari beberapa spesies merupakan bagian utama yang digunakan dalam mengklasifikasi spesies Streptomyces spp. Konidia dan spora yang sering berpigmen memberikan peran dalam mengkarakterisasi koloni yang matang (Madigan & Martinko 2006).
Kemampuan Penghambatan Streptomyces spp. terhadap Mikroba Patogen Tular Tanah
Hasil uji antagonis langsun sel Streptomyces spp. terhadap mikroba patogen tular tanah menunjukkan bahwa isolat LSW05, LBR02, SSW02, dan PS4-16 mampu menghambat bakteri patogen tanah seperti B. subtilis, B. cereus, X. axonopodis, X. oryzae dan R. solanacearum (Gambar 3). Kemampuan
penghambatan Streptomyces terhadap bakteri menunjukkan bahwa isolat LSW05, LBR02, dan SSW02 mempunyai penghambatan yang kuat dan beragam terhadap
B. subtilis berturut-turut masing-masing menghasilkan diameter penghambatan
10.7 mm, 12.7 mm, dan 9.5 mm, sedangkan PS4-16 menunjukkan penghambatan yang kuat terhadap B. cereus (11 mm).
Gambar 3 Aktivitas penghambatan sel Streptomyces spp. terhadap bakteri patogen tular tanah.
Hasil uji antagonis langsung dengan menggunakan sel ini mendukung hasil penelitian sebelumnya yang dilakukan Papuangan (2009) yang menunjukkan bahwa enam isolat Streptomyces spp. lokal (SSW02, LBR02, LSW01, LSW05, PD2-9, dan PS4-16) mempunyai penghambatan yang baik terhadap patogen tular tanah (B. subtilis, B. cereus, X. axonopodis, R. solanacearum), dan cendawan
0 2 4 6 8 10 12 14 16 LSW LBR SSW PS Z o n a h a m b a t (m m ) B. subtilis B. cereus R. solanacearum B. subtilis X. oryzae X. axonopodis B. cereus
patogen (F. oxysporum, S. rolfsii, dan R. solani). Lima diantaranya (SSW02, LBR02, LSW1, LSW05, dan PS4-16) mampu menghambat kuat terhadap
B. subtilis, B. cereus, dan X. axonopodis, enam isolat mampu menghambat X. oryzae, sedang R. solanacearum hanya mampu dihambat oleh dua isolat
(PD2-9 dan PS4-16). Kemampuan Streptomyces dalam menghambat patogen tanah berasal dari kemampuannya menghasilkan senyawa anti mikroba.
Lestari (2006) menyatakan bahwa isolat PS4-16 menghasilkan senyawa anti bakteri yang dapat menghambat bakteri patogen seperti B. subtilis dan X. oryzae. Menurut Sultan et al. (2002) menyatakan bahwa Streptomyces sp. menghasilkan senyawa aktif 2 N-butanamida 3-metil 4-metoksi 5-β-L-arabinosil propanofenon yang dapat menghambat bakteri Gram negatif dan Gram positif. Hasil penelitian yang dilakukan Kavitha dan Vijayalakshmi (2007) menunjukkan bahwa S. rochei mempunyai penghambatan yang kuat terhadap beberapa bakteri Gram positif dan Gram negatif serta dapat menghambat F. oxysporum, Aspergillus niger, dan
Candida albican.
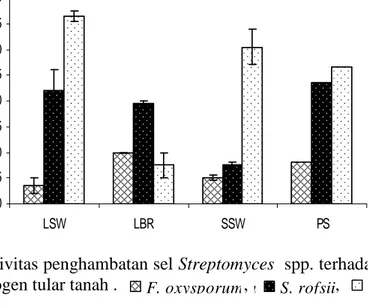
Penghambatan juga nampak dari hasil uji antagonis langsung sel isolat lokal
Streptomyces spp. terhadap cendawan patogen target. Semua isolat uji mampu
menghambat cendawan patogen tular tanah dengan penghambatan yang beragam (Gambar 4). Isolat LSW05 mempunyai kemampuan tinggi dalam menghambat
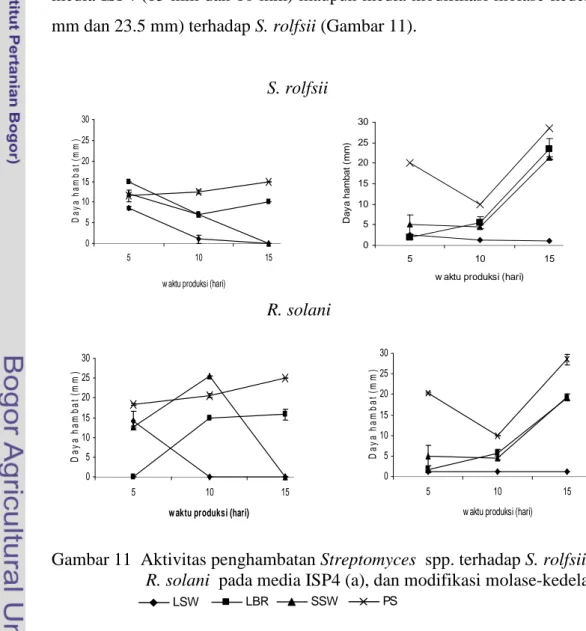
R. solani (36.5 mm). S. rolfsii dapat dihambat kuat oleh isolat PS4-16 (23.5 mm),
dan isolat LBR02 memiliki kemampuan menghambat F. oxysporum lebih tinggi dibandingkan Streptomyces lainnya (10 mm).
Isolat
Gambar 4 Aktivitas penghambatan sel Streptomyces spp. terhadap cendawan
patogen tular tanah . , , ,
0 5 10 15 20 25 30 35 40 LSW LBR SSW PS Isolat Z o n a h a m b a t (m m )
Hasil uji sel terhadap cendawan patogen tanah tersebut terlihat bahwa
R. solani dapat mudah dihambat oleh LSW05, SSW02, dan PS4-16. Kemampuan Streptomyces spp. dalam menghambat cendawan patogen tanah tersebut juga dinyatakan (Yusniawati 2009; Papuangan 2009) bahwa isolat LSW05, LBR02, SSW02 dan PS4-16 mampu menghambat F. oxysporum, S. rolfsii, dan R. solani.
Aktivitas penghambatan yang rendah terhadap F. oxysporum dapat disebabkan oleh perbedaan pertumbuhan dari masing-masing fungi target.
F. oxysporum mempunyai pertumbuhan yang lambat sehingga memerlukan waktu
yang lebih lama dalam inkubasi. S. rolfsii dan R. solani mempunyai penyebaran hifa yang cepat sehingga aktivitas penghambatannya juga lebih besar. Hal ini kemungkinan disebabkan karena mekanisme penyerangan dari masing-masing fungi target yang berbeda. S. rolfsii dan R. solani mempunyai hifa yang cepat tumbuh, sedangkan F. oxysporum mempunyai kemampuan dalam menghasilkan mikotoksin berupa fumonisin dan trikotekanes (Strange 2003).
Kemampuan Streptomyces spp. menghambat mikroba patogen tular tanah tersebut terlihat dengan adanya zona bening disekitar koloni Streptomyces spp. Zona hambat ini mengindikasikan bahwa isolat Streptomyces spp. dapat menghasilkan senyawa anti mikroba ekstraseluler yang mampu menghambat pertumbuhan mikroba lainnya. Senyawa anti mikroba yang dihasilkan
Streptomyces spp. dapat berupa antibiotik, dan enzim degradatif seperti kitinase,
glukanase (Kavitha & Vijayalakshmi 2007).
Trejo-Estrada et al. (1998) menyatakan bahwa mekanisme penghambatan mikroba dalam mengendalikan penyakit tanaman yang disebabkan oleh fungi patogen dilakukan secara antibiosis dan mikoparasitis. Antibiosis dengan menghasilkan metabolit sekunder seperti antibiotik, sedangkan mikoparasitis menghasilkan enzim ekstraseluler yang dapat menghidrolisis dinding sel. Senyawa anti mikroba yang dihasilkan tersebut menghambat pertumbuhan dan perkembangan fungi patogen. Streptomyces violacesniger diketahui menghasilkan tiga antibiotik anti fungi seperti: nigerisin, geldamisin, dan komplek poliena seperti guanidilfungin A.
Senyawa anti mikroba secara alamiah digunakan sebagai salah satu mekanisme Streptomyces spp. untuk bertahan hidup dan berkompetisi dengan
mikroba lain atau mengatasi kondisi lingkungan yang tidak menguntungkan (Madigan & Martinko 2006). Kompetisi terjadi dalam usaha untuk mendapatkan makanan atau tempat tinggal. Mekanisme inilah yang dijadikan dasar dalam merekayasa kondisi tertentu untuk menghasilkan senyawa ekstraseluler yang diinginkan. Upaya optimasi produksi senyawa anti mikroba dengan menggunakan kondisi beragam kondisis pertumbuhan (jenis media, waktu produksi, pH, dan suhu) yang berpengaruh dalam produksitivitas senyawa metabolit
Streptomyces spp.
Kemampuan Isolat Streptomyces spp. Terpilih dalam Menghasilkan Senyawa Anti Mikroba pada Media ISP4 dan Media Modifikasi Molase-Kedelai Selama 15 Hari Waktu Produksi
Optimasi produksi senyawa anti mikroba pada beberapa media dan waktu produksi bertujuan untuk mengetahui pengaruh media sebagai sumber nutrisi dan waktu produksi selama pertumbuhan isolat-isolat tersebut dalam menghasilkan senyawa anti mikroba penghambat mikroba patogen tular tanah. Papuangan (2009) menyatakan bahwa filtrat kasar dari 6 isolat lokal Streptomyces spp. dapat menghambat mikroba patogen tular tanah, akan tetapi hasil penghambatan filtrat kasar masih belum optimal dibandingkan dengan penghambatan yang dilakukan secara langsung. Hal ini mendorong upaya optimasi produksi anti mikroba dengan memodifikasi kondisis pertumbuhan berdasarkan faktor-faktor eksternal yang mempengaruhi produksi senyawa anti mikroba Streptomyces sp.
Pertumbuhan mikroba berbeda satu dengan lain, begitu juga aktivitas senyawa anti mikroba yang dihasilkan. Aktivitas senyawa anti mikroba tersebut dipengaruhi banyak hal, salah satunya adalah media dan waktu produksi. Media pertumbuhan yang baik merupakan media yang mampu menyediakan sumber karbon dan mineral-mineral lain yang dibutuhkan dalam pertumbuhan maupun aktivitasnya (Todar 2007).
Sanchez dan Demain (2002) menyatakan bahwa sumber nutrisi seperti karbon, nitrogen, dan mineral, serta faktor lingkungan seperti waktu produksi, temperatur dan pH sangat besar pengaruhnya terhadap produksi anti mikroba oleh Aktinomiset. Iwai et al. (1982) menyatakan bahwa produksi senyawa anti fungi dipengaruhi oleh kandungan media dan kondisi pertumbuhan seperti aerasi,
agitasi, temperatur, dan konsentrasi gliserol, yang kesemuanya itu berbeda responnya antara mikroba satu dengan lainnya.
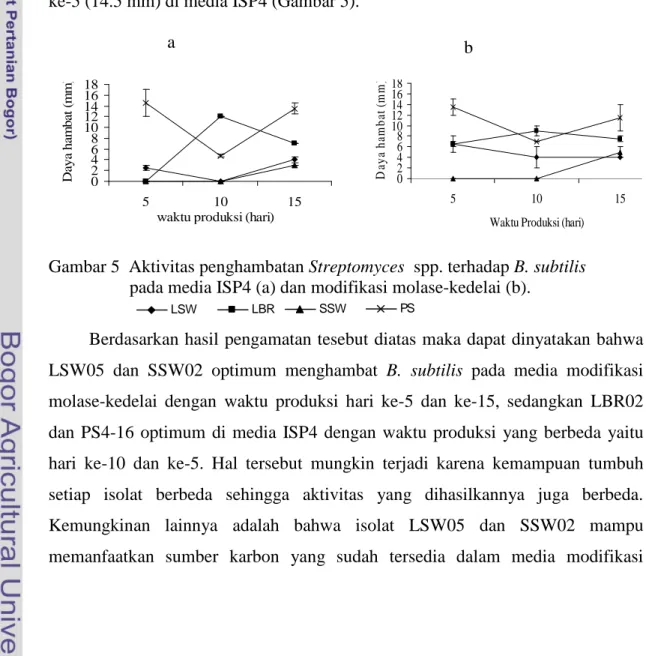
Kemampuan Streptomyces spp. dalam menghasilkan senyawa anti mikroba dilakukan pengujian dengan beberapa bakteri dan cendawan patogen tular tanah. Hasil uji kemampuan penghambatan Streptomyces spp. terhadap B. subtilis pada media ISP4 dan modifikasi molase-kedelai menunjukkan pola yang hampir sama. LSW05 mempunyai penghambatan tertinggi (6.5 mm) pada media modifikasi molase-kedelai hari ke-5, sedangkan pada media ISP4 tertinggi pada hari ke-15 (4 mm). Isolat LBR02 mempunyai penghambatan terbesar pada media ISP4 hari 10 sebesar 12 mm. Isolat SSW02 tidak mengalami penghambatan pada hari ke-5 dan ke-10 di media ISP4 maupun modifikasi molase-kedelai, penghambatan terjadi pada hari ke-15 dengan penghambatan terbesar di media modifikasi molase-kedelai (5 mm). Penghambatan tertinggi isolat PS4-16 terjadi pada hari ke-5 (14.5 mm) di media ISP4 (Gambar 5).
Gambar 5 Aktivitas penghambatan Streptomyces spp. terhadap B. subtilis pada media ISP4 (a) dan modifikasi molase-kedelai (b).
.
Berdasarkan hasil pengamatan tesebut diatas maka dapat dinyatakan bahwa LSW05 dan SSW02 optimum menghambat B. subtilis pada media modifikasi molase-kedelai dengan waktu produksi hari ke-5 dan ke-15, sedangkan LBR02 dan PS4-16 optimum di media ISP4 dengan waktu produksi yang berbeda yaitu hari ke-10 dan ke-5. Hal tersebut mungkin terjadi karena kemampuan tumbuh setiap isolat berbeda sehingga aktivitas yang dihasilkannya juga berbeda. Kemungkinan lainnya adalah bahwa isolat LSW05 dan SSW02 mampu memanfaatkan sumber karbon yang sudah tersedia dalam media modifikasi
a b LSW LBR LBR SSW PS 0 2 4 6 8 10 12 14 16 18 5 10 15
waktu produksi (hari)
D ay a h am b at (m m ) 0 2 4 6 8 10 12 14 16 18 5 10 15
Waktu Produksi (hari)
D ay a h am b at (m m )
molase-kedelai, sedangkan LBR02 dan PS4-16 mampu menghasilkan enzim amilase yang dapat mendegradasi pati menjadi senyawa karbon yang lebih sederhana sehingga dapat dimanfaatkan sebagai sumber karbon dalam metabolismenya.
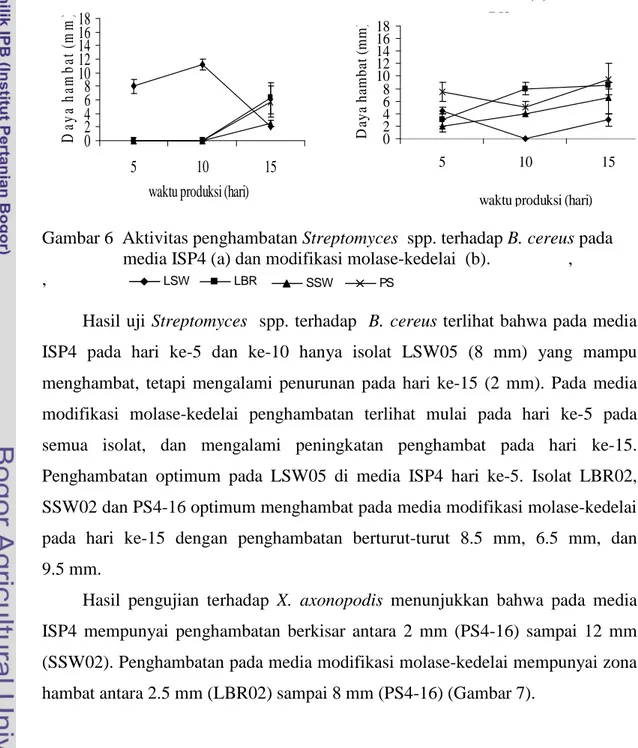
Pengujian terhadap bakteri B. cereus memperlihatkan bahwa media modifikasi molase-kedelai merupakan media optimum untuk menghasilkan anti mikroba, dan waktu produksi 15 hari. Hal tersebut terlihat dengan adanya peningkatan penghambatan pada hari ke-15 pada beberapa isolat yang diuji (Gambar 6).
(a) (b)
Gambar 6 Aktivitas penghambatan Streptomyces spp. terhadap B. cereus pada media ISP4 (a) dan modifikasi molase-kedelai (b). , ,
Hasil uji Streptomyces spp. terhadap B. cereus terlihat bahwa pada media ISP4 pada hari ke-5 dan ke-10 hanya isolat LSW05 (8 mm) yang mampu menghambat, tetapi mengalami penurunan pada hari ke-15 (2 mm). Pada media modifikasi molase-kedelai penghambatan terlihat mulai pada hari ke-5 pada semua isolat, dan mengalami peningkatan penghambat pada hari ke-15. Penghambatan optimum pada LSW05 di media ISP4 hari ke-5. Isolat LBR02, SSW02 dan PS4-16 optimum menghambat pada media modifikasi molase-kedelai pada hari ke-15 dengan penghambatan berturut-turut 8.5 mm, 6.5 mm, dan 9.5 mm.
Hasil pengujian terhadap X. axonopodis menunjukkan bahwa pada media ISP4 mempunyai penghambatan berkisar antara 2 mm (PS4-16) sampai 12 mm (SSW02). Penghambatan pada media modifikasi molase-kedelai mempunyai zona hambat antara 2.5 mm (LBR02) sampai 8 mm (PS4-16) (Gambar 7).
LSW LBR LBR SSW PS 0 2 4 6 8 10 12 14 16 18 5 10 15
waktu produksi (hari)
D ay a h am b at (m m ) B13 0 2 4 6 8 10 12 14 16 18 5 10 15
waktu produksi (hari)
D ay a h am b a t (m m )
(a) (b)
Gambar 7 Aktivitas penghambatan Streptomyces spp. terhadap X. axonopodis pada media ISP4 (a) dan modifikasi molase-kedelai (b).
Pada media ISP4 hanya isolat LBR02 dan PS4-16 yang konsisten menghambat X. axonopodis. Hal ini berbeda pada media modifikasi molase-kedelai, penghambatan dapat dilakukan oleh tiga isolat Streptomyces spp. (LSW05, LBR02, dan PS4-16), sedangkan SSW02 hanya mampu menghambat pada hari ke-15 saja. Hasil uji Streptomyces spp. terhadap X. axonopodis ini menunjukkan bahwa produksi senyawa anti mikroba optimum pada media modifikasi molase-kedelai. Setiap isolat mempunyai aktivitas berbeda satu sama lain. LSW05 dan PS4-16 optimum menghambat X. axonopodis pada hari ke-5, sedangkan LBR02 menghambat optimum pada hari ke-15.
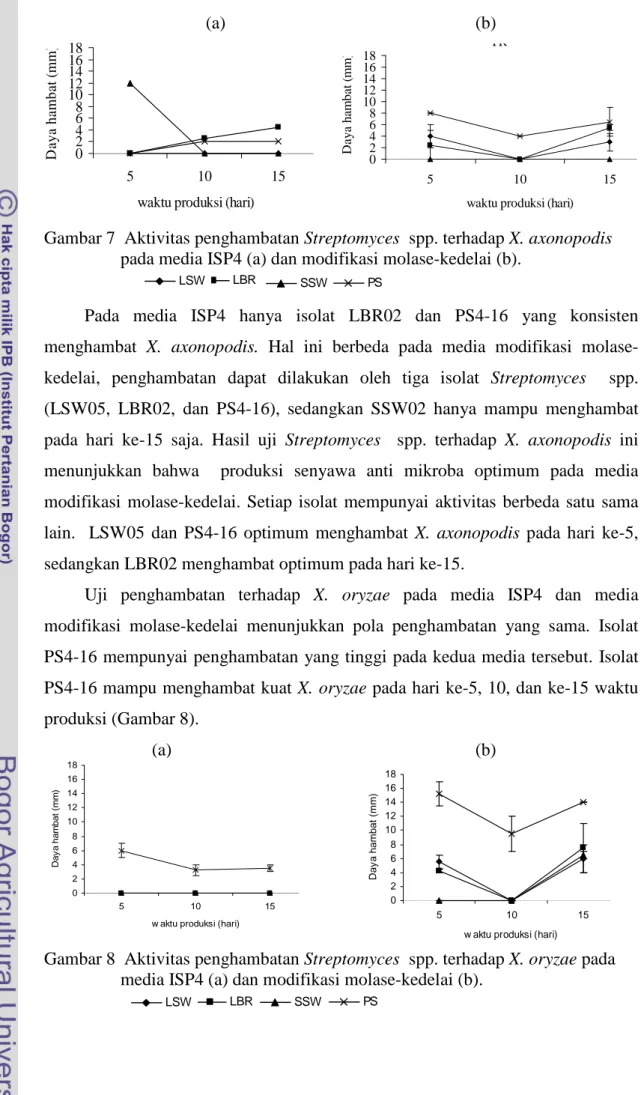
Uji penghambatan terhadap X. oryzae pada media ISP4 dan media modifikasi molase-kedelai menunjukkan pola penghambatan yang sama. Isolat PS4-16 mempunyai penghambatan yang tinggi pada kedua media tersebut. Isolat PS4-16 mampu menghambat kuat X. oryzae pada hari ke-5, 10, dan ke-15 waktu produksi (Gambar 8).
(a) (b)
Gambar 8 Aktivitas penghambatan Streptomyces spp. terhadap X. oryzae pada media ISP4 (a) dan modifikasi molase-kedelai (b).
, . 0 2 4 6 8 10 12 14 16 18 5 10 15
w aktu produksi (hari)
D a y a h a m b a t (m m ) 0 2 4 6 8 10 12 14 16 18 5 10 15
w aktu produksi (hari)
D a y a h a m b a t (m m ) LBR PS LSW LBR SSW LBR PS LSW LBR SSW 0 2 4 6 8 10 12 14 16 18 5 10 15
waktu produksi (hari)
D ay a h am b at (m m ) YR 0 2 4 6 8 10 12 14 16 18 5 10 15
waktu produksi (hari)
D a y a h am b at (m m )
Kemampuan penghambatan dari keempat isolat Streptomyces spp. memperlihatkan bahwa keempat isolat Streptomyces dapat menghambat bakteri patogen pada media modifikasi molase-kedelai pada hari ke-15. Penghambatan terhadap bakteri patogen pada media ISP4 hanya dapat dilakukan oleh PS4-16 hari ke-5. Penghambatan tertinggi pada PS4-16 hari ke-5 sebesar 15.25 mm pada media modifikasi molase-kedelai dan mengalami penurunan pada hari ke-15, tetapi pada hari ke-15 ketiga isolat lainnya (LSW05, LBR02, dan SSW02) mengalami peningkatan penghambatan. Hal ini yang menjadi alasan bahwa pada hari ke-15 merupakan waktu optimum isolat-isolat tersebut memproduksi senyawa anti mikroba.
Pengamatan terhadap R. solanacearum menunjukkan pengaruh yang berbeda antara media ISP4 dengan modifikasi molase-kedelai. Penghambatan terhadap bakteri patogen pada media ISP4 hanya dapat dilakukan dua isolat yaitu LSW05 dan LBR02. Penghambatan tersebut hampir sama pada waktu produksi hari ke-5 dan ke-10 (2 mm) maupun ke-15. Peningkatan terjadi hanya pada isolat LBR02 pada hari ke-15 (Gambar 9a).
Gambar 9 Aktivitas penghambatan Streptomyces spp. terhadap R. solanacearum pada media ISP4 (a) dan modifikasi molase-kedelai (b).
, , ,
Hasil pengujian pada media modifikasi molase-kedelai menunjukkan hasil bahwa Streptomyces spp. dapat menghambat mikroba patogen tular tanah pada hari ke-15, kecuali SSW02 yang tidak mampu menghambat R. solanacearum pada media ISP4 maupun media modifikasi. Penghambatan terhadap
R. solanacearum optimum pada media molase-kedelai dengan waktu produksi 15
hari. Peningkatan aktivitas penghambatan tersebut karena Streptomyces spp.
LBR SSW LBR PS LSW (a) (b) 0 2 4 6 8 10 12 14 16 18 5 10 15
waktu produksi (hari)
D ay a h am b at (m m ) 0 2 4 6 8 10 12 14 16 18 5 10 15
Waktu produksi (hari)
D ay a h am b at (m m )