PENGEMBANGAN SENSOR VOLTAMMETRIK ASAM URAT MELALUI MODIFIKASI ELEKTRODA EMAS DENGAN
MOLECULARLY IMPRINTED POLIANILIN
SKRIPSI
DYAH AYU PURBASARI
DEPARTEMEN KIMIA
FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS AIRLANGGA
SURABAYA 2012
PENGEMBANGAN SENSOR VOLTAMMETRIK ASAM URAT MELALUI MODIFIKASI ELEKTRODA EMAS DENGAN
MOLECULARLY IMPRINTED POLIANILIN
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Bidang Kimia pada
Fakultas Sains dan Teknologi Universitas Airlangga
Oleh :
DYAH AYU PURBASARI NIM. 080810288 Tanggal lulus : 9 Agustus 2012
Disetujui oleh :
Pembimbing I,
Dra. Miratul Khasanah, M. Si. NIP. 19670304 199203 2 001
Pembimbing II,
Dr. Muji Harsini, M. Si. NIP. 19640502 198903 2 002
LEMBAR PENGESAHAN NASKAH SKRIPSI
Judul : Pengembangan Sensor Voltammetrik Asam Urat melalui Modifikasi Elektroda Emas dengan
Molecularly Imprinted Polianilin
Penyusun : Dyah Ayu Purbasari
NIM : 080810288
Pembimbing I : Dra. Miratul Khasanah, M. Si. Pembimbing II : Dr. Muji Harsini, M.Si. Tanggal Ujian : 9 Agustus 2012
Disetujui Oleh : Pembimbing I,
Dra. Miratul Khasanah, M. Si. NIP. 19670304 199203 2 001
Pembimbing II,
Dr. Muji Harsini, M. Si. NIP. 19640502 198903 2 002
Mengetahui : Ketua Departemen Kimia Fakultas Sains dan Teknologi
Universitas Airlangga
Dr. Alfinda Novi Kristanti, DEA. NIP. 19671115 199102 2 001
PEDOMAN PENGGUNAAN SKRIPSI
Skripsi ini tidak dipublikasikan, namun tersedia di perpustakaan dalam lingkungan Universitas Airlangga, diperkenankan untuk dipakai sebagai referensi kepustakaan, tetapi pengutipan harus seijin penyusun dan harus menyebutkan sumbernya sesuai kebiasaan ilmiah.
KATA PENGANTAR
Segala puji kehadirat Allah SWT atas limpahan rahmat, taufik dan hidayah-Nya serta shalawat bagi Nabi Muhammad SAW yang menunjukkan jalan kebenaran bagi umat manusia. Dengan segala kemudahan yang diberikanNya maka penulis dapat menyelesaikan penyusunan skripsi yang berjudul “Pengembangan Sensor Voltammetrik Asam Urat melalui Modifikasi Elektroda Emas dengan Molecularly Imprinted Polianilin“ dengan baik.
Dalam kesempatan ini penulis mengucapkan terima kasih yang sebesar-besarnya kepada semua pihak yang memberikan bantuan dan dukungan terutama kepada :
1. Ibu Dra. Miratul Khasanah, M.Si dan Ibu Dr. Muji Harsini, M.Si selaku pembimbing yang meluangkan tenaga dan waktu untuk membimbing dan mengarahkan dalam penyusunan skripsi ini.
2. Ibu Dr. Nanik Siti Aminah, M.Si selaku dosen wali yang senantiasa memberikan masukan dan dukungan.
3. Ibu Dr. Alfinda Novi Kristanti, DEA. selaku Ketua Departemen yang banyak memberikan informasi dalam penyusunan skripsi ini.
4. Ibu Siti Wafiroh, S.Si, M.Si dan Ibu Dr. Pratiwi Pujiastuti, M.Si selaku penguji yang telah memberikan kritik dan saran dalam penyusunan skripsi ini.
5. Bapak dan Ibu dosen Departemen Kimia Universitas Airlangga yang banyak memberikan ilmunya.
6. Orang tua (Suharmanto Tri Adi Prodjo dan Nawastuti Iswahyuningsih) adik (Adhyaksa Herdhianto), dan keluarga yang telah memberikan dorongan berupa materi, do’a, dan kasih sayang.
7. Teman-teman kimia 2008 terutama kelompok voltammetri (Ais, Evril, Fida, Juli, Luki, Nikita) telah memberi semangat untuk menyusun skripsi ini.
9. Semua pihak yang telah membantu dalam penyusunan skripsi ini yang tidak dapat disebutkan satu persatu.
Demi kesempurnaan skripsi ini, kritik dan saran yang membangun dari pembaca sangat diharapkan. Semoga skripsi ini dapat bermanfaat bagi pembaca.
Surabaya, Juli 2012 Penyusun
Purbasari, Dyah Ayu, 2012, Pengembangan Sensor Voltammetrik Asam Urat melalui Modifikasi Elektroda Emas dengan Molecularly Imprinted Polianilin, Skripsi di bawah bimbingan Dra. Miratul Khasanah, M.Si dan Dr. Muji Harsini, M.Si, Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya.
ABSTRAK
Artrithis urica merupakan penyakit yang disebabkan oleh penumpukan
asam urat dalam tubuh yang berasal dari sisa metabolisme zat purin. Analisis kadar asam urat dalam tubuh telah dilakukan melalui beberapa metode, yaitu spektrofotometri, high performance liquid chromatography (HPLC), dan voltammetri. Pengembangan sensor asam urat dengan cara memodifikasi elektroda emas dengan moleculary imprinted polymer (MIP) dipelajari dalam penelitian ini. Penelitian ini bertujuan mengetahui potensial dan waktu pelapisan MIP yang kemudian dilakukan uji validitas metode. MIP terbuat dari anilin sebagai monomer, ammonium perokdisulfat sebagai inisiator, dan asam urat sebagai template dengan perbandingan mol 2:1:0,1, kemudian MIP dikarakterisasi menggunakan fourier transform infra red (FTIR). Asam urat dianalisis secara voltammetri pada parameter optimum, yaitu pada potensial pelapisan MIP 0,3 V, waktu pelapisan MIP 90 detik, dan pada pH 4. Kemudian dilakukan uji kinerja elektroda dan validitas metode. Metode yang dikembangkan ini menghasilkan koefisien korelasi (r) sebesar 0,9904, sensitivitas sebesar 7,93 µA/ppb cm-2, % KV dengan 0,9683 % sampai 3,7940 % untuk konsentrasi asam urat 1 – 5 ppb, limit deteksi sebesar 5,95 x 10-9 M, dan akurasi sebesar 74,60 %, 108,35 %, 97,69 % untuk konsentrasi asam urat berturut-turut 1 ppb, 3 ppb, 5 ppb.
Kata kunci : asam urat, molecularly imprinted polymer, voltammetrik, elektroda, emas, polianilin
Purbasari, Dyah Ayu, 2012, Development of Voltammetric Sensor of Uric Acid throughgold Electrode Coating with Molecularly Imprinted Polyaniline, This scription under consellor Dra. Miratul Khasanah, M. Si. and Dr. Muji Harsini, M. Si. Department of Chemistry, Faculty of Science and Technology, Airlangga University, Surabaya
ABSTRACT
Artrithis urica is a disease caused by a buildup of uric acid in the body that comes from purine metabolic waste substances. Analysis of uric acid levels in the body has been done through several methods, that is spectrophotometry, high performance liquid chromatography (HPLC), and voltammetri. Development of uric acid sensor by modifying the gold electrode with moleculary imprinted polymer (MIP) had been studied in this research. MIP was made of aniline as a monomer, ammonium perokdisulfat as an initiator, and uric acid as a template with rasio 2:1:0,1 and then characterized using fourier transform infra red (FTIR). Uric acid was analyzed by voltammetri on optimum parameters, that is potential coating 0.3 V, coating time 90 seconds, and at pH 4. This developed method produces a correlation coefficient (r) of 0.9904, a sensitivity of 7,93 μA/ppb cm-2, % KV with 0.9683% to 3.7940% for the concentration of uric acid 1-5 ppb, the detection limit of 5.95 x 10-9 M, and an accuracy of 74.60%, 108.35%, 97.69% for the concentration of uric acid in a row 1 ppb, 3 ppb, 5 ppb.
Key word : uric acid, molecularly imprinted polymer, voltammetry, electrode, gold, polyaniline
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERNYATAAN ... ii
HALAMAN PENGESAHAN ... iii
PEDOMAN PENGGUNAAN SKRIPSI ... iv
KATA PENGANTAR ... v
ABSTRAK ... vii
ABSTRACT ... viii
DAFTAR ISI ... ix
DARTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang Permasalahan ... 1
1.2 Rumusan Masalah ... 5
1.3 Tujuan Penelitian ... 5
1.4 Manfaat Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Voltammetri ... 6 2.2.1 Voltammetri lucutan ... 7 2.2.2 Elektroda ... 8 2.2 Asam Urat ... 9 2.3 Polimer ... 12 2.3.1 Macam-macam polimer ... 12
2.3.2 Molecularly imprinted polymer (MIP) ... 14
2.4 Polianilin ... 15
BAB III METODE PENELITIAN ... 18
3.1 Tempat dan Waktu Penelitian ... 18
3.2 Bahan Penelitian ... 18
3.3 Peralatan Penelitian ... 18
3.4 Skema Kerja ... 19
3.5 Prosedur Penelitian ... 20
3.5.1 Pembuatan larutan bufer ... 20
3.5.1.1 Pembuatan larutan asam asetat 2M ... 20
3.5.1.2 Pembuatan larutan natrium asetaat 2M ... 20
3.5.1.3 Pembuatan larutan bufer asetat pH 4 ... 20
3.5.2 Pembuatan larutan asam urat ... 20
30 ppb, dan 1 ppb ... 21
3.5.3 Pembuatan larutan HCl 1M ... 21
3.5.4 Pembuatan polimer, non imprinted polymer (NIP), dan MIP ... 22
3.5.5 Pelapisan MIP pada emas ... 22
3.5.6 Uji kinerja elektroda emas-MIP ... 23
3.5.7 Optimasi waktu akumulasi asam urat pada elektroda emas-MIP ... 23
3.5.8 Pembuatan kurva standar asam urat ... 23
3.5.10 Uji validitas metode ... 24
BAB IV HASIL DAN PEMBAHASAN ... 28
4.1 Pembuatan Polimer, NIP dan MIP ... 28
4.2 Karakterisasi Polianilin, NIP, dan MIP ... 30
4.3 Pelapisan MIP pada Elektroda Emas secara Voltammetri Lucutan. 32 4.4 Optimasi Waktu Akumulasi Asam Urat pada Elektroda Emas-MIP 35 4.5 Uji Kinerja Elektroda Emas-MIP ... 37
4.6 Pembuatan Kurva Standar ... 39
4.7 Uji Validitas Metode ... 40
BAB V KESIMPULAN DAN SARAN ... 44
5.1 Kesimpulan ... 44
5.2 Saran ... 44
DAFTAR PUSTAKA ... 45 LAMPIRAN
DAFTAR TABEL
Tabel Judul Tabel Halaman
4.1 Data hasil analisis asam urat pada berbagai potensial
pelapisan MIP pada elektroda emas 33
4.2 Data hasil analisis asam urat 30 ppb pada berbagai waktu
pelapisan MIP pada elektroda emas 35
4.3 Data uji kinerja elektroda emas-MIP, emas-PANi, emas-NIP,
dan emas 37
4.4 Data hasil analisis larutan standar asam urat 39 4.5 Data % KV hasil pengukuran masing-masing konsentrasi
larutan standar asam urat 41
4.6 Data R hasil pengukuran larutan standar asam urat pada
DAFTAR GAMBAR
Gambar Judul Gambar Halaman
2.1 Struktur asam urat 10
2.2 Mekanisme reaksi polimerisasi adisi 12
2.3 Reaksi polimerisasi kondensasi 13
2.4 Proses pembuatan MIP 14
2.5 Struktur polianilin 15
2.6 Tahap inisiasi polimerisasi polianilin 16
2.7 Tahap propagasi polimerisasi polianilin 16
2.8 Tahap terminasi polimerisasi polianilin 17
4.1 Ikatan yang terbentuk antara polianilin dan asam urat 29
4.2 Padatan polianilin dan serbuk NIP 29
4.3 Cetakan asam urat pada MIP 30
4.4 Spektra FT-IR anilin dan polianilin (PANi) 31
4.5 Spektra FT-IR NIP dan MIP 31
4.6 Kurva hubungan arus larutan asam urat 5 ppb dengan
potensial pelapisan MIP pada elektroda emas 34 4.7 Voltammogram asam urat 30 ppb pada potensial pelapisan MIP 35 4.8 Kurva hubungan arus asam urat dengan waktu pelapisan MIP
pada elektroda emas 36
4.9 Voltammogram asam urat 30 ppb pada waktu pelapisan MIP 37
DAFTAR LAMPIRAN
Lampiran Judul Lampiran
1 Perhitungan pembuatan larutan bufer 2 Perhitungan pembuatan larutan asam urat 3 Perhitungan pembuatan PANi, NIP, dan MIP
4 Spektra FTIR asam urat, anilin, PANi, NIP, dan MIP 5 Voltammogram optimasi potensial pelapisan MIP pada
elektroda emas
6 Voltammogram optimasi waktu pelapisan MIP
7 Uji kinerja elektroda emas, emas-PANi, emas-NIP, dan emas-MIP 8 Uji validitas metode
BAB I PENDAHULUAN
1.1 Latar Belakang Permasalahan
Metode spektrofotometri digunakan dalam bidang kesehatan untuk analisis kadar asam urat. Pada analisis asam urat dengan metode ini, asam urat dalam serum direaksikan dengan asam fosfotungstat dalam suasana basa sehingga menghasilkan larutan yang berwarna biru pada panjang gelombang 660 nm. Analisis menggunakan metode spektrofotometri mempunyai beberapa kelemahan, diantaranya memerlukan sampel dengan jumlah banyak, preparasi sampel rumit dan lama, serta menghasilkan limit deteksi yang tinggi (Sewell, et al., 2002).
Artrithis urica merupakan penyakit yang disebabkan oleh penumpukan
asam urat dalam tubuh yang berasal dari sisa metabolisme zat purin dari sisa makanan yang dikonsumsi. Purin adalah zat yang terdapat dalam setiap bahan makanan yang berasal dari tubuh makhluk hidup. Dengan kata lain, didalam tubuh terdapat zat purin akibat mengkonsumsi makanan yang berasal dari makhluk hidup. Pada berbagai sayuran dan buah-buahan juga terdapat purin. Kelebihan asam urat di dalam tubuh dapat diamati melalui beberapa penyakit seperti nyeri di persendian, hiperurisemia, batu ginjal, bahkan penyakit kardiovaskuler (Hidayat, 2009).
Metode lain yang juga digunakan untuk analisis kadar asam urat dalam tubuh adalah high performance liquid chromatography (HPLC). Analisis asam urat menggunakan metode ini menghasilkan akurasi sebesar 97- 104%
(Yokoyama et al., 2000). HPLC ini mempunyai daya pisah yang tinggi sehingga dapat memisahkan suatu campuran secara simultan. Analisis menggunakan HPLC mempunyai beberapa kelemahan, yaitu waktu analisis yang lama, memerlukan perlakuan yang rumit, limit deteksinya tinggi (0,11 µg/mL), dan dibutuhkan biaya yang tinggi (George et al., 2006).
Selain metode spektrofotometri dan HPLC, metode voltammetri juga telah banyak dikembangkan dalam bidang kesehatan. Metode ini biasa digunakan untuk analisis senyawa-senyawa yang memiliki sisi aktif seperti asam urat, kreatin, dan kreatinin. Metode ini banyak digunakan karena mempunyai beberapa kelebihan, yaitu preparasi sampel yang mudah, dapat digunakan untuk menentukan empat sampai enam unsur secara simultan, dan memiliki limit deteksi yang rendah (hingga konsentrasi 10-10 M) (Wang, 2000). Selain itu metode voltammetri ini adalah sederhana, cepat, sensitif, dan akurat (Zhao et al., 2006). Namun demikian, analisis asam urat menggunakan metode voltammetri sering diganggu oleh senyawa lain yang mempunyai potensial berdekatan dengan asam urat seperti asam askorbat (John, 2005).
Dalam analisis secara voltammetri, elektroda merupakan salah satu komponen yang penting. Elektroda kerja yang sering digunakan pada analisis asam urat secara voltammetri adalah glassy carbon, merkuri, platina dan emas.
Glassy carbon adalah bentuk konduktif karbon yang dibuat dari pirolisis karbon
atau grafit. Glassy carbon ini sangat keras (seperti berlian) sehingga sangat sulit untuk dibuat elektroda. Kekerasan ini juga menjelaskan mengapa glassy carbon relatif mahal (Monk, 2001) dan penggunaannya terbatas. Merkuri merupakan
bahan elektroda yang banyak digunakan. Akan tetapi sifat toksik dari merkuri menyebabkan penggunaannya menjadi terbatas. Platina adalah pilihan yang paling populer dari elektroda inert untuk elektroanalisis. Akan tetapi penggunaan platina sebagai elektroda tidak reproducible (Thomas, 2001). Emas adalah elektroda yang mempunyai rentang potensial kerja yang cukup luas dan tidak bersifat toksik selain itu ketahanan elektrodanya tinggi sehingga dapat digunakan secara berulang-ulang. Dari uraian tersebut maka pada penelitian ini digunakan emas sebagai elektroda pendukung yang akan dimodifikasi.
Zhao et al. (2006) mengamati perilaku asam urat dan asam askorbat secara elektrokimia menggunakan elektroda emas termodifikasi L-cysteine (L-Cys). Elektroda termodifikasi menunjukkan sifat elektrokatalis yang sangat baik pada analisis asam urat secara voltammetri siklik (CV) dalam media 0,1 M bufer fosfat (pH 7,0). Dalam pengukuran secara differential pulse voltammetric (DPV), elektroda L-Cys/emas dapat memisahkan potensial puncak oksidasi asam urat dan asam askorbat sebesar 236 mV. Dengan demikian dapat dilakukan analisis asam urat dan asam askorbat secara simultan. Limit deteksi asam urat dan asam askorbat masing-masing adalah 2,0 × 10-6 M dan 1,1 × 10-5 M. Metode ini dapat digunakan untuk penentuan asam urat dalam matriks urin.
Penelitian lain tentang asam urat juga dilakukan Khasanah et al. (2010) yang menggunakan monomer asam metakrilat dan asam etilen glikol dimetakrilat (EGDMA) sebagai cross-linker. Analisis asam urat dengan metode ini menghasilkan limit deteksi sebesar 5,94 x 10-10M, dan sensitivitas sebesar 16,405 nA L/µg.
Arwindah (2010) telah melakukan analisis asam urat secara voltammetri lucutan menggunakan modifikasi elektroda glassy carbon termodifikasi
molecularly imprinted polymer (GC-MIP). Pada penelitian yang menggunakan
monomer anilin tersebut menghasilkan limit deteksi sebesar 0,33 ppb (1,8 x 10-9 M), akurasi sebesar 84,75 % dan sensitivitas sebesar 0,96 µA/ppb. Analisis asam urat dalam sampel serum dengan metode tersebut masih diganggu asam askorbat yang ditunjukkan dengan penyimpangan arus antara 2,6 – 4,68 % pada perbandingan mol asam urat dan asam askorbat 1:10; 1:100; dan 1:1000.
Pada penelitian ini dilakukan pengembangan sensor asam urat dengan cara memodifikasi elektroda emas dengan moleculary imprinted polymer (MIP). MIP terbuat dari anilin sebagai monomer, ammonium perokdisulfat sebagai inisiator, dan asam urat sebagai template. Pada tahap pertama analit yang bertindak sebagai template dijebakkan dalam rantai polimer. Kemudian template dihilangkan dengan cara ekstraksi, sehingga terbentuk polimer tercetak molekul asam urat yang dapat digunakan untuk pengenalan molekul asam urat dalam larutan uji (Brüggemann, 2002). MIP tersebut kemudian dilapiskan pada elektroda emas dengan variasi potensial dan waktu pelapisan. Elektroda termodifikasi yang terbentuk diaplikasikan untuk analisis larutan standar asam urat dan dibandingkan voltammogram dan arus yang dihasilkan dengan voltammogram dan arus yang dihasilkan menggunakan elektroda emas, emas-non imprinted polymer (emas-NIP) dan emas-polianilin. Selanjutnya untuk mengetahui kualitas elektroda termodifikasi dilakukan uji validitas metode meliputi linieritas, sensitivitas, presisi, limit deteksi, dan akurasi.
1.2 Rumusan Masalah
Berdasarkan latar belakang permasalahan, dapat dirumuskan masalah sebagai berikut.
1. Berapa potensial pelapisan dan waktu pelapisan MIP optimum pada elektroda emas?
2. Berapa linieritas, presisi, sensitivitas, limit deteksi, dan akurasi metode analisis asam urat secara voltammetri lucutan menggunakan elektroda modifikasi emas-MIP?
1.3 Tujuan Penelitian Penelitian ini bertujuan untuk :
1. mengetahui potensial pelapisan dan waktu pelapisan optimum MIP pada elektroda emas.
2. mengetahui linieritas, presisi, sensitivitas, limit deteksi, dan akurasi metode analisis asam urat secara voltammetri lucutan menggunakan elektroda modifikasi emas-MIP.
1.4 Manfaat Penelitian
Hasil penelitian ini diharapkan dapat diperoleh elektroda termodifikasi yang sensitif terhadap asam urat, yang dapat digunakan untuk analisis asam urat dengan kadar yang sangat rendah dan hasil yang akurat.
BAB II
TINJAUAN PUSTAKA
2.1 Voltammetri
Voltammetri adalah teknik elektroanalitik yang mengukur arus sebagai fungsi potensial (Mark, 2004). Pada analisis secara voltammetri, potensial divariasi secara sistematis sehingga analit mengalami oksidasi dan reduksi dipermukaan elektroda. Analisis asam urat dengan metode ini berjalan pada kondisi elektroda kerja yang terpolarisasi, dimana kecepatan oksidasi atau reduksi analit ditentukan oleh kecepatan perpindahan massa analit ke permukaan elektroda. Hasil pengukuran dengan voltammetri ditampilkan dalam bentuk voltammogram berupa arus (dalam mikroamper) sebagai fungsi potensial yang dipasang pada elektroda kerja (Mendham et al., 2000).
Teknik analisis secara voltammetri mempunyai banyak kelebihan diantaranya mempunyai sensitivitas tinggi, limit deteksi yang rendah, waktu analisis cepat karena sedikit membutuhkan preparasi sampel, dan dapat menganalisis dalam jangkauan konsentrasi yang luas. Selain itu, metode ini dapat digunakan untuk menganalisis analit yang bersifaf elektroaktif baik senyawa-senyawa golongan anorganik maupun organik. Senyawa organik dapat dianalisis dengan metode voltammetri berdasarkan pada kemampuan gugus fungsi mengalami reaksi oksidasi dan reduksi pada permukaan elektroda (Wang, 2000).
2.1.1 Voltammetri lucutan
Teknik voltammetri lucutan merupakan teknik yang sensitif dan selektif untuk mendeteksi analit dengan konsentrasi yang kecil karena metode ini memiliki kemampuan untuk mengukur konsentrasi yang sangat rendah (low
detection limit) dan pengoperasiannya sederhana. Berdasarkan reaksi elektrokimia
yang terjadi pada elektroda, voltammetri lucutan dibedakan menjadi anodic
stripping voltammetry (ASV) dan cathodic stripping voltammetry (CSV) (Gunzler
and Williams, 2001). Analisis menggunakan voltammetri lucutan ini terdiri dari dua tahap, yaitu deposisi (plating) dan lucutan (stripping) (Mendham et al., 2000). Tahap deposisi merupakan pengumpulan analit secara elektrolitik di permukaan elektroda pada potensial konstan. Sedangkan tahap lucutan adalah pelepasan (pelucutan) analit dari elektroda ke dalam larutan.
Analisis secara voltammetri lucutan dipengaruhi oleh beberapa parameter, seperti potensial akumulasi dan waktu akumulasi analit. Potensial akumulasi adalah potensial yang diberikan pada elektroda kerja selama proses penempelan atau akumulasi analit. Potensial yang diberikan akan mempengaruhi sinyal arus voltammogram yang dihasilkan selama pengukuran. Sedangkan waktu akumulasi adalah waktu yang diperlukan analit untuk terakumulasi pada permukaan elektroda kerja. Semakin lama waktu akumulasi maka semakin banyak analit yang terakumulasi pada elektroda kerja. Pada analisis kadar analit yang sangat rendah dibutuhkan waktu akumulasi yang lebih lama.
2.1.2 Elektroda
Elektroda adalah komponen voltammetri yang berfungsi sebagai detektor analit. Sel voltammetri terdiri dari tiga elektroda yaitu elektroda kerja (working
electrode), elektroda pembanding (reference electrode), dan elektroda pembantu
(counter electrode). Ketiga elektroda dicelupkan ke dalam larutan yang mengandung analit dan elektrolit non reaktif yang disebut elektrolit pendukung (Gunzler and Williams, 2001).
Elektroda kerja merupakan elektroda tempat reaksi elektrokimia berlangsung. Elektroda kerja yang digunakan pada voltammetri memiliki permukaan yang sangat kecil guna meningkatkan polaritas dan meminimalkan penipisan analit akibat elektrolisis serta meminimalkan kemungkinan interferensi oleh matriks. Elektroda kerja dapat dibuat dari berbagai macam bahan konduktif. Bahan konduktif yang biasa digunakan sebagai elektroda dalam voltammetri adalah grafit, merkuri, emas dan karbon (Thomas and Henze, 2001). Pada umumnya, elektroda kerja yang digunakan merupakan elektroda mikro (microelectrodes). Ukuran elektroda yang kecil dapat meningkatkan polarisasi dan sensitivitas. Selain itu elektroda mikro dapat memberikan respon yang sangat cepat untuk perubahan potensial (Gunzler and Williams, 2001).
Elektroda pembanding merupakan elektroda dengan harga potensial setengah sel yang diketahui, konstan dan tidak terpengaruh oleh komposisi larutan yang sedang dianalisis. Elektroda pembanding memberikan potensial yang stabil terhadap elektroda kerja yang dibandingkan. Pada teknik voltammetri, beda potensial diberikan antara elektroda kerja dan elektroda pembanding. Elektroda
yang sering digunakan sebagai elektroda pembanding adalah Ag/AgCl dan elektroda kalomel jenuh (SCE). Elektroda ini kuat, mudah dibuat, dan menjaga agar potensial tetap konstan (Gunzler and Williams, 2001).
Elektroda pembantu adalah elektroda yang berpasangan dengan elektroda kerja namun tidak berperan dalam penentuan besarnya potensial yang diukur. Arus yang dihasilkan pada voltammetri diukur antara elektroda kerja dan elektroda pembantu. Bahan yang sering digunakan sebagai elektroda pembantu adalah platina atau karbon.
Modifikasi elektroda dengan cara melapiskan senyawa teretentu di permukaan elektroda menjadi salah satu tanda perkembangan teknologi voltammetri (Wang, 2000). Modifikasi elektroda tersebut bertujuan untuk meningkatkan selektivitas dan mengurangi pengaruh matriks sampel pada proses pengukuran (Gunzler and Williams, 2001). Modifikasi elektroda secara kimia merupakan pendekatan modern untuk sistem elektroda. Modifikasi elektroda dapat dilakukan secara self-assembled monolayer (SAM), sol-gel encapsulation of
reactive species, electrocatalytic modified electrode, preconcentrating electrodes, permselective coatings, dan conducting polymers (Wang, 2000).
2.2 Asam Urat
2.2.1 Gambaran umum
Asam urat mempunyai rumus molekul C5H4N4O3 dengan nama lain yaitu 2,6,8-trioksipurin dan 7,9-dihidro-1H-purin-2,6,8(3H)-trione. Senyawa asam urat berbentuk kristal putih tidak berasa dan tidak berbau. Komposisi unsur penyusun
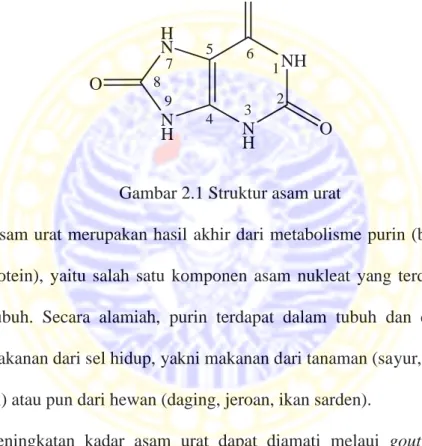
asam urat yaitu 35,72% C; 2,40% H; 33,33% N; dan 28,55% O. Massa molekul relatif (Mr) senyawa ini sebesar 168,11 g/mol dan massa jenis (ρ) sebesar 1,89 g/mL. Asam urat mudah terdekomposisi oleh panas, akan tetapi asam urat merupakan senyawa yang sukar larut dalam air (O’Neil, 2001). Struktur asam urat ditunjukkan pada Gambar 2.1.
Gambar 2.1 Struktur asam urat
Asam urat merupakan hasil akhir dari metabolisme purin (bentuk turunan nukleoprotein), yaitu salah satu komponen asam nukleat yang terdapat pada inti sel-sel tubuh. Secara alamiah, purin terdapat dalam tubuh dan dijumpai pada semua makanan dari sel hidup, yakni makanan dari tanaman (sayur, buah, kacang-kacangan) atau pun dari hewan (daging, jeroan, ikan sarden).
Peningkatan kadar asam urat dapat diamati melaui gout. Penyakit ini disebabkan oleh sintesis asam urat yang berlebihan dalam tubuh, sedangkan ekskresinya di ginjal sedikit. Asam urat sebetulnya diperlukan tubuh untuk membentuk inti-inti sel. Namun, yang diperlukan tubuh hanya sedikit. Kadar rata-rata asam urat di dalam darah atau serum tergantung pada usia dan jenis kelamin. Sebelum pubertas, kadar asam urat dalam serum laki-laki ± 3,5 mg/dL (35 ppm) dan setelah pubertas kadarnya menjadi ± 5,2 mg/dL (52 ppm), sedangkan pada
N H H N O N H NH O O 1 2 3 4 5 6 7 8 9
perempuan kadar asam urat tetap rendah, tapi setelah menginjak pramenopouse kadarnya meningkat menjadi 4 mg/dL (40 ppm) dan setelah menopouse kadarnya meningkat lagi menjadi 4,7 mg/dL (47 ppm). Pada usia ini tidak boleh mengkonsumsi makanan berkalori tinggi secara berlebih (Sci, 2007).
2.2.2 Analisis asam urat
Analisis kadar asam urat dalam bidang kesehatan selama ini dilakukan dengan menggunakan metode spektrofotometri (Sewell et al., 2002). Untuk pengukuran senyawa-senyawa yang kadarnya harus tetap terkontrol dalam tubuh, metode voltammetri telah banyak digunakan dalam beberapa tahun terakhir.
Pada penelitian sebelumnya telah dilakukan analisis asam urat (AU) dan asam askorbat (AA) dalam urin dengan metode amperometri menggunakan teknik
flow injection analysis (FIA). Keungulan metode FIA adalah sampel dan reagen
yang digunakan sangat sedikit, waktu analisisnya cepat, dan kapasitas analisisnya sangat besar. Dalam penelitian ini digunakan elektroda mikro emas yang dimodifikasi dengan palladium sebagai elektroda kerja. Asam urat dan asam askorbat masing-masing diukur secara amperometri pada 0,75 dan 0,55 V. Perlakuan enzimatik dilakukan dengan penambahan askorbat oksidase, uricase, dan peroksidase pada pH 7. Hasil kurva kalibrasi untuk asam askorbat dan asam urat linier pada rentang konsentrasi 0,44-2,64 mg/L untuk asam askorbat dan 0,34-1,68 mg/L untuk asam urat dengan standar deviasi relatif (RSD) <1% (Matos
2.3 Polimer
Polimer merupakan molekul besar yang dibentuk oleh penggabungan berulang secara kovalen senyawa kimia yang kecil dan sederhana. Kesatuan-kesatuan berulang itu setara dengan monomer, yaitu bahan dasar pembuat polimer. Akibatnya molekul-molekul polimer umumnya mempunyai massa molekul yang sangat besar. Istilah polimer diturunkan dari bahasa Yunani Poly, yang berarti “banyak” dan mer, yang berarti “bagian” (Odian, 2004).
2.3.1 Macam-macam polimer
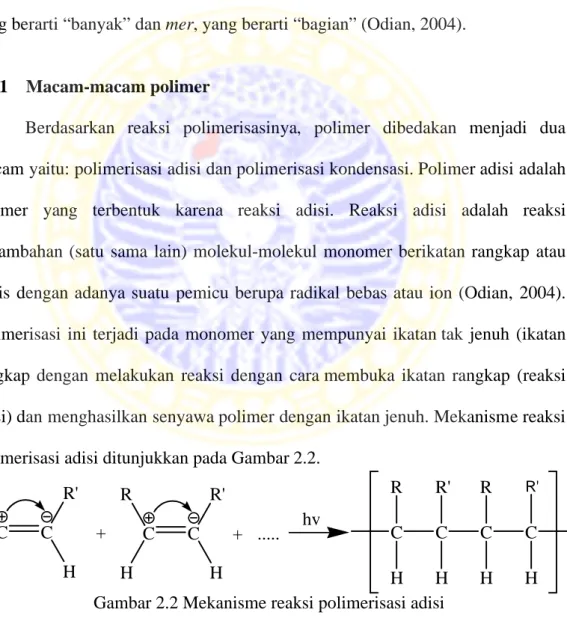
Berdasarkan reaksi polimerisasinya, polimer dibedakan menjadi dua macam yaitu: polimerisasi adisi dan polimerisasi kondensasi. Polimer adisi adalah polimer yang terbentuk karena reaksi adisi. Reaksi adisi adalah reaksi penambahan (satu sama lain) molekul-molekul monomer berikatan rangkap atau siklis dengan adanya suatu pemicu berupa radikal bebas atau ion (Odian, 2004). Polimerisasi ini terjadi pada monomer yang mempunyai ikatan tak jenuh (ikatan rangkap dengan melakukan reaksi dengan cara membuka ikatan rangkap (reaksi adisi) dan menghasilkan senyawa polimer dengan ikatan jenuh. Mekanisme reaksi polimerisasi adisi ditunjukkan pada Gambar 2.2.
Gambar 2.2 Mekanisme reaksi polimerisasi adisi
Sedangkan polimer kondensasi adalah polimer yang terjadi karena reaksi kondensasi (reaksi bertahap). Mekanisme reaksi polimer dapat ditunjukkan melaui
C C R' H R H + C C R' H R H + ... C C C C H R' R R' R H H H hv
reaksi kondensasi senyawa yang memiliki bobot molekul rendah yaitu reaksi dua gugus aktif dari 2 molekul monomer yang berbeda dengan melepaskan molekul kecil, seperti H2O dan CH3OH (metanol). Polimerisasi ini terjadi pada monomer-monomer yang mempunyai gugus fungsi pada kedua ujung rantainya. Selain menghasilkan polimer, polimerisasi kondensasi juga menghasilkan zat lain yang struktur molekulnya sederhana (kecil). Reaksi polimerisasi kondensasi ditunjukkan pada Gambar 2.3.
N H H (CH2)6 N H H + H O C (CH2)4 O C O O H * N H C * O + H2O
Gambar 2.3 Reaksi polimerisasi kondensasi
Mekanisme reaksi polimerisasi dapat dibagi menjadi tiga tahap yaitu tahap inisiasi, tahap propagasi dan tahap terminasi. Pada tahap inisiasi dibentuk sisi aktif yang memungkinkan terjadinya reaksi polimerisasi. Pada tahap ini dimulai dari penguraian inisiator dan adisi molekul monomer pada salah satu radikal bebas yang terbentuk. Tahap propagasi ditandai dengan pemanjangan rantai atau bertambahnya berat molekul. Dalam tahap propagasi ini terjadi kembali reaksi adisi pada radikal bebas yang terbentuk pada tahap inisiasi. Sedangkan pada tahap terminasi terjadi deaktifasi untuk menghasilkan produk akhir berupa polimer yang stabil. Tahap ini terjadi melalui reaksi antara radikal polimer yang sedang tumbuh dengan radikal mula-mula yang terbentuk dari inisiator atau antara radikal polimer yang sedang tumbuh dengan radikal polimer lainnya, sehingga akan membentuk polimer dengan berat molekul tinggi (Wallace, et.al., 2003).
2.3.2 Molecularly imprinted polymer
Molecularly imprinted polymer (MIP) dapat dibuat dengan mereaksikan
polimer dengan analit kemudian analit dikeluarkan dari jaringan polimer sehingga membentuk cetakan yang spesifik. Teknik ini mempunyai banyak kelebihan yaitu prosesnya tidak mahal, menghasilkan polimer yang selektif dan mampu bekerja dalam berbagai media (Yan and Ramström, 2005).
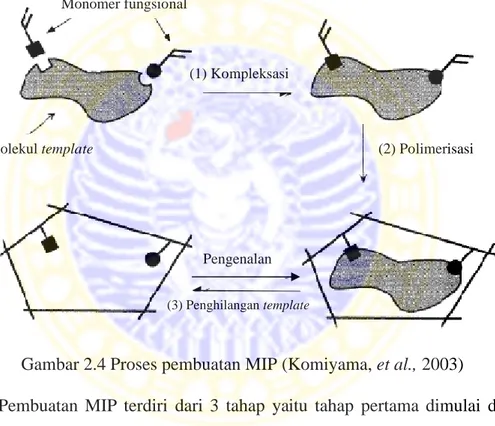
Gambar 2.4 Proses pembuatan MIP (Komiyama, et al., 2003)
Pembuatan MIP terdiri dari 3 tahap yaitu tahap pertama dimulai dengan pembentukan kompleks antara molekul target (template) dan gugus fungsi dari monomer yang berikatan secara kovalen atau non kovalen. Selanjutnya terjadi
co-polimerisasi antara kompleks yang terbentuk dengan penghubung silang dalam
pelarut yang inert. Kemudian terjadi reaksi polimerisasi dan penghilangan
template dari polimer dengan cara ekstraksi ataupun cara lain (Komiyama et al.,
2003). Pada reaksi polimerisasi ini cross-linker digunakan untuk membuat ikatan (3) Penghilangan template Monomer fungsional Molekul template (1) Kompleksasi (2) Polimerisasi Pengenalan
untuk meningkatkan kecepatan polimerisasi. Namun tidak semua reaksi polimerisasi memerlukan cross-linker dan inisiator.
2.3.3 Polianilin
Polianilin (PANi) merupakan salah satu bahan polimer konduktif yang banyak dikaji pada lebih dari dua dekade terakhir karena sifat fisika dan kimianya yang khas sehingga memiliki potensi untuk diaplikasikan pada berbagai bidang. Bahan polimer konduktif ini sangat unik yaitu dapat mengalami perubahan sifat listrik dan optik yang dapat balik (reversible) melalui reaksi redoks dan doping-dedoping atau protonasi-deprotonasi sehingga sangat potensial dimanfaatkan pada berbagai aplikasi (Maddu et al., 2008). Struktur polianilin dapat ditunjukkan pada Gambar 2.4.
Gambar 2.5 Struktur polianilin
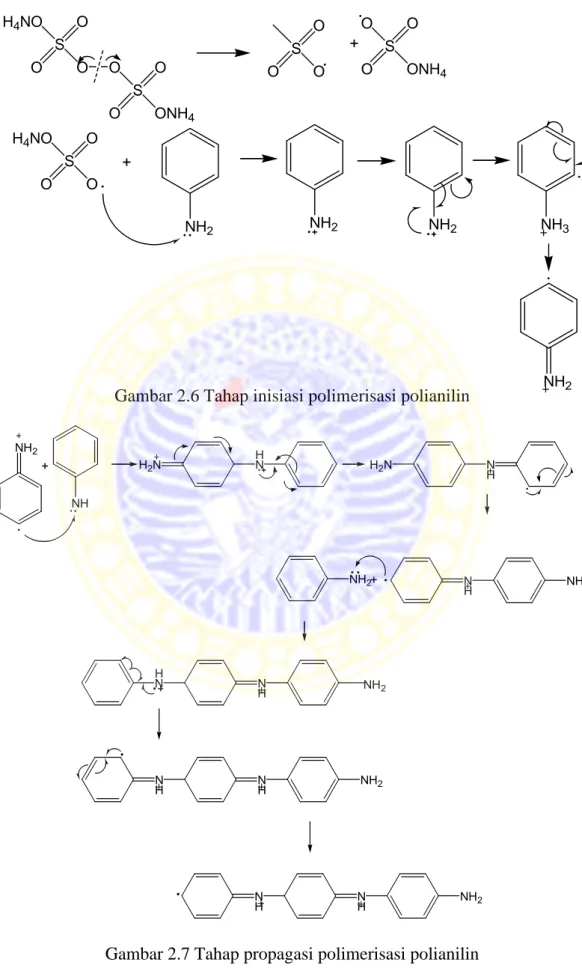
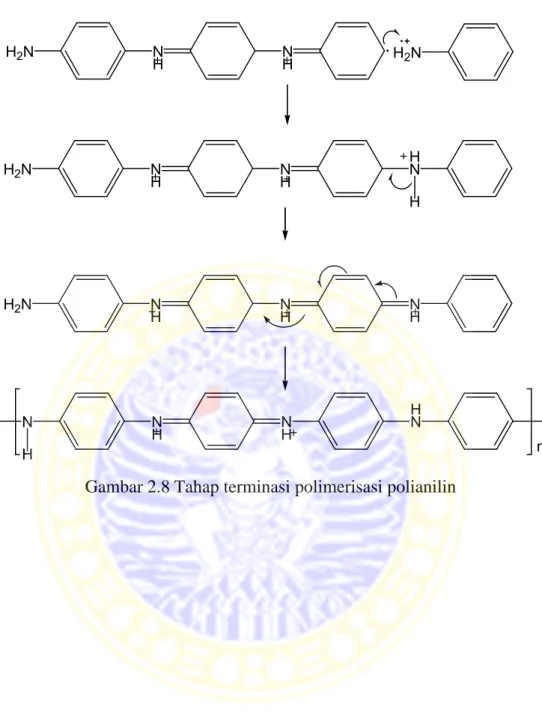
Beberapa faktor yang mempengaruhi proses polimerisasi anilin dengan cara oksidasi kimia antara lain, waktu polimerisasi, konsentrasi oksidator dan rasio mol anilin dan oksidator (Marcos et al., 2000). Faktor-faktor tersebut menyebabkan reaksi kopling kimia yang terjadi antar kation anilium semakin bertambah sehingga panjang rantai dan berat molekul polianilin yang terbentuk akan semakin bertambah. Reaksi polimerisasi polianilin ditunjukkan pada Gambar 2.6 (tahap inisiasi), Gambar 2.7 (tahap propagasi), dan Gambar 2.8 (tahap terminasi).
H
N HN HN
Gambar 2.6 Tahap inisiasi polimerisasi polianilin S O H4NO O O O S O ONH4 O S O O O + S O O ONH4 O S O O O H4NO + NH2 NH2 NH2 NH3 NH2 NH2 NH + H2N HN N H H2N N H NH2 + NH2 N H H N NH2 N H NH NH2 N H NH NH2
Gambar 2.8 Tahap terminasi polimerisasi polianilin N H NH H2N H2N H2N N H NH H N H H2N N H NH NH N N H NH H N H n
BAB III
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Kimia Analitik dan Laboratorium Instrumentasi Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga dan Laboratorium Instrumentasi Jurusan Kimia Universitas Negeri Surabaya mulai bulan Januari – Juni 2012.
3.2 Bahan Penelitian
Bahan kimia yang digunakan pada penelitian ini adalah asam urat, anilin, asam klorida, amonium peroksodisulfat, natrium hidroksida, dimetil sulfoksida, asam asetat glasial, dan natrium asetat anhidrat. Semua bahan kimia berderajat kemurnian pro analisis. Sedangkan air yang digunakan adalah akuabides.
3.3 Peralatan Penelitian
Peralatan yang digunakan pada penelitian ini adalah 797 Voltammetry
Computrace (MVA System-1) yang dilengkapi dengan wadah sampel, pengaduk
magnetik, processor unit, komputer pribadi (PC), elektroda kerja emas, elektroda pembanding Ag/AgCl dan elektroda counter Pt, mikropipet, pH meter serta peralatan pendukung lain.
3.4 Skema Kerja
Pembuatan larutan buffer dan larutan asam urat
Pembuatan polimer, NIP, dan MIP
Pelapisan MIP pada elektroda emas
Potensial (-) 600 – 600 mV Waktu deposisi : 30 - 150 dt
Optimasi parameter analisis/pengukuran
Uji kinerja elektroda
Pembuatan kurva standar
Uji validitas metode
Karakterisasi IR
emas, NIP, emas-MIP dan emas-polimer
Linieritas Limit deteksi Sentivitas Presisi Akurasi Waktu akumulasi : 30 - 150 dt Konsentrasi 1, 2, 3, 4, dan 5 ppb
3.5 Prosedur Penelitian 3.5.1 Pembuatan larutan bufer
3.5.1.1 Pembuatan larutan asam asetat 2M
Sebanyak 11,5 mL asam asetat glasial dimasukkan ke dalam gelas beker yang telah berisi 50 mL air, kemudian diencerkan dengan air sampai volume 100 mL dan diaduk hingga homogen.
3.5.1.2 Pembuatan larutan natrium asetat 2M
Sebanyak 16,4 gram CH3COONa dilarutkan dalam air pada gelas beker, kemudian diencerkan dengan air sampai volume 100 mL dan diaduk hingga homogen.
3.5.1.3 Pembuatan larutan bufer asetat pH 4
Larutan bufer asetat pH 4 dibuat dengan mencampurkan 42,6 mL CH3COOH 2M dan 7,4 mL CH3COONa 2M kemudian diencerkan dengan air hingga 100 mL dengan air. Selanjutnya pH larutan diukur dengan pH-meter. Ditambahkan CH3COONa 2M apabila pH bufer terlalu asam dan ditambahkan CH3COOH 2M apabila pH bufer terlalu basa sampai pH yang diinginkan.
3.5.2 Pembuatan larutan asam urat
3.5.2.1 Pembuatan larutan induk asam urat 1000 ppm
Sebanyak 0,1000 gram asam urat dilarutkan dalam NaOH 50% (b/b) hingga larut sempurna dalam gelas beker 100 mL, kemudian dipindahkan secara kuantitatif ke dalam labu ukur 100 mL dan diencerkan dengan air sampai tanda
3.5.2.2 Pembuatan larutan kerja asam urat 10 ppm, 1 ppm, 30 ppb dan 5 ppb Sebanyak 1,0 mL larutan induk asam urat 1000 ppm dipindahkan ke dalam labu ukur 100 mL secara kuantitatif kemudian diencerkan dengan air sampai tanda batas dan dihomogenkan sehingga larutan yang diperoleh memiliki konsentrasi 10 ppm (5,95 x 10-5M).
Sebanyak 10,0 mL larutan kerja asam urat 10 ppm dipindahkan ke dalam labu ukur 100 mL secara kuantitatif. Diencerkan dengan air sampai tanda batas dan dihomogenkan sehingga larutan yang diperoleh memiliki konsentrasi 1 ppm (5,95 x 10-6M). Larutan ini selalu dibuat baru.
Sebanyak 3,0 mL larutan kerja asam urat 1 ppm dipindahkan ke dalam labu ukur 100 mL secara kuantitatif, dan diencerkan dengan air sampai tanda batas dan dihomogenkan. Larutan yang diperoleh memiliki konsentrasi 30 ppb (1,79 x 10-4M). Larutan ini selalu dibuat baru.
Sebanyak 0,5 mL larutan kerja asam urat 1 ppm dipindahkan secara kuantitatif ke dalam labu ukur 100 mL, dan diencerkan dengan air sampai tanda batas dan dihomogenkan sehingga larutan yang diperoleh memiliki konsentrasi 5 ppb (2,98 x 10-5M). Larutan ini selalu dibuat baru.
3.5.3 Pembuatan HCl 1M
Sebanyak 4 mL HCl 37 % dipindahkan ke dalam labu ukur 50 mL secara kuantitatif, kemudian diencerkan dengan air sampai tanda batas dan dikocok hingga homogen.
3.5.4 Pembuatan polimer, non imprinted polymer (NIP), dan molecularly
imprinted polymer (MIP)
Non imprinted polymer (NIP) dibuat dengan cara mencampurkan anilin,
amonium peroksodisulfat, dan asam urat dengan perbandingan mol 2:1:0,1 (Sreenivasan, 2007). Sebanyak 0,0336 gram asam urat ditambah secara tetes demi tetes dengan 0,4 mL anilin yang telah dilarutkan dalam 7,5 mL HCl, kemudian diaduk menggunakan pengaduk magnetik selama 30 menit pada suhu 500C. Selanjutnya ditambahkan sebanyak 0,5000 gram amonium peroksodisulfat yang telah dilarutkan dengan 25 mL air dan disimpan pada suhu 250C sehingga terbentuk endapan berwarna hijau pekat. Kemudian endapan yang telah terbentuk dicuci dengan HCl 1 M. Setelah itu endapan dikeringkan sehingga terbentuk serbuk NIP yang berwarna hijau pekat. Polimer anilin dibuat dengan cara yang sama dengan NIP tetapi tanpa penambahan asam urat. NIP dan polimer yang telah dibuat dikarakterisasi menggunakan FTIR.
MIP dibuat dengan mencuci 0,0731 gram NIP menggunakan 25 mL air panas selama 20 menit pada suhu 500C kemudian disentrifuge (Arwindah, 2010), dan dilakukan sebanyak 3 kali pengulangan (Lakshmi et.al., 2006). Setelah itu endapan dikeringkan sehingga terbentuk serbuk MIP berwarna hijau pekat. MIP yang telah terbentuk dikarakterisasi menggunakan spektrofotometri FTIR.
3.5.5 Pelapisan MIP pada emas
Sebanyak 0,0050 gram MIP dilarutkan dalam 50 mL dimetil sulfoksida (DMSO) kemudian larutan diambil 20 mL dan dimasukkan ke dalam wadah sampel. Ke dalam wadah lain ditambahkan sebanyak 20 mL larutan 30 ppb dan 2
mL bufer asetat pH 4. Larutan MIP dilapiskan pada elektroda emas secara voltammetri dengan variasi potensial deposisi dari -600 mV sampai dengan 600 mV. Elektroda yang telah dimodifikasi digunakan untuk analisis asam urat 30 ppb. Hasil yang diperoleh dari optimasi potensial deposisi MIP digunakan untuk melakukan optimasi waktu deposisi MIP pada permukaan elektroda emas. Waktu deposisi divariasi dari 30 - 150 detik dengan interval 30 detik.
3.5.6 Uji kinerja elektroda emas-MIP
Elektroda emas termodifikasi MIP digunakan untuk analisis larutan asam urat 5 ppb, kemudian hasilnya dibandingkan dengan hasil analisis asam urat 5 ppb menggunakan elektroda emas, elektroda NIP, dan elektroda emas-PANi.
3.5.7 Optimasi waktu akumulasi asam urat pada elektroda emas-MIP Larutan asam urat 5 ppb sebanyak 20 mL dimasukkan ke dalam wadah sampel dan ditambahkan bufer asetat pH 4 sebanyak 2 mL, kemudian dianalisis secara voltammetri lucutan menggunakan elektroda emas-MIP. Waktu akumulasi divariasi mulai 30 - 150 detik dengan interval 30 detik. Replikasi dilakukan sebanyak tiga kali untuk masing-masing waktu akumulasi.
3.5.8 Pembuatan kurva standar asam urat
Dibuat larutan standar asam urat konsentrasi 1, 2, 3, 4, dan 5 ppb dengan memindahkan secara kuantitatif 50; 100; 150; 200; dan 250 µL larutan kerja asam urat 1 ppm ke dalam labu ukur 50 mL kemudian ditambahkan 2 mL larutan
larutan diambil sebanyak 20 mL kemudian dipindahkan ke wadah sampel dan dianalisis dengan elektroda emas-MIP. Masing-masing pengukuran dilakukan 2 kali pengulangan (duplo). Selanjutnya dibuat kurva standar antara konsentrasi larutan standar asam urat dan arus, kemudian dibuat regresi liniernya.
y = a + bx ... (3.1)
dengan ketentuan y = arus, a = intersep, b = slope, x = konsentrasi larutan standar asam urat.
3.5.9 Uji validitas metode
Validasi metode adalah suatu penilaian terhadap parameter tertentu berdasarkan percobaan laboratorium untuk membuktikan bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya. Validasi metode ini dilakukan untuk mengetahui kelayakan metode yang digunakan. Parameter yang digunakan untuk menyatakan validitas metode antara lain linieritas, presisi, sensitivitas, limit deteksi dan akurasi.
3.5.9.1 Linieritas
Pada penelitian ini linieritas dinyatakan dengan harga koefisien korelasi (r) persamaan regresi kurva standar. Linieritas antara konsentrasi dengan respon arus dikatakan baik apabila harga koefisien korelasi (r) regresi linier mendekati 1 (Miller and Miller, 1988). Adanya korelasi linier antara respon arus dan konsentrasi analit ditunjukkan dengan uji t, kemudian dibandingkan antara harga thitungdan ttabel.
... (3.2) 2 ) 2 (n r thitung
Dengan ketentuan thitung adalah besarnya nilai t yang diperoleh dari perhitungan menggunakan persamaan 3.2, r adalah harga koefisien korelasi dan n adalah jumlah larutan standar yang diukur. Koefisien korelasi diterima jika thitung > ttabel. t tabel adalah nilai t yang diperoleh dari tabel dengan tingkat kepercayaan 95% (p = 0,05%). Koefisien korelasi diterima jika thitung> ttabel.
3.5.9.2 Presisi (ketelitian)
Pada penelitian ini ketelitian ditentukan dengan menghitung simpangan baku (standar deviasi/SD) dan koefisien variasi (KV) arus masing–masing konsentrasi larutan standar.
SD =
1 2
n x xi ... (3.3) KV = x SD x 100% ... (3.4)Dengan ketentuan SD adalah standar deviasi, KV adalah koefisien variasi, xi
adalah arus pada masing–masing pengukuran, x adalah arus rata-rata, dan n adalah jumlah replikasi (Miller and Miller, 1988).
3.5.9.3 Sensitivitas
Sensitivitas pada penelitian ini ditentukan dari nilai slope kurva standar. Semakin besar nilai slope menyatakan bahwa perubahan konsentrasi analit sedikit saja menyebabkan perubahan arus yang besar, sehingga sensitivitas metode dikatakan baik jika harga slope kurva standar tinggi (Miller and Miller, 1988), namun tetap harus mempertimbangkan sinyal noise.
3.5.9.4Limit deteksi
Limit deteksi ditentukan dengan menggunakan data kurva standar yang dihitung dengan persamaan 3.5 dan 3.6.
YLOD = Ybl+ 3Sbl………. (3.5) YLOD = a + 3Sx/y……….. (3.6)
Dengan ketentuan Y LOD adalah sinyal terkecil yang masih terdeteksi, Sbl adalah
Sx/y (standar deviasi sinyal blanko) =
2 ˆ 2
n y yi, Ybl adalah a adalah sinyal
blanko (intersep dari persamaan kurva standar), n adalah jumlah larutan standar yang diukur dan yi adalah rata – rata arus masing – masing pengukuran. Sedangkan yˆ adalah sinyal (arus) yang diperoleh dari mensubtitusi masing-masing konsentrasi larutan standar sebagai nilai x ke persamaan regresi kurva standar. YLOD yang diperoleh kemudian disubstitusikan ke persamaan regresi kurva standar sehingga diperoleh nilai limit deteksi (x) (Miller and Miller, 1988).
3.5.9.5 Akurasi
Akurasi adalah seberapa dekat konsentrasi hasil pengukuran asam urat dengan konsentrasi asam urat yang sebenarnya. Pada penelitian ini dilakukan analisis larutan asam urat 1 – 5 ppb kemudian nilai arus hasil analisis disubtitusikan ke dalam persamaan regresi kurva standar. Akurasi ditentukan menggunakan persamaan 3.7
R = Csp
Dengan ketentuan R adalah persen akurasi, Cspadalah konsentrasi larutan standar yang diperoleh dengan mensubstitusi arus asam urat yang terukur ke dalam persamaan regresi kurva standar, dan Ksadalah konsentrasi standar asam urat.
BAB IV
HASIL DAN PEMBAHASAN
4.1 Pembuatan Polimer, NIP, dan MIP
Non Imprinted Polymer (NIP) dibuat dengan cara mereaksikan monomer
anilin, inisiator amonium peroksodisulfat, dan template asam urat dengan perbandingan mol 2:1:0,1 (Sreenivasan, 2007). Pada pembuatan polimer ini digunakan monomer anilin karena struktur anilin yang mempunyai sisi aktif yang dapat berinteraksi secara elektrokimia dengan gugus karbonil dari asam urat pada saat pelapisan MIP. Polianilin merupakan polimer terkonjugasi yang memiliki kestabilan yang tinggi dan bersifat reversible dalam proses doping-dedoping. Pada penelitian ini digunakan inisiator amonium peroksodisulfat yang merupakan senyawa tidak stabil dan mudah membentuk radikal dengan cara mengoksidasi anilin.
Oksidasi anilin oleh inisiator amonium peroksodisulfat lebih efektif karena adanya HCl yang dapat menambah kelarutan anilin dengan membentuk kation anilinium (Wallace, et.al., 2003). Polimerisasi dilakukan pada suhu 50oC dan diaduk menggunakan pengaduk magnetik selama 30 menit. Kemudian dibiarkan selama 12 jam pada suhu 25oC agar proses polimerisasi terjadi dengan sempurna. Polianilin dan NIP yang terbentuk berupa endapan berwana hijau pekat. NIP yang terbentuk dicuci menggunakan HCl untuk menghilangkan sisa-sisa residu anilin dan (NH4)2S2O8 yang tidak bereaksi (Maddu et al., 2008). Setelah itu endapan dikeringkan sehingga diperoleh serbuk NIP.
Pada pembuatan NIP diduga terjadi ikatan hidrogen antara gugus karbonil (C=O) dari asam urat dan amina sekunder (N-H) dari polianilin. Prakiraan ikatan antara polianilin dan asam urat dapat dilihat pada Gambar 4.1. Foto padatan polianilin dan serbuk NIP yang terbentuk ditampilkan pada Gambar 4.2.
Gambar 4.1 Ikatan yang terbentuk antara polianilin dan asam urat
(a) (b) N H H N O N H NH O O NH NH n HN HN n
Molecularly imprinted polymer (MIP) dibuat dengan cara mengekstrasi
asam urat dari NIP. NIP dalam tabung sentrifuge ditambah 25 mL air panas kemudian disentrifuge untuk memisahkan padatan dan filtrat. Ekstraksi dilakukan sebanyak 3 kali, dengan masing-masing selama 20 menit, pada suhu 50oC. Pada akhir ekstraksi diperoleh endapan berwarna hijau pekat yang kemudian dikeringkan sehingga terbentuk serbuk MIP. Cetakan asam urat pada MIP ditunjukkan pada Gambar 4.3.
Gambar 4.3 Cetakan asam urat pada MIP
4.2 Karakterisasi Polianilin, NIP, dan MIP
Polianilin, NIP, dan MIP yang telah disintesis kemudian dianalisis menggunakan FTIR. Spektra anilin dan polianilin dapat dilihat pada Gambar 4.4.
N H H N O N H NH O O NH NH n HN HN n
Cetakan
MIP
Gambar 4.4
Pada Gambar 4.3 terlihat bahwa terdapat dua puncak pada bilangan gelombang 3371 cm
sekunder (N-H). Sedangkan pada spektrum polianilin sudah tidak terlihat dua puncak pada bilangan gelo
terdapat pita pada bilangan gelombang 1149 cm ikatan C=N terprotonasi.
gelombang 1242 cm
terpolimerisasi menjadi polianilin
% T ˗˗ ˗ 3 4 3 3 ˗˗ ˗ 3 3 7 1
Gambar 4.4 Spektra FTIR anilin dan polianilin (PANi)
Pada Gambar 4.3 terlihat bahwa terdapat dua puncak pada bilangan gelombang 3371 cm-1 dan 3433 cm-1 yang merupakan pita dari gugus amina H). Sedangkan pada spektrum polianilin sudah tidak terlihat dua puncak pada bilangan gelombang sekitar 3300 – 3400 cm-1. Selain itu terdapat pita pada bilangan gelombang 1149 cm-1 yang merupakan serapan dari ikatan C=N terprotonasi. Sedangkan vibrasi stretching C-N terlihat pada bilangan gelombang 1242 cm-1. Sehingga dapat disimpulkan bahwa anilin sudah terpolimerisasi menjadi polianilin.
˗˗ ˗ 1 6 2 0 ˗˗ ˗ 1 1 4 9 ˗˗ ˗ 1 2 7 3 ˗˗ ˗1 6 2 0 ˗˗ ˗1 3 0 3 ˗˗ ˗1 2 4 9 (PANi)
Pada Gambar 4.3 terlihat bahwa terdapat dua puncak pada bilangan dari gugus amina H). Sedangkan pada spektrum polianilin sudah tidak terlihat dua . Selain itu juga yang merupakan serapan dari N terlihat pada bilangan bahwa anilin sudah
NIP MIP Anilin
Pada Gambar 4.5 menunjukkan perbedaan spektra NIP dan MIP. Hal tersebut terlihat pada bilangan gelombang sekitar 1620 cm-1 yang merupakan serapan dari gugus C=C. Sedangkan pita serapan pada daerah sekitar 1303 cm-1 dan 1249 cm-1 masing-masing merupakan serapan dari gugus C-N dan C=N. Namun tidak ada terdapat puncak pada daerah sekitar 1715 cm-1 yang merupakan serapan dari gugus C=O asam urat yang menandakan asam urat belum terikat pada polimer. Hal tersebut mungkin disebabkan karena perbandingan mol anilin, amonium peroksodisulfat, dan asam urat yang kurang tepat. Sehingga diduga tidak terjadi ikatan hidrogen antara asam urat dan PANi. Selain itu analisis FTIR yang tidak kuantitatif menyebabkan pengurangan atau penambahan gugus fungsi tidak dapat menggunakan intentitas spektra. Terbentuknya NIP dan MIP dapat dijelaskan dengan uji kinerja elektroda pada Sub bab 4.5.
4.3 Pelapisan MIP pada Elektroda Emas secara Voltammetri Lucutan Prinsip analisis asam urat menggunakan voltammetri lucutan ini adalah reaksi redoks. Dari reaksi redoks tersebut akan menghasilkan arus yang besarnya tergantung pada konsentrasi analit dalam larutan sampel. Arus tersebut dihasilkan dari aliran elektron pada antarmuka larutan elektrolit dan elektroda kerja (Gunzler and Williams, 2001).
Pada penelitian ini dilakukan analisis asam urat secara voltammetri lucutan menggunakan elektroda emas yang dilapisi dengan MIP. Pada tahap pertama dilakukan optimasi potensial pelapisan MIP yaitu pada rentang -0,60 – 0,60 Volt. Potensial pelapisan adalah potensial yang dipasang pada elektroda kerja emas saat
MIP dilapiskan pada elektroda emas tersebut. Pada optimasi ini digunakan larutan uji asam urat 30 ppb. Puncak asam urat terdeteksi pada potensial 0,196 V dengan potensial pelapisan 0,3 V dan waktu pelapisan 15 detik. Data arus dari masing-masing potensial ditunjukkan pada Tabel 4.1. Sedangkan kurva hubungan arus larutan asam urat 5 ppb dengan potensial pelapisan MIP pada elektroda emas ditampilkan pada Gambar 4.6.
Tabel 4.1 Data hasil analisis asam urat pada berbagai potensial pelapisan MIP pada elektroda emas
No. Potensial akumulasi MIP (V) Arus asam urat (nA) Lebar dasar puncak (cm) Kemiringan dasar puncak (°) 1. -0,6 295,5 8,6 9 2. -0,5 358,3 8,6 8 3. -0,4 445,1 8,5 9 4. -0,3 537,5 8,8 9 5. -0,2 600,3 9,0 11 6. -0,1 685,4 9,2 10 7. 0 1339 9,1 5 8. 0,1 1587 9,2 4 9. 0,2 1786 9,3 3 10. 0,3 1892 9,0 3 11. 0,4 1929 9,0 4 12. 0,5 1861 7,9 5 13. 0,6 1596 9,2 5
Gambar 4.6 Kurva hubungan arus larutan asam urat 5 ppb dengan potensial pelapisan MIP pada elektroda emas
Dari data pada Tabel 4.1 diperoleh rentang potensial kerja yang dijadikan pertimbangan sebagai potensial yang akan digunakan untuk proses analisis selanjutnya yaitu 0,20 – 0,50 V. Hal tersebut dikarenakan pada rentang potensial 0,20 – 0,50 V menghasilkan arus yang besar dengan perbedaan arus yang tidak terlalu jauh. Pertimbangan tersebut berdasarkan empat faktor, yaitu besar sinyal arus, bentuk puncak, lebar dasar puncak (base line) dan kemiringan dasar puncak terhadap sumbu x. Karena memiliki bentuk puncak yang bagus, arus yang besar,
base line yang sempit, dan kemiringan yang kecil, maka pada proses analisis
selanjutnya digunakan potensial 0,3 Volt. Voltammogram asam urat 30 ppb pada potensial pelapisan MIP 0,3 V dapat dilihat pada Gambar 4.7.
0 500 1000 1500 2000 2500 -0,7 -0,5 -0,3 -0,1 0,1 0,3 0,5 0,7 A ru s (n A ) Potensial pelapisan (V)
Gambar 4.7 Voltammogram asam urat 30 ppb pada potensial pelapisan MIP
4.4 Optimasi Waktu Akumulasi Asam Urat pada Elektroda Emas-MIP Optimasi waktu pelapisan dilakukan pada potensial akumulasi 0,3 V dan waktu akumulasi 30 – 150 detik dengan interval 30 detik. Data optimasi waktu pelapisan dapat dilihat pada Tabel 4.3. Sedangkan kurva hubungan arus asam urat dengan waktu akumulasi disajikan pada Gambar 4.8.
Tabel 4.2 Data arus dan potensial puncak hasil analisis asam urat 30 ppb pada berbagai waktu pelapisan MIP
No. Waktu pelapisan MIP (detik) Potensial puncak (V) Arus (nA) 1. 30 0,232 289,5 2. 60 0,226 300,4 3. 90 0,238 366,9 4. 120 0,208 473,1 5. 150 0,202 501,4 0.00 0.20 0.40 0.60 0.80 1.00 U (V) 500n 1.00u 1.50u 2.00u 2.50u I (A) Asam Urat
Gambar 4.8 Kurva hubungan arus asam urat dengan waktu pelapisan MIP pada elektroda emas
Dari data pada Tabel 4.3 dipilih waktu akumulasi 90 detik karena memiliki bemtuk voltammogram bagus, arus besar, lebar dasar puncak kecil, dan kemiringan dasar puncak yang kecil. Waktu akumulasi 150 detik memberikan arus yang paling besar, tetapi tidak dipilih sebagai waktu optimum karena pertimbangan efesiensi waktu. Voltammogram asam urat 30 ppb pada waktu pelapisan MIP 90 detik ditunjukkan oleh Gambar 4.9.
0 100 200 300 400 500 600 0 30 60 90 120 150 180 Ar us (n A)
Gambar 4.9 Voltammogram asam urat 30 ppb pada waktu pelapisan MIP 90
4.5 Uji Kinerja Elektroda Emas-MIP
Uji kinerja elektroda dilakukan dengan menggunakan elektroda emas-MIP untuk menganalisis larutan asam urat 5 ppb pada kondisi potensial dan waktu pelapisan optimum. Selanjutnya hasil analisis asam urat menggunakan elektrode emas-MIP dibandingkan dengan hasil analisis menggunakan elektroda emas, elektroda emas-NIP, dan elektroda emas-PANi. Hasil uji kinerja elektroda ditampilkan pada Tabel 4.3.
Tabel 4.3 Data arus asam urat 5 ppb hasil analisis dengan elektroda emas-MIP, emas-PANi, emas-NIP, dan emas
No. Jenis Elektroda Potensial Puncak
(V) Arus (µA) 1. Emas-PANi 0,220 40,605 2. Emas-NIP 0,226 39,870 3. Emas-MIP 0,120 38,790 4. Emas 0,214 49,610 0 0.20 0.40 0.60 0.80 1.00 U (V) 100n 200n 300n 400n 500 I (A) Asam Urat
Dari data pada Tabel 4.3 terlihat bahwa analisis asam urat menggunakan elektroda emas menghasilkan arus paling besar daripada elektroda yang lain. Hal tersebut dikarenakan luas permukaan elektroda emas yang dapat digunakan untuk kontak dengan analit lebih besar dibanding elektroda yang dilapisi polimer. Dengan demikian jumlah analit yang terakumulasi pada elektroda emas juga banyak, sehingga arus yang dihasilkan dari analisis menggunakan elektroda emas juga besar.
Elektroda emas-PANi menghasilkan arus yang lebih besar daripada elektroda emas-MIP dan emas-NIP. Hal tersebut disebabkan karena PANi memiliki pori-pori yang banyak dan lebar sehingga memungkinkan untuk dimasuki oleh analit, sehingga menghasilkan arus yang besar.
Analisis asam urat menggunakan elektroda emas-NIP seharusnya menghasilkan arus yang lebih kecil, karena sisa asam urat yang belum terekstraksi menyebabkan pori-pori elektroda tertutup oleh asam urat dan menghalangi asam urat dari larutan menuju elektroda emas. Sehingga kontak analit dengan emas menjadi berkurang. Namun, pada penelitian ini analisis asam urat menggunakan elektroda emas-NIP menghasilkan arus yang lebih besar dari elektroda emas-MIP. Hal ini disebabkan oleh asam urat yang belum diekstraksi lepas dari NIP selama proses analisis dan bercampur dengan analit sehingga arus yang terukur semakin bertambah besar.
4.6 Pembuatan Kurva Standar
Kurva standar pada penelitian ini dibuat dari data hasil analisis larutan standar asam urat konsentrasi 1, 2, 3, 4, dan 5 ppb. Analisis dilakukan menggunakan elektroda emas-MIP pada potensial optimum dan waktu akumulasi optimum. Data hasil analisis pengukuran larutan standar asam urat disajikan pada Tabel 4.4. Sedangkan kurva standar asam urat dapat dilihat pada Gambar 4.10. Tabel 4.4 Data hasil analisis larutan standar asam urat
No. Konsentrasi Asam Urat (ppb)
Arus (µA) Arus rata-rata (µA) I II 1. 1 14,12 14,40 14,260 2. 2 14,69 15,50 15,095 3. 3 15,55 15,79 15,670 4. 4 16,18 15,96 16,070 5. 5 17,02 16,16 16,590
Gambar 4.10 Kurva standar asam urat
Pada penelitian ini diperoleh persamaan kurva standar asam urat y = 0,563x + 13,84 dengan koefisien korelasi (r) = 0,9904. Persamaan kurva standar yang diperoleh selanjutnya digunakan untuk uji validitas metode.
y = 0,563x + 13,84 R² = 0,981 14 14,5 15 15,5 16 16,5 17 0 1 2 3 4 5 6 A ru s (µA ) Konsentrasi (ppb)
4.7 Uji Validitas Metode 4.7.1 Linieritas
Linieritas menyatakan hubungan antara konsentrasi asam urat yang dianalisis dengan sinyal arus yang ditimbulkan. Linieritas antara konsentrasi dengan respon arus dinyatakan baik apabila harga koefisien korelasi (r) persamaan regresi linier mendekati 1. Adanya hubungan linier antara respon arus dan konsentrasi analit ditunjukkan dengan uji t. Koefisien korelasi diterima jika thitung > t tabel. Dari hasil penelitian (Lampiran 7) maka diperoleh thitung = 12,4485, sedangkan nilai ttabel= t(3;0;05)= 2,353.
Karena thitung = 12,4485 > ttabel = 2,353 maka disimpulkan bahwa terdapat hubungan linieritas antara konsentrasi dan arus larutan asam urat. Arus larutan semakin meningkat dengan meningkatnya konsentrasi larutan yang dianalisis.
4.7.2 Presisi (ketelitian)
Pada penelitian ini presisi (ketelitian) ditentukan dari harga koefisien variasi (%KV) dan standar deviasi dari hasil pengukuran masing-masing konsentrasi larutan standar asam urat. Harga %KV yang diperoleh pada konsentrasi asam urat 1 – 5 ppb mempunyai rentang 0,9683 % sampai 3,7940 %. Data % KV pada masing-masing konsentrasi larutan standar asam urat dapat dilihat pada Tabel 4.5.
Tabel 4.5 Data % KV hasil pengukuran masing-masing konsentrasi larutan standar asam urat
No. Konsentrasi Asam Urat (ppb) Arus (µA) % KV I II 1. 1 14,12 14,40 1,3884 2. 2 14,69 15,50 3,7940 3. 3 15,55 15,79 1,0830 4. 4 16,18 15,96 0,9683 5. 5 17,02 16,16 3,6655
Harga % KV yang diperoleh tersebut berbeda dari % KV yang diperoleh pada penelitian Tambunan (2010). Dengan metode yang sama, pada penelitian tersebut menghasilkan % KV dengan rentang 7,75 % sampai 12,8 %. Sehingga dapat disimpulkan bahwa penelitian ini mempunyai presisi yang lebih baik karena menghasilkan % KV dengan rentang yang lebih kecil.
4.7.3 Sensitivitas
Pada penelitian ini, sensitivitas ditentukan dari nilai kemiringan (slope) kurva standar. Persamaan kurva standar yang diperoleh adalah y = 0,563x + 13,84. Sehingga dapat disimpulkan bahwa sensitivitas dari metode analisis asam urat secara voltammetri menggunakan elektroda emas-MIP sebesar 7,93 µA/ppb cm-2. Hal ini menunjukkan akan terjadi perubahan arus sebesar 7,93 µA setiap kenaikan konsentrasi asam urat 1 ppb dan luas area 1 cm-2. Hasil tersebut berbeda dengan sensitivitas pada penelitian Tambunan (2010) yaitu sebesar 0,227 μA/ppb. Sehingga dapat disimpulkan bahwa penelitian ini lebih sensitif dibandingkan dengan penelitian Tambunan (2010).
4.7.4 Limit deteksi
Pada penelitian ini limit deteksi adalah konsentrasi asam urat terkecil yang masih dapat dideteksi dengan baik oleh elektroda emas termodifikasi MIP. Limit deteksi ditentukan dari persamaan kurva standar asam urat yang dihitung dengan persamaan 3.5 dan 3.6.
Limit deteksi yang diperoleh pada penelitian ini sebesar 0,7625 ppb yang berarti kadar analit terkecil yang bisa diukur oleh elektroda emas-MIP adalah 0,7625 ppb. Limit deteksi ini lebih kecil daripada limit deteksi yang dihasilkan pada penelitian Zhao et. al (2010) yaitu sebesar 0,336 ppm (2,0 × 10-6 M). Hal tersebut berarti elektroda termodifikasi MIP tidak dapat mengukur konsentrasi asam urat lebih kecil daripada elektroda glassy carbon termodifikasi MIP.
4.7.5 Akurasi
Akurasi menyatakan seberapa dekat konsentrasi asam urat hasil analisis dengan konsentrasi standar yang digunakan. Akurasi semakin baik apabila mendekati 100 %. Pada penelitian ini diperoleh akurasi sebesar 74,60 %, 108,35 %, dan 97,69 % untuk konsentasi asam urat berturut-turut1 ppb, 3 pp, dan 5 ppb. Hasil pengukuran akurasi dapat dilihat pada Tabel 4.6.
Tabel 4.6 Data akurasi hasil pengukuran larutan standar asam urat
No. Konsentrasi asam urat (Ks) Arus rata-rata (µA) Csp Akurasi (%) 1. 1 14,260 0,7460 74,60 2. 3 15,670 3,2504 108,35 3. 5 16,590 4,8846 97,69
mendekati 100 %. Hasil tersebut berbeda dengan penelitian Tambunan (2010) yang mempunyai akurasi sebesar 99,62 % sehingga penelitian ini mempunyai akurasi yang kurang bagus untuk konsentrasi 1 ppb..
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan penelitian yang telah dilakukan, dapat disimpulkan sebagai berikut.
1. Potensial pelapisan optimum MIP pada elektroda emas adalah 0,3 V. Sedangkan waktu pelapisan optimumnya adalah 90 detik.
2. Metode penelitian ini menghasilkan linieritas dengan koefisien korelasi (r) sebesar 0,9904, sensitivitas sebesar 0,563 µA/ppb, % KV dengan 0,9683 % sampai 3,7940 % untuk konsentrasi asam urat 1 – 5 ppb, limit deteksi sebesar 0,7625 ppb, dan akurasi sebesar 74,60 %, 108,35 %, 97,69 % untuk konsentrasi asam urat berturut-turut 1 ppb, 3 ppb, 5 ppb.
5.2 Saran
1. Diperlukan optimasi perbandingan mol anilin, amonium peroksodisulfat, dan asam urat dalam pembuatan PANi, NIP dan MIP.
2. Diperlukan uji pengaruh asam askorbat untuk mengetahui selektivitas elektroda emas termodifikasi MIP dalam analisis asam urat.
3. Diperlukan aplikasi elektroda emas termodifikasi MIP pada sampel serum. 4. Diperlukan pengembangan elektroda yang lebih sensitiv untuk analisis
DAFTAR PUSTAKA
Alexander, C., Andersson, H.S., Andersson, L.I., Ansell, R.J., Kirsch, N., Nicholls, I.A., O’Mahony, J., Whitcombe, M.J., 2006. J. Mol. Recognit. 19, 106–180.
Arwindah, P.R., 2010, Pengembangan Sensor Asam Urat Melalui Modifikasi Elektroda Glassy Carbon Dengan Molecularly Imprinted Polymer Menggunakan Monomer Anilin Secara Voltammetri Lucutan, Skripsi, Universitas Airlangga
Bruggemann, O., 2002, Molecularly imprinted materials–receptors more durable
than nature can provide, Advanced in Biochemical Engineering/Biotechnology, Springer Verlag, Germany
George, S.K., Dipu, M.T., Mehra, U.R., Singh, P., Verma, A.K., and Ramgaokar, J.S., 2006, Improved HPLC Method for the Simultaneous Determination of Allantoin, Uric Acid, and Creatinin in Cattle Urine,
Journal of Chromatography B, 832:134
Gunzler H. and Williams A., 2001, Handbook of Analytical Technique, WILEY-VCH Verlag GmbH, D-69469 Weinheim (Federal Republic of Germany) John, S.A., 2005, Simultaneous Determination of Uric Acid and Ascorbic Acid
Using Glassy Carbon Electrodes in Acetate Buffer Solution, Journal of
Electroanalytical Chemistry, 579:249-256
Hidayat, R., 2009, Gout dan Hiperurisemia, Divisi Reumatologi Departemen Ilmu Penyakit Dalam Fakultas kedokteran Universitas Indonesia RSUPNCM, Jakarta
Khasanah, M., Mudasir, Kuncaka A., Sugiharto E., Supriyanto, G., and Wafiroh, S., 2010, Enhancement of the Sensitivity and Selectivity of the Voltammetric Sensor for Uric Acid Using Molecularly Imprinted Polymer, Indo. J. Chem., 295-300
Komiyama, M., Takeuchi, T., Mukawa, T., and Asanuma, H., 2003, Molecular
Imprinting From Fundamentals to Applications, Wiley-VCH Verlag
GmbH & Co. KgaA (Federal RePublic of Germany)
Lakshmi, D., Prasad, B.B., and Sharma, P.S., 2006, Creatinine Sensor Based on a Molecularly Imprinted Polymer Modified Hanging Mercury Drop Electrode, Talanta, 70:272-280
Marcos, S., Assensio, C., Urunuela, I., Gallarta, F., Galban, J. dan Castillo J.R., 2000, New Approach to Polyaniline Optical Sensors pH, Acetic Acid and Ammonia Determination, Quimica Analitica, 19:99-104
Mark P. O and William R. L, 2004, Analytical Instrumentation Handbook, Second Edition. Departement of Chemistry and Biochemistr, University of Maryland, Baltimore Country, Baltimore, MD, USA
Matos, R. C., Augelli, M. A., Lago, C. L., and Agnes, L, 2000, Flow Injection Analysis-Amperometric Determination Of Ascorbic And Uric Acids In Urine Using Arrays of Gold Microelectrodes Modified By Electrodeposition of Palladium, Anal. Chim. Acta, 404, 151-157
Mendham, J. and Jeney, R.C., 2000, Texbook of Quantitive Chemical Analysis
Chemistry, 6thediton, Singapore Addison Wesley, Longman Singapore Miller, J.C., and Miller, J.N., 1988, Statistic for Analytical Chemistry, 3th edition,
Ellis Horward Limited, New York
Monk, P. M. S., 2001, Fundamental of Electroanalytical Chemistry, Manchester Metropolitan University, Manchester, UK
Odian, G., 2004, Principles of Polymerization, Fourth Edition, John Wiley & Sons, Inc., New Jersey.
O’Neil and Maryadete, J. (editor), 2001, The Merck Index, 13th edition, Published by Merck Research Laboratories
Sci, Pak J Med., 2007, Serum Uric Acid Concentration in Patients With Type 2 Diabetes Melitus During Diet or Glibenclamide Therapy, Original Article, 23:361-365
Sewell, A.C., Murphy, H.C., and Iies, R.A., 2002, Use of Proton Nuclear Magnetic Resonance Spectroscopy in Detection and Study of Organic Acidurias, Clin. Chem., 48, 357-359
Sreenivasan, K., 2007, Synthesis and Evaluation of Molecularly Imprinted Polymers for Nucleic Aic Bases Using Aniline as a Monomer, Reactive
and Functional Polymers, 67:859-864
Tambunan, F. N., 2010, Aplikasi Elektroda Glassy Carbon Termodifikasi Molecularly Imprinted Polymer Menggunakan Monomer Asam Metakrilat untuk Analisis Asam Urat secara Voltammetri, Skripsi, Universitas Airlangga.