PENGEMBANGAN SENSOR VOLTAMMETRIK KREATININ MELALUI
MODIFIKASI ELEKTRODA HANGING MERCURY DROPDENGAN
MOLECULARLY IMPRINTED POLIANILIN
SKRIPSI
AISYAH PUTRI AZHAR
DEPARTEMEN KIMIA
FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS AIRLANGGA
PENGEMBANGAN SENSOR VOLTAMMETRIK KREATININ MELALUI MODIFIKASI ELEKTRODA HANGING MERCURY DROP
DENGAN MOLECULARLY IMPRINTED POLIANILIN
SKRIPSI
Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana Sains Bidang Kimia Pada Fakultas Sains dan Teknologi
Universitas Airlangga
Disetujui oleh:
Pembimbing II,
Dr. rer. nat. Ganden Supriyanto, M. Sc
NIP. 19681228 199303 1 001 Pembimbing I,
Dra. Miratul Khasanah, M. Si
LEMBAR PENGESAHAN NASKAH SKRIPSI
Judul : Pengembangan Sensor Voltammetrik Kreatinin melalui Modifikasi Elektroda Hanging Mercury Dropdengan Molecularly ImprintedPolianilin
Penyusun : Aisyah Putri Azhar
NIM : 080810186
Pembimbing I : Dra. Miratul Khasanah, M. Si
Pembimbing II : Dr. rer. nat. Ganden Supriyanto, M. Sc Tanggal Seminar : 9 Agustus 2012
Disetujui oleh:
Mengetahui:
Pembimbing II,
Dr. rer. nat. Ganden Supriyanto, M. Sc NIP. 19681228 199303 1 001 Pembimbing I,
Dra. Miratul Khasanah, M. Si NIP. 19670304 199203 2 001
Ketua Departemen Kimia
PEDOMAN PENGGUNAAN SKRIPSI
Skripsi ini tidak dipublikasikan, namun tersedia di perpustakaan dalam lingkungan Universitas Airlangga, diperkenankan untuk dipakai sebagai referensi kepustakaan, tetapi pengutipan harus seijin penulis dan harus menyebutkan sumber sesuai kebiasaan ilmiah.
KATA PENGANTAR
Alhamdulillah, segala puji syukur kehadirat Allah SWT yang telah melimpahkan rahmat, taufik serta hidayah-Nya, sehingga penulis dapat menyelesaikan penulisan skripsi dengan judul “Pengembangan Sensor Voltammetrik Kreatinin melalui Modifikasi Elektroda Hanging Mercury
Drop dengan Molecularly Imprinted Polianilin” dengan tepat waktu. Dalam
kesempatan ini, penulis menyampaikan terima kasih yang sebesar-besarnya kepada:
1. Ibu Dra. Miratul Khasanah, M. Si selaku dosen pembimbing I dan Dr. rer. nat. Ganden Supriyanto, M. Sc selaku pembimbing II yang telah meluangkan waktu, tenaga, pikiran, bimbingan serta arahannya dalam menyusun skripsi ini.
2. Ibu Dr. Nanik Siti Aminah, M. Si selaku dosen wali yang selalu senantiasa membimbing dan memberikan masukan selama penulis menempuh kuliah. 3. Ibu Dr. Alfinda Novi Kristanti, DEA selaku Ketua Departemen Kimia
Fakultas Sains dan Teknologi Universitas Airlangga.
4. Ibu Dra. Usreg Sri Handajani, M. Si dan Ibu Dr. Pratiwi Pudjiastuti, M. Si yang telah meluangkan waktu dan pikiran untuk kesempurnaan skripsi ini. 5. Bapak dan Ibu dosen lain yang membantu memberikan informasi untuk
penelitian ini.
6. Kedua orang tua, ayah dan bunda, yang telah memberikan motivasi kepada penulis.
7. Dan kepada semua pihak yang telah membantu dalam penulisan skripsi ini. Penulis menyadari bahwa penulisan skripsi ini masih jauh dari sempurna, oleh karena itu penulis mengharapkan saran dan kritik demi kesempurnaan penulisan skripsi ini. Semoga skripsi ini bermanfaat bagi semua pihak. Amin.
Azhar, Aisyah Putri. 2012. Pengembangan Sensor Voltammetrik Kreatinin Melalui Modifikasi Elektroda Hanging Mercury Drop Dengan Molecularly Imprinted Polianilin. Skripsi di bawah bimbingan Dra. Miratul Khasanah M. Si dan Dr. rer. nat Ganden Supriyanto M. Sc. Departemen Kimia, Fakultas Sains dan Teknologi Universitas Airlangga, Surabaya
ABSTRAK
Penelitian ini bertujuan untuk mengembangkan sensor voltammetrik kreatinin melalui modifikasi elektroda hanging mercury dropdengan molecularly imprinted polimer (HMD-MIP). Produk sebelum pembuatan MIP adalah non imprinted polymer (NIP). Pembuatan NIP dilakukan dengan cara mereaksikan anilin, ammonium peroksodisulfat, dan kreatinin. Endapan NIP kemudian diekstraksi untuk menghilangkan kreatinin dari jaringan polimer sehingga terbentuk cetakan kreatinin, produk hasil ekstraksi tersebut adalah MIP. Ekstraksi kreatinin dilakukan dengan air panas. Parameter validitas metode meliputi linieritas, presisi, sensitivitas, limit deteksi, dan akurasi. Dari hasil penelitian ini diperoleh koefisien korelasi (r) sebesar 0,9985, harga KV antara 2,04% hingga 13,44% untuk konsentrasi 1-5 ppb, sensitivitas metode sebesar 3,47 x 104nA/ ppb.cm2 dengan limit deteksi 0,2787 ppb dan akurasi untuk konsentrasi 1-5 ppb tersebut sebesar 95,64-105,61%
Azhar, Aisyah Putri. 2012. Development of Voltammetric Sensor Through a Modification Hanging Mercury Drop Electrode with Molecularly Imprinted Polyaniline. The final research is under guidance of Dra. Miratul Khasanah M. Si and Dr. rer. nat Ganden Supriyanto M. Sc. Department of Chemistry, Faculty Science and Technology Airlangga University, Surabaya.
ABSTRACT
This research aim to develop voltammetric sensor of creatinine through a modification hanging mercury drop electrode with molecularly imprinted polymer (HMD-MIP). The initially product before MIP is non imprinted polymer (NIP). NIP was made by reacting aniline, ammonium peroxodisulphate and creatinine. MIP was made by creatinine extraction from polymer network. Creatinine extraction was done by using hot water. Validation parameter determined are linierity, precision, sensitivity, limit of detection, and accuracy. Result of this research was obtained correlation factor (r) 0,9985, the range coefficient of variation between 2,04% to 13,44% for creatinine’s concentration 1-5 ppb, a low of detection limit is 0,2787 ppb, sensitivity method is 3,47 x 104nA/ ppb.cm2 and accuracy for creatinine’s concentration 1-5 ppb is 95,64-105,61%
DAFTAR ISI
Halaman
LEMBAR JUDUL... i
LEMBAR PENGESAHAN ... ii
LEMBAR PENGESAHAN……….. iii
PEDOMAN PENGGUNAAN SKRIPSI……… iv
KATA PENGANTAR……… v
BAB I PENDAHULUAN... 1
1.1 Latar Belakang Permasalahan... 1
1.2 Rumusan Masalah... 4
1.3 Tujuan Penelitian……….………. 4
1.4 Manfaat Penelitian... 5
BAB II TINJAUAN PUSTAKA………. 6
2.1 Kreatinin……… 6
2.1.1 Gambaran umum kreatinin……… 6
2.1.2 Analisis kreatinin………..………. 7
2.5 Moleculary Imprinted Polymer(MIP)……… 14
BAB III METODE PENELITIAN……… 15
3.1 Tempat dan Waktu Penelitian………. 15
3.2 Bahan Penelitian………..……….. 15
3.3 Peralatan Penelitian………..……….. 15
3.4 Skema Kerja………... 16
3.5 Prosedur Penelitian……….. 16
3.5.1 Pembuatan larutan kreatinin……… 16
3.5.1.1 Pembuatan larutan induk kreatinin 1000 ppm………. 16
3.5.1.2 Pembuatan larutan kerja kreatinin 10 ppm, 1 ppm, 30 ppb, 1 ppb……… 17
3.5.2 Pembuatan larutan HCl 1M……… 17
3.5.3.1 Pembuatan polianilin (PANi)……..……… 17
3.5.3.2 Pembuatan non imprinted polymer (NIP)………..…... 18
3.5.4 Pembuatan molecularly imprinted polymer(MIP).…18 3.5.5 Optimasi potensial pelapisan MIP pada elektroda hanging mercury drop(HMD)……… 19
3.5.6 Optimasi parameter analisis kreatinin dengan elektroda HMD-MIP……… 19
3.5.7 Uji kinerja elektroda yang telah dimodifikasi… 19 3.5.8 Pembuatan kurva standar……… 20
3.5.9 Uji validitas metode……… 20
BAB IV HASIL DAN PEMBAHASAN……… 24
4.1 Sintesis Polianilin (PANi), Non Imprinted Polymer(NIP), dan Molecularly Imprinted Polymer(MIP)………. 24
4.1.1 Sintesis Polianilin (PANi)………. 24
4.1.2 Sintesis non imprinted polymer(NIP)………….. 25
4.1.3 Sintesis molecularly imprinted polymer (MIP)…. 26 4.2 Karakterisasi PANi, NIP, dan MIP dengan FTIR……….. 26
4.2.1 Perbandingan spektra Anilin dan PANi……….. 26
4.2.2 Perbandingan spektra NIP dan MIP……….. 27
4.3 Optimasi Parameter Analisis Kreatinin dengan Elektroda HMD-MIP………. 30
4.3.1 Optimasi potensial pelapisan MIP pada elektroda HMD………. 30
4.3.2 Optimasi waktu akumulasi kreatinin pada elektroda HMD-MIP……… 32
4.4 Uji Kinerja Elektroda Modifikasi……… 34
4.5 Pembuatan Kurva Standar Kreatinin………. 36
4.6 Uji Validitas Metode………. 37
4.6.1 Linieritas……… 37
4.6.2 Presisi……… 37
4.6.3 Sensitivitas………. 38
4.6.4 Limit deteksi……… 39
4.6.5 Akurasi……….. 39
BAB V KESIMPULAN DAN SARAN………. 40
5.1 Kesimpulan……… 40
5.2 Saran……… 40
DAFTAR PUSTAKA……… 41
DAFTAR GAMBAR
Nomor Judul Gambar Halaman
2.1 Struktur kreatinin 6
2.2 Rumus bangun polianilin 13
2.3 Reaksi pembentukan emeraldine salt 13
2.4 Proses pembentukan MIP 14
4.1 Spektra FTIR Anilin dan PANi 26
4.2 Spektra FTIR NIP dan MIP 28
4.3 Ikatan hidrogen antara kreatinin dan PANi 29 4.4 Grafik hubungan antara potensial pelapisan 31
MIP pada elektroda HMD dengan arus kreatinin 30 ppb
4.5 Voltammogram kreatinin 30 ppb pada 32 potensial pelapisan MIP 0 V
4.6 Grafik hubungan antara waktu akumulasi 33 kreatinin dengan arus kreatinin 5 ppb
4.7 Voltammogram waktu akumulasi kreatinin 34 5 ppb selama 60 detik
DAFTAR TABEL
Nomor Judul Tabel Halaman
4.1 Perbandingan bilangan gelombang puncak 27 spektra Anilin dan PANi
4.2 Perbandingan bilangan gelombang puncak 28 spektra NIP dan MIP
4.3 Data hasil analisis kreatinin hasil optimasi 31 potensial pelapisan MIP pada elektroda
HMD
4.4 Data hasil optimasi waktu akumulasi 33 kreatinin 5 ppb pada elektroda HMD-MIP 4.5 Data hasil analisis kreatinin 5 ppb pada uji 35
kinerja elektroda modifikasi
4.6 Data hasil analisis larutan standar kreatinin 36 4.7 Data nilai koefisien variasi (KV) pada 38
DAFTAR LAMPIRAN
Nomor Judul Lampiran
1 Spektrum FTIR Anilin
2 Spektrum FTIR PANi
3 Spektrum FTIR NIP
4 Spektrum FTIR MIP
5 Voltammogram optimasi potensial pelapisan MIP pada elektroda HMD
6 Voltammogram optimasi waktu akumulasi kreatinin 5 ppb pada elektroda HMD-MIP
7 Voltammogram uji kinerja elektroda modifikasi
8 Voltammogram hasil analisis larutan standar kreatinin pada kondisi optimum
9 Perhitungan pembuatan larutan kreatinin 10 Perhitungan Linieritas kurva standar 11 Perhitungan Presisi (ketelitian) 12 Perhitungan Sensitivitas
13 Perhitungan Limit deteksi metode analisis
BAB I
PENDAHULUAN
1.1 Latar Belakang Permasalahan
Ginjal merupakan organ penting yang berfungsi membuang bahan sampah
tubuh dari hasil pencernaan maupun hasil proses metabolisme. Ginjal bekerja
menyaring plasma dan memindahkan zat dari filtrat pada kecepatan yang
bervariasi, tergantung pada kebutuhan tubuh. Ginjal akan membuang zat yang
tidak diinginkan dari filrat dengan mengekskresikannya dalam urin sedangkan zat
yang masih dibutuhkan akan dikembalikan ke dalam darah. Produk metabolisme
yang dikeluarkan ginjal meliputi urea, asam urat, produk hasil pemecahan
hemoglobin (seperti bilirubin), dan kreatinin (Guyton and Hall, 1997)
Kadar kreatinin yang rendah dapat menunjukkan status nutrisi yang rendah (Tietze, 2003). Kadar kreatinin yang tinggi dalam serum dapat dijadikan sebagai indikator beberapa kerusakan ginjal seperti nekrosis tubulus (penyebab gagal ginjal akut), glomerulonefritis (kerusakan pada glomerulus), dan sebagai petunjuk rendahnya kemampuan filtrasi glomerulus (Baron, 1992; Levey et al., 1999; Stevens and Levey, 2004).
Metode yang digunakan untuk analisis kreatinin serum dalam bidang
pada panjang gelombang 492 nm. Metode tersebut menunjukkan linieritas hingga konsentrasi 5 mg/ 100 mL (50.000 ppb) (Meiyanto et al., 2010)
Metode voltammetri banyak diaplikasikan di bidang kesehatan dan
biomedis. Dalam bidang biomedis metode voltammetri banyak diaplikasikan
untuk pengukuran senyawa-senyawa yang kadarnya dalam tubuh harus selalu
dikontrol seperti asam urat, kreatin, dan kreatinin. Keunggulan voltammetri
diantaranya adalah memiliki limit deteksi yang rendah, sensitivitas tinggi, waktu
analisis relatif cepat dan sedikit membutuhkan preparasi sampel (Wang, 2000).
Elektroda merupakan komponen terpenting pada teknik voltammetri. Sensitivitas metode elektroanalisis salah satunya ditentukan oleh jenis elektroda yang digunakan. Untuk meningkatkan sensitivitas elektroda maka seringkali diperlukan modifikasi terhadap elektroda tersebut.
Penggunaan MIP yang terbuat dari campuran monomer melamin dan kloranil sebagai bahan untuk memodifikasi elektroda HMD untuk analisis kreatinin secara voltammetri telah dikembangkan oleh Lakshmi et al., (2006). Hasil penelitian tersebut menunjukkan respon arus linier pada rentang konsentrasi 0,0025-84,0 x 103 ppb dan limit deteksi yang diperoleh adalah 1,49 ppb. Sensor tersebut juga mempunyai tingkat selektivitas tinggi untuk kreatinin tanpa diganggu oleh keberadaan NaCl, urea, kreatin, glukosa, fenilalanin, tirosin, histidin dan sitosin.
Pada penelitian ini dilakukan pengembangan sensor kreatinin dengan cara memodifikasi elektroda HMD dengan MIP (HMD-MIP) secara voltammetri lucutan. Perbedaan penelitian ini dengan penelitian Lakshmiet al., (2006) terletak pada monomer yang digunakan. Monomer yang digunakan adalah anilin dengan ammonium peroksodisulfat sebagai insiator. Arwindah (2010) memodifikasi glassy carbon dengan MIP menggunakan monomer anilin untuk menganalisis asam urat. Pada penelitian tersebut menghasilkan limit deteksi 0,323 ppb dengan sensitivitas metode sebesar 0,96 µA/ ppb.
voltammogram dan respon arus yang diperoleh dari analisis larutan kreatinin dengan konsentrasi yang sama menggunakan elektroda HMD, HMD-non imprinted polymer(NIP) dan HMD-PANi. Uji validitas metode meliputi linieritas, presisi, sensitivitas, limit deteksi dan akurasi metode juga dilakukan untuk analisis kreatinin 1-5 ppb dengan menggunakan elektroda modifikasi HMD-MIP.
1.2 Rumusan Masalah
Berdasarkan latar belakang permasalahan, dapat dirumuskan masalah sebagai berikut.
1. Berapa potensial pelapisan optimum MIP pada elektroda HMD?
2. Berapa waktu akumulasi optimum kreatinin pada elektroda modifikasi HMD-MIP secara voltammetri lucutan?
3. Berapa linearitas, presisi, sensitivitas, limit deteksi, dan akurasi metode analisis kreatinin secara voltammetri lucutan menggunakan elektroda modifikasi HMD-MIP?
1.3 Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. mengetahui potensial pelapisan optimum MIP pada elektroda HMD
3. mengetahui validitas metode meliputi linieritas, presisi, sensitivitas, limit deteksi, dan akurasi metode voltammetri lucutan menggunakan elektoda modifikasi HMD-MIP
1.4 Manfaat Penelitian
Manfaat untuk bidang biomedis dan kesehatan :
Diperoleh sensor sensitif terhadap kreatinin sehingga dapat menjadi alternatif pada pengukuran kreatinin, mendampingi teknik spektrofotometri yang selama ini digunakan di bidang biomedis dan kesehatan.
Manfaat untuk pengembangan ilmu pengetahuan:
N H N
O
CH3
NH
BAB II
TINJAUAN PUSTAKA
2.1 Kreatinin
2.1.1 Gambaran umum kreatinin
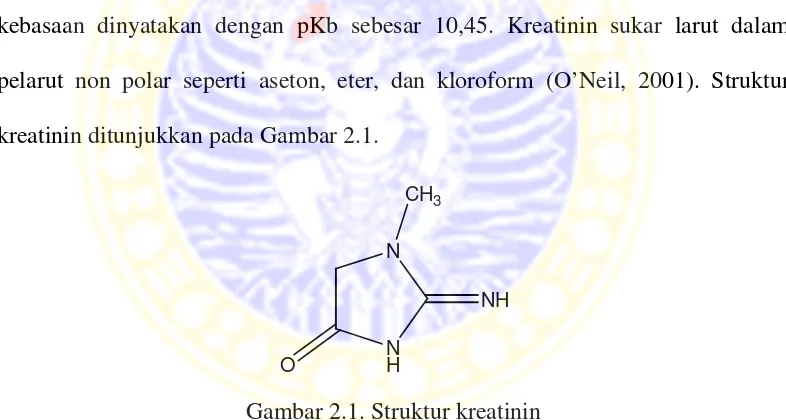
Kreatinin mempunyai mempunyai rumus molekul C4H7N3O. Nama lain kreatinin adalah 2-amino-1,5-dihidro-1-metil-4H-imidazol-4-on dan 2-amino-1-metil-4-imidazolidinon. Komposisi penyusun kreatinin yaitu 42,47% C; 6,24% H; 37,15% N; 14,14% O. Massa molekul relatif (Mr) sebesar 113,12 g/ mol. Tingkat kebasaan dinyatakan dengan pKb sebesar 10,45. Kreatinin sukar larut dalam pelarut non polar seperti aseton, eter, dan kloroform (O’Neil, 2001). Struktur kreatinin ditunjukkan pada Gambar 2.1.
Gambar 2.1. Struktur kreatinin
normal adalah 0,7 hingga 1,5 mg/dL dan jika nilai kreatinin serum di atas 1,5 mg/dL menunjukkan terjadinya efisiensi (Ansel, 2004). Untuk bayi, kadar kreatinin normal sebesar 0,22 hingga 1,01 mg/dL, untuk anak-anak sebesar 0,22 hingga 0,79 mg/dL dan untuk remaja adalah 0,45 hingga 1,01 mg/dL (Gill, 2000).
2.1.2 Analisis kreatinin
Metode yang digunakan untuk analisis kreatinin di bidang biomedis saat ini adalah metode Jaffe Reaction. Analisis kreatinin dengan metode ini menggunakan spektrofotometer ultraviolet-sinar tampak (UV-Vis) untuk menganalisis kadar kreatinin. Pada prosesnya penentuan kadar kreatinin dengan metode tersebut memerlukan larutan pikrat-basa tanpa deproteinisasi. Larutan bufer dan asam pikrat direaksikan pada suhu 20-370C (bufer dan larutan asam pikrat sebelumnya dibiarkan hingga mencapai suhu kamar). Perlakuan yang sama dilakukan untuk larutan sampel dan pengukuran dilakukan pada panjang gelombang 492 nm. Metode tersebut menunjukkan linieritas hingga konsentrasi 50μg/ mL (Meiyanto et al., 2010)
Metode yang saat ini tengah banyak dikembangkan untuk analisis kratinin adalah voltammmetri. Lakhsmi et al., (2006) melakukan analisis kreatinin menggunakan elektroda HMD termodifikasi polimelamin ko-kloranil sebagai monomer. Hasil penelitian tersebut menunjukkan respon arus linier pada rentang konsentrasi 0,0025-84,0 µg/ mL dan limit deteksi yang diperoleh adalah 1,49x10-3
μg/ mL. Sensor termodifikasi tersebut juga mempunyai tingkat selektivitas yang tinggi untuk kreatinin. Analisis tidak diganggu oleh keberadaan NaCl, urea, kreatin, glukosa, fenilalanin, tirosin, histidin dan sitosin.
2.2 Voltammetri
Voltammetri merupakan bagian dari metode elektrometri yang memberikan informasi tentang konsentrasi analit dengan sinyal potensial. Pada voltammetri bagian terpentingnya adalah elektroda kerja. Elektroda kerja tersebut berupa microelectrodes, dimana permukaannya berukuran milimeter dan banyak dalam penelitian menggunakan elektroda dengan ukuran mikrometer.
2.2.1 Voltammetri lucutan
Metode voltammetri lucutan adalah salah satu pengembangan proses metode voltammetri. Metode ini berdasarkan pengukuran arus difusi yang timbul ketika analit yang terdeposit pada elektroda kerja mengalami reaksi oksidasi atau reduksi pada potensial tertentu. Proses yang terjadi pada voltammetri lucutan adalah akumulasi dan lucutan analit dari elektroda. Tahap akumulasi merupakan tahapan terakumulasinya analit pada permukaan elektroda. Sedangkan lucutan adalah tahap dimana lepasnya analit dari permukaan elektroda ke dalam larutan. Pengukuran analit terjadi pada saat lucutan yang menimbulkan arus dan ditampilkan dalam bentuk voltammogram yang menyatakan hubungan antara arus dan potensial (Wang, 1985).
transfer massa akan terhenti walaupun masih tersisa analit dalam larutan (Zen et al., 1998).
2.2.2 Elektroda
Elektroda merupakan detektor terhadap suatu analit yang akan direspon pada analisis secara voltammetri. Sel voltammetri terdiri dari tiga macam elektroda, yaitu elektroda kerja (working electrode), elektroda pembanding (reference electrode), dan elektroda pembantu (counter electrode) (Skoog, 1985).
Elektroda kerja merupakan elektroda yang berperan sangat penting pada analisis. Elektoda kerja yang ideal harus sesuai dengan analitnya, mempunyai luas permukaan yang reproducible serta mempunyai arus background yang rendah. Pada voltammetri lucutan, elektroda kerja yang sering digunakan adalah elektroda HMD maupun elektroda padat seperti emas, glassy-carbon dan grafit (Wang, 1985).
Elektroda HMD adalah elektroda kerja yang sangat populer untuk voltammetri lucutan. Desain elektroda HMD mengalami perkembangan beberapa tahun ini. Kelebihan dari elektroda HMD adalah terkait dengan pengurangan ion hidrogen yang bisa mengganggu analisis (Skoog et al., 1996). Elektroda padat mempunyai kekurangan jika elektrodanya rusak, tidak dapat digunakan untuk analisis lagi. Elektroda HMD memberikan solusi untuk kekurangan tersebut karena apabila tetesan merkuri rusak, tetesan tersebut akan jatuh dan digantikan oleh tetesan merkuri yang baru.
elektroda pembanding adalah elektroda Ag/AgCl. Elektroda tersebut dapat dibuat dengan mencelupkan kawat perak ke dalam larutan jenuh KCl atau dengan mengelektrolisis kawat perak dengan larutan AgCl sehingga didapatkan lapisan tipis AgCl pada permukaan kawat perak (Skoog, 1985).
Elektoda pembantu merupakan elektroda yang berpasangan dengan elektroda kerja tetapi tidak berperan pada penentuan potensial. Contoh dari elektroda pembantu yang sering digunakan adalah emas, platinum, karbon, atau bahan yang bersifat inert secara elektrokimia (Taylor, 1994).
2.3 Polimer
Polimer adalah salah satu bahan rekayasa bukan logam yang berperan penting dalam berbagai bidang. Saat ini bahan polimer telah banyak digunakan sebagai bahan substitusi untuk logam terutama karena sifat-sifatnya yang ringan, tahan korosi dan kimia, dan murah, khususnya untuk aplikasi-aplikasi pada temperatur rendah. Hal lain yang banyak menjadi pertimbangan penggunan polimer adalah daya hantar listrik dan panas yang rendah, kemampuan untuk meredam kebisingan, warna dan tingkat transparansi yang bervariasi, kesesuaian desain dan manufaktur.
biasanya ditentukan secara statistik dalam bentuk rata-rata berat molekul atau distribusi berat molekulnya.
Proses pembentukan rantai molekul polimer dari unit-unit molekul terkecilnya (mer atau meros) melibatkan reaksi yang kompleks. Proses polimerisasi tersebut yang secara umum dapat dikelompokkan menjadi dua jenis reaksi, yaitu polimerisasi adisi dan polimerisasi kondensasi. (Saptono, 2008)
Polimerisasi adisi adalah ikatan antar monomer berdasarkan reaksi adisi. Polimerisasi adisi terjadi pada monomer-monomer yang mempunyai ikatan rangkap. Adanya katalisator akan membuat ikatan rangkap dari monomer terbuka sehingga dapat berikatan dengan monomer lainnya (Oxtoby, 2003)
Polimerisasi kondensasi merupakan polimerisasi dengan melepaskan molekul kecil seperti H2O dan NH3 agar dapat berikatan dengan monomer-monomernya sehingga membentuk ikatan polimer. Polimer kondensasi terjadi pada monomer yang mempunyai gugus fungsi pada kedua rantainya (Oxtoby, 2003)
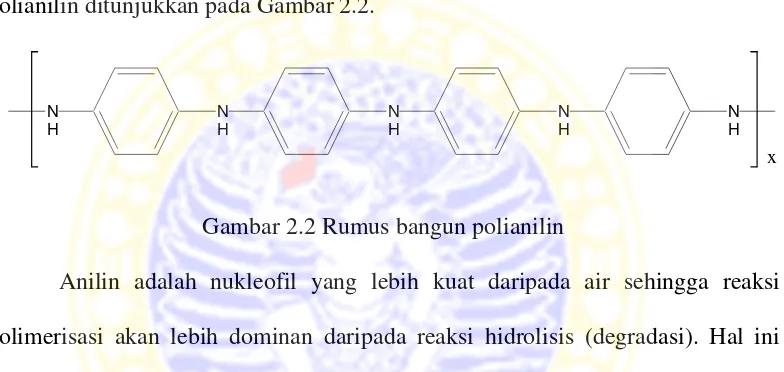
2.4 Polianilin (PANi)
NH2
1995). Rekayasa konduktifitas suatu PANi dapat diketahui dari tiga tingkat oksidasi dan doping elektron yang dapat ditempuh. Keadaan tereduksi penuh disebut leucomeraldine, tahapan teroksidasi sebagian disebut emeraldine, sedangkan tahapan teroksidasi penuh disebut pernigraniline. Pada tahapan emeraldine, paling banyak diteliti karena konduktivitasnya bisa diatur sedangkan bentuk leucomeraldine dan pernigraniline tidak dapat dibuat konduktif. Struktur polianilin ditunjukkan pada Gambar 2.2.
Gambar 2.2 Rumus bangun polianilin
Anilin adalah nukleofil yang lebih kuat daripada air sehingga reaksi polimerisasi akan lebih dominan daripada reaksi hidrolisis (degradasi). Hal ini dapat mendorong pertumbuhan autokatalitik dari polimer. Reaksi pembentukan emeraldine saltdapat dilihat pada Gambar 2.3 berikut (Wibowo, 2007):
+ 2n HCl + 5n H2SO4+ 2n (NH4)2S2O8
Gambar 2.3. Reaksi pembentukan emeraldine salt(ES)
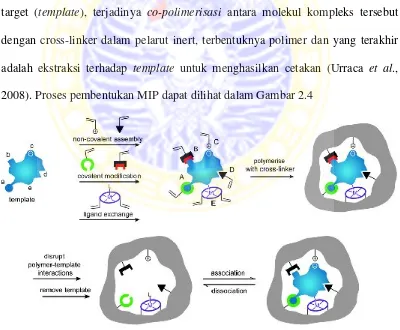
2.5Molecularly Imprinted Polymer(MIP)
Molecularly imprinted polymer (MIP) merupakan teknik pengenalan material yang dapat dibuat dengan mereaksikan polimer dengan analit melalui pembentukan cetakan yang spesifik. Dikembangkannya MIP sebagai sensor selektif karena mempunyai pengikatan yang spesifik sesuai dengan struktur molekul target. Kelebihan MIP yaitu mempunyai kestabilan yang bagus, pembuatannya memerlukan biaya relatif murah, selektif, dan mampu bekerja dalam berbagai media (Lakshmi et al., 2006). Ada 4 tahap utama dalam pembuatan MIP yaitu, pembentukan kompleks antara monomer dengan molekul target (template), terjadinya co-polimerisasi antara molekul kompleks tersebut dengan cross-linker dalam pelarut inert, terbentuknya polimer dan yang terakhir adalah ekstraksi terhadap template untuk menghasilkan cetakan (Urraca et al., 2008). Proses pembentukan MIP dapat dilihat dalam Gambar 2.4
BAB III
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Kimia Analitik dan Laboratorium Instrumentasi, Departemen Kimia, Fakultas Sains dan Teknologi Universitas Airlangga dan Laboratorium MIPA bersama Universitas Negeri Surabaya mulai bulan Februari-Juni 2012.
3.2 Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini adalah kreatinin, anilin, asam klorida, ammonium peroksodisulfat, dimetil sulfoksida. Air yang digunakan adalah akuabides. Semua bahan kimia berderajat kemurnian pro analisis.
3.3 Peralatan Penelitian
3.4 Skema Kerja
3.5 Prosedur Penelitian
3.5.1 Pembuatan larutan kreatinin
3.5.1.1 Pembuatan larutan induk kreatinin 1000 ppm
Larutan induk kreatinin 1000 ppm dibuat dengan cara menimbang 0,1000 g kreatinin secara teliti lalu dilarutkan dengan 30 mL air panas dalam gelas beker 100 mL. Setelah dingin, larutan dipindahkan secara kuantitatif ke dalam labu ukur
HMD, HMD-NIP,
HMD-PANi, HMD-MIP Preparasi larutan kreatinin, monomer dan
porogen
FTIR Sintesis dan karakterisasi Polianilin (PANi)
dan non imprinted polymer(NIP)
Pelapisan MIP pada elektroda HMD
Uji kinerja elektroda Optimasi parameter analisis kreatinin
100 mL dan diencerkan dengan air hingga tanda batas kemudian dikocok hingga homogen.
3.5.1.2 Pembuatan larutan kerja kreatinin 10 ppm, 1 ppm, 30 ppb, dan 1 ppb
Larutan kerja 10 ppm dibuat dengan cara memipet 1,0 mL larutan induk kreatinin 1000 ppm dan dipindahkan ke dalam labu ukur 100 mL. Larutan diencerkan dengan air sampai tanda batas dan dikocok hingga homogen.
Larutan kerja 1 ppm dibuat dengan cara memipet 10,0 mL larutan kerja kreatinin 10 ppm kemudian dipindahkan ke dalam labu ukur 100 mL. Larutan diencerkan dengan air sampai tanda batas dan dikocok hingga homogen.
Larutan kerja 30 ppb dibuat dengan cara memipet 3,0 mL larutan kerja kreatinin 1 ppm kemudian dipindahkan ke dalam labu ukur 100 mL. Larutan diencerkan dengan air sampai tanda batas dan dikocok hingga homogen.
Larutan kerja 5 ppb dibuat dengan cara memipet 0,5 mL larutan kerja kreatinin 1 ppm kemudian dipindahkan ke dalam labu ukur 100 mL. Larutan diencerkan dengan air sampai tanda batas dan dikocok hingga homogen.
3.5.2 Pembuatan larutan HCl 1M
Sebanyak 4 mL HCl 37% dimasukkan dalam gelas beker yang telah berisi 20 mL air kemudian diencerkan dengan air hingga volume 50 mL.
3.5.3 Pembuatan polimer dan non imprinted polymer(NIP)
3.5.3.1 Pembuatan polianilin (PANi)
cara melarutkan 0,5 g peroksodisulfat dalam 2,5 mL air) tetes demi tetes dan pengadukan diperlambat. Polimer anilin (PANi) yang terbentuk lalu dicuci dengan HCl 1 M kemudian dikeringkan. Polimer yang terbentuk dikarakterisasi dengan FTIR.
3.5.3.2 Pembuatan non imprinted polymer(NIP)
Pada penelitian ini digunakan monomer anilin, inisiator ammonium peroksodisulfat, dan sebagai template adalah kreatinin. Non imprinted polymer (NIP) dibuat dengan cara mencampurkan monomer, inisiator, dan template (analit) dengan perbandingan mol 2:1:0,1 (Sreenivasan, 2007). Sebanyak 0,4 mL anilin dalam 7,5 mL HCl 1M ditambahkan dengan kreatinin sebanyak 0,0247 g, kemudian diaduk dengan pengaduk magnetik selama 30 menit pada suhu 500C. Setelah itu ditambahkan larutan ammonium peroksodisulfat (terbuat dari 0,5 g peroksodisulfat dalam 2,5 mL air) tetes demi tetes, dengan diperlambatnya pengadukan. NIP yang terbentuk dikeringkan pada suhu 200C selama 12 jam kemudian endapan NIP dicuci dengan HCl 1 M. NIP yang telah dibuat lalu dikarakterisasi dengan FTIR.
3.5.4 Pembuatan molecularly imprinted polymer(MIP)
3.5.5 Optimasi potensial pelapisan MIP pada hanging mercury drop
electrode(HMDE)
Sebanyak 0,005 g MIP dilarutkan dalam 50 mL dimetil sulfoksida (DMSO) (Arwindah, 2010) kemudian larutan ini dimasukkan dalam sel elektrokimia. Kemudian MIP dilapiskan pada elektroda HMD secara electroplating pada potensial pelapisan yang divariasi dan waktu akumulasi tertentu. Pelapisan elektroda potensial divariasi dari (–)1000 mV sampai dengan 600 mV (interval 100 mV) dengan waktu pelapisan MIP selama 15 detik dan waktu akumulasi kreatinin 30 ppb selama 15 detik.
3.5.6 Optimasi parameter analisis kreatinin dengan elektroda HMD-MIP
Dipipet 20,0 mL larutan MIP dan dimasukkan ke dalam wadah pertama kemudian dipipet pula sebanyak 20,0 mL larutan kreatinin 5 ppb dan dimasukkan ke dalam wadah kedua. Pertama-tama dilakukan pelapisan MIP pada elektroda HMD dengan potensial optimum yang telah ditentukan sebelumnya. Setelah waktu pelapisan berjalan 120 detik (Lakshmi et al., 2006) kemudian ditekan “hold” pada tampilan layar dan wadah pertama yang berisi MIP diganti dengan wadah kedua yang berisi kreatinin lalu ditekan ”continue” pada tampilan layar untuk melanjutkan analisis. Dilakukan optimasi waktu akumulasi optimum kreatinin pada elektroda HMD-MIP dengan variasi waktu 15-120 detik (interval 15 detik).
3.5.7 Uji kinerja elektroda yang telah dimodifikasi
dengan potensial dan arus yang diperoleh dengan menggunakan elektroda HMD, HMD-non imprinted polymer (HMD-NIP) dan HMD-PANi.
3.5.8 Pembuatan kurva standar
Dibuat larutan standar dengan membuat variasi konsentrasi kreatinin, yaitu 1, 2, 3, 4 dan 5 ppb dengan cara menambahkan 50, 100, 150, 200 dan 250 L larutan kerja kreatinin 1 ppm pH 7 (Lakshmi et al., 2006) ke dalam labu ukur 50 mL kemudian diencerkan dengan air sampai tanda batas. Diambil 20 mL dari masing-masing larutan kemudian dipindahkan ke dalam wadah sampel dan dianalisis secara voltammetri lucutan menggunakan elektroda HMD yang telah dilapisi MIP pada kondisi parameter optimum. Pada masing-masing konsentrasi dilakukan pengulangan pengukuran sebanyak dua kali. Data yang diperoleh dibuat kurva hubungan konsentrasi larutan standar kreatinin dengan arus, kemudian dibuat regresi liniernya.
y = a + bx….………….(3.1)
dengan ketentuan y = arus, a = intersep, b = slope, x = konsentrasi larutan standar kreatinin.
3.5.9 Uji validitas metode
Linieritas merupakan hubungan linier antara respon detektor dengan konsentrasi zat yang dianalisis yang dinyatakan dengan harga koefisien korelasi (r). Penentuan linearitas berdasarkan data kurva standar yang diperoleh dari prosedur pembuatan kurva standar. Linieritas suatu kurva standar dikatakan baik apabila harga korelasi (r) pada arus regresi mendekati 1 (Miller and Miller, 1988). Uji adanya korelasi dilakukan dengan uji t sesuai dengan persamaan 3.2.
2
Dengan ketentuan, thitungadalah besarnya nilai t yang diperoleh dari perhitungan, r merupakan harga koefisien korelasi, n adalah jumlah larutan standar yang diukur, sedangkan ttabelmerupakan nilai t yang diperoleh pada tingkat kepercayaan 95% (p = 0,05%). Besarnya thitung dengan ttabel dibandingkan maka didapat korelasi linier antara respon detektor arus dengan konsentrasi zat yang dianalisis. Koefisien korelasi diterima jika thitung > ttabel.
Presisi (ketelitian) adalah suatu derajat keterulangan (reproducibility) dari suatu metode analisis. Ketelitian menyatakan kedekatan antar hasil yang diperoleh dengan pengukuran yang berulang terhadap suatu analit konsentrasi terrtentu pada kondisi yang sama. Pada penelitian ini, ketelitian dapat ditentukan dengan menghitung simpangan baku (standar deviasi/ SD) dan koefisien variasi (KV) nilai arus masing–masing konsentrasi larutan standar kreatinin yang diukur.
Dengan ketentuan, SD adalah standar deviasi, KV merupakan koefisien variasi, xi adalah arus pada masing–masing pengukuran, x merupakan arus rata–rata, sedangkan n adalah jumlah pengulangan pengukuran.
Sensitivitas didefinisikan sebagai arus yang terukur dalam satuan konsentrasi (Taylor, 1994). Pada penelitian ini sensitivitas metode diperoleh dari nilai slope kurva standar. Semakin besar nilai dapat diartikan bahwa perubahan konsentrasi analit sedikit saja memberikan perubahan arus yang besar, sehingga sentivitas metode dikatakan baik jika harga slope tinggi (Miller and Miller, 1988).
Limit deteksi merupakan kadar analit terkecil dalam sampel yang masih dapat dideteksi dengan baik dengan metode tersebut. Penentuan limit deteksi dapat menggunakan data kurva standar yang dihitung dengan persamaan 3.5
YLOD = Ybl+ 3Sbl...(3.5)
Dengan ketentuan, YLOD adalah sinyal terkecil yang masih terdeteksi, Sbl
adalah standar deviasi sinyal blanko = , Ybl merupakan sinyal blanko (intersep dari persamaan kurva standar), n adalah jumlah larutan standar yang diukur, yi merupakan rata–rata tinggi (arus) masing–masing pengukuran, sedangkan ŷ adalah tinggi puncak (arus) yang diperoleh dari mensubtitusi masing–masing konsentrasi larutan standar sebagai nilai x ke persamaan regresi kurva standar. YLOD yang diperoleh kemudian disubstitusikan ke persamaan regresi kurva standar sehingga diperoleh nilai limit deteksi (x) (Miller and Miller, 1988).
2 -n
ŷ) -(yi 2
Akurasi adalah seberapa dekat kadar yang diperoleh dari hasil analisis terhadap kadar sebenarnya. Harga akurasi atau persen perolehan kembali pada penelitian ini ditentukan dengan menganalisis larutan standar kreatinin konsentrasi 1-5 ppb secara voltammteri lucutan. Selanjutnya harga akurasi dihitung dengan persamaan 3.6 (Miller and Miller,1988).
R =
s sp
K C
x 100%...(3.6)
BAB IV
HASIL DAN PEMBAHASAN
4.1 Sintesis Polianilin (PANi), Non Imprinted Polymer (NIP), dan
Molecularly Imprinted Polymer(MIP)
4.1.1 Sintesis polianilin (PANi)
memberikan waktu agar reaksi polimerisasi anilin dapat terbentuk sempurna. Endapan PANi kemudian dicuci dengan HCl 1 M. Pencucian dengan HCl ditujukan untuk menghilangkan residu ammonium peroksodisulfat yang tidak bereaksi dan memastikan semua PANi yang terbentuk telah menjadi emeraldine salt (Maddu et al., 2008). Endapan yang terbentuk kemudian dikeringkan dan diperoleh serbuk PANi.
4.1.2 Sintesis non imprinted polymer(NIP)
4.1.3 Sintesis molecularly imprinted polymer(MIP)
Pembuatan MIP dilakukan dengan cara mengekstraksi kreatinin yang terperangkap dalam NIP yang terbentuk menggunakan air panas. Ekstraksi dilakukan sebanyak 3 kali dan masing-masing ekstraksi dilakukan selama 20 menit dengan sentrifuge. Tujuan ekstraksi ini untuk menghilangkan kreatinin dari jaringan polimer sehingga didapatkan cetakan kreatinin. Pada penelitian ini endapan MIP yang terbentuk setelah ekstraksi juga berwarna hijau gelap.
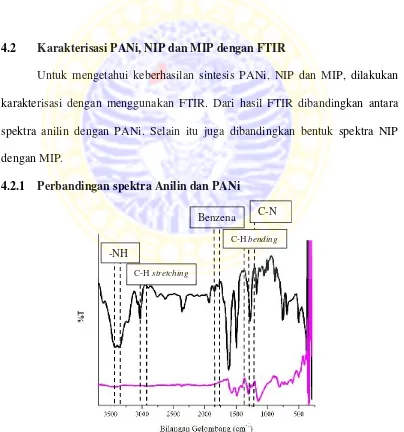
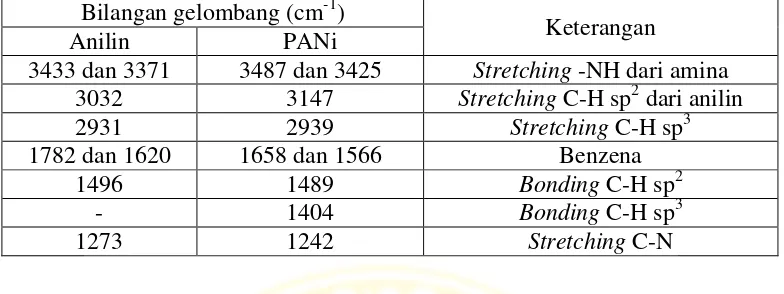
4.2 Karakterisasi PANi, NIP dan MIP dengan FTIR
Untuk mengetahui keberhasilan sintesis PANi, NIP dan MIP, dilakukan karakterisasi dengan menggunakan FTIR. Dari hasil FTIR dibandingkan antara spektra anilin dengan PANi. Selain itu juga dibandingkan bentuk spektra NIP dengan MIP.
4.2.1 Perbandingan spektra Anilin dan PANi
Gambar 4.1 Spektra FTIR Anilin dan PANi
-NH
C-Hstretching
Benzena
C-H bending
Tabel 4.1 Perbandingan bilangan gelombang puncak spektra Anilin dan PANi Bilangan gelombang (cm-1)
Keterangan
Anilin PANi
3433 dan 3371 3487 dan 3425 Stretching-NH dari amina
3032 3147 StretchingC-H sp2dari anilin
2931 2939 StretchingC-H sp3
1782 dan 1620 1658 dan 1566 Benzena
1496 1489 BondingC-H sp2
- 1404 BondingC-H sp3
1273 1242 Stretching C-N
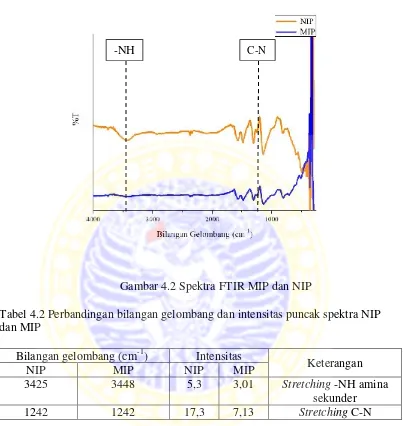
4.2.2 Perbandingan spektra NIP dan MIP
Gambar 4.2 Spektra FTIR MIP dan NIP
Tabel 4.2 Perbandingan bilangan gelombang dan intensitas puncak spektra NIP dan MIP
Bilangan gelombang (cm-1) Intensitas
Keterangan
NIP MIP NIP MIP
3425 3448 5,3 3,01 Stretching-NH amina
sekunder
1242 1242 17,3 7,13 Stretching C-N
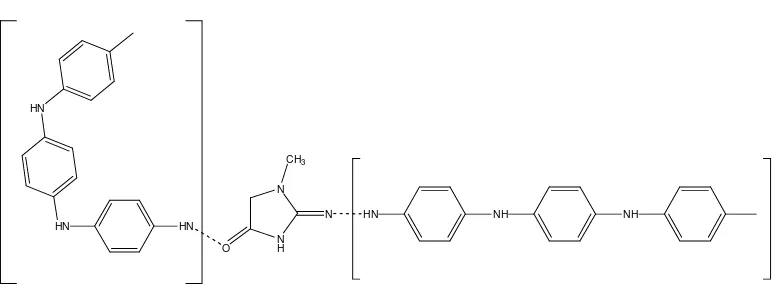
Untuk spektra NIP dan MIP, pada bilangan gelombang 3425 cm-1 dan 3448 cm-1terdapat puncak spektra khas dari amina sekunder. Pada puncak spektra amina sekunder terjadi pengurangan intensitas antara NIP dan MIP. Pengurangan intensitas juga terjadi pada stretching C-N pada bilangan gelombang 1242 cm-1. Ikatan O-H yang terbentuk antara kreatinin dengan PANi yang diduga, dapat dilihat pada Gambar 4.3.
N H N
O
CH3
N HN NH
HN HN
HN
NH
Gambar 4.3 Ikatan hidrogen antara kreatinin dan PANi
4.3 Optimasi Parameter Analisis Kreatinin dengan Elektroda HMD-MIP
Untuk analisis kreatinin dengan metode voltammetri lucutan ini, digunakan pelarut akuabides. Alasan penggunaan akubides adalah untuk menghindari pengotor yang bersifat elektroaktif yang dapat memberikan sinyal arus saat proses analisis.
Untuk mengoptimalkan hasil analisis kreatinin secara voltammetri lucutan. pada penelitian ini dilakukan optimasi potensial pelapisan MIP pada elektroda HMD dan optimasi waktu akumulasi kreatinin pada elektroda HMD-MIP. Optimasi potensial pelapisan MIP dilakukan pada rentang potensial -1000 mV sampai dengan 600 mV dengan interval 100 mV dan waktu akumulasi kreatinin pada elektroda HMD-MIP divariasi dari 15-120 detik dengan interval 15 detik. Pada penelitian ini digunakan elektrolit pendukung KCl. Elektrolit pendukung digunakan untuk meminimalkan proses migrasi analit ke permukaan (Wang, 1985).
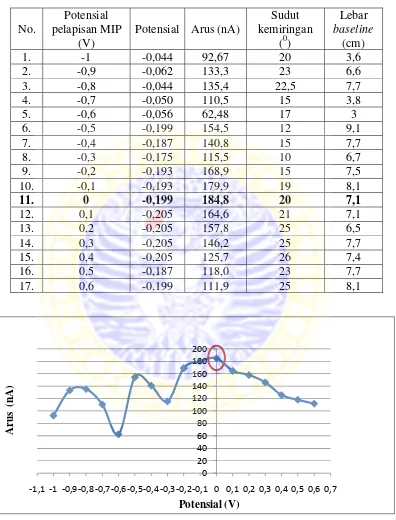
4.3.1 Optimasi potensial pelapisan MIP pada HMD
0
-1,1 -1 -0,9-0,8-0,7-0,6-0,5-0,4-0,3-0,2-0,1 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7
Potensial (V)
Tabel 4.3 Data hasil analisis kreatinin optimasi potensial pelapisan MIP pada elektroda HMD
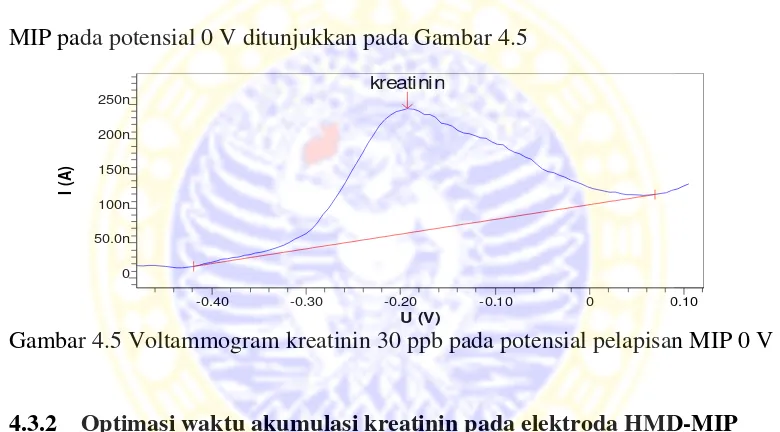
Dan dari data potensial pelapisan MIP pada elektoda HMD dengan variasi potensial akumulasi -1000 mV sampai dengan 600 mV, terdapat dua potensial yang dipertimbangkan dalam pemilihan potensial optimum yaitu pada potensial 0 V dan 0,1 V. Potensial akumulasi 0 V yang dipilih sebagai potensial optimum karena pada potensial tersebut bentuk puncak voltammogramnya bagus, sinyal arus kreatinin besar, lebar dasar puncak kecil, dan sudut kemiringan terhadap sumbu x juga relatif kecil. Voltammogram yang menunjukkan potensial pelapisan MIP pada potensial 0 V ditunjukkan pada Gambar 4.5
Gambar 4.5 Voltammogram kreatinin 30 ppb pada potensial pelapisan MIP 0 V
4.3.2 Optimasi waktu akumulasi kreatinin pada elektroda HMD-MIP
Optimasi waktu akumulasi dilakukan untuk mengetahui waktu yang dibutuhkan kreatinin untuk terakumulasi pada permukaan elektroda. Pada penelitian ini digunakan larutan uji kreatinin 5 ppb karena dengan penggunaan larutan kreatinin yang lebih besar seperti 30 ppb, elektroda jenuh oleh analit, sehingga tidak dapat memberikan perubahan arus untuk setiap perubahan waktu yang digunakan. Pada penelitian ini dilakukan variasi waktu akumulasi kreatinin dari 15-120 detik, dengan interval 15 detik. Untuk waktu pelapisannya digunakan
-0.40 -0.30 -0.20 -0.10 0 0.10
U (V)
0 50.0n 100n 150n 200n 250n
I
(A
)
120 detik (Lakhsmi et al., 2006). Data dari optimasi waktu akumulasi kerja kreatinin dapat dilihat pada Tabel 4.2
Tabel 4.4 Data hasil optimasi waktu akumulasi kerja kreatinin pada HMD-MIP
No. Waktu
akumulasi kreatinin (detik)
Potensial Arus (nA) Sudut kemiringan (0) antara waktu dan arus, sehingga dapat diketahui perubahan arus yang terjadi pada setiap perubahan waktu
Dari grafik pada Gambar 4.6 dapat dilihat pada 15 detik menuju 30 detik, terdapat selisih arus yang sangat besar. Sedangkan pada 15 detik selanjutnya terjadi perubahan yang tidak besar hingga waktu akumulasi 105 detik bahkan pada waktu akumulasi 120 detik terjadi penurunan arus. Hal tersebut menunjukkan bahwa elektroda sudah jenuh sehingga tidak lagi terjadi kenaikan arus.
Waktu 60 detik dipilih sebagai waktu akumulasi optimum kreatinin karena perbedaan arus antara 45 detik ke 60 detik merupakan kenaikan arus yang paling signifikan dibandingkan kenaikan arus yang lain. Selain itu juga dipertimbangkan bentuk puncak voltammogram, lebar baseline, dan sudut kemiringan terhadap sumbu x. Voltammogram yang menunjukkan waktu akumulasi optimum kreatinin dapat dilihat pada Gambar 4.7
Gambar 4.7 Voltammogram waktu akumulasi kreatinin 5 ppb selama 60 detik
4.4 Uji Kinerja Elektroda Modifikasi
Uji kinerja elektroda modifikasi dilakukan untuk mengetahui perbandingan arus hasil pengukuran kreatinin menggunakan elektroda HMD-MIP
-0.60 -0.40 -0.20 0
U (V)
0 25.0n 50.0n 75.0n 100n 125n
I
(A
)
dengan elektroda HMD-NIP, HMD-PANi, dan elektroda HMD murni untuk analisis kreatinin. Data arus untuk analisis kreatinin dapat dilihat pada Tabel 4.5 Tabel 4.5 Data hasil analisis kreatinin 5 ppb pada uji kinerja elektroda modifikasi
No. Jenis Elektroda Potensial Arus (nA)
1. HMD -0,065 66,07
2. HMD-PANi -0,214 46,30
3. HMD-MIP -0,167 36,43
4. HMD-NIP -0,173 23,72
Analisis kreatinin dengan menggunakan elektroda HMD murni mempunyai arus yang paling besar. Elektroda HMD yang tidak tertutupi oleh lapisan polimer memiliki permukaan yang lebih luas sehingga analit dapat kontak langsung dengan elektroda.
Untuk analisis kreatinin menggunakan elektroda HMD-PANi, juga menghasilkan arus yang besar. Pori pada PANi bermacam-macam bentuknya, ada pori yang ukurannya lebih besar dari molekul kreatinin, sehingga jumlah molekul kreatinin yang masuk lebih banyak. Ada pula pori yang pas dengan ukuran molekul kreatinin sehingga kreatinin yang dapat masuk. Namun ada pula ukuran pori yang lebih kecil dari ukuran kreatinin sehingga molekul kreatinin tidak dapat masuk dan kontak dengan lapisan PANi sehingga arus yang timbul kecil.
memiliki cetakan yang pas untuk kreatinin sehingga hanya molekul kreatinin saja yang dapat dianalisis.
4.5 Pembuatan Kurva Standar Kreatinin
Kurva standar digunakan untuk mengamati perubahan arus terhadap konsentrasi. Pembuatan kurva standar kreatinin menggunakan larutan kreatinin 1-5 ppb dan analisis dilakukan secara duplo untuk masing-masing konsentrasi. Data arus yang dihasilkan pada pengukuran larutan baku ditampilkan pada Tabel 4.6 Tabel 4.6 Data hasil analisis larutan standar kreatinin
No.
Konsentrasi larutan standar
(ppb)
Arus (nA) pada pengukuran
ke- Arus
rata-rata (nA)
1 2
1. 1 28,65 34,67 31,660
2. 2 32,14 33,81 32,975
3. 3 34,98 33,25 34,115
4. 4 36,16 35,13 35,645
5. 5 37,76 36,43 37,095
Gambar 4.8 Kurva standar kreatinin
Dari data hasil analisis larutan standar kreatinin 1-5 ppb, diperoleh persamaan regresi y=1,354x+30,23 dengan faktor korelasi (r) sebesar 0,9985 dan koefisien regresi (R2) sebesar 0,997. Dari kurva tersebut juga dapat dilihat perubahan arus secara linear seiring dengan perubahan konsentrasi.
4.6 Uji Validitas Metode
4.6.1 Linieritas
Linieritas merupakan hubungan linier antara respon detektor dengan konsentrasi zat yang dianalisis yang dinyatakan dengan harga koefisien korelasi (r) kurva kalibrasi. Penentuan linearitas analisis kreatinin berdasarkan data pembuatan kurva baku kreatinin. Koefisien korelasi (r) kurva standar yang diperoleh sebesar 0,9985. Kemudian dilakukan uji t dengan membandingkan antara thitungdan ttabel. Data thitungyang didapat dari perhitungan pada Lampiran 10 adalah 31,5584 sedangkan data ttabel sebesar 2,353. Sehingga didapatkan thitung ˃ ttabelmaka dapat disimpulkan terdapat hubungan linear antara konsentrasi dan arus yang dihasilkan. Jika dibandingkan dengan penelitian Arwindah (2010) yang mempunyai koefisien korelasi 0,9979, linieritas pada penelitian ini lebih baik.
4.6.2 Presisi (Ketelitian)
Tabel 4.7 Data nilai koefisien variasi (KV) untuk analisis larutan standar kreatinin Konsentrasi
larutan satandar (ppb)
Arus (nA) pada pengukuran ke- Arus (nA) rata-rata
Standar
Deviasi % KV
1 2
1 28,65 34,67 31,660 4,2568 13,44
2 32,14 33,81 32,975 1,1808 3,58
3 34,98 33,25 34,115 1,2232 3,58
4 36,16 35,13 35,645 0,7282 2,04
5 37,76 36,43 37,095 0,9404 2,53
Dari data perhitungan koefisien variasi secara keseluruhan pada Lampiran 11, pada penelitian ini mempunyai koefisien variasi diantara 2,04% sampai dengan 13,44%. Untuk konsentrasi rendah (1 ppb) mempunyai nilai koefisien variasi yang tinggi. Sedangkan untuk konsentrasi lebih tinggi mempunyai nilai koefisien variasi yang kecil, yaitu kurang dari 5%. Sehingga dapat disimpulkan metode HMD-MIP mempunyai presisi yang baik pada konsentrasi yang besar, sedangkan untuk konsentrasi rendah memiliki presisi yang jelek. Pada penelitian ini memiliki koefisien variasi yang kurang jika dibandingkan dengan penelitian Arwindah (2010) karena pada penelitian Arwindah koefisien variasi yang diperoleh lebih kecil, berkisar antara 0,48% hingga 7,83%.
4.6.3 Sensitivitas
4.6.4 Limit deteksi
Limit deteksi merupakan kadar analit terkecil dalam sampel yang masih dapat dideteksi dengan baik oleh suatu metode. Berdasarkan perhitungan pada Lampiran 13, limit deteksi dengan menggunakan elektroda HMD-MIP yang diperoleh pada penelitian ini sebesar 0,2787 ppb (0,2787 µg/ L) sehingga dapat disimpulkan kadar analit terkecil yang dapat diukur dengan menggunakan elektroda HMD-MIP adalah sebesar 0,2787 µg/ L. Pada penelitian ini memiliki limit deteksi yang lebih baik dibandingkan dengan Arwindah (2010) yang mempunyai limit deteksi 0,323 ppb (0,323 µg/ L). Sedangkan jika dibandingkan dengan penelitian Lakshmi et al., (2006) limit deteksi pada penelitian ini juga lebih baik karena pada penelitian tersebut dapat menghasilkan sensor yang mempunyai limit deteksi 1,49 µg/ L.
4.6.5 Akurasi
BAB V
KESIMPULAN DAN SARAN
5.1 KESIMPULAN
Dari hasil penelitian ini dapat diambil kesimpulan:
1. Potensial pelapisan optimum MIP pada elektroda HMD adalah 0 V 2. Waktu akumulasi optimum kreatinin pada elektroda modifikasi
HMD-MIP adalah 60 detik
3. Koefisien korelasi (r) sebesar 0,9985, harga KV antara 2,04% hingga 13,44% untuk konsentrasi 1-5 ppb, sensitivitas metode sebesar 3,47 x 104 nA/ ppb.cm2 dengan limit deteksi 0,2787 ppb dan akurasi untuk konsentrasi 1-5 ppb tersebut sebesar 95,64%-105,61%.
5.2 SARAN
1. Diperlukan optimasi untuk perbandingan monomer, inisiator, dan template pada pembuatan NIP sehingga didapatkan NIP yang lebih baik.
2. Diperlukan penelitian lebih lanjut mengoptimasi kondisi pH optimum pada sensor modifikasi elektroda HMD-MIP sehingga dapat diperoleh sensor yang lebih sensitif.
DAFTAR PUSTAKA
Ansel, H.C and Prince, S.J., 2004, Kalkulasi Farmasetik, Penerbit buku kedokteran EGC, Jakarta.
Arwindah, P.R., 2010, Pengembangan Sensor Asam Urat Melalui Modifikasi Elektroda Glassy Carbon dengan Molecularly Imprinted Polymer secara Stripping Voltammetri, Skripsi, Departemen Kimia Fakultas Sains dan Teknologi Unair, Surabaya.
Baron, D.N., 1992, Patologi klinik (diterjemahkan oleh Johannes Gunawan), Penerbit buku kedokteran EGC, Jakarta.
Brüggemann, O., 2002, Molecularly imprinted materials – receptors more durable than nature can provide, Adv Biochem Engin/Biotechnol, 76: 127–163.
Chandrakanthi, N., and Careem, M.A., 2001, Thermal Stability of polyaniline, Polymer Buletin, 44: 101-108.
Gill, M., Ockelford, P., Morris, A., Bierre, T., and Kyle, C., 2000, Diagnostic Handbook: The Interpretation of Laboratory Tests, Diagnostic Medlab Limited, New Zealand.
George, S.K., Dipu, M.T., Mehra, U.R., Singh, P., Verma, A.K., and Ramgaokar, J.S., 2006, Improved HPLC Method for Simulaneous Detemination of Allantoin, Uric acid, and creatinine in Cattle Urine, Journal of ChromatographyB (832): 134-137.
Guyton A.C and Hall J.E., 1997, Buku Ajar Fisiologi Kedokteran, Edisi ke-9, Penerbit buku kedokteran EGC, Jakarta.
Kamiliyah, H., 2011, Analisis Kreatinin secara Voltammetri Menggunakan Elektroda Modifikasi Grafit Imprinted Zeolit, Skripsi, Departemen Kimia Fakultas Sains dan Teknologi Unair, Surabaya.
Lakshmi, D., Prasad, B.B., and Sharma, P.S., 2006,Creatinine sensor based on molecularly imprinted polymer-modified hanging mercury drop electrode,Talanta70: 272-280
Maddu,A., Wahyudi, S.T., and Kurniati, M., 2008, Sintesis dan Karakterisasi Nanoserat Polianilin, Jurnal Nanosains & Nanoteknologi, Vol. 1: No.2. Meiyanto, E., Martono, S., Ediarti., Nurrochmad, A., Irianti, T., Hakim, A.R.,
Ikawati, M., and Hermawan, A., 2010,Petunjuk Praktikum Analisis Klinis, Bagian Kimia Farmasi Fakultas Farmasi UGM Yogyakarta, Yogyakarta. Meyer, D.J and Harvey J.W., 1998, Veterinary Laboratory Medicine:
interpreatation and diagnosis 2nd, WB Saunders, Philadelphia USA.
Miller, J.C., and Miller, J.N., 1988,Statistic for Analytical Chemistry 2nd edition, Ellis Howard Limited, New York.
Monk, P.M.S., Mortimer, R.J. and Rosseinsky, D.R., 1995, Electrochromis: Fundamental and Aplication, VCH, Weinheim.
Nicholls, IA., Andersson, H.S., Charlton, C., Henschel, H., Karlsson, B.C.G., Karlsson, J.G., O’Mahony, J., Rosengren, A.M., Rosengren, K.J, Wikman, S., 2009, Theoretical and computational strategies for rational molecularly imprinted polymer design, Biosensors and Bioelectronics, 25 (2009): 543–552
Nopper, D., Lammershop, O., Wulff, G., and Gauglitz, G., 2003,Amidine-Based Molecularly Imprinted Polymers New Sensitive Elements for Chiral Chemosensors,Anal Bioanal Chem, 377:608-613.
O’Neil, 2001, The Merck Index, an Encyclopedia of Chemicals, Drugs and Biologicals13th edition, Published by Merck Research Laboratories. Oxtoby, David, W., Nachtrieb+, and Norman, H., 2003, Kimia Modern edisi
keempat jilid dua, Alih bahasa Suminar Setiati Achmadi, Erlangga, Jakarta.
Prasad, B.B., and Lakshmi, D., 2004, Barbituric Acid Sensor Based on Molecularly Imprinted Polymer-Modifed Hanging Mercury Drop Electrode,Electroanalysis, Willey-VCH, Canada.
Saptono, R., 2008, Pengetahuan Bahan, Departemen Metalurgi dan Material FTUI.
Skoog, Douglas A., 1985, Principles of Instrumental Analysis, CBS College Publishing, USA.
Sreenivasan, K., 2007, Synthesis and Evaluation of Molecularly Imprinted Polymer for Nucleic Aic Bases Using Aniline as a Monomer,Reactive an Functional Polymer, 67: 859-864.
Stevens, L.A. and Levey, A.S., 2004,Clinical implications for estimating
equations for glomerular filtration rate, Ann. Intern. Med, 141: 959-961.
Taylor, L. R., Papp, R.B., and Pollard, B.D., 1994, Instrumental Methods for Determining Elements, Selection and Aplication, VCH Publishers, Inc, New York.
Tietze, K.J., 2003, Clinical skills for pharmacists a patient-focused approach, Mosby. Inc, Missauri.
Urraca, J.L., Carbajo, M.C., Torralvo, M.C., Gonzalez, V. J., Orrellana, G., Moreno, B.M., 2008, Effect of the Template an Functional Monomer on the Textural Properties of Molecularly Imprinted Polymers. Biosensors and Bioelectronics, 24: 155-161.
Wang, J., 1985, Stripping Analysis: Principles, Instrumentation, Application, VCH Publishers, Inc, USA.
Wang, J., 2000,Analytical Electrochemistry, Wiley-VCH, Canada.
Lampiran 6. Voltammogram optimasi waktu akumulasi kreatinin 5 ppb pada HMD-MIP
Waktu akumulasi kreatinin 15 detik Waktu akumulasi kreatinin 30 detik
VR V nA I.mean Std.Dev. I.delta
Waktu akumulasi kreatinin 45 detik Waktu akumulasi kreatinin 60 detik
Waktu akumulasi kreatinin 75 detik Waktu akumulasi kreatinin 90 detik
Waktu akumulasi kreatinin 105 detik Waktu akumulasi kreatinin 120 detik
-0.50 -0.40 -0.30 -0.20 -0.10
Lampiran 7. Voltammogram uji kinerja elektroda modifikasi
-0.30 -0.25 -0.20 -0.15 -0.10 -0.05
Lampiran 8. Voltammogram kurva baku menggunakan larutan 1-5 ppb pada kondisi optimum
Kreatinin 1 ppb pada kondisi optimum
VR V nA I.mean Std.Dev. I.delta
Kreatinin 2 ppb pada kondisi optimum
VR V nA I.mean Std.Dev. I.delta
Kreatinin 3 ppb pada kondisi optimum
VR V nA I.mean Std.Dev. I.delta -0.50 -0.40 -0.30 -0.20 -0.10
U (V)
-0.50 -0.40 -0.30 -0.20 -0.10
Kreatinin 4 ppb pada kondisi optimum
Kreatinin 5 ppb pada kondisi optimum
VR V nA I.mean Std.Dev. I.delta
-0.30 -0.25 -0.20 -0.15 -0.10 -0.05
Lampiran 9. Perhitungan pembuatan larutan kreatinin
Larutan induk kreatinin 1000 ppm (Mr kreatinin = 113,12 g/ mol)
1000 ppm = 1000 mg/ 1000 mL = 100 mg/ 100 mL = 0,1 g/ 100 mL
Larutan kerja kreatinin 10 ppm dari larutan induk 1000 ppm
V. M 10 ppm = V. M 1000 ppm 100.10 = V. 1000 V = 1 mL
Larutan kerja kreatinin 1 ppm dari larutan kerja 10 ppm
V. M 1 ppm = V. M 10 ppm 100.1 = V. 10 V = 10 mL
Larutan kerja kreatinin 30 ppb dari larutan kerja 1 ppm (1 ppm=103 ppb)
V. M 30 ppb = V. M 1 ppm 30.100 = V. 1000 V = 3 mL
Larutan kerja kreatinin 5 ppb dari larutan kerja 1 ppm
V. M 1 ppb = V. M 1 ppm 100.5 = V. 1000 V = 0,5 mL
Larutan standar kreatinin 1 ppb dari larutan kerja 1 ppm
50. 1 = V. 1000
V = 0,05 mL (50 µL)
Larutan standar kreatinin 2 ppb dari larutan kerja 1 ppm
V. M 2 ppb = V. M 1 ppm 50. 2 = V. 1000
V = 0,1 mL (100 µL)
Larutan standar kreatinin 3 ppb dari larutan kerja 1 ppm
V. M 3 ppb = V. M 1 ppm 50. 3 = V. 1000
V = 0,15 mL (150 µL)
Larutan standar kreatinin 4 ppb dari larutan kerja 1 ppm
V. M 4 ppb = V. M 1 ppm 50. 4 = V. 1000
V = 0,2 mL (200 µL)
Larutan standar kreatinin 5 ppb dari larutan kerja 1 ppm
V. M 5 ppb = V. M 1 ppm 50. 5 = V. 1000
Lampiran 10. Perhitungan linearitas kurva standar
Persamaan kurva standar kreatinin yang didapatkan sebesar y = 1,354 x + 30,23
r2= 0,997 r = 0,9985
Nilai ttabel = t (3;0,05)= 2,353
Nilai thitung
Karena thitung ˃ ttabel maka diperoleh kesimpulan konsentrasi dan arus memiliki hubungan yang linear.
= │r│ n-2 1-r2
= │0,9985│ 5-2 1-0,997
= │0,9985│ 1,7320 0,0548 = 1,7294
Lampiran 11. Perhitungan Presisi (Ketelitian)
1 28,65 34,67 31,66 -3,01 3,01 18,1202
2 32,14 33,81 32,975 -0,835 0,835 1,3944
3 34,98 33,25 34,115 -0,865 0,865 1,4964
4 36,16 35,13 35,645 -0,515 0,515 0,5304
5 37,76 36,43 37,095 0,665 -0,665 0,8844
Lampiran 12. Perhitungan Sensitivitas
Persamaan regresi : y = 1,354x + 30,23 Sehingga diketahui nilai slopeyaitu 1,354
Luas permukaan HMD diasumsikan sebagai luas ½ bola, sehingga:
LHMD = ½ x 4πr2
= 2πr2
= 2 x 3,14 x (25.10-4)2 = 3,9 x 10-5cm2
Jadi, sensitivitas yang diperoleh = slope/LHMD = 1,354 / 3,9.10-5