MODIFIKASI ELEKTRODA HANGING MERCURY DROP DENGAN
IMPRINTING ZEOLIT UNTUK SENSOR PADA ANALISIS KREATIN
SECARA VOLTAMMETRI LUCUTAN
SKRIPSI
JULIE ANDRYA SARI
DEPARTEMEN KIMIA
FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS AIRLANGGA
MODIFIKASI ELEKTRODA HANGING MERCURY DROP DENGAN
IMPRINTING ZEOLIT UNTUK SENSOR PADA ANALISIS KREATIN
SECARA VOLTAMMETRI LUCUTAN
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Bidang Kimia pada Fakultas Sains dan
Teknologi Universitas Airlangga
Disetujui Oleh :
Pembimbing I,
Dra. Miratul Khasanah, M.Si NIP. 19681228 199303 1 001
Pembimbing II,
LEMBAR PENGESAHAN SKRIPSI
Judul : Modifikasi Elektroda Hanging Mercury Drop dengan
Imprinting Zeolit untuk Sensor pada Analisis Kreatin
secara Voltammatri Lucutan Penyusun : Julie Andrya Sari
NIM : 080810182
Pembimbing I : Dra. Miratul Khasanah, M.Si Pembimbing II : Alfa Akustia Widati, S.Si., M.Si Tanggal ujian : 30 Agustus 2012
Disetujui Oleh : Pembimbing I,
Dra. Miratul Khasanah, M.Si NIP. 19670304 199203 2 001
Pembimbing II,
Alfa Akustia Widati, S.Si., M.Si NIK. 139 080 770
Mengetahui, Ketua Departemen Kimia Fakultas Sains dan Teknologi
Universitas Airlangga
PEDOMAN PENGGUNAAN SKRIPSI
Skripsi ini tidak dipublikasikan, namun tersedia di perpustakaan dalam lingkungan Universitas Airlangga. Diperkenankan untuk dipakai sebagai referensi kepustakaan, tetapi pengutipan seijin penulis dan harus menyebutkan sumbernya sesuai kebiasaan ilmiah.
KATA PENGANTAR
Puji syukur kehadirat Allah S.W.T yang telah melimpahkan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan penulisan skripsi yang berjudul “Modifikasi Elektroda Hanging Mercury Drop dengan Imprinting
Zeolit untuk Sensor pada Analisis Kreatin secara Voltammetri Lucutan”.
Skripsi ini dibuat untuk memenuhi persyaratan akademis pendidikan sarjana sains dalam bidang kimia Fakultas Sains dan Teknologi Universitas Airlangga.
Penulis menyadari dalam penyusunan skripsi ini tidak lepas dari bantuan berbagai pihak, untuk itu penulis menyampaikan terimakasih kepada :
1. Dra. Miratul Khasanah, M.Si selaku dosen pembimbing I atas bimbingan dan nasehatnya selama penyusunan dan penyelesaian skripsi ini.
2. Alfa Akustia Widati, S.Si., M.Si selaku dosen pembimbing II atas bantuan dan kesabarannya dalam memberikan bimbingan kepada penulis.
3. Dr. Alfinda Novi Kristanti, DEA, selaku Kepala Departemen Kimia FSAINTEK Universitas Airlangga.
4. Dr. Nanik Siti Aminah, M.Si selaku dosen wali yang telah memberikan banyak masukan selama proses perkuliahan.
5. Ayah, ibu, eyang putri, eyang kakung, mbak Mita, dek Conny, dan seluruh keluarga yang telah banyak memberikan doa, semangat dan dukungan. 6. Seluruh dosen pengajar di Departemen Kimia FSAINTEK Universitas
Airlangga yang memberikan mata kuliah dengan sabar.
7. Bapak Giman, bapak Kamto, mas Rochadi, dan semua karyawan di Departemen Kimia FSAINTEK Universitas Airlangga yang telah memberikan bantuan dalam pelaksanaan penelitian skripsi ini.
8. Sahabat-sahabat tercinta saya Asri, Aya, Adel, Marina, O’ox, Dita, Alivina, Culan, Bela, Mumun yang telah memberikan semangat dan bantuan dalam menyelesaikan skripsi ini.
9. Genk volta Nikita, Fida, Ais, Ayu, Evril, Marina yang menjadi teman senasib seperjuangan dalam menyelesaikan penelitian skripsi ini.
penulisan skripsi ini.
11. Abdurrazaq Al Muharram yang telah memberikan semangat, dukungan dan bantuan dalam menyelesaikan skripsi ini.
Penulis menyadari bahwa masih terdapat banyak kekurangan dalam penyusunan skripsi ini, oleh karena itu kritik dan saran yang besifat membangun untuk kesempurnaan penulisan skripsi ini sangat diperlukan. Semoga skripsi ini dapat bermanfaat bagi semua pihak.
Surabaya, Juli 2012 Penulis,
Sari, J.A., 2012, Modifikasi Elektroda Hanging Mercury Drop dengan Imprinting Zeolit untuk Sensor pada Analisis Kreatin secara Voltammetri
Lucutan. Skripsi ini di bawah bimbingan Dra. Miratul Khasanah, M. Si., dan Alfa Akustia Widati S.Si., M.Si., Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya
ABSTRAK
Pada penelitian ini telah dilakukan pembuatan imprinted zeolit (IZ) yang
digunakan sebagai material pada pembuatan sensor dalam penentuan kadar kreatin secara voltammetri lucutan. Zeolit yang digunakan adalah zeolit sintesis yang porinya dikondisikan agar sesuai dengan ukuran partikel kreatin. Tujuan penelitian ini adalah untuk mengetahui karakteristik IZ, kondisi pelapisan IZ pada elektroda hanging mercury drop (HMD) dan kondisi awal kreatin dalam larutan,
serta menguji validitas metode. Pada penelitian ini diperoleh kondisi optimum potensial akumulasi -700 mV selama 60 detik. Metode ini memiliki linieritas 0,996 yang diperoleh dari kurva standar dengan konsentrasi kreatin 1-5 ppb, limit deteksi yang diperoleh sebesar 0,44 ppb, sensitivitas bernilai 4,6664 nA/ppb cm2,
dan nilai akurasi pada konsentrasi larutan standar 1, 3, dan 5 ppb berturut-turut adalah 111%, 97%, dan 99,2%.
Sari, J.A., 2012, Modification of Hanging Mercury Drop Electrode with Imprinting Zeolite for Sensor on Analysis of Creatine by Stripping Voltammetry. This script is supervised by Dra. Miratul Khasanah, M. Si., and Alfa Akustia Widati S.Si., M.Si., Department of Chemistry, Faculty of Science and Technology, Airlangga University, Surabaya.
ABSTRACT
Synthesis of imprinted zeolite (IZ), which was used as material in the manufacture of sensors in determination of creatine in stripping voltammetry, had been done. The zeolite, which was used, was zeolite pores synthesis which was conditioned to be available in the size of the creatine particles. The purposes of this study were to determine the characteristics of IZ, IZ coating conditions on the hanging mercury drop (HMD) electrode and the initial conditions of creatine in solution, and test the validity of the method. In this research, it was obtained optimum conditions of accumulation potential at -700 mV for 60 seconds. The method had a linearity of 0.996 which was obtained from a standard curve of creatine 1-5 ppb, limit of detection obtained was 0.44 ppb, the value of sensitivity was 4,6664 nA/ppb cm2, and the accuracy value of the standard solution at
concentration of 1, 3, and 5 ppb was respectively 111%, 97%, and 99.2%.
DAFTAR ISI
LEMBAR JUDUL ... i
LEMBAR PERNYATAAN ... ii
LEMBAR PENGESAHAN ... iii
LEMBAR PEDOMAN PENGGUNAAN SKRIPSI ... iv
KATA PENGANTAR ... v
2.3 Spektrofotometri Inframerah (IR) ... 12
2.4 Spektrofotometri Difraksi Sinar-x... 12
2.5 Zeolit ... 13
2.5.1 Modifikasi elektroda dengan zeolit ... 14
BAB III METODE PENELITIAN
3.5.1.1 Pembuatan larutan induk kreatin 1000 ppm ... 18
3.5.1.2 Pembuatan larutan kerja kreatin 10 ppm, 1 ppm, 50 ppb, 1 ppb ... 18
3.5.2.1 Pembuatan zeolit ... 18
3.5.2.2 Pembuatan non imprinted zeolit (NIZ) ... 19
3.5.2.3 Pembuatan imprinted zeolit (IZ) ... 19
3.5.3 Karakterisasi terhadap zeolit ... 20
3.5.4 Karakterisasi terhadap zeolit, NIZ, dan IZ ... 20
3.5.5 Optimasi analisis kreatin secara voltammetri menggunakan Elektroda HMD ... 20
3.5.5.1 Optimasi potensial akumulasi ... 21
3.5.5.2 Optimasi waktu akumulasi ... 21
3.5.6 Karakterisasi sensor secara voltammetri ... 21
3.5.7 Pembuatan kurva standar kreatin... ... 22
3.5.8 Uji validitas metode ... 22
3.5.8.1 Linieritas ... 22
3.5.8.2 Presisi (ketelitian) ... 23
3.5.8.3 Sensitivitas... 24
3.5.8.4 Limit deteksi (LOD) ... 24
3.5.8.5 Akurasi (ketepatan) ... 25
BAB IV HASIL DAN PEMBAHASAN 4.1 Sintesis Zeolit, Non Imprinted Zeolit (NIZ), dan Imprinted Zeolit (IZ) ... 26
4.2 Karakterisasi Zeolit Menggunakan Difraksi Sinar-x ... 28
4.3 Karaterisasi Zeolit, NIZ, dan IZ Menggunakan FTIR ... 29
4.4 Optimasi Analisis Kreatin Menggunakan Elektroda HMD ... 33
4.4.1 Optimasi potensial akumulasi ... 33
BAB V KESIMPULAN DAN SARAN 5.1 Kesimpulan... 44
5.2 Saran ... 45
DAFTAR TABEL
Nomor Judul Tabel Halaman
2.1
Data rentang potensial pengukuran elektroda kerja pada voltammetri
Data bilangan gelombang puncak spektra FTIR zeolit, NIZ, dan IZ
Data hasil analisis kreatin pada berbagai potensial akumulasi kreatin pada elektroda HMD
Data hasil optimasi waktu akumulasi kreatin menggunakan elektroda HMD
Data hasil analisis kreatin 50 ppb pada uji kinerja elektroda HMD, zeolit, HMD-IZ, dan HMD-NIZ secara voltammetri lucutan
Data hasil pengukuran arus larutan standar kreatin
DAFTAR GAMBAR
Nomor Judul Gambar Halaman
2.1 Skema pembuatan NIZ dan IZ
Spektra difraksi sinar-x zeolit sintesis TS-1 Spektra IR zeolit, NIZ, dan IZ
Grafik hubungan antara arus kreatin 50 ppb dengan potensial akumulasi menggunakan elektroda HMD
Voltammogram kreatin pada potensial akumulasi -700 mV menggunakan elektroda HMD
Grafik hubungan antara arus kreatin 50 ppb dengan waktu akumulasi menggunakan elektroda HMD
Voltammogram kreatin pada waktu
akumulasi 60 detik menggunakan elektroda HMD
DAFTAR LAMPIRAN Nomor Judul
1 Perhitungan Pembuatan Larutan Kerja Kreatin 2 Perhitungan Komposisi Zeolit
3 Analisis Data Validasi Metode
4 Voltammogram Kreatin Hasil Optimasi Waktu Akumulasi Menggunakan Elektroda HMD
5 Voltammogram Kreatin Hasil Optimasi Potensial Akumulasi Menggunakan Elektroda HMD
6 Voltammogram Karakterisasi Kreatin Menggunakan Elektroda HMD, HMD-NIZ, HMD-IZ, dan HMD-zeolit
BAB I PENDAHULUAN
1.1Latar Belakang Permasalahan
Kreatin merupakan senyawa nitrogen fisiologis yang disintesis dari asam amino. Kreatin juga dikenal sebagai asam asetat metilguanidin (Stout et al.,
2008). Asam amino yang berperan dalam sintesis kreatin adalah arginin, glisin dan S-metilmetionin (Wyss dan Kaddurah-Daouk, 2000). Kreatin dalam jumlah
yang tepat dapat meningkatkan kinerja olahraga atau dalam kegiatan yang membutuhkan energi tinggi, mengurangi kelelahan, mempercepat pemulihan energi dan pertumbuhan otot, meningkatkan kekuatan otot, meningkatkan ukuran otot tanpa mempengaruhi lemak tubuh (Flisinska dan Bojanowska, 1996). Hasil beberapa peneliti telah menunjukkan bahwa jumlah kreatin yang berlebihan dapat menyebabkan pencernaan yang tidak lancar, diare, kram otot, dan gagal ginjal (Brudnak, 2004).
Metode analisis kreatin yang umum digunakan dalam bidang kesehatan adalah spektrofotometri UV-VIS. Metode yang didasarkan pada serapan cahaya ini mudah untuk dilakukan dan mempunyai selektivitas tinggi. Tetapi analisis kreatin menggunakan metode spektrofotometri memerlukan waktu yang lama serta membutuhkan sampel yang banyak (Sewell et al., 2002). Metode lain yang
2
Metode ini memiliki efisiensi dan selektivitas yang baik namun penggunaan listriknya boros karena menggunakan tegangan tinggi (Zinellu et al., 2005). Mo et
al (2003) juga telah melakukan penentuan kreatin dalam larutan air maupun
dalam plasma tikus menggunakan metode kromatografi cair. Analisis ini membutuhkan sampel dalam jumlah yang kecil, daya pisah cukup tinggi, waktu analisis cepat dan akurat. Namun pada proses pengerjaannya, harus dilakukan penentuan yang sesuai. Metode voltammetri pulsa differensial juga telah dikembangkan untuk analisis kreatin (Stefan dan Bokretsion, 2003). Voltammetri merupakan teknik yang cepat dan akurat yang sangat sesuai untuk menganalisis kadar kreatin (Braitina et al., 2000).
Pada metode voltammetri, elektroda merupakan komponen terpenting. Sensitivitas metode voltammetri salah satunya ditentukan oleh jenis elektroda yang digunakan. Salah satu elektroda yang sering digunakan pada analisis secara voltammetri adalah elektroda cair seperti elektroda hanging mercury drop (Wang,
2000). Elektroda HMD mempunyai luas permukaan yang reproducible serta arus
background rendah (Mendham dan Jenney, 2000).
Penggunaan elektroda tanpa modifikasi untuk analisis kreatin dalam sampel serum seringkali diganggu oleh senyawa lain dan menyebabkan penyimpangan nilai respon kreatin (Lakshmi et al., 2007). Pada penelitian ini
dikembangkan sensor untuk analisis kreatin secara voltammetri lucutan dengan cara memodifikasi elektroda merkuri dengan zeolit tercetak molekul kreatin
Zeolit mempunyai struktur berpori dan dapat digunakan sebagai penyaring molekul. Aktivitas zeolit dipengaruhi oleh beberapa hal yaitu, stabilitas termal, hidrofobisitas/hidrofilisitas dari permukaan zeolit (Xu et al., 2007). Zeolit
mempunyai sifat sebagai adsorben yang selektif dan mempunyai stabilitas termal yang tinggi (Ardakani et al., 2005).
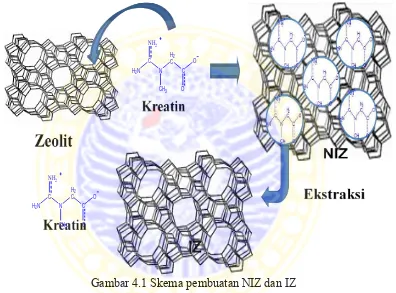
Pada penelitian ini dilakukan sintesis zeolit dan zeolit yang tercetak molekul kreatin (Imprinted zeolit). Imprinted zeolit disintesis dari tetraetil
ortosilikat (TEOS), tetrapropilamonium hidroksida (TPAOH), tetrabutil ortotitanat (TBOT), air, dan analit kreatin. Kemudian kreatin yang terperangkap dalam struktur zeolit diekstraksi sehingga terbentuk cetakan yang diharapkan hanya sesuai dengan bentuk dan ukuran kreatin. Zeolit, IZ dan non imprinted
zeolit (NIZ) dikarakterisasi menggunakan fourier transform infrared (FTIR)
spectrophotometer.
Selanjutnya IZ digunakan untuk memodifikasi elektroda HMD melalui pelapisan. Pelapisan zeolit pada elektroda HMD dilakukan secara in situ, yaitu
penempelannya pada permukaan elektroda dilakukan bersamaan dengan akumulasi kreatin pada elektroda. Sensor modifikasi yang terbentuk dikarakterisasi (diuji kinerjanya) dengan cara mengaplikasikannya untuk analisis kreatin konsentrasi tertentu dan dibandingkan hasilnya dengan hasil analisis menggunakan elektroda HMD, HMD-zeolit dan HMD-NIZ.
4
dilakukan uji validitas metoda meliputi linieritas, sensitivitas, presisi, limit deteksi, dan akurasi.
1.2 Rumusan Masalah
Berdasarkan latar belakang permasalahan, dapat dirumuskan masalah sebagai berikut.
1. Bagaimanakah hasil karakterisasi zeolit, NIZ dan IZmenggunakan FTIR? 2. Berapakah kondisi optimum potensial akumulasi dan waktu akumulasi pada
analisis kreatin secara voltammetri lucutan menggunakan elektroda HMD? 3. Bagaimana hasil analisis kreatin menggunakan elektroda HMD, HMD-zeolit,
HMD-IZ dan HMD-NIZ?
4. Berapakah nilai validitas metode analisis kreatin secara voltammetri lucutan menggunakan elektroda HMD-IZ meliputi linieritas, presisi, sensitivitas, limit deteksi, dan akurasi?
1.3Tujuan Penelitian
Tujuan penelitian ini adalah sebagai berikut.
1. Melakukan karakterisas zeolit, NIZ dan IZ menggunakan FTIR,
2. Mengetahui kondisi optimum potensial akumulasi dan waktu akumulasi pada analisis kreatin secara voltammetri lucutan menggunakan elektroda HMD, 3. Melakukan uji kinerja elektroda modifikasi dengan cara membandingkan hasil
analisis kretin menggunakan elektroda HMD-IZ dengan hasil analisis menggunakan elektroda HMD, HMD-zeolit, dan HMD-NIZ,
1.4 Manfaat Penelitian
BAB II
TINJAUAN PUSTAKA
2.1 Kreatin
2.1.1 Kreatin dalam tubuh manusia
Kreatin merupakan senyawa alami guanidino yang memainkan peran penting dalam metabolisme. Konsentrasi serum kreatin dapat diamati pada kasus katabolisme otot (Burke et al., 1999). Kreatin dapat ditemukan dalam daging dan
jaringan otot dari mamalia (Stout et al.,2008). Kreatin mempunyai rumus molekul
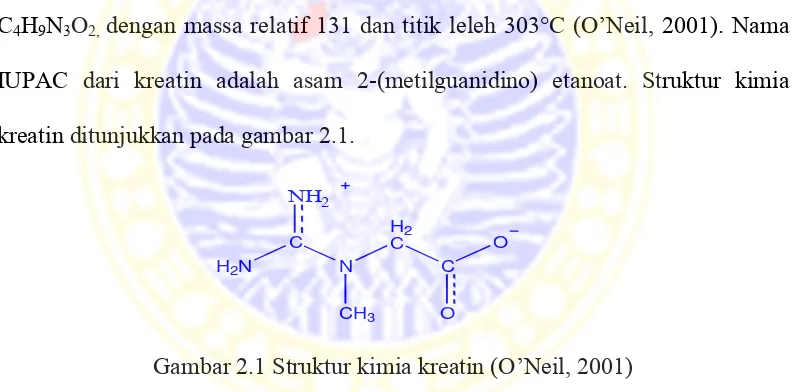
C4H9N3O2, dengan massa relatif 131 dan titik leleh 303°C (O’Neil, 2001). Nama
IUPAC dari kreatin adalah asam 2-(metilguanidino) etanoat. Struktur kimia kreatin ditunjukkan pada gambar 2.1.
NH2
C
H2N N
H2
C
CH3
C O
O
Gambar 2.1 Struktur kimia kreatin (O’Neil, 2001)
Dalam otot rangka, kreatin disintesis secara endogen dari arginin, glisin, dan S-metilmetionin. Kreatin didistribusikan ke seluruh tubuh, namun 95% ditemukan dalam otot rangka dan sisanya (5%) ditemukan di otak, hati, ginjal, dan testis (Nasrallah et al., 2009). Kreatin memainkan peran penting dalam
2.1.2 Analisis kreatin
Pada bidang biomedis, metode analisis kadar kreatin yang digunakan adalah secara spektrofotometri UV-VIS. Sampel diukur secara spektrofotometri pada panjang gelombang 219 nm. Kadar kreatin ditentukan berdasarkan perbedaan absorbansi antara larutan sampel dengan larutan kreatin kontrol pada panjang gelombang tersebut. Dengan metode ini, limit deteksi yang diperoleh sebesar 1,603 mg/dL atau 16,03 ppm (Sewell et al., 2002).
Metode voltammetri lucutan menggunakan elektroda HMD merupakan metode yang dapat digunakan untuk menganalisis senyawa elektroaktif dalam tubuh. Pada penelitian sebelumnya telah dilakukan analisis kreatin dalam serum secara voltammetri menggunakan elektroda HMD. Penelitian tersebut menghasilkan limit deteksi yang diperoleh adalah 0,11 ppb. Harga recovery
kreatin yang diperoleh pada serum kontrol adalah 95,57±10,38%, sedangkan
recovery kreatin pada sampel darah adalah 96,43±4,66% (Lakshmi et al., 2007).
2. 2 Voltammetri
Voltammetri merupakan metode elektrokimia yang mengamati hubungan arus dan potensial. Arus yang dihasilkan pada analisis secara voltammetri sebanding dengan konsentrasi spesi kimia di dalam larutan. Semua unsur yang dapat mengalami reaksi oksidasi atau reduksi di permukaan elektroda dapat dianalisis secara voltammetri (Saryati dan Wardiyati, 2007).
8
dan sensitivitas. Dalam voltammetri dikenal istilah difusi dan migrasi. Difusi adalah perpindahan massa karena adanya perbedaan konsentrasi. Akibat proses difusi ini maka timbul arus yang disebut arus difusi. Migrasi disebabkan oleh komponen ion yang mengalir dalam sel ke permukaan elektroda. Ion positif bergerak menuju elektroda kerja yang bermuatan negatif dan ion negatif bergerak dalam arah yang berlawanan. Proses migrasi tersebut dapat menyebabkan timbulnya arus migrasi dan mempengaruhi arus total yang terukur. Pada analisis secara voltammetri, hanya arus difusi yang diharapkan. Proses migrasi dapat dikurangi dengan cara menambahkan elektrolit pendukung, seperti larutan KCl 0,2 M. Konsentrasi elektrolit pendukung biasanya jauh lebih besar dari konsentrasi analit, sehingga kontribusi analit terhadap arus migrasi dapat diabaikan (Thomas dan Henze, 2001).
2.2.1 Voltammetri Lucutan
Voltammetri lucutan merupakan teknik analisis elektrokimia yang didasarkan pada pengukuran arus difusi pada saat analit terlucut dari permukaan elektroda kerja. Analit mengalami oksidasi atau reduksi pada potensial tertentu di permukaan elektroda kerja (Mendham dan Jenney, 2000). Teknik voltammetri lucutan merupakan teknik yang efisien untuk penentuan tingkat konsentrasi sub-nanomolar. Teknik ini memiliki beberapa kelebihan yaitu mudah, cepat, limit deteksi rendah, akurasi tinggi, dan rentang konsentrasi pengukuran yang luas (Al-Ghamdi dan Hefnawy, 2012).
(stripping) analit dari elektroda (Mendham dan Jenney, 2000). Dalam voltammetri
lucutan dikenal istilah lucutan anodik (anodic stripping), yaitu selama tahap
deposisi elektroda kerja bertindak sebagai katoda dan analit mengalami reduksi, sedangkan selama tahap lucutan elektroda kerja bertindak sebagai anoda dan analit mengalami oksidasi. Dalam hal ini potensial akumulasi lebih negatif dari potensial puncak (Wang, 2000). Deposisi merupakan proses pemekatan analit dengan cara mengakumulasikannya pada elektroda pada potensial dan waktu tertentu. Sedangkan lucutan merupakan tahapan dimana analit dilepaskan (dilucutkan) kembali dari elektroda ke dalam larutan. Setelah proses lucutan diperoleh voltammogram yang menyatakan kurva hubungan potensial dan arus (Harvey, 2000).
Analisis sampel dengan metode voltammetri lucutan dipengaruhi oleh beberapa parameter pengukuran diantaranya yaitu potensial akumulasi dan waktu akumulasi. Potensial akumulasi adalah potensial yang diberikan pada elektroda selama proses akumulasi analit berlangsung. Sedangkan waktu akumulasi atau waktu deposisi adalah lamanya waktu yang diperlukan oleh analit untuk terakumulasi pada elektroda. Semakin lama waktu akumulasi semakin banyak analit yang dapat terakumulasi pada elektroda (Wang, 2000). Puncak voltammogram yang dihasilkan dari metode voltammetri menggunakan teknik pulsa differensial, mempunyai arus yang besarnya sebanding dengan konsentrasi analit yang dianalisis. Hal ini sesuai dengan hukum Faraday pada persamaan 2.1.
……….. (2.1)
C
e=
i
1.t
d10
Dengan Ce adalah konsentrasi analit yang terakumulasi pada elektroda, il adalah
arus batas untuk akumulasi, td merupakan waktu akumulasi, n adalah jumlah
elektron yang terlibat dalam proses akumulasi, F merupakan bilangan Faraday, dan V adalah volume elektroda (Wang, 2000).
2.2.2 Elektroda
Elektroda merupakan komponen utama voltammetri yang berfungsi sebagai detektor analit yang akan direspon untuk menghasilkan sinyal arus. Analisis secara voltammetri melibatkan tiga elektroda yaitu elektroda kerja
(working electrode), elektroda pembanding (reference electrode), dan elektroda
pembantu (counter electrode) (Skoog, 1985). Ketiga elektroda dicelupkan ke
dalam larutan yang mengandung analit dan juga elektrolit pendukung.
Elektroda kerja merupakan elektroda yang sensitif terhadap analit yang dianalisis dan sebagai tempat analit mengalami reaksi reduksi-oksidasi. Elektroda kerja yang bagus dapat memberikan respon dan sinyal yang baik pada analit, mempunyai luas permukaan yang reproducible, serta memiliki arus background
yang rendah. Elektroda kerja yang banyak digunakan pada voltammetri adalah elektroda merkuri, karbon, dan logam mulia seperti platina dan emas (Wang, 2000).
Dalam analisis voltammetri, elektroda kerja yang sering digunakan adalah elektroda HMD. Elektroda HMD bersifat reproducible, mudah dimodifikasi, dan
memiliki permukaan yang halus (Wang, 2000). Selain itu, elektroda kerja lain yang banyak digunakan pada voltammetri adalah elektroda glassy carbon (GC).
luas dalam pengukuran. Selain itu, permukaan elektroda karbon mudah untuk dimodifikasi. Namun demikian elektroda GC biasanya memberikan arus
background yang tinggi (Wilson dan Wilson’s, 1992).
Pada Tabel 2.1 ditampilkan besarnya rentang pengukuran pada elektroda merkuri dan glassy carbon.
Tabel 2.1 Data rentang potensial pengukuran elektroda kerja pada voltammetri
Jenis Elektroda Rentang Potensial Pengukuran(V)
Hanging mercury drop electron (HMDE) + 0,2 – (-2,0)
Mercury film electrode (MFE) +0,2 – (-1,3)
Glassy carbon electrode (GCE) +1,5 – (-0,8)
Sumber : Kopanica, 1993
Elektroda pembanding merupakan elektroda dengan nilai potensial sel yang telah diketahui, konstan dan tidak peka terhadap larutan yang sedang dianalisis. Elektroda pembanding hanya berfungsi untuk mengontrol beda potensial dari elektroda kerja. Elektroda pembanding yang sering digunakan adalah elektroda Ag/AgCl. Elektroda Ag/AgCl dapat dibuat dengan cara mencelupkan kawat perak pada larutan jenuh KCl, sehingga terbentuk lapisan tipis AgCl pada permukaan kawat Ag (Skoog, 1985).
Elektroda pembantu merupakan elektroda yang berpasangan dengan elektroda kerja tetapi tidak berperan dalam menentukan besarnya potensial yang diukur. Selama proses lucutan (stripping) arus mengalir diantara elektroda
12
2. 3 Spektrofotometri Inframerah (IR)
Spektrofotometri inframerah merupakan teknik analisis suatu senyawa yang digunakan untuk menentukan gugus fungsi senyawa dan karakteristik senyawa yang sudah diketahui strukturnya. Daerah bilangan gelombang dituliskan dalam satuan cm-1. Daerah radiasi spektrofotometri inframerah berkisar antara
bilangan gelombang 4000-400 cm-1. Pada spektrum absorbsi dibuat dengan
bilangan gelombang pada sumbu x dan persentase transmitan (T) pada sumbu y (Khopkar, 1990).
Spektrofotometri inframerah dapat digunakan untuk analisis sampel berupa cairan maupun padatan. Analisis pada sampel cairan mempunyai sel khusus berupa pelat NaCl. Cairan diteteskan pada pelat berupa lapisan tipis. Untuk sampel berupa padatan digunakan teknik pelet KBr. Teknik ini dilakukan dengan cara menumbuk (0,1-2,0)% sampel dengan KBr, kemudian ditekan dengan tekanan tinggi dalam cetakan hingga membentuk pelet KBr yang transparan. Pelet tersebut diletakkan dalam sel alat spektrofotometer inframerah kemudian didapatkan spektrum IR sampel (Sitorus, 2009).
2.4 Spektrofotometri Difraksi Sinar-X
n.λ = 2.d.sin θ ……….. (2.2) Dengan n= 1,2, dan seterusnya, λ adalah panjang gelombang sinar-x yang digunakan, d adalah jarak antara dua bidang kisi, θ adalah sudut antara sinar datang dengan sinar pantul, dan n adalah bilangan bulat yang disebut sebagai orde pembiasan. Berdasarkan persamaan Bragg, sinar-x yang ditembakkan ke sebuah atom-atom akan terserap dan dihamburkan. Sinar-x yang diserap oleh atom-atom menyebabkan terjadinya eksitasi elektron yang dapat memancarkan elektron dan sinar-x. Sinar-x yang dihamburkan oleh atom-atom kemungkinan dapat menyebabkan terjadinya kehilangan elektron dan tidak kehilangan elektron pada proses hamburan cahaya (Chorkendorff dan Niemantsverdriet, 2003)
2.5 Zeolit
Zeolit merupakan kristal yang mempunyai karakter mikroporous (diameter kurang dari 2 nm) serta mempunyai stabilitas suhu yang tinggi. Rumus kimia zeolit adalah Mc/n [ (AlO2)C (SiO2)d ].bH2O, dengan ketentuan Mc/n adalah kation
logam alkali atau alkali tanah, n adalah valensi logam alkali, c adalah bilangan tertentu alumina dari 2-10, d adalah bilangan tertentu silika dari 2-7, b adalah jumlah molekul air kristal. Zeolit sering digunakan sebagai penyaring molekul karena bersifat selektif (Xu et al, 2007). Zeolit dapat memisahkan
molekul-molekul berdasarkan ukuran dan bentuk struktur kristal zeolit. Zeolit berfungsi sebagai penjebak molekul agar tertahan pada porinya (Harahap, 2006).
14
struktur tetrahedral (Prasetyoko et al, 2005). Berdasarkan ukuran pori-porinya,
zeolit dibagi menjadi tiga kelompok, yaitu sistem pori cincin-8 oksigen, sistem pori cincin-10 oksigen, dan sistem pori cincin-12 oksigen (Subagjo, 1993). Pada struktur MFI, zeolit mempunyai sistem pori cincin-10 oksigen.
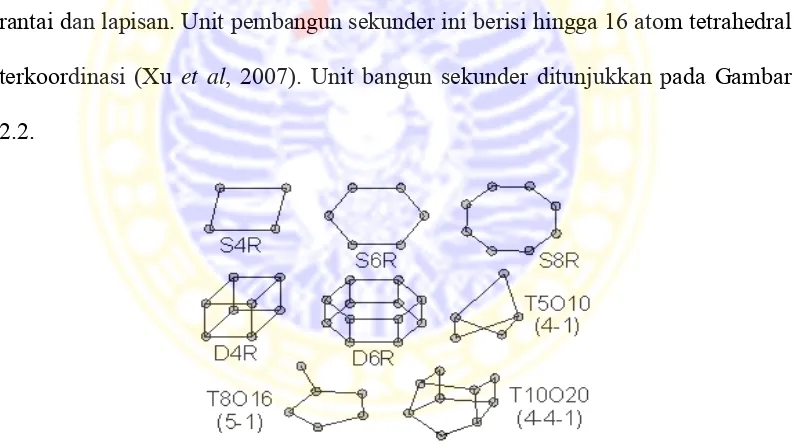
Struktur zeolit terdiri dari satuan unit pembangun primer dan yang paling kecil berupa tetrahedral TO4. Setiap atom T terkoordinasi untuk empat atom
oksigen, sedangkan masing-masing atom oksigen menjembatani dua atom T. Selanjutnya, unit pembangun primer membentuk rangkaian menjadi unit yang lebih besar yaitu unit pembangun sekunder. Unit pembangun sekunder berupa rantai dan lapisan. Unit pembangun sekunder ini berisi hingga 16 atom tetrahedral terkoordinasi (Xu et al, 2007). Unit bangun sekunder ditunjukkan pada Gambar
2.2.
Gambar 2.2 Unit bangun sekunder zeolit (Liebau, 1985) 2.5.1 Modifikasi elektroda dengan zeolit
BAB III
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini telah dilakukan di Laboratorium Kimia Analitik dan Laboratorium Instrumentasi Departemen Kimia Fakultas Sains dan Teknologi Universitas Airlangga, serta dilakukan di Laboratorium Bersama Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Surabaya. Penelitian dilaksanakan mulai bulan Januari sampai Juni 2012.
3.2 Bahan Penelitian
Bahan kimia yang digunakan dalam penelitian ini adalah kreatin (C4H9N3O2), tetraetil ortosilikat (TEOS), tetrapropilamonium hidroksida
(TPAOH), tetrabutil ortotitanat (TBOT), 2-propanol (C3H8O). Air yang digunakan
adalah akuabides. Bahan yang digunakan adalah pro analisis. 3.3 Peralatan Penelitian
Peralatan yang digunakan adalah 797 Voltammetry Computrace (MVA
system-1) yang terdiri atas wadah sampel, pengaduk magnetik, processor unit, PC,
elektroda kerja hanging mercury drop (HMD), elektroda pembanding Ag/AgCl
dan elektroda counter Pt. Peralatan lainnya adalah mikropipet, oven, neraca
3.4 Skema Penelitian
Uji validitas metode Pembuatan kurva standar
Optimasi parameter analisis kreatin menggunakan elektroda HMD-IZ
Uji kinerja elektroda HMD-IZ Pembuatan larutan kreatin
Linieritas Presisi Sensitivitas Limit deteksi Akurasi
Potensial akumulasi waktu akumulasi
Dibandingkan dengan elektroda HMD, HMD-zeolit dan HMD-NIZ Pembuatan zeolit, NIZ dan IZ
18
3.5 Prosedur Penelitian
3.5.1 Pembuatan larutan kreatin
3.5.1.1 Pembuatan larutan induk kreatin 1000 ppm
Sebanyak 0,1000 gram kreatin dilarutkan dalam air hingga tepat larut dalam gelas beker 100 mL. Kemudian larutan dipindahkan secara kuantitatif ke dalam labu ukur 100 mL dan diencerkan dengan air sampai tanda batas dan dikocok hingga homogen.
3.5.1.2 Pembuatan larutan kerja kreatin 10 ppm, 1 ppm, 50 ppb, 1 ppb Larutan kerja kreatin dengan konsentrasi 10 ppm dan 1 ppm masing-masing dibuat dengan cara memipet 1,0 mL larutan induk kreatin 1000 ppm dan 10,0 mL larutan kerja 10 ppm. Masing-masing larutan dipindahkan ke dalam labu ukur 100 mL, diencerkan dengan air sampai tanda batas dan dikocok hingga homogen.
Larutan kerja kreatin 50 ppb dan 1 ppb masing-masing dibuat dengan cara memindahkan secara kuantitatif 5,0 mL larutan kerja kreatin 1 ppm dan 2,0 mL larutan kreatin 50 ppb. Masing-masing larutan dipindahkan ke dalam labu ukur 100 mL. Larutan diencerkan dengan air sampai tanda batas dan dikocok hingga homogen. Larutan ini selalu dibuat baru.
3.5.2 Pembuatan zeolit, non imprinted zeolit (NIZ), dan imprinted zeolit (IZ)
3.5.2.1 Pembuatan zeolit
Sebanyak 11,8 mL TPAOH ditambahkan ke dalam campuran tersebut dan dilakukan pengadukan selama 15 jam, kemudian ditambahkan dengan 30 mL air, sehingga diperoleh campuran yang mempunyai perbandingan mol TEOS, TiO2,
TPAOH, dan H2O adalah 1 : 0,017 : 0,24 : 21,1. Campuran yang terbentuk
didiamkan selama 4 hari pada suhu 80°C (Eimer et al., 2008).
3.5.2.2 Pembuatan non imprinted zeolit (NIZ)
NIZ dibuat dengan cara mengambil sebanyak 0,57 gram TBOT dimasukkan ke dalam gelas beker yang berisi 10 mL 2-propanol dan ditambahkan 22 mL TEOS, kemudian dilakukan pengadukan selama 30 menit pada suhu kamar. Sebanyak 11,8 mL TPAOH ditambahkan ke dalam campuran tersebut dan dilakukan pengadukan selama 15 jam, kemudian ditambahkan dengan 30 mL air, sehingga diperoleh campuran yang mempunyai perbandingan mol TEOS, TiO2,
TPAOH, dan H2O = 1 : 0,017 : 0,24 : 21,1. Campuran yang terbentuk didiamkan
selama 4 hari pada suhu 80°C. Sebanyak 0,033 g kreatin dilarutkan dalam air panas hingga larut sempurna kemudian ditambahkan ke dalam campuran hingga diperoleh rasio molar kreatin/Si= 2,98 x 10-4 (Eimer et al., 2008). Selanjutnya,
campuran didiamkan selama 3 jam. Campuran ini disebut non imprinted zeolit
(NIZ).
3.5.2.3 Pembuatan imprinted zeolit (IZ)
20
dilakukan pengadukan selama 15 jam, kemudian ditambahkan dengan 30 mL air, sehingga diperoleh campuran yang mempunyai perbandingan mol TEOS, TiO2,
TPAOH, dan H2O adalah 1 : 0,017 : 0,24 : 21,1. Campuran yang terbentuk
didiamkan selama 4 hari pada suhu 80°C. Sebanyak 0,033 g kreatin dilarutkan dalam air panas hingga larut sempurna kemudian ditambahkan ke dalam campuran hingga diperoleh rasio molar kreatin/Si= 2,98 x 10-4 (Eimer et al.,
2008). Setelah didiamkan selama 3 jam, campuran dicuci dengan air panas sampai pH campuran bersifat netral. Pada tahap ini diduga terjadi pelepasan kreatin dari struktur zeolit. Zeolit, NIZ dan IZ yang terbentuk selanjutnya digunakan untuk memodifikasi elektroda HMD.
3.5.3 Karakterisasi terhadap zeolit
Dilakukan karakterisasi terhadap zeolit hasil sintesi menggunakan difraksi sinar-x. Kemudian dilihat struktur kristal zeolit, sudah terbentuk atau belum. 3.5.4 Karakterisasi terhadap zeolit, NIZ dan IZ
Dilakukan karakterisasi terhadap zeolit, NIZ dan IZ hasil sintesis menggunakan FTIR. Kemudian dilihat pergeseran puncak spektranya untuk mempelajari ikatan yang terbentuk antara zeolit dan template (kreatin).
3.5.5 Optimasi analisis kreatin secara voltammetri menggunakan elektroda HMD
diperoleh suatu kondisi yang optimum untuk kedua parameter. Selanjutnya hasil optimasi kedua parameter tersebut digunakan pada prosedur kerja selanjutnya. 3.5.5.1 Optimasi potensial akumulasi
Sebanyak 20 mL larutan kreatin 50 ppb dimasukkan ke dalam sel voltammetri dan ditambah dengan 5 mg IZ dan dilakukan analisis secara voltametri lucutan menggunakan elektroda HMD pada waktu akumulasi 60 detik, pH larutan 7,1 (Lakshmi et al., 2007), laju pengadukan 2000 rpm, dengan
potensial akumulasi yang divariasi mulai dari -1000 mV sampai 100 mV dengan interval 100 mV.
3.5.5.2 Optimasi waktu akumulasi
Sebanyak 20 mL larutan kreatin 50 ppb dimasukkan ke dalam sel voltammetri dan ditambah dengan 5 mg IZ. Selanjutnya dilakukan analisis secara voltametri lucutan menggunakan elektroda HMD dengan potensial optimum, pH larutan 7,1 (Lakshmi et al., 2007), dan waktu akumulasi divariasi mulai dari 30
detik sampai 120 detik.
3.5.6 Karakterisasi sensor secara voltammetri
22
3.5.7 Pembuatan kurva standar kreatin
Dibuat larutan standar kreatin dengan konsentrasi berturut-turut 1, 2, 3, 4, dan 5 ppb dengan cara memindahkan secara kuantitatif 50; 100; 150; 200; dan 250 µL larutan kreatin 1 ppm ke dalam 5 buah labu ukur 50 mL dan diencerkan dengan air sampai tanda batas. Diambil 20 mL masing-masing larutan standar tersebut dan dipindahkan ke wadah sampel dan ditambahkan 5 mg IZ, kemudian dilakukan dianalisis secara voltammetri lucutan menggunakan elektroda HMD. Untuk masing-masing konsentrasi dilakukan pengulangan pengukuran sebanyak 3 kali. Dari hasil pengukuran dibuat kurva standar antara konsentrasi kreatin dan arus yang teramati untuk masing – masing konsentrasi larutan standar kreatin, dan dibuat regresi liniernya. Data kurva standar tersebut digunakan untuk uji validitas metode.
3.5.8 Uji validitas metode
Data hasil pengukuran larutan standar digunakan untuk uji validitas metode. Validasi metode merupakan penilaian terhadap parameter tertentu berdasarkan percobaan laboratorium untuk membuktikan bahwa metode tersebut
telah memenuhi persyaratan penggunaan (Harmita, 2004). Parameter yang
digunakan untuk menyatakan validitas metode voltammetri pada penelitian ini
antara lain linieritas, presisi, sensitivitas, limit deteksi dan akurasi.
3.5.8.1 Linieritas
Linieritas merupakan kemampuan metode analisis yang memberikan
respon terhadap konsentrasi analit dan dinyatakan dengan harga koefisien
konsentrasi dengan arus dari penelitian ini diperoleh persamaan regresi y = a+bx dan harga koefisien korelasi (r). Korelasi linier antara respon arus dan konsentrasi analit ditentukan dengan uji t (persamaan 3.1). Koefisien korelasi diterima jika harga thitung > t tabel (Miller dan Miller, 1988).
...(3.1) Dengan ketentuan thitung adalah besarnya nilai t yang diperoleh dari perhitungan
menggunakan persamaan 3.1, r adalah harga koefisien korelasi dan n adalah jumlah larutan standar yang diukur. Sedangkan t tabel adalah nilai t yang diperoleh
dari tabel statistik dengan tingkat kepercayaan 95% (p = 0,05%). 3.5.8.2 Presisi (ketelitian)
24
Dengan SD adalah standar deviasi, KV adalah koefisien variasi, xi adalah arus
pada masing – masing pengukuran, x adalah arus rata-rata dan n adalah jumlah
pengulangan pengukuran. 3.5.8.3 Sensitivitas
Sensitivitas merupakan perbedaan arus yang dihasilkan dari perubahan konsentrasi pada analit. Sensitivitas metode pada penelitian ini ditentukan dari nilai slope kurva standar dibagi dengan luas permukaan setengah bola tetes elektroda. Semakin besar nilai slope dapat diartikan bahwa perubahan konsentrasi analit sedikit saja menyebabkan perubahan arus yang besar (Miller and Miller, 1988).
3.5.8.4 Limit deteksi (LOD)
Limit deteksi merupakan konsentrasi terkecil analit yang masih dapat dideteksi oleh metode tersebut (Harmita, 2004). Limit deteksi ditentukan dengan menggunakan data pada kurva standar dan dihitung dengan persamaan 3.4 dan 3.5.
YLOD = Ybl + 3Sbl……….(3.4)
YLOD = a + 3Sx/y………..(3.5)
Dengan Y LOD merupakan sinyal terkecil yang masih terdeteksi, Sbl adalah Sx/y =
standar deviasi sinyal blanko =
2 diperoleh dari intersep dari persamaan kurva standar, n adalah jumlah larutan standar yang diukur dan yi adalah rata – rata arus masing – masing pengukuran.
masing-masing konsentrasi larutan standar sebagai nilai x ke persamaan regresi kurva standar. YLOD yang diperoleh kemudian disubstitusikan ke persamaan regresi
kurva standar sehingga diperoleh nilai limit deteksi (x) (Miller dan Miller,1988). 3.5.8.5 Akurasi (ketepatan)
Akurasi adalah suatu harga yang menunjukkan derajat kedekatan hasil analisis dengan konsentrasi analit yang sebenarnya akurasi dinyatakan sebagai persen perolehan kembali (recovery) (Harmita, 2004). Pada penelitian ini, harga
akurasi ditentukan dengan menganalisis kreatin menggunakan konsentrasi larutan standar 1, 3, dan 5 ppb (Ks) secara voltammetri lucutan. Nilai arus yang diperoleh disubstitusikan ke persamaan regresi kurva standar sehingga diperoleh konsentrasi kreatin (Csp). Harga akurasi dapat dihitung dengan persamaan 3.6 (Miller dan Miller,1988).
R = x 100%...(3.6)
dengan ketentuan R adalah akurasi, Csp adalah konsentrasi kreatin hasil analisis
secara voltammetri lucutan, dan Ks adalah konsentrasi kreatin yang sebenarnya.
s sp
BAB IV
HASIL DAN PEMBAHASAN
4.1 Sintesis Zeolit, Non Imprinted Zeolit (NIZ), dan Imprinted Zeolit (IZ)
Penelitian ini bertujuan meningkatkan sensitivitas elektroda hanging
mercury drop (HMD) dengan cara memodifikasi elektroda HMD dengan IZ. Pada
penelitian ini, IZ dilapiskan pada permukaan elektroda HMD secara in situ, yaitu
penempelannya pada permukaan elektroda dilakukan bersamaan dengan akumulasi kreatin. Zeolit disintesis dengan menggunakan metode Eimer et al.,
(2008).
Zeolit yang digunakan dalam penelitian ini adalah zeolit sintesis. Zeolit disintesis dengan cara mencampurkan tetraetil ortosilikat (TEOS), tetrabutil ortotitanat (TBOT), tetrapropilamonium hidroksida (TPAOH), 2-propanol, dan air. TEOS berfungsi sebagai sumber silika, dan TBOT berperan sebagai sumber titanium. TBOT mempunyai sifat mudah terhidrolisis jika terkena udara. Oleh sebab itu, TBOT harus dilarutkan terlebih dahulu di dalam 2-propanol sebelum dicampurkan dengan bahan lainnya (Prasetyoko et al., 2005). Apabila
terhidrolisis, TBOT akan menjadi TiO2 yang stabil sehingga Ti tidak dapat
membentuk ikatan dengan Si. Sedangkan TPAOH berperan sebagai basa organik yang memberikan suasana basa dan menyumbangkan OH- untuk proses hidrolisis
Dalam melakukan sintesis zeolit ini wadah harus tertutup agar bahan dan produk tidak mudah terhidrolisis oleh udara. Selain itu pada saat proses sintesis selalu dilakukan pengadukan dengan kecepatan konstan. Pengadukan bertujuan untuk proses homogenasi dan mempercepat reaksi. Pada saat TEOS, TBOT, dan 2-propanol dicampurkan, terbentuk campuran berwarna putih. Selanjutnya, campuran diaduk selama 30 menit dan setelah ditambahkan TPAOH membentuk gel berwarna putih. Pengadukan dilanjutkan selama 15 jam. Pada saat ini terjadi proses aging yaitu pembentukan inti kristal zeolit (Smitha et al., 2006). Setelah
proses aging, sejumlah air ditambahkan ke dalam campuran hingga diperoleh perbandingan mol TEOS, TiO2, TPAOH, dan H2O sebesar 1: 0,017: 0,24: 21,2.
Kemudian campuran tersebut dimasukkan ke dalam reaktor dan dilakukan pemanasan hidrotermal dengan suhu 80°C selama 4 hari. Pada tahap ini terjadi pertumbuhan inti kristal zeolit. Hasil sintesis berupa cairan berwarna putih.
NIZ adalah zeolit yang porinya terisi oleh partikel kreatin. NIZ disintesis dengan cara mencampurkan larutan kreatin ke dalam campuran larutan bahan pembentuk zeolit, sehingga diperoleh rasio molar kreatin/Si= 2,98 x 10-4.
NH2
Ekstraksi dilakukan dengan menggunakan air panas karena kreatin dapat larut dalam air panas. Selanjutnya dilakukan sentrifuge untuk memisahkan endapan dan filtrat. Ekstraksi dilakukan hingga pH netral. Pada saat pH netral maka kemungkinan kreatin sudah lepas dari pori zeolit. Selanjutnya IZ dikeringkan dan didapatkan serbuk berwarna putih.
Gambar 4.1 Skema pembuatan NIZ dan IZ 4.2 Karakterisasi Zeolit Menggunakan Difraksi Sinar-x
Pada penelitian ini dilakukan karakterisasi zeolit menggunakan difraksi sinar-x. Tujuan dilakukan karakterisasi menggunakan difraksi sinar-x adalah untuk mengetahui proses hamburan sinar-x oleh bahan kristal. Apabila energi yang digunakan untuk menembakkan sinar besar, maka akan dihasilkan interaksi elektron inti dengan elektron pada kulit atom.
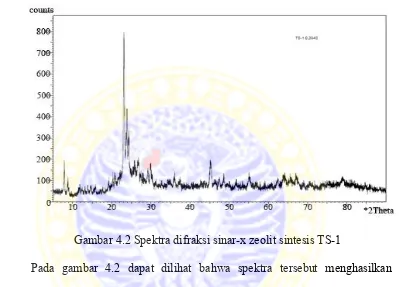
Pada penelitian ini, pola difraksi sinar-x zeolit sintesis TS-1 menggunakan daerah 2θ, 5 sampai 90°. Spektra difraksi sinar-x zeolit sintesis TS-1 pada penelitian ini ditampilkan pada gambar 4.2.
Gambar 4.2 Spektra difraksi sinar-x zeolit sintesis TS-1
Pada gambar 4.2 dapat dilihat bahwa spektra tersebut menghasilkan intensitas yang paling tinggi pada daerah 7,95°, 8,94°, 23,2°, 23,7°, 24,1° yang merupakan puncak khas dari struktur MFI pada zeolit. Dengan demikian sintesis zeolit telah berhasil dilakukan.
4.3 Karakterisasi Zeolit, NIZ, dan IZ Menggunakan FTIR
Pada penelitian ini dilakukan karakterisasi zeolit, NIZ, dan IZ
menggunakan fourier transform infrared (FTIR) spectrophotometer. Tujuan
FTIR dari zeolit, NIZ, dan IZ dapat dilihat pada Tabel 4.1, sedangkan spektra FTIR ditampilkan pada Gambar 4.3.
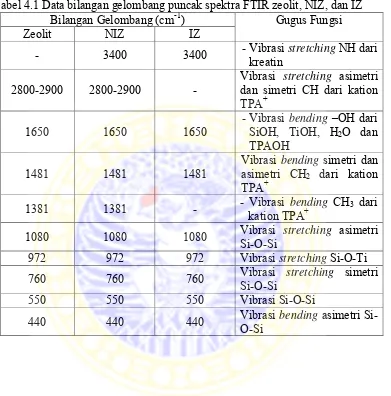
Tabel 4.1 Data bilangan gelombang puncak spektra FTIR zeolit, NIZ, dan IZ Bilangan Gelombang (cm-1) Gugus Fungsi
Zeolit NIZ IZ
- 3400 3400 -Vibrasi kreatin stretching NH dari
2800-2900 2800-2900 - Vibrasi dan simetri CH dari kation stretching asimetri TPA+
1650 1650 1650 -Vibrasi SiOH, TiOH, Hbending –OH dari 2O dan
TPAOH
1481 1481 1481 Vibrasi asimetri CHbending 2 dari kation simetri dan
TPA+
1381 1381 - - Vibrasi kation TPAbending+ CH3 dari
1080 1080 1080 Vibrasi Si-O-Si stretching asimetri 972 972 972 Vibrasi stretching Si-O-Ti
760 760 760 Vibrasi Si-O-Si stretching simetri
550 550 550 Vibrasi Si-O-Si
Si-Gambar 4.3 Spektra IR zeolit, NIZ, dan IZ
34
00
28
00
-2
90
0
16
50
14
81
13
81
10
80
972
760
550
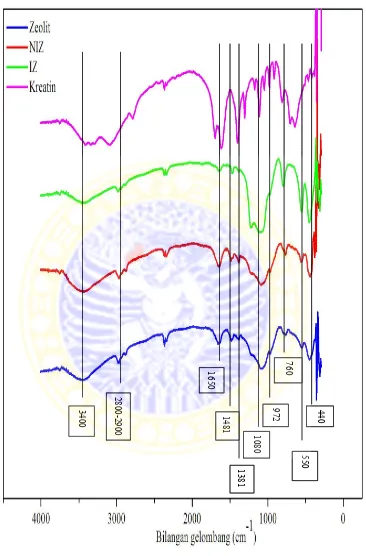
Dari spektra IR pada hasil sintesis zeolit, NIZ, dan IZ menunjukkan adanya gugus fungsi pada daerah bilangan gelombang tertentu. Pada daerah bilangan gelombang sekitar 1650 cm-1 menunjukkan adanya vibrasi bending dari
–OH dari SiOH, TiOH, H2O, TPAOH. Selanjutnya pada daerah bilangan
gelombang 440, 550, 760, 972, 1080 cm-1 menunjukkan puncak vibrasi
karakteristik untuk struktur zeolit. Bilangan gelombang 450 cm-1 menunjukkan
adanya vibrasi bending asimetri Si-O-Si. Pada daerah bilangan gelombang 550
cm-1 menunjukkan tebentuknya cincin ganda lima yang merupakan bukti
terbentuknya struktur zeolit MFI. Sedangkan pada bilangan gelombang 760 dan 1080 cm-1 menunjukkan vibrasi stretching simetri dan stretching asimetri dari
Si-O-Si. Kemudian pada daerah 972 cm-1 menunjukkan karakteristik pita sidik jari
vibrasi stretching Si-O-Ti yang merupakan bukti telah bergabungnya titanium ke
dalam struktur TS-1 (Zhao et al, 2000). Sutrisno et al (2005) telah melakukan
karakterisasi zeolit menggunakan FTIR. Gugus fungsi dihasilkan pada daerah bilangan gelombang 450, 551, 795, 960, dan 1100 cm-1 yang merupakan puncak
khas dari struktur zeolit.
Pada bilangan gelombang 1481, 1381, dan 2800-2900 cm-1 merupakan puncak khas dari TPAOH. Adanya vibrasi bending simetri dan asimetri CH2 dari
kation TPA+ ditunjukkan pada pita karakteristik 1481 cm-1. Pada daerah 2800-2900 cm-1 menunjukkan vibrasi stretching asimetri dan simetri CH dari kation
TPA+. Sedangkan bilangan gelombang 1381 cm-1 merupakan puncak untuk vibrasi
bending CH3 dari kation TPA+. Untuk zeolit dan NIZ puncak pada daerah tersebut
dikarenakan kemungkinan bebrapa kation TPA+ ikut terekstraksi dari NIZ. Pada
spektra imprinted zeolit, puncak pada daerah 2800-2900 dan 1381 cm-1 yang
merupakan puncak dari TPA+ tersebut mulai mengecil. Pada spektra IR NIZ dan
IZ daerah bilangan gelombang 3400 cm-1 menunjukkan adanya vibrasi stretching
NH dari kreatin. Puncak kreatin tidak dapat terlihat pada spektra IR NIZ. Hal ini kemungkinan disebabkan karena perbandingan jumlah mol kreatin/Si terlalu kecil, sehingga tidak ada perbedaan antara spektra NIZ dan zeolit. Untuk itu dilakukan uji kinerja elektroda (sub bab 4.5) untuk mengetahui perbedaan antara zeolit, NIZ, dan IZ.
4.4 Optimasi Analisis Kreatin Menggunakan Elektroda HMD
Kreatin merupakan senyawa elektroaktif yang dapat dianalisis menggunakan metode voltammetri. Untuk menggunakan voltammetri ini perlu dilakukan optimasi beberapa parameter diantaranya potensial dan waktu akumulasi. Pada penelitian ini digunakan pH 7,1 (Lakshmi et al., 2007).
4.4.1 Optimasi potensial akumulasi
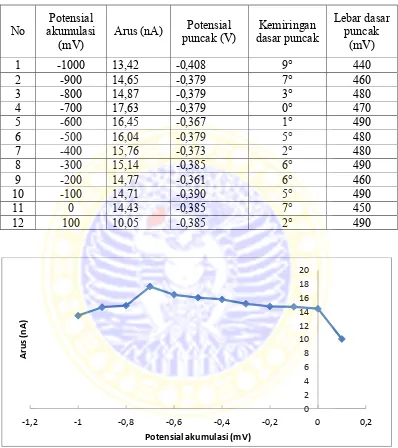
Tabel 4.2 Data hasil analisis kreatin pada berbagai potensial akumulasi kreatin pada elektroda HMD
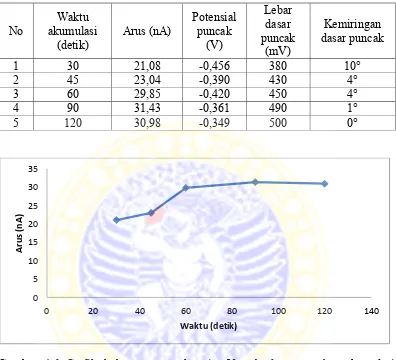
No akumulasi Potensial
(mV) Arus (nA)
Potensial
puncak (V) dasar puncak Kemiringan
Lebar dasar akumulasi menggunakan elektroda HMD
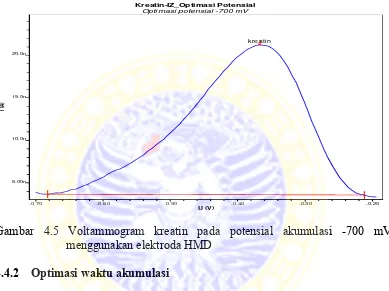
Pada penelitian ini dipilih potensial akumulasi -700 mV. Pada potensial tersebut diperoleh arus sebesar 17,63 nA dan potensial puncak sebesar -0,379 V. Analisis kreatin pada penelitian ini merupakan lucutan anodik karena potensial akumulasi lebih negatif dari potensial puncak (Wang, 2000). Potensial tersebut
dipilih karena memiliki arus optimum, bentuk kurva yang paling bagus, dengan kemiringan dan lebar dasar puncak yang kecil. Pada Gambar 4.5 merupakan voltammogram kreatin yang dianalisis menggunakan potensial akumulasi -700 mV.
Gambar 4.5 Voltammogram kreatin pada potensial akumulasi -700 mV menggunakan elektroda HMD
4.4.2 Optimasi waktu akumulasi
Pada penelitian ini optimasi waktu akumulasi terhadap kreatin dilakukan pada potensial kerja -700 mV dengan menggunakan variasi waktu 30, 45, 60, 90, 120 detik. Pada Tabel 4.3 dapat dilihat data hasil optimasi waktu akumulasi kreatin menggunakan elektroda HMD.
Kreatin-IZ_Optimasi Potensial
Optimasi potensial -700 mV
-0.70 -0.60 -0.50 -0.40 -0.30 -0.20 U (V)
5.00n 10.0n 15.0n 20.0n
I (
A)
Tabel 4.3 Data hasil optimasi waktu akumulasi kreatin menggunakan elektroda
Waktu akumulasi yang dipilih untuk analisis kreatin menggunakan elektroda HMD adalah 60 detik. Waktu akumulasi merupakan lamanya waktu yang diperlukan oleh analit untuk terakumulasi pada permukaan elektroda kerja, dan dapat mempengaruhi jumlah analit yang terakumulasi pada permukaan elektroda. Semakin lama waktu akumulasi, semakin lama besar arus yang dihasilkan (Wang, 2000). Pada Gambar 4.6 dapat diamati bahwa arus semakin besar seiring semakin lama waktu akumulasinya. Pada waktu akumulasi 30-90
detik arus yang dihasilkan semakin tinggi, tetapi pada waktu akumulasi 120 detik arus yang dihasilkan relatif sama. Hal ini kemungkinan disebabkan karena semakin lama waktu akumulasi, menyebabkan elektroda HMD jenuh oleh analit kreatin (Zen dan Hsu, 1998).
Gambar 4.7 Voltammogram kreatin pada waktu akumulasi 60 detik menggunakan elektroda HMD
4.5 Uji Kinerja Elektroda
Pada penelitian ini, uji kinerja elektroda termodifikasi dilakukan dengan cara membandingkan arus yang dihasilkan dari hasil analisis kreatin menggunakan elektroda HMD, HMD-zeolit, HMD-IZ, dan HMD-NIZ secara voltammetri lucutan. Pengukuran ini dilakukan dengan menggunakan potensial -700 mV, waktu analisis 60 detik, dan pH 7,1 (Lakshmi et al., 2007).
Hasil analisis kreatin menggunakan elektroda HMD, zeolit, HMD-IZ, dan HMD-NIZ secara voltammetri lucutan ditampilkan pada Tabel 4.4.
Kreatin_optimasi waktu Kreatin-IZ_Optimasi Waktu_60s
-0.70 -0.60 -0.50 -0.40 -0.30 -0.20 U (V)
10.0n 20.0n 30.0n 40.0n
I
(A
)
Tabel 4.4 Data hasil analisis kreatin 50 ppb pada uji kinerja elektroda HMD, HMD-zeolit, HMD-IZ, dan HMD-NIZ secara voltammetri lucutan
No Jenis elektoda Arus (nA) Arus rata-rata (nA) Potensial puncak
(mV) %KV
1 HMDE 31,74 30,47 30,77 -0,39 2,77
30,12
2 HMDE-IZ 28,59 29,59 29,25 -0,24 1,95 29,57
3 HMDE-Zeolit 15,66 15,32 14,78 -0,21 8,32 13,38
4 HMDE-NIZ 41,50 32,77 35,55 -0,37 14,5 32,38
Tabel 4.4 di atas dapat diamati hasil karakterisasi kreatin menggunakan elektroda HMD, HMD-zeolit, HMD-IZ, dan HMD-NIZ. Pada pengukuran ini dilakukan pengulangan sebanyak 3 kali. Nilai arus yang tertinggi diperoleh dari analisis kreatin menggunakan elektroda HMD-NIZ, kemudian urutan selanjutnya adalah hasil analisis menggunakan HMD-IZ, HMD, dan HMD-zeolit.
partikel kreatin lebih besar, sehingga cukup banyak partikel kreatin yang terukur setelah terlucut. Hal ini menyebabkan arus yang dihasilkan oleh elektroda HMD lebih besar daripada HMD-IZ dan HMD-zeolit.
Pada analisis kreatin menggunakan elektroda HMD-IZ, arus yang dihasilkan lebih besar daripada HMD-zeolit. Hal ini disebabkan karena IZ merupakan zeolit yang porinya telah tercetak partikel kreatin. Partikel kreatin dapat memasuki pori-pori zeolit karena ukuran pori-pori zeolit sudah sesuai dengan ukuran partikel kreatin. Kesesuaian ukuran pori menyebabkan analit kreatin mudah berdifusi menuju elektroda HMD dan menimbulkan arus. Adanya IZ ini dapat meningkatkan sensitivitas dari elektroda HMD terhadap partikel kreatin, sehingga arus yang dihasilkan cukup besar. Selanjutnya pada analisis kreatin menggunakan elektroda HMD-zeolit memiliki arus paling kecil, karena ukuran pori-pori zeolit belum disesuaikan dengan ukuran partikel kreatin. Pada saat ini, zeolit mempunyai homogenitas ukuran pori yang rendah sehingga tidak semua pori-pori zeolit dapat dimasuki oleh kreatin yang menyebabkan hanya sedikit kreatin terukur.
Jika dilihat dari nilai koefisien variasi pada tabel 4.4, elektroda HMD-IZ mempunyai nilai KV yang paling kecil. Sehingga dapat disimpulkan elektroda tersebut mempunyai ketelitian yang paling baik.
4.6 Kurva Standar Kreatin
tiga kali dan diambil nilai rata-rata arus yang dihasilkan. Pengukuran ini dilakukan menggunakan elektroda HMD-IZ pada potesial -700 mV dan waktu 60 detik. Data hasil pengukuran larutan standar kreatin ditampilkan pada Tabel 4.5. Tabel 4.5 Data hasil pengukuran arus larutan standar kreatin
No Konsentrasi (ppb) Arus (nA) Arus rata-rata (nA)
Gambar 4.8 Grafik hubungan antara konsentrasi kreatin dan nilai arus
Dari data hasil pengukuran larutan standar kreatin, dapat dilihat nilai arus dari masing-masing konsentrasi yang mengalami kenaikan dari 1 ppb hingga 5 ppb. Grafik kurva standar menunjukkan garis yang linier dan menghasilkan persamaan regresi y = 8,14x + 8,432 dengan R2 = 0,993. Data hasil pengukuran
kurva baku dapat digunakan untuk menghitung validitas metode. 4.7 Uji Validitas Metode
4.7.1 Linieritas
Linieritas merupakan hubungan linier antara konsentrasi kreatin dan nilai arus yang dihasilkan yang dinyatakan dengan harga koefisien korelasi (r) dari persamaan regresi kurva standar. Persamaan regresi yang dihasilkan dari kurva standar adalah y = 8,14x + 8,432 dengan R2 = 0,993. Nilai koefisien korelasinya
(r) adalah 0,996. Karena nilai koefisien korelasinya mendekati 1 maka linieritasnya dikatakan baik. Korelasi linier antara konsentrasi kreatin dan arus dapat ditentukan dengan uji t. Koefisien korelasi dapat diterima jika harga thitung >
ttabel. Pada penelitian ini koefisien korelasi dari persamaan regresi dapat diterima
karena harga thitung = 20,61 > ttabel = 3,18. Pada penelitian Lakshmi (2007),
menggunakan elektroda HMD-MIP mempunyai nilai koefisien korelasi 0,99. 4.7.2 Presisi (ketelitian)
Tabel 4.6 Data hasil perhitungan standar deviasi dan koefisien variasi
No Konsentrasi kreatin
(ppb) Standar Deviasi (SD) Koefisien Variasi (KV)
1 1 0,25 1,43 %
2 2 8,835 37, 5 %
3 3 3,779 11,7 %
4 4 2,87 6,79 %
5 5 1,01 2, 06 %
Dari data Tabel 4.6 dapat dilihat nilai standar deviasi dan koefisien variasi dari masing-masing konsentrasi larutan standar. Suatu metode dikatakan mempunyai ketelitian yang baik jika nilai koefisien variasi (KV) kurang dari 3%. Pada analisis ini larutan standar pada konsentrasi 1 dan 5 ppb mempunyai nilai KV kurang dari 3% yaitu 1,43% dan 2,06%. Hal ini menandakan pengulangan pengukuran pada konsentrasi 1 dan 5 ppb baik, sehingga juga mempunyai ketelitian yang baik. Pada analisis larutan standar kreatin konsentrasi 2, 3, 4 ppb mempunyai nilai KV lebih dari 3% yaitu 37,5%, 11,7%, 6,79%. Hal tersebut berarti pada konsentrasi 2, 3, dan 4 ppb mempunyai ketelitian yang kurang baik. 4.7.3 Sensitivitas
4.7.4 Limit deteksi (LOD)
Limit deteksi pada penelitian ini dapat dihitung melalui data hasil analisis larutan standar. Pada penelitian ini menghasilkan nilai limit deteksi sebesar 0,44 ppb. Hal ini berarti pada konsentrasi terkecil analit dalam sampel yang masih dapat diukur dan terdeteksi oleh elektroda HMD-IZ adalah 0,44 ppb. Pada penelitian Lakshmi (2007), menggunakan elektroda HMD-MIP memperoleh limit deteksi 0,11 ppb.
4.7.5 Akurasi (ketepatan)
Ketepatan merupakan ukuran yang menunjukkan derajat kedekatan hasil analisis dengan kadar analit yang sebenarnya. Ketepatan dinyatakan sebagai persen perolehan kembali (recovery) (Harmita, 2004). Untuk menghitung nilai
akurasi ini dikonsentrasi 1, 3, 5 ppb. Akurasi suatu metode dikatakan baik jika mempunyai nilai recovery mendekati 100%. Pada penelitian ini nilai recovery
pada konsentrasi 1 ppb adalah 111%, pada konsentrasi 3 ppb adalah 97%, sedangkan recovery pada konsentrasi 5 ppb adalah 99,2%. Lakshmi et al., (2007)
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari penelitian yang telah dilaksanakan, dapat diambil kesimpulan sebagai berikut.
1. Berdasarkan karakteristik spektra IR dari zeolit, NIZ, dan IZ dihasilkan puncak spektra IR pada bilangan gelombang 1650, 440, 550, 760, 972, 1080, 1481, 1381, dan 2800-2900 cm-1. Pada IZ bilangan gelombang 3400
cm-1 merupakan puncak dari kreatin, yaitu vibrasi NH. Puncak kreatin lain tidak dapat terlihat pada spektra IR NIZ kemungkinan disebabkan karena perbandingan jumlah mol kreatin/Si terlalu kecil.
2. Kondisi optimum potensial akumulasi dan waktu akumulasi pada analisis kreatin menggunakan elektroda HMD-IZ adalah pada potensial -700 mV dan pada waktu 60 detik.
3. Hasil analisis kreatin menggunakan elektroda HMD, zeolit, HMD-IZ, dan HMD-NIZ menghasilkan arus yang paling besar pada elektoda NIZ, dengan urutan selanjutnya adalah HMD, IZ, dan HMD-zeolit.
berkisar antara 1,43 % hingga 37,5 %, limit deteksi 0,44 ppb, dan nilai akurasi pada konsentrasi 1, 3, dan 5 pbb adalah 111%, 97%, dan 99,2%. 5.2 Saran
1. Diperlukan penelitian lebih lanjut untuk mengetahui ukuran zeolit yang disintesis.
2. Dibuat perbandingan mol kreatin/Si yang lebih besar lagi.
DAFTAR PUSTAKA
Al-Ghamdi, A.F., Hefnawy, M.M., 2012, Electrochemical Determination Of Rosiglitazone by Square-wave Adsorptive Stripping Voltammetry Method, Arabian Journal of Chemistry, 5, 383-389
Ardakani, M.M., Akrami, Z., Kazemian, H., Zare, H.R., 2005, Electrocatalytic Characteristics of Uric Acid Ovidation at Graphite-zeolite-modified Electrode Doped with Iron (III), Jurnal of Electroanalytical Chemistry,
589, 60-69
Braitina Kh. Z., Malakhova N.A., Stojko, Y., 2000, Stripping Voltammetry in Environmental and Food Analysis, Fresenius Journal of Analytical
Chemistry,368, 307-325
Brudnak, M. A., 2004, Creatine: Are the Benefits Worth the Risk? Toxicology
Letters, 150, 123–130
Burke, D.G., MacLean, P.G.,Walker, R.A., Dewar, P.J., Smith-Palmer, T., 1999, Analysis of Creatine and Creatinine in Urine by Capillary Electrophoresis, Journal of Chromatography B, 732, 479–485
Chorkendorff, I., Niemantsverdriet, J.W., 2003, Concepts of Modern Catalysis
and Kinetics, WILEY-VCH Verlag GmbH & Co., New York
Eimer, G.A., Diaz, I., Sastre, E., Casuscelli, G.S., Crivello, M.E., Herrero, E.R., and Perez-Pariente, J., 2008, Mesoporous Titanosilicates Synthesized from TS-1 Precursors with Enhanced Catalytic Activity Activity in The –Pinene Selective Oxidation, Applied Catalysis A: General, 343,
77-86
Flisinska, A., Bojanowska, A., 1996, Effects of Oral Creatine Administration on Skeletal Muscle Protein and Creatine Levels, Biology of Sport, 13,
39–46
Harahap, S., 2006, Laporan Akhir Kajian Bahan Galian Zeolit Utuk Dimanfaatkan Sebagai Bahan Baku Pupuk, Badan Penelitian &
PengembanganPropinsi Sumatra Utara, Medan
Harmita, 2004, Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitungannya, Majalah Ilmu Kefarmasian,1, 117-135
Harvey, D., 2000, Modern Analytical Chemistry, McGraw-Hill Companies,
Kasumov, T., Gruca, L.L., Dasarathy, S., Kalhan, S., 2009, Simultaneous Assay of Isotopic Enrichment and Concentration of Guanidinoacetate and Creatine by Gas Chromatography–Mass Spectrometry, Analytical
Biochemistry, 395, 91-99
Khopkar, penerjemah Saptorahardjo, 1990, Konsep Dasar Kimia Analitik, UI
Press, Jakarta
Kopanica, M., 1993, Advanced Instrumental Method of Chemical Analysis, Editor
Jaroslav Churacek, Head of Departement of Analytical Chemistry, University of Chemical Technology, Pardubice, Czech Republic, 94-95 Lakshmi, D., Sharma, P.S., Prasad, B.B., 2007, Imprinted Polymer-Modified
Hanging Mercury Drop Electrode for Differential Pulse Cathodic Stripping Voltammetric Analysis of Creatine, Biosensors and
Bioelectronics, 22, 3302-3308
Liebau, F., 1985, Stuctrural Chemistry of Silictes, Spinger-Verlag, Berlin
Mendham, J., and Jenney, R.C., 2000, Textbook of Quantitative Chemical
Analysis, 6thedition, Singapore Addision Wesley, Longman Singapore.
Miller, J.C., and Miller, J.N., 1988, Statistic for Analytical Chemistry, 2nd edition,
Ellis Horword Limited, England
Mo, Y., Dobberpuhl, D., Dash, A.K., 2003, A Simple HPLC Method with
Pulsed EC Detection for the Analysis of Creatine, Journal of
Pharmaceutical and Biomedical Analysis, 32,125-132
Nasrallah, F., Feki, M., Kaabachi, N., 2009, Creatine and Creatine Deficiency Syndromes: Biochemical and Clinic Aspect, Review Article, 163-171
O’Neil, 2001, The Merck Index, An Encyclopedia of Chemicals, Drugs and
Biologicals, 13th edition, Merck Research Laboratories Division of, Merck
and Co., Inc., Whitehouse Station, New York, 5831, 9947
Prasetyoko, D., Ramli, Z., Endud, S., Nu, H., 2005, Pengaruh Konsentrasi Titanium dalam Silikat pada Vibrasi Gugus Hidroksil Permukaan dengan Menggunakan Teknik Spektroskopi Inframerah, Journal of
Analytical Chemistry, 4, 1-10
Saryati, Wardiyati, S., 2007, Aplikasi Voltametri Untuk Penentuan Logam Berat Dalam Bahan Lingkungan, Jurnal Sains Materi Indonesia,
48
Sewell, A.C., Murphy, H.C., Iies, R.A., 2002, Use of Proton Nuclear Magnetic Resonance Spectroscopy in Detection and Study of Organic Acidurias,
Clinical Chemistry, 48, 357–359
Sitorus, M., 2009, Spektroskopi Eludasi Struktur Molekul Organik, Graha Ilmu,
Yogyakarta
Skoog, D.A., 1985, Principles of Instrumental Analysis, CBS College Publishing,
USA
Skoog, D.A., West, D.M., Holler, F.J., 1998, Fundamental of Analytical
Chemistry, 7th edition, Thomson Learning Inc
Smitha, S., Shajesh, P., Aravind, P.R., Kumar, S.R., Pillai, P.K., Warrier, K.GK., 2006, Effect of Aging Time and Concentration of Aging Solution on the Porosity Characteristics of Subcritically Dried Silica Aerogels,
Microporous and Mesoporous Material, 91, 286-292
Stefan, R.I., Bokretsion, R.G., 2003, Determination of Creatine and Creatinine Using a Diamond Paste Based Electrode, Instrumentation Science &
Technology, 31, 183–188.
Stout. J.R., Antonio, J., Kalman, D., 2008, Essentials of Creatine In Sport and
Health, Humana Press, Totowa
Subagjo, 1993, Zeolit: Struktur, dan Sifat-sifatnya, Warta Kimia analitik, ITB,
Vol. 7, No. 3
Sutrisno, H., Suharto, Kristianingrum, S., 2005, Optimasi dan Mekanisme Reaksi Pembentukan Kristal Mikropori Redoks Titanium Silikat Tipe MFI, Journal of Analytical Chemistry, 4, 35-44
Thomas, F.G., Henze, G., 2001, Introducing to Voltammetric Analysis Theory and
Practice, CSIRO Publishing, Australia
Walcarius, A.,1998, Zeolite Modified Electrodes in Electroanalytical Chemistry, Analytica Chimica Acta, 384, 1-16
Wang, J., 2000, Analytical Electrochemistry, Wiley-VCH, Canada.
Wilson and Wilson’s, 1992, Comprehensive Analytical Chemistry : Analytical
Voltammetry, Vol. XXVII, Edited By G.Svehla, Elseviers, New York
Wyss, M., Kaddurah-Daouk, R., 2000., Creatine and Creatinine Metabolism,
Xu, R., Pang, W., Yu, J., Huo, Q., Chen, J., 2007, Chemistry of Zeolites and
Realited Porous Materisl: Synthesis and Structure, John Willey & Sons
(Asia), Singapore
Zinellu, A., Caria, M.A., Tavera, C., Sotgia, S., Chessa, R., Deiana, L., Carru, C., 2005, Plasma Creatinine and Creatine Quantification by Capillary Electrophoresis Diode Array Detector, Analytical Biochemistry, 342,
186–193
Zen, Jyh-Myng., Hsu, Chi-Teng., 1998, A Selective Voltammetric Method for Uric Acid Detection at Nafion®-coated Carbon Paste Electrodes,
Talanta, 46, 1363-1369
Lampiran 1. Perhitungan Pembuatan Larutan Kerja Kreatin 1. Larutan induk kreatin 1000 ppm
1000 ppm = 1000 =
1000 =
Untuk membuat larutan induk kreatin 1000 ppm dalam 100 mL diperlukan kreatin 100 mg atau 0,1000 gram.
2. Larutan kreatin 10 ppm M1.V1 = M2. V2
1000. V1 = 10. 100
V1 = 1,0 mL
3. Larutan kreatin 1 ppm M1.V1 = M2. V2
10. V1 = 1. 100
V1 = 10,0 mL
4. Larutan kreatin 50 ppb M1.V1 = M2. V2
1000. V1 = 50. 100
V1 = 5,0 mL
5. Larutan kreatin 1 ppb M1.V1 = M2. V2
50. V1 = 1. 100
Lampiran 2. Perhitungan Komposisi Zeolit 1 TEOS : 0,017 TBOT : 0,24 TPAOH : 21,2 H2O
1. TEOS 99%
n TEOS =
gram TEOS = 1 x 208,32 = 208,32 gram
99% TEOS =
x 208,32 = 210,42 gram
V TEOS = = = 225,29 mL
2. TBOT 98%
n TBOT =
gram TBOT = 0,017 x 340,32 = 5, 7854
98% TBOT =
x 5,7854 = 5,9035 gram
V TBOT = = = 6,7 mL
3. TPAOH 40%
n TPAOH =
gram TPAOH = 0,24 x 203,365 = 48,8076
40% TPAOH =
x 48,8076 = 122,019 gram
V TPAOH = = = 120,572 mL = 120,6 mL
4. H2O
gram H2O = 21,2 x 18 = 381,6 gram
H2O dalam campuran:
1% TEOS =
x 210,42 = 2,1042 gram
2% TBOT =
x 5,9035 = 0,1181 gram
60% TPAOH = x 122,019 = 73,2114 gram
H2O yang harus ditambahkan :
H2Oyang dibutuhkan - H2Ocampuran
= 381,6 – (2,1042 + 0,1181 + 73,2114)