PENGEMBANGAN SENSOR VOLTAMMETRIK KREATIN MELALUI MODIFIKASI ELEKTRODA HANGING MERCURY DROP DENGAN
MOLECULARLY IMPRINTED POLIANILIN
SKRIPSI
MARGARETHA C.P. NIKITA
DEPARTEMEN KIMIA
FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS AIRLANGGA
Pembimbing II
Dr. rer. nat. Ganden Supriyanto, M.Sc NIP. 19681228 199303 1 001
Pembimbing I
Dra. Miratul Khasanah, M.Si NIP. 19670304 199203 2 001
PENGEMBANGAN SENSOR VOLTAMMETRIK KREATIN MELALUI MODIFIKASI ELEKTRODA HANGING MERCURY DROP DENGAN
MOLECULARLY IMPRINTED POLIANILIN
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Bidang Kimia Pada Fakultas Sains dan Teknologi
Universitas Airlangga
Oleh :
MARGARETHA C.P. NIKITA NIM : 080810302
Pembimbing I
Dra. Miratul Khasanah, M.Si NIP. 19670304 199203 2 001
Pembimbing II
Dr. rer. nat. Ganden Supriyanto, M.Sc NIP. 19681228 199303 1 001
LEMBAR PENGESAHAN NASKAH SKRIPSI
Judul : Pengembangan Sensor Voltammetrik Kreatin melalui Modifikasi Elektroda Hanging Mercury Drop dengan
Molecularly Imprinted Polianilin
Penyusun : Margaretha C.P. Nikita NIM : 080810302
Pembimbing I : Dra. Miratul Khasanah, M.Si
Pembimbing II : Dr. rer. nat. Ganden Supriyanto, M.Sc Tanggal Ujian : 9 Agustus 20123 Januari 2012
Disetujui oleh :
Mengetahui:
Kepala Departemen Kimia Fakultas Sains dan Teknologi
Universitas Airlangga
PEDOMAN PENGGUNAAN SKRIPSI
Skripsi ini tidak dipublikasikan, namun tersedia dalam lingkungan Universitas Airlangga, diperkenankan untuk dipakai sebagai referensi kepustakaan, tetapi pengutipan harus seijin penyusun dan harus menyebutkan sumbernya sesuai kebiasaan ilmiah.
KATA PENGANTAR
Puji syukur kepada Tuhan Yang Maha Esa atas penyertaanNya dan RahmatNya yang tak terhingga sehingga penyusun dapat menyelesaikan skripsi dengan judul “Pengembangan Sensor Voltammetrik Kreatin melalui Modifikasi Elektroda Hanging Mercury Drop dengan Molecularly Imprinted
Polianilin”
Penyusun menyadari bahwa penulisan skripsi ini tidak lepas dari bantuan berbagai pihak, untuk itu penyusun menyampaikan terima kasih kepada:
1. ibu Dra. Miratul Khasanah, M.Si selaku pembimbing I dan Bapak Dr. rer nat Ganden Supriyanto, M.Sc selaku pembimbing II yang telah memberikan saran, doa dan bimbingan sampai terselesaikannya skripsi ini
2. ibu Dr. Nanik Siti Aminah, M.Si selaku Dosen Wali yang senantiasa membimbing serta memberikan banyak masukan
3. ibu Dr. Alfinda Novi Kristanti, DEA selaku Ketua Departemen Kimia yang senantiasa memberikan dukungan
4. bapak Drs. Handoko D, DEA dan ibu Dr. Pratiwi Pujiastuti, M.Si selaku
penguji yang telah memberikan masukan sehingga naskah skripsi ini dapat terselesaikan
5. Seluruh dosen jurusan kimia fakultas Sains dan Teknologi yang telah memberikan ilmu selama proses perkuliahan
6. ibu dan almarhum ayah yang memberikan kasih sayang, doa, kepercayaan, dan
7. teman – teman angkatan 2008 yang senantiasa menemani dalam menuntut ilmu dan teman-teman angkatan 2006, 2007, 2009, dan 2010 yang telah memberikan banyak dukungan
8. pihak – pihak yang tidak dapat disebutkan satu persatu yang banyak
memberikan saran, masukan dan pengalamannya
Penyusun menyadari bahwa dalam penulisan skripsi ini masih banyak kekurangan, sehingga penyusun mengharapkan kritik dan saran yang membangun demi perbaikan skripsi ini selanjutnya. Semoga skripsi ini dapat bermanfaat bagi pengembangan ilmu kimia analitik khususnya di bidang voltammetri.
Surabaya, Juli 2012 Penyusun
Nikita, M. C. P., 2012, Pengembangan Sensor Voltammetrik Kreatin melalui Modifikasi Elektroda Hanging Mercury Drop dengan Molecularly Imprinted
Polianilin, Skripsi dibawah bimbingan Dra. Miratul Khasanah, M.Si., dan Dr. rer. nat. Ganden Supriyanto, M.Sc., Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga.
ABSTRAK
Kreatin merupakan salah satu senyawa golongan asam amino yang memainkan peran sangat penting dalam metabolisme protein. Kelebihan kreatin dalam tubuh dapat mengakibatkan penyakit jantung dan ginjal sehingga pengontrolan kadar kreatin dalam tubuh menjadi sangat penting dengan mendiagnosa sejak awal. Penelitian ini dikembangkan untuk menganalisis kreatin secara voltammetri menggunakan elektroda modifikasi hanging mercury drop
(HMD) dengan molecularly imprinted polianilin (MIP). MIP disintesis dengan cara mereaksikan anilin sebagai monomer, amonium peroksodisulfat sebagai inisiator dan kreatin sebagai molekul target. MIP yang terbentuk dikarakterisasi menggunakan FTIR. Elektroda HMD-MIP yang terbentuk digunakan untuk menganalisis kreatin secara voltammetri pada potensial akumulasi 0,3 volt, waktu pelapisan MIP 15 detik, waktu akumulasi kreatin 90 detik dan pH 7. Validitas metode didapatkan dari regresi linier kurva standar kreatin pada konsentrasi 1 ppb – 5 ppb. Harga faktor korelasi (r) yang didapatkan sebesar 0,9669, % KV pada konsentrasi 1, 3 dan 5 ppb berturut-turut adalah 19,90%, 28,42% dan 22,51%, sensitivitas yang didapatkan sebesar 4,794 x 10-5 nA/ppb cm2, limit deteksi sebesar 1, 4379 ppb dan akurasi pada 1, 3 dan 5 ppb berturut-turut sebesar 123,40%, 116,00% dan 99,09%.
Nikita, M. C. P., 2012, Development of Voltammetric Sensor for Creatine through a Modification of Hanging Mercury Drop Electrode with Molecularly Imprinted Polyaniline, The final research is under guidance of Dra. Miratul Khasanah, M.Si., and Dr. rer. nat. Ganden Supriyanto, M.Sc., Department of Chemistry, Faculty of Science and Technology, Airlangga University
ABSTRACT
Creatine is an amino acid which plays an important role in the metabolism of proteins. The excess of creatine in body can cause heart attack and kidney disease therefore creatine’s control in body becomes very important to diagnose early. This research was developed to analyze creatine by voltammetry using modification of hanging mercury drop (HMD) electrode with molecularly imprinted polyaniline (MIP). MIP was synthesized by reacting the solution of aniline as monomer, ammonium peroxodisulphate as initiator and creatine as molecular target. MIP formed was characterized using FTIR. HMD-MIP electrode formed is used to analyze creatine by voltammetry on accumulation potential 0,3 volt, deposition time of MIP 15 seconds, accumulation time of creatine 60 seconds and pH solution 7. Validation parameter was obtained from a linear regression of standard curve at 1 ppb – 5 ppb concentrations. Correlation factor (r) obtained is 0,9669, %KV at 1, 3 and 5 ppb concentration respectively are 19,90%, 28,42% and 22,51%, sensitivity of method is 4,794 x 10-5 nA/ppb cm2, limit of detection is 1,4379 and accuracy at 1, 3 and 5 ppb concentration are 123,40%, 116,00% and 99,09%.
DAFTAR ISI
LEMBAR JUDUL ... i
LEMBAR PERNYATAAN ... ii
LEMBAR PENGESAHAN ... iii
PEDOMAN PENGGUNAAN SKRIPSI ... iv
KATA PENGANTAR ... v
ABSTRAK ... vii
ABSTRACT ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN 1.1 Latar Belakang Permasalahan ... 1
1.2 Perumusan Masalah ... 3
1.3 Tujuan Penelitian ... 4
1.4 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA 2.1 Kreatin... 5
2.1.1 Gambaran umum kreatin ... 5
2.1.2 Analisis kreatin ... 6
2.2 Voltammetri ... 7
2.2.1 Voltammetri lucutan ... 8
2.2.2 Elektroda ... 9
2.3 Polimer ... 10
2.4 Polianilin (PANi) ... 12
2.5 Molecularly Imprinted Polymer (MIP) ... 13
BAB III METODE PENELITIAN 3.1 Tempat dan Waktu Penelitian ... 15
3.2 Bahan Penelitian ... 15
3.3 Peralatan Penelitian ... 15
3.4 Diagram Alir Penelitian ... 16
3.5 Prosedur Penelitian ... 17
3.5.1 Pembuatan larutan kreatin ... 17
3.5.1.1 Pembuatan larutan induk kreatin 1000 ppm ... 17
3.5.1.2 Pembuatan larutan kerja kreatin 10 ppm, 1 ppm, 30 ppb dan 5 ppb ... 17
3.5.2 Pembuatan polianilin (PANi), non imprinted polymer (NIP), dan molecularly imprinted polymer (MIP) ... 18
3.5.4 Optimasi waktu akumulasi kreatin menggunakan elektroda
HMD ... 19
3.5.5 Uji kinerja elektroda ... 19
3.5.6 Pembuatan kurva standar kreatin ... 20
3.5.7 Uji validitas metode ... 20
3.5.7.1 Linieritas ... 20
3.5.7.2 Ketelitian ... 21
3.5.7.3 Sensitivitas ... 21
3.5.7.4 Limit deteksi ... 22
3.5.7.5 Akurasi ... 23
BAB 1V HASIL DAN PEMBAHASAN 4.1 Sintesis NIP (NonImprinted Polymer), MIP (Molecularly Imprinted Polymer) dan Polianilin (PANi) ... 24
4.1.1 Sintesis NIP (non imprinted polymer) ... 24
4.1.2 Sintesis MIP (molecularly imprinted polymer) ... 27
4.1.3 Sintesis polianilin (PANi) ... 27
4.1.4 Karakterisasi NIP, MIP dan PANi ... 29
4.2 Optimasi Analisis Kreatin Menggunakan Voltammetri Lucutan ... 31
4.2.1 Optimasi potensial akumulasi kreatin ... 32
4.2.2 Optimasi waktu akumulasi kreatin ... 34
4.3 Uji Keberhasilan Ekstraksi Kreatin dari Jaringan Polimer ... 36
4.4 Uji Kinerja Elektroda ... 37
4.5 Pembuatan Kurva Standar Kreatin... 39
4.6 Validitas Metode ... 40
4.6.1 Linieritas ... 41
4.6.2 Ketelitian ... 41
4.6.3 Sensitivitas ... 42
4.6.4 Limit deteksi ... 42
4.6.5 Akurasi ... 43
BAB V KESIMPULAN DAN SARAN 5.1 Kesimpulan ... 44
5.2 Saran ... 44
DAFTAR TABEL
No Judul Halaman
4.1 Data hasil analisis kreatin 30 ppb pada optimasi potensial akumulasi kreatin menggunakan elektroda HMD
33
4.2 Data hasil analisis kreatin 30 ppb pada optimasi waktu akumulasi kreatin menggunakan HMD
35
4.3 Data hasil analisis kreatin 5 ppb pada uji kinerja elektroda HMD, HMD-MIP, HMD-NIP dan HMDE-PANi
37
4.4 Data hasil pengukuran larutan standar kreatin 40
DAFTAR GAMBAR
No Judul Halaman
2.1 Struktur kreatin 5
2.2 Reaksi kesetimbangan kreatin dan kreatinin dalam air
6
2.3 Reaksi polimerisasi kondensasi padapoliester 11
2.4 Reaksi polimerisasi adisi pada polimerisasi vinyl 12
2.5 Skema ilustrasi dari pembentukan molecular imprinting
13
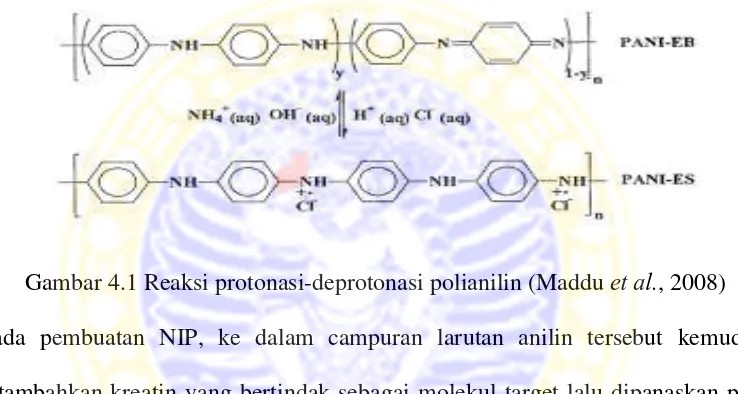
4.1 Reaksi protonasi-deprotonasi polianilin 25
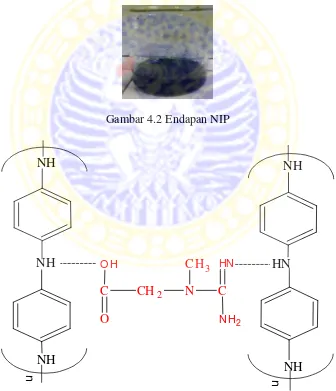
4.2 Endapan NIP 26
4.3 Dugaan ikatan antara polianilin dan kreatin 26
4.4 (a) Foto endapan MIP hasil sentrifugasi, (b) MIP berbentuk serbuk
27
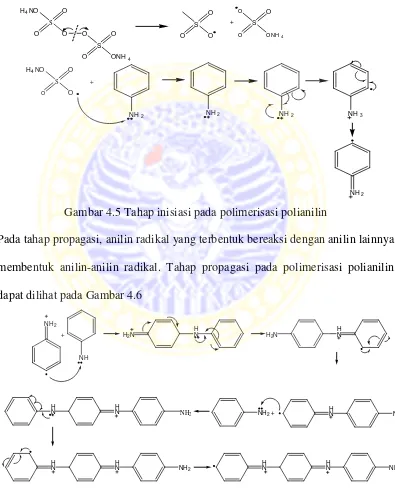
4.5 Tahap inisiasi pada proses polimerisasi polianilin 28
4.6 Tahap propagasi pada polimerisasi polianilin 28
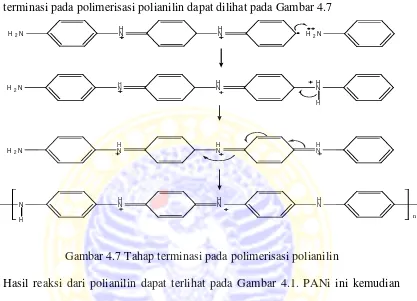
4.7 Tahap terminasi pada polimerisasi polianilin 29
4.8 Spektra FTIR NIP, MIP, PANi dan anilin 30
4.9 Kurva hubungan antara arus hasil analisis kreatin 30 ppb pada optimasi potensial akumulasi kreatin
4.10 Voltammogram hasil analisis kreatin 30 ppb pada potensial akumulasi 0,3 volt
34
4.11 Reaksi reduksi dan oksidasi pada analisis kreatin menggunakan voltammeter
34
4.12 Kurva hubungan antara arus hasil analisis kreatin 30 ppb pada optimasi waktu akumulasi kreatin
35
4.13 Voltammogram hasil analisis kreatin 30 ppb pada waktu akumulasi 90 detik
35
4.14 Voltammogram hasil analisis kreatin 5 ppb pada uji kinerja elektroda (a) HMD, (b) HMD-MIP, (c) HMD-NIP dan (d) HMD-PANi
39
4.15 Kurva hubungan antara konsentrasi larutan kreatin dan arus
DAFTAR LAMPIRAN
No Judul
1 Spektra FTIR
2 Voltammogram analisis kreatin menggunakan elektroda HMD-MIP pada optimasi potensial
3 Voltammogram analisis kreatin menggunakan elektroda HMD-MIP pada optimasi waktu akumulasi
4 Voltamogram uji keberhasilan ekstraksi kreatin menggunakan elektroda HMD-MIP pada air
5 Analisis data validasi metode
BAB I PENDAHULUAN
1.1 Latar Belakang Permasalahan
Kreatin merupakan salah satu senyawa golongan asam amino (metil guanidin asam asetat) yang memainkan peran sangat penting dalam metabolisme protein. Kreatin mewakili kira-kira 0,17% massa tubuh dimana 95% terdapat di otot rangka dan 5% terdapat di otak, ginjal, hati dan testikel, dan bagian kecil pada plasma darah. Kreatin bukan merupakan komponen penting dari makanan karena terbentuk secara alami dalam tubuh manusia. Namun, kreatin dapat diperoleh melalui daging dan ikan (Navratil et al., 2010). Dalam 15 tahun terakhir, kreatin sangat populer karena banyak digunakan sebagai suplemen tubuh. Namun, adanya 5% atau lebih kreatin fosfokinase dalam darah mengisyaratkan terjadinya serangan jantung (Marks et al., 2000).
Beberapa peneliti sebelumnya telah melakukan identifikasi terhadap kreatin dan kreatinin menggunakan teknik kromatografi dan elektroforesis. Analisis kreatin dan kreatinin dengan cara tersebut membutuhkan waktu analisis yang relatif lama dan membutuhkan pelarut yang cukup banyak (Kochansky and Strein, 2000). Identifikasi kreatin dengan menggunakan high performance liquid
chromatography (HPLC) juga telah dilakukan. Analisis kreatin dengan metode ini
cara ini cukup rumit karena larutan standar harus disiapkan dalam keadaan baru dari larutan stok setiap hari (Werner et al., 1990).
Metode identifikasi terhadap kreatin ini terus dikembangkan untuk mendapatkan metode yang sensitif dan selektif. Salah satu teknik yang dinilai memiliki sensitivitas yang tinggi, yaitu teknik voltammetri. Metode voltammetri selain memiliki sensitivitas yang tinggi, juga memiliki limit deteksi yang rendah ( g/L) (Wang, 2000).
Dalam teknik voltammetri, bagian yang sangat berperan penting dalam analisis sampel adalah elektroda. Oleh karena itu modifikasi elektroda banyak dilakukan karena dapat meningkatkan laju transfer elektron dari reaksi redoks pada elektroda sehingga metode menjadi lebih sensitif. Elektroda yang sering digunakan pada voltammeter adalah elektroda glassy carbon karena permukaannya dapat dipasangkan secara kovalen dengan berbagai bahan untuk modifikasi (Lin and Li, 2006). Belakangan ini elektroda HMD banyak menarik perhatian karena sifatnya yang mudah diperbaharui dan sensitivitasnya yang tinggi. Molecularly imprinted polymer (MIP) merupakan salah satu bahan yang digunakan untuk memodifikasi elektroda dimana polimer yang disintesis memiliki kemampuan untuk mengenali molekul secara spesifik (Tom and Foster, 2010). Pada teknik ini, terjadi proses penjebakan molekul target yang disebut dengan
template dalam jaringan polimer. Setelah terjadi polimerisasi, template dilepaskan
Lakshmi et al., (2007) telah melakukan modifikasi hanging mercury drop
electrode (HMDE) dengan molecularly imprinted poly(p-aminobenzoic
acid-co-1,2-dichloroethane) untuk analisis kreatin. Modifikasi elektroda tersebut telah
meningkatkan sensitivitas elektroda HMD. Limit deteksi yang diperoleh sebesar 0,11 µg/L.
Pada penelitian ini dilakukan pelapisan elektroda HMD dengan MIP yang terbuat dari monomer anilin. Anilin mempunyai sisi aktif dan setelah membentuk polimer (polianilin/PANi) mempunyai sifat sebagai polimer konduktifdan mampu berinteraksi dengan banyak senyawa melalui ikatan hidrogen (Sreenivasan, 2007). Setelah proses polimerisasi, template dilepaskan dari jaringan polimer hingga terbentuk cetakan yang spesifik untuk analit (template). Modifikasi elektroda dilakukan dengan cara melapisi elektroda HMD dengan MIP. Selanjutnya dilakukan karakterisasi terhadap elektroda HMD-MIP secara voltammetri dan dilakukan uji validitas metode meliputi linieritas, sensitivitas, ketelitian, limit deteksi, dan akurasi.
1.2 Perumusan Masalah
Berdasarkan latar belakang permasalahan, dapat dirumuskan masalah sebagai berikut.
1. Berapakah potensial akumulasi optimum pada analisis kreatin secara voltammetri menggunakan elektroda HMD?
2. Berapakah waktu akumulasi optimum pada analisis kreatin secara voltammetri
3. Bagaimanakah validitas metode pengukuran kreatin secara voltammetri menggunakan elektroda HMD-MIP meliputi linearitas, ketelitian, sensitivitas, limit deteksi dan akurasi?
1.3 Tujuan Penelitian
Penelitian ini bertujuan untuk :
1. menentukan potensial akumulasi optimum pada analisis kreatin secara
voltammetri menggunakan elektroda HMD
2. menentukan waktu akumulasi optimum pada analisis kreatin secara
voltammetri menggunakan elektroda HMD
3. menentukan validitas metode pengukuran kreatin secara voltammetri menggunakan elektroda HMD-MIP meliputi linearitas, ketelitian, sensitivitas, limit deteksi dan akurasi
1.4 Manfaat Penelitian
BAB II
TINJAUAN PUSTAKA
2.1 Kreatin
2.1.1 Gambaran umum kreatin
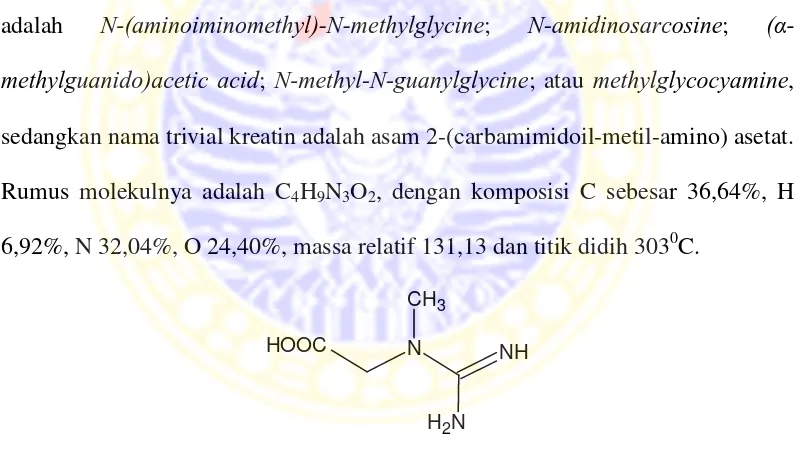
Kreatin merupakan salah satu senyawa golongan asam amino yang bersifat basa. Kreatin telah banyak diketahui karena perannya dalam mengirim dan menyimpan energi pada sel dan jaringan tubuh manusia. (Verhoeven et al., 2005). Nama kreatin berasal dari Yunani “kreas” yang berarti daging. Nama lain kreatin adalah N-(aminoiminomethyl)-N-methylglycine; N-amidinosarcosine; (α
-methylguanido)acetic acid; N-methyl-N-guanylglycine; atau methylglycocyamine,
sedangkan nama trivial kreatin adalah asam 2-(carbamimidoil-metil-amino) asetat. Rumus molekulnya adalah C4H9N3O2, dengan komposisi C sebesar 36,64%, H
6,92%, N 32,04%, O 24,40%, massa relatif 131,13 dan titik didih 3030C.
HOOC N NH
CH3
N
H2
Gambar 2.1 Struktur kreatin
Sebanyak 95% kreatin dalam tubuh terdapat di dalam otot rangka, dan 5% terdapat di otak, ginjal, hati, testis dan dalam plasma darah (Persky and Brazeau, 2001). Jaringan-jaringan tersebut mengandung kreatin kinase yang mengkatalisis konversi antar kreatin dan fosfokreatin. Untuk mempertahankan keutuhan kreatin, tubuh memiliki dua mekanisme yaitu penyerapan kreatin dari makanan dan mensintesis kreatin secara endogen.
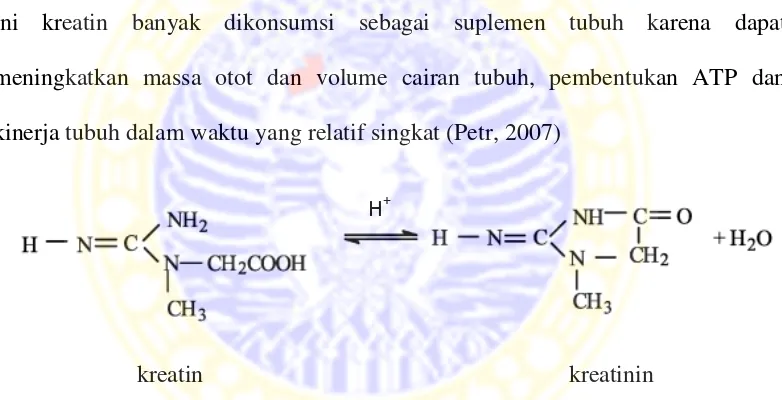
Secara kimia, kreatin merupakan basa lemah. Dalam larutan air dan di bawah kondisi asam, kreatin terkonversi menjadi kreatinin (Mo et al., 2003). Saat ini kreatin banyak dikonsumsi sebagai suplemen tubuh karena dapat meningkatkan massa otot dan volume cairan tubuh, pembentukan ATP dan kinerja tubuh dalam waktu yang relatif singkat (Petr, 2007)
kreatin kreatinin
Gambar 2.2 Reaksi kesetimbangan kreatin dan kreatinin dalam air (Mo et al., 2003) 2.1.2 Analisis kreatin
Metode yang biasa digunakan untuk analisis kreatin dalam bidang medis adalah spektrofotometrri (Sewell et al., 2002). Analisis kreatin dengan menggunakan high performance liquid chromatography (HPLC) juga telah dikembangkan. Metode ini tidak membutuhkan preparasi sampel, dapat dikalibrasi dengan standar yang sesuai dan memiliki presisi yang baik. Hasil analisis kreatin dengan HPLC ini menghasilkan linieritas yang baik dan memiliki
koefisien variasi (presisi) kurang dari 2%. Namun cara ini sudah lama ditinggalkan karena pengerjaannya cukup rumit, yaitu harus menyiapkan larutan standar setiap hari dalam keadaan baru dan membutuhkan larutan standar yang cukup banyak.
Belakangan ini, metode voltammetri banyak menarik perhatian karena memiliki sensitivitas yang tinggi dan limit deteksi yang rendah ( g/L) (Wang, 2000). Elektroda kerja yang digunakan bermacam-macam seperti glassy carbon
dan hanging mercury drop (HMD).
Lakshmi et al., (2007) telah melakukan analisis kreatin dengan menggunakan elektroda modifikasi HMD-molecularly imprinted polymer (MIP) menggunakan poly(p-aminobenzoic acid-co-1,2-dichloroethane) dengan potensial akumulasi -0,01 V (vs Ag/AgCl), waktu deposisi 15 detik, waktu akumulasi 60 detik, pH 7,1 dan limit deteksi 0,11 µg/L.
2.2 Voltammetri
2.2.1 Voltammetri lucutan
Voltammetri lucutan merupakan teknik voltammetri yang sering digunakan dalam analisis. Metode voltammetri lucutan menjadi metode yang menarik karena analisis lucutan memiliki kemampuan mengukur 4-6 logam secara bersama-sama (simultan) sampai pada tingkat konsentrasi sub-ppb.
Analisis secara voltammetri lucutan terdiri atas dua langkah. Langkah pertama, analit diendapkan pada mikro elektroda. Pada tahap ini biasanya dilakukan pengadukan. Setelah waktu tertentu, elektroanalisis dan pengadukan dihentikan. Kemudian pada tahap kedua, analit yang terendapkan dilarutkan kembali atau terlucuti (stripping) dari mikro elektroda tersebut. Proses ini yang menjadikan nama dari metode voltammetri lucutan. Pada tahap ini dilakukan pengukuran arus yang timbul.
waktu deposisi dan pengadukan sampel dan larutan standar yang dilakukan (Skoog et al., 1996).
2.2.2 Elektroda
Elektroda merupakan komponen utama dalam analisis voltammetri. Secara umum, elektroda pada voltammetri terdiri atas elektroda kerja, elektroda pembantu dan elektroda pembanding.
Elektroda kerja merupakan tempat dimana analit mengalami reduksi atau oksidasi (Skoog et al., 1996). Umumnya, elektroda kerja yang digunakan pada voltammetri memiliki luas permukaan yang kecil untuk meningkatkan polarisasi. Ukuran elektroda yang kecil ini juga digunakan untuk meminimalisasi penipisan analit akibat proses elektrolisis (Wang, 1985). Pemilihan elektroda kerja terutama bergantung pada sifat redoks dari analit target dan daerah potensial yang digunakan. Elektroda yang paling umum digunakan diantaranya adalah karbon dan emas (Wang, 2000). Elektroda kerja yang ideal harus memiliki sifat elektrokimia yang baik, permukaan yang reprodusibel, dan arus latar
(background) yang rendah. Elektroda kerja yang digunakan pada pengukuran
Salah satu elektroda kerja yang digunakan pada analisis secara voltammetri adalah HMD. Pada elektroda ini, merkuri dimasukkan ke dalam reservoir melalui kapiler. Tetesan yang reprodusibel terbentuk pada ujung kapiler melalui pengaturan dari mikrometer yang telah dikalibrasi. Tetesan ini selanjutnya jatuh pada akhir proses lucutan kemudian tetesan yang baru siap dikeluarkan untuk percobaan selanjutnya. HMD merupakan elektroda kerja yang saat ini banyak digunakan. Hal ini dikarenakan sifatnya yang reprodusibel dan mudah diperbaharui, dan dapat digunakan untuk waktu deposisi yang panjang. Namun, elektroda HMD ini juga memiliki kekurangan, yaitu memiliki luas permukaan yang rendah. Untuk menghindari jatuhnya tetesan merkuri dibutuhkan kecepatan pengadukan yang benar-benar tepat (Wang, 1985).
Elektroda pembanding pada voltammetri adalah elektroda yang potensialnya konstan selama percobaan (Skoog et al., 1996). Elektroda yang biasa digunakan adalah Ag/AgCl atau kalomel, sedangkan elektroda pembantu merupakan elektroda yang digabungkan dengan elektroda kerja namun tidak memainkan peranan dalam penentuan besarnya potensial selama proses pengukuran. Elektroda ini biasanya berisi gulungan kawat platina atau merkuri yang berfungsi menghubungkan listrik dari sumber arus melalui larutan sampai ke mikro elektroda (Skoog et al., 1996).
2.3 Polimer
atau hampir sama dengan bentuk monomernya atau bentuk material pertama pada saat polimer terbentuk. Panjang rantai polimer ditentukan oleh jumlah pengulangan unit rantai. Inilah yang dinamakan derajat polimerisasi. Proses Polimerisasi dibedakan menjadi dua bagian, yaitu polimerisasi kondensasi dan adisi.
Polimerisasi kondensasi, yang biasa disebut dengan step-reaction polymerization, terjadi antara dua molekul poli fungsional yang membentuk poli fungsional yang lebih besar dengan melepas molekul kecil seperti air. Kestabilan diperoleh dengan mengatur jumlah reaktan dan hasil. Jenis dari hasil yang terbentuk pada reaksi kondensasi ditentukan melalui monomer fungsionalnya. Salah satu contoh reaksi polimerisasi kondensasi adalah reaksi yang terjadi pada poliester.
2
HO R OH
+
HOCO R' COOH HO R OCO R' COOx x xH
+
( x- 1 ) H2OGambar 2.3 Reaksi polimerisasi kondensasi pada poliester
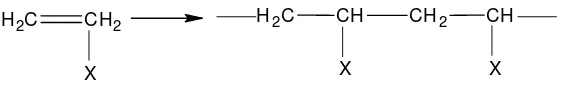
Polimerisasi adisi juga biasa disebut dengan chain-reaction polymerization.
Polimerisasi adisi merupakan reaksi yang melibatkan radikal bebas dan tidak terjadi hilangnya sejumlah molekul kecil. Radikal bebas ini biasanya terbentuk melalui dekomposisi dari material yang tidak stabil yang disebut inisiator. Radikal bebas ini mampu membuka ikatan rangkap dan menambahnya dengan elektron yang tidak berpasangan yang tersisa (Billmeyer, 1984).
C
H2 CH2
X
H2C CH CH2 CH
X X
Gambar 2.4 Reaksi polimerisasi adisi pada polimerisasi vinyl
2.4 Polianilin (PANi)
Polianilin (PANi) adalah material yang sangat atraktif yang termasuk dalam kelompok polimer konduktif. Konduktivitas dari polimer ini dipengaruhi oleh konjugasi elektron π, yang terletak di sepanjang tulang punggung polimer. Elektron π memiliki kemampuan untuk membentuk valensi dan menghubungkan pita orbital, yang diperpanjang melalui seluruh polimer (Zic, 2009).
Polianilin memiliki keunikan dibandingkan polimer konduktif lainnya seperti polipirol dan politiofena, yaitu dapat disintesis menjadi 3 bentuk tingkat oksidasi. Tingkat oksidasi pertama yaitu leucomeraldine base (LB) yang tereduksi penuh, kedua yaitu emeraldine base (EB) yang teroksidasi setengah dan ketiga adalah pernigraniline base (PB) yang teroksidasi penuh. Dari tiga bentuk tingkat oksidasi ini, EB memiliki tingkat oksidasi yang paling stabil karena konduktivitasnya dapat diatur menjadi konduktif atau isolatif melalui penambahan asam atau basa. Dengan penambahan asam (HCl) sifat EB menjadi konduktif atau semikonduktif. Bentuk konduktif dari EB disebut dengan emeraldine salt (ES) yang berwarna hijau. Dengan penambahan basa (NH4OH) sifat konduktif dari ES
dapat diubah kembali menjadi EB yang bersifat isolatif dan berwarna biru (Maddu
2.5 Molecularly Imprinted Polymer (MIP)
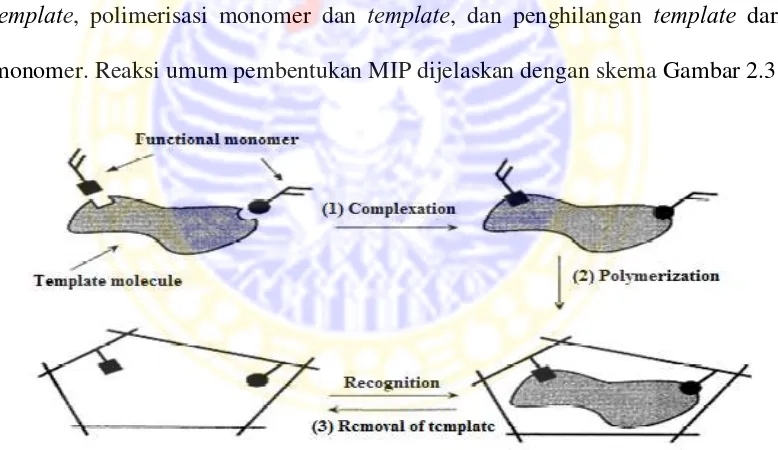
MIP merupakan polimer terikat silang dengan bagian pengikatan yang spesifik untuk analit tertentu. Bagian pengikatan ini dibuat dengan mereaksikan monomer dan agen pengikat silang (cross linker) dengan molekul target yang dinamakan template. Setelah polimerisasi, template ini dihilangkan dari polimer. Pada tahap ini terbentuk polimer yang memiliki ukuran, bentuk dan fungsional yang sama dengan molekul analit (Masque et al., 2001).
Proses pembuatan MIP ini melalui 3 tahapan, yaitu pembentukan ikatan kovalen konjugasi atau adisi non kovalen antara monomer fungsional dan molekul
template, polimerisasi monomer dan template, dan penghilangan template dari
monomer. Reaksi umum pembentukan MIP dijelaskan dengan skema Gambar 2.3
Gambar 2.5 Skema ilustrasi dari pembentukan molecular imprinting (Masque et al., 2001)
polimer. Pada teknik non kovalen, interaksi non kovalen digunakan untuk menghubungkan monomer fungsional dengan template. Hal ini dapat dengan mudah diperoleh dengan cara mencampurkan monomer, cross linker dan template
secara langsung pada proses polimerisasi. Setelah terjadi polimerisasi, template
BAB III
METODOLOGI PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di laboratorium kimia analitik, laboratorium Instrumentasi Kimia Universitas Airlangga dan Laboratorium Bersama Universitas Negeri Surabaya pada bulan Januari sampai Juni 2012.
3.2 Bahan Penelitian
Bahan yang digunakan pada penelitian ini adalah kreatin, anilin, ammonium peroksodisulfat, asam klorida, dan dimetilsulfoksida (DMSO). Semua bahan kimia berderajat kemurnian pro analisis. Air yang digunakan pada penelitian ini adalah akuabides.
3.3 Peralatan Penelitian
3.4 Diagram Alir Penelitian Pembuatan larutan
Pembuatan polianilin, NIP, dan MIP
Optimasi potensial akumulasi
Optimasi waktu akumulasi
Uji kinerja elektroda
Pembuatan kurva standar kreatin
Uji validitas metode
Karakterisasi dengan FTIR
E = -1000 - 1000mv t = 60 detik
• HMD-PANi
• HMD-NIP
• HMD-MIP
• HMD
• Linieritas
• Ketelitian
• Sensitivitas
• Limit deteksi
• Akurasi t = 30 – 150 detik Penyiapan monomer dan
3.5 Prosedur Penelitian
3.5.1 Pembuatan larutan kreatin
3.5.1.1 Pembuatan larutan induk kreatin 1000 ppm
Sebanyak 0,1000 gram kreatin dilarutkan dengan air dalam gelas beker. Setelah itu larutan dimasukkan ke dalam labu ukur 100 mL dan ditambah dengan air hingga tanda batas, kemudian larutan dikocok hingga homogen.
3.5.1.2 Pembuatan larutan kerja kreatin 10 ppm, 1 ppm, 30 ppb dan 5 ppb Larutan kerja kreatin 10 ppm dibuat dengan cara memipet larutan induk kreatin 1000 ppm sebanyak 1,0 mL kemudian dimasukkan ke dalam labu ukur 100 mL dan ditambah dengan air hingga tanda batas, kemudian larutan dikocok hingga homogen.
Larutan kerja kreatin 1 ppm dibuat dengan cara memipet larutan kerja kreatin 10 ppm sebanyak 10,0 mL kemudian dimasukkan ke dalam labu ukur 100 mL dan ditambah dengan air hingga tanda batas, kemudian larutan dikocok hingga homogen.
Larutan kerja kreatin 30 ppb dibuat dengan cara memipet larutan kerja kreatin 1 ppm sebanyak 3 mL kemudian dipindahkan ke dalam labu ukur 100 mL dan ditambah dengan air hingga tanda batas, kemudian larutan dikocok hingga homogen. Larutan ini selalu dibuat baru.
3.5.2 Pembuatan polianilin (PANi), non imprinted polymer (NIP) dan
molecularly imprinted polymer (MIP)
NIP dibuat dengan mereaksikan kreatin sebagai molekul target, ammonium peroksodisulfat sebagai inisiator, dan anilin sebagai monomer dengan perbandingan mol 0,1:1:2 (Sreenivasan, 2007).
Sebanyak 0,4 mL anilin (Mr= 93,13) dalam 7,5 mL HCl 1 M ditambah dengan 0,0287 gram kreatin (Mr= 131,13), kemudian diaduk dengan pengaduk magnetik pada suhu 40 oC. Setelah itu ditambahkan 0,5000 gram ammonium peroksodisulfat (Mr= 228,18) yang dilarutkan dalam 5 ml air dengan tetap dilakukan pengadukan. Larutan dibiarkan selama 12 jam pada suhu 25 oC (Sreenivasan, 2007). Padatan yang terbentuk kemudian dicuci dengan HCl 1 M untuk menghilangkan ammonium peroksodisulfat dan anilin yang tidak bereaksi. Padatan inilah yang dinamakan NIP.
Tahap selanjutnya adalah melakukan ekstraksi kreatin dari jaringan NIP melaui sentrifugasi dengan penambahan 10 mL air panas sebanyak 3 kali (Prasad
et al., 2004). Polimer inilah yang disebut dengan MIP.
MIP dan PANi yang terbentuk dikeringkan pada hotplate pada suhu 60oC – 70oC kemudian masing-masing dianalisis dengan FTIR.
3.5.3 Optimasi potensial akumulasi kreatin menggunakan elektroda HMD Optimasi potensial kreatin dilakukan menggunakan 20 mL larutan kreatin 30 ppb pada waktu 60 detik sedangkan potensial yang digunakan divariasi dari -1 V sampai dengan 1 V dengan interval 0,1 V menggunakan elektroda pembanding Ag/AgCl, kemudian dibuat kurva hubungan antara potensial akumulasi dan arus. 3.5.4 Optimasi waktu akumulasi kreatin menggunakan elektroda HMD
Elektroda HMD selanjutnya diujicobakan untuk menganalisis 20 mL larutan kreatin 30 ppb. Dilakukan optimasi waktu akumulasi kreatin pada elektroda kerja HMD menggunakan elektroda pembanding Ag/AgCl. Potensial yang digunakan adalah potensial akumulasi kreatin optimum yang telah dilakukan sebelumnya. Waktu akumulasi divariasi dari 30 detik - 150 detik dengan interval 30 detik, kemudian dibuat kurva hubungan antara waktu akumulasi dan arus. 3.5.5 Uji kinerja elektroda
menganalisis larutan kreatin 5 ppb dengan waktu akumulasi kreatin optimum. Dilakukan prosedur yang sama untuk elektroda HMD-NIP dan HMD-PANI. 3.5.6 Pembuatan kurva standar kreatin
Larutan standar kreatin dibuat dengan konsentrasi 1, 2, 3, 4 dan 5 ppb. Secara berturut-turut dipipet 100; 200; 300; 400; 500 µL larutan kreatin 1 ppm, kemudian masing-masing dimasukkan ke dalam labu ukur 100 mL. Ke dalam masing-masing larutan ditambah dengan air sampai tanda batas dan dikocok hingga homogen. Larutan standar kreatin tersebut dianalisis dengan menggunakan HMD-MIP dengan pengulangan 2 kali. Kemudian dibuat kurva hubungan antara konsentrasi kreatin dan arus yang terukur pada masing-masing larutan. Setelah itu dibuat regresi liniernya yang selanjutnya digunakan untuk uji validitas metode. 3.5.7 Uji validitas metode
Berdasarkan data arus yang didapatkan pada pembuatan kurva standar, dilakukan uji validitas metode. Uji yang dilakukan yaitu linieritas, presisi, sensitivitas, limit deteksi dan akurasi.
3.5.7.1 Linieritas
Linieritas adalah hubungan linier antara respon detektor dengan konsentrasi zat yang dianalisis dan dinyatakan dengan harga koefisien korelasi (r) persamaam regresi kurva standar kreatin. Linieritas yang baik ditunjukkan dengan nilai (r) yang mendekati 1 (Miller and Miller, 1988). Hubungan linier antara respon detektor dengan konsentrasi zat yang dianalisis ditunjukkan dengan uji t, yaitu membandingkan nilai thitung dengan ttabel. Koefisien korelasi diterima jika
2
dengan ketentuan r adalah koefisien korelasi kurva kalibrasi dan n adalah jumlah
larutan standar kreatin yang diukur. Sedangkan nilai ttabel didapatkan dari tabel
statistik dengan tingkat kepercayaan 95% (p = 0,05%)
3.5.7.2 Ketelitian
Ketelitian merupakan suatu derajat keterulangan (reproducibility) dari
suatu metode analisis. Ketelitian menyatakan hasil yang diperoleh dari
pengukuran yang berulang pada kondisi yang sama. Semakin kecil nilai koefisien
variasi yang dihasilkan maka ketelitian metode semakin baik. Pada penelitian ini,
ketelitian ditentukan dengan menghitung simpangan baku (standar deviasi/SD)
dan koefisien variasi (KV) dari nilai arus pada pengukuran masing-masing larutan
standar kreatin sesuai persamaan 3.2 dan 3.3
SD =
dengan ketentuan SD adalah standar deviasi, KV adalah koefisien variasi, xi
adalah arus kreatin pada masing – masing pengukuran, xadalah arus kreatin rata
– rata, dan n adalah jumlah replikasi (pengulangan) pengukuran.
3.5.7.3 Sensitivitas
Sensitivitas didapatkan dari persamaan regresi kurva standar kreatin. Dari
slope/luas permukaan elektroda maka menunjukkan bahwa sedikit perubahan konsentrasi analit memberikan perubahan arus yang besar. Sehingga sensitivitas metode dapat dikatakan baik apabila harga slope/luas permukaan elektroda dari kurva standar tinggi (Miller and Miller, 1988), namun juga harus mempertimbangkan sinyal noise yang muncul.
3.5.7.4 Limit deteksi
Limit deteksi adalah kadar analit terkecil yang masih dapat terukur dengan baik menggunakan metode tertentu. Semakin kecil nilai dari limit deteksi maka metode yang digunakan semakin baik. Pada penelitian ini, limit deteksi ditentukan berdasarkan data hasil pembuatan kurva standar kreatin dan dihitung menggunakan persamaan 3.4 dan 3.5.
YLOD = Ybl + 3Sbl………...(3.4)
Ybl : a = sinyal blanko (intersept dari persamaan kurva standar)
n : jumlah larutan standar kreatin yang diukur
yi : rata – rata arus hasil dari pengukuran masing-masing konsentrasi
y : tinggi puncak (arus) yang diperoleh dari mensubstitusi
masing-masing konsentrasi larutan standar kreatin sebagai nilai x ke persamaan regresi kurva standar.
Harga YLOD kemudian disubstitusikan ke persamaan regresi linier yang
didapatkan dari kurva standar kreatin sehingga diperoleh nilai (x) yaitu limit deteksi (Miller and Miller, 1988).
3.5.7.5 Akurasi
Akurasi merupakan besaran yang menyatakan seberapa dekat konsentrasi yang diperoleh dengan konsentrasi yang sebenarnya. Nilai akurasi semakin baik apabila nilainya semakin mendekati 100%. Harga akurasi pada penelitian ini didapatkan dari analisis kreatin konsentrasi 1, 3 dan 5 (Ks) secara voltammetri lucutan. Masing-masing sebanyak 100 µL, 300 µL dan 500 µL larutan kerja kreatin 1 ppm dimasukkan ke dalam labu ukur 100 ml dan diencerkan dengan air sampai tanda batas kemudian dikocok hingga homogen. Dipipet 20,0 ml larutan tersebut lalu dimasukkan wadah sampel dan dianalisis secara voltammetri lucutan. Nilai arus yang didapatkan disubstitusikan ke dalam persamaan regresi yang diperoleh dari kurva standar kreatin sehingga diperoleh konsentrasi kreatin (Csp). Nilai akurasi dihitung dengan persamaan 3.6
R =
s sp
K C
x 100%...(3.6)
dengan ketentuanR adalah akurasi, Csp adalah konsentrasi kreatin hasil analisis
BAB IV
HASIL DAN PEMBAHASAN
4.1 Sintesis NIP (Non Imprinted Polymer), MIP (Molecularly Imprinted Polymer) dan Polianilin (PANi)
Pada penelitian ini dilakukan sintesis NIP, MIP dan polianilin yang akan dilapiskan kepada elektroda HMD sehingga menghasilkan suatu sensor yang sensitif terhadap kreatin.
4.1.1 Sintesis NIP (non imprinted polymer)
Pada penelitian ini anilin dilarutkan dalam HCl. Dalam pelarut asam, polimer yang terbentuk bersifat konduktif atau semikonduktif (emeraldine salt) sedangkan dalam pelarut basa, polimer yang terbentuk bersifat isolatif (emeraldine base) (Maddu et al., 2008). Selain itu, dalam pelarut asam anilin membentuk kation anilium sehingga memudahkan reaksi polimerisasi oleh adanya ammonium peroksodisulfat.
dan anilin yang tidak bereaksi. Endapan dicampur dengan HCl 1M dalam gelas beker kemudian diaduk lalu disaring menggunakan kertas saring. Endapan kemudian dikeringkan pada hotplate pada suhu 60oC- 70oC. Endapan inilah yang disebut dengan NIP. Larutan NIP kemudian dilapiskan pada elektroda HMD dan digunakan untuk menganalisis larutan kreatin kemudian dibandingkan hasilnya dengan hasil analisis HMDE, HMDE-MIP dan HMDE-PANi. Ikatan yang terjadi antara kreatin dan polianilin diduga seperti pada Gambar 4.3.
Gambar 4.2 Endapan NIP
C CH2 N CH3
C
O NH2
O H HN
NH
NH
NH
NH NH
HN
n n
4.1.2 Sintesis MIP (molecularly imprinted polymer)
MIP merupakan NIP yang molekul targetnya telah terekstraksi. Ekstraksi kreatin dari jaringan NIP dilakukan melalui sentrifugasi dengan penambahan 10 mL air panas. Pada penelitian ini ekstraksi dilakukan sebanyak 3 kali (Prasad et al., 2004). Endapan dipisahkan dari filtratnya, kemudian dikeringkan pada
hotplate pada suhu 60oC-70oC. Endapan yang terbentuk dinamakan MIP. MIP
yang dihasilkan dari penelitian ini memiliki warna yang sama dengan NIP, yaitu hijau kehitaman. Larutan MIP ini dilapiskan pada elektroda HMD dan digunakan untuk menganalisis larutan kreatin kemudian dibandingkan hasilnya dengan hasil analisis menggunakan elektroda HMD, HMD-NIP dan HMD-PANi. Pada Gambar 4.4 ditampilkan foto endapan MIP dan MIP dalam bentuk serbuk.
(a) (b)
Gambar 4.4 (a) Foto endapan MIP hasil sentrifugasi, (b) MIP berbentuk serbuk 4.1.3 Sintesis polianilin (PANi)
terminasi. Pada tahap inisiasi, inisiator membentuk senyawa radikal yang tidak stabil kemudian menyerang monomer anilin sehingga ikatan rangkap pada anilin terputus membentuk anilin radikal. Tahap inisiasi pada polimerisasi polianilin dapat dilihat pada Gambar 4.5.
Gambar 4.5 Tahap inisiasi pada polimerisasi polianilin
Pada tahap propagasi, anilin radikal yang terbentuk bereaksi dengan anilin lainnya membentuk anilin-anilin radikal. Tahap propagasi pada polimerisasi polianilin dapat dilihat pada Gambar 4.6
Pada tahap terminasi, anilin radikal membentuk rantai dengan anilin radikal lainnya sehingga membentuk rantai polimer yang panjang dan netral. Tahap terminasi pada polimerisasi polianilin dapat dilihat pada Gambar 4.7
Gambar 4.7 Tahap terminasi pada polimerisasi polianilin
Hasil reaksi dari polianilin dapat terlihat pada Gambar 4.1. PANi ini kemudian dilapiskan pada elektroda HMD dan digunakan untuk menganalisis larutan kreatin selanjutnya dibandingkan hasilnya dengan hasil analisis menggunakan elektroda HMD, HMD-NIP dan HMD-MIP.
4.1.4 Karakterisasi NIP, MIP dan PANi
Hasil karakterisasi NIP, MIP dan PANi menggunakan FTIR ditunjukkan pada Gambar 4.8.
H
N HN H2N
H2N
H2N
H
N HN HN
H
H2N
H
N HN HN
N HN HN HN
Gambar 4.8 Spektra FTIR NIP, MIP, PANi dan anilin
Pada spektrum anilin terlihat 2 puncak pada bilangan gelombang sekitar 3300 cm-1 hingga 3500 cm-1 yang menandakan adanya gugus fungsi dari -NH2.
Sedangkan pada spektra NIP, MIP dan polianilin hanya terlihat 1 puncak pada bilangan gelombang tersebut karena telah terbentuk polimerisasi anilin menjadi polianilin. Dengan demikian dapat disimpulkan bahwa gugus –NH2 pada anilin
sudah digunakan untuk berikatan dengan gugus –NH2 pada anilin lainnya
bilangan gelombang sekitar 1590-1600 cm-1. Ikatan =CH sp2 pada benzena juga terlihat pada bilangan gelombang 3040-3100 cm-1. Pada spektra NIP, puncak kreatin tidak dapat terlihat. Hal ini mungkin disebabkan oleh perbandingan jumlah mol kreatin terlalu kecil. Terbentuknya MIP terlihat dari gugus kreatin yang telah terekstraksi dari jaringan NIP. Namun spektra FTIR pembentukan NIP menjadi MIP pada penelitian ini juga tidak terlihat sehingga diduga tidak terjadi ikatan hidrogen antara kreatin dan anilin. Selain itu, analisis menggunakan FTIR tidak dilakukan secara kuantitatif pada penelitian ini sehingga intensitas spektra tidak bisa digunakan untuk patokan apakah ada pengurangan atau penambahan intensitas gugus tertentu. Untuk itu dilakukan uji keberhasilan ekstraksi kreatin dari jaringan polimer dengan menggunakan voltammetri lucutan (sub bab 4.3) dan uji kinerja elektroda (sub bab 4.4).
4.2 Optimasi Analisis Kreatin Menggunakan Voltammetri Lucutan
Dalam penelitian ini sebanyak 20 mL larutan kreatin 30 ppb dianalisis secara voltammetri menggunakan voltammetri lucutan. Elektroda kerja yang digunakan adalah HMD, elektroda pembanding Ag/AgCl dan elektroda pembantu Pt. Sebelum dilakukan analisis dilakukan optimasi potensial dan waktu akumulasi kreatin pada elektroda HMD. Optimasi kedua parameter dilakukan secara terpisah. Potensial optimum yang telah didapatkan digunakan untuk optimasi waktu akumulasi. Selama proses analisis kreatin secara voltammetri menggunakan elektroda HMD dilakukan pengaliran gas N2 yang berfungsi untuk
reaksi redoks antara H2O dan O2 sehingga akan menimbulkan puncak yang dapat
mengganggu proses analisis. Selain itu, pada penelitian ini juga digunakan KCl sebagai elektrolit pendukung untuk meminimalkan adanya arus migrasi yang disebabkan oleh adanya medan listrik (Wang, 2000).
4.2.1 Optimasi potensial akumulasi kreatin
Tabel 4.1 Data hasil analisis kreatin 30 ppb pada optimasi potensial akumulasi kreatin menggunakan elektroda HMD
Gambar 4.10 Voltammogram hasil analisis kreatin 30 ppb pada potensial akumulasi 0,3 V
Berdasarkan data yang diperoleh dapat disimpulkan bahwa analisis kreatin secara voltammetri lucutan menggunakan elektroda HMD termasuk jenis voltammetri lucutan katodik. Untuk voltammetri lucutan katodik, terjadi reaksi oksidasi di elektroda pada saat proses akumulasi (deposisi) dan mengalami reduksi pada saat lucutan. Reaksi reduksi dan oksidasi yang terjadi pada saat proses analisis kreatin menggunakan voltammeter ditunjukkan pada Gambar 4.11.
N
Gambar 4.11 Reaksi reduksi dan oksidasi pada analisis kreatin menggunakan voltammeter
4.2.2 Optimasi waktu akumulasi kreatin
Pada penelitian ini dilakukan optimasi waktu akumulasi kreatin pada rentang 30 detik hingga 150 detik dengan interval 30 detik. Analisis dilakukan dengan menggunakan potensial akumulasi 0,3 volt. Data hasil optimasi waktu akumulasi kreatin menggunakan HMD dapat dilihat pada Tabel 4.2.
optimasi potensial tanpa MIP optimasipotensial60s03
-0.40 -0.30 -0.20 -0.10 0.00 0.10
Tabel 4.2 Data hasil analisis kreatin 30 ppb pada optimasi waktu akumulasi optimasi waktu akumulasi kreatin
Gambar 4.13 Voltammogram hasil analisis kreatin 30 ppb pada waktu akumulasi 90 detik
optimasi waktu akumulasi MIP optwktuakumulasi03 90s
-0.40 -0.30 -0.20 -0.10 0.00 0.10
Berdasarkan data pada Tabel 4.2, waktu akumulasi optimum yang dipilih adalah 90 detik. Pemilihan waktu akumulasi optimum juga didasarkan pada arus yang besar, bentuk kurva yang bagus, lebar dasar puncak (baseline) yang sempit, dan kemiringan dasar puncak terhadap sumbu x yang kecil. Pada dasarnya, semakin tinggi waktu akumulasi maka jumlah analit yang terakumulasi pada elektroda juga semakin banyak sehingga arus yang terukur juga semakin tinggi. Berdasarkan kurva pada Gambar 4.12 dapat dilihat bahwa pada waktu akumulasi 30 detik hingga 90 detik, arus yang terukur bertambah tinggi seiring dengan bertambahnya waktu akumulasi. Pada waktu akumulasi 120 detik dan 150 detik arus yang terukur berkurang secara drastis disebabkan karena elektroda telah dipenuhi oleh analit sehingga analit lain tidak dapat terukur oleh elektroda. Jumlah analit yang terlalu banyak menempel pada elektroda ini juga menyebabkan elektroda menjadi jenuh (Zen dan Hsu, 1958).
4.3 Uji Keberhasilan Ekstraksi Kreatin dari Jaringan Polimer
yang terbentuk kemudian digunakan untuk menganalisis 20 mL air selama 90 detik. Hasil yang ditampilkan pada Lampiran 4 menunjukkan bahwa tidak ada puncak kreatin yang muncul pada voltammogram. Hal ini menandakan bahwa kreatin yang masih tertinggal pada MIP tidak mengganggu analisis.
4.4 Uji Kinerja Elektroda
Uji kinerja elektroda digunakan untuk membandingkan hasil analisis kreatin 5 ppb secara voltammetri menggunakan elektroda HMD, HMD-MIP, HMD-NIP dan HMD-PANi. Pembuatan larutan NIP dan PANi dilakukan sama seperti pembuatan larutan MIP (sub bab 4.3). Setelah itu larutan dilapiskan pada elektroda HMD. Data hasil uji kinerja elektroda ditunjukkan pada Tabel 4.3. Tabel 4.3 Data hasil analisis kreatin 5 ppb pada uji kinerja elektroda HMD,
HMD-MIP, HMD-NIP dan HMD-PANi
Elektroda Arus (nA) Potensial puncak (v)
HMD 140,7 -0,084
HMD-MIP 30,30 -0,309
HMD-NIP 40,92 -0,227
HMD-PANi 57,87 0,207
(a) HMD (b) HMD-MIP
(c) HMD-NIP (d) HMD-PANi
Gambar 4.14 Voltammogram hasil analisis kreatin 5 ppb pada uji kinerja elektroda (a) HMD, (b) MIP, (c) NIP dan (d) HMD-PANi
4.5 Pembuatan Kurva Standar Kreatin
Kurva standar kreatin dibuat dengan cara menganalisis masing-masing 20 mL larutan kreatin 1, 2, 3, 4 dan 5 ppb secara voltammetri menggunakan elektroda HMD-MIP pada pH 7, waktu pelapisan MIP 15 detik (Lakshmi et al., 2007), potensial pelapisan 0,3 volt dan waktu akumulasi 90 detik. Dari data yang diperoleh kemudian dibuat kurva hubungan antara konsentrasi kreatin dan arus. Data hasil pengukuran larutan standar dapat dilihat pada Tabel 4.4.
Tabel 4.4 Data hasil pengukuran larutan standar kreatin Konsentrasi
larutan kreatin (ppb)
Arus (nA)
Arus rata-rata (nA) Replikasi I Replikasi II
1 35,91 27,05 31,480
2 29,32 35,47 32,395
3 57,66 33,65 45,655
4 55,22 41,67 48,445
5 63,54 46,09 54,815
Gambar 4.15 Kurva hubungan antara konsentrasi larutan kreatin dan arus Pada optimasi sebelumnya, puncak kreatin terdeteksi pada -0,05 volt, namun setelah dilakukan pelapisan menggunakan MIP, letak kreatin bergeser menjadi -0,2.
4.6 Validasi Metode
4.6.1 Linieritas
Linieritas didapatkan dari harga koefisien korelasi (r) pada kurva standar kreatin. Berdasarkan data, diperoleh harga koefisien korelasi sebesar 0,9669 yang menunjukkan bahwa kurva baku memiliki linieritas yang baik. Lakshmi et al., (2007) telah melakukan analisis kreatin secara voltammetri lucutan menggunakan elektroda HMD-MIP. Dari penelitian tersebut diperoleh linieritas sebesar 0,99. Dengan demikian dapat disimpulkan bahwa penelitian ini memiliki linieritas yang kurang baik dibandingkan dengan penelitian sebelumnya. Setelah itu dilakukan analisis uji t dengan membandingkan nilai thitung dengan ttabel. Berdasarkan
perhitungan pada Lampiran 5 dapat dilihat bahwa thitung > ttabel sehingga dapat
disimpulkan bahwa terdapat hubungan linier antara konsentrasi kreatin dan arus. 4.6.2 Ketelitian
Tabel 4.5 Data hasil koefisien variasi larutan standar kreatin
replikasi I replikasi II
1 35,91 27,05 31,480 19,90
3 57,66 33,65 45,655 28,42
5 63,54 46,09 54,815 22,51
4.6.3 Sensitivitas
Sensitivitas didapatkan dari nilai slope regresi linier kurva standar/luas permukaan elektroda HMD. Besarnya nilai slope/luas permukaan elektroda HMD tersebut menunjukkan besarnya perubahan arus tiap terjadi perubahan konsentrasi. Nilai slope dari regresi linier kurva standar yang diperoleh pada penelitian ini adalah sebesar 6,272 dan luas permukaan elektroda HMD adalah 1,3083 x 10-5 cm2 (Lampiran 5). Hal ini menunjukkan bahwa analisis kreatin menggunakan HMDE-MIP memiliki sensitivitas yang tinggi karena perubahan konsentrasi sebesar 1 ppb akan meningkatkan arus sebesar 4,79 x 105 nA/cm2.
4.6.4 Limit Deteksi
Beyer (1993) juga telah melakukan analisis kreatin dengan menggunakan spektrofotometri. Dari penelitian tersebut diperoleh limit deteksi sebesar 13 µM (1,7 x 103 ppb). Hal ini berarti bahwa hasil limit deteksi pada penelitian ini lebih baik bila dibandingkan dengan metode spektrofotometri yang biasa digunakan untuk menganalisis kreatin.
4.6.5 Akurasi
BAB V
KESIMPULAN DAN SARAN 5.1 Kesimpulan
Berdasarkan penelitian yang telah dilakukan, maka dapat diambil kesimpulan sebagai berikut.
1. Potensial akumulasi optimum pada analisis kreatin secara voltammetri menggunakan elektroda HMD adalah pada potensial 0,3 volt dan kreatin terdeteksi pada potensial -0,037 volt.
2. Waktu akumulasi optimum pada analisis kreatin secara voltammetri
menggunakan elektroda HMD adalah pada waktu 90 detik dan kreatin terdeteksi pada potensial -0,031 volt.
3. Nilai validitas metode yang didapatkan pada pengukuran kreatin secara
voltammetri menggunakan elektroda HMD-MIP yaitu linieritas sebesar 0,9669, presisi (% KV) untuk konsentrasi 1, 3 dan 5 ppb masing-masing sebesar 19,90 %, 28,42 % dan 22,51 %, sensitivitas sebesar 4,794 x 10-5 nA/ppb cm2, limit deteksi sebesar 1,4379 ppb dan akurasi pada konsentrasi 1, 3 dan 5 ppb sebesar 123,40 %, 116,00 % dan 99,09 %.
5.2 Saran
1. Diperlukan optimasi perbandingan mol kreatin : ammonium peroksodisulfat : anilin.
DAFTAR PUSTAKA Biofluids: Creatinine, Creatine, Uric Acid and Xanthines, Journal of
Chromatography B, 747: 217–227
Komiyama, M., Takeuchi ,T., Mukawa, T., and Asanuma, H., 2003, Molecular
Imprinting From Fundamentals to Applications, Wiley-VCH: Germany
Lakshmi, D., Sharma, P. S., and Prasad, B. B., 2007, Imprinted Polymer-Modified Hanging Mercury Drop Electrode for Differential Pulse Cathodic Stripping Voltammetric Analysis of Creatine, Biosensors and
Bioelectronics, 22: 3302–3308
Lin, X., and Li, Y., 2006, Monolayer Covalent Modification of 5-Hydroxytryptophan on Glassy Carbon Electrodes for Simultaneous Determination of Uric Acid and Ascorbic Acid, Electrochimica Acta,
51: 5794-5801
Maddu, A., Wahyudi, S.T., and Kurniati, M., 2008, Sintesis dan Karakterisasi Nanoserat Polianilin, Jurnal Nanosains & Nanoteknologi, Vol. 1, No. 2: 74-78
Marks, D. B., Marks, A. D., and Smith C. M., 2000, Biokimia Kedokteran Dasar,
cetakan pertama, EGC: Jakarta
Masque, N., Marce, R.M., and Borrull, F., 2001, Molecularly Imprinted Polymers: New Tailor-Made Materials for Selective Solid-Phase Extraction, Trends in Analytical Chemistry, Vol. 20, No. 9: 477-486
Miller, J.C., and Miller, J.N., 1988, Statistic for Analytical Chemistry, 3th edition, Ellis Horword Limited, New York
Mo, Y., Dobberpuhl, D., and Dash, A. K., 2003, A Simple HPLC Method with Pulsed EC Detection for the Analysis of Creatine, Journal of
Navratil, T., Kohlikova, E., Petr, M., Pelclova, D., Heyrovsky, M., and Pristoupilova, K., 2010, Supplemented Creatine Induces Changes in Human Metabolism of Thiocompounds and One- and Two-Carbon Units, Physiol. Res., 59: 431-442
O’Neil, 2001, The Merck Index, an Encyclopedia of Chemicals, Drugs and
Biologicals, 13th edition, Merck Research Laboratories Division of, Merck
and Co., Inc., Whitehouse Station, NJ
Persky, A. and Brazeau, G., 2001, Clinical Pharmacology of the Dietary
Supplement Creatine Monohydrate, Department of Pharmaceutics, College
of Pharmacy, University of Florida, Gainesville
Petr, M., 2007, Metabolic Pathways Leading to Excretion of Thiodiglycolic Acid
into Urine Affected by Creatine Supplementation, PhD Thesis, Charles
University in Prague, Prague
Prasad, B.B., and Lakshmi, D., 2004, Barbituric Acid Sensor Based on Molecularly Imprinted Polymer-Modified Hanging Mercury Drop Electrode, Electroanalysis, Wiley-VCH, Canada
Sewell, A.C., Murphy, H.C., and Iies, R.A., 2002, Use of Proton Nuclear Magnetic Resonance Spectroscopy in Detection and Study of Organic Acidurias, Clinical Chemistry., 48: 357-359
Skoog, D.A., West, D.M and Holler, F.J., 1996, Fundamental of Analytical Chemistry, 7th edition, Thomson Learning Inc.
Sreenivasan, K., 2007, Synthesis and Evaluation of Molecularly Imprinted Polymers for Nucleic Acid Bases Using Aniline as a Monomer,
Reactiveand Functional Polymers, 67: 859-864
Tom, L. A., and Foster, N., 2010, Development of a Molecularly Imprinted Polymer for the Analysis of Avermectin, Analytica Chimica Acta, 680: 79–85
Verhoeven, N. M., Salomons, G.S., and Jakobs, C., 2005, Laboratory Diagnosis of Defects of Creatine Biosynthesis and Transport, Clinica Chimica Acta, 361: 1 –9
Wang, J., 1985, Stripping Analysis: Principle Instrumentation, Wiley-VCH, America
Werner, G., Schneider, V., and Emmert, J., 1990, Simultaneous Determination of Creatine, Uric Acid and Creatinine by High-Performance Liquid Chromatography with Direct Serum Injection and Multi-Wavelength Detection, Journal of Chromatography, 525: 265-275 Zen, J., and Hsu, C., 1998, A Selective Voltammetric Method for Uric Acid
Detection at Nafion-Coated Carbon Paste Electrodes, Talanta, 46: 1363-1369
Zic, M., 2009, The Influence of the PANI Structure on the Conductive Mechanism and on the Electrical Equivalent Circuit Analysis, Journal
Lampiran 1 Spektra FTIR a). Spektra FTIR anilin
c). Spektra FTIR NIP
Lampiran 2
Voltammogram analisis kreatin menggunakan elektroda HMD-MIP pada optimasi potensial
a). Potensial -1 volt
b). Potensial -0,9 volt
c). Potensial -0,8 volt
d). Potensial -0,7 volt
e). Potensial -0,6 volt
f). Potensial -0,5 volt
g). Potensial -0,4 volt
h). Potensial -0,3 volt
i). Potensial -0,2 volt
j). Potensial -0,1 volt
k). Potensial 0 volt
l). Potensial 0,1 volt
m). Potensial 0,2 volt
n). Potensial 0,3 volt
o). Potensial 0,4 volt
p). Potensial 0,5 volt
q). Potensial 0,6 volt
r). Potensial 0,7 volt
s). Potensial 0,8 volt
t). Potensial 0,9 volt
u). Potensial 1,0 volt
Lampiran 3
Lampiran 4
Voltammogram uji keberhasilan ekstraksi kreatin menggunakan elektroda HMD-MIP pada air
Method title MIP-AIR
-0.50 -0.40 -0.30 -0.20 -0.10 0
U (V)
35.0n 40.0n 45.0n 50.0n 55.0n 60.0n
I (A)
Lampiran 5
Analisis data validasi metode 1. Uji t linieritas
Persamaan regresi linier yang didapatkan dari kurva baku: y = 6,272x + 23,74
r2 = 0,935 r = 0,9669
Nilai tabel = t(3; 0,05) = 2,353
Nilai thitung =
| | ( )
√
thitung =
| , | ( )
√ ,
thitung =
, , ,
= ,
,
= 6,5687
Karena thitung > ttabel maka dapat disimpulkan bahwa terdapat
2. Ketelitian Kreatin 1 ppb
Perhitungan % KV larutan standar kreatin 1 ppb.
Replikasi (n) x (nA) ( − ) ( − )
1 35,91 4,43 19,6249
2 27,05 -4,43 19,6249
= 62,962 = 31,48 ( − ) = 39,2498
SD =
!
∑( )=
!
, #= 6,2650
% KV = $%
& x 100 %
= ,
, # x 100 %
= 19,90 %
3. Sensitivitas
Diameter permukaan elektroda HMD = 50 x 10-4 cm drop nomor 9 * Permukaan elektroda HMD diibaratkan sebagai ½ bola
Luas permukaan bola = 4πr2
Luas permukaan ½ bola = 2πr2
= 2 x 3,14 x (25 x 10-4)2 = 3,925 x 10-5cm2 Untuk drop nomor 3 = 3,925 x 10-5cm2 x 3/9
= 1,3083 x 10-5 cm2
Sensitivitas = slope/luas permukaan elektroda HMD = 6,272/1,3083 x 10-5
4. Limit deteksi
Untuk konsentrasi 1 ppb '+ = 6,272 x + 23,74 = 6,272 (1) + 23,74 = 30,012 nA
Untuk konsentrasi 2 ppb '+ = 6,272 x + 23,74 = 6,272 (2) + 23,74 = 36,284 nA
Untuk konsentrasi 3 ppb '+ = 6,272 x + 23,74 = 6,272 (3) + 23,74 = 42,556 nA
Untuk konsentrasi 4 ppb '+ = 6,272 x + 23,74 = 6,272 (4) + 23,74 = 48,828 nA
Sy/x =
!
(-. -+)
=
!
,= √9,037 = 3,0062 YLOD = a + 3 Sy/x
= 23,74 + 3 (3,0062) = 32,7585
YLOD = 6,272x + 23,74
32,7585 = 6,272x + 23,74 9,0185 = 6,272x
x = 1,4379
5. Akurasi
R = 012
31 x 100 %
y = 6,272x + 23,74
Arus rata-rata konsentrasi kreatin 5 ppb = 54,815 nA (y) 54,815 = 6,272x + 23,74
x = 31,075/6,272 = 4,9546 ppb (Csp)
R = 012
31 x 100 %
R = 4,9546/5 x 100 % = 99,092 %
Lampiran 6
Perhitungan pada pembuatan larutan kreatin
1). Pembuatan larutan induk kreatin 1000 ppm 1000 ppm = 1000 mg/L
= 0,1000 gram/100 mL 2). Pembuatan larutan kerja kreatin 10 ppm
(V1 x M1) kreatin 1000 ppm = (V2 x M2) kreatin 10 ppm V1 x 1000 ppm = 100 mL x 10 ppm
V1 = 1 mL
3). Pembuatan larutan kerja kreatin 1 ppm
(V1 x M1) kreatin 10 ppm = (V2 x M2) kreatin 1 ppm V1 x 10 ppm = 100 mL x 1 ppm
V1 = 10 mL 4). Pembuatan larutan kerja kreatin 30 ppb
(V1 x M1) kreatin 1 ppm = (V2 x M2) kreatin 30 ppb V1 x 1000 ppb = 100 mL x 30 ppb
V1 = 3 mL
Lampiran 7
Perhitungan pada pembuatan NIP, MIP dan PANi
Perbandingan mol kreatin : ammonium peroksodisulfat : anilin = 0,1 : 1 : 2 1). Pembuatan ammonium peroksodisulfat
n = 4
mol kreatin = 0,1 x mol ammonium peroksodisulfat = 0,1 x (2,1912 x 10-3)