SINTESIS NANOPARTIKEL MAGNETIT SECARA KOPRESIPITASI DAN KONVERSINYA MENJADI MAGHEMIT SERTA UJI
KATALITIKNYA PADA OKSIDASI METILEN BIRU
Ayu Dwi Puspasari, Fauziatul Fajaroh, dan Sutrisno
Jurusan Kimia, FMIPA, Universitas Negeri Malang
E-mail: ayudwipuspasari@gmail.com; fau_kim_um@yahoo.co.id; tris_chemum@yahoo.com
ABSTRAK: Nanopartikel magnetit (Fe3O4) dapat disintesis dengan metode
kopresipitasi dari larutan FeSO4 dan FeCl3 menghasilkan serbuk berwarna hitam
dengan diameter rata-rata partikel sebesar 10,28 nm. Nanopartikel maghemit (γ-Fe2O3) dapat disintesis melalui proses oksidasi magnetit menghasilkan serbuk
berwarna coklat kemerahan dengan diameter rata-rata partikel sebesar 14,06 nm. Daya katalitik nanopartikel magnetit dalam proses oksidasi metilen biru oleh hidrogen peroksida lebih besar daripada maghemit dengan persentase oksidasi masing-masing 48,98% dan 43,71%.
Kata-kata kunci: nanopartikel magnetit, nanopartikel maghemit, katalitik, metilen biru
ABSTRACT: Magnetite nanoparticle (Fe3O4) can be synthesized from a mixture
FeSO4 and FeCl3 by coprecipitation method produces black powder with average diameter is 10.28 nm. Maghemite nanoparticle (γ-Fe2O3) can be synthesized from
oxidation of magnetite producesreddish brown powder with average diameter is 14.06 nm. Catalytic performance of magnetite nanoparticle in oxidation process of methylene blue by hydrogen perioxide was higher than maghemite by percentages of 48.98% and 43.71% respectively.
Keywords: magnetite nanoparticle, maghemite nanoparticle, catalytic, methylene blue
PENDAHULUAN
Pengembangan nanopartikel magnetit dan maghemit banyak menginspirasi para ilmuwan karena manfaatnya di berbagai bidang, salah satunya sebagai katalis. Nanopartikel magnetit dan maghemit berpotensi sebagai katalis heterogen. Pemanfaatannya sebagai katalis heterogen akan sangat efektif karena didukung oleh luas permukaan yang besar (Cornell & Schwertmann, 2003). Luas permukaan besar menyediakan sisi aktif yang memadai sehingga meningkatkan sifat katalitiknya (Mori dkk., 2010). Karakter inilah yang diunggulkan dalam aplikasi nanopartikel magnetit dan maghemit sebagai katalis.
Sintesis nanopartikel magnetit yang telah dikembangkan antara lain sol-gel, elektrokimia, hidrotermal, dan kopresipitasi. Metode kopresipitasi merupakan metode yang paling banyak dikembangkan karena dapat dilakukan pada temperatur kamar, peralatan sederhana, relatif murah, dan memberikan rendemen yang memadai. Beberapa peneliti telah melakukan penelitian tentang sintesis nanopartikel magnetit dengan kopresipitasi. Salah satunya adalah menggunakan larutan FeCl2 dan FeCl3 dengan perbandingan 1:2 pada media basa (Nedkov, 2006). Hasil yang didapatkan adalah nanopartikel magnetit yang berukuran 3 nm. El Ghandoor dkk. (2012) telah berhasil mensintesis nanopartikel magnetit
menggunakan campuran larutan (NH4)2Fe(SO4)2 dan FeCl3 pada media basa. Perbedaan jenis pereaksi dan kondisi sintesis menghasilkan karakteristik nanopartikel magnetit yang berbeda. Dalam penelitian ini dipilih pereaksi FeSO4 karena lebih mudah didapat dan harganya murah dibandingkan dengan (NH4)2Fe(SO4)2.
Maghemit dapat disintesis dari magnetit dengan dan tanpa pemanasan. Di udara terbuka, magnetit secara perlahan-lahan akan teroksidasi menjadi maghemit. Proses ini dapat dipercepat dengan pemanasan pada temperatur 230-380 ºC (Cornell & Schwertmann, 2003). Legodi dkk. (2007) telah berhasil mensintesis maghemit dari magnetit dengan temperatur konversi 200 ºC selama 3 jam. Maghemit dapat diperoleh melalui oksidasi serbuk magnetit hasil presipitasi pada temperatur 300 ºC (Aji dkk., 2007). Temperatur oksidasi magnetit yang beragam, karakter magnetit yang digunakan, serta kondisi lingkungan menjadikan oksidasi nanopartikel maghemit dari nanopartikel magnetit menarik untuk dipelajari.
Sebagaimana kita ketahui saat ini beberapa industri yang berkembang pesat seperti industri plastik, kertas, dan tekstil menggunakan zat warna sebagai bahan baku sehingga limbahnya berpotensi mencemari lingkungan. Selain bersifat toksik, keberadaan zat warna di perairan berpotensi menghalangi penetrasi sinar matahari yang masuk sehingga menggangu kehidupan biota air. Upaya untuk mengurai kadar zat warna menggunakan katalis besi telah dilakukan. Dan & Tao (2011) telah berhasil menggunakan katalis besi yang didukung oleh karbon aktif untuk mengurangi COD dari air tercemar metilen biru hingga 85%. Katalis magnetit berhasil mengurangi kadar rhodamin B pada pH netral yang telah dilakukan oleh Xue dkk.(2009).
Sebagai upaya mengembangkan proses oksidasi limbah zat warna, khususnya metilen biru, dalam penelitian ini dilakukan sintesis nanopartikel magnetit dengan metode kopresipitasi dan maghemit dari oksidasi magnetit. Hasil sintesis yang diperoleh akan digunakan sebagai katalis heterogen dalam oksidasi metilen biru.
METODE Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini adalah gelas kimia, gelas ukur, pipet ukur, pipet tetes, labu ukur, erlenmeyer, batang pengaduk, spatula, botol semprot, gelas arloji, corong kaca, mortar, pastel, kertas saring, oven,
magnetic stirrer, hot plate, furnace, indikator universal, kertas lakmus merah,
kertas lakmus biru, pengaduk mekanik, centrifuge, neraca analitik, spectronic 20
(Genesys), XRD (Panalytical Xpert Pro), BET (Nova 1200 Quantachrome), dan
TG-DTA (Mettler Toledo). Bahan-bahan yang digunakan dalam penelitian adalah serbuk metilen biru, asam klorida 36%, etanol 96%, natrium hidroksida, besi(II) sulfat heptahidrat, besi(III) klorida anhidrat, larutan hidrogen peroksida 30%, air, air kapur, dan aqua demineralisasi. Semua bahan yang digunakan dalam kategori
pro analys dan diproduksi oleh Merck, kecuali air, air kapur, dan aqua
Eksperimen
Sintesis Nanopartikel Magnetit
Sebanyak 8 mL larutan besi(II) sulfat 0,5 M dan 8 mL larutan besi(III) klorida 1 M dicampurkan ke dalam gelas kimia secara bersama kemudian diaduk hingga homogen. Campuran ditambahkan secara perlahan ke dalam 50 mL larutan natrium hidroksida 1,5 M dalam gelas kimia diaduk dengan magnetic stirrer. Endapan hitam yang diperoleh disaring dan dicuci hingga pH air cucian sama dengan pH air yang digunakan untuk mencuci. Endapan dikeringkan dalam oven selama 3 jam pada suhu 60-65 ºC. Endapan yang telah kering ditumbuk. Terhadap serbuk hitam yang diperoleh dilakukan pengamatan fisik, uji kelarutan (dalam air, etanol, dan asam klorida), dan karakterisasi dengan XRD, BET, dan TG-DTA.
Sintesis Nanopartikel Maghemit
Sebanyak 1 gram serbuk magnetit hasil sintesis dipanaskan di dalam
furnace pada temperatur 200 oC selama 2 jam. Terhadap serbuk yang diperoleh
dilakukan pengamatan fisik, uji kelarutan (dalam air, etanol, dan asam klorida), dan dikarakterisasi dengan XRD dan BET.
Penentuan Panjang Gelombang Maksimum Metilen Biru
Larutan metilen biru 3 ppm diukur absorbansinya menggunakan spectronic 20 pada panjang gelombang 640, 645, 650, 655, 660, 661, 662, 663, 664, 665, dan 670 nm.
Penentuan Jumlah Larutan Hidrogen Peroksida 30%
Sebanyak 50 mL larutan metilen biru 3 ppm direaksikan dengan larutan hidrogen peroksida 30% pada variasi volume 0,4; 0,6; 0,8; 1,0; 1,2; dan 1,4 mL sambil diaduk. Setelah 24 jam reaksi berlangsung, hasil oksidasi larutan metilen biru oleh larutan hidrogen peroksida 30% diukur absorbansinya menggunakan
spectronic 20 pada panjang gelombang 664 nm.
Uji Sifat Katalitik Nanopartikel Magnetit dan Maghemit pada Reaksi Oksidasi Metilen Biru
Oksidasi tanpa Katalis. Sebanyak 50 mL larutan metilen biru 3 ppm direaksikan
dengan 1 mL larutan hidrogen peroksida 30% sambil diaduk selama 1 jam. Absorbansi larutan metilen biru diukur setiap 1 jam selama 5 jam proses oksidasi.
Oksidasi dengan Katalis. Sebanyak 0,05 gram magnetit hasil sintesis dicampur
dengan 50 mL larutan metilen biru 3 ppm dan diaduk selama 90 menit. Setelah itu, ke dalam campuran tersebut ditambahkan 1 mL larutan hidrogen peroksida 30% dan pengadukan dilakukan kembali. Setelah 1 jam, campuran disentrifuge dan supernatan diukur absorbansinya pada panjang gelombang 664 nm. Supernatan yang telah diukur absorbansinya dimasukkan kembali dalam gelas kimia bersama endapan yang ada. Pengukuran absorbansi dilakukan setiap jam selama 5 jam proses oksidasi berlangsung. Oksidasi dengan katalis maghemit dilakukan dengan prosedur yang sama. Pengambilan data dilakukan sebanyak dua kali untuk oksidasi tanpa dan dengan katalis.
25 30 35 40 45 50 55 60 65 (220) (311) (222) (400) (422) (511) (440) 2
Identifikasi Senyawa Hasil Oksidasi Metilen Biru
Gas amonia diidentifikasi dengan cara menempelkan kertas lakmus merah basah pada mulut erlenmeyer saat reaksi oksidasi metilen biru berlangsung. Gas karbon dioksida diidentifikasi dengan cara mengalirkan gas yang dihasilkan saat proses oksidasi larutan metilen biru pada air kapur.
HASIL DAN PEMBAHASAN
Sintesis dan Karakterisasi Nanopartikel Magnetit
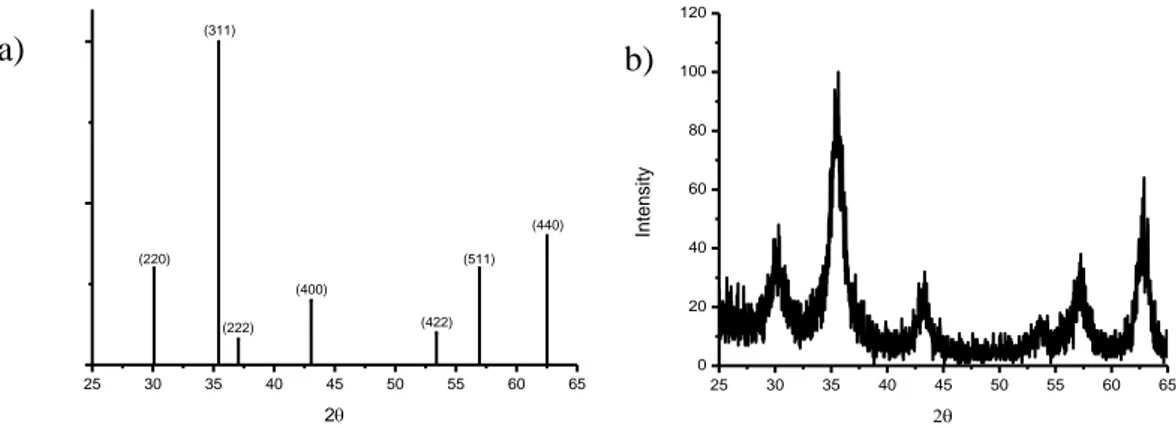
Produk hasil kopresipitasi berupa serbuk berwarna hitam, larut dalam asam klorida tetapi tidak dapat larut dalam air dan etanol (Hawley, 1971). Berdasarkan Gambar 1, intensitas relatif puncak-puncak tertinggi yang muncul pada spektrum XRD magnetit hasil sintesis bersesuaian dengan referensi, yaitu pada nilai 2θ 30,0945° (220); 35,4223° (311); 37,0518° (222); 43,0519° (400); 53,3909° (422); 56,9425° (511); dan 62,5146° (440). Dilihat dari hasil karakterisasi tersebut, tampak bahwa ada kesesuaian antara data hasil sintesis dengan referensi JCPDS Card No. 19-629 untuk magnetit. Sehingga dapat diyakini bahwa zat hasil sintesis merupakan magnetit.
Gambar 1 (a) Spektrum XRD Magnetit (JCPDS Card No. 19-629) dan (b) Spektrum XRD Magnetit Hasil Sintesis
Analisis BET (Brunauer Emmet Teller)
Hasil karakterisasi BET memberikan hasil luas permukaan sebesar 112,701 m2/g dengan diameter rata-rata partikel sebesar 10,28 nm. Hal ini menunjukan bahwa magnetit yang disintesis telah memiliki ukuran pada skala nanometer karena berukuran kurang dari 100 nm.
Analisis TG-DTA (Thermogravimetry Differential Thermal Analysis)
Analisis TG-DTA dilakukan untuk mengetahui pengaruh temperatur terhadap kestabilan magnetit, sehingga dapat menunjukkan temperatur oksidasi maghemit dari magnetit hasil sintesis disajikan pada Gambar 2.
25 30 35 40 45 50 55 60 65 0 20 40 60 80 100 120 Int en sity a) b)
Gambar 2 Kurva TG-DTA
Berdasarkan Gambar 2 kurva merah merupakan kurva TG, kurva biru adalah kurva DTA, dan kurva hijau adalah kurva temperatur. Pada kurva DTA muncul puncak eksotermik yang menandakan adanya perubahan kimia pada sampel. Dalam hal ini dapat dianalisis bahwa puncak eksotermik merupakan indikasi magnetit teroksidasi menjadi maghemit. Puncak tersebut di plotkan pada kurva temperatur sehingga diperoleh temperatur oksidasi magnetit menjadi maghemit yaitu 200 oC.
Sintesis dan Karaterisasi Nanopartikel Maghemit
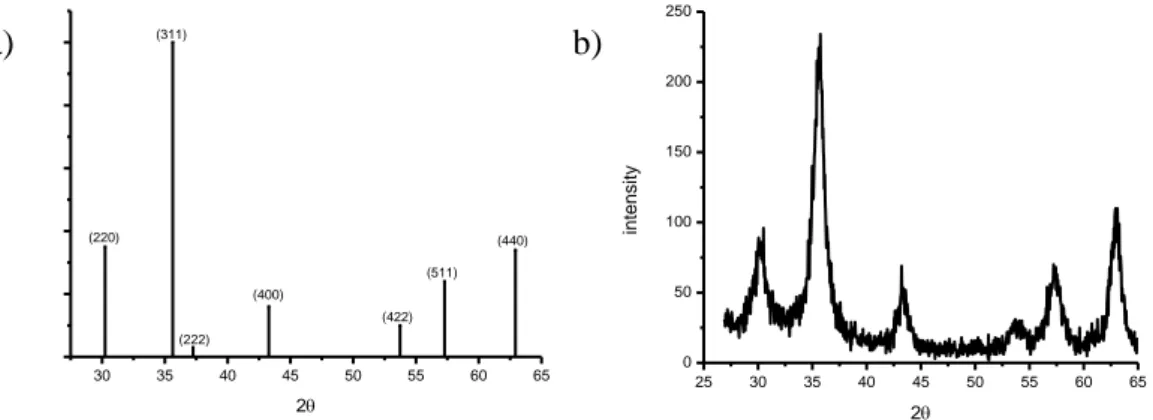
Produk hasil oksidasi magnetit berupa serbuk berwarna coklat kemerahan, larut dalam asam klorida tetapi tidak dapat larut dalam air dan etanol (Hawley, 1971). Berdasarkan Gambar 3, intensitas relatif puncak-puncak tertinggi yang muncul pada spektrum XRD maghemit hasil sintesis bersesuaian dengan referensi, yaitu pada nilai 2θ 30,2406° (220); 35,6302° (311); 37,2492° (222); 43,2835° (400); 53,7325° (422); 57,2714° (511); dan 62,9250° (440). Dilihat dari hasil karakterisasi tersebut, tampak bahwa ada kesesuaian antara data hasil sintesis dengan referensi JCPDS Card No. 39-1346 untuk maghemit. Sehingga dapat diyakini bahwa zat hasil sintesis merupakan maghemit.
Gambar 3 (a) Spektrum XRD Maghemit (JCPDS Card No.
39-25 30 35 40 45 50 55 60 65 0 50 100 150 200 250 inte nsity 2 30 35 40 45 50 55 60 65 (440) (511) (422) (222) (311) (220) (400) 2 b) a)
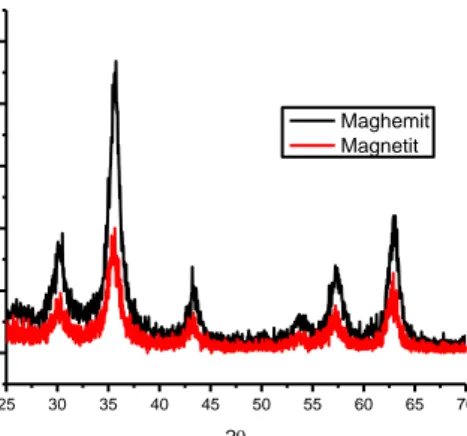
Terbentuknya masing-masing oksida besi magnetit dan maghemit diperkuat dengan adanya perbedaan geseran sudut 2θ berdasarkan Gambar 4.
Gambar 4 Perbandingan Spektrum XRD Magnetit dan Maghemit
Berdasarkan Gambar 4, tampak bahwa sudut 2θ yang dibentuk oleh maghemit memiliki nilai yang lebih besar daripada magnetit. Hal ini disebabkan karena magnetit memiliki panjang unit sel (a) lebih besar daripada maghemit. Magnetit memiliki nilai a sebesar 8,39 Å sedangkan maghemit adalah 8,34 Å, nilai a berbanding terbalik dengan sudut 2θ. Semakin besar nilai a maka sudut 2θ yang terbentuk akan semakin kecil dan sebaliknya. Berdasarkan hal tersebut, maghemit memiliki sudut 2θ yang lebih besar dibandingkan dengan magnetit dengan data yang tersaji pada Tabel 1.
Tabel 1 Perbandingan Nilai 2θ Magnetit dan Maghemit Hasil Sintesis Magnetit Maghemit 30,1460o 30,2112 o 35,5052 o 35,6510 o 37,0300 o 37,5800 o 43,2817 o 43,3731 o 53,7755 o 53,8600 o 57,1753 o 57,2200 o 62,8520 o 62,9734 o
Analisis BET (Brunauer Emmet Teller)
Hasil karakterisasi BET memberikan hasil luaspermukaan sebesar 87,616 m2/g dengan diameter rata-rata partikel sebesar 14,06 nm. Hal ini menunjukan bahwa magnetit yang disintesis telah memiliki ukuran pada skala nanometer karena berukuran kurang dari 100 nm.
25 30 35 40 45 50 55 60 65 70
2
Maghemit Magnetit
Uji Sifat Katalitik Nanopartikel Magnetit dan Maghemit pada Reaksi Oksidasi Metilen Biru
Uji sifat katalitik diawali dengan penentuan panjang gelombang maksimum larutan metilen biru. Berdasarkan hasil pengukuran panjang gelombang larutan metilen biru pada rentang 640-670 nm dengan menggunakan
spectronic 20, larutan metilen biru menyerap spektrum cahaya tampak secara
maksimum pada panjang gelombang 664 nm dengan absorbansi 0,588.
Selanjutnya dilakukan penentuan jumlah larutan hidrogen peroksida 30% untuk proses oksidasi larutan metilen biru. Penentuan ini dilakukan untuk memperoleh persentase oksidasi yang maksimal. Berdasarkan hasil penelitian, jumlah optimum larutan hidrogen peroksida 30% yang digunakan untuk oksidasi larutan metilen biru adalah 1 mL dengan persentase oksidasi 97,62% disajikan pada Tabel 2.
Tabel 2 Data Persentase Oksidasi Penentuan Jumlah Hidrogen Peroksida 30% Volume H2O2 30% (mL) % Oksidasi 0,4 96,43 0,6 96,94 0,8 97,28 1,0 97,62 1,2 96,77 1,4 96,77
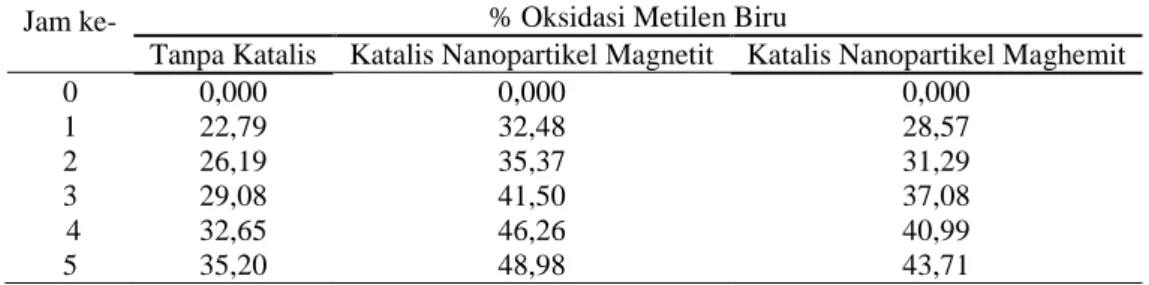
Nanopartikel magnetit dan maghemit hasil sintesis digunakan sebagai katalis pada reaksi oksidasi metilen biru. Selama proses oksidasi pengambilan data oksidasi dilakukan dengan cara mengukur nilai absorbansi larutan tiap jam selama 5 jam menggunakan spektronik 20. Dalam penelitian ini hasil tidak dibandingkan dengan blanko berupa campuran air dan metilen biru. Nilai absorbansi yang diperoleh diolah menjadi persentase oksidasi dengan data disajikan dalam Tabel 3.
Tabel 3 Perbandingan Persentase Oksidasi tanpa dan dengan Katalis Jam ke- % Oksidasi Metilen Biru
Tanpa Katalis Katalis Nanopartikel Magnetit Katalis Nanopartikel Maghemit
0 0,000 0,000 0,000 1 22,79 32,48 28,57 2 26,19 35,37 31,29 3 29,08 41,50 37,08 4 32,65 46,26 40,99 5 35,20 48,98 43,71
Berdasarkan Tabel 3 kemampuan oksidasi tanpa katalis pada penelitian ini sebesar 35,20%, dengan katalis magnetit 48,98%, dan maghemit 43,71%. Oksidasi dengan katalis menghasilkan persentase oksidasi yang lebih tinggi dari pada oksidasi tanpa katalis. Hal ini dikarenakan dengan adanya sisi aktif
Oksidasi menggunakan katalis magnetit menghasilkan persentase oksidasi lebih besar dibandingkan menggunakan katalis maghemit. Hal ini disebabkan luas permukaan magnetit lebih luas daripada maghemit. Jika luas permukaan suatu katalis semakin luas, maka sisi aktif yang tersedia semakin banyak. Sehingga kemungkinan bertumbukan dengan reaktan semakin besar, akibatnya proses oksidasi menjadi lebih cepat.
Pada penelitian ini selama proses oksidasi metilen biru dengan katalis, muncul gelembung gas pada awal proses reaksi. Campuran hasil oksidasi memiliki pH 7 yang dibuktikan dengan indikator universal dan tidak merubah warna kertas lakmus merah maupun biru. Dari hasil pengamatan tersebut diduga reaksi yang terjadi sebagai berikut:
Metilen Biru(aq) + H2O2(aq) H2O(l) + O2(g) + hasil oksidasi(aq)
Dari reaksi tersebut penurunan nilai absorbansi tiap jam karena terbentuknya H2O pada reaksi mengakibatkan bertambahnya volume pelarut yang juga menjadi faktor menurunnya nilai absorbansi (meningkatnya persentase oksidasi). Berdasarkan reaksi, gelembung gas yang muncul di identifikasi sebagai gas oksigen. Hal ini didukung dengan identifikasi senyawa hasil oksidasi metilen biru, menunjukkan tidak terdapat gas ammonia maupun gas karbon dioksida yang diamati dengan tidak berubahnya warna kertas lakmus merah dan juga air kapur tidak keruh ketika dialiri gas hasil samping.
PENUTUP
Nanopartikel magnetit yang disintesis dengan metode kopresipitasi dari larutan FeSO4 dan FeCl3 menghasilkan serbuk berwarna hitam dengan diameter rata-rata partikel 10,28 nm. Nanopartikel maghemit yang disintesis melalui oksidasi magnetit menghasilkan serbuk berwarna coklat kemerahan dengan diameter rata-rata partikel 14,06 nm. Kemampuan nanopartikel magnetit dalam mengkatalisis proses oksidasi metilen biru oleh hidrogen peroksida selama 5 jam lebih besar daripada maghemit dengan persentase oksidasi masing-masing sebesar 48,98% dan 43,71%.
DAFTAR RUJUKAN
Aji, M.P., Yulianto, A. & Bijaksana, S. 2007. Sintesis Nanopartikel Magnetit, Maghemit dan Hematit dari Bahan Lokal. Jurnal Sains Materi Indonesia, Edisi Khusus Oktober: 106-108.
Cornell, R.M. & Schwertmann, U. 2003. The Iron Oxides. Weinheim: WILEY-VCH Verlag GmbH & Co. KgaA.
Dan, Z. & Tao, Z. 2011. Methylene Blue Degradation by Heterogeneous
Fenton-Like Reactions Using Activated Carbon-Fe Catalysts. Makalah disajikan
dalam International Conference Bioinformatics and Biomedical Engineering, Wuhan, 10-12 Mei.
El Ghandoor, H., Zidan, H.M., Khalil, M.M.H. & Ismail, M.I.M. 2012. Synthesis and Some Physical Properties of Magnetite (Fe3O4) Nanoparticles.Journal
of Electrochemical Science, 7: 5734-5745.
Hawley, G.G. 1971. The Condensed Chemical Dictionary. New York: Van Nostrand Reinhold Company.
Legodi, M.A. & de Waal, D. 2007. The Preparation of Magnetite, Geothite, Hematite and Maghemite of Pigment Quality from Mill Scale Iron Waste.
Dyes and Pigment, 74 : 161-168.
Mori, K., Tanimura, I. & Yamashita, H. 2010. Synthesis, Characterization, and Catalytic Properties of Hollow γ-Fe2O3 Spheres toward Liquid-Phase Oxidation Using Hydrogen Peroxide. Bull. Chem. Soc. Jpn., 83 (9): 1122-1126.
Nedkov, I., Merodiiska, T., Slavov, L., Vandenberghe, R.E., Kusano, Y. & Takada, J. 2006. Surface Oxidation, Size and Shape of Nano-sized Magnetite Obtained by Co-Presipitation. Journal of Magnetism and
Magnetic Materials, 300 : 358-367.
Xue, X., Hanna, K. & Deng, N. 2009. Fenton-like oxidation of Rhodamine B in the presence of two types of iron (II, III) oxide. Journal of Hazardous