Pengaruh Auksin dan Sitokinin Terhadap Pertumbuhan
Planlet Anggrek Mokara
(Effect of Auxin and Cytokinin on the Growth
of Mokara Orchid Plantlets)
Widiastoety, D
Balai Penelitian Tanaman Hias, Jl. Raya Ciherang-Pacet, Cianjur 43253 E-mail: [email protected]
Naskah diterima tanggal 29 Agustus 2014 dan disetujui untuk diterbitkan tanggal 22 September 2014
ABSTRAK. Mokara merupakan salah satu jenis anggrek yang disukai konsumen. Pada umumnya budidaya anggrek komersial menggunakan benih berasal dari kultur jaringan. Optimasi media dalam kultur jaringan sangat diperlukan untuk mempercepat penyediaan benih. Salah satu cara untuk mengoptimasi media kultur jaringan yaitu dengan perlakuan zat pengatur tumbuh. Penelitian bertujuan mendapatkan komposisi zat pengatur tumbuh yang tepat dalam mempercepat pertumbuhan planlet. Penelitian dimulai pada bulan Mei sampai dengan November 2013, di Laboratorium Kultur Jaringan Pasar Minggu Jakarta. Bahan penelitian yang digunakan ialah planlet anggrek Mokara ditumbuhkan dalam media Vacin dan Went (VW) yang diberi sitokinin dan auksin. Penelitian menggunakan rancangan acak kelompok dengan enam perlakuan dan empat ulangan. Perlakuan terdiri atas (1) kontrol, (2) BAP 1ppm + NAA 1 ppm, (3) BAP 1 ppm + NAA 1 ppm + 2.4-D 0,1 ppm, (4) BAP 1 ppm, (5) NAA 1 ppm, dan (6) 2.4-D 0,1 ppm. Hasil penelitian menunjukkan bahwa perlakuan media VW + air kelapa 15% + gula pasir 20 g/l + pisang 75 g/l + charcoal 2 g/l + BAP 1 ppm + NAA 1 ppm + 2.4-D 0,1 ppm memberikan hasil terbaik dibandingkan perlakuan lainnya dan kontrol dalam meningkatkan pertumbuhan tinggi planlet, jumlah daun, panjang daun, dan jumlah akar.
Katakunci: Anggrek Mokara; Zat pengatur tumbuh; In vitro
ABSTRACT. Mokara is one of the favourite genera of orchid. The commercial orchid plantations generally use seedling from in vitro culture. Optimizing media is critical factor to improve plantlet growth and to promote plantlet procurement. One of the methods to enrich the medium is by the use of plant growth regulator. The experiment was conducted in the Laboratory of Indonesian Ornamental Plant Research Institute at Pasar Minggu-Jakarta, from May to November 2013. The materials used were Mokara plantlet that were cultivated in Vacin and Went added with 15% coconut water + 20 g/l sucrose + 75 g/l banana + 2 g/l charcoal. The treatments were arranged in a randomized block design with six treatments and four replications. The treatments given were plant growth regulator : (1) control, (2) BAP 1ppm + NAA 1 ppm,(3) BAP 1 ppm + NAA 1 ppm + 2.4-D 0,1 ppm,(4) BAP 1 ppm, (5) NAA 1 ppm, (6) 2.4-D 0.1 ppm. The results showed that medium VW + 15% coconut water + 20 g/l sucrose + 75 g/l banana + 2 g/l charcoal + 1 ppm BAP + 1 ppm NAA + 0,1 ppm 2.4-D was the best to enhance the plantlet height, leaf number, leaf length, and root number compared to those other treatment and control.
Keywords: Mokara orchids; Growth regulator; In vitro
Anggrek merupakan komoditas tanaman hias yang mempunyai arti penting dalam perdagangan internasional. Sampai saat ini anggrek masih menjadi pusat perhatian petani dan pencinta tanaman hias, karena potensinya cerah sebagai bunga potong dan tanaman pot. Potensi ekonomi anggrek sebagai salah satu komoditas hortikultura telah dimanfaatkan dan dikembangkan oleh banyak negara termasuk Indonesia. Hal ini menunjukkan bahwa bisnis bunga di level internasional sangat prospektif. Pengembangan usaha anggrek diharapkan berdampak terhadap peningkatan pendapatan, penyediaan tenaga kerja, dan pertumbuhan ekonomi nasional. Namun pengembangan anggrek di Indonesia terkendala oleh terbatasnya benih bermutu, karena teknologi yang digunakan masih tradisional. Teknologi perbanyakan klonal melalui teknik kultur jaringan dapat mengatasi ketersediaan benih bermutu dalam skala massal (Thengane et al. 2006).
Mokara merupakan kerabat Vanda hasil persilangan trigenerik yaitu persilangan antara Arachnis x Ascocentrum x Vanda. Perbanyakan melalui kultur in vitro pada anggrek Vanda pertama kali dilakukan di Singapore dengan mendapatkan massa kalus dari sumber eksplan. Pertumbuhan planlet Mokara sangat lambat, sehingga memengaruhi fase pertumbuhan generatifnya. Oleh karena itu diperlukan cara untuk mempercepat pertumbuhannya, yaitu dengan pemberian zat pengatur tumbuh. Pada umumnya media Vacin dan Went (VW) digunakan sebagai media dasar untuk pertumbuhan dan memperbanyak Vanda secara kultur in vitro (Kunisaki et al. 1972). Menurut Nguyen Thi Lang & Ngo Thi Hang (2006) pembentukan embrio sangat dipengaruhi oleh asal usul kalus atau protocorm like bodies (Plbs). Sahrawat & Chand (2001) melaporkan bahwa perubahan keseimbangan hormon dalam sel terhadap zat pengatur
tumbuh (ZPT) auksin dan sitokinin menentukan proses diferensiasi. Kombinasi antara sitokinin dengan auksin yang tepat pada kultur endosperm dapat menginduksi pembentukan kalus (Miyashita et al. 2009). Respons jaringan tanaman berbeda-beda terhadap ZPT auksin (Firoozabady & Moy 2004) maupun sitokinin (Sripaoraya et al. 2003), keadaan tersebut dapat digunakan dalam proses regenerasi. Menurut Decruse et al. (2003) kombinasi perlakuan perbandingan antara auksin dan sitokinin sangat memengaruhi dalam menentukan tipe morfogenesis.
Zat pengatur tumbuh golongan auksin seperti NAA, IAA, IBA, dan 2,4-D berfungsi dalam meningkatkan tekanan osmotik, permeabilitas sel, mengurangi tekanan pada dinding sel, meningkatkan plastisitas dan mengembangkan dinding sel, serta meningkatkan sintesis protein. Di samping itu auksin berperan menstimulir pemanjangan dan pembesaran sel, sedangkan ZPT golongan sitokinin seperti kinetin, BAP atau BA berfungsi dalam pembelahan sel. Dalam hubungannya dengan permeabilitas sel, auksin meningkatkan difusi masuknya air ke dalam sel. Kombinasi auksin dengan sitokinin akan menstimulir pembelahan sel dan memengaruhi lintasan diferensiasi. Zat pengatur tumbuh 2,4-D merupakan auksin yang mempunyai daya aktivitas kuat, tetapi pada konsentrasi rendah dapat menginduksi kalus endosperm (Thomas & Chaturvedi 2008). Menurut Fonnesbech (1992) auksin tidak berfungsi bila tidak berinteraksi dengan hormon lainnya. Morel (1974) menyatakan bahwa konsentrasi terbaik yang digunakan ialah 1 ppm sitokinin dan 1 ppm NAA.
Tujuan penelitian ialah mendapatkan komposisi ZPT dalam medium yang tepat untuk menstimulir pertumbuhan planlet anggrek Mokara. Hipotesis yang diajukan dalam penelitian ini adalah bahwa pemberian auksin dan sitokinin dengan konsentrasi tertentu dapat menstimulir pertumbuhan planlet anggrek Mokara.
BAHAN DAN METODE
Penelitian dilaksanakan di Laboratorium Kultur Jaringan Kebun Percobaan – Balai Penelitian Tanaman Hias Pasar Minggu Jakarta Selatan, dimulai pada bulan Mei sampai dengan November 2013. Bahan penelitian yang digunakan ialah planlet/tunas tanpa akar berukuran 1,5 cm yang berasal dari hasil kultur mata tunas dengan medium tumbuh Vacin dan Went (VW). Rancangan percobaan yang digunakan ialah rancangan acak kelompok (RAK) dengan enam perlakuan dan empat ulangan. Kombinasi auksin dan sitokinin dalam penelitian ini adalah sebagai berikut :
(A) VW + air kelapa 15% + gula pasir 20 g/l +pisang 75 g/l + charcoal 2 g/l (kontrol), (B) VW + air kelapa 15% + gula pasir 20 g/l + pisang 75 g/l + charcoal 2 g/l + BAP 1 ppm + NAA 1 ppm, (C) VW + air kelapa 15% + gula pasir 20 g/l + pisang 75 g/l + charcoal 2 g/l + BAP 1 ppm + NAA 1 ppm + 2,4-D 0,1 ppm, (D) VW + air kelapa 15% + gula pasir 20 g/l + pisang 75 g/l + charcoal 2 g/l + BAP 1 ppm, (E) VW + air kelapa 15 % + gula pasir 20 g/l + pisang 75 g/l + charcoal 2 g/l + NAA 1 ppm, dan (F) VW + air kelapa 15% + gula pasir 20 g/l + pisang 75 g/l + charcoal 2 g/l + 2.4-D 0,1 ppm.
Planlet/tunas tanpa akar berukuran kurang lebih 1,5 cm dalam keadaan steril ditumbuhkan secara aseptis dalam botol-botol kultur sesuai perlakuan. Setiap botol kultur terdiri atas 10 planlet/tunas. Botol-botol kultur diletakkan dan dipelihara pada rak-rak kultur di ruang kultur dalam posisi horizontal dengan kemiringan 20o dan kondisi terang yang diberi cahaya lampu TLD 40 watt, suhu ruangan berkisar antara 22o– 25oC.
Prosedur Membuat Medium
Pada Penelitian ini digunakan medium modifikasi VW padat. Untuk memudahkan pembuatan medium telah dibuat larutan baku dan disimpan dalam freezer sebelum digunakan untuk membuat medium. Pembuatan larutan buku selain untuk mempermudah kelarutan setiap unsur yang digunakan juga memberikan ketelitian yang lebih tinggi bagi unsur-unsur yang digunakan dalam jumlah yang sangat kecil.
Di bawah ini diuraikan cara pembuatan VW: a. Komposisi medium modifikasi VW
Ca3 (P04)2 : 0,200 g KN03 : 0,525 g KH2 P04 : 0,250 g MgS04. 7H20 : 0,250 g (NH4)2SO4 : 0,500 g Na2EDTA : 0,0373 g FeSO4. 7H2O : 0,0278 g MnSO4. 4H2O : 0,0075 g Sukrosa : 20 g Air Kelapa : 150 ml Pisang : 75 g Charcoal : 2 g Aquades : 850 ml pH : 4,8 – 5,2
b. Pembuatan larutan baku :
Larutan baku A per liter
(NH4)2SO4 : 5,000 g
MNSO4. 4H2O : 0,075 g
Larutan baku B per liter MgSO4.7H2.O : 2,500 g
Larutan F per 100 ml
Na2EDTA : 0,746 g
FeSO4.7H2O : 0,556 g c. Pembuatan medium
Ke dalam tabung yang berisi 250 ml akuades dimasukkan larutan F sebanyak 5 ml. Kemudian ke dalam tabung tersebut ditambahkan 100 ml larutan baku A dan 100 ml larutan baku B. Untuk melarutkan Ca3(PO4)2 sebanyak 0,200 g dibutuhkan kira-kira 5 ml larutan 1N HCL. Air Kelapa yang diperlukan 150 ml dan telah disaring tiga kali dengan menggunakan kertas saring, bubur pisang 75 g, sukrosa 20 g dan charcoal 2 g/l. Penambahan BA, NAA dan 2.4-D diberikan sesuai perlakuan. Seluruh bahan-bahan dicampur menjadi satu, selanjutnya larutan medium tersebut ditambah akuades sehingga volumenya menjadi 1 liter dan pH ditetapkan berkisar antara 4,8 – 5,2.
Setelah itu ke dalam botol-botol kultur yang berukuran 350 ml masing-masing diisi larutan medium sebanyak 60 ml, kemudian ditutup dengan tutup karet yang di atasnya dilapisi dengan kertas sampul cokelat dan diikat dengan karet. Sterilisasi medium dilakukan dengan otoklaf pada tekanan 15 lbs selama 15 menit. Setelah beberapa hari medium tidak terkontaminasi maka medium siap untuk digunakan.
Semua parameter pada setiap planlet dicatat dan dihitung jumlahnya pada minggu ke-28 (7 bulan) setelah penanaman. Beberapa parameter yang digunakan untuk mengukur pertumbuhan vegetatif planlet/tunas, ialah sebagai berikut : (1)tinggi planlet, diukur mulai dari pangkal batang sampai dengan ujung daun terpanjang, (2) jumlah daun, semua daun pada
diukur mulai dari pangkal daun sampai ujung daun, (4) lebar daun, diukur pada bagian tengah daun, (5) panjang akar, diukur mulai dari pangkal akar sampai ujung akar, dan (6) jumlah akar, semua akar pada setiap planlet dihitung jumlahnya.
Analisis statistik dilakukan terhadap semua parameter pada minggu ke-28 (7 bulan) dengan Analisis Variansi (ANOVA). Anova dilakukan untuk mengetahui ada tidaknya pengaruh pemberian perlakuan ZPT auksin dan sitokinin pada setiap perlakuan dari masing-masing parameter yang diuji. Untuk mengetahui perbedaan antar perlakuan, maka dilakukan uji jarak berganda Duncan pada taraf 5 % untuk mengetahui jenis perlakuan yang terbaik.
HASIL DAN PEMBAHASAN
Pada percobaan ini penggunaan ZPT auksin (NAA dan 2,4-D) serta sitokinin (BAP) dalam media kultur memperlihatkan pengaruh yang berbeda nyata terhadap pertumbuhan planlet. Stabilitas genetik tanaman yang dihasilkan melalui kultur jaringan sangat dipengaruhi oleh jenis eksplan, lamanya kultur, genotip tanaman, kondisi kultur, dan metode regenerasi (Route et al. 2006).
Tinggi Planlet
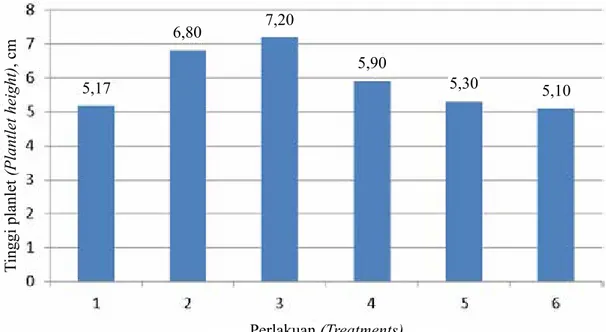
Hasil penelitian menunjukkan bahwa perlakuan media VW + air kelapa 15% + gula pasir 20 g/l + pisang 75 g/l + charcoal 2 g/l + BAP 1 ppm + NAA 1 ppm dan media VW + air kelapa 15% + gula pasir 20 g/l + pisang 75 g/l + charcoal 2 g/l + BAP 1 ppm + NAA 1 ppm + 2.4-D 0,1 ppm memberikan hasil yang lebih baik terhadap pertumbuhan tinggi planlet dibandingkan dengan perlakuan lainnya dan kontrol (Tabel 1).
Pemberian auksin NAA dan 2,4-D mampu menstimulir sintesis protein dalam jaringan tanaman yang dapat menyebabkan meningkatnya permeabilitas dinding sel, sehingga merangsang pembelahan dan pemanjangan sel yang akan memengaruhi pertambahan Tabel 1. Tinggi planlet setelah 6 bulan penanaman (Plantlet height at 6 months after cultured)
Perlakuan (Treatments) Tinggi planlet (Plantlet height), cm Tanpa ZPT (Without ZPT) BAP 1 ppm + NAA 1 ppm BAP 1 ppm + NAA 1 ppm + 2.4-D 0,1 ppm BAP 1 ppm NAA 1 ppm 2,4-D 0,1 ppm 5,17 c 6,80 a 7,20 a 5,90 b 5,30 c 5,10 c KK (CV), % 14,85
Angka yang diikuti dengan huruf yang sama pada kolom yang sama tidak berbeda nyata menurut uji Duncan pada taraf kepercayaan 5% (Mean followed by the same letters in the same column are not significantly different at 5% Duncan test)
tinggi planlet (Rost et al. 1998). Pemanjangan batang terjadi karena adanya proses pembelahan, pemanjangan dan pembesaran sel-sel baru yang terjadi pada meristem apikal dan ruas batang, yang menyebabkan tanaman bertambah tinggi. Dengan pemberian BAP ke dalam media kultur akan berpengaruh terhadap pertumbuhan jaringan. Zat pengatur tumbuh 2,4-D mempunyai sifat yang lebih mudah diserap oleh sel tanaman, tidak mudah terurai dan berfungsi mendorong aktivitas morfogenesis (Shoemaker et al. 1991).
Jumlah daun
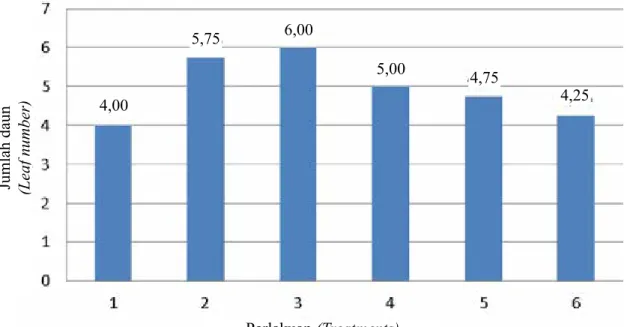
Pada percobaan ini penggunaan ZPT auksin (NAA dan 2,4-D) serta sitokinin (BAP) dalam media kultur memperlihatkan pengaruh yang berbeda nyata terhadap pertambahan jumlah daun. Hasil penelitian menunjukkan bahwa perlakuan media VW + air kelapa 15% + gula pasir 20 g/l + pisang 75 g/l +charcoal 2 g/l + BAP 1 ppm + NAA 1 ppm dan media VW + air kelapa 15% + gula pasir 20 g/l + pisang 75 g/l + charcoal 2 g/l + BAP 1 ppm + NAA 1 ppm + 2,4-D 0,1 ppm memberikan hasil yang lebih baik terhadap
Gambar 1. Pengaruh auksin dan sitokinin terhadap pertumbuhan tinggi planlet anggrek Mokara (Effect of auxin and cytokinin on the height of Mokara orchid plantlet)
pertambahan jumlah daun dibandingkan dengan perlakuan lainnya dan kontrol (Tabel 2).
Fitohormon bekerja secara sinergis dengan hormon tumbuh lainnya dalam menstimulir pertumbuhan. IAA yang merupakan auksin alami diproduksi dalam jaringan tumbuhan bekerja secara sinergis dengan NAA dan 2,4-D yang merupakan auksin sintetis serta BAP yang merupakan sitokinin sintetis yang diberikan pada percobaan ini penting dalam pengaturan pembelahan sel dan merangsang pertumbuhan daun, sehingga jumlah daun bertambah. Jumlah daun erat hubungannya dengan proses fotosintesis dan metabolisme tanaman, serta penyerapan hara, karena daun merupakan organ utama berlangsungnya proses fotosintesis. Selain itu 2,4-D berperan penting terhadap pembentukan embriogenesis somatik secara langsung (Lan et al. 2009).
Panjang dan Lebar daun
Auksin tidak berfungsi dengan baik bila tidak berinteraksi dengan zat pengatur tumbuh lainnya seperti sitokinin dan nutrisi lainnya. Hasil penelitian Tabel 2. Jumlah daun setelah 6 bulan penanaman (Leaf number at 6 months after cultured)
Perlakuan (Treatments) Jumlah daun (Leaf number) Tanpa ZPT (Without ZPT) BAP 1 ppm + NAA 1 ppm BAP 1 ppm + NAA 1 ppm + 2.4-D 0,1 ppm BAP 1 ppm NAA 1 ppm 2.4-D 0,1 ppm 4,00 d 5,75 a 6,00 a 5,00 b 4,75 bc 4,25 cd KK (CV), % 16,26 Tinggi planlet (Plantlet height) , cm Perlakuan (Treatments) 5,17 6,80 7,20 5,90 5,30 5,10
Gambar 2. Pengaruh auksin dan sitokinin terhadap pertambahan jumlah daun planlet anggrek Mokara (Effect of auxin and cytokinin on the leaf number of Mokara orchid plantlet)
Tabel 3. Panjang dan lebar daun setelah 6 bulan penanaman (Leaf length and leaf width at 6 months after cultured)
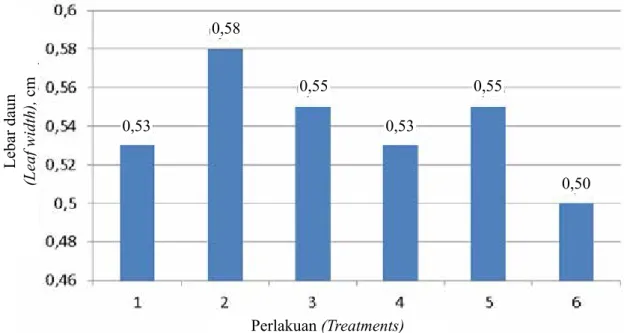
Perlakuan (Treatments) Panjang daun (Leaf length), cm Lebar daun (Leaf width), cm Tanpa ZPT (Without ZPT) BAP 1 ppm + NAA 1 ppm BAP 1 ppm + NAA 1 ppm + 2.4-D 0,1 ppm BAP 1 ppm NAA 1 ppm 2.4-D 0,1 ppm 4,50 d 6,00 b 6,75 a 5,00 c 4,50 d 4,30 d 0,53 a 0,58 a 0,55 a 0,53 a 0,55 a 0,50 a KK (CV), % 18,13 14,32 Perlakuan (Treatments) Jumlah daun (Leaf number)
4,00
5,75 6,00
5,00 4,75
4,25
Gambar 3. Pengaruh auksin dan sitokinin terhadap pertumbuhan panjang daun planlet anggrek Mokara (Effect of auxin and cytokinin on the leaf length of Mokara orchid plantlet)
Perlakuan (Treatments) Panjang daun (Leaf length), cm 4,50 6,00 6,75 5,00 4,50 4,30 Perlakuan (Treatments)
Gambar 4. Pengaruh auksin dan sitokinin terhadap pertumbuhan lebar daun planlet anggrek Mokara (Effect of auxin and cytokinin on the leaf width of Mokara orchid plantlet)
Perlakuan (Treatments) Lebar daun (Leaf width), cm 0,53 0,58 0,55 0,53 0,55 0,50
Tabel 4. Jumlah dan panjang akar setelah 6 bulan penanaman (Root number and root length at 6 months after cultured)
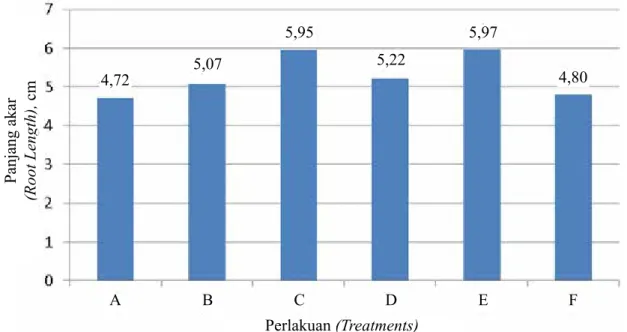
Perlakuan (Treatments) Jumlah akar (Root number) Panjang akar (Root length), cm Tanpa ZPT (Without ZPT) BAP 1 ppm + NAA 1 ppm BAP 1 ppm + NAA 1 ppm + 2.4-D 0,1 ppm BAP 1 ppm NAA 1 ppm 2.4-D 0,1 ppm 4,75 bcd 5,25 bc 6,25 a 4,25 d 4,50 cd 5,50 ab 4,72 a 5,07 a 5,95 a 5,22 a 5,97 a 4,80 a KK (CV), % 17,32 18,63
Gambar 5. Pengaruh auksin dan sitokinin terhadap penambahan jumlah akar planlet anggrek Mokara (Effect of auxin and cytokinin on the root number of Mokara orchid plantlet)
Jumlah akar (Root number)
Perlakuan (Treatments)
4,75 5,25
6,25
4,25 4,50
Gambar 6. Pengaruh auksin dan sitokinin terhadap pertumbuhan panjang akar planlet anggrek Mokara (Effect of auxin and cytokinin on the root length of Mokara orchid plantlet)
Perlakuan (Treatments)
Panjang akar
(Root Length),
cm
menunjukkan bahwa media VW + air kelapa 15% + gula pasir 20 g/l + pisang 75 g/l + charcoal 2 g/l + BAP 1 ppm + NAA 1 ppm + 2,4-D 0,1 ppm memperlihatkan pengaruh nyata terhadap panjang daun dibandingkan dengan perlakuan lainnya dan kontrol. Sedangkan semua perlakuan tidak menunjukkan pengaruh nyata terhadap lebar daun (Tabel 3).
Peningkatan pertumbuhan panjang daun disebabkan karena adanya percepatan pembelahan sel dan mendorong proses diferensiasi. Pembelahan sel membutuhkan energi tinggi yang diperoleh dari auksin dan sitokinin serta nutrisi lainnya. Energi dalam bentuk ATP yang merupakan hasil proses respirasi digunakan untuk mensintesis senyawa essensial, seperti protein, karbohidrat, lemak, dan senyawa essensial lainnya. Senyawa-senyawa tersebut diperlukan untuk proses pembelahan sel-sel baru yang terjadi pada meristem apikal dan meristem interkalar. Proses pertumbuhan dan perkembangan daun membutuhkan ZPT seperti auksin dan sitokinin serta nutrisi lainnya yang terkandung dalam media tumbuh. Pemberian auksin dapat memengaruhi pertumbuhan daun terutama panjang jaringan-jaringan pembuluhnya (Agrawal 1999). Hal ini sesuai dengan pernyataan Humphries & Wheeler (1963) bahwa panjang dan lebar daun erat hubungannya dengan arah pembelahan, pembesaran, jumlah, dan distribusi sel. Makin luas daun, jumlah stomata semakin bertambah. Stomata sangat berperan dalam penyerapan nurisi dan zat-zat yang dibutuhkan dalam proses metabolisme tanaman untuk menghasilkan asimilat-asimilat.
Jumlah dan Panjang Akar
Dalam peranannya sebagai penentu arah perkembangan jaringan, pemberian auksin dan sitokinin harus mempertimbangkan konsentrasi maupun perbandingannya dalam media. Bila auksin lebih tinggi dibandingkan sitokinin menyebabkan diferensiasi mengarah ke pertumbuhan akar. Hasil penelitian menunjukkan bahwa perlakuan VW + air kelapa 15% + gula pasir 20 g/l + pisang 75 g/l + charcoal 2 g/l + BAP 1 ppm + NAA 1 ppm + 2,4-D 0,1 ppm memperlihatkan jumlah akar dan panjang akar yang lebih baik, sedangkan semua perlakuan tidak menunjukkan pengaruh nyata terhadap panjang akar (Tabel 4).
Pembentukan akar berhubungan dengan kandungan auksin dan sitokinin endogen dalam jaringan tanaman, selanjutnya diikuti oleh proses pemanjangan dan pembesaran sel. Hasil penelitian menunjukkan bahwa media VW + air kelapa 15% + gula pasir 20 g/l + pisang 75 g/l + charcoal 2 g/l + BAP 1 ppm + NAA 1 ppm + 2,4-D 0,1 ppm memberikan hasil yang lebih baik dibandingkan dengan perlakuan lainnya dan kontrol (Tabel 4). Di samping pengaruh auksin dan sitokinin endogen, terjadinya pembentukan akar juga dipengaruhi oleh intensitas cahaya. Intensitas cahaya yang rendah dapat merangsang ZPT endogen untuk bekerja lebih aktif dalam melakukan proses pertumbuhan dan perkembangan akar. Menurut Martin Urdiroz et al. (2004) kondisi terang berpengaruh nyata terhadap
4,72 5,07 5,95 5,22 5,97 4,80 A B C D E F
perbaikan kemampuan regenerasi planlet. Auksin dalam jaringan tanaman dapat bekerja dengan aktif meskipun dalam keadaan gelap, tetapi sintesis auksin berlangsung dalam keadaan terang. Pertambahan panjang akar disebabkan terjadinya proses pembelahan sel pada meristem ujung akar, selanjutnya diikuti oleh proses pemanjangan dan pembesaran sel.
Gambar 7. Pertumbuhan planlet anggrek Mokara dalam berbagai konsentrasi auksin dan sitokinin
(The growth of Mokara orchid plantlet in several concentration of auxin and cytokinin)
KESIMPULAN DAN SARAN
1. Perlakuan zat pengatur tumbuh auksin dan sitokinin berpengaruh nyata terhadap pertumbuhan dan perkembangan planlet anggrek Mokara.
2. Perlakuan media VW + air kelapa 15% + gula pasir 20 g/l + pisang 75 g/l + arang 2 g/l + BAP 1 ppm +
planlet, jumlah daun, panjang daun, dan jumlah akar planlet anggrek Mokara.
PUSTAKA
1. Agrawal, KC 1999, Physiology and biochemistry of respiration, Agro Botanical Publishers, New Delhi. 2. Decruse, SW, Gangaprasad, A, Seeni, S & Sarajini, MV 2003,
‘Micropropagation and ecorestoration of Vanda spathulata, an exquisite orchid’, Plant Cell Tissue and Organ Culture, vol. 72, pp. 199-202.
3. Firoozabady, E & Moy, Y 2004, ‘Regeneration of pineapple plants via somatic embryogenesis and organogenesis’, In Vitro Cell Dev Biol. Plant., vol. 40, pp. 67-74.
4. Fonnesbech, M 1992, ‘Growth hormone and propagation of Cymbidium in vitro’, Physiol. Plant., vol. 27, pp. 310-16. 5. Humphries, EC & Wheeler, AW 1963, ‘The physiology of leaf
growth’, Ann. Rev. PlantPhysiol., vol. 14, pp. 385-96. 6. Kunisaki, JT, Kim, KK & Sagawa, Y 1972, ‘Shoot-tip culture
of Vanda’, Amer. OrchidSoc. Bull., vol. 41, pp. 435-9. 7. Lan, TH, Hong, PL, Huang, CC, Chang, WC & Lin, CS 2009,
‘High frequency direct somatic embryogenesis from leaf tissues of Drimiopsis kirkii Baker (giant squill)’, Invitro Cell. Dev. Biol. Plant., vol. 45, pp. 44-7.
8. Martin-Urdiroz, N, Garrido-Galo, J, Martin, J & Barondiaran, X 2004, ‘Effect of light on the organogenic ability of garlic roots using a one-step in vitro system’, Plant Cell Rep., vol.10, pp. 55-62.
9. Miyashita, T, Takafumi, O, Fukashi, S, Hajime, A & Yoichiro, H 2009, ‘Plant regeneration with maintenance of the endosperm ploidy level by endosperm culture in Lonicera caerulea var. emphyllocalyx’, Plant Cell Tissue and Organ Culture, vol. 98 no. 3, pp. 291-301.
CL(ed.), The orchidsscientific studies, Wiley-Interscience Publication, John Wiley & Sons, New York., pp. 169-22. 11. Lang, NT & Hang, NT 2006, ‘Using biotechnological
approaches for Vanda orchid improvement’, Omonrice, vol. 14, pp. 140-3.
12. Rost, TL, Barbour, MG, Stocking, CR & Murphy, TM 1998, Plant biology, Wadsworth Publishing Company, California. 13. Route, GR, Mohapatra, A & Mohan, JS 2006, ‘Tissue culture
of amental pot plant : a critical review on present scenario and future prospects’, Biotechnol. Adv., no. 24, pp. 531-60. 14. Sahrawat, AK & Chand, S 2001, ‘Continuous somatic
embryogenesis and plant regeneration of hypocotyls segments of Psoralea corylifolia Lin. An endangered and medicinally important fabaceae plant’, Current Science, vol. 81 no.10, pp. 1328-31.
15. Shoemaker, RC, Amberger, LA, Palmer, RG, Oglesby, L & Ranch, JP 1991, ‘Effect 2.4-dichlorophenoxy acetic acid concentration on somatic embryogenesis and heretable variation in soybean (Glycine max (L.) Merr)’, In vitro Cell Dev. Biol., vol. 27, pp. 84-8.
16. Sripaoraya, S, Marchant, R, Power, JB & Davey, MR 2003, ‘Plant regeneration via somatic embryogenesis and organogenesis of commercial pineapple (Ananas comosus L.)’, In Vitro CellDev. Biol. Plant, vol. 39, pp. 450-4.
17. Thengane, SR, Deodhar, SR, Bhosle, SV & Rawal, SK 2006, ‘Direct somatic embryogenesis and plant regeneration in Garcinia indica Choiss’, Current Science, vol. 91 no. 8, pp 1074-8.
18. Thomas, TD & Chaturvedi, R 2008, ‘Endosperm culture: a novel method for triploid plant production’, Plant Cell Tissue and Organ Culture, vol. 93, pp. 1-14.