Echinochloa crussgalli. L., DAN BAYAM PADA BERBAGAI
CEKAMAN KEKERINGAN
MUHAMMAD ARIFAI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2009
PERNYATAAN MENGENAI TESIS
DAN SUMBER INFORMASI
Dengan ini menyatakan bahwa tesis yang berjudul ” Respon Anatomi Daun dan Parameter Fotosintesis Tumbuhan Padi Gogo, Caisim, Echinochloa crussgalli. L., dan Bayam pada Berbagai Cekaman Kekeringan”
merupakan gagasan karya saya beserta pembimbing yang belum pernah dipublikasikan dalam bentuk apapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan oleh penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagan akhir tesis ini.
Bogor, Agustus 2009
Muhammad Arifai
Parameter of Upland Rice, Green Mustard, Echinochloa crussgalli L., and Spinach to Drought Application. Under the direction of HAMIM and TRIADIATI.
Response of leaf anatomy and photosynthetic parameters of crops to drought was observerd on C3 (upland rice and mustard green) and C4 plants (Echinochloa crussgalli.L and spinach). Plants were grown in 6 kg pot containing soil and sand (1:1, v/v) under green house condition. Drought stress was provided by withholding water for 12 days for cultivated upland rice, mustard green and spinach, and 14 days for E.crussgalli.L. Observation was carried out during drought period by measuring soil water content (SWC), relative water content (RWC), plant growth, dry weight, leaf anatomy, and photosynthetic chlorophyll fluorescence parameters including the maximum efficiency of photosynthesis (Fv/Fm), photochemical quenching (qP), non-photochemical quenching (qN), quantum Yield (qY), and ascorbic acid concentration (ASA). The results showed that drought stress caused decrease of SWC by average of 17.42% and RWC of 60%. Even though the SWC of C4 plants was lower than that of C3 plants, the value of RWC of those two types of plants was not significantly different. Drought stress decreased plant dry weight by 48.85% and seed production by average of 43.80%. The longer drought decreased significantly Fv/Fm, qP, and qY, while it increased of qN. The Fv/Fm of C4 plant (E.crussgalli.L and spinach) were higher than that of C3 plant (upland rice and mustard green) on 12 days after drought stressed. The drought stress also caused decrease of leaf thicknnes, phloem diameter, bulliform and pallisade cells height, mesophyll cells and spongy parenchyma thicknnes, while it increased xylem diameter of C3 and C4 crops. Generally, ASA content increased after 4 days and reached maximum at the last period of drought, even though it reduced after rewatering except in spinach which did not accumulate ASA significantly in response to drought stress.
Keywords : drought stress, leaf anatomy, photosynthesis parameters, C3 and C4
RINGKASAN
MUHAMMAD ARIFAI. Respon Anatomi Daun dan Parameter Fotosintesis Padi gogo, Caisim, Echinochloa crussgalli L., dan Bayam pada Berbagai Cekaman Kekeringan. Dibimbing oleh HAMIM dan TRIADIATI.
Peningkatan suhu udara atmosfir diduga akan sangat mempengaruhi iklim global dunia, seperti kemungkinan meningkatnya frekwensi dan tingkat kekeringan di beberapa belahan bumi khususnya Asia dan Afrika. Keadaan ini mempengaruhi pertumbuhan tanaman dan bahkan dapat menurunkan produksi pertanian tadah hujan seperti menurunnya produksi beras, sehingga dapat menimbulkan kerawanan pangan.
Secara fisiologi ada perbedaan yang menyolok antara tumbuhan C3 dan C4 dalam menghadapi kekeringan. Pada tumbuhan C3 apabila stomata menutup akibat kekeringan, maka laju fotorespirasi meningkat, namun laju fotosintesis menurun. Berbeda dengan tumbuhan C4 yang memiliki metabolisme reduksi CO2 di ruang mesofil daun oleh PEP karboksilase. PEP karboksilase mengubah fosfoenol piruvat (PEP) menjadi senyawa berkarbon empat, sehingga PEP karboksilase tidak dapat mengikat O2 di ruang mesofil. Sementara aktivitas Rubisco di sel seludang pembuluh relatif tinggi konsentrasi CO2-nya. Tingginya konsentrasi CO2 di sel seludang pembuluh menyebabkan fotorespirasi pada tumbuhan C4 sangat rendah. Hal tersebut memungkinkan tumbuhan C4 yang relatif lebih tahan terhadap kekeringan dibanding tumbuhan C3.
Informasi tentang mekanisme fotosintesis kedua jenis tumbuhan C3 dan C4 dilihat dari aspek fisiologi dan anatomi masih kurang. Penelitian ini bertujuan mengamati respon anatomi daun dan parameter fotosintesis tumbuhan C3 dan C4 yang diberikan perlakuan cekaman kekeringan. Diharapkan diperoleh data dan informasi tentang respon anatomi daun dan fisiologi tumbuhan C3 dan C4 yang dibutuhkan dalam pengembangan tumbuhan yang toleran terhadap cekaman kekeringan.
Dua spesies tumbuhan C3 yaitu padi gogo dan caisim dan C4 yaitu
E.crussgalli.L dan bayam ditanam dalam pot yang berukuran 6 kg di rumah kaca
dengan media campuran tanah dan pasir (1:1 v/v). Perlakuan kekeringan diberikan dengan menunda penyiraman selama 12 hari pada padi gogo, caisim dan bayam, dan 14 hari pada Echinochloa (E.crussgalli.L). Pengamatan dilakukan pada Kadar Air Media (KAM), Kadar Air Relatif (KAR), tinggi tajuk, panjang akar, luas daun bobot akar, bobot tajuk, respon anatomi daun, dan parameter laju fotosintesis (Pn) yang meliputi: photochemical quenching (qP), non-photochemical quenching (qN), quantum Yield (qY), efisiensi maksimum fotosintesis (Fv/Fm), dan asam askorbat (ASA). Percobaan disusun secara faktorial dalam lingkungan Rancangan Acak Lengkap (RAL). Faktor pertama jenis tumbuhan dengan 4 taraf yaitu padi gogo (J1), caisim (J2), Echinochloa (J3), dan bayam (J4). Faktor kedua perlakuan 2 taraf yaitu penyiraman sebagai kontrol (K0), tanpa penyiraman sebagai kekeringan (K1). Data dianalis dengan ANOVA dilanjutkan dengan Tukey pada taraf α=5% menggunakan SPSS versi 15.
Perlakuan cekaman kekeringan mengakibatkan penurunan KAM rata-rata 53,58% dan KAR di bawah 60% pada tanaman uji. Selain itu kekeringan menghambat laju pertumbuhan, menurunkan bobot kering tumbuhan yang diamati
non photochemical quenching (qN) semakin meningkat. Efisiensi fotosintesis tumbuhan C4 (echinochloa dan bayam) relatif lebih tinggi dari tumbuhan C3 (padi gogo dan caisim) pada 12 hari setelah kekeringan (HSK). Perlakuan cekaman kekeringan juga menurunkan tebal daun dan diameter floem, sebaliknya meningkatkan diameter xilem semua tanaman. Tidak ada perbedaan yang menyolok antara tumbuhan C3 dan C4 dalam hal anatomi daun sebagai respon terhadap cekaman kekeringan. ASA diakumulasi pada tumbuhan secara umum mulai hari 8 hingga 12 HSK, kecuali Echinochloa yang mengakumulasi ASA pada 10-14 HSK. Bayam hampir tidak mengakumulasi ASA selama cekaman kekeringan, yang menandakan bahwa mungkin secara genetik tumbuhan ini tidak mengakumulasi ASA.
© Hak Cipta milik Institut Pertanian Bogor, tahun 2009
Hak cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa
mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan yang wajar IPB.
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh Karya tulis dalam bentuk apa pun tanpa izin IPB.
Echinochloa crussgalli. L., DAN BAYAM PADA BERBAGAI
CEKAMAN KEKERINGAN
MUHAMMAD ARIFAI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Mayor Biologi Tumbuhan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2009
Judul Penelitian : Respon Anatomi Daun dan Parameter Fotosintesis Tumbuhan Padi gogo, Caisim, Echinochloa crussgalli.L., dan Bayam pada Berbagai Cekaman Kekeringan
Nama : Muhammad Arifai
NIM : G 353070201
Disetujui Komisi Pembimbing
Dr. Ir. Hamim, M.Si Ketua
Dr. Dra. Triadiati, M.Si Anggota
Diketahui
Koordinator Mayor Biologi Tumbuhan
Dr. Ir. Miftahudin, M.Si
Dekan Sekolah Pascasarjana IPB
Prof. Dr. Ir. Khairil A.Notodiputro, M.S Tanggal Ujian: 07 Agustus 2009 Tanggal Lulus:
PRAKATA
Puji syukur penulis ucapkan kehadirat Allah SWT yang selalu melimpahkan rahmat dan hidayah-Nya, sehingga penulis dapat menyelesaikan tesis ini dengan judul “Respon Anatomi Daun dan Parameter Fotosintesis Tumbuhan Padi gogo, Caisim, Echinochloa crussgalli. L., dan Bayam pada berbagai Cekaman Kekeringan”. Penelitian ini dibiayai oleh Departeman Agama R.I dan Pemerintah daerah Kabupaten Wajo Sulawesi Selatan.
Ucapan terima kasih penulis sampaikan kepada:
1. Dr. Ir. Hamim, M.Si ketua komisi pembimbing yang selalu mengarahkan dan memberi semangat bagi penulis.
2. Dr. Dra. Triadiati, M.Si sebagai komisi pembimbing atas saran dan masukan yang berguna dalam penelitian ini.
3. Dr. Ir. Juliarni, M.Agr. atas saran dan bimbingannya dalam penyempurnaan tesis ini.
4. Dekan Sekolah Pascasarjana dan Koordinator Mayor Biologi tumbuhan atas kesempatan yang diberikan untuk mengikuti pendidikan di SPs IPB.
5. Departemen Agama yang telah memberi beasiswa
6. Pemerintah Kabupaten Wajo atas bantuan dana penelitian
7. Yayasan Puangrimaggalatung dan STKIP Prima Sengkang atas bantuannya. 8. Mertua, serta saudara-saudara ipar dan keluarga semua, atas segala doa dan
kasih sayangnya.
9. Seluruh sahabat yang telah membantu dalam penyelesaian tesis ini
Secara khusus, penulis sampaikan rasa terima kasih yang tulus kepada Istri tercinta Nurjannah, S.Ag, M.PdI, atas segala pengorbanan baik moril maupun materil, dorongan, kesabaran dan doanya. Kepada almarhum kedua orang tua penulis, dengan iringan doa, semoga amal ibadahnya diterima di sisi Allah SWT. Begitu pula ananda tercinta Arian Nurrifki dan Afifah Salsabilah atas kesabaran dan pengorbanannya. Semoga Allah SWT melimpahkan rahmat dan hidayah-Nya. Amien. Semoga tesis ini bermanfaat.
Bogor, Agustus 2009
Penulis dilahirkan di Wajo Sulawesi Selatan pada tanggal 31 Desember 1970 dari Ayah Muhammad Siri dan ibu Ambica. Penulis merupakan putra kedua dari dua bersaudara.
Tahun 2002 penulis menyelesaikan kuliah strata satu di Program Studi Pendidikan Biologi, Sekolah Tinggi Keguruan dan Ilmu Pendidikan Puangrimaggalatung Sengkang Sulawesi Selatan. Tahun akademik 2007 /2008 penulis diterima di Sekolah Pascasarjana Strata dua pada Mayor Biologi Tumbuhan, Depertemen Biologi, Institut Pertanian Bogor, dengan Beasiswa utusan daerah yang diselenggarakan oleh Departemen Agama RI.
Penulis mulai bekerja sebagai staf pengajar di Madrasah Aliyah Swasta As’adiyah Putri Pusat Sengkang dari tahun 1995 sampai sekarang pada bidang studi Biologi. Selain itu penulis juga sebagai Dosen Yayasan di STKIP PRIMA Sengkang pada Program studi Pendidikan Biologi mulai tahun 2003. Pada tahun 1997 penulis menikah dengan Nurjannah Rum , M.PdI dan dikaruniahi dua putra putri yaitu Arian Nurrifqhi dan Afifah Salsabilah.
DAFTAR ISI
Halaman
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
PENDAHULUAN Latar Belakang ... 1 Tujuan ... 3 Hipotesis ... 3 Manfaat Penelitian ... 4 TINJAUAN PUSTAKA Peranan Air bagi Pertumbuhan Tanaman ... 5
Cekaman Kekeringan pada Tumbuhan ... 6
Efek Kekeringan terhadap Fotosintesis ... 8
Hambatan stomata ... 8
Hambatan non-stomata ... 10
Cekaman Oksidatif ... 11
Penyelamatan tumbuhan dari ROS oleh asam askorbat ... 13
Mekanisme Toleransi terhadap Cekaman Kekeringan ... 14
Pengaruh Kekeringan terhadap Anatomi daun ... 15
METODOLOGI PENELITIAN Waktu dan Tempat ... 17
Bahan dan Alat ... 17
Rancangan Percobaan ... 17
Pelaksanaan ... 18
Pengambilan Data ... 19
HASIL DAN PEMBAHASAN Kadar Air Media (KAM) dan Kadar Air Relatif (KAR) daun ... 23
Parameter Fotosintesis ... 26
Kandungan Asam askorbat ... 29
Pertumbuhan Tanaman ... 31
Produksi bahan kering tumbuhan ... 35
Pengamatan Anatomi jaringan tumbuhan ... 36
KESIMPULAN DAN SARAN ... 40
DAFTAR PUSTAKA ... 41
Halaman 1 Tinggi tajuk dan panjang akar tumbuhan padi gogo, caisim, Echinochloa,
bayam perlakuan kontrol (K0) dan cekaman kekeringan (K1) pada akhir perlakuan ... 32 2 Bobot tajuk, bobot akar, bobot biji/pot tumbuhan C3 (padi gogo dan
caisim), Dan C4 (Echinochloa dan bayam) pada perlakuan kontrol (K0) dan cekaman kekeringan (K1) ... 35 3 Ketebalan daun, ukuran sel-sel daun, dan diameter xilem dan floem
tumbuhan C3 (padi dan caisim), dan C4 (Echinochloa dan bayam)
DAFTAR GAMBAR
Halaman 1 Mekanisme pembentukan ROS ... 12 2 Produksi ROS pada transpor elektron fotosintesis pada kondisi
cahaya tinggi ... 13 3 Metabolisme redoks asam askorbat ... 14 4 Nilai rata-rata Kadar Air Media (KAM) dan Nilai rata-rata Kadar Air
Relatif (KAR) daun ... 23 5 Morfologi tumbuhan percobaan pada 12 HSK ... 24 6 Parameter fotosintesis tumbuhan uji ... 28 7 Kandungan asam askorbat padi gogo, caisim, Echinochloa, dan
Bayam mulai 0 sampai 12 HSK dan 14 HSK Echinochloa ... 30 8 Luas daun padi gogo, caisim, Echinochloa, dan bayam mulai 0
sampai 12 HSK dan recovery... 34 9 Struktur anatomi daun tanaman uji pada cekaman kekeringan... 38
Halaman
1 Seri larutan dehidran ... 49 2 Hasil analisis tanah yang digunakan sebagai media tanam... 50 3 Kriteria penilaian sifat kimia tanah ... 51
PENDAHULUAN
Latar Belakang
Peningkatan suhu udara atmosfir diduga akan sangat mempengaruhi iklim global dunia, seperti kemungkinan meningkatnya frekuensi dan tingkat kekeringan di beberapa belahan bumi khususnya Asia dan Afrika (Pitelka dan Rojas 2001). Keadaan ini mempengaruhi pertumbuhan dan menyebabkan penurunan produksi tumbuhan (Hamim 2005). Apalagi di daerah-daerah pertanian padi tadah hujan, keadaan kekeringan yang berkepanjangan akan menurunkan produksi beras, sehingga dapat menimbulkan kerawanan pangan.
Kekeringan merupakan salah satu faktor lingkungan yang besar pengaruhnya terhadap penurunan produksi tumbuhan. Bahkan kekeringan merupakan penyebab terbesar penurunan produksi pangan dunia bila dibandingkan dengan faktor lingkungan lain (Boyer 1985). Selain menurunkan laju fotosintesis, kekeringan juga menyebabkan penurunan laju pertumbuhan akibat rendahnya potensial air dan turgor tumbuhan (Tezara et al. 2002).
Secara fisiologis ada perbedaan yang menyolok antara tumbuhan C3 dan C4 dalam menghadapi cekaman kekeringan. Pada tumbuhan C3, ketika stomata menutup sebagai akibat kekeringan, fotosintesis neto akan menurun dengan cepat, sedangkan fotorespirasi akan meningkat (Drake et al. 1997). Hal ini berkaitan dengan karakteristik dari enzim fotosintetik, RuBP karboksilase (Rubisco) yang selain mengikat CO2 juga dapat berikatan dengan oksigen dalam proses fotorespirasi, dan keadaan ini terjadi khususnya ketika rasio CO2/O2 menurun akibat penutupan stomata (Hamim 2005).
Tumbuhan C4 memiliki metabolisme reduksi CO2 yang berbeda dengan C3. Pada tumbuhan C4, CO2diikat oleh enzim PEP karboksilase di ruang mesofil daun. Enzim PEP karboksilase dapat mengikat CO2 membentuk senyawa berkarbon empat, namun PEP karboksilase tidak dapat mengikat O2 (Kanai dan Edwards 1999). Senyawa berkarbon empat yang terbentuk di ruang mesofil selanjutnya dipompa ke sel seludang pembuluh. Hal ini menyebabkan sel seludang pembuluh memiliki kadar CO2 lebih tinggi, dan disini CO2 akan diikat oleh rubisko membentuk gula. Tingginya konsentrasi CO2 di sel seludang
pembuluh menyebabkan fotorespirasi pada tumbuhan C4 sangat rendah. Hal tersebut memungkinkan tumbuhan C4 relatif lebih tahan terhadap kekeringan dibanding tumbuhan C3 (Voznensenskaya et al. 2003).
Pada kondisi intensitas cahaya yang tinggi, kekeringan mungkin juga bisa mengakibatkan terjadinya cekaman oksidatif karena dalam keadaan intensitas cahaya tinggi akan terjadi kelebihan energi dari proses reaksi terang, sedangkan laju reduksi CO2 fotosintesis menurun drastis akibat penutupan stomata selama cekaman (Violita 2007).
Hamim (2004) menyatakan bahwa pada tahap awal kekeringan menyebabkan berkurangnya pembukaan stomata untuk meminimalisir kehilangan air di bawah kondisi cahaya berlebihan. Peristiwa ini mengakibatkan terjadinya penurunan konsentrasi CO2 intrasel, sehingga tumbuhan mengalami kelebihan reduksi pada transfer elektron fotosintesis (Berkowitz 1998). Kelebihan reduksi ini terjadi karena pembentukan NADPH pada reaksi terang tidak diimbangi oleh pemakaian NADPH pada reaksi gelap karena penurunan konsentrasi CO2intrasel. Hal ini mengakibatkan terbentuknya spesies oksigen reaktif (ROS) yang diawali dengan peningkatan jumlah elektron pada transpor elektron fotosintesis oleh oksigen. Proses selanjutnya akan terbentuk berbagai bentuk senyawa ROS seperti; superoksida (O2-), singlet oksigen (.O2), radikal hidroksil (OH-) dan hidrogen peroksida (H2O2) (Mc Kersie dan Leshem 1994). Senyawa ROS ini akan dapat menimbulkan kerusakan pada tumbuhan (Aroca et al. 2001). Jika hal ini dibiarkan, maka lama kelamaan tumbuhan akan mati (Apel dan Hirt 2004).
Dalam menghadapi cekaman oksidatif yang di antaranya ditimbulkan oleh cekaman kekeringan, dapat diatasi oleh tumbuhan melalui mekanisme adaptasi, baik yang berjalan secara enzimatik maupun non enzimatik. Salah satu mekanisme penyelamatan secara non enzimatik terhadap cekaman oksidatif ini yaitu dengan mengakumulasi senyawa antioksidan seperti asam askorbat (ASA). ASA merupakan asam organik yang terdapat di dalam kloroplas seperti halnya klorofil yang berfungsi menetralisir radikal oksigen yang terbentuk akibat cekaman oksidatif (Dina 2001).
Selain mekanisme fisiologis, tumbuhan juga memiliki kemampuan adaptasi secara morfologis dan anatomis. Pada keadaan cekaman kekeringan
3
terdapat dua mekanisme utama yang mungkin terjadi pada tumbuhan, yaitu: (a) tumbuhan berusaha menghindari cekaman, baik dengan cara melakukan perubahan struktur morfologi dan anatomi, maupun dengan meningkatkan efisiensi penggunaan air dengan cara mengatur laju transpirasi, dan (b) meningkatkan toleransi terhadap cekaman kekeringan melalui perubahan kimia sel (Meyer dan Boyer 1981)
Pada dasarnya tumbuhan memiliki mekanisme tertentu dalam menghadapi cekaman kekeringan. Informasi tentang mekanisme tumbuhan C3 dan C4 dilihat dari aspek fisiologis dan anatomis khususnya yang menyangkut perbedaan kaakteristik antara tumbuhan C3 dan C4 masih kurang. Oleh karenanya kajian-kajian tentang perubahan struktur anatomi, laju fotosintesis dan perubahan fisiologi dari kedua kelompok tumbuhan tersebut saat mendapat cekaman kekeringan khususnya untuk jenis tumbuhan C3 dan C4 yang ada di Indonesia masih perlu dilakukan.
Tujuan
1 Membandingkan laju fotosintesis dari parameter yang diukur yaitu:
efisiensi maksimum fotosintesis (Fv/Fm), pelepasan energi untuk reaksi fotokimia (qP), pelepasan energi untuk reaksi non fotokimia (qN), dan quatum hasil fotosintesis (qY) terhadap perlakuan cekaman kekeringan pada tumbuhan C3 dan C4.
2 Mengamati respon anatomi daun pada tumbuhan C3 (padi gogo dan caisim) dan C4 (echinochloa dan bayam) pada perlakuan cekaman kekeringan.
3 Mengamati akumulasi Asam askorbat (ASA) pada tumbuhan C3 dan C4 yang mendapat cekaman kekeringan.
Hipotesis
1 Terdapat perbedaan laju fotosintesis dari parameter yang diukur yakni;
Fv/Fm, qP, qN, dan qY terhadap perlakuan cekaman kekeringan pada tumbuhan C3 dan C4.
2 Terdapat perbedaan respon anatomi daun terhadap cekaman kekeringan pada tumbuhan C3 dan C4.
3 Peningkatan akumulasi ASA pada tumbuhan C3 dan C4 yang mendapat cekaman kekeringan.
Manfaat Penelitian
Penelitian ini dapat diperoleh data dan informasi tentang respon anatomi daun dan fisiologi tumbuhan C3 dan C4 yang dibutuhkan dalam pengembangan tumbuhan yang toleran terhadap cekaman kekeringan.
5
TINJAUAN PUSTAKA
Peranan Air bagi Pertumbuhan Tanaman
Air merupakan komponen utama tumbuhan, yaitu membentuk 80-90% bobot segar jaringan yang sedang tumbuh aktif. Air sebagai komponen esensial tumbuhan memiliki peranan antara lain: (a) sebagai pelarut, didalamnya terdapat gas, garam, dan zat terlarut lainnya, yang bergerak keluar masuk sel, (b) sebagai pereaksi dalam fotosintesis dan pada berbagai proses hidrolisis, dan (c) air esensial untuk menjaga turgiditas diantaranya dalam pembesaran sel, pembukaan stomata (Griffin et al. 2004).
Pada keadaan normal tumbuhan membutuhkan keseimbangan potensial air antara tanah-akar-daun-atmosfer. Keseimbangan ini berarti gradien potensial air antara bagian-bagian tersebut yang memungkinkan tumbuhan untuk melakukan transpor air dan hara dari akar ke daun. Air akan mengalir dari potensial air tinggi ke potensial air rendah yang dipengaruhi oleh proses transpirasi (Taiz dan Zeiger 2002).
Proses transpirasi di daun terutama terjadi pada siang hari dan dipengaruhi oleh cahaya matahari. Ketika terjadi proses transpirasi pada tumbuhan, maka tekanan turgor akan mengalami penurunan. Penurunan ini menyebabkan potensial air di daun lebih rendah dari pada di akar, sehingga akan mempermudah aliran air di xilem dari akar sampai ke daun. Peningkatan aliran air ini dibutuhkan untuk pertumbuhan sel tanaman. Aliran air ke sel akan mengakibatkan perbesaran dan pemanjangan sel, sehingga sel dapat tumbuh (Kramer dan Boyer 1995).
Pada kondisi lingkungan tertentu tumbuhan dapat mengalami defisit air. Defisit air berarti terjadi penurunan gradien potensial air antara tanah-akar-daun-atmosfer, sehingga laju transpor air dan hara menurun (Taiz dan Zeiger 2002). Penurunan ini akan mengakibatkan gangguan pada pertumbuhan tanaman, terutama pada jaringan yang sedang tumbuh (Kramer dan Boyer 1995). Hal ini biasanya terjadi pada tanah yang kekurangan air, sehingga gradien potensial air di tanah dan akar menurun. Itulah sebabnya tanaman yang tumbuh pada tanah yang kering mengalami hambatan pertumbuhan.
Cekaman Kekeringan pada Tumbuhan
Cekaman kekeringan akan mengakibatkan rendahnya laju penyerapan air oleh akar tanaman. Ketidakseimbangan antara penyerapan air oleh akar dan kehilangan air akibat transpirasi membuat tanaman menjadi layu. Cekaman kekeringan atau drought stress dapat terjadi karena beberapa hal yaitu: (1)
tingginya kecepatan evaporasi yang melebihi persediaan air dari tanah ke akar yang akan mengakibatkan penurunan potensial air, (2) adanya senyawa yang bersifat osmotik, seperti pada tanah salin, yang dapat menurunkan pengambilan air sehingga terjadi penurunan potensial osmosis dan tidak cukupnya pengambilan air oleh tanaman yang diserap dari tanah (Borges 2003).
Cekaman kekeringan dapat menghambat pertumbuhan tanaman. Penghambatan pertumbuhan ini salah satunya dapat dilihat pada perluasan daun. Penurunan luas daun merupakan respon pertama tanaman terhadap kekeringan. Keterbatasan air akan menghambat pemanjangan sel yang secara perlahan akan menghambat pertumbuhan luas daun. Kecilnya luas daun mengakibatkan rendahnya transpirasi, sehingga menurunkan laju suplai air dari akar ke daun. Jika kondisi ini dibiarkan terus menerus, lama kelamaan akan terjadi absisi daun (Taiz dan Zeiger 2002).
Hambatan pertumbuhan pada tanaman bukan saja dari keterbatasan air, namun dapat juga disebabkan persaingan antara tanaman dengan gulma. Echinochloa merupakan kelompok Graminaea yang tergolong sebagai gulma yang bersaing dengan tanaman padi. Hubungan Echinochloa dengan tanaman padi dapat berupa kompetisi yang dapat diartikan sebagai persaingan dua organisme dalam meraih makanan dan tempat hidup yang sama, seperti unsur hara, air, cahaya, bahan ruang tumbuh, dan CO2. Persaingan antara gulma dengan tanaman adalah persaingan inter spesifik. Perbedaan spesies, akan menentukan kemampuan bersaing karena perbedaan fotosintesis, kondisi perakaran dan keadaan morfologinya (Kennedy et al. 1983).
Echinochloa memiliki jalur fotosintesis C4, sedangkan padi tanaman C3. Echinochloa tumbuh saat tanaman padi mulai kekurangan air, sehingga persaingan menjelang panen berpengaruh besar terhadap kualitas hasil produksi
7
padi (Moffet dan McCarthy 1973). Namun Echinochloa memiliki potensi secara genetik lebih tahan terhadap kekeringan dari pada tanaman padi (Kennedy et al. 1983).
Padi tersebar luas di seluruh dunia dan tumbuh dihampir semua belahan bumi yang memiliki cukup air dan suhu udara yang cukup hangat. Padi menyukai tanah yang lembab dan becek. Kebutuhan padi yang tinggi akan air pada sebahagian tahap kehidupannya, sehingga menjadi suatu masalah tersendiri bagi daerah yang memiliki curah hujan yang rendah untuk melakukan penanaman padi. Di beberapa daerah tadah hujan, orang mengembangkan padi gogo, suatu tipe padi lahan kering yang relatif toleran tanpa penggenangan seperti di sawah (Wikipedia 2009). Walaupun padi gogo relatif toleran terhadap kekeringan, namun padi sebagai tanaman C3 masih kurang efisien dalam pemanfaatan air dibanding tumbuhan C4 (Long 1999).
Tumbuhan C3 yang juga dikembangkan di Indonesia adalah caisim (Brassica rapa. L). Caisim bukan tumbuhan asli Indonesia, namun mempunyai kecocokan terhadap iklim, cuaca dan tanahnya, sehingga dapat dikembangkan di Indonesia. Caisim dapat tumbuh baik di tempat yang berhawa panas maupun berhawa dingin. Meskipun kenyataannya hasil yang diperoleh lebih baik di dataran tinggi yang relatif berhawa sejuk.
Caisim tidak tahan terhadap kekeringan. Pada musim kemarau harus disiram dengan teratur. Caisim membutuhkan hawa yang sejuk, sehingga tumbuh lebih cepat jika ditanam pada kondisi yang lembab (Nicole 2006). Akan tetapi caisim juga tidak senang pada air yang tergenang. Caisim cocok ditanam pada akhir musim penghujan. Manfaat caisim yaitu digunakan sebagai sayuran yang biasa dicampur dengan bakso. Caisim mempunyai tangkai daun yang panjang, langsing berwarna putih kehijaun. Selain itu caisim memiliki rasa renyah, segar dengan sedikit rasa pahit (Izzul 2009).
Selain caisim, salah satu tumbuhan yang dimanfaatkan juga sebagai sayuran adalah bayam (Amaranthus caudatus. L.). Bayam sebagai sayuran hanya umum dikenal di Asia timur dan Asia tenggara, sehingga disebut Chinese amaranth. Bayam merupakan sayuran daun yang bergizi tinggi dan digemari oleh semua lapisan masyarakat.
Bayam membutuhkan ketersediaan air di dalam tanah. Bayam termasuk tumbuhan yang memerlukan cukup banyak air untuk pertumbuhannya. Penanaman bayam dianjurkan pada awal musim hujan atau akhir musim kemarau. Bayam menyukai iklim hangat dan intensitas cahaya yang relatif tinggi. Bayam relatif tahan terhadap pengcahayaan langsung, karena merupakan tumbuhan C4. Batang berair kurang berkayu, daun bertangkai berwarna hijau merah atau hijau keputih-putihan (Stallknecht dan Schulz-Schaeffer 1993).
Tanaman bayam memerlukan cahaya matahari penuh. Kebutuhan akan sinar matahari untuk tanaman bayam cukup besar. Pada tempat yang ternaungi, pertumbuhan bayam menjadi kurus dan meninggi akibat kurang mendapat sinar matahari penuh. Suhu udara yang sesuai berkisar antara 16-20 oC kelembaban udara yang cocok untuk tanaman bayam antara 40-60% (Costea et al. 2006).
Efek Kekeringan terhadap Fotosintesis
Penurunan potensial air tanaman pada kondisi kekeringan menyebabkan terjadinya penurunan laju fotosintesis. Hal ini terjadi karena adanya hambatan yang ditimbulkan oleh penutupan stomata (stomatal limitation) maupun hambatan akibat penurunan proses biokimia dalam tumbuhan (non-stomatal limitation) (Kalefetoglu dan Ekmekci 2005).
Hambatan stomata
Pada kondisi cekaman kekeringan ringan (moderat) tumbuhan akan segera mengurangi pembukaan stomata. Penurunan pembukaan stomata ini dilakukan untuk meminimalisir kehilangan air yang berlebihan. Dengan terjadinya penurunan pembukaan stomata, maka konsentrasi CO2 daun akan menurun sehingga dengan sendirinya proses fotosintesis juga menurun (Flexas dan Medrano 2002).
Comstock (2002) menambahkan bahwa pengaturan konduktan stomata berkaitan dengan sinyal hidrolik (hydraulic signaling) dan sinyal kimia (chemical
signaling). Ketika tumbuhan mengalami kondisi cekaman kekeringan, terjadi
9
potensial air antara akar dan tanah, sehingga laju penyerapan air oleh akar menurun. Penurunan laju penyerapan air ini dan ditambah dengan peningkatan transpirasi akibat radiasi matahari membuat tanaman mengalami kekurangan air (Blake dan Li 2003). Gradien potensial air akan menimbulkan hydraulic signaling terhadap cekaman kekeringan sehingga stomata menutup (Comstock 2002).
Peningkatan konsentrasi asam absisat (ABA) pada akar tumbuhan merupakan sinyal kimia yang akan ditranspor ke daun saat tumbuhan mengalami kekurangan air dari tanah. Ketika cekaman kekeringan terjadi peningkatan sintesis ABA pada akar tanaman sebagai respon terhadap keadaan defisit air tanah. Peningkatan ABA ini terkait dengan status air di akar tumbuhan. Proses selanjutnya ABA akan ditranspor dari akar melalui xilem menuju ke daun. Selain di akar, tanaman juga mensintesis ABA di daun, sehingga terjadi peningkatan ABA di daun (Srivastava 2002). Pada kondisi ini protein channel Kout di sel penjaga daun akan diaktifkan oleh keberadaan ABA dan protein channel Kin akan dihambat oleh ABA, sehingga banyak ion K+ yang keluar dari sel penjaga. Kondisi ini akan menurunkan potensial osmotik sel penjaga sehingga stomata menutup (Roberts dan Snowman 2000). Proses isyarat oleh ABA dari akar ke daun ini dikenal dengan istilah long-distance chemical signaling (Comstock 2002).
Kehilangan ion K+ pada sel penjaga dapat disebabkan oleh penurunan kandungan air daun, dan ABA memegang peranan penting dalam proses ini. ABA disintesis secara lambat terus menerus di sel mesofil dan terakumulasi di kloroplas. Ketika mesofil terhidrasi maka ada dua hal yang akan terjadi yaitu:
1 Sebagian ABA yang disimpan di kloroplas akan dilepas ke apoplas sel mesofil. Redistribusi ABA ini bergantung kepada gradien pH daun, keasaman bahan molekul ABA dan permeabilitas membran sel. Redistribusi ABA memungkinkan aliran transpirasi untuk membawa sebagian ABA ke sel penjaga (Trejo et al. 1995)
2 ABA disintesis dengan kecepatan tinggi di akar sehingga mengakibatkan lebih banyak ABA yang diakumulasi pada apoplas daun (Taiz dan Zeiger 2002).
Hasil penelitian pada Arabidopsis diperoleh bahwa peningkatan konsentrasi ABA seiring dengan penurunan konduktan stomata dengan semakin lamanya kondisi kekeringan (Desikan et al. 2003). Bingham dan McCabe (2006) menambahkan bahwa ABA merupakan faktor yang mengatur konduktansi stomata.
Hambatan non-stomata
Hambatan non-stomata pada fotosintesis berkaitan dengan proses metabolik yaitu pada proses transpor elektron fotosintesis. Jika kondisi kekeringan terus terjadi maka tanaman akan mengalami penurunan proses metabolik, karena berkurangnya difusi CO2ke kloroplas (Chaves dan Oliveira 2004) yang nantinya akan mengarah kepada penurunan kandungan ribulosa 1,5-biphosphat (RuBP) pada proses fotosintesis (Flexas dan Medrano 2002). Vu et al. (1997) menambahkan bahwa peningkatan cekaman kekeringan pada tumbuhan C3 akan menurunkan total aktivitas rubisko.
Cekaman kekeringan akan menginduksi terjadinya fotoinhibisi, selanjutnya akan menurunkan kandungan protein D1 pada fotosistem II (PSII) (Pastenes et al. 2004). PS II sebagai sistem penangkap cahaya (light harvesting
system) memiliki dua fungsi esensial yaitu; (1) menangkap cahaya pada proses
fotosintesis, (2) melepas energi tereksitasi apabila terjadi kelebihan energi. Berdasarkan hal tersebut, PS II akan merespon isyarat eksternal dari lingkungan. Hal ini berkaitan dengan peningkatan gradien pH (∆pH) di trans-membran tilakoid. Peningkatan ∆pH di trans-membran tilakoid ini berfungsi sebagai kontrol balik terhadap kelebihan transpor elektron fotosintesis. Proses ini dikenal dengan
non-photochemical quenching (NPQ) yang bergantung pada siklus xanthophyll
dan protein PsbS pada fotosistem (Horton dan Ruban 2004), sebagai mekanisme pertahanan tumbuhan terhadap fotoinhibisi (Taiz dan Zeiger 2002).
Fotosintesis pada tumbuhan C4 melibatkan dua kumpulan sel yang ditunjukkan dengan adanya sel-sel mesofil (Siklus C4) dan sel-sel seludang pembuluh (siklus Calvin). Jalur C4 menggunakan enzim PEP karboksilase terutama pengikatan awal CO2, dan karbon yang terikat mulanya terbentuk melalui berbagai asam berkarbon empat seperti asam oksalo asetat (AOA), malat,
11
dan aspartat, kemudian CO2 akhirnya terlepas dan diikat kembali oleh enzim RuBP karboksilase (Sugiharto et al. 2002). Tumbuhan yang mempunyai jalur ini pada umumnya berbeda secara anatomi dengan tumbuhan C3 yaitu memiliki anatomi ”Kranz”, dengan satu lapisan yang terikat baik di sekitar pembuluh vaskuler dan kloroplas terpusat di dalam sel-sel mesofil yang melingkar di luar lapisan itu sendiri.
Cekaman Oksidatif
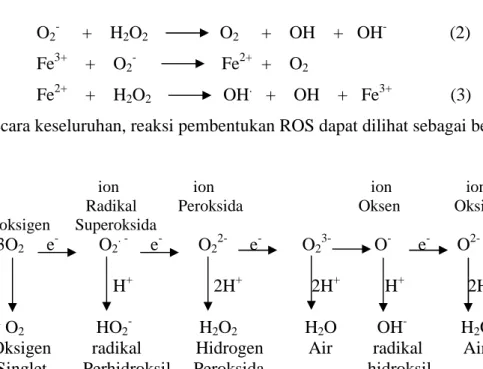
Perubahan lingkungan yang tidak menguntungkan termasuk kekeringan pada tumbuhan, dapat menyebabkan terbentuknya senyawa oksidatif. Jika kondisi ini dibiarkan, tumbuhan akan mengalami cekaman oksidatif. Pembentukan senyawa oksidatif pada tumbuhan diawali dengan reduksi oksigen pada membran sel kloroplas membentuk superoksida (O2-). Jika hal ini terjadi akan terbentuk spesies oksigen reaktif (ROS) yang meliputi molekul-molekul seperti: superoksida (O2-), singlet oksigen (.O2), radikal hidroksil (OH-) dan hidrogen peroksida (H2O2) (Gambar 1) (Blokhina et al. 2003). Radikal bebas merupakan molekul yang sangat reaktif, karena memiliki elektron yang tidak berpasangan dan dapat mengakibatkan kerusakan pada membran sel (Mc Kersie dan Leshem 1994). Contoh reaksi tersebut adalah:
2 O2 + 2 Fdred 2 O2- + 2 Fdox
Berikut tahap mekanisme pembentukan radikal hidroksil melalui keberadaan ion metal besi:
(1) Molekul O2- yang reaktif akan berusaha melepaskan elektron bebasnya dan bereaksi dengan H+membentuk H2O2. (2) Proses selanjutnya hidrogen peroksida dan superoksida bereaksi membentuk molekul yang sangat reaktif yaitu radikal hidrosil. (3) Selain itu radikal hidroksil bisa dibentuk dengan keberadaan ion besi melalui reaksi fenton. Keberadaan besi atau ion metal lainnya dapat meningkatkan kerusakan oksidatif ( Mc Kersie dan Leshem 1994). Berikut ini adalah skema pembentukan radikal bebas:
O2- + H2O2 O2 + OH + OH- (2)
Fe3+ + O2- Fe2+ + O2
Fe2+ + H2O2 OH. + OH + Fe3+ (3)
Secara keseluruhan, reaksi pembentukan ROS dapat dilihat sebagai berikut:
ion ion ion ion
Radikal Peroksida Oksen Oksida
Dioksigen Superoksida
3O2 e- O2. - e- O22- e- O23- O- e- O
2-H+ 2H+ 2H+ H+ 2H+
1
O2 HO2- H2O2 H2O OH- H2O
Oksigen radikal Hidrogen Air radikal Air
Singlet Perhidroksil Peroksida hidroksil
Gambar 1 Mekanisme pembentukan ROS (Apel dan Hirt 2004)
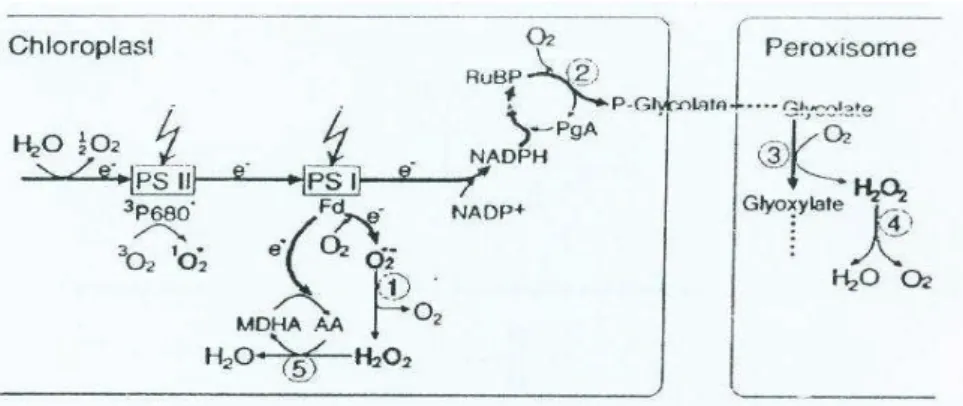
Menurut Mc Kersie dan Leshem (1994) ada beberapa peluang terjadinya pembentukan ROS pada proses fotosintesis.
1 Pada PS (Photosystem) I dapat terjadi reduksi oksigen melalui reaksi Mehler. Reduksi oksigen ini terjadi pada transport elektron feredoksin, reduksi ini terjadi ketika NADP+ terbatas yang salah satunya disebabkan oleh berkurangnya penggunaannya NADPH untuk fiksasi CO2 pada siklus Calvin.
2 Pada PS II terjadi oksidasi dengan mentransfer empat single elektron dari H2O membentuk triplet atau ground state oksigen. Selain itu alkohol tertentu juga bisa direduksi oleh PS II.
3 Fotoaktifasi dari kloroplas secara normal mentransfer energi ke pusat reaksi PS, namun pada kondisi yang tidak menguntungkan klorofil akan menangkap energi cahaya pada sistem transpor elektron, sehingga dapat mengeksitasi oksigen dari bentuk triplet ke bentuk singlet (Gambar 2). 4 Fotorespirasi merupakan lintasan yang paling mudah untuk menghasilkan
proses oksigenasi. Walaupun tidak terjadi pengaktifan oksigen di dalam kloroplas, namun terjadi metabolisme glikolat lebih lanjut di dalam peroksisom (Gambar 2).
13
Gambar 2 Produksi ROS pada transpor elektron fotosintesis pada kondisi cahaya tinggi (Apel dan Hirt 2004).
Peningkatan ROS dapat menimbulkan kerusakan pada komponen membran sel. Komponen membran sel yang mengalami kerusakan tersebut antara lain: lipid (peroksidasi dari asam lemak tidak jenuh pada membran), protein (denaturasi), karbohidrat, dan asam nukleat. Kerusakan membran ini dapat dilihat dari perubahan komposisi dan kandungan lipid, pengaktifan lipid peroksidase dan meningkatnya kebocoran membran (Blokhina et al. 2003).
Penyelamatan tumbuhan dari ROS oleh asam askorbat
Pembentukan ROS akan meningkat ketika kondisi lingkungan tidak menguntungkan terus terjadi, namun tanaman mempunyai suatu mekanisme penyelamatan terhadap kondisi tersebut. Mekanisme penyelamatan ini antara lain melalui mekanisme antioksidan baik yang bersifat enzimatik maupun non-enzimatik untuk menghindari kerusakan yang terjadi akibat cekaman oksidatif. Mekanisme pembentukan antioksidan non-enzimatik sebagai antioksidasi dengan menghasilkan senyawa-senyawa antioksidan seperti: asam askorbat (ASA), glutation (GSH), termasuk juga tokopherol, flavonoid, alkaloid dan karotenoid (Apel dan Hirt 2004).
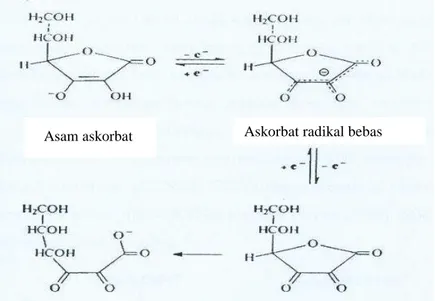
ASA atau vitamin C merupakan asam organik dengan kemampuannya sebagai antioksidan. ASA dapat larut dalam air dan sangat mudah dioksdasi yaitu sebagai senyawa reduktan (Gambar 3). ASA akan rusak ketika ditempatkan pada
cahaya atau panas yang akan berubah dalam bentuk teroksidasi yaitu asam dehidroaskorbat (Karyotou dan Donaldson 2004).
Gambar 3 Metabolisme redoks asam askorbat (Wikipedia 2008).
Asam askorbat mempunyai banyak fungsi untuk tumbuhan (Noctor dan Foyer 1998). Asam askorbat juga digunakan sebagai ko-faktor untuk violaxanthin de-epoksidase pada siklus xanthophyll. Proses ini dilibatkan dalam perlindungan pelepasan penyerapan cahaya dalam bentuk panas dan bisa diukur sebagai NPQ dari klorofil flouressen (Sonja et al. 2001). ASA sebagai senyawa antioksidan dapat berinteraksi dengan membran plasma dan mendonorkan elektronnya ke radikal α-tocopheroksil yang dapat membantu melindungi membran plasma dari peroksidasi (Asada 2006).
Mekanisme Toleransi terhadap Cekaman Kekeringan
Berdasarkan kemampuan genetiknya, daya adaptasi tumbuhan terhadap cekaman lingkungan berbeda-beda. Jones et al. (1981) mengklasifikasikan resistensi tanaman terhadap kekeringan berdasarkan beberapa mekanisme:
1 Melepaskan diri dari cekaman kekeringan (Drought escape) yaitu kemampuan Asam askorbat Askorbat radikal bebas
15
tanaman menyelesaikan siklus hidupnya sebelum mengalami defisit air yang parah. Mekanisme ini ditunjukkan dengan perkembangan sistem pembungaan yang cepat dan perkembangan plastisitas jaringannya.
2 Toleransi dengan potensial air jaringan yang tinggi, yaitu kemampuan tanaman tetap menjaga potensial jaringan dengan meningkatkan penyerapan air atau menekan kehilangan air. Pada mekanisme ini biasanya tanaman mempunyai kemampuan untuk meningkatkan sistem perakaran dan konduktitivitas hidrolitik atau kemampuan untuk menurunkan hantaran epidermis dengan regulasi stomata, pengurangan absorbsi radiasi dengan pembentukan lapisan lilin, bulu yang tebal dan penurunan permukaan evapotranspirasi melalui penyempitan daun serta pengguguran daun tua.
3 Toleransi dengan potensial air jaringan yang rendah, yaitu kemampuan tumbuhan untuk menjaga tekanan turgor sel dengan menurunkan potensial airnya melalui akumulasi solut seperti gula, asam amino dan sebagainya atau dengan meningkatkan elastisitas sel.
Ada dua pendekatan utama yang sering digunakan untuk melihat kemampuan tumbuhan dalam menghadapi cekaman kekeringan. Pendekatan pertama adalah dengan melihat kemampuan pengambilan air secara maksimal dengan perluasan dan kedalaman sistem perakaran. Pendekatan kedua dengan melihat kemampuan tumbuhan mempertahankan turgor melalui penurunan potensial osmotik, mengingat tekanan turgor mutlak diperlukan bagi jaringan untuk menjaga tingkat aktivitas fisiologi (Cortes dan Sinclair 1986)
Perubahan struktur tumbuhan yang terjadi sebagai respon terhadap cekaman lingkungan berkaitan dengan sifat toleransinya. Perubahan struktur yang mengarah kepada bentuk yang menghindarkan tumbuhan dari bahaya cekaman yang banyak terjadi pada beberapa tumbuhan, misalnya perkembangan sistem perakaran, perubahan bentuk daun mekanisme penutupan stomata, dan sebagainya.
Pengaruh Kekeringan terhadap Anatomi Daun
Pengamatan daun dapat didasarkan atas fungsinya sebagai penerima cahaya dan salah satu tempat berlangsungnya fotosintesis. Selain luas daun
sebagai parameter utama, ketebalan daun juga menentukan kemampuan absorbsi cahaya yang juga menarik untuk diamati, dan dapat dinyatakan dalam bentuk nisbah berat berat per luas daun, atau secara anatomi dengan mengukur ketebalan sayatan melintang daun. Parameter ini cukup sensitif terhadap perubahan lingkungan seperti kekurangan air ( Filho dan Paiva 2006).
Lamina daun merupakan bagian utama yang mengandung jaringan fotosintesis, sedang tangkai daun yang berfungsi menopang lamina daun memiliki jaringan fotosintesis yang relatif kecil. Pada lamina daun dari tumbuhan dikotil terdapat sel mesofil yang terdifrensiasi menjadi jaringan palisade dan bunga karang. Sedangkan pada tumbuhan monokotil mempunyai lamina daun yang bagian adaksial terdapat sel bulliform yang berfungsi menutup dan membuka helai daun bila mendapat gangguan lingkungan seperti intensitas cahaya yang tinggi maupun cekaman kekeringan (Sutrian 1992).
Menurut Radwan (2007) terjadinya penurunan laju fotosintesis tersebut berhubungan dengan kombinasi beberapa proses, yaitu: penutupan stomata, yang secara hidroaktif mengurangi suplai CO2 ke dalam daun, dehidrasi kutikula, dinding epidermis, dan membran sel mengurangi permeabilitasnya terhadap CO2. Selain itu, bertambahnya tahanan sel mesofil terhadap pertukaran gas dan menurunnya efisiensi sistem fotosintesis berkenaan dengan proses-proses biokimia dan aktivitas enzim dalam sitoplasma, terutama dalam fotosintesis terdapat proses hidrolisis yang memerlukan air. Air sebagai komponen utama tumbuhan dibutuhkan untuk berbagai proses metabolisme tumbuhan untuk pertumbuhan dan perkembangan tumbuhan termasuk transportasi hara dan mineral. Pada kondisi ini tumbuhan telah mampu kembali menjaga keseimbangan gradien potensial osmotik antara media akar dan tajuk (Marschner 1995). Cekaman kekeringan selain menghambat laju fotosintesis juga menekan akumulasi N dalam tumbuhan.
BAHAN DAN METODE
Waktu dan Tempat
Penelitian dimulai dari bulan Juni 2008 hingga Maret 2009 dan, dilaksanakan di rumah kaca kebun percobaan Cikabayan IPB, Laboratorium Fisiologi Tumbuhan, dan di Laboratorium Anatomi dan Morfologi Tumbuhan, Departemen Biologi, Fakultas MIPA, Institut Pertanian Bogor .
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini antara lain: tanah ultisol Cikabayan, pasir, pupuk NPK, TSP dan pupuk kandang. Tumbuhan C3: benih padi gogo (Oryza sativa L.) varietas Situbagendit, caisim (Brassica rapa L.), tumbuhan C4: Echinochloa (Echinochloa crussgalli L.), dan bayam (Amaranthus caudatus), nitrogen cair, kantong kertas, aluminium foil, kertas saring, bahan-bahan untuk pengukuran parameter fotosintesis, sediaan mikroskopis, dan bahan-bahan untuk analisis kandungan asam askorbat.
Alat-alat yang digunakan untuk keperluan penanaman adalah rumah kaca, dan timbangan duduk kapasitas 25 kg, rol meter. Alat-alat laboratorium yang digunakan adalah: timbangan analitik, oven, cork borer, tabung reaksi, botol piol, mortar, masker, sarung tangan, corong, biuret 50 ml, gelas ukur (250 ml dan 500 ml), mikroskop cahaya (Nikon SE), dan mikrotom putar (Yamato RV-240),
Photosynthetic chlorophyl flourometer (Qubit system model ACT 1), tabung nitrogen cair, cool box, dan freezer -30oC.
Rancangan Percobaan
Percobaan dirancang dan dilaksanakan menggunakan Rancangan Acak Lengkap (RAL) dengan rancangan perlakuan faktorial yang terdiri dari dua faktor. Faktor pertama adalah jenis tanaman yang meliputi 4 taraf yaitu:
18
J2 : Echinochloa (E. crussgalli L.) J3 : Caisim (B. rapa L.)
J4 : Bayam (A. caudatus L.)
Faktor kedua adalah perlakuan cekaman yang meliputi 2 taraf yaitu: K0 : Disiram setiap hari (Kontrol)
K1 : Penundaan penyiraman sampai layu berat (Kekeringan)
Ada 24 unit uji ( 8 kombinasi perlakuan yang masing-masing dengan 3 ulangan).
Untuk mengetahui pengaruh dari seluruh perlakuan digunakan Analysis of
Variance (ANOVA), jika berbeda nyata dilakukan uji lanjut Tukey pada taraf 5%
dengan menggunakan program SPSS versi 15.
Pelaksanaan Penyiapan media tanam
Pada percobaan ini digunakan empat jenis tumbuhan. Padi gogo varietas situbagendit diperoleh dari Balai Benih Ciomas, Bogor, Echinochloa dari P.T. Syngenta Cikampek, caisim dan bayam dari produksi P.T. Sang Hyang Seri (Persero).
Tanah diambil dari kebun percobaan Cikabayan pada lapisan olah 0-25 cm, kemudian dikering-udarakan. Setelah itu dihaluskan dan disaring menggunakan saringan dengan diameter lubang 5 mm. Polibag diisi tanah campuran pasir perbandingan 1:1 sebanyak 6 kg yang telah diberi pupuk kandang 600 g per polibag. Sebelum ditanami, tanah di analisis sifat fisik dan kimianya untuk melihat kadar air tanah pada keadaan kapasitas lapang untuk menentukan jumlah air yang harus ditambahkan pada media dan titik layu permanen serta kandungan hara dan pH tanah (Lampiran 1).
Penanaman dan pemeliharaan
Benih ditanam di polibag yang telah disiapkan, sebanyak 3-5 benih/polibag untuk setiap perlakuan. Pada saat berumur seminggu, semua tanaman percobaan dipupuk dengan NPK 2,5 g/polibag dan TSP 1,12 g/polibag. Setelah padi gogo dan Echinochloa berumur 2 minggu, sedangkan caisim dan bayam berumur 1 minggu, maka tanaman dijarangkan hingga terdapat 2 tanaman per polibag. Tanaman disiram setiap hari sebelum diberi perlakuan cekaman kekeringan.
Pemberian perlakuan
Keempat jenis tumbuhan diberi perlakuan, yaitu disiram setiap hari (K0) dan tanpa disiram (K1). Pemberian perlakuan tanpa disiram sampai tanaman menunjukkan gejala kritis (layu berat). Gejala layu berat terlihat setelah diberi kondisi gelap pada tumbuhan, akan tetapi pada jam enam pagi masih tetap layu. Kontrol setiap tanaman tetap disiram setiap hari. Media tanam ditutup mulsa, agar penguapan langsung dari media dapat diminimalisir.
Pengambilan Data
Pengukuran KAM dan KAR
Pengukuran terhadap status air yang dilakukan meliputi: kadar air media tanam (KAM), dan kadar air relatif daun (KAR). KAM dan KAR diukur pada 0, 4, 8, 12 hari setelah perlakuan (HSP) untuk padi gogo, caisim dan bayam, sedangkan untuk Echinochloa diukur pada 0, 4, 8, 12 dan 14 HSP serta 2 hari setelah penyiraman kembali (recovery).
KAM diukur dengan cara mengambil sampel tanah dari bagian atas, tengah dan bawah polibag. Sampel tanah ditimbang untuk memperoleh berat basah (BB), kemudian dioven pada suhu 800C selama 2x24 jam untuk mendapatkan berat kering (BK). KAM diperoleh dengan rumus:
% 100 x BB BK -BB KAM
Kadar Air Relatif daun diukur dengan mengambil sampel daun posisi yang ketiga pada tumbuhan dengan menggunakan cork borer diameter 1 cm. Sampel daun yang diperoleh ditimbang untuk mendapatkan berat segar (BS), kemudian dilakukan hidrasi selama 24 jam dalam botol kecil untuk mendapatkan berat jenuh (BJ). Sampel selanjutnya di oven pada suhu 800C selama 2x24 jam untuk memperoleh berat kering (BK) setelah sebelumnya didinginkan dalam desikator (Barr and Weatherley 1962). KAR didapat dihitung dengan rumus:
% 100 x BK -BJ BK -BB KAR
20
Pengukuran Parameter Fotosintesis
Pengukuran parameter fotosintesis tanaman dilakukan pada hari ke 0, 4, 8, 12 (padi caisim, dan bayam) dan 0, 4, 8, 12, 14 (echinochloa) dan 2 hari setelah penyiraman kembali. Parameter fotosintesis yang diamati meliputi: efisiensi maksimum fotosintesis (Fv/Fm), energi pelepasan fotokimia (qP), energi pelepasan non-fotokimia (qN), dan hasil quantum fotosintesis (qY). Pengukuran dilakukan dengan menggunakan alat Photosynthetic Chlorophyl Flourescence (Qubit system tipe ACT 1). Daun pada posisi ke-3 pada tanaman diletakkan pada Kuvet, kemudian daun diadaptasikan pada keadaan gelap dengan cara ditutup kain hitam selama lebih kurang 20 menit. Kemudian saturating flash dinyalakan, dan
fluorescence akan meningkat dari nilai ground state (Fo) ke nilai maksimum (Fm).
Data yang diperoleh digunakan untuk mengukur efisiensi quantum maksimum fotosintesis dengan rumus: Fv/Fm = (Fm-Fo)/Fm. Selanjutnya Actinic light dinyalakan, pada kondisi ini fluorescence yield akan meningkat dari nilai steady
state (Ft). Saturating flash dinyalakan dengan interval 20 detik dan akan dilakukan
pengukuran fluorescence yield pada kondisi ada cahaya (Fm’) yang ditentukan setelah nilainya stabil. Pengukuran fluorescence yield akan diperoleh nilai
photochemical quenching dengan rumus: qP = (Fm’-Ft)/(Fm’-Fo), non photochemical quenching, NPQ = (Fm-Fm’)/Fm’ dan quantum Yield dari transfer elektron pada PSII, (PSII)=(Fm’-Ft)/Fm’
.
Analisis Kandungan Asam Askorbat (ASA) (Reiss 1993)
Kandungan ASA diukur dengan menggunakan metode titrasi. Sampel daun ( 5 g) digerus dalam 10 ml asam metafosforik 5%, hasil gerusan disaring dengan filter Wathman no.1. Kemudian filtrat yang diperoleh dititrasi dengan dichlorophenol-indolphenol (DCIP) 0,8 g l-1. Titrasi dihentikan ketika filtrat tepat berwarna merah muda. Standar asam askorbat diketahui dengan mentitrasi asam askorbat murni yaitu: 1 ml larutan yang mengandung asam askorbat (4,0 g l-1) dan 9 ml asam metaphosporik 5% dititrasi dengan dichlorophenol-indolphenol (DCIP) 0,8 g l-1. Kandungan ASA diperoleh dengan rumus sebagai berikut :
a. Untuk standarisasi larutan ASA ( 4 mg ASA murni ekuivalen dengan 1 ml yang dititrasi DCIP). DCIP sebagai indikator warna titrasi.
ASA (mg) 4 mg ASA murni
=
1 ml DCIP Volume DCIP yang dititrasi
b. Untuk mengetahui kandungan ASA daun tanaman (ASA per100 gram jaringan daun):
mg ASA per aliquot x (total volume ekstrak (ml)/ volume aliquot(ml)) x (100 g/berat segar)
Pengamatan Pertumbuhan
Pengamatan pertumbuhan tanaman setelah perlakuan kekeringan yang meliputi: tinggi tanaman, panjang akar, luas daun.
Pengambilan data tinggi tanaman dan luas daun dilakukan pada 0, 3, 6, 9, 12, 14 HSP dan 2 hari setelah penyiraman. Sedangkan panjang akar diukur setelah 12 HSP pada tumbuhan padi gogo, caisim dan bayam, serta 14 HSP pada Echinochloa. Tinggi tajuk diukur mulai dari permukaan tanah sampai titik tumbuh. Panjang akar diukur mulai dari pangkal akar hingga ujung akar yang paling panjang.
Pengukuran panjang dan lebar daun dipilih posisi daun yang kedua, ketiga dan keempat disetiap ulangan percobaan untuk menghitung luas daun (LD). LD dihitung menggunakan ukuran panjang daun (P) dan lebar daun (L) mengikuti metode Sitompul dan Guritno (1995), dengan rumus:
LD = P x L x k (konstanta kalibrasi = 0,74)
Produksi Bobot Kering Tanaman
Pengukuran bahan kering tanaman meliputi; bobot kering tajuk, bobot kering akar, dan bobot kering biji. Penimbangan bobot kering tajuk dan akar dilakukan pada saat akhir perlakuan cekaman kekeringan. Bobot kering akar dan tajuk ditimbang secara terpisah setelah dioven 800C selama 2x24 jam. Bobot kering biji saat panen diperoleh dengan cara menjemur biji di rumah kaca selama kurang lebih 2 minggu, lalu ditimbang.
22
Sediaan miroskopis
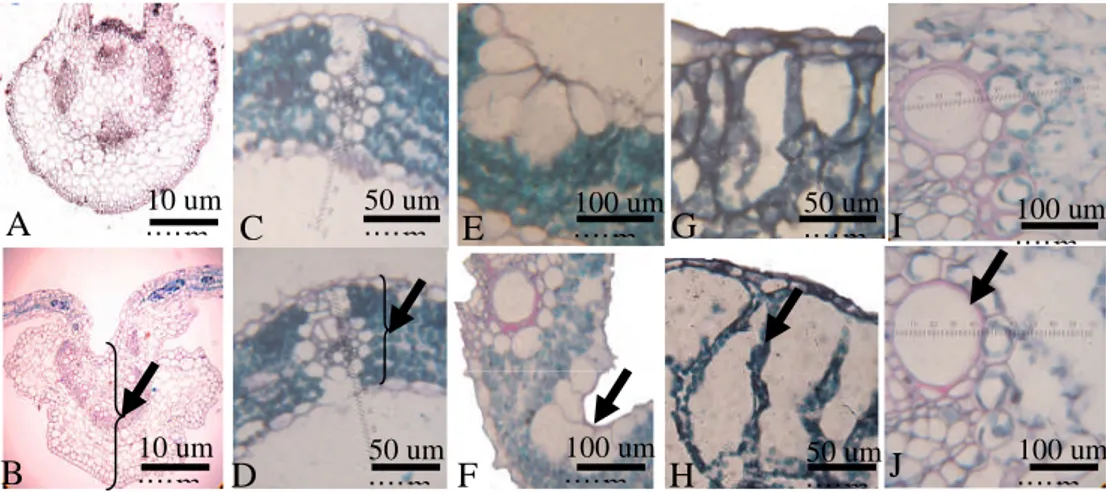
Sampel daun untuk sayatan mikroskopis diambil pada 11 HSP kemudian langsung dimasukkan ke dalam larutan fiksatif FAA (formaldehid 37%: asam asetat glasial: alkohol 70%= 5:5:90) sebagai bahan pemfiksasi. Irisan transversal dibuat menurut metode parafin dengan campuran larutan n-butanol –alkohol-akuades sebagai dehidrannya (Nakamura 1995). Daun yang telah difiksasi selama 24 jam di dalam larutan FAA dimasukkan ke dalam seri larutan dehidrasi ke-3 sampai ke-7 (Lampiran 1), dengan masing-masing tahap perendaman selama 1 jam. Infiltrasi parafin dilakukan secara bertahap, selanjutnya blok parafin yang terbentuk diiris setebal 10 m kemudian pita diletakkan pada gelas objek. Sebelum pita parafin diwarnai terlebih dahulu dicelupkan ke dalam larutan xilol selama 5 menit. Sampel yang telah dicuci dengan xilol lalu diwarnai dengan pewarnaan ganda safranin 2% dan fast green 0,5%, kemudian ditetesi dengan canada balsam dan ditutup dengan gelas penutup. Preparat diamati di bawah mikroskop cahaya pada 6 bidang dengan perbesaran 100, 400 dan 1000 kali. Parameter pengamatan meliputi; tebal helai daun, epidermis atas, epidermis bawah, sel bulliform, tebal jaringan palisade, tebal jaringan bunga karang, serta diameter xilem dan floem.
HASIL DAN PEMBAHASAN
Kadar Air Media (KAM) dan Kadar Air Relatif (KAR) Daun
Kebutuhan air pada tumbuhan C3 (padi gogo dan caisim) dan C4 (Echnochloa dan bayam) dapat dipenuhi melalui tanah dengan jalan penyerapan oleh akar, walaupun sebagian besar air akan dilepas ke udara dalam proses transpirasi. Besarnya penyerapan air oleh tumbuhan dalam pot, ditandai dengan penurunan kadar air media (KAM) tanam. Kandungan air pada tumbuhan akan dipengaruhi oleh faktor lingkungan, dan salah satunya adalah kadar air tanah itu sendiri.
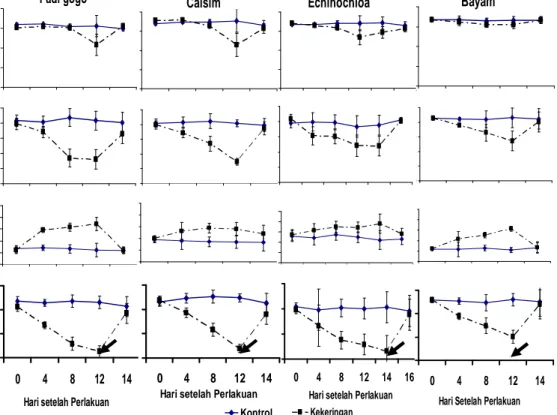
Perlakuan cekaman kekeringan dengan menunda penyiraman dapat menurunkan KAM tumbuhan (Gambar 4 atas). Penurunan KAM terus terjadi sampai akhir perlakuan kekeringan yaitu 12 hari setelah perlakuan (HSP) pada padi gogo, caisim, dan bayam, serta 14 HSP pada Echinochloa.
Gambar 4 Nilai rata-rata Kadar Air Media (KAM) (%) (Gambar atas), dan nilai rata-rata Kadar Air relatif (KAR)(%) (Gambar bawah) padi gogo, cesim dan bayam pada 0-12 HSP dan 0-14 HSP (Echinochloa) dan recovery. Tanda panah menunjukkan titik rewatering.
Umumnya tumbuhan uji sudah layu berat pada 12 HSP yang ditunjukkan dengan nilai KAM secara berturut-turut pada padi gogo sebesar 15,93%, caisim sebesar 15,93%, dan bayam sebesar 14,13%. Nilai KAM pada Echinochloa pada 12 HSP sebesar 14,13%, namun secara morfologi tumbuhan Echinochloa belum
Padi gogo 0 10 20 30 40 0 4 8 12 Recovery K A M (% )
Caisim Echinochloa Bayam
0 20 40 60 80 100 0 4 8 12 14 Hari Setelah Perlakuan
K A R (% ) 0 4 8 12 14 Hari Setelah Perlakuan
Kontrol
0 4 8 12 14 16 Hari Setelah Perlakuan
Kekeringan
0 4 8 12 14 Hari Setelah Perlakuan
24
nampak layu berat, sehingga perlakuan kekeringan dilanjutkan hingga 14 HSK (Gambar 5C). Penurunan KAM secara nyata terjadi antara perlakuan kekeringan dengan kontrol, namun terhadap jenis tumbuhan yang diamati tidak berbeda nyata (P>0,05). Walaupun demikian KAM meningkat lagi setelah dilakukan penyiraman kembali (Gambar 4 atas).
Penurunan KAM dapat mengakibatkan terjadinya ketidakseimbangan aliran air pada tumbuhan, sehingga terjadi defisit air dan gangguan fungsi fisiologis di dalam sel tumbuhan. Aliran air ini terkait dengan potensial air, potensial osmotik dan gradien tekanan. Ketika kandungan air tanah menurun, konduktivitas hidrolik tanah juga akan menurun drastis. Penurunan ini terjadi karena adanya penguapan akibat transpirasi. Pada tanah yang sangat kering, potensial air media akan menurun di bawah titik layu permanen. Pada kondisi ini berarti potensial air tanah lebih rendah dari atau sama dengan potensial osmotik tumbuhan, sehingga tumbuhan tidak mampu mempertahankan tekanan turgor walaupun kehilangan air lewat transpirasi berhenti (Tang et al. 2002).
Aliran air di tanah terjadi dalam bentuk aliran massa yang terjadi karena adanya gradien tekanan. Air ini kemudian akan diserap oleh tumbuhan secara osmosis melalui membran sel akar. Penyerapan air oleh akar terjadi karena adanya gradien potensial osmotik ataupun gradien potensial air antara tumbuhan dan tanah (Taiz dan Zeiger 2002). Perakaran yang lebih dalam akan meningkatkan ketersediaan air dari proliferasi akar (berat akar persatuan volume tanah), meningkatkan pengambilan air dari suatu satuan volume tanah sebelum terjadi pelayuan permanen (Sharma dan Flotcher 2002).
Gambar 5 Morfologi tumbuhan percobaan pada hari 12 HSK. (A) padi gogo, (B) caisim, (C) Echinochloa, dan (D) bayam . Tanda panah menunjukkan cekaman kekeringan.
Penurunan KAM akibat perlakuan cekaman kekeringan menyebabkan penurunan kadar air relatif (KAR) daun tumbuhan, walaupun pola penurunannya agak berbeda (Gambar 4 bawah). KAM menurun sejak awal kekeringan, namun penurunan KAR daun baru terlihat pada hari ke-8, walaupun tidak berbeda nyata (p >0,05) antara perlakuan cekaman kekeringan dan kontrol. Penurunan ini terus terjadi sampai hari terakhir perlakuan hari ke-12 untuk padi gogo, caisim, dan bayam serta 14 HSP untuk echinochloa. Nilai KAR terendah daun pada padi gogo, caisim, dan bayam berturut-turut sebesar 56,68%, 53,97%, dan 57,97%, sedangkan echinochloa sebesar 63,25%.
Secara umum hari ke-12 setelah perlakuan kekeringan tumbuhan mengalami penurunan KAR di bawah 60%, kecuali pada echinochloa. Echinochloa memiliki nilai KAR lebih tinggi dari pada ketiga tumbuhan uji (padi gogo, caisim, dan bayam) pada 12 HSK. Hal ini kemungkinan terkait dengan karakteristik echinochloa sebagai tumbuhan C4 yang dapat memanfaatkan air lebih efisisen. Long (1999), menyatakan bahwa tumbuhan C4 cukup efisien dalam pemanfaatan air. Echinochloa mengalami penurunan nilai KAR di bawah 60 % terjadi pada hari ke-14 setelah perlakuan kekeringan yaitu sebesar 59,91% (Gambar 4 bawah).
Penurunan nilai KAR daun akan menyebabkan kehilangan turgor daun sehingga akhirnya terjadi kelayuan, penutupan stomata, penurunan fotosintesis dan mempengaruhi proses metabolisme dasar lainnya (Alfredo et al. 2000). Kehilangan turgor akibat penurunan KAR daun berkaitan erat dengan kondisi air media tanam. Pada kondisi normal, saat potensial air media lebih tinggi dari pada potensial air tumbuhan, akar dapat menyerap air dengan baik. Proses ini berlangsung hingga tekanan turgor bernilai positif pada jaringan tumbuhan (Taiz dan Zeiger 2002). Ketika cekaman kekeringan terjadi, saat KAM rendah, laju penyerapan air oleh tumbuhan menurun dan akan menurunkan tekanan turgor sel.
Kadar air relatif daun yang menggambarkan status air daun merupakan parameter ketahanan menghadapi cekaman kekeringan. Proses fotosintesis pada sebagian besar tumbuhan akan mulai tertekan bila nilai KAR tumbuhan lebih rendah dari 70 %, sehingga tumbuhan memerlukan pengaturan dalam tubuhnya diantaranya dengan melakukan penutupan stomata (Quilambo 2004).
Penurunan KAR daun akan menurunkan konduktansi stomata daun dan dengan perlahan akan menurunkan konsentrasi CO2 di dalam daun. Karena
26
penurunan konduktansi stomata menyebabkan penurunan konsentrasi CO2, dan dengan sendirinya akan menurunkan laju fotosintesis (Lawlor 2002). Penurunan konduktansi stomata ini terjadi pada tumbuhan untuk mengurangi kehilangan air yang berlebihan akibat cekaman air yang terjadi (Tezara et al. 2002).
Rewatering akan mengembalikan kondisi KAM sehingga dapat meningkatkan KAR daun dengan nilai yang tidak berbeda nyata dengan tumbuhan kontrol setelah dua hari recovery (Gambar 4 atas dan bawah). Peningkatan kandungan air tanah dapat mengurangi faktor cekaman yang disebabkan oleh cekaman kekeringan dan dapat menurunkan kerusakan akibat cekaman yang terjadi. Dengan sendirinya tumbuhan dapat tumbuh kembali dan terhindar dari kerusakan akibat cekaman air (Marschner 1995).
Peningkatan KAR daun ini diperlukan untuk perbaikan tumbuhan dari kerusakan akibat perlakuan cekaman kekeringan. Blanco-shanchez et al. (2002) telah melakukan penelitian pada tumbuhan Cistus albidus dan Cistus monspeliensis. Pemberian air kembali pada tumbuhan yang mendapat perlakuan
kekeringan dapat meningkatkan KAR daun sampai mencapai nilai yang sama dengan kontrol.
Parameter Fotosintesis
Perlakuan cekaman kekeringan beberapa hari menyebabkan penurunan suplai CO2 yang berakibat pada penurunan laju fotosintesis yang dapat diamati melalui parameter fotosintesis. Pada percobaan ini parameter fotosintesis yang diamati meliputi; efisiensi maksimum fotosintesis (Fv/Fm), pelepasan energi untuk reaksi fotokimia atau photochemical quenching (qP), hasil quantum fotosintesis (qY), dan pelepasan energi reaksi non fotokimia atau non photochemical quenching (qN).
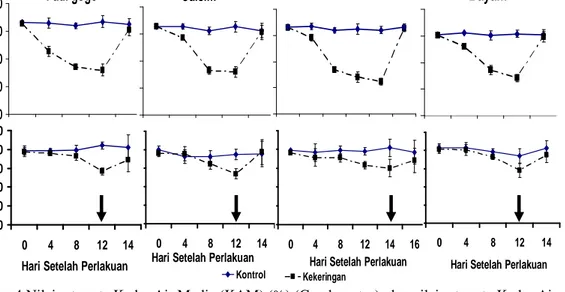
Perlakuan cekaman kekeringan tidak terlalu besar pengaruhnya terhadap nilai Fv/Fm, namun pada akhir cekaman (12 HSK) nilai Fv/Fm menurun cukup besar terutama pada tumbuhan C3 (padi gogo dan caisim). Nilai Fv/Fm pada caisim saat 12 HSK menurun dari 0,70 menjadi 0,45 µmol m-2 s-1 dan padi gogo dari 0,62 menjadi 0,43 µmol m-2s-1sedangkan Echinochloa dari 0,69 menjadi 0,59 µmol m-2s-1dan pada bayam penurunan Fv/Fm hanya terjadi sedikit (Gambar 6A).
Dari parameter fotosintesis yang diukur menunjukkan efisiensi fotosintesis maksimum (Fv/Fm) cenderung menurun pada akhir perlakuan kekeringan (Gambar 6A), walaupun tidak berbeda nyata, namun kecenderungan penurunan lebih besar pada tumbuhan C3 dibandingkan tumbuhan C4. Penurunan Fv/Fm diduga sebagai akibat terjadinya kerusakan piranti fotosintesis, khususnya pada fotosistem II (PSII) (Hamim 2005).
Cekaman kekeringan secara dramatis menurunkan parameter fotosintesis qP. Penurunan qP terlihat nyata mulai hari ke-4 (caisim) dan hari ke-8 (padi gogo) hingga 12 HSP (Gambar 6B). Pada akhir cekaman yaitu 12 HSP nilai qP pada tumbuhan padi gogo, caisim, dan bayam berturut-turut dari: 0,32 µmol m-2s-1, 0,30 µmol m-2 s-1, dan 0,54 µmol m-2 s-1 serta 14 HSP pada Echinochloa sebesar 0,30 µmol m-2 s-1 dibandingkan dengan rata-rata kontrol berturut-turut sebesar 0,83 µmol m-2 s-1, 0,81 µmol m-2 s-1, 0,86 µmol m-2 s-1, dan 0,81 µmol m-2 s-1. Berdasarkan data parameter pelepasan energi untuk reaksi fotokimia (qP) menggambarkan bahwa telah terjadi penurunan laju fotosintesis (Pn) akibat cekaman kekeringan. Penurunan qP pada tumbuhan C3 terjadi lebih besar dari pada tumbuhan C4 (Gambar 6B). Hal tersebut menggambarkan bahwa pemanfaatan energi hasil reaksi terang untuk reduksi karbon jauh lebih rendah pada tumbuhan C3 dibanding tumbuhan C4 sebagai akibat cekaman kekeringan.
Cekaman kekeringan yang diberikan selama 12 hari telah menyebabkan suplai air untuk menjaga tugiditas sel dan jaringan berkurang sehingga menurunkan laju fotosintesis. Penurunan ini disebabkan terutama akibat suplai CO2 yang berkurang akibat penutupan stomata (Cornic 2000). Pada keadaan ini pemanfaatan energi dari reaksi terang untuk reaksi karbon menurun yang ditandai dengan penurunan nilai qP (photochemical quenching). Penrunan qP hingga akhir periode cekaman menandakan bahwa reaksi fotokimia fotosintesis semakin rendah dan hampir mencapai nol. Hal ini berakibat pada terjadinya over reduksi pada tumbuhan karena pemakaian ATP dan NADPH hasil reaksi terang tidak terjadi (Subrahmanyam 2006).
Di lain pihak untuk menghindari terjadinya kerusakan akibat over reduksi, energi hasil reaksi terang dimanfaatkan untuk proses non-photochemical quenching (qN), yang dapat melepaskan kembali energi dalam bentuk panas. Hal tersebut dapat dilihat dengan nilai qN yang justru meningkat dengan perlakuan kekeringan.
28
Peningkatan qN secara nyata mulai 4 HSP (padi gogo) dan 8 HSP (bayam) hingga 12 HSP. Pada akhir cekaman peningkatan qN tertinggi terjadi pada tumbuhan padi gogo yaitu dari 0,24 hingga 0,69 µmol m-2s-1 dan terendah pada Echinochloa yaitu dari 0,57 menjadi 0,62 µmol m-2s-1 (Gambar 6C).
A
B
C
D
Gambar 6 Parameter fotosintesis tumbuhan uji. (A) Efisiensi maksimum fotosintesis (Fv/Fm), (B) pelepasan energi untuk reaksi fotokimia (qP), (C) pelepasan
energi untuk reaksi non fotokimia (qN) ,dan (D) quantum Yield (qY) tumbuhan padi gogo, caisim, Echinochloa dan bayam. Tanda panah menunjukkan titik
rewatering.
Mungkin penurunan qP dikompensasi dengan disipasi energi berupa panas melalui proses non fotokimia (qN), sehingga nilai qN meningkat. Peningkatan qN ini berfungsi sebagai kontrol balik terhadap kelebihan transpor elektron saat fotosintesis. Proses disipasi energi berupa panas ini merupakan suatu mekanisme pertahanan tumbuhan terhadap kerusakan piranti fotosintesis akibat cekaman kekeringan (Pastenes et al. 2004).
Cekaman kekeringan juga menurunkan quantum Yield (qY) pada semua tumbuhan yang diamati di akhir perlakuan. Penurunan qY terbesar pada padi gogo
Padi gogo 0 0,2 0,4 0,6 0,8 0 4 8 12 Recovery F v /F m (u m o l m -2 s -1 Caisim Echinochloa 0 4 8 12 Recovery Bayam 0 0,2 0,4 0,6 0,8 1 q P (u m o l m -2 s -1 ) 0 0,2 0,4 0,6 0,8 1 0 4 8 12 14 Recovery 0 0,2 0,4 0,6 0,8 1 0 4 8 12 Recovery 0 0,2 0,4 0,6 0,8 1 0 4 8 12 Recovery q N (u m o l m -2 s -1 ) Caisim 0 0,2 0,4 0,6 0,8 1 0 0,2 0,4 0,6 0 4 8 12 14
Hari setelah Perlakuan
q Y (u m o l m -2 s -1 ) 0 4 8 12 14
Hari setelah Perlakuan Kontrol
0 4 8 12 14 16
Hari setelah Perlakuan Kekeringan
Bayam
0 4 8 12 14
dari 0,46 menjadi 0,05 µmol m-2 s-1 dan penurunan terkecil pada bayam dari 0,52 menjadi 0,20 µmol m-2 s-1 setelah 12 HSP kekeringan (Gambar 6D). Peningkatan qN dan penurunan qP menyebabkan transfer elektron yang akan menghasilkan energi dalam bentuk ATP dan NADPH atau quantum Yield (qY) menjadi berkurang. Hal ini ditunjukkan pada Gambar (6D). Penurunan qY disebabkan banyaknya energi yang dilepas dalam bentuk energi panas yang terkait dengan perubahan gradien pH dan siklus xantofil (Horton dan Ruban 2004).
Rewatering selama 2 hari meningkatkan kembali laju fotosintesis pada
semua tumbuhan yang diamati dengan nilai yang tidak berbeda nyata dengan kontrol pada 14 HSP (padi gogo, caisim, dan bayam), dan 16 HSP (Echinochloa). Hal ini menunjukkan bahwa tumbuhan dapat recovery setelah cekaman air dan peningkatan laju fotosintesis seiring dengan peningkatan KAR pada daun tumbuhan yang diuji. Menurut Wang dan Huang (2004), rewatering sangat penting untuk perbaikan fisiologi tumbuhan yang diberi perlakuan cekaman kekeringan dan cekaman suhu tinggi. Tumbuhan memulai kembali aktifitas fisiologinya seperti fotosintesis, stabilitas membran sel, dan aktifitas senyawa antioksidan. Semua proses tersebut sangat penting bagi tumbuhan untuk perbaikan dari cekaman seperti kekeringan.
Kandungan Asam Askorbat (ASA)
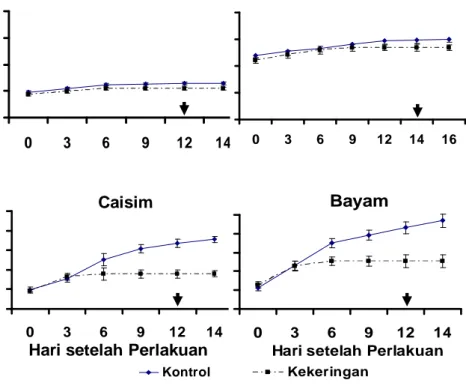
Perlakuan cekaman kekeringan dapat menginduksi peningkatan kandungan ASA pada semua tumbuhan kecuali bayam (Gambar 7). Kandungan ASA tertinggi dijumpai pada echinochola sebesar 17,71 g/100g berat segar dan terendah pada bayam sebesar 6,95 g/100g berat segar, sementara itu rata-rata nilai ASA dari semua tumbuhan kontrol adalah 5,57 g/100g berat segar. Akumulasi ASA lebih tinggi pada tumbuhan berdaun sempit dibanding tumbuhan berdaun lebar saat mengalami cekaman kekeringan. Bahkan pada tumbuhan bayam akumulasi ASA hampir tidak terjadi hingga pada akhir periode cekaman kekeringan. Kandungan ASA daun kembali mengalami penurunan setelah penyiraman kembali.
30
Gambar 7 Kandungan asam askorbat padi gogo, caisim, dan bayam mulai 0 sampai 12 HSP dan 14 HSP Echinochloa dan recovery. Tanda panah menunjukkan titik rewatering.
Perlakuan cekaman kekeringan pada tumbuhan uji dapat menginduksi peningkatan kandungan ASA daun terutama pada tumbuhan berdaun sempit (Padi gogo dan Echinochloa) mulai hari 8 HSP pada padi gogo dan 12 HSP pada Echinochloa sampai akhir perlakuan kekeringan (Gambar 7). Peningkatan kandungan ASA ini diduga berkaitan dengan tindakan penyelamatan tumbuhan terhadap tingginya ROS terutama periode akhir cekaman. Peranan asam askorbat (ASA) pada tumbuhan terutama diperlukan pada saat tumbuhan mengalami cekaman oksidatif. Cekaman oksidatif dapat terjadi pada saat tumbuhan mengalami cekaman kekeringan berat (Violita 2007). ASA digunakan sebagai senyawa antioksidan yang dapat membantu mengubah senyawa oksidatif menjadi senyawa yang tidak berbahaya bagi tumbuhan. ASA berkaitan dengan aktivitas enzim askorbat peroksidase (APX) pada siklus askorbat-glutation. Pada siklus ini ASA berperan sebagai senyawa yang ikut mengubah H2O2 menjadi H2O (Apel dan Hirt 2004).
ASA berperan sebagai agen reduksi yang dapat menetralisir spesies oksigen reaktif (ROS) seperti hidrogen peroksida pada tumbuhan. Pembentukan senyawa oksidatif pada tumbuhan diawali dengan reduksi oksigen pada membran sel kloroplas membentuk ROS seperti; (O2-), H2O2(Blokhina et al. 2003). Peningkatan ROS dapat menimbulkan kerusakan pada komponen membran sel terutama pada saat tumbuhan defisit air (Noctor dan Foyer 1998).
Walaupun demikian ASA bukan satu-satunya antioksidan pada tumbuhan, seperti yang terjadi pada bayam. Bayam memiliki kandungan ASA lebih rendah
Padi gogo 0 5 10 15 20 0 4 8 12 14 Hari setelah Perlakuan
A S A (m g /1 0 0 g B S ) Caisim 0 4 8 12 14 Hari setelah Perlakuan
Kontrol
Echinochloa
0 4 8 12 14 16 Hari setelah Perlakuan
Kekeringan
Bayam
0 4 8 12 14 Hari setelah Perlakuan