PRE ANALITIK PEMERIKSAAN HEMOSTASIS Sri Suryo Adiyanti
Departemen Patologi Klinik FKUI-RSCM
Pendahuluan
Penggunaan alat analitik modern saat ini sangat membantu dalam pemeriksaan laboratorium dengan hasil yang akurat. Pemantapan mutu internal dan eksternal yang dilakukan dengan baik diharapkan dapat mengurangi kesalahan pada proses analitik. Adanya hasil tes yang tidak tepat dalam pemeriksaan hemostasis dapat disebabkan oleh keadaan diluar pemeriksaan itu sendiri terutama dalam proses pre analitik. Keadaan yang dapat menyebabkan kesalahan misalnya dari penanganan sampel yang tidak tepat, atau dari proses pengambilan sampel itu sendiri. Pada keadaan ini maka hasil tes tidak menggambarkan keadaan sampel sesuai keadaan klinis pasien tersebut secara akurat. 1,2 Pada makalah ini akan dibahas tentang hal yang perlu diperhatikan pada pemeriksaan pre analitik hemostasis terutama saat pengambilan darah vena antara lain identifikasi pasien, pemilihan lokasi vena, antikoagulan, cara pengambilan dan urutan penampungan. Selain itu juga dibahas tentang stabilitas dan penyimpanan.
Pengambilan darah vena
Pengambilan darah harus dilakukan oleh tenaga yang terlatih dan berpengalaman dan identifikasi pasien harus dilakukan dengan tepat sehingga dan pengambilan sampel dilakukan dari pasien yang benar. Identifikasi pasien dapat dilakukan seperti mencocokkan dengan nama lengkap pasien, serta identifikasi tambahan lainnya seperti tanggal lahir, nomor rekam medik. Pasien dapat diminta menyebutkan nama lengkapnya, alamat, tanggal lahir atau nomor identifikasinya, selain itu pencantuman tanggal dan waktu pengambilan sampel juga harus diperhatikan.1,3
Pasien sebaiknya berada dalam keadaan santai, karena adanya stres dan aktivitas fisik yang berlebihan dapat menyebabkan perubahan dalam pembekuan darah yaitu akan meningkatkan faktor von willebrand dan fibrinolisis. Pasien juga sebaiknya tidak mengkonsumsi makanan atau obat yang dapat mempengaruhi fungsi trombosit selama setidaknya 10 hari dan sebaiknya puasa overnight karena adanya kilomikron dapat mempengaruhi pemeriksaan Terdapat beberapa obat yang dapat mempengaruhi fungsi trombosit, seperti aspirin, ibuprofen, indometasin, asam mefenamat, juga makanan seperti kopi dan alkohol. Posisi badan mempengaruhi konsentrasi komponen darah seperti perubahan dari berbaring ke berdiri mengurangi volume plasma sekitar 12% maka
pengambilan darah cenderung dilakukan pada posisi berbaring. Istirahat selama 30 menit juga direkomendasikan untuk tes fibrinolisis.1-6
Pengambilan sampel yang berhubungan dengan pemberian obat harus diperhatikan (seperti APTT pada monitoring terapi heparin).2 Variasi diurnal dan makanan dapat memodifikasi beberapa parameter, maka darah sebaiknya diambil antara pukul 7-9 pagi, 12 jam setelah makan terakhir, dan pada keadaan telentang yang bebas dari stres, kecuali jika efek obat perlu dimonitor waktunya seperti heparin.4
Alat yang diperlukan untuk pengambilan darah vena antara lain adalah jarum, torniket, kapas alkohol, sarung tangan, tabung dan tube holder. Jarum yang digunakan harus sesuai dengan diameter vena. Jarum dengan diameter besar (16-18 gauge) digunakan untuk mengambil darah dalam jumlah besar seperti donor darah sehingga umumnya digunakan jarum ukuran 19-21 gauge. Penggunaan torniket adalah untuk membantu melihat lokasi vena lebih jelas. Jika penggunaan torniket > 1 menit maka kadar F VIII, faktor von willebrand dan tissue plasminogen activator akan meningkat, dan fibrinolisis akan teraktivasi. Selain itu juga terdapat hemokonsentrasi yang akan meningkatkan semua protein dalam darah sehingga torniket tidak boleh terlalu kencang dan harus dipasang tidak lebih dari 1 menit, saat darah sudah mengalir ke dalam tabung maka secepatnya torniket harus dilepas.4,6,7
Sampel sebaiknya diambil tanpa bendungan sehingga darah dapat mengalir ke semprit dengan aliran kontinyu tanpa tahanan atau dengan adanya tekanan negatif dari tabung hampa udara (vakum), karena adanya bendungan yang terlalu lama pada vena dapat menyebabkan hemokonsentrasi, peningkatan aktivitas fibrinolitik, dan aktivasi sejumlah faktor pembekuan.2
Pembuluh vena besar di lengan daerah lipat siku lebih direkomendasikan, karena pembuluh dengan diameter yang kecil dapat menjadi kolaps sehingga menyebabkan aliran darah menjadi terhambat dan/atau pengisian tabung menjadi tidak tepat. Pemilihan lengan juga harus diperhatikan. Pengambilan vena harus membuat trauma seminimal mungkin. Darah tidak boleh diambil dari lengan yang terpasang infus. Kontaminasi sampel dengan cairan infus (terutama yang mengandung heparin) merupakan penyebab paling umum kesalahan pra analitik di rumah sakit. 3,4
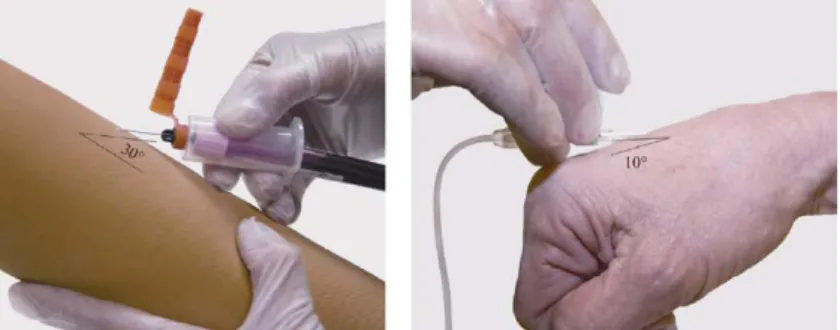
Gambar 1. Cara pengambilan darah vena8
Jenis, volume dan pH antikoagulan, rasio volume darah dan hematokrit merupakan beberapa hal yang termasuk variabel pra analitik dan dapat mempengaruhi tes koagulasi. Sebelum 2003, NCCLS (sekarang The Clinical and Laboratory Standard Institute (CLSI)) merekomendasikan bahwa 5 ml darah pertama sebaiknya digunakan untuk pemeriksaan lain yang bukan hemostasis karena satu ml darah pertama dapat terkontaminasi oleh tissue
factor, namun kini hal tersebut tidak berlaku lagi karena tidak ada bukti adanya perubahan
efek pada pemeriksaan koagulasi. Saat ini CLSI memperkenalkan ‘coagulation before
serum’, tes koagulasi yang sebaiknya tidak dilakukan setelah sampling pada tabung yang
mengandung aktivator atau tabung yang mengandung antikoagulan lain seperti heparin dan EDTA karena dikhawatirkan dapat terjadi efek carry over dari bahan tambahan dari tabung sebelumnya ke tabung berikutnya yang kemudian akan mempengaruhi hasil. Carry over terjadi jika jarum yang digunakan untuk mengisi sebuah tabung memindahkan sedikit darah atau campuran antikoagulan dari darah tersebut ke tabung yang diisi berikutnya. Antikoagulan dan zat aditif lainnya pada tabung dapat mempengaruhi hasil pemeriksaan pada tabung lainnya walaupun dari penelitian Fukugawa ditemukan bahwa efek carryover dari clot activators dalam tabung serum minimal. Urutan pengambilan tabung juga serupa pada penggunaan semprit. Jika 2 atau 3 tabung digunakan maka diisi volumenya sampai batas yang dianjurkan,selain itu CLSI juga menyatakan bahwa hasil tes PT dan APTT tidak terpengaruh bila dari tabung pertama.1,4,9,10
Sampel untuk pemeriksaan koagulasi harus menggunakan tabung yang mengandung antikoagulan yaitu sitrat. Adanya sitrat akan menyingkirkan kalsium sehingga tidak akan terjadi proses pembekuan. Konsentrasi sitrat yang direkomendasikan adalah 0.105-0.109 M (biasanya 3.2%) dengan rasio 9 volume darah dengan 1 volume antikoagulan, sehingga penting untuk mengisi tabung sedikitnya 90% dari kapasitas tabung atau mencapai batas yang terdapat pada tabung untuk tercapainya rasio antar volume darah dan antikoagulan tersebut selain itu tabung juga harus dicampur merata dengan dibolak balik perlahan sebanyak 5-6 kali dan jangan dikocok supaya darah dengan antikoagulan menjadi homogen. 1,4,7
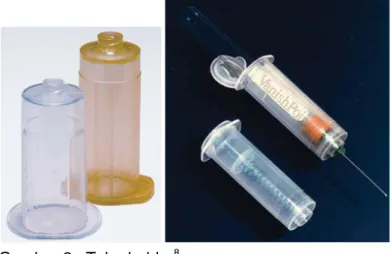
Gambar 2. Tube holder8
Gambar 3. Tabung untuk pemeriksaan hemostasis dengan panah yang menunjukkan batas terisinya8
Stabilitas dan Penyimpanan
Jeda waktu antara sampling dan sentrifugasi sangat penting sehingga waktu kapan tepatnya sampel diambil perlu diketahui. Sebelum mengirim sampel ke laboratorium hemostasis maka harus disimpan dalam suhu ruangan untuk mencegah aktivasi dingin oleh F VII. Sebaiknya sampel dikirim secepat mungkin untuk mencegah deteriorisasi faktor pembekuan yang labil seperti F V dan VIII dan tidak perlu diantar dalam pendingin, namun pada suhu 15-22 oC. Sampel untuk pemeriksaan PT yang disentrifugasi atau tidak disentrifugasi dengan plasma berada di bagian atas dalam tabung tertutup dibiarkan pada suhu 18 – 24 oC harus diperiksa dalam waktu 24 jam setelah pengambilan. Sampel untuk pemeriksaan APTT pada pasien yang tidak mendapat heparin disimpan pada 2-4 oC atau 18-24 oC harus diperiksa dalam 4 jam, sedangkan untuk pemeriksaan APTT pada sampel yang diduga mengandung unfractioned heparin disimpan pada suhu 2-4 oC atau 18-24 oC
yang harus dikerjakan dalam waktu 1 jam karena potensi netralisasi heparin oleh adanya pelepasan isi trombosit. Sampel untuk pemeriksaan lain (Trombin Time, Protein C, F V, F VIII) disimpan pada suhu 2-4 oC atau 18-24 oC, disentrifugasi dan diperiksa dalam waktu 4 jam. 1,2,4
Suhu yang ekstrim harus dihindari dan keterlambatan dalam transportasi dapat mempengaruhi faktor yang labil (FV, FVIII), sehingga menyebabkan waktu pembekuan memanjang dan hilangnya aktivitas faktor tersebut. Pada kasus tersebut, melakukan sentrifugasi dan pemisahan plasma yang diikuti dengan transpor plasma yang beku dapat dipertimbangkan. Umumnya, untuk mempertahankan integritas sampel, sampel harus dikerjakan secepatnya (idealnya dalam waktu 1 jam setelah pengambilan) dan tes dilakukan dalam waktu 4 jam (atau diproses dengan dilakukan sentrifugasi lebih dahulu dan plasma dibekukan). Selama disimpan dalam waktu yang singkat, sampel harus tetap tertutup dan berada dalam suhu kamar. Jika pemeriksaan belum akan dilakukan dalam waktu 4 jam untuk APTT dan 24 jam untuk PT, maka plasma sebaiknya dipisahkan dari fraksi seluler dengan satu atau dua kali sentrifugasi, tanpa menganggu pellet sel. Plasma yang sudah terpisah dapat disimpan dalam keadaan beku untuk dikerjakan tes selanjutnya. Plasma yang terpisah umumnya dapat disimpan pada suhu ruangan atau dalam lemari es selama beberapa jam tanpa ada efek pada koagulasi.1,2,4
Ketika menyimpan plasma, semakin rendah suhu freezer, semakin lama spesimen dapat disimpan. Umumnya tes pada sampel yang disimpan pada suhu di bawah -20 oC dapat dikerjakan dalam waktu 2-4 minggu sedangkan tes pada sampel yang disimpan pada suhu -80 oC dapat dikerjakan dalam waktu beberapa bulan dan terkadang beberapa tahun dalam freezer yang tidak mempunyai defrost cycle yang dapat mencairkan dan membekukan kembali sampel secara periodik selama penyimpanan. Sebelum pemeriksaan, sampel yang beku harus dicairkan pada 37 oC selama 5-10 menit atau sudah mencair seluruhnya dan diperiksa secepatnya. Jika pemeriksaan tidak dapat dilakukan secepatnya maka sampel yang sudah dicairkan dapat disimpan dalam suhu 5-15 oC selama 2 jam. 1,11,12
Sentrifugasi : persiapan Platelet Poor Plasma (PPP) dan Platelet Rich Plasma (PRP) Sampel secara keseluruhan perlu diamati adanya bekuan. Untuk memperoleh plasma, maka sampel disentrifugasi pada kecepatan dan waktu tertentu untuk menghasilkan
platelet poor plasma (PPP) dengan jumlah trombosit < 10 x 10 9/L) (10.000/µl). Hal ini dapat dicapai dengan sentrifugasi pada 1500 g 15 menit pada suhu kamar. Direkomendasikan untuk menggunakan swing-out bucket rotor untuk menghindari pencampuran kembali antara plasma dan trombosit. Sampel yang tampak hemolisis tidak dapat digunakan karena kemungkinan adanya aktivasi pembekuan dan interferensi pada alat. Beberapa instrumen yang menggunakan detektor optik dapat bermasalah dalam pengukuran pada sampel yang
ikterik, lipemik atau mengandung substansi yang menganggu transmisi cahaya sehingga metoda alternatif seperti mekanik atau elektromekanik harus dipertimbangkan.11
Untuk pemeriksaan agregasi trombosit, digunakan Platelet Rich Plasma (PRP) dengan jumlah trombosit sedikitnya 200 x 10 9/L yang dapat diperoleh dengan sentrifugasi pada 150-200 g selama 10-15 menit pada suhu kamar, dan kemudian diperiksa selambatnya dalam waktu 2 jam.2,13
Beberapa kesalahan teknis yang paling umum terjadi2 :
1. Kesalahan saat pengambilan sampel, menyebabkan koagulasi sudah terjadi sebagian (sehingga waktu pembekuan memendek).
2. Pengisian tabung tidak penuh atau terlalu penuh atau hematokrit yang rendah ataupun tinggi (dapat menyebabkan volume sitrat dengan perbandingan volume plasma tidak tepat)
3. Antikoagulan yang tidak sesuai seperti EDTA.
4. Pengambilan darah dilakukan melalui selang yang sebelumnya terdapat kontak dengan heparin (sehingga menyebabkan pemanjangan APTT dan TT).
5. Kontaminasi kaolin/platelet substitute reagent dengan sisa thromboplastin (dapat menyebabkan APTT memendek).
6. Penundaan analisis sampel 7. Pipetting yang tidak akurat 8. Malfungsi alat.
9. Suhu waterbath tidak tepat
10. Kalsium klorida tidak tepat konsentrasinya atau tidak segar.
Ringkasan
Pemeriksaan hemostasis memerlukan perhatian khusus, dimana pre analitiknya memegang peranan penting yang dapat mempengaruhi hasil tes secara keseluruhan. Beberapa hal yang harus diperhatikan seperti saat pengambilan sampel yaitu identifikasi pasien, urutan pengambilan tabung dan penggunaan antikoagulan. Tabung harus terisi penuh 90%, menggunakan antikoagulan yang tepat seperti sitrat. Kini CLSI merekomendasikan ‘coagulation before serum’ karena dikhawatirkan efek carry over yang akan terjadi meskipun penelitian menunjukkan tidak ada perbedaan bermakna PT dan APTT yang diambil dari tabung pertama maupun kedua. Transportasi dan penyimpanan sampel juga memegang peranan penting tergantung dari tes apa yang akan dikerjakan seperti APTT yang harus diperiksa dalam waktu 4 jam, sedangkan PT dalam waktu 24 jam bila didiamkan dalam suhu kamar. Hal lain seperti hematokrit dan cara sentrifugasi juga harus
diperhatikan. Bila pre analitik dilakukan dengan baik maka pada pemeriksaan hemostasis akan diperoleh hasil yang akurat dan sesuai klinis pasien.
DAFTAR PUSTAKA
1. Favaloro EJ, Funk DM, Lippi G. Pre-analytical Variables in Coagulation Testing Associated with Diagnostic Error in Hemostasis. Labmedicine.2012;(43)2:1-10 2. Manning R, Laffan M. Investigation of Hemostasis : Preanalytical variables including
sample collection. In : Lewis SM, Bain BJ, Bates I.Dacie and Lewis Practical Hematology.10th eds.Philadelphia: Churchill Livingstone;2006.p 391-2. 3. Ernst DJ . Performing the Venipuncture. In : Applied Phlebotomy. Baltimore:
Lippincott Williams and Wilkins.2005.p 59-95.
4. Pollack B, Schved JF, Boneu B. Preanalytical Recommendations of the ‘Groupe d ‘Etude sur l’Hemostase et la Thrombose’ (GEHT) for Venous Blood Testing in Hemostasis Laboratories. Haemostasis.2001;(31):61-68.
5. Stegnar M, Knezevic A, Bozic-Mijovski M. The effect of pre-analytical variables on light transmittance aggregometry in citrated platelet rich plasma from healthy subjects. Clin Chem Lab Med.2010;(48):1463-5.
6. Harrison P, Mackie I, Mumford A, Briggs C, Liesner R, Winter M, Machin S. Guidelines for the Laboratory Investigation of Heritable Disorders of Platelet Function. British Committee for Standard Haematology. 2011.p 1-41.
7. Ernst DJ . Selecting and Assembling Equipment. In : Applied Phlebotomy. Baltimore: Lippincott Williams and Wilkins;2005.p 38-58.
8. Blood Collection Equipment, Additives and Order of Draws. In : McCall RE,
Tankersley CM. Phlebotomy Essensials. 5th eds. Baltimore: Lippincot William and Wilkins;2012.p 191-224
9. Fukugawa Y, Ohnishi H, Ishii T, Tanouchi A, Sano J, Miwayaki H, Kishino T, et al. Effect of Carryover of Clot Activators on Coagulation Tests during Phlebotomy. Am J Clin Pathol. 2012;(137):900-3.
10. Arkin CF, Adcock DM, Ernst DJ, Marlar RA, Parish GT, Szamosi DI and Warunek DJ. Collection, Transport, and Processing of Blood Specimens for testing Plasma-Based Coagulation Assays; Approved Guideline-Fourth Edition. Clinical and Laboratory Standards Institute. 2003;H21-A4(23)35
11. Ernst DJ . Specimen Handling, Storage and Tranportation. In : Applied Phlebotomy.Baltimore: Lippincott Williams and Wilkins;2005.p 162-181.
12. Kitchen S, Makris M. Laboratory tests of hemostasis. In : O’Shaughnessy, Makris M, Lilicrap D , editors. Practical Hemostasis and Thrombosis.2005.. Massachussets: Blackwell Publishing;2005.p 8-17.
13. Manning R, Laffan M. Investigation of Hemostasis : Platelet Aggregation. In : Lewis SM, Bain BJ, Bates I.Dacie and Lewis Practical Hematology.10th eds.Philadelphia: Churchill Livingstone;2006.p 427