ISOLASI BAKTERI DAN UJI AKTIVITAS
AMILASE TERMOFIL KASAR DARI SUMBER AIR PANAS
PENEN SIBIRUBIRU SUMATERA UTARA
TESIS
Oleh
DESSY CHRISTINA SIANTURI
067030006/BIOSEKOLAH PASCASARJANA
UNIVERSITAS SUMATERA UTARA
MEDAN
ISOLASI BAKTERI DAN UJI AKTIVITAS
AMILASE TERMOFIL KASAR DARI SUMBER AIR PANAS
PENEN SIBIRUBIRU SUMATERA UTARA
TESIS
Untuk Memperoleh Gelar Magister Sains dalam Program Studi Biologi pada Sekolah Pascasarjana
Universitas Sumatera Utara
Oleh
DESSY CHRISTINA SIANTURI
067030006/BIO
SEKOLAH PASCASARJANA
UNIVERSITAS SUMATERA UTARA
MEDAN
2008
Judul Tesis : ISOLASI BAKTERI DANUJI AKTIVITAS AMILASE TERMOFIL KASAR DARI SUMBER AIR PANAS PENEN SIBIRUBIRU SUMATERA UTARA
Nama Mahasiswa
: Dessy Christina Sianturi Nomor Pokok : 067030006
Program Studi
: Ilmu Biologi
Menyetujui Komisi Pembimbing
(Dr. Dwi Suryanto, M.Sc.) (Prof. Dr. Erman Munir, M.Sc.) Ketua Anggota
Ketua Program Studi Direktur
(Dr. Dwi Suryanto, M.Sc.) (Prof. Dr. Ir. T. Chairun Nisa B, M.Sc.)
Telah diuji pada
Tanggal : 26 September 2008
PANITIA PENGUJI TESIS
Ketua : Dr. Dwi Suryanto, M.Sc.
Anggota : 1. Prof. Dr. Erman Munir, M.Sc.
2. Dr. Delvian SP., MP.
ABSTRAK
Telah dilakukan isolasi bakteri termofil penghasil enzim amilase dari sumber air panas Penen Sibirubiru Sumatera Utara di Laboratorium Mikrobiologi MIPA Universitas Sumatera Utara dari bulan Februari-Juli 2008. Enam belas isolat bakteri penghasil amilase didapatkan melalui uji iodin pada media pati yang digunakan untuk pertumbuhan isolat-isolat tersebut. Melalui pengukuran diameter zona bening pada media selektif amilase dengan uji iodin dipilih tiga isolat yang paling besar zona beningnya yaitu PN1, PN4 dan PN9. Enzim amilase kasar yang dihasilkan ketiga isolat terpilih tersebut diuji aktivitasnya lewat konsentrasi glukosa yang dihasilkan dari hidrolisis pati pada pengaruh suhu inkubasi dan pH yang berbeda. Dari hasil pengujian didapatkan hasil amilase kasar isolat PN9 menghasilkan glukosa lebih banyak pada suhu 80oC (165,78µg/ml) diikuti oleh amilase kasar isolat PN1 (117,88 µg/ml) dan PN4 (129,19 µg/ml), meskipun pada suhu optimum aktifitasnya (60°C) amilase isolat PN4 menghasilkan glukosa yang lebih banyak sebagai hasil hidrolisis pati yaitu 437,22 µg/ml. Amilase kasar isolat PN1 memiliki aktivitas katalik yang lebih tinggi pada pH yang alkalis (pH 9,0) dibandingkan dengan PN4 dan PN9. Amilase kasar isolat PN4 aktivitas amilasenya lebih tinggi di suasana pH yang sifatnya sedikit asam sampai netral (pH 5,0 – pH 7,0). Amilase kasar isolat PN9 memiliki aktivitas katalik yang tertinggi dari ketiga isolat dan optimum aktivitasnya pada pH substrat yang bersifat netral (pH 7,0) dengan glukosa hasil hidrolisis tertinggi (390,11µg/ml).
Kata kunci : Amilase termofil, air panas Penen, enzim amilase, isolasi bakteri.
ABSTRACT
Isolation of amylolytic thermophile bacteria from Penen Hot spring Sibirubiru has been carried out in Microbiology Laboratory, Department of Biology, Faculty of Mathematics and Natural Sciences, University of Sumatera Utara from February to July 2008. Sixteen amylolytic bacterial isolates were obtained through the Iodine test on starch media. Three out of sixteen isolates showed relatively high hydrolytic activity and were used for further study. PN9 showed enzyme activity at 80oC by producing 165,78 µg/ml glucose, followed by PN4 with 129,19 µg/ml and PN1 with 117,88 µg/ml glucose, respectively. Optimum activity were showed by PN4 at 60oC by producing 437,22 µg/ml glucose. This isolate also showed relatively high enzyme activity at pH 5,0-7,0. Crude enzyme activity were measured at different of temperature and pH. However PN9 showed the highest activity among isolates tested and has optimum activity at pH 7,0 with glucose production 390,11µg/ml.
Key word : Thermophile amylase, Penen hot spring, amylase enzyme, isolation of bacteria.
UCAPAN TERIMA KASIH
Dengan segenap jiwaku aku menyerukan terima kasih padaMu ya Tuhan, karena atas segala rencana, berkat kasih dan pertolonganMulah aku dapat melalui dan menyelesaikan perkuliahan serta tugas akhir tesis ini. Besar kasih dan kuasaMu dan segala puji syukur kupanjatkan kehadiratMu Tuhan.
Terima kasih yang sebesar besarnya saya ucapkan kepada Pemerintah Provinsi Sumatera Utara lewat BAPPEDA Provinsi Sumatera Utara yang memberikan kesempatan dan bantuan finansial selama perkuliahan saya di Program Studi Biologi SPs USU.
Dengan selesainya tesis ini perkenankanlah saya mengucapkan terima kasih yang sebesar-besarnya kepada: Rektor Universitas Sumatera Utara Bapak Prof. Chairuddin P. Lubis, DTM&H, Sp.A(K), atas kesempatan fasilitas yang diberikan kepada kami untuk menyelesaikan pendidikan program Magister, Direktur Sekolah Pascasarjana Ibu Prof. Dr. Ir. T. Chairun Nisa B, M.Sc., Ketua Program Studi Biologi Bapak Dr. Dwi Suryanto, M.Sc dan Sekretaris Program Studi Biologi Bapak Prof. Dr. Ing. Ternala Alex Barus, M.Sc. atas kesempatan dan bimbingan yang diberikan kepada kami selama mengikuti perkuliahan pada program Studi Biologi Pascasarjana Universitas Sumatera Utara ini.
Terima kasih dan penghargaan yang sebesar-besarnya kepada :
1. Bapak Dr. Dwi Suryanto, M.Sc selaku pembimbing I dan Bapak Prof. Dr. Erman Munir, M.Sc selaku pembimbing II saya, yang selama penelitian dan penyusunan tesis ini telah banyak memberikan bantuan dan masukan sehingga tesis ini dapat selesai.
2. Bapak Dr. Delvian, SP, MP dan Ibu Dr. Ir. Herla Rusmarilin MS, selaku dosen penguji yang telah banyak memberikan masukan saran untuk penyelesaian tesis ini agar lebih baik, terima kasih buat dukungannya.
3. Bapak Prof.Dr. Erman Munir, M.Sc. selaku Kepala Laboratorium Mikrobiologi FMIPA USU dan Bapak Drs. Fathur Rahman Harun, M.Si. Apt., selaku Kepala Laboratorium Kimia Farmasi Kuantitatif Fakultas Farmasi USU yang memberi saya kesempatan melakukan penelitian tesis di laboratorium tersebut.
4. Bapak dan Ibu dosen di Program Studi Biologi Magister SPs USU, terima kasih untuk ilmu yang sudah diberikan selama ini.
5. Bu Nurhasni Muluk Laboran Mikrobiologi dan Bu May Laboran Kimia Farmasi
Kuantitatif, terima kasih buat bantuannya selama saya melakukan penelitian di laboratorium.Buatadik-adikAsistenLabMikrobiologiAtika,Lidya,Netty,Ginta, Ansen dan yang lainnya, juga buat Muti dan Faksi di Lab Kimia Farmasi Kuantitatif. Terima kasih atas bantuannya selama di Laboratorium.
6. Ayahandaku Drs. F. Sianturi dan Ibundaku R. A. Tambunan, BA. Tiada terbalas segala doa, kebaikan, dukunganmu, dan pengorbananmu sehingga ananda bisa menyelesaikan tugas akhir tesis ini. Kupersembahkan semua yangkudapatkan ini
untukmelengkapi kebahagianmu, telah kuwujudkan harapanmu, juga buat Ibu mertuaku Ny. Pdt. Nalom Simanjuntak br. Tampubolon. Terima kasih buat dukungan doamu. Buat kakak,abang dan adik-adikku semua, terima kasih buat dukungan semangat dari kalian semua.
7. Suamiku tercinta Ir. Basar S.L. Simanjuntak, tanpa semangat dan semua bantuan dandukungan yang kau berikan aku tidak dapat menyelesaikan perkuliahanku dan tugastesiskuini,terimakasihyangtakterkirabuatmu.Anak-anakkutercintaAdela, OtnieldansikecilkuRegita,kalianmerupakanmotivasiterbesardalamhidupmama. Terima kasih buat pengertianmu untuk semua tugas kuliah mamaselama ini, buat waktubermaindanbelajarbersama yang terpakai untuk kuliah mama. Semoga apa yang mama peroleh ini dapat menjadi motivasi baik buat kehidupan kalian kelak untuk belajar yang sungguh-sungguh.
8. Kepala Sekolah dan segenap rekan guru serta pegawaidi SMA Negeri 3 Medan yang selalu memberikan semangat pada saya untuk menyelesaikan kuliah ini. 9. Teman-temankudi S2Biologi 06,khususnyadiMikrobiologi(Bu Bunga, Bu Dewi Bu Nur,Bu Sri, Bu Ros, Bu Iche, Pak Jusuf danPak Parasian), terima kasih buat kebersamaan selama ini, juga buat teman-teman di Biologi 07 dan Biologi 08, terima kasih atas dukungannya.
Penulis menyadari bahwa tesis ini masih jauh dari sempurna, karena itu penulis sangat mengharapkan kritik dan saran dari pembaca yang bermanfaat untuk menyempurnakan tesis ini. Semoga tesis ini dapat bermanfaat bagi penelitian dan ilmu pengetahuan.
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 12 Desember 1970 di Medan, putri dari Bapak Drs. F. Sianturi dan Ibu R.A. Tambunan, BA., sebagai anak pertama dari empat bersaudara. Penulis menjalani pendidikan di SD Negeri Sei Petani Medan Baru dari tahun 1977 sampai tahun 1983, kemudian masuk ke SMP Katholik RK Makmur Medan dari tahun 1983 sampai tahun 1986 dan kemudian melanjut ke SMA Negeri 8 Medan dari tahun 1986 sampai tahun 1989. Tahun 1989 melanjutkan Pendidikan ke IKIP Negeri Medan dengan mengambil Jurusan Biologi di Fakultas Pendidikan Matematika dan Ilmu Pengetahuan Alam dan lulus Sarjana Pendidikan Biologi pada tahun 1993.
Penulis memperoleh SK Pengangkatan sebagai guru Pegawai Negeri Sipil pada tahun 1994 dan ditempatkan sebagai guru Biologi di SMA Negeri Padang Tualang Kabupaten Langkat dan tahun 1998 mutasi ke SMA Negeri 3 Medan dan sampai saat ini aktif bertugas sebagai guru Biologi di SMA Negeri 3 Medan.
Pada tahun 1997 penulis menikah dengan Ir. Basar SL. Simanjuntak dan dikarunia 3 orang anak yaitu Adela Yohanna Simanjuntak, Otniel Wahana Simanjuntak dan Regita Flora Simanjuntak.
Penulis melanjutkan pendidikan ke Sekolah Pascasarjana Universitas Sumatera Utara dengan mengambil jenjang Magister program studi Biologi pada bulan September 2006 dengan bantuan dana dari Pemerintah Propinsi Sumatera Utara melalui BAPPEDA Propinsi Sumatera Utara.
DAFTAR ISI
Halaman
ABSTRAK ...i
ABSTRACT...ii
UCAPAN TERIMA KASIH ...iii
RIWAYAT HIDUP ...vii
DAFTAR ISI ...viii
DAFTAR TABEL ...xi
DAFTAR GAMBAR ...xii
DAFTAR LAMPIRAN ...xiii
BAB I. PENDAHULUAN...1
1.1. Latar Belakang Masalah ...1
1.2. Permasalahan ………..4 1.3. Tujuan penelitian ………5 1.4. Hipotesis ……….5 1.5. Manfaat Penelitian...5 1.6. Pembatasan masalah ...5
BAB II. TINJAUAN PUSTAKA ...7
2.1. Amilum ...7
2.2. Enzim ...9
2.3. Enzim Amilase ...11
2.4. Bakteri Termofil ...16
2.5. Amilase dari Mikroorganisma...19
2.6. Amilase dari Mikroba Termofil ………..21
2.7. Sumber Air Panas Penen Sibirubiru.. ……….24
BAB III. METODE PENELITIAN...26
3.1. Waktu dan Tempat ...26
3.2. Bahan dan Alat ...26
3.3. Sampel Percobaan ...26
3.4. Pengambilan Sampel Air Panas...27
3.5. Isolasi Bakteri dan Pemurnian Bakteri ...27
3.6. Pembuatan Stok Kultur ...28
3.7. Uji Diameter Zona Bening Hasil Hidrolisis Pati ...29
3.8. Karakterisasi Morfologi Bakteri Penghasil Enzim Amilase Termofil ...29
3.9. Karakterisasi Bakteri Penghasil Amilase Secara Mikroskopis ...30
3.10. Uji Sifat Biokimia Bakteri Amilase Termofilik …...………30
3.11. Pembuatan Larutan Standar Glukosa ...31
3.12. Produksi Enzim Amilase Dari Isolat
...32
3.13. Ekstraksi Enzim Dari Kultur Cair Bakteri...32
3.14. Pengukuran Aktivitas Enzim Amilase Kasar Dari Isolat Bakteri Termofil ...33
3.15. Pengaruh Suhu Inkubasi Terhadap Aktifitas Enzim Amilase Kasar ...33
3.16. Pengaruh pH Terhadap Aktifitas Enzim ...34 3.17. Metode Statistik dan Analisis Data...35 BAB IV. HASIL DAN PEMBAHASAN ...37
4.1. Isolasi dan Seleksi Bakteri Amilolitik ...37
4.2. Karakterisasi Morfologi dan Uji Biokimia ...37 4.3. Hasil Seleksi Isolat Untuk Pengujian Aktifitas Enzim
Amilase Kasar ...41 4.4. Pengaruh Suhu Inkubasi terhadap Aktifitas Enzim Amilase Kasar ....43
4.5. Pengaruh pH terhadap Aktifitas Enzim Amilase Kasar ...47
BAB V. KESIMPULAN DAN SARAN ...52
5.1. Kesimpulan ...52
5.2. Saran ...53
DAFTAR TABEL
Nomor Halaman Tabel 1. Penggunaan Amilum Di Bidang Industri ...9 Tabel 2. Enzim Amilase Dari Mikroorganisma Dan Aplikasinya Pada Bidang
Industri ...22 Tabel 3. Karakter Morfologi dan Uji Biokimia Isolat Bakteri Termofil
Amilolitik Penen Sibirubiru ...38 Tabel 4. Pengaruh Suhu Inkubasi Terhadap Aktifitas Enzim Amilase Kasar ...43
Tabel 5. Pengaruh pH Terhadap Aktifitas Enzim Amilase Kasar
DAFTAR GAMBAR Nomor Halaman
Gambar 1. Struktur Kimia Dari Amilosa Dan Amilopektin ...8 Gambar 2. Jenis Reaksi Hidrolisis Yang Dikatalis Oleh Enzim Amilase ...13 Gambar 3. Konversi Amilum Menjadi Glukosa Oleh Enzim
α
danß Amilase ...14 Gambar 4. Rentang Suhu Lingkungan Yang Menggambarkan Keberadaan
Tempat Hidup Bakteri ...16 Gambar 5. Diameter Zona Bening Hasil Hidrolisa Pati oleh Enzim Amilase Isolat Bakteri Termofil Penen ...41 Gambar 6. Tiga Isolat Terpilih Berdasarkan Diameter Zona Bening Uji Iodin ...42
Gambar 7. Pengaruh Suhu Inkubasi Terhadap Aktifitas Enzim Amilase Kasar Isolat Bakteri Termofil Sumber Air Panas Penen Sibirubiru ...44 Gambar 8. Pengaruh pH Terhadap Aktifitas Enzim Amilase Kasar Isolat Bakteri Termofil Sumber Air Panas Penen ...50
DAFTAR LAMPIRAN
Nomor Judul Halaman
1. Isolasi Bakteri Dari Sampel Air Panas ...60
2. Uji Adanya Produksi Enzim Amilase Oleh Isolat Bakteri ...61
3. Karakterisasi Isolat Bakteri Penghasil Enzim Amilase ...62
4. Produksi Enzim Amilase Dan Ekstraksi Enzim Dari Kultur ...63
5. Pembuatan Larutan StandarGlukosa ...64
6. Pengukuran Pengaruh Suhu Inkubasi Terhadap Aktifitas Enzim Amilase Kasar ...65
7. Pengukuran Pengaruh pH Substrat Terhadap Aktifitas Enzim Amilase Kasar ...66
8. Pembuatan Larutan Blanko ...67
9. Hasil Uji Diameter Zona Bening Hidrolisa Pati...68
10. Analisis Varians Untuk Aktifitas Enzim ...69
11. Kurva Standart Glukosa ...72
12. Foto-Foto Pewarnaan Bakteri Isolat Penen ...73
BAB I
PENDAHULUAN
1.1. Latar Belakang MasalahEnzim dihasilkan oleh semua makhluk hidup untuk mengkatalis reaksi biokimia dalam tubuh mahluk hidup tersebut sehingga reaksi-reaksi itu dapat berlangsung lebih cepat. Enzim memegang peranan penting dalam dunia industri seperti industri tekstil, detergen, bahan pangan dan minuman, bahan kimia, obat-obatan dan industri kulit (Muchtadi et al., 1992). Produksi dan perdagangan enzim didominasi oleh kelompok enzim hidrolitik seperti amilase, protease, katalase dan lipase. Enzim untuk kebutuhan industri diekstraksi dari berbagai jenis sel mahluk hidup, tetapi pada saat ini enzim lebih banyak diekstraksi dari berbagai jenis mikroorganisma, sebab mikroorganisma menghasilkan enzim yang dapat dimanfaatkan manusia dalam jumlah dan jenis yang sangat bervariasi selain mikroorganismanya sendiri dapat dikulturkan untuk memperoleh enzim yang dihasilkannnya (Palmer, 1985).
Salah satu jenis enzim yang banyak dihasilkan oleh mikroorganisma adalah enzim amilase. Enzim amilase memiliki distribusi yang sangat luas dan merupakan salah satu jenis enzim yang paling banyak dipelajari baik di Indonesia maupun di luar Indonesia. Enzim ini memiliki aplikasi untuk skala yang sangat luas mulai dari industri tekstil sampai ke pengujian-pengujian yang sangat luas (Aiyer, 2005). Kebutuhan amilase di dunia sangat tinggi, pada tahun 2004 saja mencapai penjualan sekitar US $2 milyar, sedangkan amilase yang digunakan untuk industri makanan dan minuman pada tahun 2004 bernilai sekitar US $11
juta. Produksi amilase sendiri oleh Bacillus lichineformis dan Aspergillus sp sekitar 300 ton enzim murni pertahun (Sivaramkrisnan et al., 2000).
Enzim amilase digunakan dalam menghidrolisis berbagai jenis sumber amilum menjadi senyawa-senyawa sederhana seperti maltosa, glukosa dan produksi bioetanol yang memiliki nilai ekonomi lebih tinggi. Enzim amilase merupakan salah satu dari enzim hidrolitik yang dapat memecah ikatan-ikatan pada amilum hingga terbentuk maltosa (Poedjiadi, 1994). Pengetahuan tentang manfaat amilase yang berasal dari mikroba untuk hal yang bersifat komersial merupakan awal dari penggunaan enzim dalam industri beberapa dekade yang lalu (Walter & Nagesh, 1965).
Saat ini amilase yang bersumber dari mikroorganisma termofil dan hipertermofillebihbanyakdigunakandalambidangindustri,terutamaindustriyang menggunakan suhu tinggi dalam prosesnya. Hal ini terjadi karena enzim yang berasal dari mikroorganisma tersebut memiliki termostabilitas dan aktivitas yang tetap optimal pada suhu yang tinggi (Vieille & Zeikus, 2001).
Bakteri termofil penghasil enzim amilase dapat diisolasi dari berbagai tempat seperti sumber-sumber geotermal, daerah vulkanoik, pemandian mata air panas di darat maupun mata air panas di laut dalam dan juga dari proses pembuatan kompos (Brock, 1978). Bakteri termofil mampu hidup secara optimal di atas suhu 45oC, dengan struktur protein penyusun enzim yang tetap stabil atau tidak terdenaturasi oleh panas. Mikroorganisma ini sendiri tidak hanya bersifat toleran terhadap suhu lingkungannya yang bersifat ekstrim tetapi juga mampu
untuk bertahan hidup dan berkembangbiak pada kondisi suhu yang ekstrim tersebut (Brock, 1986).
Banyak penelitian yang dilakukan baik di Indonesia maupun di luar Indonesia untuk mencari dan mendapatkan informasi tentang bakteri termofil penghasil enzim amilase ini. Misalnya Hyun dan Zeikus (1985) berhasil
mengisolasi dan mengkarakterisasi sifat biokimia dari Clostridium
thermosulfurogenes yang diperoleh dari Octopus Hot Spring di Taman Nasional
Yellow Stone. Isolat ini menghasilkan enzim β-amilase yang memiliki aktivitas optimum pada suhu 75oC–80oC. Fu Shaw et al. (1995) berhasil mempurifikasi dan mendata sifat dari Thermus sp, penghasil enzim ekstraseluler α-amilase dari sedimen sumber air panas di Taman Nasional Yangmin Shan, Taiwan bagian Utara. Enzim amilase tersebut bekerja optimum pada suhu 70oC. Al-Qodah et al.
(2007), berhasil mendeterminasi parameter kinetik dari enzim amilase yang dihasilkan oleh Bacillus sphaericus yang berasal dari sumber air panas di Jordania, dengan suhu optimum aktivitasnya pada suhu 50oC. Hartuti (2006) berhasil mengisolasi dan mengkarakterisasi bakteri termofil penghasil amilase yang bersumber dari pemandian Air panas Pawan, Riau. Ternyata ada 24 isolat yang bersifat amilolitik. Diantara isolat tersebut 15 isolat berbentuk basil gram negatif, delapan isolat berbentuk basil gram positif sedangkan satu berbentuk kokus gram negatif. Semuanya memiliki suhu inkubasi optimum sebesar 50oC.
1.2. Permasalahan
Proses-proses kimia dalam bidang industri banyak yang berlangsung pada suhu yang relatif tinggi di atas 40oC. Agar proses reaksi berlangsung cepat dibutuhkan bantuan enzim, namun enzim yang digunakan harus bersifat stabil pada suhu yang tinggi tersebut. Banyak industri yang melibatkan bantuan enzim amilase terutama amilase termostabil dalam proses reaksi-reaksi kimianya, karena itu perlu dicari dan diteliti sumber-sumber di muka bumi yang dapat menghasilkan enzim amilase termostabil tersebut.
Indonesia merupakan negara pertanian yang mana hasil pertaniannya banyak berasal dari golongan karbohidrat. Hal ini tentu membutuhkan banyak enzim amilase untuk pengolahan hasil pertanian tersebut agar memiliki nilai ekonomi yang lebih tinggi dan lebih bermanfaat. Indonesia juga sebagai salah satu wilayah yang memiliki aktivitas vulkanoik dan sumber geotermal yang banyak, memiliki kesempatan untuk menghasilkan sumber-sumber mikroorganisma yang dapat memproduksi enzim amilase termostabil tersebut. Salah satu sumber geotermal itu adalah mata air panas yang cukup banyak tersebar di Indonesia termasuk di Sumatera Utara. Di Sumatera Utara sendiri terdapat sumber mata air panas yang banyak jumlahnya, salah satunya adalah sumber mata air panas Penen Sibirubiru yang ada di Kabupaten Deli Serdang. Untuk itu diharapkan dari sumber mata air panas Penen Sibirubiru tersebut dapat ditemukan mikroorganisme termofil terutama bakteri penghasil enzim amilase yang tetap memiliki aktivitas pada suhu tinggi.
1.3. Tujuan Penelitian
a. Untuk mendapatkan serta mengetahui karakter isolat bakteri termofil
yang memiliki potensi amilolitik dari sumberair panas PenenSibirubiru .
b. Untuk mengetahui potensi aktivitas enzim amilase termofil kasar
dari
isolat bakteri termofil di sumber air panas Penen Sibirubiru tersebut.
1.4. Hipotesis
a. Terdapat beberapa isolat bakteri termofil yang memiliki karakter berbeda serta mampu menghasilkan enzim amilase.
b. Terdapat perbedaan potensi aktifitas enzim amilase kasar yang dihasilkan bakteri termofil isolat Penen tersebut.
1.5. Manfaat Penelitian
a. Untuk mendapatkan isolat bakteri termofil penghasil enzim amilase yang hidup di sumber air panas Penen Sibirubiru dan data karakternya.
b. Untuk mengetahui berapa besar potensi aktivitas enzim amilase kasar yang dihasilkan oleh isolat bakteri termofil Penen tersebut.
c. Sebagai sumber informasi untuk penelitian lebih lanjut terhadap usaha
ekplorasi enzim amilase termofil.
1.6. Pembatasan Masalah
Berdasarkan masalah yang telah dirumuskan penelitian ini dibatasi pada isolasi bakteri dan karakterisasi yang dilakukan pada tingkat pengamatan
makroskopis, mikroskopis dan sifat biokimia dari isolat–isolat bakteri yang diperoleh serta pengujian aktivitas enzim amilase kasar lewat pengaruh variasi suhu inkubasi dan pH substrat yang berbeda.
BAB II
TINJAUAN PUSTAKA
2.1. AmilumAmilum adalah polimer karbohidrat dengan rumus molekul (C6H10O5)n.
Karbohidrat golongan polisakarida ini banyak terdapat di alam, terutama pada sebagian besar tumbuhan. Amilum dalam bahasa sehari-hari disebut juga pati terdapat pada umbi, daun, batang dan biji-bijian. Amilum merupakan kelompok terbesar karbohidrat cadangan yang dimiliki oleh tumbuhan sesudah selulosa (Liu, 2005). Butir-butir pati apabila diamati dengan mikroskop ternyata berbeda-beda bentuknya dan ukurannya tergantung dari tumbuhan apa pati tersebut diperoleh (Poedjiadi, 1994).
Amilum disusun oleh dua kelompok polisakarida yaitu amilosa (Gambar 1.), kira kira 20–28% dan amilopektin sebagai sisanya (Poedjiadi, 1994). Baik amilosa maupun amilopektin memiliki monomer yang sama yaitu molekul glukopiranosa. Amilosa terdiri dari 100-10000 unit -D-glukopiranosa per molekulnya, yang tiap unitnya berikatan lewat ikatan α-1,4 glikosida (Liu, 2005). Tiap rantai polimer molekulnya memiliki satu ujung gula tereduksi dan satu ujungnya lagi gula non reduksi sehingga molekul amilosa merupakan rantai terbuka (Poedjiadi, 1994).
Amilosa merupakan bagian terdepan dari rantai amilum, bersifat larut dalam air yang dipanaskan dan dapat membentuk endapan dalam air, yang sifatnya tidak dapat balik (Aiyer, 2005). Amilopektin merupakan rantai molekul polisakarida yang memiliki banyak percabangan. Molekul D-glukopiranosa yang
menjadi unit monomernya yang berikatan lewat ikatan α-1,4 glikosida seperti pada amilosa yang membentuk rantai lurus dan ikatan α-1,6 glikosida yang membentuk percabangan pada rantai amilopektin tersebut (Murray et al., 2003). Molekul amilopektin lebih besar dari molekul amilosa dengan berat moleklunya berkisar antara 106–109 g permolnya (Liu, 2005). Molekul amilosa merupakan molekul yang larut dalam air dan memberikan warna biru apabila tercampur dengan larutan iodin, sedang amilopektin merupakan molekul yang tidak larut dalamairdan akan kelihatan berwarna merah bila terkena iodin (Sale, 1961).
Butir-butir pati tidak larut dalam air dingin, tetapi apabila suspensi dalam air dipanaskan terbentuk suatu larutan koloid yang kental. Bila pati dipanaskan dan didilusi dengan asam, pati akan terhidrolisis menjadi dekstrin, maltosa dan
D-glukosa (Sale, 1961). Semua hasil hidrolisis ini memiliki sifat yang larut dalam air. Hidrolisis dari pati juga dapat terjadi dengan bantuan enzimamilase yang akan mengubah amilum menjadi maltosa dalam bentuk β-maltosa (Poedjiadi, 1994 ).
Gambar1.Struktur kimiadari(a)Amilosa,(b)Amilopektin (Murray et al., 2003)
Dalam kehidupan manusia amilum berperan sebagai sumber makanan penghasil energi utama dari golongan karbohidrat, disamping itu amilum juga dapat berperan sebagai bahan aditif pada proses pengolahan makanan, misalnya sebagai penstabil dalam proses pembuatan puding. Amilum juga berperan dalam pembuatan sirup dan pemanis buatan seperti sakarin. Dalam bidang non makanan, amilum digunakan untuk bahan baku dalam proses pembuatan kertas, pakaian dari katun, industri cat, maupun untuk produksi hidrogen. Tabel 1. di bawah ini menunjukkan peran amilum di berbagai bidang.
Tabel 1. Penggunaan amilum di bidang industri (Liu, 2005) Jenis Industri Penggunaan Amilum/ Amilum Termodifikasi Makanan Pengental, pelapis makanan, film makanan Bahan perekat Pembuat lem
Kertas dan papan Kertas penjilid, pembungkus,pengepak Textil Dalam proses sizing, finishing dan printing
Farmasi Kapsul obat, bahan pelarut obat Pengeboran minyak Modifikasi pengental
Detergen Surfaktan, bahan pensuspensi, bahan pemutih, aktivator pemutih
Kimia pertanian Pemungkus biji, pembungkus pestisida,benang pintal
Plastik Pembungkus makanan, filler Kosmetik Bedak dan talk
Purifikasi Flokulan
Bidang Medis Scaffold, plasma eksterder, produk absorben untuk sanitasi
2.2. Enzim
Enzim merupakan protein khusus yang dapat bergabung dengan suatu substrat spesifik untuk mengkatalisasi reaksi biokimia dari substrat tersebut (Maier et al., 2000). Dalam reaksi tersebut enzim mengubah senyawa yang
disebut substrat menjadi bentuk suatu senyawa baru yang disebut produk. Enzim memiliki substrat spesifik dan reaksi kimia yang spesifik untuk dikatalisnya (Palmer, 1985). Aktivitas enzim dipengaruhi oleh suhu, pH dari lingkungan tempat enzim bekerja, konsentrasi substrat, aktivator dan inhibitor enzim.
Suhu bepengaruh besar terhadap aktivitas enzim. Semua enzim bekerja dalam rentang suhu tertentu pada tiap jenisorganisma.Peningkatansuhueksternal secara umum akan meningkatkan kecepatan reaksi kimia enzim, tetapi kenaikan suhu yang terlalu tinggi akan menyebabkan terjadinya denaturasi enzim yaitu kerusakan struktur protein enzim, terutama kerusakan pada ikatan ion dan ikatan hidrogennya. Hal ini menyebabkan terjadinya penurunan kecepatan reaksi yang dikatalis oleh enzim tersebut. Denaturasi enzim di atas suhu optimum akan menyebabkan terjadinya kematian pada sel organisma, tetapi beberapa organisma mampu bertahan hidup dan tetap aktif pada suhu yang sangat tinggi, dimana organisma lain sudah tidak mampu lagi hidup seperti bakteri dan alga yang ditemukan pada sumber-sumber air panas di taman Nasional Yellow Stone Amerika, suhu optimum untuk hidupnya sebesar 70oC (Brock & Brock, 1978). Selain suhu aktivitas enzim dipengaruhi oleh pH lingkungan tempat enzim tersebut bekerja. Banyak enzim yang sensitif terhadap perubahan pH dan setiap enzim memiliki pH optimum untuk aktivitasnya. Perubahan pH dapat menyebabkan berhentinya aktivitas enzim akibat proses denaturasi pada struktur tiga dimensi enzim (Palmer, 1985). Umumnya enzim bekerja optimum pada rentang pH 6-8, tetapi beberapa jenis organisma dapat hidup pada pH yang lebih
rendah yang dikenal dengan istilah asidofil ataupun pada pH yang lebih tinggi yang dikenal dengan istilah alkalifil.
Aktivitas enzim di lingkungan juga terjadi pada berbagai sumber mikroorganisma seperti bakteri, jamur dan aktinomisetes. Mikroorganisma ini menghasilkan enzim intraseluler dan enzim ekstraseluler. Enzim intraseluler merupakan enzim yang langsung digunakan di dalam sel, dan sering ditemukan pada bagian membran dari sebuah organel sel. Enzim ekstraseluler merupakan enzim yang dilepas dari sel ke lingkungan untuk menghidrolisis molekul polimer di lingkungan, seperti selulosa, hemiselulosa, lignin, ataupun juga untuk memfasilitasi pengambilan suatu zat dari lingkungan bagi kebutuhan metabolismanya (Maier et al., 2000). Enzim ekstraseluler dapat dipisahkan dari lingkungan dengan filtrasi ataupun sentrifugasi (Palmer, 1985), sedangkan enzim intraseluler dapat diekstrak dari dalam sel lewat proses pemecahan sel.
2.3. Enzim Amilase
Amilase adalah kelompok enzim yang memiliki kemampuan untuk memutuskan ikatan glikosida yang terdapat pada molekul amilum. Hasil hidrolisis atau pemecahan molekul amilum ini adalah molekul-molekul yang lebih kecil seperti maltosa, dekstrin dan terutama molekul glukosa sebagai unit terkecil (Reddy et al., 2003). Amilase dihasilkan oleh berbagai jenis organisma hidup, mulai dari tumbuhan, hewan, manusia bahkan pada mikroorganisma seperti bakteri dan fungi. Kelompok enzim ini memiliki banyak variasi dalam aktivitasnya, sangat spesifik, tergantung pada sumber organismanya dan
tempatnya bekerja. Enzim amilase memiliki nama asli diastase dan pertama kali ditemukan dan diisolasi oleh Anselme Payen pada tahun 1833. Seiring dengan penemuan-penemuan baru di bidang penelitian kelompok enzim amilase yang dapat mendegradasi amilum dan senyawa polisakarida lainnya juga semakin bertambah jumlahnya. Menurut Aiyer (2005), Hagihara et al. (2001) beberapa kelompok enzim amilase tersebut adalah:
a. Alpha amilase (α –amilase), EC.3.2.1.1
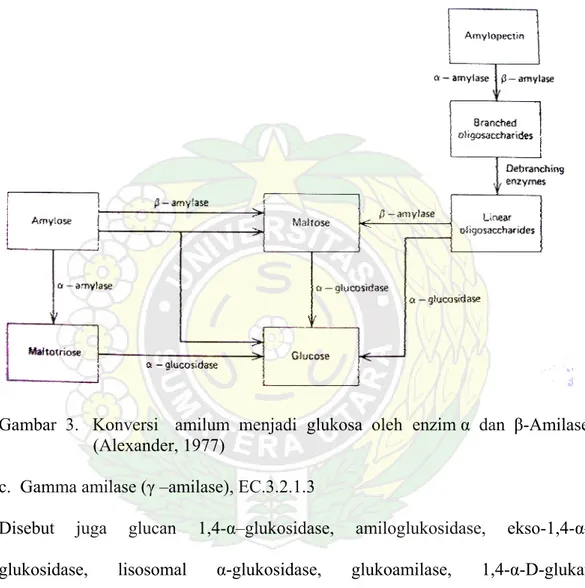
Disebut juga dengan 1,4–α-D-glukan glukanohidrolase atau glukogenase. Enzim ini bekerja memutus ikatan α-1,4 glikosida pada amilum secara acak terutama pada rantai yang panjang (Gambar 2.) sehingga menghasilkan maltotriosa dan maltosa dari polimer amilosa pada amilum (Gambar 3.), dan menghasilkan glukosa dan sedikit dekstrin dari polimer amilopektin penyusun amilum. Karena sifatnya yang dapat memutus ikatan glikosida secara acak, enzim ini bekerja lebih cepat dibanding amilase lainnya terutama β-amilase. Pada kelompok hewan α–
amilase merupakan enzim pencerna amilum yang utama. Enzim α–amilase
merupakan kelompok metaloenzim yang tidak dapat bekerja sama sekali bila ion calsium tidak ada (Palmer, 1985). α–Amilase merupakan jenis enzim yang bersifat calcium metalloenzyme dependent.
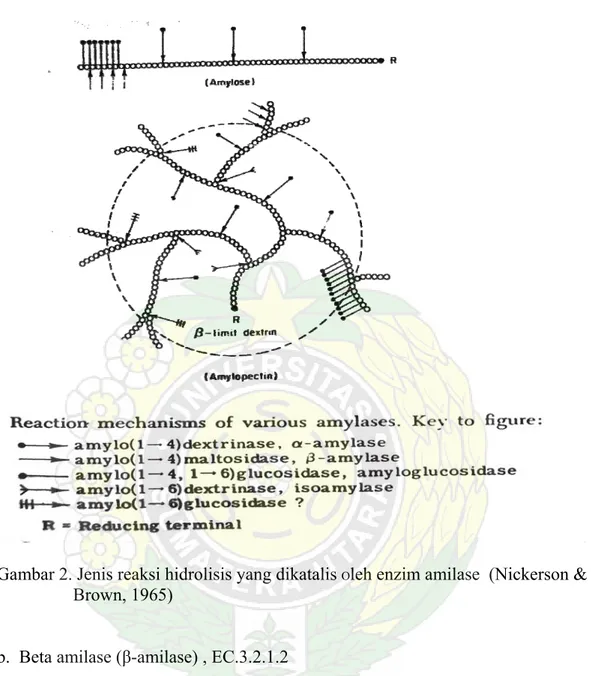
Gambar 2. Jenis reaksi hidrolisis yang dikatalis Oleh enzim amilase (Nickerson &
Brown, 1965)
b. Beta amilase (β-amilase) , EC.3.2.1.2
Disebut juga 1,4–α-D-glukan maltohidrolase ataupun sakarogen amilase. Enzim ini dijumpai pada kelompok tumbuhan, bakteri dan fungi. Enzim ini bekerja menghidrolisis amilum dari bagian ujung non reduksi dan menghidrolisis ikatanα -1,4 glikosida pada tahap kedua hidrolisis amilum sehingga terbentuk molekul maltosa yang disusun oleh dua unit glukosa pada saat yang sama setelah -amilase bekerja. Selama proses pematangan buah β-amilase bekerja memecah amilum menjadi gula sehingga buah yang matang terasa manis. Jaringan hewan
tidak menghasilkan enzim β-amilase, kecuali bila ada mikroorganisma yang bersimbiosis di saluran pencernaannya. Produk akhir dari hasil hidrolisa enzim -amilase dan β-amilase ini dapat di β-amilase lihat pada Gambar 3.
Gambar 3. Konversi
amilum menjadi glukosa oleh enzim α dan β-Amilase (Alexander, 1977)
c. Gamma amilase (γ –amilase), EC.3.2.1.3
Disebut juga glucan 1,4-α–glukosidase, amiloglukosidase, ekso-1,4-α–
glukosidase, lisosomal α-glukosidase, glukoamilase, 1,4-α-D-glukan
glukohidrolase. Merupakan pemutus terakhir ikatan glikosida pada bagi ujung non reduksi dari amilosa dan amilopektin untuk menghasilkan unit glukosa.
d. Pullulanase, EC.3.2.1.41
Merupakan enzim pemutus cabang, menghidrolisis hanya pada ikatan α-1,6 glikosida, seperti pullulan 6-glukanohydrolase.
e. α-Glukosidase,EC.3.2.1.20
Memutus ikatan α-1,4 glikosida dari molekul amilosa ataupun amilopektin menjadi rantai-rantai pendek oligosakarida.
f. Enzim Penghasil Siklodekstrin
Enzim yang dapat menghidrolisis amilum menjadi jenis siklik D-glukosil non reduksi yaitu suatu jenis polimer yang disebut siklodekstrin atau sakhardinger dekstrin. Jenis ini dijumpai misalnya pada amilase yang dihasilkan oleh Bacillus macerans.
Berdasarkan arahnya memutus ikatan glikosida dari amilum, maka enzim amilase dapat dikategorikan menjadi 2 kelompok (Reddy et al., 2003) yaitu endoamilase dan ektoamilase. Endoamilase melakukan hidrolisis secara acak
dari bagian depan molekul amilum sehingga menghasilkan molekul
oligosakarida dalam bentuk rantai lurus maupun bercabang dengan panjang rantai yang bervariasi sedangkan ektoamilase melakukan hidrolisis dari ujung non reduksi dan dengan produk akhir molekul yang pendek.
Enzim amilase secara konstitusi merupakan kelompok enzim yang sangat dibutuhkan dalam bidang industri, dengan pangsa pasar mencapai hampir 25% dari pasaran enzim di dunia (de Carvalho et al., 2008). Penggunaan enzim amilase dalam industri sangat luas mulai dari industri pembuatan roti, sirup, pemanis, campuran oligosakarida, dekstrin, industri textil, pembuatan ethanol, pengujian limbah cair yang mengandung amilum, industri detergen, industri obat dan suplemen enzim (Palmer, 1985). Karena enzim ini sangat bernilai komersil maka
perlu ditemukan banyak sumber-sumber penghasil enzim amilase dengan karakteristik yang sesuai dengan yang dibutuhkan.
2.4. Bakteri Termofil
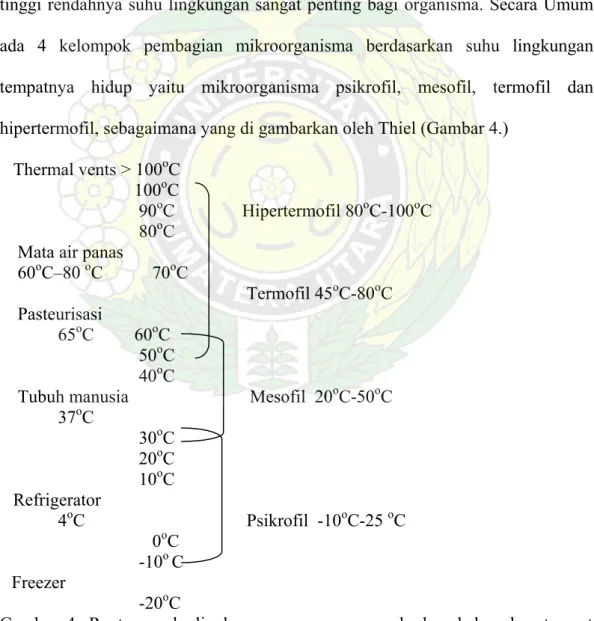
Suhu merupakan salah satu faktor penting di lingkungan yang mengontrol aktivitas dan evolusidariorganisma hidup (Brock, 1978). Tidak semua tingkatan suhu cocok bagi pertumbuhan dan reproduksi dari organisma. Dengan demikian tinggi rendahnya suhu lingkungan sangat penting bagi organisma. Secara Umum ada 4 kelompok pembagian mikroorganisma berdasarkan suhu lingkungan tempatnya hidup yaitu mikroorganisma psikrofil, mesofil, termofil dan hipertermofil, sebagaimana yang di gambarkan oleh Thiel (Gambar 4.)
Thermal vents > 100oC 100oC
90oC Hipertermofil 80oC-100oC 80oC
Mata air panas 60oC–80 oC 70oC Termofil 45oC-80oC Pasteurisasi 65oC 60oC 50oC 40oC
Tubuh manusia Mesofil 20oC-50oC
37oC 30oC 20oC 10oC Refrigerator 4oC Psikrofil -10oC-25 oC 0oC -10o C Freezer -20oC
Gambar 4. Rentang suhu lingkungan yang menggambarkan keberadaan tempat
hidup mikroorganisma (Thiel, 1999)
Ada empat peristiwa yang menjadi penyebab lingkungan bersuhu
tinggi yaitu sinar matahari, pembakaran, letusan gunung api, peluruhan
radioaktif dan aktifitas geotermal di perut bumi (Brock, 1978). Dengan
ditemukannya mikroorganisma yang memiliki kemampuan untuk hidup pada
suhu yang relatif tinggi (60oC atau lebih) konsep tentang daya tahan dan kestabilan protoplasma sel untuk bertahan pada batas limit suhu 42oC – 45oC perlu dipikirkan kembali. Istilah termofil pertama kali dipergunakan oleh Miquel
pada tahun 1879, untuk menggambarkan organisma yang dapat berkembang
pada lingkungan dengan suhu tinggi pada saat mana bagi organisma lain sudah tidak dapat hidup (Morrison & Tanner, 1921).
Menurut klasifikasi fisiologis yang dibuat Gilter dijelaskan
organisma termofil memiliki suhu minimum untuk hidupnya sebesar 45oC,
optimum 55oC dan maksimum 70oC. Muir dan Rikhie mendefinisikan bakteri termofil merupakan organisma yang tumbuh sangat baik pada suhu 60oC– 70oC, sedangkan Hiss dan Zinsser menyatakan bakteri termofilik merupakan bakteri yang didapatkan dari sumber air panas ataupun lapisan bagian paling atas dari permukaan tanah (Morrison & Tanner, 1921). Bakteri termofil juga merupakan kelompok mikroorganisma yang dapat ditemukan di lingkungan yang sangat bervariasi kondisinya serta tetap eksis pada suhu tinggi dengan sifat obligat, fakultatif maupun termotoleran (Singleton & Amelunxen, 1973). Spesies termofil paling banyak ditemukan pada kelompok bakteri dan dapat tetap hidup pada keadaan aerob, anaerob fakultatif dan anaerob.
Kelompok bakteri termofil tergolong dalam kelompok Archaebacteria yang secara umum struktur selnya memiliki beberapa kelebihan dibanding kelompok bakteri lainnya. Kelompok ini umumnya memiliki daya adaptasi yang sangat tinggi terhadap kondisi lingkungan yang bersifat ekstrim seperti temperatur, kadar garam, pH, tekanan dan oksigen dimana mikroorganisma lain tidak dapat mempertahankan aktifitas hidupnya (de Rosa et al., 1986).
Kemampuan hidup dari mikroorganisma termofil ini berhubungan dengan struktur selnya yang memiliki kelebihan dalam beberapa hal, yaitu :
a. Struktur membran sel
Membran sel setiap mahluk hidup tersusun atas senyawa lipid dan protein yang disebut lipoprotein. Pada umumnya bagian lipid dari membran sel mahluk hidup dihubungkan oleh ikatan ester, sedangkan pada organisma termofil senyawa lipid membran selnya mengandung ikatan eter yang terbentuk lewat proses kondensasi dari gliserol atau senyawa poliol kompleks lainnya dengan alkohol isoprenoid yang mengandung 20, 25 atau 40 atom karbon (de Rossa et al., 1986). Lebih jauh lagi senyawa eter gliserol pada Archaebacteria ini mengandung 2,3 О
-sn-gliserol yang menyebabkan struktur lipoprotein dari membran sel termofil
tersebut lebih stabil. b. Struktur Protein
Chaperonin merupakan suatu jenis protein yang merupakan jenis protein
yang tidak umum dijumpai pada protein-protein fungsional lainnya di dalam sel. Protein ini berperan dalam mempertahankan kembali struktur tiga dimensi dari protein fungsional sel dari denaturasi suhu lingkungan yang bersifat ekstrim.
Protein ini memiliki struktur yang tetap stabil, tahan terhadap denaturasi dan proteolisis (Kumar & Nussinov, 2001). Protein ini dapat membantu organisma termofil mengembalikan fungsi aktifitas enzimnya bila terdenaturasi oleh suhu yang tinggi (Everli & Alberto, 2000). Chaperonin tersusun oleh molekul yang disebut chaperone, yang membentuk struktur chaperonin seperti tumpukan kue donot pada sebuah drum. Tiap cincin donat ini terdiri atas 7, 8 atau 9 subunit chaperone tergantung jenis organismanya. Dalam aktivitasnya mempertahankan struktur protein fungsional agar tetap stabil, chaperonin membutuhkan molekul ATP.
c. Struktur DNA Gyrase
DNA gyrase merupakan salah satu anggota kelompok enzim topoisomerase yang berperan dalam mengontrol topologi DNA suatu sel dan memegang peran penting dalam proses replikasi dan transkripsi DNA. Semua jenis topoisomerase dapat merelaksasikan DNA tetapi hanya DNA gyrase yang dapat mempertahankan struktur DNA tetap berbentuk supercoil ( Maxwell, 1999). DNA gyrase disusun oleh 90-150 pasangan basa-N DNA. DNA gyrase ini juga selalu dijumpai pada organisma yang hidup di lingkungan di atas 70oC dan juga
dapat dijumpai pada organisma yang hidup pada suhu sekitar 60oC. DNA ini merupakan salah satu kelengkapan sel dari organisma termofil (D’ Amaro et al.,
2007).
2.5. Amilase dari Mikroorganisma
Enzim yang digunakan untuk keperluan industri sebagian besar diisolasi dari mikroba. Pemilihan mikroba sebagai sumber enzim mempunyai beberapa
keuntungan bila dibandingkan dengan enzim yang diisolasi dari tumbuhan maupun hewan. Keuntungan itu antara lain sel mikroba lebih mudah untuk ditumbuhkan dan kecepatan pertumbuhannya relatif lebih cepat, skala produksi sel lebih mudah ditingkatkan apabila dikehendaki produksi yang lebih besar, biaya produksinya relatif lebih murah, kondisi selama produksi tidak tergantung oleh adanya perubahan musim dan waktu yang dibutuhkan dalam proses produksi lebih singkat (Poernomo, 2003).
Amilase secara umum diproduksi oleh tumbuhan, hewan, manusia dan mikroba, tetapi enzim amilase yang berasal dari fungi dan bakteri mendominasi penggunaan enzimamilasedibidangindustri.Beberapadari jenis Bacillus sp. dan
Actinomycetes, termasuk Termomonospora dan Thermoactinomycetes merupakan
kelompok yang memiliki kemampuan besar dalam meproduksi enzim amilase,
Bacillus licheniformis memiliki kemampuan untuk menghasilkan enzim amilase
dalam kondisi lingkungan yang bersifat alkalis (Reddy et al., 2003)
Enzim amilase yang dihasilkan oleh mikroba terutama dari bakteri, merupakan jenis enzim ekstraseluler (Palmer, 1985). Bakteri menghasilkan enzim ini di dalam sel dan menggunakannya di luar sel, yaitu untuk menghidrolisis sumber makanan yang mengandung amilum yang terdapat di lingkungannya. Molekul amilum tidak dapat masuk ke dalam sel bakteri karena ukurannya sangat besar, karena itu molekul amilum dihidrolisis terlebih dahulu oleh enzim amilase ekstraselular menjadi molekul karbohidrat yang lebih sederhana dan kecil ukuran molekulnya. Molekul hasil hidrolisis amilum oleh enzim amilase tersebut
selanjutnya akan ditransport masuk ke dalam sel bakteri dan digunakan sebagai sumber karbon bagi aktivitas pertumbuhan dan kehidupannya (Benson, 1994). Enzim amilase ekstraseluler yang dihasilkan bakteri maupun fungi tersebut dimanfaatkan sebagai katalisator dalam industri maupun untuk keperluaan dalam bidang kesehatan (Tabel 2.). Untuk mendapatkan enzim amilase dari mikroba tersebut maka kultur mikroba yang memproduksi enzim amilase ekstraseluler tersebut disentrifugasi untuk mendapatkan supernatan yang mengandung enzim amilase ekstraselular (Palmer, 1985).
Tabel 2. Enzim amilase dari mikroorganisma dan aplikasinya pada bidang industri (Brock & Brock, 1978)
Enzim Sumber Aplikasi Industri
Fungi Pembuatan roti Roti
Bakteri Pembungkus kertas Kertas
Fungi Pabrik sirup dan glucosa Makanan
Bakteri Binatu Amilum
Fungi Obat pencernaan Farmasi
Amilase
Bakteri Pembersih pakaian Tekstil
2.6. Amilase dari mikroba termofil
Enzim hidrolitik yang dihasilkan oleh mikroorganisma termofil merupakan salah satu kelompok yang menarik perhatian untuk dipelajari (Cordeiro et al., 2002). Enzim dari mikroorganisma termofil ini memiliki nilai komersial yang cukup tinggi dalam bidang industri karena memiliki daya termostabilitas yang tinggi, stabil terhadap zat-zat yang bersifat dapat mendenaturasi enzim seperti detergen dan senyawa organik lainnya, stabil dalam
kondisi lingkungan yang asam maupun alkalis, sangat cocok untuk proses fermentasi di bidang industri (www.osmania.ac.in). Kelebihan-kelebihan ini menjadikan enzim yang berasal dari mikroorganisma termofil semakin berkembang penggunaannya dalam bidang industri dan bioteknologi.
Konsep tentang termostabilitas yang dimiliki oleh enzim yang berasal dari mikroorganisma termofil ini dilandaskan pada dua konsep yaitu pertama struktur molekular pada selnya yang memang tersusun oleh molekul protein yang termostabil, kedua termostabilitas itu berkaitan dengan adanya asosiasi senyawa protein enzim dengan molekul lainnya seperti lipid, polisakarida maupun protein lainnya yang menyebabkan terbentuknya suatu senyawa yang memiliki mekanisma yang memungkinkannya tetap stabil saat menghadapi kondisi yang dapat menginaktivasinya (Hibino et al., 1974).
Hampir 70% sektor industri yang menggunakan enzim dalam prosesnya memanfaatkan enzim yang berasal dari mikroorganisma termofil. Industri detergen misalnya menggunakan protease yang bersifat tahan suasana alkalis, industri amilum menggunakan enzim amilase, amiloglukosidase dan glukoisomerase yang berasal dari mikroorganisma termofil.
Amilase termostabil digunakan dalam skala yang cukup luas pada proses industri. Enzim amilase yang digunakan tersebut berkisar pada -amilase, ß-amilase, glukoß-amilase, pullulanase dan jenis lainnya (Illanes, 1999). Diantara semua jenis enzim amilase, -amilase dari mikroorganisma termofil ini memiliki nilai aplikasi komersil yang paling tinggi dalam bidang industri makanan, minuman, pembuatan sirup yang mengandung glukosa, maltosa maupun
oligosakarida.
-Amilase pertama sekali diisolasi dari isolat Bacillusamyloliquefaciens dan digunakan dalam bidang industri selama bertahun-tahun
(Cordeiro et al., 2002), tetapi penemuan enzim amilase termostabil dari isolat
Bacillus licheniformis ternyata menunjukkan adanya termostabilitas yang lebih
tinggi sekitar 10-20oC dibandingkan dari amilase termostabil pada B.
amyloliquefaciens (Rath & Subramanyam, 1998). Selanjutnya enzim–enzim
amilase termostabil juga berhasil didapatkan dari mikroorganisma seperti B.
subtilis, B. stearothermophilus, B. calcalovelox, B. alcalophilus, Thermus sp.,
Clostridium acetobutylicum, Pyrococcus furiosus, Sulfolobus acidocaldarius, dan
lainnya. Selain yang dihasilkan oleh bakteri ternyata beberapa kelompok fungi
seperti Aspergillus oryzae, A. niger dan Saccharomyces castelli juga
menghasilkan amilase termostabil, demikian juga halnya dengan kelompok
Aktinomisetes seperti Thermomyces vulgaris, Streptomyces thermoviolaceaus
memproduksi amilase yang bersifat termostabil (Rath & Subramanyam, 1998). Akhir-akhir ini penelitian terhadap mikroorganisma termofil penghasil enzim amilase termostabil telah diarahkan bukan hanya yang bersifat temofil saja tetapi juga hipertermofil (mampu hidup di atas suhu 80oC) seperti amilase yang didapatkan pada Pyrococcus furiosus, Pyrococcus woesei yang memiliki aktifitas katalitik sampai 130oC (Carolina, 1999). Pada umumnya mikroba-mikroba termofil tersebut dijumpai di sumber-sumber air panas, daerah aktifitas gunung berapi, maupun di dasar laut yang memiliki sumber mata air panas.
Adapun faktor-faktor yang dianggap berhubungan dengan termostabilitas enzim-enzim dari mikroorganisma termofil bervariasi pada berbagai spesies
termofil, namun beberapa hal umum yang ditemukan antara lain terjadinya peningkatan ikatan hidrogen dan salt bridge pada protein dari enzim termofik. Selain itu ditemukan juga adanya perbedaan jenis dan komposisi asam amino penyusun protein enzim termofil bila dibandingkan dengan protein enzim yang mesofilik. Pada enzim temofilik terjadi penurunan jumlah sistein dan serin secara nyata, sedangkan jumlah arginin dan tirosin meningkat secara nyata. Asam amino prolin juga lebih sedikit ditemukan pada struktur -heliks pada protein termofilik (Kumar et al., 20000).
2.7. Sumber Air Panas Penen Sibirubiru
Manifestasi panas bumi di permukaan adalah sebagai indikasi adanya aktifitas panas bumi di bawah permukaan tersebut. Bentuk manifestasi aktifitas panas bumi di dalam perut bumi itu dapat berupa munculnya mata air panas, munculnya bualan gas ke permukaan tanah, fumarola, solfatara dan tanah panas. Mata air panas yang muncul ke permukaan ini dapat mengandung klorida, bikarbonat ataupun sulfat.
Sumber air panas meskipun memiliki suhu cukup tinggi ternyata dapat dijadikan untuk lingkungan tempat kehidupan bagi beberapa mikroorganisma yang tahan terhadap suhu air yang panas tersebut, seperti bakteri, fungi maupun alga yang bersifat termofil. Sumber air panas selain memiliki air yang suhunya cukup tinggi juga memiliki suatu aroma khas yaitu berupa aroma hidrogen peroksida (H2S) yang berasal dari aktifitas bakteri anaerob yang menggunakan
Sumber mata air panas Penen Sibirubiru terletakdi desa Penen Kecamatan Sibirubiru Kabupaten Deli Serdang Propinsi Sumatera Utara. Tepatnya berada di posisi geografis 03o 18’ 02,7” LU dan 98o 38’ 53,3” BT. Memiliki suhu air sekitar 47oC sampai 57o C, dengan pH air berkisar netral 6,8.
BAB III
METODE PENELITIAN
3.1. Waktu dan TempatPenelitian ini dilakukan dari bulan Februari 2008 sampai Juli 2008 bertempat di Laboratorium Mikrobiologi Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara.
3.2. Bahan dan Alat
Bahan utama yang digunakan dalam penelitian ini adalah media agar untuk seleksi bakteri termofil, media agar untuk seleksi bakteri amilolitik, kristal violet, aquadest, gram iodin, alkohol, safranin, malachit green, reagen DNS, sitrat buffer phosphat, glukosa monohidrat, NaOH, larutan iodin, media untuk produksi enzim amilase. Alat yang digunakan adalah botol sampel steril, termometer, pH meter (Hanna Instrument), timbangan analitik, hoki stik, shakerwaterbath (Julabo Sw22), vortex, waterbath (Griffin), bunsen, pipet serologi, propipet, mikropipet (Gilson), jarum ose, tabung uji, sentrifuge, petridish, erlenmeyer, tabung reaksi, otoklaf (Yamato), inkubator (Fisher), oven (Gallenkamp), gelas benda, mikroskop lanjutan, kamera foto digital, spektofotometer.
3.3. Sampel Percobaan
Sampel percobaan dalam hal ini adalah isolat-isolat bakteri termofil
penghasil enzim amilase, yang didapat dari kolam sumber air panas yang ada di sumber mata air panas Penen Sibirubiru.
3.4. Pengambilan Sampel Air Panas
Sampel air panas diambil dari sumber mata air panas, masing-masing pada 3 tempat yang berbeda. Sebelum sampel air diambil terlebih dahulu dilakukan pengukuran parameter fisika dan kimia di lapangan kerja. Parameter yang diukur pertama adalah suhu air di tiap titik pengambilan dengan menggunakan termometer yang dicelupkan selama 3 menit ke dalam tiap bagian tempat pengambilan sampel dan di catat suhunya. Parameter kedua adalah pH air di tiap titik pengambilan diukur dengan pH meter yang dicelupkan ke permukaan air lalu angka pH yang tertera dicatat. Sampel air diambil dari bagian kolam dengan kedalaman 50 cm dari permukaan air. Sampel air diambil sebanyak 200 ml dari tiap tempat dan dimasukkan ke dalam botol steril dan diberi label. Selanjutnya sampel air di bawa ke Laboratorium Mikrobiologi Departemen Biologi Fakultas MIPA Universitas Sumatera Utara, untuk dilakukan isolasi.
3.5. Isolasi Bakteri dan Pemurnian Bakteri
Media yang digunakan untuk mengisolasi bakteri termofil adalah Luria agar (ekstrak yeast 5 g, tripton 5 g, NaCl 5 g, tepung agar 5 g dalam 1 liter aquadest) disterilkan, dituang pada petri steril. Setelah media padat sebanyak 0,1 ml sampel air panas disebar dengan hoki stik pada permukaan agar, diinkubasi selama 48 jam pada suhu 65oC. Tiap sampel air panas dibuat ulangannya 2 kali.
Untuk pemurnian bakteri, tiap koloni bakteri yang tumbuh berbeda pada kultur sebelumnya diambil satu ose dan digores ke tiap cawan petri lain yang mengandung media agar selektif amilolitik (Yeast ekstrak 0,2 %, pepton 0,5 %,
NaCl 0,05 %, MgSO4 0,05%, CaCl2 0,015%, tepung agar 2 % dan soluble pati
1%), diinkubasi selama 24 jam pada suhu 65oC. Hal ini dilakukan untuk
mendapatkan biakan tunggal tiap jenis bakteri termofil penghasil amilase yang hidup pada sumber air panas Penen. Setiap isolat murni yang dapat tumbuh diasumsikan dapat menggunakan media yang mengandung pati tersebut. Untuk memastikannya dilakukan uji iodin dengan cara meneteskan iodin pada permukaan agar yang berisi isolat, bila terdapat zona bening pada media mengindikasikan enzim amilase diproduksi oleh isolat sehingga di daerah tersebut amilum sudah dihidrolisis (Cappucino, 1983), sedangkan media yang berwarna biru kehitaman menandakan pati di tempat itu belum terhidrolisis. Sebelum pengujian tiap isolat disiapkan dulu stok kulturnya pada media miring. Hal ini perlu dilakukan karena uji iodin membuat isolat bakteri mati karena larutan iodin bersifat desinfektan (Pelczar & Chan, 1988).
3.6. Pembuatan Stok Kultur
Stok kultur disiapkan dengan cara menggores satu ose dari tiap isolat bakteri yang tumbuh di kultur pemurnian sebelumnya, dalam bentuk media miring dengan komposisi media sama seperti media pemurnian isolat. Kultur diinkubasi selama 24 jam pada suhu 65oC, selanjutnya disimpan di kulkas untuk stok isolat. Stok kultur ini diremajakan sekali dalam 3 minggu.
3.7. Uji Diameter Zona Bening Hasil Hidrolisis Pati
Isolat bakteri disuspensikan dalam larutan NaCl fisiologis sampai kekeruhannya sama dengan kekeruhan Larutan Mac Farland 0,5 standart yang setara dengan 108 CFU. Dari tiap suspensi bakteri diambil 5 µl suspensi dengan menggunakan mikropipet, lalu diteteskan dengan tepat pada bagian tengah cawan petri yang sudah berisi media agar pati yang disterilkan. Kultur diinkubasi selama 72 jam pada suhu 65oC. Tiap isolat bakteri yang tumbuh pada media pati tersebut ditetesi dengan larutan iodin untuk melihat kemampuan daya amilolitiknya. Isolat yang menghasilkan enzim amilase menghasilkan zona bening pada agar di sekitar koloninya jika ditetesi dengan larutan iodin. Lebar zona bening yang terbentuk diukur dengan menggunakan jangka sorong (Hartuti, 2006). Tiga isolat terbesar zona beningnnya selanjutnya digunakan dalam penelitian ini untuk pengujian parameter aktifitas enzim amilase kasar.
3.8. Karakterisasi Morfologi Bakteri Penghasil Enzim Amilase Termofil
Morfologi isolat bakteri penghasil amilase diamati pada kultur isolat yang dimurnikan. Pengamatan morfologi dari tiap isolat meliputi warna koloni, bentuk koloni dilihat dari atas, permukaan koloni dilihat dari samping dan tepi koloni dilihat dari atas (Cappuccino, 1983).
3.9. Karakterisasi Bakteri Penghasil Amilase Secara Mikroskopis
Pewarnaan gram dilakukan dengan mengambil satu ose isolat bakteri, diletakkan pada kaca objek yang ditetesi 1 tetes air, disebar, kemudian difiksasi dengan memanaskannya di atas lampu bunsen. Pewarnaan dilakukan dengan kristal violet dengan memiringkan gelas objek. Setelah 1 menit dibilas dengan air perlahan, kemudian diberi gram iodin, setelah itu secepatnya diberi aseton alkohol dan dibilas. Kemudian diteteskan larutan safranin sebagai zat warna tandingan, dibiarkan satu menit, lalu dibilas dengan air dan dikeringkan perlahan dengan tissue. Selanjutnya diamati di bawah mikroskop, bentuk dan penataan sel-selnya serta gramnya (Cappuccino, 1983).
Pewarnaan spora dilakukan dengan mengambil satu ose isolat bakteri, difiksasi pada kaca objek, lalu diberikan 2-3 tetes Malachite green, lalu dipanasuapkan selama 5 menit (sampai uap terlihat), didiamkan selama 1 menit, bilas dengan aquadest, diteteskan safranin dan dibiarkan selama 30 detik, lalu dikeringkan tanpa pamanasan Setelah itu diamati dengan mikroskop, spora berwarna hijau sedangkan bagian sel lainnya berwarna merah (Cappucinno, 1983).
3.10. Uji Sifat Biokimia Bakteri Amilase Termofilik
Uji katalase dilakukan dengan mengambil 2 tetes hidrogen peroksida 3% diletakkan pada kaca objek, satu ose isolat bakteri, diletakkan di atas cairan hidrogen peroksida tersebut. Uji katalase positif ditandai dengan dihasilkannya gelembung udara (Cappuccino,1983).
Uji sitrat dilakukan dengan mengambil satu ose isolat bakteri, digores pada permukaan media Simon Citrat Agar dan dengan ose lurus satu ose isolat bakteri juga ditusukkan ke bagian tengah media sampai ke dasar tabung reaksi. Media kultur tersebut diinkubasi pada suhu 65oC selama 48 jam. Uji positif bila media berubah dari warna hijau menjadi warna biru (Cappuccino, 1983).
Uji fermentasi karbohidrat dilakukan dengan menggores isolat bakteri pada permukaan media miring Triple Sugar Iron agar dan juga ditusuk lurus pada bagian tengah media. Kultur dinkubasi selama 48 jam pada suhu 65oC, lalu diamati perubahan warna media. Uji positif bila terjadi perubahan warna media TSIA dari warna teh menjadi warna oranye atau kuning (Cappuccino, 1983).
Uji gelatinase dilakukan dengan menginokulasikan isolat bakteri dengan cara menusuk cara tegak lurus jarum ose pada bagian tengah media Gelatin, lalu diinkubasi selama 5 hari pada suhu 65oC, setelah itu kultur media disimpan dalam kulkas selama 15 menit. Uji gelatinase positif ditandai dengan bentuk media yang tetap cair meskipun telah disimpan di dalam kulkas (Cappuccino, 1983).
Uji Motilitas dilakukan dengan cara menginokulasikan isolat bakteri dengan cara menusukkan jarum ose secara tegak lurus hingga setengah tinggi media Sulfit Indol Motility pada tabung reaksi. Tabung diinkubasi selama 48 jam pada suhu 65oC, setelah itu diperhatikan jejak pergerakan bakteri (Cappuccino, 1983).
3.11. Pembuatan Larutan Standar Glukosa
Aktivitas enzim amilase yang akan diuji dari ketiga isolat terpilih diplotkan ke kurva standar glukosa agar dapat diketahui berapa konsentrasi
glukosa yang diperoleh dari hasil hidrolisis amilum yang dikatalis enzim amilase isolat terpilih tersebut. Untuk membuat larutan standar glukosa tersebut dibuat larutan–larutan glukosa dengan konsentrasi mulai dari 80-260 µg/ml. Untuk tiap konsentrasi diambil 1 ml larutan glukosa tersebut, dan ditambahkan 1,5 ml larutan reagen DNS, divorteks, kemudian diinkubasi dididihkan selama 5 menit, didinginkan dengan air mengalir selama 15 menit, ditambah aquabidest sebanyak 20 ml, divortex, lalu diukur absorbansinya pada panjang gelombang 540 nm. Dari tiap hasil absorbansi masing-masing larutan glukosa dengan konsentrasi yang berbeda tersebut dibuat garis regresi yang menunjukkan hubungan linier antara absorbansi dan kadar glukosa (Junaidi, 2008).
3.12. Produksi Enzim Amilase Dari Isolat
Satu ose kultur bakteri amilolitik dari stok kultur yang berumur 1 hari dimasukkan ke dalam media cair steril untuk perangsang pembentukan amilase. Media cair terbuat dari (gram per liter larutan) 6 peptone, 0,5 KCl, 0,5 MgSO4.7H2O, 1 pati. Larutan kemudian disterilisasi. Media yang mengandung
kultur bakteri diinkubasi pada suhu 65oC selama 72 jam pada shakerwaterbath
dengan kecepatan 150 rpm (Ajayi, 2007).
3.13. Ekstraksi Enzim Dari Kultur Cair Bakteri
Setelah diinkubasi selama 72 jam, kultur cair bakteri dimasukkan ke dalam tabung centrifuge dan diputar selama 20 menit dengan kecepatan 6000 rpm.
Supernatan yang mengandung ekstrak dari enzim amilase kasar diambil dengan mikropipet untuk di uji aktivitasnya (Palmer, 1985).
3.14. Pengukuran Aktivitas Enzim Amilase Kasar Dari Isolat Bakteri Termofil
Aktivitas enzim amilase dideterminasi lewat metode DNS dengan menggunakan pati sebagai substrat (Bernfeld, 1951; Bailey, 1988). Supernatan dari kultur enzim amilase kasar digunakansebagaisampelenzim. Aktivitas enzim amilase dihitung berdasarkan data kadar glukosa relatif sebagai mg glukosa yang dihasilkan oleh 1 ml filtrat kasar amilase. Satu Unit aktifitas enzim didefenisikan sebagai banyaknya µmol glukosa yang dihasilkan dari hidrolisa pati oleh 1 ml ekstrak kasar enzim amilase selama masa inkubasi. Untuk melihat besarnya satu unit aktifitas enzim tersebut digunakan rumus:
AE = MG x 1000 ...(Kombong, 2004)
BMg x MI
di mana :
AE = Aktifitas enzim ( Unit/mL filtrat enzim).
MG = Miligram glukosa yang dihasilkan dari reaksi hidrolisa pati BMg = Berat Molekul Glukosa = 180
MI = Masa Inkubasi = 20 menit
3.15. Pengaruh Suhu Inkubasi Terhadap Aktifitas Enzim Amilase Kasar
Sebanyak 1 ml ekstrak amilase kasar hasil sentrifugasi dimasukkan ke dalam tabung uji, lalu ditambahkan 1% larutan pati yang sudah dilarutkan dalam
sitrat bufer fosfat pH 6,5. Larutan pati dan enzim tersebut diinkubasi pada waterbath dengan suhu yang bervariasi mulai suhu 40oC, 50oC, 60oC, 65oC, 70oC, 80oC selama 20 menit. Untuk blanko disiapkan 2 ml ekstrak amilase kasar dalam tabung uji dan dipanaskan hingga mendidih selama 20 menit, lalu secepatnya dimasukkan dalam es selama 5 menit untuk menginaktivasi enzim tersebut. Bagian ini digunakan untuk blanko. Ke dalam tabung blanko ditambahkan juga larutan pati 1% dalam sitrat bufer fosfat pH 6,5, lalu diinkubasi pada suhu yang bervariasi sama dengan sampel enzimnya yang aktif selama 20 menit. Untuk menghentikan reaksi setelah 20 menit, ke dalam tiap tabung uji ditambahkan 2 ml reagen DNS (terbuat dari 1 g 3,5,dinitrosalicyclic acid, 20 ml NaOH dan 30 g sodium potassium tartarate dalam 100 ml larutan). Tabung uji dipanaskan hingga mendidih selama 5 menit, didinginkan dengan air mengalir selama 15 menit dan ditambahkan air yang didestilasi sebanyak 20 ml. Tiap larutan dalam tabung uji kemudian dideterminasi intensitas warnanya dengan menggunakan spektrofotometer pada panjang gelombang 540 nm. Nilai absorbansinya diplotkan dengan kurva standart glukosa yang terbuat dari larutan glukosa monohidrat dengan konsentrasi antara 80–260 µg/ml yang telah dibuat sebelumnya (Junaidi, 2008). Tiap sampel pengujian aktifitas enzim dibuat ulangannya sebanyak tiga kali.
3.16 Pengaruh pH Terhadap Aktifitas Enzim
Aktivitas enzim amilase dideterminasi lewat metode DNS (3,5-dinitro salicylic acid) dengan menggunakan pati sebagai substrat (Bernfeld, 1951; Bailey,
1988). Filtrat dari kultur enzim amilase kasar digunakansebagai sampelenzim. Sebanyak 1 ml ekstrak amilase kasar hasil sentrifugasi dimasukkan ke dalam tabung uji, lalu ditambahkan 1% larutan pati yang sudah dilarutkan dalam sitrat bufer fosfat dengan variasi pH 4, pH 5, pH 6, pH 7, pH 8 dan pH 9, Lalu tiap sampel diinkubasi pada waterbath dengan menggunkan suhu 65oC selama 20 menit, setelah itu ditambahkan masing-masing 2 ml reagen DNS, dididihkan selama 5 menit, didinginkan pada air mengalir selama 15 menit, ditambahkan masing-masing aquadest sebanyak 20 ml, divortex dan absorbansinya diukur dengan menggunakan spektrofotometer pada panjang gelombang 540 nm. Untuk blanko digunakan enzim yang sudah dinonaktifkan dengan cara dididihkan selama 20 menit lalu didinginkan dengan es selama 5 menit.. Untuk perlakuannya dibuat sama dengan perlakuaan sampel pH yang mau diuji.
3.17. Metode Statistik dan Analisis data
Penelitian ini dilakukan dengan menggunakan metode Rancangan Acak Lengkap (RAL) yang bersifat eksperimen dan Non Faktorial dengan menggunakan model persamaan :
Yij = µ + τi + εij ...(Yitnosumarto, 1991).
dimana : Yij = µg/ml glukosa yang dihasilkan oleh reaksi amilase + patipada
perlakuan ke-i ulangan ke-j µ = nilai tengah umum
τi = pengaruh perlakuan ke-i
εij = galat percobaan pada perlakuan ke-i ulangan ke-j
40, 50, 60, 65, 70 dan 80oC untuk perlakuan parameter suhu dan pH4, 5, 6, 7, 8, 9 untuk perlakuan parameter pH substrat ( p)
j = 1,2,3 (n)
Hasil pengamatan karakterisasi makroskopis, mikroskopis dan uji biokimia dipaparkan secara deskriptif, sedangkan hasil berupa data kuantitatif hasil uji aktifitas enzim dianalisis varian. Bila didapatkan perbedaan nyata atau sangat nyata dilanjutkan dengan Uji Duncan Multiple Range Test untuk melihat perbedaan antar perlakuan yang dibuat (Yitnosumarto, 1991).
BAB IV
HASIL DAN PEMBAHASAN
4.1. Isolasi dan Seleksi Bakteri AmilolitikDari isolasi bakteri dari sampel air panas Penen didapatkan 22 isolat masing-masing terdiri dari 5 isolat dari lokasi I (suhu 48oC, pH 6,8), 12 isolat dari lokasi II (suhu55oC, pH 6,8) dan 5isolat dari lokasi III (suhu 57oC, pH 6,7). Masing-masing isolat dimurnikan pada media agar pati 1% dan didapatkan hasil 2 isolat amilolitik dari lokasi I, 10 isolat dari lokasi II dan 4 isolat dari lokasi III. Setiap isolat yang dapat dimurnikan dianggap dapat menggunakan pati tetapi untuk memastikan dilakukan uji iodin. Isolat yang mampu menghidrolisis pati menghasilkan zona bening di sekeliling isolat setelah ditetesi iodin (Cappuccino, 1983). Sebelum penetesan iodin dilakukan terlebih dahulu dilakukan karakterisasi morfologis dari koloni, juga dibuat stok kultur untuk ke enam belas isolat yang tumbuh tersebut. Dari hasil uji iodin didapatkan hasil enam belas isolat yang tumbuh itu semuanya dapat menghidrolisis pati.
4.2. Karakterisasi Morfologis dan Uji Biokimia
Enam belas isolat bakteri yang teridentifikasi dapat menghidrolisis pati tersebut, dikarakterisasi sifat morfologi dan biokimianya, hasil dapat dilihat pada Tabel 3 di bawah ini:
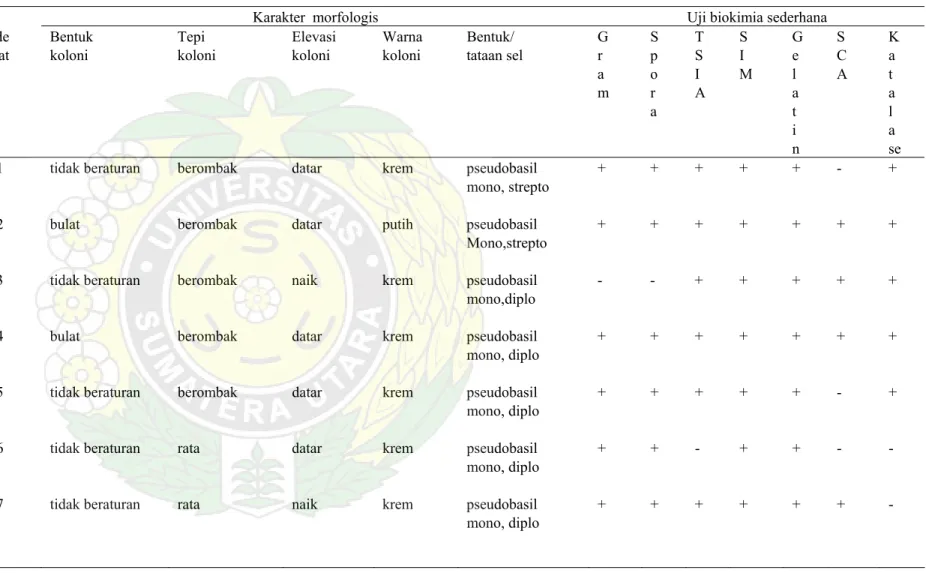
Tabel 3. Karakter Morfologi danSifat Biokimia Isolat Bakteri Termofil Amilolitik Penen Sibirubiru
Karakter morfologis Uji biokimia sederhana
Kode Bentuk Tepi Elevasi Warna Bentuk/ G S T S G S K
isolat koloni koloni koloni koloni tataan sel r p S I e C a a o I M l A t
m r A a a
a t l
i a
n se
PN1 tidak beraturan berombak datar krem pseudobasil + + + + + - +
mono, strepto
PN2 bulat berombak datar putih pseudobasil + + + + + + + Mono,strepto
PN3 tidak beraturan berombak naik krem pseudobasil - - + + + + + mono,diplo
PN4 bulat berombak datar krem pseudobasil + + + + + + +
mono, diplo
PN5 tidak beraturan berombak datar krem pseudobasil + + + + + - + mono, diplo
PN6 tidak beraturan rata datar krem pseudobasil + + - + + - - mono, diplo
PN7 tidak beraturan rata naik krem pseudobasil + + + + + + - mono, diplo
Lanjutan Tabel 3 :
PN8 bulat berombak datar krem pseudobasil - - + + + + -
mono, diplo
PN9 tidak beraturan berombak naik krem pseudobasil + + + + + + +
mono, diplo
PN10 tidak beraturan berombak datar krem pseudobasil mono, diplo - - + + + + + strepto
PN11 tidak beraturan filamen datar krem pseudobasil - - + + + + + mono, strepto
PN12 tidak beraturan filamen datar krem pseudobasil + + + + + + + mono, diplo
PN13 tidak beraturan filamen datar krem pseudobasil + + + + + + - mono, diplo
PN14 rizoid berlekuk datar Putih pseudobasil + + + + + - + Mono, diplo
PN15 rizoid filamen datar krem Kokus/ + + + + + - -
Mono, diplo
PN16 bulat rata datar putih pseudobasil + + + + + - +
Dari hasil pewarnaan gram terlihat isolat amilolitik Penen ini 15 berbentuk batang pendek (pseudobasil) dan satu kokus. Untuk sifat gram 12 isolat gram positif dan 4 isolat bersifat gram negatif. Duabelas dari 16 isolat dapat membentuk endospora, sehingga diduga sebagian besar yang berbentuk basil, gram positif dan endospora positif dan katalase positif tersebut berasal dari genus
Bacillus. Bakteri jenis ini mampu bertahan hidup dalam bentuk sel vegetatifnya
sampai suhu 70oC, pada suhu yang lebih tinggi dari 70oC bakteri ini membentuk endospora (Tarigan, 1988; Pelczar & Chan, 1988).
Hasil uji biokimia pada media Simon Citrat Agar menunjukkan 10 dari 16 isolat amilolitik Penen dapat menggunakan sitrat sebagai sumber karbonnya. Kemampuan menggunakan sitrat ini ini ditandai oleh berubahnya warna media SCA dari warna hijau menjadi warna biru (Cappuccino, 1983).
Hasil uji biokimia fermentasi karbohidrat dengan media TSIA memperlihatkan 15 dari 16 isolat menunjukkan hasil positif dapat menggunakan media TSIA sebagai sumber karbon. Limabelas isolat tersebut memperlihatkan hasil fermentasi pada bagian atas berwarna merah dan bagian dasar kuning sehingga dari sumber carbon yang tersedia isolat hanya dapat memfermentasi glukosa untuk sumber energinya. Tidak ada di antara limabelas isolat tersebut yang memproduksi H2S karena tidak terjadi pembentukan warna hitam pada
bagian dasar media setelah fermentasi 48 jam (Cappuccino, 1983).
Hasil uji motilitas dengan media SIM memperlihatkan 16 isolat tersebut bersifat motil. Hal ini ditandai dengan adanya jejak pergerakan bakteri sesudah media yang diinokulasi dengan isolat diinkubasi selama 3 hari.
Hasil uji gelatinase dengan media gelatin agar memperlihatkan 16 isolat dapat menghidrolisis gelatin. Hal ini tampak dari bentuk media gelatin yang sudah diinokulasi dan diinkubasi selama 3 hari lalu sesudah itu disimpan di kulkas selama 30 menit ternyata tetap cair (Cappuccino, 1983).
Hasil uji katalase memperlihatkan 11 dari 16 isolat positif menghasilkan katalase. Hal ini ditandai dengan munculnya gelembung oksigen dari permukaan isolat ketika ditetesi dengan H2O2 (Cappuccino, 1983).
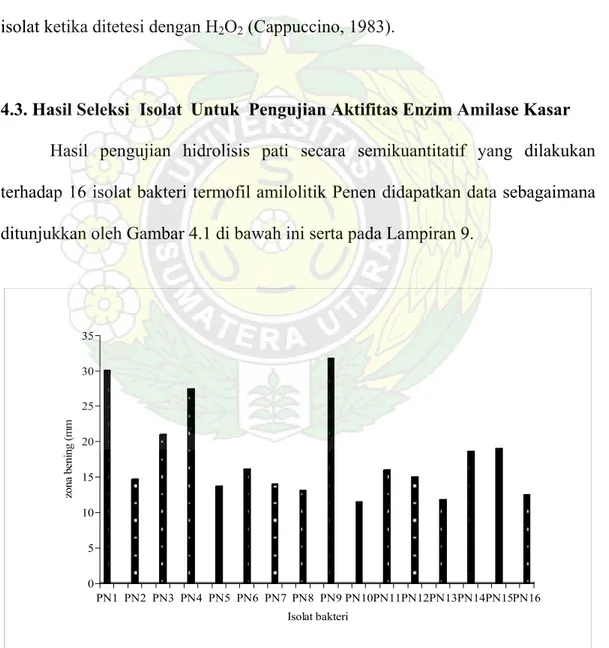
4.3. Hasil Seleksi Isolat Untuk Pengujian Aktifitas Enzim Amilase Kasar Hasil pengujian hidrolisis pati secara semikuantitatif yang dilakukan terhadap 16 isolat bakteri termofil amilolitik Penen didapatkan data sebagaimana ditunjukkan oleh Gambar 4.1 di bawah ini serta pada Lampiran 9.
0 5 10 15 20 25 30 35 zona ben ing (m m PN1 PN2 PN3 PN4 PN5 PN6 PN7 PN8 PN9 PN10PN11PN12PN13PN14PN15PN16 Isolat bakteri
Gambar 5. Diameter zona bening hasil hidrolisis pati oleh enzim amilase isolat bakteri termofil