PENGHILANGAN H2S DAN NH3 DENGAN TEKNIK BIOFILTER PADA
GUDANG PENYIMPANAN LEUM PABRIK KARET
Oleh
RENDY ADITYA F34104125
2008
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
PENGHILANGAN H2S DAN NH3 DENGAN TEKNIK BIOFILTER PADA
GUDANG PENYIMPANAN LEUM PABRIK KARET
Sebagai salah satu syarat untuk meraih gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Teknologi Industri Pertanian
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh
RENDY ADITYA F34104125
2008
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
PENGHILANGAN H2S DAN NH3 DENGAN TEKNIK BIOFILTER PADA
GUDANG PENYIMPANAN LEUM PABRIK KARET
Sebagai salah satu syarat untuk meraih gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Teknologi Industri Pertanian
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh: RENDY ADITYA
F34104125
Dilahirkan pada tanggal 22 Juli 1986 di Jakarta
Tanggal lulus: September 2008
Bogor, September 2008 Menyetujui,
Dr. Ir. Mohamad Yani, M.Eng Drs. Purwoko, M.Si
KATA PENGANTAR
Puji syukur penulis ucapkan ke hadirat Allah SWT Tuhan semesta alam serta salam dan shalawat kepada Nabi Besar Muhammad SAW yang telah membimbing manusia keluar dari jalan kegelapan menuju kemenangan. Berkat izin-Nya, penulis dapat menyelesaikan skripsi yang berjudul ” Penghilangan H2S dan NH3 dengan Teknik Biofilter pada Gudang Penyimpanan Leum Pabrik Karet ”, sebagai salah satu syarat untuk menyelesaikan pendidikan di Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Begitu banyak pihak yang telah membantu penulis dalam penyelesaian laporan praktek lapang ini. Izinkan penulis untuk mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Dr. Ir. Mohamad Yani, M.Eng, sebagai Dosen Pembimbing I yang telah membimbing Penulis selama ini.
2. Drs Purwoko, M.Si, sebagai Dosen Pembimbing II Yang telah membimbing Penulis selama penelitian sampai penyelesaian skripsi ini.
3. Dr. Ir. Ono Suparno, M.T, sebagai dosen penguji yang telah memberikan banyak masukan kepada penulis.
4. Kedua orang tua penulis beserta saudara yang memberikan kasih sayang, dukungan materil maupun moril selama ini.
5. Seluruh staf dan karyawan PTPN VIII Cikumpay, Purwakarta, Jawa Barat. 6. Seluruh staf pengajar, staf penunjang dan karyawan Departemen Teknologi
Industri Pertanian IPB.
7. Tim Biofilter 2008: Teguh, Puji, Feni dan Anes, serta rekan-rekan TIN’41. Penulis menyadari masih banyak kekurangan yang terdapat dalam skripsi ini, oleh karena itu saran dan kritik yang membangun sangat penulis harapkan. Penulis berharap, skripsi ini dapat bermanfaat bagi para pembacanya.
Bogor, Agustus 2008 Penulis
DAFTAR ISI
Halaman
KATA PENGANTAR ... iii
DAFTAR TABEL... vi
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN... viii
I. PENDAHULUAN A. LATAR BELAKANG ... 1
B. TUJUAN ... 2
II. TINJAUAN PUSTAKA A. INDUSTRI PENGOLAHAN LATEKS... 3
B. GAS HIDROGEN SULFIDA (H2S) ... 3
C. GAS AMONIAK (NH3)... 4
D. BAKTERI PENGOKSIDASI HIDROGEN SULFIDA ... 5
E. BAKTERI PENGOKSIDASI AMONIAK ... 6
F. BIOFILTER ... 7
G. BAHAN PENGISI ... 8
III. METODE PENELITIAN A. BAHAN DAN ALAT ... 11
B. LOKASI PENELITIAN... 11
C. REAKTOR BIOFILTER ... 12
D. BAHAN PENGISI ... 13
E. PENELITIAN UTAMA... 13
F. ANALISA DATA ... 14
IV. HASIL DAN PEMBAHASAN A. KARAKTERISTIK BAHAN PENGISI ... 15
B. INLET NH3 DAN H2S ... 16
C. KINERJA BIOFILTER 1... 19
D. KINERJA BIOFILTER 2... 27
E. PERBANDINGAN KINERJA PENGHILANGAN N DAN S ... 35
V. KESIMPULAN DAN SARAN
A. KESIMPULAN ... 37
B. SARAN ... 38
DAFTAR PUSTAKA ... 49
DAFTAR TABEL
Halaman Tabel 1. Dampak Menghirup H2S... 4 Tabel 2. Karakteristik Bahan Pengisi yang Digunakan...15 Tabel 3. Perbandingan Penyerapan N dan S pada Beberapa Pabrik
Karet... 35
DAFTAR GAMBAR
Halaman
Gambar 1. Struktur Amoniak...5
Gambar 2. Thiobacillus sp... 6
Gambar 3. Nitrosomonas sp... 7
Gambar 4. Diagram Biofilter... 12
Gambar 5. Konsentrasi Inlet Gas Amoniak Selama Penelitian... 17
Gambar 6. Konsentrasi Inlet Gas Hidrogen Sulfida Selama Penelitian... 18
Gambar 7. Kondisi dan Kinerja Penghilangan NH3 Biofilter 1... 21
Gambar 8. Kinerja Penghilangan H2S Biofilter 1 ... 22
Gambar 9. Konsentrasi Beberapa Unsur Pada Biofilter 1... 24
Gambar 10. Kapasitas Penyerapan N Terhadap Beban yang Masuk ke Biofilter 1... 25
Gambar 11. Kapasitas Penyerapan S Terhadap Beban yang Masuk ke Biofilter 1... 26
Gambar 12. Kondisi dan Kinerja Penghilangan NH3 Biofilter 2... 29
Gambar 13. Kinerja Penghilangan H2S Biofilter 2... 31
Gambar 14. Konsentrasi Beberapa Unsur Pada Biofilter 2... 32
Gambar 15. Kapasitas Penyerapan N Terhadap Beban yang Masuk Ke Biofilter 2 ... 33
Gambar 16. Kapasitas Penyerapan S Terhadap Beban yang Masuk ke Biofilter 2 ... 34
DAFTAR LAMPIRAN
Halaman Lampiran 1. Metode Analisis Penelitian... 42 Lampiran 2. Cara Kerja Pengujian Mikroba ... 48 Lampiran 3a. Kurva Standar NH3 (panjang gelombang 420 nm) ... 46 Lampiran 3b. Hasil Pengamatan NH3, Inlet, Outlet, dan Efisiensi
Biofilter 1 ... 52 Lampiran 3c. Hasil Pengamatan NH3, Inlet, Outlet, dan Efisiensi
Biofilter 2 ... 54 Lampiran 4a. Kurva Standar H2S(panjang gelombang 560 nm) ... 56 Lampiran 4b. Hasil Pengamatan H2S, Inlet, Outlet, dan Efisiensi Biofilter 1 ... 53 Lampiran 4c. Hasil Pengamatan H2S, Inlet, Outlet, dan Efisiensi Biofilter 2 ... 59
I. PENDAHULUAN
A. LATAR BELAKANG
Tanaman karet masuk ke Indonesia pada abad ke-20 dari Malaysia ke pulau Jawa dan Kalimantan melalui pulau Sumatra. Tanaman karet dibudidayakan dengan baik oleh rakyat maupun pihak perkebunan swasta. Saat ini Indonesia berada pada peringkat dua setelah Thailand sebagai penghasil karet terbesar di dunia.
Karet alam (natural rubber) yang diperoleh dari tanaman Hevea braziliensis merupakan salah satu komoditas ekspor yang memiliki peranan penting sebagai devisa negara sub-sektor perkebunan. Luas areal perkebunan karet yang ada mencapai 2.7 – 3.4 juta hektar dengan produksi mencapai lebih dari 1.370 juta ton / tahun (BPS, 2002).
Untuk memenuhi kebutuhan ekspor, diperlukan penambahan industri pengolahan lateks agar bahan baku yang tersedia dapat diolah secara optimal. Perkembangan industri ini menyebabkan timbulnya emisi yang dihasilkan dari aktivitas pabrik. Industri lateks pekat merupakan salah satu industri yang menimbulkan emisi karena penggunaan amoniak (NH3) dalam jumlah yang cukup besar untuk menjaga lateks agar tetap pada kondisi cair dan pekat. Emisi lain seperti hidrogen sulfida (H2S) juga dihasilkan dari tempat produksi maupun gudang penyimpanan leum yang dapat mencemari dan mengganggu kesehatan dan keselamatan pekerja pabrik.
Terdapat beberapa cara yang digunakan untuk mengurangi polutan yaitu secara fisik, kimia dan biologis. Secara fisik, biasanya digunakan arang aktif sebagai filter. Secara kimia, dapat dilakukan penambahan bahan kimia atau proses tertentu seperti insinerasi. Pengolahan secara biologis dapat digunakan metode bioscrubber, biotrickling filter dan biofilter
Pada pabrik pengolahan karet, bau yang ditimbulkan dari gudang leum dapat diantisipasi dengan penambahan bahan kimia yang disebut deorub.
(asap cair) limbah padat kelapa sawit yang berwarna coklat tua dengan bau asap dan pH sekitar 0.5. Penggunaannya memiliki beberapa kelemahan, salah satunya adalah daya kerja penghilangan yang bersifat sementara sehingga dalam kurun waktu tertentu perlu dilakukan penambahan kembali yang pada akhirnya akan meningkatkan biaya perawatan dan produksi industri pengolahan lateks.
Alternatif lain adalah penggunaan biofilter. Penggunaan biofilter
memiliki beberapa keuntungan, diantaranya kebutuhan biaya yang relatif murah dan pendegradasian emisi yang dihasilkan menjadi senyawa yang lebih ramah lingkungan. Selain itu, biofilter dapat digunakan untuk jangka panjang dan nutrisi bahan pengisi pada biofilter sangat tinggi sehingga dapat dimanfaatkan sebagai pupuk saat bahan pengisi telah mencapai titik jenuhnya.
B. TUJUAN
Tujuan penelitian ini adalah untuk menentukan kinerja biofilter skala pilot dengan waktu kerja dengan rentang tertentu yaitu tiga jam operasi dan tiga jam idle, dalam mengurangi emisi amoniak dan hidrogen sulfida dari gudang leum.
II. TINJAUAN PUSTAKA
A. INDUSTRI PENGOLAHAN LATEKS
Karet (Hevea braziliensis) merupakan tanaman yang tumbuh di berbagai daerah di Indonesia. Sebagai salah satu komoditas perkebunan unggulan, usaha peningkatan produksi lateks selalu dilakukan. Salah satu langkah yang ditempuh adalah meningkatkan jumlah industri pengolahan lateks. Resiko yang dihadapi saat jumlah industri pengolahan lateks bertambah adalah meningkatnya tingkat pencemaran lingkungan dari industri tersebut.
Lateks yang telah disadap dari kebun dikumpulkan di tempat pengumpulan untuk diteruskan ke pabrik pengolahan menggunakan truk tangki. Selama proses penyadapan lateks, seringkali ditambahkan antikoagulan agar lateks tidak cepat membeku. Antikoagulan yang biasa digunakan adalah amoniak (Goutara et al., 1985). Walaupun telah ditambahkan amoniak, lateks masih dapat membeku secara alami. Lateks yang membeku ini disebut leum. Leum merupakan bahan baku yang digunakan untuk membuat crumb rubber dan biasanya disimpan di gudang leum sebelum diproses. Penyimpanan yang kurang baik menyebabkan leum menghasilkan gas H2S yang berbau busuk akibat terkontaminasi mikroorganisme pengurai karena lateks merupakan media kaya nutrisi yang dibutuhkan mikroorganisme (Zuhra, 1996). Selain H2S, pada gudang penyimpanan leum juga terdapat gas NH3 sisa penyadapan di kebun.
B. GAS HIDROGEN SULFIDA (H2S)
Hidrogen sulfida (H2S) adalah gas yang tidak berwarna, beracun, berbau seperti telur busuk dan mudah terbakar pada konsentrasi tertentu (Martin et al., 2004). Gas ini juga dapat menyebabkan terjadinya korosi pada logam. Sulfur tereduksi dalam bentuk H2S di biosfer sebagai hasil dari aktivitas vulkanik dan metabolisme mikrobial. H2S di alam hanya terkumpul dalam
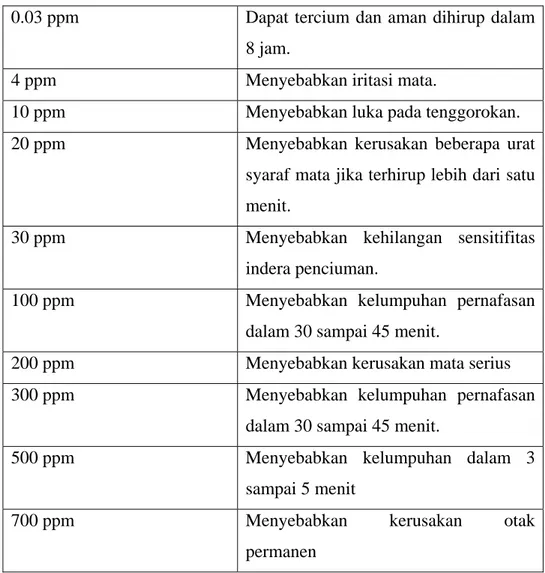
kondisi anaerobik, tetapi akan teroksidasi secara spontan dan cepat dengan adanya oksigen. H2S merupakan polutan yang tidak menyebar luas seperti SO2. Gas ini umumnya berasosiasi dengan sumber spesifik seperti bahan organik terdekomposisi, lumpur dan limbah industri. Gas H2S mempunyai bau seperti telur busuk dan terkadang lebih toksik dibandingkan karbon monoksida (CO) (Tabel 1).
Tabel 1. Dampak Menghirup H2S
0.03 ppm Dapat tercium dan aman dihirup dalam 8 jam.
4 ppm Menyebabkan iritasi mata.
10 ppm Menyebabkan luka pada tenggorokan.
20 ppm Menyebabkan kerusakan beberapa urat
syaraf mata jika terhirup lebih dari satu menit.
30 ppm Menyebabkan kehilangan sensitifitas
indera penciuman.
100 ppm Menyebabkan kelumpuhan pernafasan
dalam 30 sampai 45 menit.
200 ppm Menyebabkan kerusakan mata serius
300 ppm Menyebabkan kelumpuhan pernafasan
dalam 30 sampai 45 menit.
500 ppm Menyebabkan kelumpuhan dalam 3
sampai 5 menit
700 ppm Menyebabkan kerusakan otak
permanen Sumber (Turk et al., 1972)
C. GAS AMONIAK (NH3)
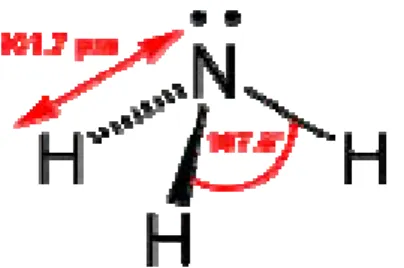
Amoniak merupakan senyawa dari unsur nitrogen dengan hidrogen yang memiliki formula NH3 (Gambar 1). Di atmosfer, amoniak terdeteksi
dalam jumlah kecil yang berasal dari proses penguraian sisa-sisa makhluk hidup yang mengandung unsur nitrogen (Wikipedia, 2008). Amoniak sendiri merupakan gas tidak berwarna, memiliki bau yang menyengat serta menyebabkan iritasi dan korosi pada konsentrasi yang tinggi.
Gambar 1. Struktur Amoniak (Wikipedia, 2008)
Amoniak digunakan pada industri pengolahan lateks sebagai bahan antibeku untuk mencegah terjadinya prokoagulasi lateks kebun selama proses transportasi dari kebun menuju pabrik pengolahan (Solichin, 1988). Adapun alasan digunakannya amoniak pada industri pengolahan lateks adalah sebagai berikut:
• Bersifat desinfektan sehingga mengurangi terjadinya kontaminasi oleh mikroba.
• Bersifat basa sehingga dapat mempertahankan pH lateks hingga siap olah.
• Harga yang relatif lebih murah dibandingkan antikoagulan lainnya. D. BAKTERI PENGOKSIDASI HIDROGEN SULFIDA
Di alam, terdapat beberapa jenis bakteri yang berperan dalam transfer sulfur. Bakteri ini terpisah menjadi dua kelompok yaitu bakteri sulfur ungu (Chromatuaceae) dan bakteri sulfur hijau (Chlorobioceae). Bakteri ini mendapatkan energi metabolisme melalui oksidasi H2S, serta menggunakan CO2 sebagai sumber karbon. Beberapa jenis dari kelompok ini mengoksidasi
H2S membentuk sulfur elemen (So) dan kelompok lainnya mengoksidasi sulfur elemen menjadi asam sulfat (H2SO4).
Gambar 2. Thiobacillus (Wikipedia, 2008)
Reaksi oksidasi H2S menghasilkan asam sulfat melalui reaksi sebagai berikut:
H2S + O2 2So + 2H2O
2S + 2H2O + 3O2 4H+ + 2SO4 2-S2O32- + H2O + CO2 2H+ + 2SO4
2-Beberapa bakteri yang dapat mengoksidasi senyawa sulfur adalah
Thiobacillus thioxidans dan Thiobacillus feroxidans (Gambar 2). Kedua mikroorganisme ini mengoksidasi H2S dan membentuk sulfur elemen yang disimpan dalam selnya. Keduanya mengoksidasi bahan anorganik seperti H2S, FeS dan mengubahnya menjadi asam sulfat (Edmons, 1978).
E. BAKTERI PENGOKSIDASI AMONIAK
Keadaan lingkungan yang aerobik akan menyebabkan terjadinya proses proses oksidasi amoniak menjadi nitrit (NO2-) dan dalam kondisi yang sama, nitrit dioksidasi menjadi nitrat (NO3-). Organisme yang melakukan proses nitrifikasi ini disebut nitrosobakter, diantaranya Nitrosomonas (Gambar 3)
yang mengubah amonium menjadi nitrit. Organisme yang mengubah nitrit menjadi nitrat adalah Nitrobacter (Wikipedia, 2008).
Gambar 3. Nitrosomonas sp (Wikipedia, 2008)
Nitrosomonas merupakan bakteri kemolitrotrof berbentuk batang dengan metabolisme aerobik. Bakteri ini melakukan metabolisme dengan mengurai amoniak dengan bantuan oksigen. Membran dalam sel bakteri menggunakan elektron dari atom nitrogen amoniak untuk menghasilkan energi. Untuk melengkapi divisi sel, Nitrosomonas harus mengkonsumsi amoniak dalam jumlah banyak (Wikipedia, 2008).
F. BIOFILTER
Biofilter adalah reaktor dengan bahan pengisi berupa material padat (filter bed) yang berfungsi sebagai media mikroorganisme tumbuh (Chou dan Cheng, 1997). Mikroorganisme biasanya tumbuh di lapisan biofilm pada permukaan media atau terikat pada fase air yang terdapat pada media. Filter bed yang digunakan pada biofilter biasanya bersifat inert, kaya nutrisi bagi mikroba dan luas permukaan kontak yang cukup besar (Devinny et al., 1999). Menurut Devinny et al., (1999), elemen utama dalam penghilangan gas kontaminan adalah biofilm yang terbentuk pada filter bed. Udara dari sumber polutan dialirkan menggunakan blower ke dalam biofliter secara merata. Pada tahap awal terjadi penghilangan secara fisik dimana polutan tersaring oleh
filter bed. Pada tahap selanjutnya mikroorgansime pengoksidasi yang akan bekerja membentuk biofilm. Di dalam biofilm mikroorganisme mengoksidasi polutan menjadi CO2, H2O, garam mineral dan biomassa (Schmidt et al., 2004).
Menurut Otenggraf (1986), terdapat beberapa parameter yang dapat digunakan untuk menilai kinerja biofilter, antara lain:
1.Kecepatan tercapainya kondisi aklimatisasi mikroba. Parameter ini menunjukkan kinerja dari bioavailabilitas konsorsium mikroba yang dikembangkan untuk pendegradasian polutan. Semakin cepat masa adaptasi (lag phase), kinerja bioreaktor semakin baik.
2.Kemampuan mempertahankan rasio penghilangan gas dalam waktu yang relatif lama.
3.Kemampuan bahan pengisi dalam mempertahankan kondisi pH, suhu dan kadar air. Kemampuan ini menggambarkan kinerja
biofilter terhadap fluktuasi beban polutan yang tinggi, kurangnya humidifikasi dan masa idle biofilter akibat fluktuasi proses produksi pada industri.
4.Kapasitas pengilangan maksimum (g/ kg-media kering/ hari).
G. BAHAN PENGISI
Bahan pengisi merupakan salah satu faktor yang mempengaruhi kinerja biofilter karena merupakan tempat mikroorganisme pengoksidasi polutan tumbuh. Untuk itu dibutuhkan bahan pengisi yang tepat untuk mendukung pertumbuhan mikroorganisme pengoksidasi polutan (Hirai et al., 2001). Beberapa faktor yang digunakan dalam penentuan bahan pengisi adalah sebagai berikut:
• Memiliki kapasitas menahan air yang tinggi
• Area permukaan spesifik yang luas
• Mudah didapat dan harga yang murah
• Tidak mudah mengalami perubahan bentuk untuk pemakaian jangka panjang
• Memiliki daya penyangga untuk hasil pengoksidasian yang bersifat asam
Berikut beberapa jenis bahan pengisi yang sering digunakan pada biofilter: a. Tanah
Tanah dapat digunakan sebagai bahan pengisi pada biofilter
sebab relatif murah, dan mudah didapat. Tanah juga memiliki bahan organik yang merupakan sumber makanan mikroorganisme dan memiliki daya penyangga yang baik terhadap asam.
Berdasarkan volume secara umum, tanah terbagi atas dua bagian yaitu padatan dan ruang pori. Padatan yang dimaksud berupa bahan mineral sebesar 45% dan bahan organik sebesar 5%, sedangkan pada ruang pori terdiri dari udara dan air, masing-masing sebesar 25% (Hanafiah, 2005).
b. Kompos
Pengkomposan adalah proses pendegradasian biokimia bahan-bahan organik oleh mikroorganisme menjadi zat humus pada kondisi yang dikontrol (Gaur, 1983). Biokonversi bahan organik pada saat pengomposan dilakukan oleh kelompok mikroorganisme heterofilik seperti bakteri, kapang, protozoa dan
actinomicetes (Gaur, 1983).
Gaur (1983), menyatakan bahwa bahan organik yang dikomposkan dan akan digunakan untuk tanah pertanian harus terdekomposisi secara baik dan tidak menimbulkan efek negatif terhadap tanaman. Umumnya kompos dicirikan oleh sifat berikut: 1.Berwarna coklat tua hingga hitam.
2.Tidak larut dalam air, meskipun sebagian kompos membentuk suspensi.
3.Sangat larut dalam pelarut alkali seperti natrium pirofosfat atau larutan amonium oksalat.
4.Memiliki nisbah C/ N sebesar 10-20. 5.Secara biokimiawi tidak stabil.
6.Menunjukkan kapasitas pemindahan kation dan absorpsi zat yang tinggi.
c. Bahan Pengisi Tambahan
Bahan pengisi tambahan berfungsi untuk meningkatkan porositas campuran kompos dan tanah yang digunakan. Bahan tambahan yang diberikan terdiri dari arang sekam, kulit kayu karet dan serasah daun karet yang semuanya mudah didapat. Menurut Buckman dan Brandy (1982), bahan tambahan juga bisa menjadi sumber bahan organik bagi mikroorganisme.
III. METODE PENELITIAN
A. BAHAN DAN ALAT
Media sulfat bagi pertumbuhan bakteri yang terdiri atas Na2S2O3, CaCl2, KH2PO4, MgSO4.7H2O, (NH4)2SO4 dan Fe-sitrat. Untuk media
Nitrosomonas Sp digunakan Fenol Red, (NH4)2SO4, KH2PO4, MgSO4. 7H2O, CaCl2 dan larutan Ferric EDTA.
Penyerap NH3 yang digunakan adalah asam borat. Bahan penyerap H2S yang digunakan adalah Zn Asetat, Na Asetat dan NaCl. Indikator NH3 yang digunakan adalah larutan Nessler, sedangkan indikator untuk H2S adalah larutan Diamin dan larutan FeCl3.
Alat yang digunakan dalam persiapan biofilter ini adalah: blower, selang, pipa, kolom biofilter dari tangki air kapasitas 650 L, bahan pengisi berupa tanah, arang sekam, dan kompos.
Alat yang digunakan untuk analisis: erlenmeyer, cawan petri, tabung ulir, mikro pipet, tabung sampling, spektrofotometer, clean bench dan
autoclave.
B. LOKASI PENELITIAN
Penelitian ini dilaksanakan di gudang penyimpanan leum Pabrik Karet PTPN VIII Cikumpay, Purwakarta, Jawa Barat. Penelitian dilakukan mulai bulan April hingga Juni 2008. Analisis dilakukan di Laboratorium Teknologi Industri Pertanian, antara lain: Laboratorium Bioindustri dan Laboratorium Teknologi Kimia.
C. REAKTOR BIOFILTER
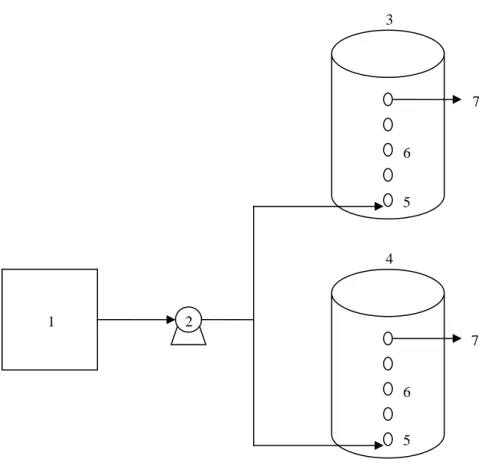
Desain biofilter menggunakan tangki air kapasitas 650 L. Biofilter terdiri dari dua kolom (Gambar 4). Kolom 1 berfungsi sebagai kolom kontrol, sedangkan kolom 2 merupakan kolom uji. Pada bagian bawah kolom dilengkapi lubang sebagai inlet saluran dan pembuangan air (drainage). Setiap kolom dilengkapi dengan enam lubang sampling, masing-masing tiga buah pada sisi badan kolom yang membentuk sudut 90o dan satu buah lubang
outlet. Lubang sampling ini juga berfungsi untuk mengambil sampel tanah yang akan diuji tiap minggu.
1 2 3 4 5 5 6 6 7 7
Gambar 4. Diagram Biofilter. 1. Sumber Polutan dari Gudang leum; 2. Blower; 3. Biofilter Kontrol; 4. Biofilter Uji; 5. Lubang Inlet; 6. Lubang Pengamatan; 7. Lubang Outlet
D. BAHAN PENGISI
Bahan pengisi yang digunakan dalam penelitian ini berupa tanah, arang sekam dan kompos dengan perbandingan 1: 1: 0.2. Tanah yang digunakan berasal dari hutan CIFOR, Bogor. Pemilihan lokasi pengambilan tanah ini didasarkan pada tempat yang mudah dijangkau dan kondisi tanah yang terjaga dari kontaminasi pestisida yang dapat mempengaruhi pertumbuhan mikroorganisme, sedangkan untuk arang sekam dan kompos didapat dari produsen kompos di desa BBS. Kompos berfungsi sebagai nutrisi bakteri, sedangkan arang sekam untuk meningkatkan porositas bahan pengisi.
E. PENELITIAN UTAMA
Perlakuan yang dilakukan dalam penelitian ini adalah perbedaan penambahan bakteri Nitromonas sp dan Thiobacillus sp pada kolom uji, sedangkan pada kolom kontrol tidak dilakukan penambahan kedua jenis bakteri tersebut. Besarnya flow inlet yang masuk ke dalam biofilter adalah 105 liter per menit. Selain itu, waktu kerja blower diatur untuk menyala selama tiga jam dan mati selama tiga jam. Fokus penelitian ini adalah mengamati efisiensi dan kapasitas penyerapan biofilter terhadap NH3 dan H2S
Beberapa analisis yang digunakan untuk mendapatkan hasil sesuai dengan fokus penelitian utama, yaitu:
a.Senyawa N dalam bentuk amoniak (NH3). Pengamatan dilakukan selama 42 hari dengan pengambilan sampel inlet dan outlet setiap hari, pada siang hari. Lama waktu pengambilan sampel adalah 5 menit. Metode yang digunakan untuk menghitung jumlah amoniak adalah metode Nessler.
b.Senyawa S dalam bentuk hidrogen sulfida (H2S). Pengamatan dilakukan selama 42 hari dengan pengambilan sampel inlet dan
adalah 5 menit. Metode yang digunakan untuk menghitung jumlah hidrogen sulfida adalah metode Metilen Blue.
c.Pengukuran pH dan kadar air yang dilakukan sekali dalam seminggu untuk menjaga kondisi bahan tetap sesuai bagi kebutuhan bakteri. d.Pengukuran kandungan total C, total N, total S, NO3-, NH4+, dan sulfat yang dilakukan sekali dalam seminggu untuk mengetahui perubahan unsur-unsur kimia dalam biofilter.
e.Penghitungan jumlah mikroorganisme pada bahan pengisi yang dilakukan sekali dalam seminggu. Mikroorganisme yag dihitung adalah Nitromonas sp dan Thiobacillus sp serta bakteri heterotrof.
Nitromonas sp dihitung menggunakan metode Most Probable Number (MPN) sedangkan Thiobacillus sp dan heterotrof dihitung menggunakan metode Total Plate Count (TPC).
Prosedur analisis pH, kadar air, kandungan total C, total N, total S, NO3-, NH4+, sulfat dan mikroba disajikan pada Lampiran 1 dan Lampiran 2.
F. ANALISIS DATA
Data yang didapat disajikan menggunakan metode deskriptif dengan grafik yang akan menggambarkan kondisi seluruh parameter selama penelitian berlangsung.
IV. HASIL DAN PEMBAHASAN
A. KARAKTERISTIK BAHAN PENGISI
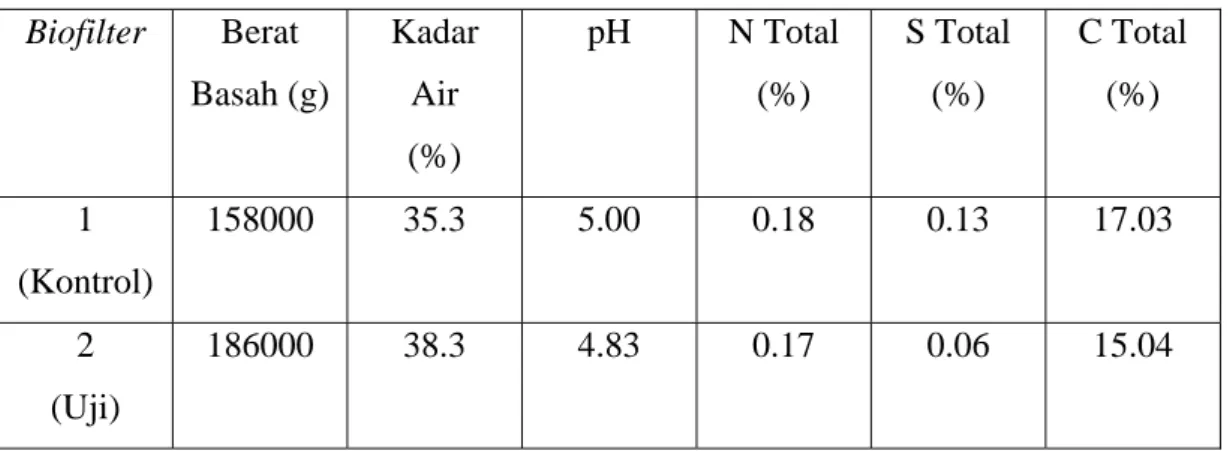
Bahan pengisi merupakan komponen utama yang terdapat pada biofilter. Berat basah bahan pengisi biofilter 1 adalah 158 kg sedangkan biofilter 2 adalah 186 kg (Tabel 2). Perbedaan berat basah kedua biofilter disebabkan penambahan starter bakteri pada biofilter 2. Penambahan starter cair bakteri menyebabkan bahan pengisi menjadi lebih padat sehingga volumenya menurun. Agar volume bahan pengisi sama, ditambahkan bahan pengisi lagi hingga volume bahan pengisi kedua biofilter sama. Penambahan bahan pengisi pada biofilter 2 menyebabkan berat basahnya naik.
Tabel 2. Karakteristik Bahan Pengisi yang Digunakan
Biofilter Berat Basah (g) Kadar Air (%) pH N Total (%) S Total (%) C Total (%) 1 (Kontrol) 158000 35.3 5.00 0.18 0.13 17.03 2 (Uji) 186000 38.3 4.83 0.17 0.06 15.04
Air merupakan salah satu kebutuhan utama mikroorganisme untuk dapat bertahan hidup. Menurut Devinny et al., (1999), mikroba membutuhkan media yang memiliki kadar air tinggi, yaitu pada rentang 40-60%. Dari Tabel 2, kadar air kedua biofilter berada dibawah 40%. Kadar air pada biofilter 2 sedikit lebih besar dibandingkan dengan biofilter 1. Hal ini disebabkan pada
biofilter 2 ditambahkan inokulum cair untuk perkembangan Nitrosomonas sp
Mikroorganisme dapat hidup baik pada pH 6-8 (Kleinjan, 2005). pH yang terdapat pada kedua biofilter cenderung bersifat asam sehingga kurang baik untuk pertumbuhan bakteri. Hal ini dapat disebabkan terjadinya kondisi aerob pada karung-karung tanah yang diletakkan di tempat terbuka. Pada kondisi aerob, senyawa nitrogen yang terdapat pada tanah akan ternitrifikasi menjadi nitrat (NO3-) yang bersifat asam (Hanafiah, 2005).
Sebagai salah satu unsur esensial dalam tanah, jumlah N pada tanah secara umum adalah 0.1% (Anonim, 1991). Dari data didapat bahwa jumlah N total pada biofilter 1 adalah 0.18%, sedangkan pada biofilter 2 0.17%. Menurut Hanafiah (2005), kadar nitrogen yang terdapat pada tanah adalah selisih penambahan secara fiksasi kimia atau biologi dan pupuk N dikurangi dengan kehilangan N yang terjadi akibat immobilisasi tanaman, volatilasi selama mineralisasi N, denitrifikasi N-nitrat dan pelindian N-mineral.
Unsur sulfur merupakan salah satu unsur hara makro yang terdapat pada tanah. Unsur ini dimanfaatkan tanaman terutama dalam bentuk SO42-. Pada penelitian ini, didapatkan kandungan sulfur total pada biofilter 1 adalah 0.13% sedangkan pada biofilter 2 sebesar 0.06%.
Unsur C atau karbon merupakan salah satu unsur penting dalam pertumbuhan mikroorganisme yaitu sebagai sumber energi. Dari data yang didapat terlihat bahwa jumlah C total pada kedua biofilter tidak berbeda terlalu jauh yaitu 17.03% pada biofilter 1 dan 15.04% pada biofilter 2.
B. INLET NH3 DAN H2S
Pada industri pengolahan lateks, amoniak merupakan salah satu bahan kimia yang paling banyak digunakan, mulai dari proses penyadapan hingga proses utama lainnya. Gas amoniak yang terdapat pada gudang leum sendiri berasal dari sisa-sisa amoniak yang tercampur pada leum yang telah membeku secara alami saat disadap.
Gas hidrogen sulfida yang terdapat pada gudang leum berasal dari proses pembusukan leum selama proses penyimpanan. Proses pembusukan
terjadi karena leum mengandung nutrisi yang dibutuhkan mikroorganisme pembusuk (Zuhra, 1996).
1.Inlet Gas Amoniak
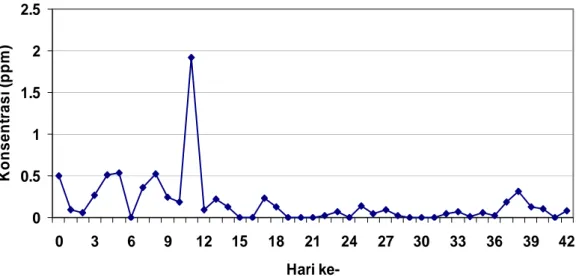
Menurut Keputusan Menteri Lingkungan Hidup no 50 tahun 1996, baku mutu polutan NH3 untuk industri pengolahan lateks adalah 2 ppm. Pada penelitian ini, konsentrasi NH3 pada gudang leum selama penelitian berlangsung berkisar antara 0.01-0.46 ppm (Gambar 5). Berdasarkan keputusan tersebut, gas amoniak yang terdapat di gudang leum masih berada dibawah baku mutu. Gas amoniak yang terdapat di gudang leum berasal dari sisa-sisa amoniak pada saat penyadapan yang digunakan untuk menghindari pembekuan lateks selama proses penyadapan hingga tiba di pabrik pengolahan. Hal ini menyebabkan konsentrasi amoniak di gudang leum cukup rendah. Penambahan obat pengurang bau yang disebut deorub
juga turut berpengaruh dalam mengurangi konsentrasi gas amoniak.
0 0.5 1 1.5 2 2.5 0 3 6 9 12 15 18 21 24 27 30 33 36 39 42 Hari ke-m ) n tr as i ( p p n se K o
Gambar 5. Konsentrasi Inlet Gas Amoniak Selama Penelitian
Pada hari ke- 10 dan hari ke- 19 hingga 22 terjadi peningkatan konsentrasi gas amoniak yang cukup besar. Berdasarkan pengamatan di lapangan, peningkatan konsentrasi amoniak terjadi saat penambahan jumlah leum yang ditampung di gudang. Pada leum segar yang baru dibawa dari
kebun terdapat amoniak yang masih tersisa sehingga konsentrasi gas amoniak di gudang akan meningkat.
2.Inlet Gas Hidrogen Sulfida
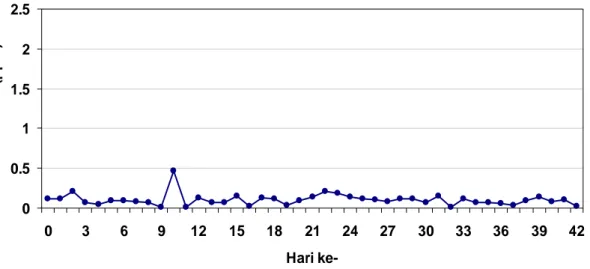
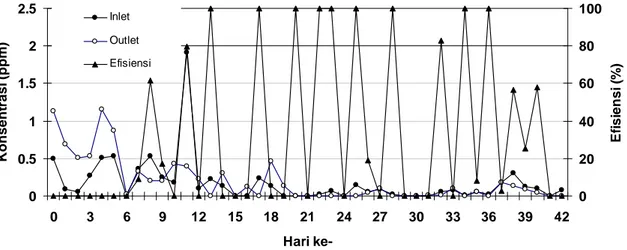
Menurut Keputusan Menteri Lingkungan Hidup no 50 tahun 1996, baku mutu polutan H2S untuk industri pengolahan lateks adalah 0.02 ppm. Pada penelitian ini, konsentrasi H2S pada gudang leum selama penelitian berlangsung berada pada rentang 0-1.9 ppm (Gambar 6). Berdasarkan keputusan tersebut, gas hidrogen sulfida yang terdapat pada gudang leum berada diatas baku mutu yang telah ditetapkan. Gas hidrogen sulfida dihasilkan dari proses pembusukan pada leum yang menumpuk di gudang.
0 0.5 1 .5 2 .5 0 3 6 9 12 15 18 21 24 27 30 33 36 39 42 Hari ke-K o n sen tr asi ( p p m ) 2 1
Gambar 6. Konsentrasi Inlet Gas Hidrogen Sulfida Selama Penelitian
Menurut Zuhra (1996), lateks kebun terdiri dari beberapa fraksi yang didapat melalui proses sentrifugasi yaitu:
a.Fraksi Lateks: karet, protein, lipida, ion logam
b.Fraksi Frey Wyssling: karotenoid, lipida, air, karbohidrat c.Fraksi Serum: senyawa nitrogen, asam nukleat, nukleotida d.Fraksi Dasar: air, protein, senyawa nitrogen, karet.
Bahan-bahan yang terdapat pada fraksi tersebut merupakan nutrien bagi mikroorganisme pembusuk yang menghasilkan sisa metabolisme berupa gas hidrogen sulfida.
Mulai dari hari ke- 19 hingga 42, konsentrasi gas hidrogen sulfida cenderung stabil dengan konsentrasi dibawah 0.5 ppm. Hal ini disebabkan penambahan deorub untuk mengurangi bau menyengat hidrogen sulfida saat leum akan mulai diproses menjadi crumb rubber.
C. KINERJA BIOFILTER 1
1.Penghilangan Amoniak (NH3)
Biofilter 1 merupakan biofilter kontrol yang dioperasikan tanpa penambahan bakteri Nitrosomonas sp dan Thiobacillus sp. Kinerja dari
biofilter 1 dapat dilihat pada Gambar 7.
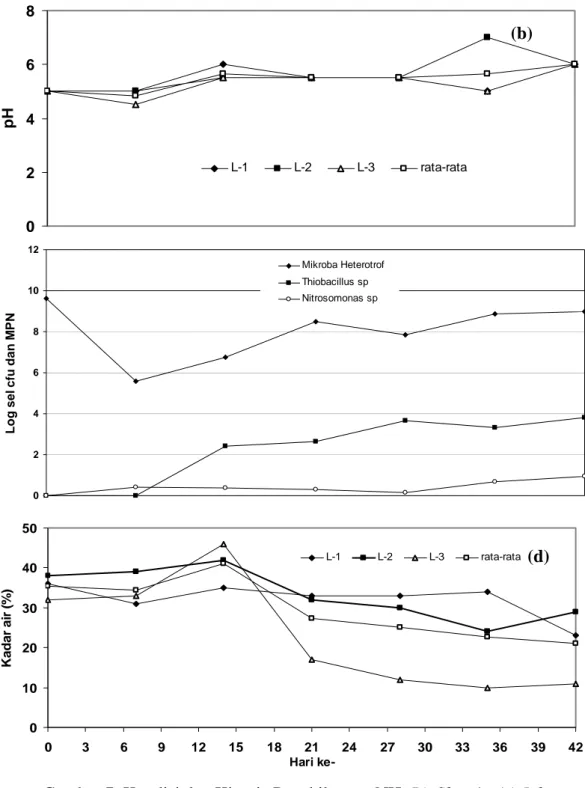
Pada Gambar 7, terlihat ketidakstablian efisiensi pengilangan gas amoniak oleh biofilter 1. Selama penelitian berlangsung, efisiensi berkisar antara 0-85%. Pada hari ke-0 hingga ke-5 efisiensi berfluktuasi antara 0- 43%. Efisiensi yang rendah ini disebabkan tidak adanya bakteri pengoksidasi amoniak sehingga amoniak yang masuk ke dalam biofilter
hanya diserap secara fisik oleh bahan pengisi. Saat memasuki hari ke-7, bakteri Nitrosomonas sp mulai tumbuh sebanyak 0.9x101 sel/ g bahan kering (Gambar 7c). Peningkatan jumlah Nitrosomonas sp juga berpengaruh langsung terhadap efisiensi pada hari ke- 6 yaitu sebesar 50%. Walaupun terjadi peningkatan jumlah Nitrosomonas sp, namun jumlahnya hanya sedikit. Selain tidak ditambahkan starter Nitrosomonas sp, hal ini juga dipengaruhi oleh pH bahan pengisi yang asam dan kadar air yang rendah pada hari ke-7 yaitu 34.3% (Gambar 7d). Menurut Deviny et al.,
(1999), kadar air optimal untuk pertumbuhan mikroorganisme adalah 40-60%.
Efisiensi pada hari ke-8 meningkat menjadi 71% namun turun menjadi 0% mulai dari hari ke-9 hingga hari ke 12. Penurunan efisiensi
0 0 0 0 0.6 0.7 0 3 6 9 12 15 18 21 24 27 30 33 36 39 42 Hari ke-K o n sen tr asi ( p p m ) 0 20 40 60 80 100 E fis ie n s i ( % ) 0.1 0.2 .3 .4 .5 Inlet Outlet Efisiensi
berdasarkan konsentrasi NH3 pada outlet lebih besar dibandingkan pada
inlet. Hal ini dapat disebabkan kondisi anaerobik yang terjadi pada biofilter
1. Kondisi anaerobik menyebabkan tanah pada bahan pengisi merubah senyawa nitrogen didalamnya menjadi amonium (NH4+) (Hanafiah, 2005), sehingga hasil yang didapatkan pada outlet merupakan penjumlahan antara amoniak yang dioksidasi Nitrosomonas sp dan amonisasi senyawa nitrogen pada tanah.
Kecederungan penurunan efisiensi terjadi mulai dari hari ke-13 hingga hari ke-28. Hal ini disebabkan berkurangnya jumlah Nitrosomonas sp dari 0.7x101 menjadi 0.3x101 sel/ g bahan kering. Penurunan jumlah
Nitrosomonas sp disebabkan mulai dari ke-14 hingga hari ke-28 terjadi penurunan kadar air yang cukup tinggi yaitu dari 41 menjadi 25%. Kadar air yang terlalu rendah menyebabkan bakteri tidak dapat hidup dan berkembang dengan baik.
Pada hari ke-29 hingga hari ke-31, efisiensi biofilter 1 kembali meningkat dari 26 menjadi 85% secara bertahap. Walaupun kadar air semakin berkurang, pH bahan pengisi cenderung naik mendekati netral sehingga jumlah Nitrosomonas sp 0.3x101 sel/ g bahan kering pada hari ke-28 menjadi 2.2x101 / g sel bahan kering pada hari ke-35.
Pada proses nitrifikasi, senyawa nitrogen akan menghasilkan nitrat (NO3-) yang bersifat asam. Penumpukan nitrat pada bahan pengisi biofilter
menyebabkan penurunan pH. Dari data yang diperoleh, pH awal pada
biofilter 1 cenderung asam yaitu 5, namun pada hari ke-42 pH menjadi 6 (Gambar 7b). Hal ini terjadi akibat kondisi anaerobik saat blower mati sehingga menghasilkan amonium (NH4+) yang bersifat basa dan menaikkan pH bahan pengisi biofilter.
0 2 4 6 8 10 12 Log se l c fu dan M P N Mikroba Heterotrof Thiobacillus sp Nitrosomonas sp 0 2 4 6 8
2.Penghilangan Hidrogen Sulfida (H2S)
Berdasarkan pengukuran gas hidrogen sulfida dari outlet biofilter 1, didapat efisiensi penghilangan berkisar antara 0-100% (Gambar 8).
pH rata-rata (b) L-1 L-2 L-3 0 10 20 30 40 50 0 3 6 9 12 15 18 21 24 27 30 33 36 39 42 Hari ke-rata-rata (d) L-1 L-2 L-3 ir (% ) d a r a K a
Gambar 7. Kondisi dan Kinerja Penghilangan NH3 Biofilter 1 : (a) Inlet- Outlet dan Efisiensi, (b) pH, (c) Jumlah Mikroba Heterotrof, Thiobacillus sp dan Nitrosomonas sp, (d) Kadar Air
Efisiensi pada hari ke-0 hingga hari ke-6 menunjukkan nilai 0%. Tidak terjadinya oksidasi hidrogen sulfida disebabkan tidak terdapat bakteri
Thiobacillus sp yang hidup sampai dengan hari ke-7. Pada hari ke-8, terjadi peningkatan efisiensi yang signifikan, yaitu sebesar 61% dan 79% pada hari ke-11. Penghilangan hidrogen sulfida ini terjadi karena mulai dari hari ke-7 hingga hari ke-14 terdapat Thiobacillus sp yang tumbuh sebesar 5.2x103 sel/ g bahan kering.
Dimulai hari ke-7 hingga hari ke-27, terjadi fluktuasi efisiensi antara 0-100% yang berselang setiap satu atau dua hari. Efisiensi bernilai 0% karena konsentrasi hidrogen sulfida yang terukur pada outlet lebih besar dibandingkan inlet. Hal ini dapat terjadi akibat hidrogen sulfida yang tidak teroksidasi secara sempurna terakumulasi pada bagian atas biofilter
sehingga walaupun pengukuran hidrogen sulfida pada inlet bernilai 0 ppm, pada bagian outlet akan tetap terdeteksi adanya hidrogen sulfida.
0 0.5 1 1.5 2 2.5 0 3 6 9 12 15 18 21 24 27 30 33 36 39 42 Hari ke-K o n sent asi ppm ) 0 20 40 60 80 100 E fi s ie n s i ( % ) Inlet Outlet Efisiensi ( r
Gambar 8. Kinerja Penghilangan H2S Biofilter 1
Pada hari ke-0 hingga hari ke-7 tidak ditemukan adanya Thiobacillus sp (Gambar 7c). Hal ini disebabkan karena tidak dilakukan penambahan starter Thiobacillus sp pada biofilter 1. Memasuki hari ke-14, Thiobacillus sp mulai tumbuh sebanyak 5.2x103 sel/ g bahan kering. Thiobacillus sp
sendiri merupakan bakteri yang hidup pada kondisi asam (Wikipedia, 2008). Kondisi pH biofilter 1 yang cukup asam serta konsentrasi hidrogen sulfida yang ada di biofilter memicu pertumbuhan Thiobacillus sp.
3.Konsentrasi Nitrogen, Sulfur dan Karbon Pada Biofilter 1
Pengujian N total dilakukan untuk mengetahui N yang terdapat pada bahan pengisi, terutama N organik dan amonium (NH4+). Dari data selama pengamatan, kandungan N total awal bahan adalah 1800 ppm dan terus meningkat sampai dengan hari ke-21 yaitu 13700 ppm (Gambar 9a). Kenaikan konsentrasi N total juga diikuti kenaikan konsentrasi nitrat (NO3_) dan amonium (NH4+) pada bahan pengisi biofilter. Hal ini disebabkan nitrogen yang terdapat pada bahan pengisi berupa nitrat, nitrit, amonium dan nitrogen organik. Pada hari ke-28, konsentrasi N total berkurang menjadi 3100 ppm dan kembali meningkat di hari ke-35 menjadi 6800 ppm. Pada akhir pengamatan konsentrasi N total pada biofilter 1 adalah 2800 ppm.
Konsentrasi S total selama penelitian cenderung mengalami peningkatan (Gambar 9b). Pada hari ke-0 konsentrasi S total adalah 0.13% dan sempat menurun menjadi 0.08% pada hari ke-7. Setelah itu konsentrasi S total terus mengalami peningkatan mulai hari ke-14, 21, 28, 35 dan 42 menjadi 0.11; 0.12; 0.24; 0.37; dan 0.38%. Peningkatan konsentrasi sulfat yang terbentuk memiliki pola yang sama dengan S total. Peningkatan konsentrasi sulfat ini terjadi akibat pengoksidasian hidrogen sulfida oleh
Thiobacillus sp. Konsentrasi sulfat awal pada bahan pengisi adalah 0.3% dan sempat menurun pada hari ke-7 menjadi 0.24%. Konsentrasi sulfat pada akhir pengamatan adalah 1.14%.
Konsentrasi karbon sangat berhubungan dengan populasi bakteri heterotrof yang terdapat pada bahan pengisi karena karbon merupakan sumber energi bagi pertumbuhan dan kelangsungan hidup bakteri heterotrof. Kandungan awal karbon pada biofilter 1 adalah 17.03%. Pada hari ke-7 dan 14 konsentrasi karbon mengalami peningkatan menjadi 17.64% (Gambar 9c). Hal ini disebabkan populasi bakteri heterotrof pada hari ke-7 dan 14 mengalami penurunan dari 4.2x109 sel/ gr bahan kering menjadi 6.4x107 sel/ g bahan kering. Berkurangnya populasi bakteri heterotrof menyebabkan berkurangnya konsumsi karbon organik.
Memasuki hari ke-14 hingga hari ke-42, terjadi pertumbuhan populasi bakteri heterotrof. Hal ini menyebabkan konsentrasi karbon cenderung berkurang hingga pada hari ke-42 menjadi 13.57%.
0 4000 8000 12000 16000 N Total NO3 NH4 Konsen trasi (p pm ) (a) 0 0.4 0.8 1.2 1.6 K o n s en tra s i (% ) S Total SO4 (b) 0 5 10 15 20 0 3 6 9 12 15 18 21 24 27 30 33 36 39 42 Hari ke-K o n sen tr asi ( % ) C Organik (c)
Gambar 9. Konsentrasi Beberapa Unsur Pada Biofilter 1: (a) Nitrogen, (b) Sulfur, (c) Karbon
4.Kapasitas Penyerapan N dan S oleh Biofilter 1
a.Kapasitas Penyerapan N oleh Biofilter 1
Pada Gambar 10 terlihat bahwa beban yang masuk ke dalam
biofilter 1 berada pada rentang 0.009-0.376 g-N/ kg bahan kering/ hari, sedangkan kapasitas penyerapan N berkisar antara 0-0.167 g-N/ kg bahan kering/ hari. Garis diagonal merupakan tingkat efisiensi penyerapan. Titik-titik yang berada lebih dekat dengan garis diagonal menunjukkan efisiensi yang lebih baik.
0 0.1 0.2 0.3 0.4 0 0.1 0.2 0.3
Beban (g-N/ kg bahan kering/ hari)
P en yerap an ( g -N / kg b ah an ker in g / h ari ) 0.4
Gambar 10. Kapasitas Penyerapan N Terhadap Beban yang Masuk ke Biofilter 1
Dari data tersebut dapat terlihat beban maksimal yang dapat diserap dengan baik oleh biofilter adalah sebesar 0.107 g-N/ kg bahan kering/ hari dengan penyerapan yang terjadi sebesar 0.097 g-N/ kg bahan kering/ hari. Jika beban yang diterima lebih besar, maka efisiensi penyerapan N akan semakin kecil. Hal ini dapat dilihat saat beban yang diberikan sebesar 0.376 g-N/ kg bahan kering/ hari, maka penyerapan N hanya sebesar 0.167 g-N/ kg bahan kering/ hari.
Untuk jumlah beban yang sama, seringkali terdapat penyerapan yang berbeda. Hal ini terjadi akibat efisiensi kinerja biofilter yang berfluktuatif selama penelitian berjalan.
b.Kapasitas Penyerapan S oleh Biofilter 1
Pada Gambar 11 terlihat bahwa beban yang masuk ke dalam
biofilter 1 berkisar antara 0-3.6 g-S/ kg bahan kering/ hari, sedangkan penyerapan S berkisar antara 0-3.17 g-S/ kg bahan kering/ hari.
0 1 2 3 4 0 1 2 3 4
Beban (g-S/ kg bahan kering/ hari)
P e ny e ra pa n (g-S / k g ba ha n k e ri ng/ ha ri )
Gambar 11. Kapasitas Penyerapan S Terhadap Beban yang Masuk ke Biofilter 1
Dari gambar tersebut dapat dilihat bahwa beban S selama penelitian berlangsung cenderung berada pada kisaran 0-0.5 g-S/ kg bahan kering/ hari dan penyerapan yang terjadi cukup baik.
Beban paling besar yang masuk ke biofilter adalah 3.6 g-S/ kg bahan kering/ hari dan penyerapan yang terjadi sebesar 3.17 g-S/ kg bahan kering/ hari.
D. KINERJA BIOFILTER 2
1.Penghilangan Amoniak (NH3)
Biofilter 2 merupakan biofilter uji yang dioperasikan dengan penambahan bakteri Nitrosomonas sp dan Thiobacillus sp. Kinerja dari
biofilter 2 dapat dilihat pada Gambar 12.
Selama penelitian berlangsung, efisiensi biofilter 2 berada antara 0-85% (Gambar 12a). Pada hari ke-0 dan hari ke-1, efisiensi bernilai 0%. Pengukuran di lapangan menghasilkan konsentrasi amoniak pada outlet
yang lebih besar dibandingkan dengan inlet. Hal ini terjadi karena kondisi anaerobik pada biofilter. Kondisi anaerobik menyebabkan senyawa nitrogen pada tanah bereaksi membentuk amonium (NH4+) (Hanafiah, 2005), sehingga hasil yang didapatkan pada outlet merupakan penjumlahan antara amoniak yang dioksidasi Nitrosomonas sp dan amonisasi senyawa nitrogen pada tanah. Jumlah Nitrosomonas sp pada hari ke-0 cukup besar yaitu 1.4x106 sel/ g bahan kering (Gambar 12c) dan kadar air sebesar 38.3% yang cukup baik untuk pertumbuhan mikroba (Gambar 12d).
Pada hari ke-7, terjadi penurunan jumlah Nitrosomonas sp yang cukup signifikan menjadi 1.1x101 sel/ g bahan kering. Penurunan jumlah
Nitrosomonas sp terjadi akibat penurunan kadar air menjadi 36% pada hari ke-7. Penurunan jumlah Nitrosomonas sp ini juga berpengaruh langsung terhadap efisiensi kinerja biofilter 2 yang menurun dari 19% pada hari ke-6 menjadi 0% pada hari ke-7 hingga hari ke-11.
Efisiensi biofilter kembali meningkat pada hari ke-12 menjadi 83%. Peningkatan efisiensi ini berbanding lurus dengan jumlah Nitrosomonas sp
yang hidup dan kadar air pada biofilter. Selain kadar air yang cukup, tumbuhnya Nitrosomonas sp didukung oleh meningkatnya pH pada bahan pengisi mendekati 6 yang cocok untuk perkembangan Nitrosomonas sp.
Pada hari ke-18 efisiensi biofilter mencapai 50% namun mengalami penurunan hingga pada hari ke-21 efisiensi kembali bernilai 0%. Nilai ini terus bertahan hingga hari ke-28. Kondisi ini disebabkan penurunan kadar
air dari 35.6% pada hari ke-21 menjadi 34% pada hari ke-28. Hal ini menyebabkan jumlah Nitrosomonas sp turun menjadi 0.9x101 sel/ gr bahan kering.
Efisiensi biofilter 2 kembali meningkat pada hari ke-29 menjadi 81% dan mencapai nilai maksimumnya pada hari ke-31 yaitu 85%. Dimulai hari ke-32 hingga hari ke-42 terlihat efisiensi cenderung mengalami penurunan meskipun sempat naik pada hari ke-34, 37 dan 31.
Kadar air awal pada biofilter 2 lebih tinggi dibandingkan dengan
biofilter 1 karena adanya penambahan inokulum cair Nitrosomonas sp dan
Thiobacillus sp. Penambahan ini juga menyebabkan bahan pengisi pada
biofilter 2 lebih padat sehingga kadar air pada setiap pengukuran tidak berbeda terlalu jauh. Kepadatan bahan pengisi yang tinggi menyebabkan air sulit untuk mengalir karena pori-pori pada tanah mengecil dan jumlahnya tidak terlalu banyak (Hanafiah, 2005).
0 0.1 2 3 4 5 0.6 0.7 Ko nsen trasi (ppm ) 20 40 60 80 100 Efisi e nsi (% ) (a) Inlet 0. 0. 0. 0. Outlet Efisiensi 0 0 2 4 6 8 0 3 6 9 12 15 18 21 24 27 30 33 36 39 42 Hari ke-pH L-1 L-2 L-3 rata-rata (b)
0 10 20 30 40 50 0 3 6 9 12 15 18 21 24 27 30 33 36 39 42 Hari ke-K a d a r a ir(% ) L-1 L-2 L-3 rata-rata 0 2 4 6 8 10 12 Log s e l c fu da n M P N Mikroba Heterotrof Thiobacillus sp Nitrosomonas sp (c) (d)
Gambar 12. Kondisi dan Kinerja Penghilangan NH3 Biofilter 2 : (a) Inlet- Outlet dan Efisiensi, (b) pH, (c) Jumlah Mikroba Heterotrof, Thiobacillus sp dan Nitrosomonas sp, (d) Kadar Air
2.Penghilangan Hidrogen Sulfida
Efisiensi penghilangan hidrogen sulfida biofilter 2 selama penelitian berlangsung berkisar antara 0-100% (Gambar 13). Pada hari ke-0 sampai dengan hari ke-10 efisiensi bernilai sangat kecil dan peningkatan efisiensi yang cukup besar terjadi pada hari ke-11. Ketidakstabilan efisiensi ini terjadi akibat sedikitnya Thiobacillus sp yang tumbuh. Walaupun telah ditambahkan inokulum Thiobacillus sp, pada hari ke-0 hingga hari ke-7 tidak ditemukan Thiobacillus sp yang hidup pada biofilter. Memasuki hari ke-14 barulah terdapat Thiobacillus sp sebanyak 2.9x103 sel/ g bahan kering (Gambar 12c).
Efisiensi berlangsung cukup baik pada hari ke-19 hingga hari ke-25. Jika dilihat dari jumlah Thiobacillus sp yang tumbuh, maka terlihat pada hari ke-14 hingga hari ke-28 Thiobacillus sp tumbuh dengan baik sehingga
0 0.5 1 1.5 2 2.5 0 3 6 9 12 15 18 21 24 27 30 33 36 39 42 Hari ke-K o n s e n tr a s i (p p m ) 0 20 40 60 80 100 E fis ie n s i ( % ) Inlet Outlet Efisiensi
Gambar 13. Kinerja Penghilangan H2S Biofilter 2
didapat korelasi antara Thiobacillus sp dengan efisiensi biofilter pada rentang waktu tersebut. Walaupun terjadi penurunan kadar air pada hari ke-14 sebesar 42% menjadi 34% pada hari ke-28, Thiobacillus sp masih dapat tumbuh dengan baik pada kadar air tersebut.
Memasuki hari ke-26, efisiensi biofilter turun drastis menjadi 0% dan bertahan hingga hari ke-30. Hal ini disebabkan menurunnya populasi
Thiobacillus sp dari 4.7x103 sel/ g bahan kering pada hari ke-28 menjadi 2.1x103 sel/ g bahan kering pada hari ke-35. Dari data ini terlihat penurunan jumlah Thiobacillus sp berpengaruh besar terhadap menurunnya efisiensi
biofilter.
Efisiensi biofilter 2 kembali meningkat menjadi 59% pada hari ke-32 dan 100% pada hari ke-33 sampai hari ke-36. Walaupun sempat turun pada hari ke-37, 39 dan 40, efisiensi memiliki kecenderungan konstan memasuki minggu terakhir pengamatan. Peningkatan Thiobacillus sp juga terlihat pada hari terakhir pengamatan yaitu sebesar 4.1x104 sel/ gr bahan kering.
Selama penelitian berlangsung dapat dilihat pH pada biofilter 2 cenderung stabil pada rentang 4.8-6 (Gambar 12b). Proses perombakan hidrogen sulfida oleh Thiobacillus sp akan menghasilkan sulfat (SO4-) yang bersifat asam. Hal ini berbeda dengan yang terlihat dari pengamatan selama penelitian. pH pada biofilter 2 dapat bertahan pada rentang 4.8-6 akibat kemampuan tanah sebagai buffer. Selain itu, pada awal pengamatan terjadi kondisi biofilter yang anaerobik akibat blower yang tidak bekerja 24 jam.
Kondisi ini akan menyebabkan tanah melakukan proses amonifikasi terhadap senyawa nitrogen yang ada pada tanah menjadi amonium (NH4+) yang bersifat basa sehingga pH pada biofilter cenderung meningkat.
3.Konsentrasi Nitrogen, Sulfur dan Karbon Pada Biofilter 2
Konsentrasi awal N total pada biofilter 2 adalah 1700 ppm (Gambar 14a). Jumlah ini tetap bertahan sampai dengan hari ke-7. Pada hari ke-14, konsentrasi N total meningkat menjadi 2000 ppm. Peningkatan ini disebabkan bertambahnya konsentrasi nitrat hasil pengoksidasian amoniak. Hal ini terlihat dari peningkatan konsentrasi nitrat dari 3358 ppm pada hari ke-0 menjadi 5740 ppm pada hari ke-14. Selain nitrat, peningkatan konsentrasi N total juga dipengaruhi peningkatan konsentrasi amonium dari 70 ppm pada hari ke-0 menjadi 106 ppm pada hari ke-14. Mulai dari hari ke-14, konsentrasi N total, nitrat dan amonium cenderung mengalami penurunan hingga akhir pengamatan. Penurunan ini terjadi akibat efisiensi
biofilter 2 yang kurang baik sehingga hasil dari pengoksidasian amoniak seperti nitrat dan amonium berkurang.
Konsentrasi S total awal pada biofilter 2 adalah 0.06% sedangkan konsentrasi sulfat adalah 0.18% (Gambar 14b). Dari grafik dapat dilihat bahwa pola konsentrasi antara S total dengan sulfat yang terbentuk memiliki kemiripan. Pada hari ke-7, konsentrasi sulfat meningkat menjadi 1.23%. Peningkatan konsentrasi sulfat ini mempengaruhi konsentrasi S total yang meningkat menjadi 0.41% pada hari yang sama. Konsentrasi sulfat cenderung mengalami kenaikan hingga akhir pengamatan. Hal ini menunjukkan bahwa terjadi proses pengoksidasian hidrogen sulfida pada
biofilter, hanya saja kinerjanya kurang baik karena konsentrasi sulfat dan S total tidak stabil.
Konsentrasi karbon organik awal pada biofilter 2 sebesar 15.04% dan pada hari ke-42, karbon organik yang tersisa sebesar 11.56% (Gambar 14c). Konsentrasi karbon organik berbanding terbalik dengan populasi bakteri heterotrof yang hidup karena semakin banyak populasi, semakin bertambah pula kebutuhan karbon organik sebagai sumber energi bagi bakteri
heterotof. Jumlah bakteri heterotrof pada hari ke-0 adalah 5.8x109 g sel/ gr bahan kering dan pada hari ke-42 menjadi 2.1x1010 sel/ gr bahan kering.
0 0.4 0.8 1.2 1.6 K o n s e n tr a s i (%) S Total SO4 0 0 5 10 15 20 0 3 6 9 12 15 18 21 24 27 30 33 36 39 42 Hari ke-K o n s en tr a si ( % ) C Organik 4000 8000 12000 000 K o n s e n tra s i (p p m ) 16 N Total NO3 NH4 (a) (b) (c)
Gambar 14. Konsentrasi Beberapa Unsur Pada Biofilter 2: (a) Nitrogen, (b) Sulfur, (c) Karbon.
4.Kapasitas Penyerapan N dan S oleh Biofilter 2
a.Kapasitas Penyerapan N oleh Biofilter 2
Kapasitas penyerapan N pada biofilter 2 dapat dilihat pada Gambar 15. Dari gambar tersebut dapat terlihat bahwa beban yang masuk ke dalam biofilter 2 berada pada rentang 0.008-0.327 g-N/ kg bahan kering/ hari sedangkan kapasitas penyerapan N berkisar antara 0-0.094 g-N/ kg bahan kering/ hari.
0 0.1 0.2 0.3 0.4 0 0.1 0.2 0.3
Beban (g-N/ kg bahan kering/ hari)
P e n yer ap an ( g -N / k g b ah an ker in g / ha ri ) 0.4
Gambar 15. Kapasitas Penyerapan N Terhadap Beban yang Masuk ke Biofilter 2
Penyerapan maksimal terjadi pada saat beban yang masuk ke dalam biofilter sebesar 0.102 g-N/ kg bahan kering/ hari. Penyerapan yang terjadi sebesar 0.094 g-N/ kg bahan kering/ hari. Saat beban yang masuk lebih besar dari 0.102 g-N/ kg bahan kering/ hari maka penyerapan yang terjadi akan menurun. Hal ini dapat dilihat dari titik-titik yang semakin jauh dari garis diagonal saat beban yang masuk mengalami peningkatan.
b.Kapasitas Penyerapan S oleh Biofilter 2
Kapasitas penyerapan S oleh biofilter 2 dapat dilihat pada gambar 16. Dari gambar terlihat bahwa beban yang masuk ke dalam biofilter 2 berkisar antara 0-3.138 g-S/ kg bahan kering/ hari, sedangkan kapasitas penyerapan S berkisar antara 0-2.838 g-S/ kg bahan kering/ hari.
0 1 2 3 4 0 1 2 3 4
Beban (g-S/ kg bahan kering/ hari)
P e ny e ra pa n ( g-S / k g ba ha n k e ri ng/ ha ri )
Gambar 16. Kapasitas Penyerapan S Terhadap Beban yang Masuk ke Biofilter 2
Beban yang masuk ke dalam biofilter selama penelitian berlangsung umumnya terdapat pada 0-0.4 g-S/ kg bahan kering/ hari dan penyerapan yang terjadi cukup baik karena banyak titik yang berada dekat dengan garis diagonal. Beban maksimal yang diterima sebesar 3.138 g-S/ kg bahan kering/ hari dengan kapasitas penyerapan yang cukup baik yaitu sebesar 2.8383 g-S/ kg bahan kering/ hari.
E. PERBANDINGAN KINERJA PENGHILANGAN N DAN S
Berikut adalah perbandingan kinerja penghilangan N dan S biofilter
pada penelitian sebelumnya:
Tabel 3. Perbandingan Penyerapan N dan S Biofilter pada Beberapa Pabrik Karet
Lokasi Penyerapan N (g-N/ kg BK/ hari) Penyerapan S (g-S/ kg BK/ hari) Sumber Pabrik RSS Cibungur, Bogor 2.87 0.02 Indriasari (2005) Pabrik Karet Sukamaju,
Sukabumi
67.29 2.56 Pahlevi
(2007) Pabrik Karet Cikumpay,
Purwakarta
0.16 3.17
Dari Tabel 3 terlihat bahwa kapasitas penyerapan N pada penelitian ini merupakan yang paling rendah dibandingkan dengan penelitian-penelitian sebelumnya yaitu sebesar 0.16 g-N/ kg bahan kering/ hari. Untuk kapasitas penghilangan S pada penelitian ini lebih tinggi dibandingkan dengan penelitian-penelitian sebelumnya yaitu sebesar 3.17 g-S/ kg bahan kering/ hari. Perbedaan kapasitas penyerapan N dan S biofilter ini disebabkan beberapa hal, diantaranya ialah penggunaan deorub dan bahan pengisi yang digunakan. Pabrik RSS Cibungur, tidak menggunakan deorub untuk mengantisipasi bau yang ditimbulkan dari gudang leum, sedangkan pabrik karet Sukamaju menggunakan deorub dengan dosis yang kecil dan waktu yang tidak beraturan. Penggunaan deorub yang teratur di pabrik karet Cikumpay menyebabkan pertumbuhan bakteri Nitrosomonas sp pada biofilter
terhambat sehingga proses pengoksidasian NH3 tidak berjalan dengan baik. Bahan pengisi biofilter yang digunakan di pabrik RSS Cibungur berupa tanah, kompos, sekam, serasah daun karet serta sludge dari instalasi pengolahan limbah cair pabrik karet. Penambahan sludge dan kompos mampu meningkatkan kinerja biofilter karena pada sludge dan kompos terdapat nutrisi
yang dibutuhkan oleh bakteri. Bahan pengisi yang digunakan pada biofilter di pabrik karet Cikumpay terdiri dari tanah dan sekam, serta kompos sebagai sumber nutrisi bakteri.
V. KESIMPULAN DAN SARAN
A. KESIMPULAN
Emisi amoniak yang terdapat pada gudang leum pabrik karet PTPN VIII Cikumpay berkisar antara 0.01-0.46 ppm sehingga masih berada dibawah baku mutu yang ditetapkan pemerintah yaitu 2 ppm. Emisi hidrogen sulfida berkisar antara 0-1.9 ppm, berada diatas baku mutu yang ditetapkan pemerintah yaitu 0.02 ppm.
Karakteristik bahan pengisi awal biofilter 1 memiliki kadar air 35.34% dan nilai pH 5.0. Kandungan N total, S total dan C total biofilter 1 secara berurutan adalah 0.18%; 0.13%; 17.03%. Bahan pengisi awal biofilter 2 memiliki kadar air 38.30% dan pH 4.8. Kandungan N total, S total dan C
biofilter 2 secara berurutan adalah 0.17%; 0.06%; 15.04%.
Efisiensi penghilangan amoniak pada biofilter 1 (kontrol, tanpa penambahan starter bakteri) berkisar antara 0-85%, dengan efisiensi rata-rata sebesar 26.62%. Kinerja penghilangan amoniak biofilter 1 kurang baik karena efisiensinya rendah dan tidak stabil. Untuk penghilangan hidrogen sulfida, efisiensi berkisar antara 0-100% dengan efisiensi rata-rata sebesar 31.42%. .
Efisiensi penghilangan amoniak pada biofilter 2 (uji, dengan penambahan starter bakteri) berkisar antara 0-85% dengan efisiensi rata-rata sebesar 20.42%. Kinerja penghilangan amoniak tidak cukup baik karena terjadi sangat berfluktuasi dan efisiensi yang rendah. Untuk penghilangan hidrogen sulfida, efisiensi berkisar antara 0-100% dengan efisiensi rata-rata sebesar 29.42%.
Pada akhir penelitian, kadar air pada biofilter 1 mengalami penurunan menjadi 21.00%, sedangkan pH mengalami peningkatan menjadi 6.0. Kandungan N total, S total dan C total biofilter 1 pada akhir pengamatan secara berurutan adalah 0.28%; 0.38%; 13.57%. Kadar air biofilter 2 menurun menjadi 36.67% dan pH meningkat menjadi 6.0. Kandungan N total, S total dan C total biofilter 2 pada akhir pengamatan secara berurutan adalah 0.24%; 0.46%; 11.56%.
Kisaran populasi bakteri Thiobacillus sp pada biofilter 1 dan 2 adalah sampai dengan 6.54x104 sel/ g-contoh dan sampai dengan 4.1x104 sel/ g-contoh. Populasi bakteri Nitrosomonas sp pada biofilter 1 dan 2 adalah sampai dengan 2.8x101 sel/ g-contoh dan 0.9x101-1.4x106 sel/ g-contoh. Kisaran populasi bakteri heterotrof pada biofilter 1 dan 2 adalah 6.40x107 -1.13x1010 sel/ g-contoh dan 6.01x108-1.13x1010 sel/ g-contoh.
Kapasitas penyerapan N oleh biofilter 1 berkisar antara 0-0.16 g-N/ kg bahan kering/ hari sedangkan penyerapan S berkisar antara 0-3.17 g-S/ kg bahan kering/ hari. Kapasitas penyerapan N oleh biofilter 2 berkisar antara 0.094 g-N/ kg bahan kering/ hari sedangkan penyerapan S berkisar antara 0-2.83 g-S/ kg bahan kering/ hari.
B. SARAN
1.Dalam perancangan biofilter, dibutuhkan perhitungan waktu kontak yang tepat antara polutan dengan bahan pengisi yang mengandung bakteri pengoksidasi polutan sehingga didapat jumlah flow inlet yang sesuai agar polutan dapat teroksidasi secara sempurna dan meningkatkan kinerja
biofilter.
2.Dibutuhkan dua buah blower yang bekerja secara bergantian agar biofilter
selalu dalam kondisi aerobik. Alternatif lain adalah penggunaan blower yang tahan bekerja 24 jam dalam rentang waktu yang cukup lama.
3.Untuk menjaga populasi bakteri pengoksidasi diperlukan pengaturan kondisi bahan pengisi yang lebih cermat, terutama kadar air dan pH.
4.Gudang leum sebaiknya menerapkan sistem first in-first out (FIFO) agar leum tidak menumpuk terlalu lama di gudang yang menyebabkan kosensentrasi H2S menjadi tinggi, selain itu penggunaan deorub harus dihentikan apabila ingin mengaplikasikan biofilter karena uap deorub yang masuk ke biofilter dapat membunuh bakteri Nitrosomonas sp pada biofilter.
DAFTAR PUSTAKA
Anonim. 1991. Kimia Tanah. Direktorat Jendral Pendidikan Tinggi, Departemen Pendidikan dan Kebudayaan, Jakarta
Anonim. 2005. Ammonia. (online). Diperoleh dari http :// en.wikipedia. org/ wiki/ Ammonia ( 13 Juni 2008).
Anonim. 2005. Thiobacillus. (online). Diperoleh dari http :// genome.jgi-psf. org/ finished_microbes/ niteu/ niteu. home. html (13 Juni 2008)
BPS. 2002. Perkebunan Besar. Badan Pusat Statistik.
Buckman, H. O dan N. C. Brandy. 1982. Ilmu Tanah. Bharata Karya Aksara, Jakarta
Chou, M. S dan W. H. Cheng. 1997. Screening Biofiltering Material for VOC Treatment. Journal of The Air and Waste Managment Association; 47: 674-681.
Devinny, J. S., M. A Deshusses dan T. S. Webster. 1999. Biofiltration fo Air Pollution Control. Lewis Publishers, New York
Edmons, P. 1978. Microbiology an Environmental Perspective. Collier Macmillan, London.
Gaur, A. R. 1983. Manual of Rural Composting. FAO.
Goutara, B., Djatmiko dan W. Tjiptadi. 1985. Dasar Pengolahan Karet. Teknologi Industri Pertanian FATETA IPB, Bogor.
Hanafiah, K. A. 2005. Dasar-Dasar Ilmu Tanah. PT RajaGrafindo Persada, Jakarta.
Hirai, M., M. Kamamoto, M. Yani dan M. Shoda. 2001. Comparison of The Biological NH3 Removal Characteristics Amoung Four Inorganic Packing
Materials. Journal of Bioscience and Bioengineering. Vol 91(4):396-402. Indriasari, S. 2005. Penerapan Teknik Biofilter Skala Pilot Pada penghilangan
Gas Penyebab Bau Dari Gudang Penyimpanan Leum Industri Karet (Ribbed Smoke Sheet). Tesis. Program Pascasarjana. Institut Pertanian Bogor, Bogor.
Kleinjan, W. 2005. Biologically Produced Sulfur Particles and Polysulfide Ions. Wageningen. Wageningen Univesiteit.
Martin, R. W., J. R. Mihelcic dan J. C. Crittenden. 2004. Design and Performance Strategy Using Modeling for Biofiltration Control of Odorous Hydrogen Sulfide. Journal of The Air and Waste Management Association vol 54(7):834-844.
Ottengraf, S. P. P. 1986. Exhaust Gas Purification in Biotechnology 8 (eds). Rehm, H. J and Reed, G. VCH.
Pahlevi, D. 2007. Penghilangan Emisi Bau Pada Pabrik Karet Remah. Skripsi. Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor, Bogor.
Schmidt, D., K. Janni dan R. Nicolai. 2004. Biofilter Design Information. Department of Biosystems and Agricultural Engineering University of Minnesota.
Solichin, M. 1988. Permasalahan dan Pencegahan Prokoagulasi Lateks Kebun. Lateks Vol III. 2:18-21.
Turk, A., J. Turk dan J. T Wittes. 1972. Ecology, Pollution, Environment. W. B Saunders Company, Philadelphia.
Zuhra, C. F. 2006. Karet. Karya Ilmiah. Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Sumatera Utara.
Lampiran 1. Metode Analisis Penelitian
1.Pengujian NH3 (SNI 19-7119.1-2005)
Buat terlebih dahulu larutan Nessler dengan melarutkan 160 g NaOH pada 500 ml akuades dalam labu takar 1 liter dan dinginkan. Timbang 100 g HgI2 dan 70 g KI, kemudian larutkan pada gelas piala dengan sedikit akuades. Selanjutnya larutan ini ditarnbahkan sedikit demi sedikit ke dalam labu takar yang telah berisi larutan NaOH. Campuran yang terbentuk diencerkan sampai tanda tera. Untuk penetapannya, takar 50 ml sampel yang telah berisi NH3 dipipet pada labu takar 50 ml kemudian tambahkan dengan 1 ml larutan Nessler. Campuran yang berada di labu takar di kocok dan didiamkan selarna 10 menit sebelurn diukur dengan menggunakan spektrofotometer dengan panjang gelombang 400-425 nm. Tentukan konsentrasi NH3 dengan menggunakan larutan NH4Cl pada konsentrasi 10mg NH3-N/liter.
2.Pengukuran H2S (Herwati, 2002)
Bahan
a. Larutan Penyerap Zn Acetat 5 %
b. Larutan Diamin 0.15 % (N, N-Dimethyl-l,4-Phenylen Diamonium Diklorida)
c. Larutan FeCI3 25 %
d. Larutan Induk Standar H2S (Na2S.9H2O 0.12 %) e. Aquades
f. Larutan Natrium Thiosulfat 0.1 N g. Larutan lodin 0.1 N
h. Larutan Indikator Amilum i. Larutan HCI.
Alat
a. Labu Ukur 50 ml
c. Erlenmeyer d. Buret 50 ml
e. Spektrophotometer UV-Vis
Cara Kerja
a.Larutan Kurva Standar Kalibrasi H2S
Sediakan 6 buah labu ukur 50 ml. Ke dalam rnasing-masing labu ukur pipet 0.05; 0.1; 0.2: 0.3 dan 0.4 ml larutan induk standar H2S 86.904ppm Kedalam masing-masing labu tersebut tambahkan 1 ml larutan Diamin dan 1.5 ml larutan FeCI3 dan 10 ml larutan penyerap Zn-Acetat, kemudian encerkan dengan akuades hingga tanda tera. Ukur absorbansinya dengan spektrofotometer setelah 15 - 30 menit pada panjang gelombang 560 nm dan gunakan blanko, yaitu labu ukur berisi 0 ml larutan induk standar H2S.
* Standarisasi larutan induk standar H2S b.Larutan Sampel
Pindahkan larutan penyerap yang telah mengandung H2S ke dalam labu ukur 50 ml, tambahkan 1 ml larutan diamin dan 1.5 ml larutar FeCI3. Encerkan dengan air suling hingga tanda tera. Ukur dengan spektrofotometer seperti pada pengukuran standar kalibrasi H2S.
c.Hitung Kandungan H2S di Udara dalam µ/M3
µg x t + 273 x 1000 H2S µ/M3) =
V 298
µg = µg sampel H2S yang didapat dari grafik t = Suhu dalam °C
V = Volume udara dalam L
Pipet 10 ml larutan induk standar H2S kedalam Erlenmeyer, tambahkan 5 ml larutan iodine 0.1 N dan 5 ml lautan HCI 0.1 N. Titrasi kelebihan iodin dengan larutan Natrium Thiosulfat 0.1 N (gunakan larutan indikator amilum). Lakukan titrasi blanko dengan rnenggunakan 10 ml air suling sebagai pengganti larutan induk standar H2S
(A-B) x N x 0.0017 x 1000 x 1000 H2S (µ/ml) =
0.1x 10
A = Volume Natrium Thiosulfat unruk penitaran blanko (ml) B = Volume Natrium Thiosulfat untuk penitaran sampel (ml) N = Normalitas Natriuin Thiosulfat
Standarisasi dilakukan setiap kali digunakan
3.Pengukuran pH
Pengukuran pH cairan kultur dilakukan dengan menggunakan pH-meter yang telah dikalibrasi dengan menggunakan larutan buffer standar. Sampel cairan kultur langsung diukur dengan pH-meter tanpa dilakukan pengenceran terlebih dahulu.
4.Pengukuran Kadar Air (AOAC, 1995)
Cawan porselen dikeringkan dalam oven pada suhu 100-105 °C selama 1 jam (sampai didapat berat konstan cawan). Dinginkan cawan dalarn desikator selama 30 menit setelah itu ditimbang. Contoh yang akan ditentukan kadar airnya ditimbang sebanyak 2-5 gram. Cawan yang telah berisi contoh dimasukan dalam oven bersuhu 100-105°C selama 5 jam sampai bobotnya konstan. Kadar air dihitung berdasarkan persamaan berikut:
B1 – B2
% kadar air = x 100%
B
Keterangan : B Bobot contoh (g)
B 2 = Bobot (contoh + cawan) seteiah dikeringkan (g)
5.Pengukuran Nitrat (Anonymous, 1978)
Kadar nitrat diukur dalam bentuk NO3-. Sampel kompos basah sebanyak 10 gram diblender sampai hancur dan dilarutkan sampai 100 ml. Sampel disaring, kemudian dipipet sebanyak 2 ml dan diencerkan kembali sampai 50 ml. Hasil pengenceran diambil sebanyak 5 atau 10 ml. Kernudian ditambahkan dengan dengan 0,5 ml Brucine 5 % dan 2,5 ml H2S04, kernudian didinginkan. Sampel tersebut kemudian diukur dengan spektrofotometer pada panjang gelombang 410 nm.
6.Pengukuran NOx
Pengukuran dilakukan dengan menggunakan Metode Gas Chromatography (GC). Contoh gas dipersiapkan dengan mengambil gas di sebuah ruangan menggunakan sirin yang telah berisi contoh gas.
7.Kadar Nitrogen (Anonymous, 1978)
Contoh sebanyak 0.1 gram yang telah dihaluskan, dimasukkan ke dalam labu kedalam 30 ml. Contoh ditambahkan 2.5 ml H2S04 pekat, 1 gram katalis dan batu didih. Contoh selanjutnya didestruksi selama 1-1.5 jam atau hingga cairan berwarna jernih. Labu beserta isinya didinginkan, lalu isinya dipindahkan ke dalam alat destitasi dan ditambahkan 15 ml larutan NaOH 50%, kemudian dibilas dengan air suling. Labu kocok berisi HCl 0.02 N diletakkan di bawah kondensor, sebelurnnya ditambahkan ke dalamnya 2-4 tetes indikator (campuran metil merah 0.02 % dalam alkohol dan metil biru 0,02 % dalam alkohol dengan perbandingan 2 : 1). Ujung tabung kondensor harus terendam dalam labu larutan HCL kernudian dilakukan destilasi sampai sekitar 25 ml destilat dalam labu kocok. Hasil destilat dalam labu kocok selanjutnya dititrasi