KARYA TULIS
KOLEKSI ISOLAT
CENDAWAN MIKORIZA ARBUSKULA
ASAL HUTAN PANTAI
Oleh:
Dr. Delvian, SP.MP.
NIP. 132 299 348
JURUSAN KEHUTANAN
FAKULTAAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
2006
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
KATA PENGANTAR
Puji dan syukur Penulis panjatkan ke hadirat Allah SWT atas rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan tulisan tentang Koleksi Isolat Cendawan Mikoriza Arbuskula Asal Hutan Pantai ini dengan baik.
Tulisan ini berisi informasi tentang kegiatan-kegiatan yang dilakukan dalam upaya mendapatkan isolat cendawan mikoriza arbuskula dari suatu areal, dimana dalam tulisan ini areal studi adalah kawasan hutan pantai. Ada banyak tahapan kegiatan yang harus dilakukan, mulai dari kegiatan eksplorasi lapangan, kultur
trapping, kultur spora tunggal, seleksi kultur sampai dengan pengujian isolat baik
skala laboratorium atau rumah kaca maupun lapangan. Satu hal yang menjadi catatan penting adalah bahwa isolasi dan seleksi isolat cendawan mikoriza arbuskula sangat penting dilakukan guna mendapatkan isolat yang tidak saja infektif tetapi juga mempunyai efektivitas kerja yang sangat baik.
Penulis berharap tulisan yang sederhana ini dapat bermanfaat sebagai bahan bacaan bagi para mahasiswa yang berminat dan dapat menjadi salah satu sumber referensi dalam melakukan penelitian dalam bidang yang berkaitan.
Akhirnya, pada kesempatan ini Penulis ingin menyampaikan terima kasih kepada semua pihak yang telah memberikan bantuannya dalam penulusuran bahan tulisan ini.
Medan, Juli 2006
Penulis
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
DAFTAR ISI
Halaman KATA PENGANTAR DAFTAR ISI I. PENDAHULUAN 1II. TAHAPAN KEGIATAN UNTUK MENDAPATKAN ISOLAT
CENDAWAN MIKORIZA ARBUSKULA 7
A. Persiapan 7
B. Trapping 7
C. Kultur Spora Tunggal 10
D. Perbanyakan Kultur CMA 12
III. KOLEKSI ISOLAT CENDAWAN MIKORIZA ARBUSKULA
ASAL HUTAN PANTAI 16
A. Kultur Trapping 16
B. Kultur Spora Tunggal 19
C. Perbanyakan Kultur 22 IV. ULASAN 26 V. KESIMPULAN 34 DAFTAR PUSTAKA 35
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
KOLEKSI ISOLAT CENDAWAN MIKORIZA ARBUSKULA
ASAL HUTAN PANTAI
DELVIAN
Departemen Kehutanan Fakultas Pertanian
Universitas Sumatera Utara
Jl. Tri Darma Ujung No. 1 Kampus USU Padang Bulan
M e d a n
e-mail :
dvilly6@yahoo.co.uk
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
PENDAHULUAN
Mikoriza tersebar hampir di seluruh permukaan bumi dan dapat berasosiasi dengan sebagian besar tumbuhan. Menurut Smith dan Read (1987) 83% dikotiledon, 79% monokotiledon dan semua Gymnospermeae yang pernah dipelajari adalah bermikoriza. Tanaman yang tidak bermikoriza biasanya terdapat pada daerah dengan tanah yang sangat kering atau salin atau tergenang, mengalami gangguan yang sangat berat seperti aktivitas penambangan, atau dimana kandungan hara tanah sangat tinggi atau sangat rendah (Brundrett, 1991).
Mikoriza juga tidak ditemukan pada semua Cruciferae dan Chenopodiaceae (Harley dan Harley, 1987) dan juga jarang atau tidak ada sama sekali pada beberapa anggota Proteaceae atau spesies-spesies tanaman yang mempunya akar tipe cluster (Brundrett dan Abbott, 1991). Khusus pada CMA menurut Meyer (1973) dan Hayman (1981) lebih dari 90% tanaman berasosiasi dengan CMA dan hanya 3% tumbuhan saja yang berasosiasi dengan ektomikoriza.
Setiap jenis CMA mempunyai sifat morfologi dan fisiologi yang berbeda sehingga sangat penting untuk mengetahui identitas jenis CMA yang ada. Di samping itu walaupun CMA mempunyai sebaran inang yang luas cendawan ini mempunyai pengaruh yang spesifik terhadap tanaman yang dikolonisasi. Menurut Marschner (1995) meskipun CMA sangat kuat ketergantungannya pada tanaman inang tetapi tidak selalu tanaman inang mendapat keuntungan darinya. Asosiasi tanaman dengan CMA bisa bersifat mutualistik, netral atau parasitik tergantung pada faktor lingkungan. Dengan demikian hanya beberapa atau tidak semua CMA bermanfaat bagi tanaman inangnya.
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
Para ahli mikoriza membuat suatu asumsi bahwa semua spesies dalam Glomales adalah kohesif, dimana sifat-sifat dari suatu jenis mencerminkan sifat-sifat semua anggota dari jenis tersebut. Asumsi ini akan mempengaruhi penjelasan dan generalisasi hasil-hasil percobaan (Morton et al., 1992). Menurut Clark (1997) kondisi lingkungan di mana suatu jenis CMA diperoleh akan mempengaruhi fungsi dan kerjanya. Dengan kata lain sifat beberapa CMA dari spesies yang sama tetapi berasal dari ekosistem yang berbeda akan dipengaruhi oleh ekosistem asalnya. Oleh karena itu sangat penting untuk membedakan suatu CMA yang berasal dari suatu ekosistem tertentu (disebut isolat) dengan CMA dari ekosistem lainnya, sehingga efektivitas kerjanya dalam meningkatkan pertumbuhan tanaman dapat dimaksimalkan.
Kelangkaan dan kekurangan isolat adalah salah satu faktor pembatas penggunaan CMA secara luas. Upaya untuk mendapatkan isolat dari suatu ekosistem tertentu dapat dimulai dengan melakukan eksplorasi CMA pada ekosistem tersebut. Kegiatan berikutnya adalah pemurnian isolat-isolat dari lapangan yang dilanjutkan dengan perbanyakan isolat yang sudah ada. Kemudian dilakukan pengujian efektivitas dari isolat yang diperoleh terhadap berbagai faktor lingkungan. Terakhir dilakukan perbanyakan inokulum dari isolat-isolat terpilih.
Sampai saat ini perbanyakan inokulum CMA dalam media aseptik masih sulit dilakukan (Menge, 1984; Varma dan Hock, 1998). Ada beberapa alasan untuk kesulitan tersebut, yaitu adanya kebutuhan metabolit esensial dari CMA yang belum diketahui atau bentuk dan jumlahnya belum tercukupi. Di samping itu mungkin karena terhalangnya kontinyuitas sintesis enzim atau makromolekul penting pada awal proses perkecambahan. Karena sifat CMA yang obligat maka inokulum CMA harus ditumbuhkan pada akar tanaman hidup yang cocok sebagai inangnya.
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
Metoda yang paling umum dan diandalkan untuk memproduksi inokulum CMA adalah metoda kultur pot. Akar-akar atau tanah dari lapangan dapat digunakan langsung sebagi sumber inokulum untuk kultur. Akan tetapi kultur yang langsung dari lapangan biasanya mengandung banyak mikroorganisme yang tidak diinginkan. Oleh karena itu dianjurkan untuk memulai produksi inokulum dengan kultur spora tunggal yang bebas dari semua organisme lain. Kultur CMA yang berasal dari kultur spora tunggal lebih disukai karena kultur dihasilkan dari satu spora sehingga kemurnian kultur sangat terjamin (Raschen dan von Alten, 1992).
Koleksi CMA berupa kultur murni adalah sangat penting. Kultur murni memudahkan kegiatan identifikasi jenis CMA karena ketersediaan spora yang cukup dengan variabilitas yang sangat rendah. Selain itu kita dapat mempelajari kesesuaian suatu jenis CMA tertentu dengan tanaman tertentu pula. Dengan demikian informasi tentang ekologi, biologi dan fisiologi dari suatu jenis CMA dapat diketahui secara lebih lengkap.
Kegiatan produksi CMA harus memperhatikan beberapa faktor yang dapat mempengaruhi kualitas inokulum yang dihasilkan. Faktor tersebut menurut Menge (1984) antara lain adalah tanaman inang, media tumbuh, pemupukan, aerasi, pH, cahaya dan fotoperiode, suhu, dan pemakaian bahan kimia. Tanaman inang yang akan digunakan harus mempunyai daya adaptasi yang baik, berasosiasi dengan CMA, cepat tumbuh dengan perakaran yang ekstensif, dan tidak rentan terhadap patogen. Karena sebagian besar tanaman berasosiasi dengan CMA maka berbagai jenis tanaman dapat digunakan sebagai inang CMA. Menurut Vilarino (1992) umumnya kesehatan tanaman adalah lebih penting daripada jenis tanamannya.
Pemilihan media tumbuh dalam produksi inokulum CMA merupakan aspek paling penting (Menge, 1984). Dianjurkan menggunakan media yang sedikit
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
mengandung unsur hara dengan kapasitas tukar kation yang tinggi dan ketersediaan unsur P yang rendah serta bebas patogen. Media tanam dengan kandunga P tersedia yang tinggi akan menghambat kolonisasi dan produksi spora CMA (Cooper, 1984). Selanjutnya dikatakan bahwa tanah adalah faktor yang kritis sebagai media tumbuh karena tanah merupakan sumber P dan unsur mikro dan juga berfungsi sebagai penahan alami bagi ketersediaan unsur hara. Oleh karena itu dapat digunakan media lain berupa vermikulit, gambut, serbuk gergaji, kulit kayu, perlite, batu apung atau campuran dari media-media tersebut.
Kandungan hara, khususnya P dan N dalam media pertumbuhan dapat mempengaruhi perkembangan CMA (Douds dan Schenck, 1990). Menurut Vejsudova (1992) penambahan P ke dalam media tumbuh dapat mengurangi kolonisasi dan produksi spora CMA. Akan tetapi belum dapat dibuat standar P yang harus diberikan pada media tumbuh CMA. Pengaruh pemberian N pada media kultur CMA belum diketahui secara pasti, namun N dalam bentuk amonium menurut Menge (1984) lebih toksik terhadap CMA dibanding nitrat. Untuk tanaman inang
yang tidak memfiksasi N udara memerlukan tambahan NH4NO3 sebanyak 30 mg/kg
tanah atau 3 g/L larutan.
Kualitas inokulum CMA akan menurun pada kondisi terlalu basah atau terlalu kering. Menurut Read dan Bowen (1979) dalam Menge (1984) kolonisasi maksimum dari CMA terjadi pada takanan potensial air –0,2 bar dan kolonisasi akan menurun dengan berkurangnya potensial air. Sebaliknya bila air dijenuhkan maka kolonisasi CMA akan menurun sampai 50% dari kolonisasi maksimum. Pada kondisi ini difusi O2 sangat terbatas sehingga menghambat perkecambahan spora CMA dan kolonisasi akar dan mikroorganisme anaerob akan berkembang.
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
Berbeda dengan kolonisasi akar, menurut Pacioni (1986) pembentukan spora CMA justeru dirangsang oleh kondisi cekaman air. Ferguson dan Woodhead (1991) mencatat bahwa cekaman air pada tanaman bermikoriza akan menginduksi peluruhan miselium sehingga akan memicu pembentukan spora lebih awal.
Menurut Menge (1984) pH dapat mempengaruhi berbagai macam kondisi tanah maka seringkali sulit menentukan pengaruh pH terhadap produksi inokulum dan kisaran pH terbaik untuk perkembangan CMA. Selanjutnya Clark (1997) menyatakan bahwa setiap spesies CMA mempunyai kisaran toleransi terhadap pH yang sangat beragam. Pengaturan pH media pertumbuhan tanaman harus dilakukan dengan hati-hati sesuai dengan jenis CMA yang dikulturkan.
Meningkatnya kolonisasi CMA adalah karena meningkatnya proses fotosintesis yang menyebabkan meningkatnya konsentrasi karbohidrat dalam akar dan meningkatnya senyawa-senyawa eksudat. Untuk memaksimumkan produksi inokulum CMA perlu memaksimumkan fotosintesis inang dengan meningkatkan intensitas dan periodesitas cahaya matahari (Ferguson dan Woodhead, 1982 ; Menge, 1984 ; Marschner, 1995). Akan tetapi fotoperiodesitas yang lebih lama dapat meningkatkan kolonisasi lebih besar daripada intensitas cahaya. Menurut Johnson et al. (1982) pengurangan intensitas cahaya sampai 30% tidak mempengaruhi kolonisasi akar sebaliknya peningkatan fotoperiodesitas dapat meningkatkan produksi spora dua kali lebih banyak.
Pada kebanyakan kasus kolonisasi dan produksi spora CMA meningkat dengan meningkatnya suhu sampai pada batas pertumbuhan inang (Graham et al., 1982; Koske, 1987). Akan tetapi pengaruh suhu terhadap kolonisasi CMA sangat bervariasi tergantung pada tanaman inang dan jamur simbionnya. Harus diingat bahwa suhu tanah adalah lebih penting daripada suhu udara dalam memperoduksi
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
inokulum CMA dan suhu terbaik adalah di atas suhu optimum tanaman inang (Menge, 1984).
Pemakaian pestisida dapat mengganggu kolonisasi dan produksi spora CMA, tetapi ada beberapa jenis yang dapat menguntungkan. Pestisida dapat menguntungkan untuk produksi inokulum CMA karena dapat mengurangi patogen tanaman atau parasit yang dapat menjadi pesaing bagi CMA baik terhadap inang maupun unsur hara (von Alten dan Lindermann, 1992; Trouvelot et al. (1992). Menge (1984) menyatakan bahwa beberapa herbisida diketahui dapat meningkatkan kolonisasi CMA, mungkin karena herbisida tersebut dapat meningkatkan eksudat akar dalam bentuk asam amino atau gula.
Ketersediaan inokulum dalam kuantitas dan kualitas yang baik merupakan faktor penting dalam penggunaan CMA dalam skala yang lebih luas. Dinamika produksi inokulum, adanya kekhususan inang, aktivitas hiperparasit, dan ketiadaan bank inokulum CMA dalam skala regional atau nasional merupakan faktor-faktor yang krusial dalam memproduksi inokulum. Oleh karena dirasa perlu dilakukan upaya-upaya untuk mendapatkan isolat-siolat CMA yang potensial khususnya untuk daerah-daerah yang mempunyai masalah dengan salinitas tanah.
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
TAHAPAN KEGIATAN UNTUK MENDAPATKAN
ISOLAT CENDAWAN MIKORIZA ARBUSKULA
A. Persiapan
Persiapan Media Tumbuh
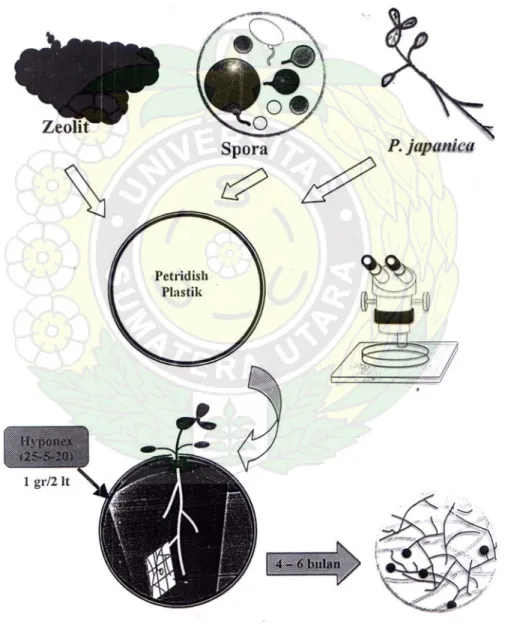
Batuan zeolit (ukuran 1-2 mm) dicuci sampai bersih guna menghilangkan serbuk halus zeolit dan kotoran yang ada. Batuan zeolit yang tidak bersih dapat berdampak negatif terhadap perkembangan CMA. Kemudian disterilisasi dengan autoclave pada tekanan 15 atm selama 15 menit untuk menghilangkan kemungkinan patogen yang ada. Setelah itu batuan zeolit direndam dalam larutan NaCl 5.000 ppm selama 24 jam.
Persiapan Tanaman Inang
Benih-benih P. javanica yang digunakan sebagai tanaman inang terlebih dahulu direndam dalam larutan Chlorox 5% selama 5-10 menit sebagai upaya sterilisasi permukaan. Kemudian direndam dalam air hangat selama ± 24 jam untuk memecahkan dormansi yang mungkin terjadi. Selanjutnya benih-benih tersebut disemaikan dalam bak persemaian selama ± 10 hari atau telah muncul dua helai daun. Setelah itu dapat langsung dilakukan penanaman.
B. Pemerangkapan (Trapping)
Teknik trapping yang digunakan mengikuti metoda Brundrett et al. (1994) dengan menggunakan pot kultur terbuka. Media tanam yang digunakan berupa campuran contoh tanah sebanyak ± 50 gram dan batuan zeolit sebanyak ± 150
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
gram. Teknik pengisian media tanam dalam pot kultur adalah pot kultur diisi dengan zeolit sampai setengah volume pot, kemudian dimasukkan contoh tanah dan terakhir ditutup dengan zeolit sehingga media tanam tersusun atas zeolit-contoh tanah-zeolit.
Gambar 1. Skematis teknis pembuatan kultur trapping CMA
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
Dari setiap contoh tanah dibuat 3 pot kultur sehingga terdapat 150 pot kultur. Disamping itu diberikan perlakuan pemberian asam humik dan tanpa asam humik untuk setiap contoh tanah. Dengan demikian terdapat 300 pot kultur, masing-masing 150 pot kultur dengan pemberian asam humik dan 150 pot kultur tanpa pemberian asam humik.
Perlakuan asam humik (HUMEGATM 6% ) diberikan dengan konsentrasi
2,5% sebanyak 20 ml tiap pot. Frekuensi pemberian asam humik adalah 3 x 1 minggu selama satu bulan pertama dan 1 x 1 minggu selama 1 bulan kedua. Penambahan asam humik ini diharapkan berpengaruh terhadap sporulasi cendawan mikoriza.
Untuk menjaga supaya tidak terjadi penurunan salinitas tanah yang drastis maka dilakukan pemberian larutan NaCl dengan konsentrasi 5.000 ppm dan frekuensi pemberian 1 x 1 minggu. Perlakuan ini diharapkan dapat mengurangi kemungkinan terjadinya perubahan sifat kimia tanah dibandingkan dengan ekosistem asalnya. Penetapan konsentrasi NaCl yang diberikan didasarkan pada konsentrasi NaCl yang terdapat pada tingkat salinitas tanah tertinggi.
Pemeliharaan kultur meliputi kegiatan penyiraman, pemberian hara dan pengendalian hama secara manual. Larutan hara yang digunakan adalah Hyponex
merah (25-5-20) dengan konsentrasi 1 gr. l-1. Pemberian larutan hara dilakuan
setiap minggu sebanyak 20 ml tiap pot kultur.
Pemanenan dilakukan setelah pembentukan spora-spora baru cukup baik yang diketahui dengan melakukan pengecekan kultur setiap satu bulan. Variabel-variabel yang diamati adalah perubahan tingkat salinitas tanah selama pemeliharaan dan jumlah spora per 50 gram media tanam dan jenis spora.
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
Selanjutnya spora-spora yang diperoleh dari kultur ini digunakan untuk kegiatan tahap berikutnya, yaitu pembuatan kultur spora tunggal.
C. Kultur Spora Tunggal
Persiapan Media Kultur
Pembuatan kultur spora tunggal mengacu pada metoda yang dilakukan Mansur (2000), yaitu Petri-dish Observation Chamber (PDOC). Cawan petri plastik (diameter 9 cm) yang akan digunakan sebagai tempat penanaman kultur terlebih dahulu dilubangi (0,5x0,5 cm) pada bagian tepinya yang berfungsi sebagai tempat munculnya tanaman (Gambar 2). Kemudian diisi dengan batuan zeolit yang telah disterilkan dan dijenuhi dengan larutan NaCl (5.000 ppm).
atas (penutup bawah batuan zeolit lubang tanam Gambar 2. Cawan petri plastik diameter 9 cm yang dilubangi 0,5x0,5
cm sebagai tempat tumbuh tanaman inang. Batuan zeolit steril digunakan untuk menunjang pertumbuhan akar tanaman dan CMA
Pembuatan Kultur
Spora-spora CMA yang telah diisolasi dari kultur trapping dikumpulkan dalam gelas arloji dan dilakukan pemisahan spora berdasarkan genusnya. Kemudian bibit P. javanica yang telah memiliki 2-3 helai daun (7-10 hari
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
setelah semai) diletakkan di atas kertas tissue. Kemudian dengan menggunakan pinset spora setiap bibit P. javanica diinokulasi dengan satu spora Bibit P. javanica yang telah diinokulasi kemudian dipindahkan dengan hati-hati pada media kultur dengan posisi bagian batang bibit diletakkan pada bagian tepi cawan petri yang telah dilubangi.
Gambar 3. Skematis teknis pembuatan kultur spora tunggal
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
Selanjutnya cawan petri ditutup dan diberi perekat (selotip) pada sisi-sisinya. Kemudian kultur diberi label yang memuat data tentang tanggal pembuatan kultur, nomor petak asal kultur (menunjukkan titik lokasi di lapangan), jenis spora yang diinokulasi , dan pembuat kultur. Selanjutnya cawan petri kultur dibungkus dengan alumunium foil untuk mengurangi pengaruh langsung cahaya terhadap media kultur. Cawan petri kultur kemudian diletakkan dalam bak plastik kecil yang berfungsi sebagai tempat air dan larutan hara bagi kultur. Pemberian air dilakukan sesuai dengan kebutuhan tanaman, sedangkan pemberian larutan hara Hyponex
merah (25-5-20) dilakukan 1 x 1 minggu dengan konsentrasi 1 gr l-1.
Untuk mempertahankan tingkat salinitas media tumbuh spora-spora CMA seperti pada kultur sebelumnya maka dilakukan pemberian larutan NaCl dengan konsentrasi 5.000 ppm dan frekuensi pemberian 1 x 1 minggu. Dengan demikian diharapkan kondisi lingkungan tumbuh CMA tidak jauh berbeda dengan ekosistem asalnya. Penetapan konsentrasi NaCl yang diberikan didasarkan pada konsentrasi NaCl yang terdapat pada tingkat salinitas tanah tertinggi.
Kultur spora tunggal ini dipelihara selama 6 bulan tergantung sporulasi yang terjadi. Untuk mengetahui perkembangan proses sporulasi maka kultur-kultur diamati setiap dua minggu yang dimulai pada awal bulan kedua setelah pembuatan kultur. Apabila spora yang terbentuk sudah cukup banyak maka dilakukan sub-kultur sehingga diperoleh sub-kultur yang cukup untuk tahapan berikutnya.
D. Perbanyakan Kultur CMA Perbanyakan Tahap I
Kultur spora tunggal yang telah menghasilkan spora cukup baik langsung di-sub-kulturkan untuk memperbanyak jumlah spora yang terbentuk. Teknik sub-kultur
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
dilakukan dengan sistem pot kultur terbuka. Tahapan selengkapnya adalah sebagai berikut: pertama, cawan petri dari kultur spora tunggal terpilih dibongkar secara hati-hati untuk mengutangi kerusakan hifa-hifa CMA. Kemudian seluruh media kultur (berisikan spora, potongan hifa dan potongan akar terkolonisasi) dibagi menjadi tiga bagian sebagai inokulum, sehingga dari satu cawan petri kultur diperoleh tiga put sub-kultur baru.
Gambar 4. Skematis teknis perbanyakan CMA hasil kultur spora tunggal
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
Sebelum dilakukan penanaman semua pot kultur (volume 200 gram) diisi dengan batuan zeolit yang telah steril dan dijenuhi dengan larutan NaCl (5.000 ppm). Selanjutnya dibuat dibuat lubang tanam dan pada setiap lubang tanam diisi dengan inokulum yang telah disiapkan. Kemudian dilakukan penanaman P javanica sebagai tanaman inang dimana setiap pot kultur ditanami dua tanaman inang. Pada setiap pot kultur dilengkapi dengan label yang berisikan data tentang tanggal pembuatan kultur dan nomor petak asal kultur serta jenis spora yang dikulturkan.
Kultur-kultur ini dipelihara dalam rumah kaca dan selama kegiatan pemeliharaan dilakukan penyiraman dan pemberian larutan hara Hyponex merah
(25-5-20) dengan dosis 1 gr.l-1 sebanyak 20 ml per pot setiap minggu. Di samping
itu dilakukan pemberian larutan NaCl setiap minggu dengan konsentrasi 5.000 ppm sebagai upaya untuk mempertahankan kondisi salinitas media tanam.
Setelah kultur berumur tiga bulan sejak inokulasi dilakukan pengecekan untuk mengetahui pertumbuhan dan perkembangan dari spora-spora CMA tersebut. Pengecekan kultur dilakukan secara periodik dengan interval waktu 7 hari. Setelah perkembangan kultur cukup baik dilakukan pengeringan kultur dengan tidak melakukan penyiraman untuk merangsang pembentukan spora yang lebih banyak (Hernandez et al., 1986 ; Pacioni, 1986). Selanjutnya dilakukan pemanenan terhadap pot-pot kultur yang menghasilkan spora CMA dengan kepadatan yang cukup tinggi, yaitu berkisar antara 70-100 spora per 30 gram kultur. Hasil panen akan digunakan sebagai inokulan untuk kegiatan perbanyakan tahap berikutnya.
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
Perbanyakan Tahap II
Langkah-langkah perbanyakan tahap II ini sama dengan kegiatan perbanyakan tahap I. Perbanyakan tahap II ini hanya bertujuan untuk meningkatkan kuantitas kultur terpilih sehingga diperoleh jumlah kultur yang cukup untuk pengujian efektivitasnya.
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
KOLEKSI ISOLAT CENDAWAN MIKORIZA ARBUSKULA
ASAL HUTAN PANTAI
Kultur Trapping
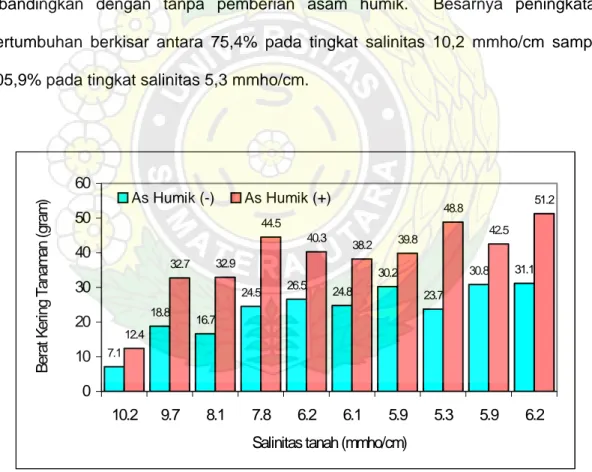
Dari kegiatan pemerangkapan (trapping) ini diperoleh hasil bahwa pemberian asam humik (Humega TM) dapat meningkatkan pertumbuhan tanaman inang dan sporulasi cendawan mikoriza arbuskula (CMA). Pada Gambar 5 tampak bahwa pemberian asam humik dapat meningkatkan pertumbuhan P. javanicum dibandingkan dengan tanpa pemberian asam humik. Besarnya peningkatan pertumbuhan berkisar antara 75,4% pada tingkat salinitas 10,2 mmho/cm sampai 105,9% pada tingkat salinitas 5,3 mmho/cm.
7.1 18.8 16.7 24.5 26.5 24.8 30.2 23.7 30.8 31.1 12.4 32.7 32.9 44.5 40.3 38.2 39.8 48.8 42.5 51.2 0 10 20 30 40 50 60 10.2 9.7 8.1 7.8 6.2 6.1 5.9 5.3 5.9 6.2
Salinitas tanah (mmho/cm)
Berat Kering Tanaman (gram)
As Humik (-) As Humik (+)
Gambar 5. Respon pertumbuhan P. Javanicum terhadap pemberian asam humik pada beberapa tingkat salinitas tanah
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
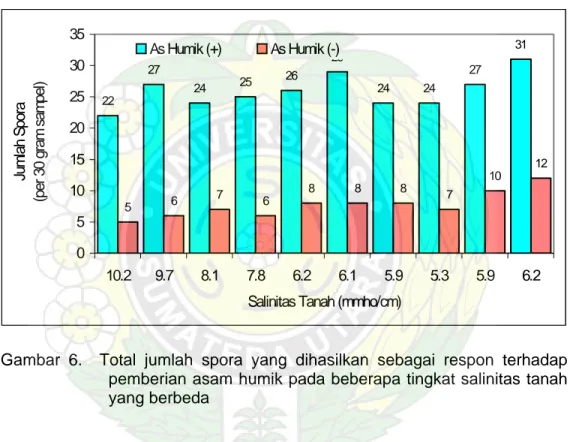
Untuk varaibel jumlah spora, pemberian asam humik mampu meningkatkan jumlah spora yang terbentuk seperti yang ditunjukkan pada Gambar 6 dan 7. Besarnya peningkatan produksi spora berkisar antara 156,25% yang terjadi pada tingkat salinitas 9,7 mmho/cm sampai 261,54% yang terjadi pada tingkat salinitas tanah 6,1 mmho/cm. 22 27 24 25 26 29 24 24 27 31 5 6 7 6 8 8 8 7 10 12 0 5 10 15 20 25 30 35 10.2 9.7 8.1 7.8 6.2 6.1 5.9 5.3 5.9 6.2
Salinitas Tanah (mmho/cm)
Jumlah Spor a (per 30 gr am sampel) As Humik (+) As Humik (-)
Gambar 6. Total jumlah spora yang dihasilkan sebagai respon terhadap pemberian asam humik pada beberapa tingkat salinitas tanah yang berbeda
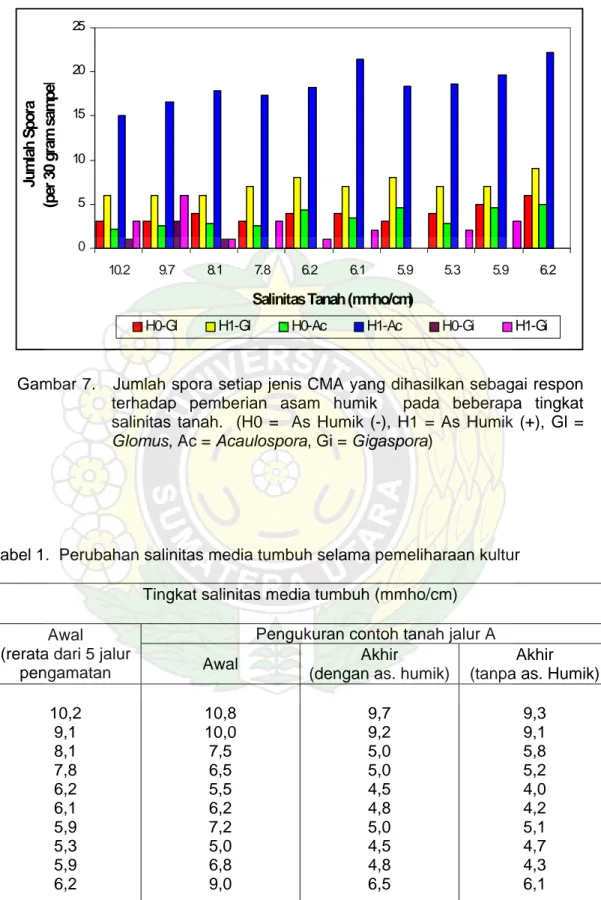
Bila kita cermati Gambar 7 tampak bahwa besarnya peningkatan jumlah spora yang dihasilkan pada semua tingkat salinitas tanah didominasi oleh CMA dari jenis Acaulospora spp. Jumlah spora Acaulospora spp. jauh melebihi spora dari jenis Glomus spp. dan Gigaspora spp. Akan tetapi dibandingkan dengan Gigaspora spp. jumlah spora Glomus spp. masih jauh lebih banyak.
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
0 5 10 15 20 25 10.2 9.7 8.1 7.8 6.2 6.1 5.9 5.3 5.9 6.2 Salinitas Tanah (mmho/cm)
Jumlah Spora
(per 30 gram sampe
l
H0-Gl H1-Gl H0-Ac H1-Ac H0-Gi H1-Gi
Gambar 7. Jumlah spora setiap jenis CMA yang dihasilkan sebagai respon terhadap pemberian asam humik pada beberapa tingkat salinitas tanah. (H0 = As Humik (-), H1 = As Humik (+), Gl =
Glomus, Ac = Acaulospora, Gi = Gigaspora)
Tabel 1. Perubahan salinitas media tumbuh selama pemeliharaan kultur Tingkat salinitas media tumbuh (mmho/cm)
Pengukuran contoh tanah jalur A Awal
(rerata dari 5 jalur
pengamatan Awal
Akhir (dengan as. humik)
Akhir (tanpa as. Humik) 10,2 9,1 8,1 7,8 6,2 6,1 5,9 5,3 5,9 6,2 10,8 10,0 7,5 6,5 5,5 6,2 7,2 5,0 6,8 9,0 9,7 9,2 5,0 5,0 4,5 4,8 5,0 4,5 4,8 6,5 9,3 9,1 5,8 5,2 4,0 4,2 5,1 4,7 4,3 6,1
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
Kultur Spora Tunggal
Spora-spora yang digunakan untuk kultur spora tunggal diambil dari kultur trapping dengan perlakuan pemberian asam humik. Jumlah kultur spora tunggal keseluruhan adalah 683 kultur dari 3 genus CMA, yaitu Glomus (terdiri dari Glomus sp.-2, Glomus sp.-3, Glomus sp.-5, Glomus sp.-6, dan Glomus sp.-7), Acaulospora (terdiri dari Acaulospora sp.-1, Acaulospora sp.-2 dan Acaulospora sp.-3) dan
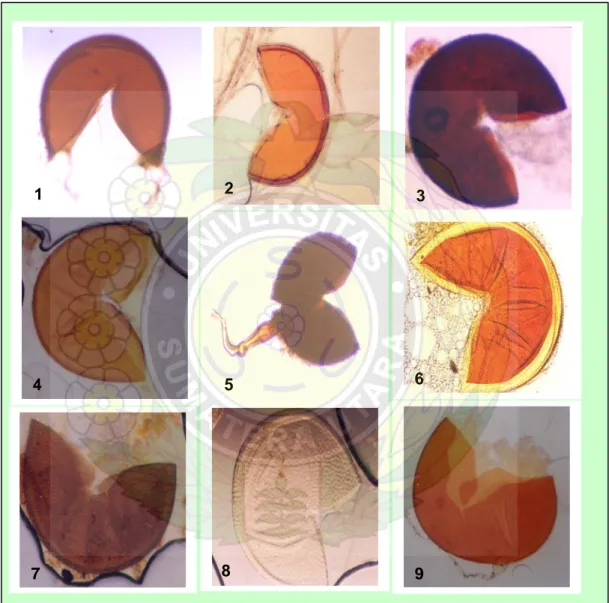
Gigaspora (Gigaspora sp.) seperti yang tampak pada Gambar 8.
Dari ketiga genus spora CMA tersebut, spora-spora Glomus adalah yang paling cepat berkecambah, diikuti oleh Gigaspora dan Acaulospora. Umur berkecambah masing-masing secara berurutan adalah 28-35 hari, 42-49 hari dan 70-79 hari setelah inokulasi, seperti yang disajikan pada Tabel 2. Perbedaan umur mulai berkecambah ini mungkin berhubungan dengan adanya sifat dormansi yang berbeda dari setiap genus CMA.
Tabel 2. Waktu (hari setelah inokulasi) spora mulai berkecambah dan pembentukan spora baru
Waktu (hari setelah inokulasi) Genus CMA
Perkecambahan spore Pembentukan spora baru
Glomus Acaulospora Gigaspora 28-35 70-77 42-49 42-49 77-84 56-63
Pada Tabel 10 juga dapat dilihat umur mulai terbentuknya spora-spora baru sejak diinokulasikan pada akar tanaman inang. Tampak bahwa pola umur pembentukan spora-spora baru dari masing-masing genus CMA sama dengan umur spora-spora mulai berkecambah. Glomus membentuk spora paling cepat (42-49
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
hari setelah inokulasi) dibandingkan dua genus lainnya. Sedangkan Acaulospora baru membentuk spora 77-84 hari setelah inokulasi.
1 2
4
3
5 6
7 8 9
Gambar 8. Jenis spora CMA yang digunakan untuk pembuatan kultur spora tunggal, yaitu Glomus sp.-2 (1), Glomus sp.-3 (2), Glomus sp.-5 (3), Glomus sp.-6 (4), Glomus sp.-7 (5), Acaulospora sp.-1 (6),
Acaulospora sp-2 (7 dan 8), dan Gigaspora sp. (9). Preparasi
spora dengan pewarnaan Melzer’s. (Perbesaran 100x)
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
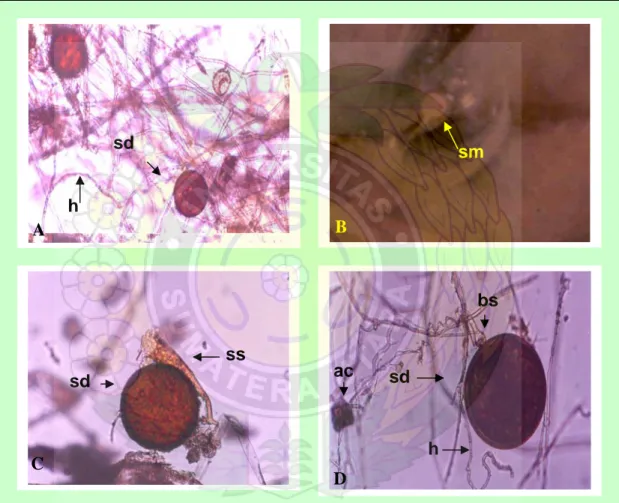
Spora-spora Acaulospora tumbuh dari sporiferous saccule yang berwarna hyaline (Gambar 9). Pada waktu muda spora Acaulospora berwarna hyaline dan akan berwarna coklat tua kemerahan setelah matang. Spora-spora yang terbentuk tersebar di dalam substrat atau media tanam.
sd
sd
ss
h
sm
bs
sd
h
A
B
C
D
ac
Gambar 9. Spora-spora yang berkembang dalam kultur spora tunggal dengan teknik PDOC dari jenis Glomus (A), Acaulospora (B dan C) dan
Gigaspora (D): sd = spora dewasa, h = hifa, sm = spora muda, ss =
sporiferous saccule, bs = bulbous suspensor, ac = auxiliary cell. (Perbesaran 100 X)
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
Spora-spora Glomus terbentuk pada hifa-hifa eksternal di dekat perakaran. Biasanya spora Glomus muda berwarna hyaline dan pada waktu matang menjadi berwarna putih atau kuning kecoklatan. Sementara spora-spora Gigaspora terbentuk pada ujung-ujung hifa eksternal dan membentuk bulbous suspensor. Ukuran spora Gigaspora relatif besar jika dibandingkan dengan spora Glomus dan
Acaulospora.
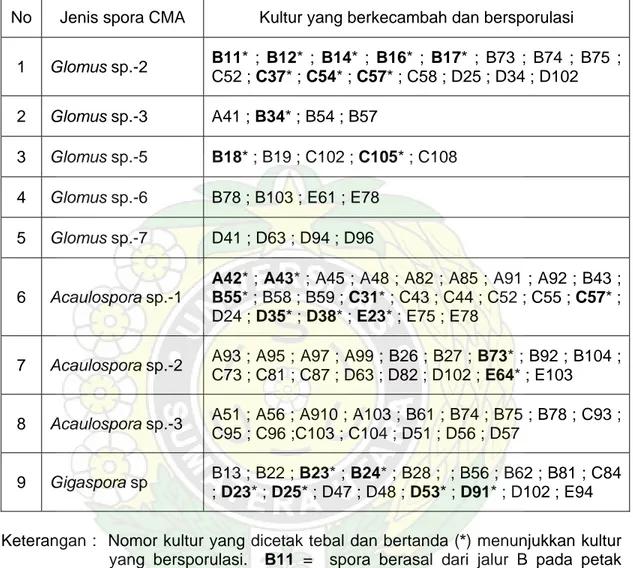
Sampai kultur berumur 180 hari setelah inokulasi hanya 15,8% atau 108 kultur dari 683 kultur spora tunggal yang berkecambah dan membentuk spora-spora baru. Hasil selengkapnya dapat dilihat pada Tabel 3..
Perbanyakan Kultur
Dari 108 cawan petri kultur spora tunggal yang berkecambah dan membentuk spora baru hanya 28 kultur yang memenuhi kriteria untuk diperbanyak pada tahap pertama. Kriteria yang digunakan dalam memilih kultur adalah kepadatan spora minimal 30 spora untuk satu cawan kultur. Hasil perbanyakan pada tahap pertama ini selanjutnya digunakan sebagai inokulum untuk perbanyakan tahap kedua, dimana hanya 16 dari 28 kultur yang diperbanyak pada tahap kedua ini. Kultur-kultur yang tidak memenuhi kriteria selanjutnya dipelihara sebagai koleksi isolat. Kultur-kultur yang diperbanyak selengkapnya disajikan pada Tabel 4 berikut.
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
Tabel 3. Kultur-kultur spora tunggal yang berkecambah dan membentuk spora-spora baru sampai pada umur 180 hari setelah inokulasi
No Jenis spora CMA Kultur yang berkecambah dan bersporulasi
1 Glomus sp.-2 B11* ; B12* ; B14* ; B16* ; B17* ; B73 ; B74 ; B75 ;
C52 ; C37* ; C54* ; C57* ; C58 ; D25 ; D34 ; D102 2 Glomus sp.-3 A41 ; B34* ; B54 ; B57
3 Glomus sp.-5 B18* ; B19 ; C102 ; C105* ; C108
4 Glomus sp.-6 B78 ; B103 ; E61 ; E78
5 Glomus sp.-7 D41 ; D63 ; D94 ; D96
6 Acaulospora sp.-1
A42* ; A43* ; A45 ; A48 ; A82 ; A85 ; A91 ; A92 ; B43 ; B55* ; B58 ; B59 ; C31* ; C43 ; C44 ; C52 ; C55 ; C57* ;
D24 ; D35* ; D38* ; E23* ; E75 ; E78
7 Acaulospora sp.-2 A93 ; A95 ; A97 ; A99 ; B26 ; B27 ; B73* ; B92 ; B104 ;
C73 ; C81 ; C87 ; D63 ; D82 ; D102 ; E64* ; E103 8 Acaulospora sp.-3 A51 ; A56 ; A910 ; A103 ; B61 ; B74 ; B75 ; B78 ; C93 ;
C95 ; C96 ;C103 ; C104 ; D51 ; D56 ; D57
9 Gigaspora sp B13 ; B22 ; B23* ; B24* ; B28 ; ; B56 ; B62 ; B81 ; C84
; D23* ; D25* ; D47 ; D48 ; D53* ; D91* ; D102 ; E94 Keterangan : Nomor kultur yang dicetak tebal dan bertanda (*) menunjukkan kultur
yang bersporulasi. B11 = spora berasal dari jalur B pada petak nomor 1 dan kultur nomor 1.
Pada akhir kegiatan diperoleh tiga isolat yang berhasil diperbanyak. Ketiga isolat tersebut adalah Glomus sp.-2, Acaulospora sp.-1 dan Gigaspora sp. Dilihat dari kode-kode kultur spora tunggal yang berhasil diperbanyak tampak bahwa ketiga isolat yang diperoleh berasal dari petak ukur yang cukup menyebar, mulai dari petak ukur 1 sampai petak ukur 10. Isolat Glomus sp.-2 (pot kultur B11 ; B14 ; B17 ; C37 ; C54 ; D102) berasal dari petak 1, 3, 5, dan 10. Isolat Acaulospora sp-1 ( pot kultur
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
Tabel 4. Kultur-kultur yang diperbanyak sampai tahap kedua
Kultur yang diperbanyak
No Jenis spora CMA
Tahap I Tahap II 1 Glomus sp.-2 B11 ; B12 ; B14 ; B16 ; B17 ; C37 ; C54 ; C57 ; D102 B11 ; B14 ; B17 ; C37 ; C54 ; D102 2 Glomus sp.-3 B34 --- 3 Glomus sp.-5 B18 ; C105 --- 4 Glomus sp.-6 --- --- 5 Glomus sp.-7 --- ---
6 Acaulospora sp.-1 A42 ; A43 ; B55 ; C31 ; C57
; D35 ; D38 ; E23 A43 ; B55 ; C57 ; D35 ; E23 7 Acaulospora sp.-2 C73 ; E64 ; --- 8 Acaulospora sp.-3 --- --- 9 Gigaspora sp. B23 ; B24 ; D23 ; D25 ; D53 ; D91 B23 ; B24 ; D23 ; D25 ; D53
A43 ; B55 ; C57 ; D35 ; E23) berasal dari petak 2 ; 3 ; 4 dan 5 sementara isolat
Gigaspora sp. (pot kultur B23 ; B24 ; D23 ; D25 ; D53) berasal dari petak 2 dan 5.
Ini berarti bahwa isolat-isolat tersebut adalah isolat yang mampu berkembang pada konsentrasi NaCl 5.000 ppm meskipun berasal dari petak-petak ukur dengan konsentrasi NaCl yang beragam (3440,63 - 6509,06 ppm). Pada Gambar 10 ditampilkan gambar ketiga isolat yang berhasil dikulturkan.
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
A-1
B-1 B-2
A-2
C-1 C-2
Gambar 10. Tiga jenis spora hasil seleksi dan perbanyakan, yaitu Glomus sp.-2 (A-1 dan A-2), Acaulospora sp.-1 (B-1 dan B-2) dan
Gigaspora sp. (C-1 dan C-2).
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
ULASAN
Kultur Trapping
Pemberian asam humik mampu meningkatkan pertumbuhan P. javanica dengan peningkatan berkisar antara 75,4% – 105,9%. Terjadinya perbedaan respon pertumbuhan ini berhubungan dengan pengaruh asam humik terhadap peningkatan penyerapan hara, baik hara makro maupun mikro. Tan (1978) menyatakan bahwa senyawa humik dapat mempengaruhi penyerapan unsur hara melalui pengaruhnya terhadap laju pelepasan unsur hara dari komponen tanah. Pemberian senyawa humik dapat meningkatkan sintesis protein, aktivitas hormon tumbuh, meningkatkan laju fotosintesis, dan mempengarhui aktivitas enzim (Chen dan Aviad, 1990; Ayuso
et al., 1996). Semua ini akan meningkatkan pertumbuhan tajuk, berat kering tajuk
dan akar, jumlah akar-akar lateral dan dapat mempengaruhi inisiasi akar-akar baru. Di samping itu senyawa humik juga mempengaruhi kelarutan hara mikro dari bentuk-bentuk anorganik, terutama Fe, Zn dan Mn. Sebelumnya MacCarthy et
al. (1990), telah melaporkan bahwa senyawa humik tidak hanya meningkatkan
kelarutan Fe dalam larutan tanah, tetapi juga mempengaruhi translokasi Fe dari akar ke tajuk. Diketahui bahwa Fe adalah unsur yang berperan penting untuk mencegah klorosis (Chen dan Stevenson, 1986) dan pembentukan klorofil (Marschner, 1995) yang sangat penting bagi proses fotosintesis. Fotosintesis yang berlangsung dengan baik pada akhirnya akan mempengaruhi jumlah energi yang dihasilkan untuk pertumbuhan dan perkembangan tanaman. Lulakis dan Petsas (1995) menegaskan bahwa mekanisme utama dari pengaruh senyawa humik terhadap peningkatan pertumbuhan tanaman adalah melalui peningkatan penyerapan hara makro dan mikro, baik melalui proses metabolik (aktif) maupun non-metabolik (pasif).
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
Pada kultur-kultur trapping yang tanpa pemberian asam humik berat kering tanaman berkisar antara 7,1-31,1 gram per tanaman, sedangkan dengan pemberian asam humik berkisar antara 12,4-51,2 gram per tanaman. Rendahnya pertumbuhan
P. javanica pada kultur tanpa pemberian asam humik mungkin disebabkan dua hal,
yaitu tanaman mengalami kekurangan hara dan keracunan unsur mikro terutama Cl dan Na yang berasal dari contoh tanah dalam konsentrasi yang tinggi. Pada kultur dengan pemberian asam humik yang terjadi justeru sebaliknya dimana ketersediaan hara menjadi lebih baik dengan meningkatnya kapasitas tukar kation (MacCarthy et
al., 1990a) dan penyerapan Na dapat ditekan (Chen dan Aviad, 1990).
Peningkatan serapan hara oleh tanaman berhubungan dengan perubahan permeabilitas membran sel akar tanaman. Chen dan Schnitzer (1978) menyatakan bahwa senyawa humik dapat meningkatkan permeabilitas membran sel yang pada akhirnya dapat meningkatkan penyerapan hara. Bentuk hubungan antara senyawa humik dengan permeabilitas membran sel ini belum jelas. Chen dan Schnitzer (1978) menduga hal ini berkaitan dengan aktivitas permukaan senyawa humik yang dihasilkan dari adanya tapak yang hidrofilik dan hidrofobik. Dengan demikian senyawa humik dapat berinteraksi dengan struktur fosfolipid dari membran sel dan berperan sebagai pembawa unsur hara bagi tanaman.
Dalam hubungannya dengan tingkat salinitas tanah, tampak bahwa penurunan tingkat salinitas tanah menyebabkan terjadinya peningkatan pertumbuhan tanaman. Seperti diketahui bahwa salinitas tanah yang tinggi, salah satunya ditentukan oleh konsentrasi NaCl, akan memberikan dampak negatif bagi pertumbuhan tanaman. Salinitas yang tinggi menyebabkan terjadinya beberapa perubahan, antara lain jumlah dan ukuran stomata, penghambatan diferensiasi dan menekan pertumbuhan tanaman (Poljakoff-Mayber dan Gale, 1975). Seiring dengan
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
adanya penurunan tingkat salinitas tanah maka pertumbuhan tanaman pun menjadi semakin baik.
Di samping itu dengan pemberian asam humik akan makin mengurangi dampak negatif dari tingginya tingkat salinitas tanah. Dengan kapasitas tukar kation yang tinggi, asam humik dapat membentuk suatu kompleks dengan ion-ion yang bersifat toksik, terutama ion-ion logam, sehingga memberikan suasana rizosfir yang kondusif bagi pertumbuhan tanaman. MacCarthy et al. (1990) menyatakan bahwa adanya senyawa humik dapat menekan penyerapan Na oleh perakaran tanaman. Sedangkan Badura (1965) menyatakan bahwa dengan kapasitas tukar kation yang tinggi asam humik dapat mempengaruhi konsentrasi dan ketersediaan garam-garam dalam tanah.
Untuk varaibel jumlah spora, pemberian asam humik ternyata mampu meningkatkan jumlah spora yang terbentuk. Banyaknya jumlah spora yang terbentuk ini tidak terlepas dari respon pertumbuhan tanaman inang yang lebih baik dengan pemberian asam humik. Pada kondisi yang demikian proses-proses metabolisme tanaman, seperti fotosintesisi, akan berlangsung secara maksimal sehingga fotosintat yang dihasilkan menjamin proses pertumbuhan tanaman dan kelangsungan simbiosis antara tanaman dan mikoriza. Dengan terjaminnya suplai karbon dari tanaman bagi perkembangan mikoriza maka sporulasi juga akan berlangsung dengan baik. Sebaliknya perkembangan mikoriza yang baik ini akan menjamin suplai air dan hara bagi pertumbuhan tanaman.
Peranan asam humik dalam meningkatkan jumlah spora CMA yang dihasilkan dalam kultur ini diperkuat oleh hasil analisa salinitas media pertumbuhan pada akhir penelitian. Perubahan salinitas media selama pemeliharaan kultur pada
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
kedua perlakuan (dengan dan tanpa pemberian asam humik) hanya berkisar antara 13,89-20,00%.
Selain daripada itu pemberian asam humik ini dapat mempengaruhi pembentukan akar-akar baru dan meningkatkan permeabilitas membran akar (http : //www.horizonag.com). Banyaknya akar-akar yang baru dengan permeabilitas membran yang tinggi akan menguntungkan bagi proses kolonisasi akar oleh mikoriza. Seperti diketahui bahwa kolonisasi mikoriza umumnya terjadi pada akar-akar muda (Sieverding, 1991) dan proses kolonisasi akan lebih mudah terjadi pada akar-akar dengan permeabilitas membran yang tinggi (Cooper, 1984).
Dengan demikian jika pada satu sisi kolonisasi sudah terbentuk dengan baik dan pada sisi lain pertumbuhan tanaman juga baik, maka akan terjadi simbiosis yang mutualistik bagi perkembangan tanaman dan mikoriza. Salah satu ukuran perkembangan mikoriza yang lebih baik dengan pemberian asam humik ini adalah peningkatan jumlah spora yang terbentuk.
Respon pertumbuhan dan perkembangan setiap jenis CMA terhadap pemberian asam humik ini adalah variatif. Pembentuk spora Acaulospora akibat pemberian asam humik jauh melebihi peningkatan spora dari jenis Glomus dan
Gigaspora. Hal ini sangat menarik karena beberapa studi melaporkan bahwa
Glomus spp. adalah jenis CMA yang paling banyak ditemukan pada tanah-tanah
salin (Allen dan Cunningham, 1983; Pond et al., 1984; Ho,1987). Apakah
Acaulospora lebih respon terhadap pemberian asam humik dibandingkan dengan
Glomus. Tentu saja ini suatu yang memerlukan pengkajian lebih lanjut. Akan tetapi
dibandingkan dengan Gigaspora jumlah spora Glomus masih jauh lebih banyak. Dilihat dari sudut hubungan antara salinitas tanah dengan asam humik terhadap jumlah spora yang dihasilkan, tampak bahwa pada semua tingkat salinitas
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
jumlah spora yang terbentuk dengan pemberian asam humik jauh lebih banyak dibandingkan tanpa pemberian asam humik. Beberapa fungsi penting dari asam humik antara lain adalah: dapat mempengaruhi konsentrasi dan ketersediaan garam-garam dalam tanah (Badura, 1965) dan mempertahankan pH tanah (Lee dan Bartlett, 1976). Selain itu senyawa humik bersifat amfoter, yaitu mempunyai kisi positif dan kisi negatif (Huang dan Schnitzer, 1997) sehingga akan mengikat senyawa-senyawa atau unsur-unsur yang tidak atau belum diperlukan tanaman. Dengan demikian maka sifat-sifat tanah dapat dipertahankan sebagaimana halnya kondisi di lapangan. Hal ini memberikan keuntungan bagi perkembangan mikoriza indogen.
Kultur Spora Tunggal dan Perbanyakan Kultur
Teknik pembuatan kultur spora tunggal dengan metoda PDOC memberikan peluang untuk dapat mempelajari pola perkembangan dan kolonisasi hifa-hifa CMA. Menurut Mansur (2000) dengan metoda PDOC tahap awal dari perkembangan simbiosis CMA dengan tanaman dapat dipelajari. Di samping itu perkecambahan spora, perkembangan hifa eksternal dan tahapan perkembangan spora (spore ontogeny) sampai menjadi spora matang akan lebih mudah diamati.
Dari keseluruhan kultur spora tunggal yang berasal dari 3 genus diketahui bahwa Glomus lebih cepat berkecambah (masa dormansinya lebih pendek) dibandingkan Gigaspora dan Acaulospora. Alasan untuk terjadinya perbedaan umur berkecambah dari setiap genus CMA ini berhubungan dengan adanya dormansi yang terjadi pada spora-spora CMA (Tommerup, 1983; Gazey et al., 1993). Tommerup (1983) mendapatkan bahwa spora-spora dari isolat CMA Acaulospora
laevis, Scutellospora calospora, Glomus caledonium, dan glomus monosporum
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
telah mempunyai sifat dorman secara genetik. Selanjutnya, panjang periode dormansi akan bervariasi antara isolat-isolat CMA. Menurut Ocampo et al. (1986) perbedaan waktu berkecambah spora dari setiap jenis CMA berhubungan dengan faktor intrinsik dari jenis itu sendiri.
Secara umum Glomus lebih cepat berkecambah dibandingkan Gigaspora dan Acaulospora. Hasil ini sejalan dengan Clark (1997) yang mempelajari perkecambahan dari 5 jenis Glomus, 4 jenis Scutellospora dan 4 jenis Gigaspora, dimana rata-rata waktu perkecambahan spora Glomus, Scutellospora dan
Gigaspora secara berurutan adalah 6 minggu, 14 minggu dan 21 minggu. Apakah
kecepatan berkecambah spora CMA juga ditentukan oleh kecepatan proses hidrasi yang merupakan tahap awal dari proses perkecambahan (Tommerup, 1984) dan ukuran spora? Secara hipotetis spora-spora Glomus yang berukuran lebih kecil dari genus-genus lainnya akan mempunyai fase hidrasi yang lebih cepat sehingga aktivitas enzim-enzim yang berhubungan dengan perkecambahan akan berlangsung llebih awal. Pada akhirnya proses perkecambahan juga akan terjadi lebih awal dari genus lainnya.
Dalam studi ini spora langsung diinokulasikan pad akar tanaman inang tanpa diinkubasi atau dikecambahkan terlebih dahulu. Ini mungkin menjadi alasan lain untuk lamanya waktu perkecambahan spora. Suhu dan kelembaban adalah faktor lingkungan paling penting untuk perkecambahan spora CMA (Daniels dan Trappe, 1980; Smith dan Read, 1997). Lebih lanjut Haugan dan Smith (1992) dalam Mansur (2000) yang bekerja dengan Glomus intraradices yang merupakan isolat dari tropis menyatakan bahwa perkecambahan akan lebih cepat dengan persentase
yang lebih tinggi jika spora-spora diinkubasi pada 30 0C. Berarti perkecambahan
spora akan lebih lama dengan persentase yang rendah pada kondisi lingkungan
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
kultur yang tidak terkendali. Mansur (2000) melaporkan bahwa perkecambahan
Glomus manihotis BEG112, Gigaspora rosea BEG111 dan Scutellospora
heterogama BEG40 yang diinokulasikan langsung pada akar tanaman akan lebih
lama dibandingkan jika spora-spora tersebut diinkubasi terlebih dahulu pada 30 0C.
Untuk pembentukan spora-spora baru dari setiap genus CMA tampaknya mempunyai pola yang sama dengan perkecambahan spora. Spora-spora yang telah berkecambah masih dipengaruhi oleh kecocokan dengan eksudat tanaman untuk dapat mengkolonisasi akar sampai akhirnya nanti membentuk spora-spora baru (Ocampo et al., 1986). Dalam penelitian ini pembentukan spora baru terjadi lebih awal pada Glomus diikuti oleh Gigaspora dan Acaulospora. Perbedaan waktu pembentukan spora-spora baru ini mungkin berhubungan dengan terlambatnya perkecambahan spora dan kolonisasi akar (Mansur, 2000). Akibatnya terjadi kekurangan atau ketiadaan karbon (C) untuk perkembangan hifa eksternal dan pembentukan spora.
Faktor lain yang dapat mempengaruhi pembentukan spora-spora baru adalah tingkat ketersediaan hara dalam media tumbuh (kultur). Doud Jr. dan Schenck (1990) menyatakan bahwa pembentukan spora CMA akan meningkat jika ketersediaan hara dimanipulasi sehingga tercipta kondisi yang kondusif untuk transpor bilateral P dari CMA ke inang dan C dari inang ke CMA. Rasio dan jumlah N dan P dalam larutan hara yang dibutuhkan adalah bervariasi (Johnson, 1984). Ketersediaan P yang rendah akan menjaga kolonisasi akar tetap tinggi dan meningkatkan manfaat dari transfer P ke inang, sedangkan unsur-unsur lain yang tinggi akan meningkatkan ketersediaan fotosintat yang penting untuk pembentukan spora.
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
Setiap spesies CMA membutuhkan rasio dan jumlah hara yang berbeda (Doud Jr. dan Schenck, 1990). Glomus intraradices Schenck dan Smith (INVAM-208) akan menghasilkan spora lebih banyak jika hanya diberi air daripada perlakuan lainnya. Sementara Glomus clarum (INVAM-204) lebih cocok dalam larutan Hoagland tanpa P daripada perlakuan lainnya. Perbedaan ini mungkin disebabkan oleh kebiasaan (habit) dari suatu jenis CMA saat pembentukan spora pada akar.
Dalam penelitian ini semua kultur mendapatkan larutan hara dalam rasio dan jumlah yang sama. Hal ini diduga menjadi penyebab rendahnya jumlah kultur spora tunggal yang berhasil membentuk spora-spora baru. Bahkan mungkin untuk jenis CMA yang sudah membentuk spora, komposisi dan konsentrasi hara yang diberikan belum merupakan komposisi dan konsentrasi terbaik bagi proses pembentukan spora. Ini ditunjukkan dengan kepadatan spora yang masih relatif rendah. Dengan demikian harus ada studi khusus untuk mendapatkan komposisi dan konsentrasi larutan hara terbaik bagi perkembangan CMA, khususnya untuk pembentukan spora-spora baru. Hal ini tidak saja bermanfaat dalam meningkat produksi spora tetapi juga dapat meningkatkan jumlah jenis CMA yang mampu membentuk spora dalam pembuatan kultur murni.
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
KESIMPULAN
Dari hasil penelitian ini dapat diambil kesimpulan sebagai berikut:
1. Pemberian asam humik dapat meningkatkan pertumbuhan tanaman inang
sehingga jumlah spora yang terbentuk juga akan meningkat.
2. Tipe spora Glomus mempunyai kecepatan berkecambah dan pembentukan
spora paling tinggi yang diikuti oleh Gigaspora dan Acaulospora.
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
DAFTAR PUSTAKA
Abbott LK dan Gazey C. 1994. An ecological view of the formation of VA mycorrhizas. Plant and Soil 159 : 69-78
Allen EB. dan Cunningham GL. 1983. Effects of vesicular-arbuscular mycorrhizae on Distichlis spicata under three salinity levels. New Phytol. 93 : 227-236. Ayuso M, Hernandez T, garcia C, dan Pascual JA. 1996. Stimulation of barley
growth and nutrient absorption by humic substances originating from various organic materials. Bioresource Technology 57 : 251-257
Badura L. 1965. On the mechanism of stimulating influence of Na-Humate upon the process of alcoholic fermentation and multiflication of yeasts. Acta. Soc. Bot. Pol. 34 : 287-328.
Brundrett MC. 1991. Mycorrhizal in natural ecosystems. Adv. Ecol. Res. 21 : 171-313
Brundrett MC, Melville L and Peterson L. 1994. Practical Methods in Mycorrhiza Research. Mycologue Publications. Ontario, Canada. 161 pp.
Brundrett MC dan Abbott LK. 1991. Roots of jarrah forest plants. I. Mycorrhizal associations of shrubs and herbaceous plants. Aust. J. Bot. 39 : 445-457 Chen Y dan Schnitzer M. 1978. The surface tension of aqueous solutions of soil
humic substances. Soil Sci. 125 : 7-15.
Chen Y dan Aviad T. 1990. Effect of humic substances on plant growth. Di Dalam : maccarthy P, Clapp CE, Malcolm RL, dan Bloom PR (Eds.). Humic substances in soil and crop science: selected readings. American Society of Agronomy, Inc. Soil Science Society of America, Inc. Madison, Wisconsin, USA. Hal. 161-186
Clark RB. 1997. Arbuscular mycorrhizal adaptation, spore germination, root colonization, and hoast plant growth and mineral acquisition at low pH. Plant and Soil 192 : 15-22
Cooper KM. 1984. Physiology of VA mycorrhizal associations. Di Dalam : Powell CL dan Bagyaraj DJ (Eds.) VA Mycorrhiza. Florida. CRC Press. Hal. 155-186
Daniels BA and Trappe JM. 1980. Factors affecting spore germination of vesicular-arbuscular mycorrhizal fungus, Glomus epigaeus. Mycologi. 72 : 457-463.
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
Douds Jr. DD dan Schenck NC. 1990. Increased sporulation of vesicular-arbuscular mycorrhizal fungi by manipulation of nutrient regimens. Applied and Environmental Microbiology. Feb. : 413-418
Ferguson JJ dan Woodhead SH. 1991. Increase and maintenance of vesicular-arbsucular mycorrhizal fungi. Di Dalam : Schenck NC. (Ed.). Methods and principles of mycorrhizal research. The American phytopathological Society (APS) Press. Hal. 47-54
Gazey C, Abbott LK dan Robson AD. 1993. VA mycorrhizal spores from three species of Acaulospora : germination, longevity and hyphal growth. Mycol. Res. 97 (7) : 785-790
Graham JH, Leonard RT dan Menge JA. 1982. Interaction of light intensity and soil temperature with phosphorous inhibition of vesicular-arbuscular mycorrhiza formation. New Phytol 91 : 683
Hayman DS. 1981. Praction aspect of vesicular-arbuscular mycorrhizae. Di Dalam : Rao NS (Ed.). Advances in agricultural mycrobiology. Oxford V.J.B.H. Publing. Nrew Delhi.
Harley JL dan Harley EL. 1987. A check list og\f mycorrhiza in the British flora. New Phytol. (Suppl). 105 : 1-102
Hernandez AP, El-Sharkawy, Sieverding E, dan Toro S. 1986. influence of water stress on growth and formation of VA mycorrhiza of 20 cassava cultivars. Di Dalam : Gianinazzi-Pearson V dan Gianinazzi S (Eds). Physiological and
genetical aspect of mycorrhizae. Proceeding of the 1st Europens
Symposium on Mycorrhizae. Hal. 717-720
Ho I. 1987. Vesicular-arbuscular mycorrhizae of halophytic grasses in the Alvard Desert of Oregon. Northwest Sci. 61 : 148-151.
Huang PM dan Schnitzer M. 1997. Interaksi mineral tanah dengan organik alami dan mikroba. Terjemahan. Gadjah Mada University Press. 920 hal.
Johnson CR. 1984. Phosphorus nutrition on mycorrhizal colonization, photosynthesis, growth and nutrient composition of Citrus aurantium. Plant Soil : 80 : 35-42
Johnson CR, Menge JA, Schwab S, dan Ting IP. 1982. Interaction of photoperiod and vesicular-arbuscular mycorrhizae on growth and metabolism of sweet orange. New Phytol 90 : 665
Kim CK and Weber DJ. 1985. Distribution of VA Mycorrhiza on Halophytes on Inland Salt Playas. Plant Soil. 83 : 207-214.
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
Koske RE. 1987. Distribution of VA mycorrhizal fungi along a latitudinal temperature gradient. Mycologia 79(1) : 55-68
Lee YS dan Bartlett RJ. 1976. Stimulating of plant growth by humic substances. Soil Sci. Soc. Am. J. 40 : 876-879.
Lulakis MD dan Petsas SI. 1995. Effect of humic substances from vine-canes mature compost an tomato seedling growth. Bioresource Technology 54 : 179-182
MacCarthy P, Clapp CE, Malcolm RL, dan Bloom PR. 1990. Humic substances in soil and crop science: selected readings. American Society of agronomy, Inc. Soil Science Society of america, Inc. Madison, Wisconsin, USA. 281 hal.
Mansur I. 2000. Diversity of rhizobia nodulating the tree legumes Acacia mangium and Paraserianthes falcataria and their interaction with arbuscular mycorrizal fungi in young seedling. PhD Dissertation, University of Kent at Canterbury, Kent, Inggris.
Marschner H. 1995. Mineral nutrition of higher plants. Second Edition. Academic Press. Harcourt Brace & Company, Publisher. London.
Menge JA. 1984. Inoculum production. Di Dalam : Powell CL dan Bagyaraj DJ (Eds.) VA Mycorrhiza. Florida. CRC Press. Hal. 187-203
Meyer FH. 1973. Distribution of ectomycorrhizae in native and man-made forest. Di Dalam : Mark GC dan Kozlawasky TT (Eds.). Ectomycorrhizae : their ecology and physiology. Academic Press. New York. Hal. 19-105
Ocampo JA, cardona FL dan El-Atrach F. 1986. Effect of root extracts of non host plants on VA mycorrhizal infection and spore germination. Di Dalam : Gianinazzi-Pearson V dan Gianinazzi S (Eds). Physiological and genetical
aspect of mycorrhizae. Proceeding of the 1st Europens Symposium on
Mycorrhizae. Hal. 721-724
Pacioni G. 1986. Sporulation of the VAM fungi stimulated by water stress in natural conditions. Di Dalam : Gianinazzi-Pearson V dan Gianinazzi S (Eds).
Physiological and genetical aspect of mycorrhizae. Proceeding of the 1st
Europens Symposium on Mycorrhizae. Hal. 713-716
Poljakoff-Mayber A dan Gale J. 1975. Plants in saline environments. Springer-Verlag. Berlin Heidelberg. New York. 213 p.
Pond EC, Menge JA dan Jarrell WM. 1984. Improved growth of tomato in silinized soil by vesicular-arbuscular mycorrhizal fungi collected from salinie soils. Mycologia 76 : 74-84
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
Ragupathy S and Mahadevan A. 1991. VAM distribution influenced by salinity gradient in a coastal tropical forest. pp. 91-97. Di Dalam : Soerianegara and Supriyanto (Eds). Proceeding of second Asian Conference on
Mycorrhiza. BIOTROP Special Publication. No. 42. SEAMEO BIOTROP.
Bogor. Hal. 91-97
Raschen I dan von Alten H. 1992. Examination of single spore culture of VA fungi by isoenzyme patterns after polyacrylamide gel electrophoresis (PAGE). . Di Dalam : Read DJ, Lewis DH, Fitter AH, dan Alexander IJ. (Eds.). Mycorrhizas in ecosystems. CAB International. Cambridge. Hal. 398 Sieverding E. 1991. Vesicular-arbuscular mycorrhiza management in tropical
agrosystems. Deutsche Gesellschaft fur Technische Zusammenarbeit, Germany. 371 hal.
Smith SE and Read DJ. 1997. Mycorrhizal symbiosis. Second edition. Academic Press. Harcourt Brace & Company Publisher. London. pp. 32-79.
Tan KH. 1978. Effects of humic and fulvic acids on release of fixed potassium. Geoderma. 21 : 67-74.
Tommerup IC. 1983. Spore dormancy in vesicular-arbsucular mycorrhizal fungi. Trans. Br. Mycol. Soc. 81 : 37-45
Tommerup IC. 1984. Effect of Soil Water Potential on Spore Germination by Vesicular-Arbuscular Fungi. Trans. Br. Mycol. Soc. 83 : 193-202.
Trouvelot A, Abdel-Fattah GM, Gianinazzi S, dan Gianinazzi-Pearson V. Differential effects of fungicides on VA fungal viability and efficiency. . Di Dalam : Read DJ, Lewis DH, Fitter AH, dan Alexander IJ. (Eds.). Mycorrhizas in ecosystems. CAB International. Cambridge. Hal. 404
Varma A dan Hock B. Mycorrhiza structure, function, molecular biology and biotechnology. 2nd Edition. Springer. 704 p
Vejsadova H. 1992. The influence of organic and inorganic fertilization on the development og indigenous VA fungi in roots of red clover. Di Dalam : Read DJ, Lewis DH, Fitter AH, dan Alexander IJ. (Eds.). Mycorrhizas in ecosystems. CAB International. Cambridge. Hal. 406
Vilarino A, Arines J dan Schuepp H. 1992. Propagule production by VA fungi in red clover plants subjected to periodic removal of the aerial parts. . Di Dalam : Read DJ, Lewis DH, Fitter AH, dan Alexander IJ. (Eds.). Mycorrhizas in ecosystems. CAB International. Cambridge. Hal. 406
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006
Von Alten H dan Lindemann. 1992. Acceleration of VA mycorrhiza development by bacteria or fungicides. Di Dalam : Read DJ, Lewis DH, Fitter AH, dan Alexander IJ. (Eds.). Mycorrhizas in ecosystems. CAB International. Cambridge. Hal. 407
Delvian: Koleksi Isolat Cendawan Mikoriza Arbuskula , 2006 USU Repository©2006