1 BAB I
PENDAHULUAN
A. Latar belakang
Inflamasi merupakan suatu gejala pada beberapa penyakit dan dirasa oleh banyak orang tidak nyaman. Proses inflamasi merupakan suatu mekanisme perlindungan tubuh untuk menetralisir dan membasmi agen-agen yang berbahaya pada tempat cedera dan mempersiapkan keadaan untuk perbaikan jaringan (Kee dan Hayes, 1996). Obat modern yang biasa digunakan sebagai antiinflamasi adalah obat golongan AINS (Antiinflamasi Non Steroid) yang pada umumnya mempunyai efek samping tukak lambung, sehingga perlu dicari pengobatan alternatif untuk melawan dan mengendalikan rasa nyeri dan peradangan. Sebagai alternatif yang lebih aman adalah penggunaan kurkumin sebagai antiinflamasi dengan mekanisme menghambat produksi prostaglandin yang dapat diperantarai melalui penghambatan aktivitas enzim siklooksigenase (Sudjarwo, 2004). Penggunaan secara klinik telah banyak dilakukan terhadap kurkumin sebagai agen antiinflamasi. Dari beberapa uji klinik pada manusia menunjukkan bahwa kurkumin aman untuk terapi antiinflamasi. Permasalahan yang dihadapi adalah kestabilan kurkumin. Kurkumin mudah mengalami dekomposisi pada pH basa dan faktor cahaya yang disebabkan oleh gugus metilen aktifnya (Tonnesen dan Karlsen, 1985).
Oleh karena itu, untuk memperbaiki kelemahan tersebut dilakukan sintesis analog kurkumin yakni gamavuton-0 disingkat GVT-0. Senyawa tersebut mirip
dengan kurkumin karena sama-sama mempunyai gugus hidroksi dan gugus metoksi pada rantai aromatiknya. Selain itu, GVT-0 juga mempunyai satu gugus karbonil dan sama sekali tidak mempunyai gugus metilen. Senyawa ini lebih stabil daripada kurkumin dan tetap mempunyai aktivitas antiinflamasi (Sardjiman, 2000). Untuk itu, GVT-0 sebagai senyawa analog kurkumin dapat digunakan sebagai salah satu alternatif yang potensial.
Kurkumin dan GVT-0 merupakan senyawa yang sulit larut dalam air, sehingga dengan sifat tersebut mengakibatkan bioavailabilitasnya dalam tubuh rendah. Ravindranath dan Chandrasekhara (1980-1982) mempelajari absorpsi, metabolisme, dan distribusi kurkumin dalam jaringan pada pemberian oral kurkumin, menyimpulkan bahwa kurkumin sulit diabsorpsi di usus akibat sifatnya yang sukar larut dalam air tersebut. Oleh karena itu, untuk memberikan efek farmakologis diperlukan dosis yang besar yakni antara 20-80 mg/kg BB (Jurenka, 2009). Hal ini juga terjadi pada GVT-0 karena kemiripan struktur kimianya.
Salah satu strategi yang dapat dilakukan untuk mengatasi berbagai hambatan di atas yaitu dengan mengembangkan sistem penghantaran obat dalam bentuk nanopartikel yang bersifat lebih mudah terdispersi stabil dalam air (Saha dkk., 2010). Salah satu metode pembuatan nanopartikel adalah menggunakan metode ionik gelasi yang distabilkan dengan suatu cross linker (Martien dkk., 2006). Ionik gelasi melibatkan interaksi suatu senyawa dengan polimer yang memiliki gugus-gugus dengan muatan yang berlawanan.
Kurkumin dan gamavuton-0 memiliki muatan negatif dalam air karena memiliki gugus karbonil dan hidroksi akan dapat mengadakan interaksi ionik dengan gugus bermuatan positif. Kitosan merupakan polimer kationik karena memiliki gugus amina yang terprotonasi menjadi amonium pada kondisi asam. Kitosan memiliki sifat biokompatibel dan biodegradabel sehingga menjadi pilihan yang baik dalam preparasi nanopartikel (Tiyaboonchai, 2003). Sebagai stabilisator nanopartikel yang terbentuk, digunakan cross linker bermuatan negatif yaitu sodium tripolifosfat (Na-TPP). Anion TPP akan mengait sisa gugus amonium dalam satu polimer yang tidak berinteraksi dengan kurkumin atau gamavuton-0.
Penelitian ini dilakukan menggunakan model uji antiinflamasi dengan udema pada kaki tikus. Untuk penentuan aktivitas antiinflamasi digunakan senyawa uji yaitu GVT-0, kurkumin, nanopartikel GVT-0 dan nanopartikel kurkumin. Senyawa uji diberikan secara oral 30 menit sebelum penyuntikkan suspensi karagenin 1% secara subplantar pada telapak kaki tikus betina galur Wistar dan diamati volume udem yang timbul tiap 30 menit dari jam ke-0 hingga jam ke-6 (Patel dkk, 2012). Formulasi nanopartikel pada kedua senyawa tersebut diharapkan mampu memperbaiki bioavailabilitas GVT-0 dan kurkumin. Dengan kestabilan yang lebih tinggi daripada kurkumin diharapkan aktivitas GVT-0 sebagai antiinflamasi juga meningkat. Selanjutnya akan diketahui perbandingan efektivitas daya antiinflamasi antara kurkumin dengan GVT-0 sebelum dan setelah formulasi nanopartikel.
B. Rumusan masalah
Berdasarkan latar belakang masalah yang telah dikemukakan di atas, maka dapat dirumuskan beberapa permasalahan sebagai berikut :
1. Bagaimana pengaruh formulasi nanopartikel terhadap daya antiinflamasi kurkumin dan GVT-0 ?
2. Apakah nanopartikel GVT-0 memiliki aktivitas antiinflamasi yang lebih baik daripada nanopartikel kurkumin ?
C. Tujuan penelitian
Penelitian ini bertujuan untuk :
1. Mengetahui pengaruh formulasi nanopartikel terhadap daya antiinflamasi GVT-0 dengan kurkumin pada tikus betina galur Wistar yang diinduksi karagenin
2. Mengetahui perbandingan aktivitas antara nanopartikel GVT-0 dengan nanopartikel kurkumin sebagai senyawa antiinflamasi
D. Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan manfaat antara lain sebagai berikut,
1. Penelitian ini dapat digunakan sebagai alternatif studi pustaka yang dijadikan bahan evaluasi untuk pengembangan metode selanjutnya
2. Dapat dijadikan acuan dan pustaka dalam evaluasi pengembangan produk analog kurkumin yang lebih aplikatif dan dapat
H3CO HO O O OCH3 OH
direalisasikan menjadi produk jadi yang dapat dimanfaatkan oleh masyarakat
3. Dapat memberikan alternatif pengobatan inflamasi yang lebih aman, efektif, dan dapat diterima dengan baik (acceptable) bagi pasien
E. Tinjauan Pustaka 1. Kurkumin
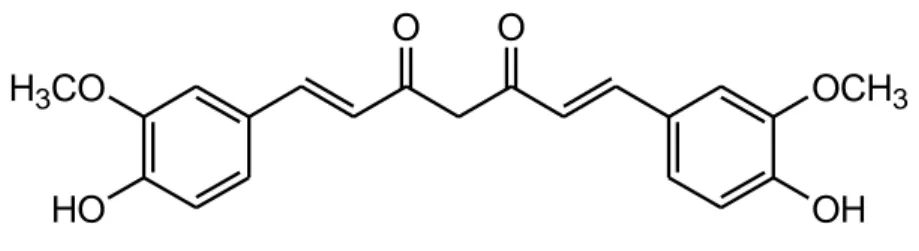
Kurkumin merupakan senyawa yang berupa kristal kuning jingga. Di alam kurkumin tedapat bersama dua turunan senyawa lainnya yaitu demetoksikurkumin dan bis-demetoksikurkumin, yang dikenal dengan kurkuminoid (Tonnesen dan Karlsen, 1985). Kurkumin memiliki rumus molekul kurkumin C21H20O6 dengan
BM 368,37 g/mol serta titik lebur pada 183° C. Kurkumin tidak larut dalam air dan eter, larut dalam etanol, dimetilsulfoksida dan aseton (Wahyuni dan Paskalina, 2004). Kurkumin telah dikembangkan melalui sintesis dengan cara kondensasi antara vanillin dengan asetil aseton dan merupakan senyawa β diketon tak jenuh (Sudibyo, 1996).
Gambar 1. Struktur kimia kurkumin (Sardjiman, 2000)
Senyawa ini berwarna merah kecoklatan dalam kondisi alkali dan kuning muda dalam kondisi asam. Degradasi kurkumin tergantung pH dan berlangsung
lebih cepat pada kondisi netral-basa. Kurkumin stabil dalam pH asam, sedangkan pada pH basa mudah mengalami dekomposisi. Produk utama dekomposisinya adalah asam ferulat dan 4-fenil-3-butena-2-on, yang secara cepat mengalami kondensasi retro-aldol menjadi vanilin dan aseton. Di samping itu, cahaya juga dapat mendekomposisi kurkumin menjadi ferulat aldehid, asam ferulat, adihidroksinaftalen, vinilguaiacol, vanilin, dan asam vanilat. Faktor penyebab dekomposisi kurkumin ini disebabkan oleh gugus metilen aktifnya, sehingga dengan modifikasi gugus ini menjadi gugus lain diharapkan mampu memperbaiki kelemahan kurkumin (Tonnesen dan Karlsen, 1985). Penghilangan gugus metilen aktif dan gugus karbonil dapat menghasilkan bentuk yang lebih stabil dan masih memiliki aktivitas antioksidan (Sardjiman, 2000).
Ketidakstabilan kurkumin juga dipengaruhi oleh bentuk struktur senyawanya. Kurkumin memiliki struktur β-diketon yang terdiri dari dua molekul asam ferulat yang dihubungkan melalui jembatan metilen pada atom karbon dari gugus karboksilnya. Atom Cα pada kurkumin diapit oleh dua gugus karbonil menyebabkan atom Cα aktif sehingga menjadikan kurkumin tidak stabil. Oleh karena itu, kurkumin dapat mengalami tautomerisasi dalam bentuk keto enol. Kurkumin dalam kondisi asam, netral, dan dalam fase padat didominasi bentuk keto sedangkan dalam kondisi basa didominasi oleh bentuk enol (Strimtakos dan Sharma, 2008).
Struktur kurkumin secara umum dapat dibagi menjadi dua bagian besar yaitu inti aromatik dan β-diketon. Gugus β-diketon berperan sebagai antiinflamasi, antikanker, dan antimutagenik (Majeed dkk., 1995). Kurkumin saat
ini banyak dikembangkan sebagai anti hepatotoksik, antiinflamasi dan antikanker. Sebagai obat antiinflamasi terkait dengan sebagian besar obat antiinflamasi seperti
Nonsteroidal Antiinflammatory Drugs (NSAIDs) menunjukkan efek samping
gangguan saluran pencernaan (Meiyanto, 1999). Efek antiinflamasi dari kurkumin dikaitkan dengan aktivitasnya sebagai inhibitor dan represor COX-2. Jaringan yang mengalami inflamasi akan terjadi peningkatan ekspresi COX-2 yang mengakibatkan overproduksi prostanoid termasuk didalamnya adalah prostaglandin (Meiyanto, 1999).
2. Gamavuton-0 ( GVT-0 )
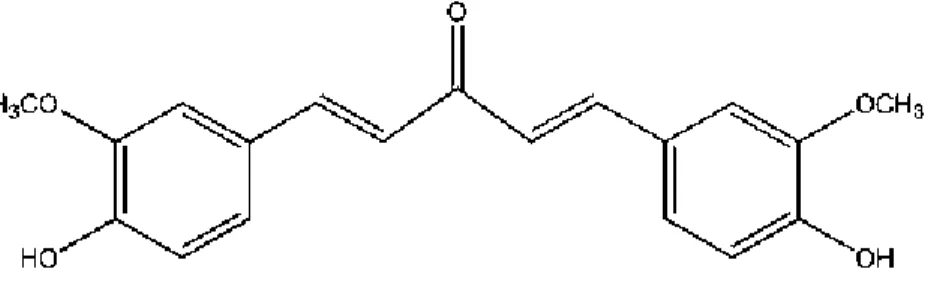
Senyawa gamavuton (GVT-0) memiliki nama kimia 1,5-bis(4’-hidroksi-3’-metoksifenil)-1,4-pentadien-3-on, merupakan salah satu senyawa analog kurkumin. Nama Gamavuton-0 berasal dari kata “Gama” yang berarti Gadjah
Mada ,“vu” dari “Vrije Universiteit”, dan “ton” menunjukkan bahwa senyawa
tersebut mengandung gugus keton di tengah-tengah molekulnya (Patent No.: US 6,777, 447 B2, Date of Patent : Aug. 17, 2004)(Reksohadiprodjo dkk., 2004). Senyawa tersebut mirip dengan kurkumin karena sama-sama mempunyai gugus hidroksi dan gugus metoksi pada rantai aromatiknya. Perbedaannya senyawa tersebut mempunyai kerangka 1,5-difenil-1,4-pentadien-3-on sedangkan kurkumin adalah 1,7-difenil-1,6-heptadien-3,5-dion, hal tersebut menggambarkan bahwa senyawa GVT-0 ini mempunyai jembatan rantai karbon yang lebih pendek (pentadienon) daripada kurkumin (heptadiendion). Selain itu, GVT-0 juga mempunyai satu gugus karbonil dan tidak mempunyai gugus
metilen. Senyawa ini lebih stabil pada pH di atas 6,5 dibandingkan dengan kurkumin dan tetap mempunyai sifat antiinflamasi (Sardjiman, 2000).
Gambar 2. Struktur Kimia Gamavuton-0 (Sardjiman, 2000)
Senyawa GVT-0 dapat diperoleh dengan mereaksikan antara vanillin dan aseton dengan katalis asam. Mekanisme reaksinya melalui reaksi kondensasi
Claisen-Schmidt. Modifikasi kurkumin menjadi senyawa GVT-0 bertujuan untuk
memperbaiki stabilitas kurkumin, yang dipengaruhi oleh pH dan cahaya. Pada struktur kimia GVT-0, memodifikasi bagian tengah kurkumin pada gugus metilen dan gugus karbonil menjadi 1,4-pentadien-3-on dan masih tetap mempertahankan bagian hidroksi pada cincin aromatik yang bertanggung jawab untuk aktivitas biologisnya, menghasilkan suatu senyawa yang lebih stabil dibandingkan dengan kurkumin (Sardjiman dkk., 1997). Senyawa GVT-0 memiliki sifat sangat sukar larut dalam air. Hal ini menyebabkan bioavalabilitasnya dalam tubuh rendah seperti yang terjadi pada senyawa kurkumin karena kemiripan struktur kimianya (Ravindranath dan Chandrasekha, 1981).
Senyawa ini mempunyai aktivitas antioksidan dan antiinflamasi (Masuda dkk., 1993; Sardjiman dkk., 1997; Sardjiman, 2000). Kemampuan GVT-0 dalam menghambat COX dapat ditinjau dari struktur yang hampir sama dengan kurkumin.
3. Nanopartikel
Nanopartikel adalah dispersi partikel padat yang memiliki ukuran 10 nm sampai dengan 1000 nm (Mohanraj dan Chen, 2006). Nanopartikel diformulasi menggunakan polimer biodegradabel maupun nonbiodegradabel yang mengakibatkan bahan obat dapat terjebak (entrapped), diadsorpsi atau bergandengan secara kimia (Sahoo dan Labhasetwar, 2006). Ada dua tipe nanopartikel jika ditinjau dari proses preparasinya yaitu nanosfer dan nanokapsul (Alleman dkk., 1993). Nanosfer memiliki struktur dengan tipe monolitik (matriks) dimana obat atau senyawa aktif terdispersi di dalam permukaan atau teradsorpsi pada permukaan partikel matriks pembawanya. Nanokapsul membentuk struktur dinding-membran dan obat atau senyawa aktif terjebak di dalam intinya atau teradsorpsi pada permukaan membran tersebut. Istilah “nanopartikel” diambil karena secara umum, berhubungan dengan ukurannya yang sangat kecil, sangat sulit membedakan apakah suatu kompleks nanopartikel termasuk dalam tipe nanosfer (matriks) atau nanokapsul (membran) (Tiyaboonchai, 2003).
Partikel dalam ukuran nano dapat melewati membran dengan mudah karena ukuran partikel lebih kecil daripada ukuran kapiler. Mudah masuknya partikel dapat meningkatkan efisiensi obat. Kelebihan nanopartikel yang lain adalah permukaannya dapat dimodifikasi sehingga dapat lebih spesifik terikat pada ligan tertentu (Bisht dkk., 2007). Dalam bidang farmasi, nanopartikel telah banyak dipelajari dan diharapkan mampu memperbaiki penghantaran senyawa dengan permeabilitas mukosa rendah, absorbsi terbatas, kelarutan rendah, tidak
stabil di saluran cerna serta mengalami first pass effect (Bhardwaj dan Kumar, 2006).
Keuntungan menggunakan nanopartikel dalam penghantaran obat diantaranya karena ukurannya yang kecil dapat berpenetrasi melalui kapiler lebih banyak sehingga memungkinkan akumulasi obat lebih efisien pada target aksi obat. Dengan penggunaan bahan biodegradabel dapat memungkinkan pelepasan tertunda dalam sisi target selama periode waktu lama. Selain itu permukaan nanopartikel dapat dimodifikasi untuk mengubah biodistribusi obat atau dikonjugasikan dengan ligan untuk mencapai target spesifik dari penghantaran obat (Sahoo dan Labhasetwar, 2006). Nanopartikel memiliki zeta potensial positif sehingga dapat menempel pada membran bermuatan negatif dan membantu proses endositosis obat kedalam sel (Mohanraj dan Chen, 2006).
Kelebihan nanopartikel untuk penghantaran per oral adalah meningkatkan bioavailabilitas, meningkatkan transport obat melalui sirkulasi limfatik sehingga menghindari pre systemic metabolism di hepar dan mereduksi iritasi gastrointestinal oleh obat (Sakuma dkk., 2001). Penghantaran koloidal dalam ukuran partikel kecil juga mampu meningkatkan stabilitas obat terhadap denaturasi di lumen gastrointestinal serta memperpanjang kontak dengan membran mukosa (mukoadesif) (Ponchel dkk., 1997).
Pengembangan nanopartikel polimer dapat berasal dari polimer alami atau polimer sintetik. Kriteria polimer yang ideal sebagai pembawa nanopartikel adalah mudah untuk disintesis dan dikarakteristik, biokompatibel, biodegradabel,
memiliki respon imun yang minim, sifat toksisitasnya yang rendah, larut air, dan tidak mahal. Pengembangan nanopartikel untuk sistem penghantaran obat telah dikembangkan dengan memanfaatkan polimer alam seperti kitosan. Kitosan memiliki banyak kelebihan seperti biokompatibel, biodegradabel, toksisitas yang rendah, mudah disintesis, dan dikarakterisasi (Tiyaboonchai, 2003). Sistem penghantaran nanopartikel harus memenuhi kriteria antara lain stabil, tidak toksik, reprodusibel, mudah dan tidak mahal untuk pembuatan skala besar, dapat diaplikasikan untuk berbagai obat, protein, dan polinukleotida (Tiyaboonchai, 2003). Kurkumin dan turunannya yaitu PGV, GVT, dan HGV merupakan salah satu contoh kandidat obat yang menerapkan teknologi nanopartikel sebagai upaya untuk memperbaiki bioavailabilitasnya (Jayanti, 2011).
Salah satu metode yang digunakan adalah metode ionik gelasi yang merupakan salah satu teknik enkapsulasi. Metode ionik gelasi umum digunakan untuk membentuk nanopartikel dari kitosan (Lee dkk., 2001). Caranya adalah menyelimuti material dengan materi intinya yang terlarut ditekan sebagai tetesan-tetesan dalam larutan ionik. Teknik ionik gelasi banyak digunakan dalam pembentukan nanopartikel. Dalam metode ionik gelasi, polisakarida (alginat, gellan, dan pektin) dilarutkan dalam air atau dalam medium asam lemah (untuk kitosan). Larutan tersebut kemudian ditambahkan pada larutan yang mengandung
counterions dalam kondisi pengadukan konstan. Berhubungan dengan terjadinya
pembentukan kompleks oleh muatan yang saling berlawanan, polisakarida mengalami ionik gelasi dan mengendap membentuk partikel sferis. Partikel difiltrasi, dicuci dengan akuades dan dikeringkan. Counterions yang digunakan
dalam ionik gelasi, dapat dibagi dalam dua kategori yaitu counterions dengan BM rendah (kalsium klorida, magnesium klorida, perak klorida, pyrophosphate,
tripolyphosphate, tetrapolyphosphate, octapolyphosphate, hexametaphosphate )
dan counterions dengan BM tinggi (octyl sulphate, lauryl 17 sulphate, hexadecyl
sulphate, cetylstearyl sulphate). Metode ionik gelasi sangat sederhana dan ringan.
Sebagai tambahan, terjadinya ikatan silang (crosslink) secara fisik yang bersifat reversibel dari interaksi elektrostatik untuk menstabilkan kompleks nanopartikel yang terbentuk. Ikatan bersifat reversibel sehingga dapat menghindari adanya toksisitas reagen dan efek lain yang tidak diharapkan (Racovita dkk., 2009).
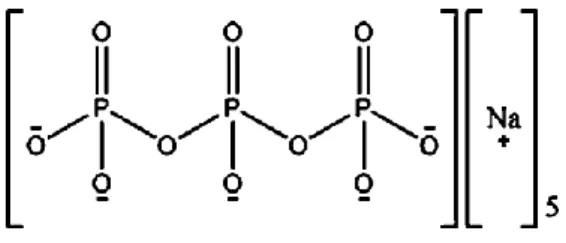
Calvo dan rekan-rekannya (1997) mengembangkan suatu metode untuk membentuk nanopartikel kitosan hidrofilik dengan ionik gelasi. Metode ini meliputi pencampuran dua fase cairan yang mana salah satunya adalah polimer kitosan dan yang lainnya adalah polianion sodium TPP. Berikut ini adalah gambar struktur kimianya TPP
Gambar 3. Struktur Kimia Sodium TPP
Dengan metode ini, dalam suasana asam (pH 4-6) muatan positif dari gugus amina primer kitosan yang telah terprotonasi (-NH3+) berinteraksi dengan
muatan negatif TPP untuk membentuk kompleks dengan ukuran nanometer. TPP banyak digunakan dalam berbagai penelitian sebagai polianion untuk berinteraksi
dengan kitosan. Alonso dan Sanchez (2003) mengembangkan penelitian pembentukan nanopartikel dengan penambahan TPP pada larutan asam (pH 4-6) yang berisi kitosan. Dalam pelarut asam, umumnya pada pH 4-6, gugus amina primer diprotonasi sehingga bersifat elektrofilik (Aranaz dkk., 2010). Interaksi ionik terjadi antara muatan positif -NH3+ dari kitosan dengan muatan negatif
P3O105- dari TPP yang secara random akan menghasilkan kompeks. Penambahan
TPP (Tri Poli Phosphat) biasanya dilakukan dalam proses ionik gelasi sebagai agen crosslinker yang berfungsi untuk menstabilkan partikel (Mohanraj dan Chen, 2006). Konsentrasi kitosan dan TPP berperan penting pada tahap formulasi nanopartikel (Kunjachan dkk., 2010).
Nanopartikel harus tetap stabil dalam cairan ekstraselular. Ketidakstabilan nanopartikel dalam cairan ekstraselular dapat mengganggu interaksi polielektrolit. Setelah nanopartikel sampai ke sel target, nanopartikel kemudian terikat oleh membran sel yang bermuatan negatif dan kemudian memicu terjadinya endositosis (Mohanraj dan Chen, 2006).
4. Kitosan
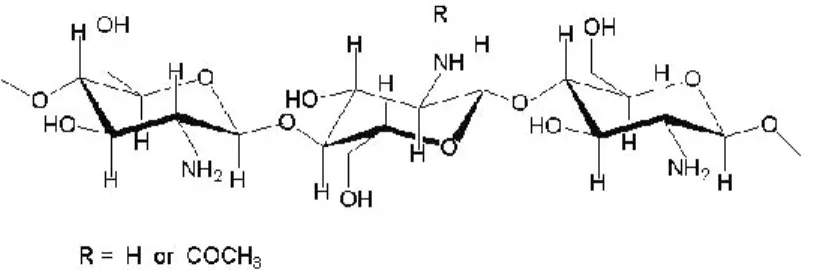
Kitosan adalah polisakarida turunan kitin yang terdiri dari ikatan D-glukosamin dan N-asetil-D-Glukosamin yang berikatan (1,4)-β-glikosidik. Kitosan mempunyai rantai tidak linier dan mempunyai rumus molekul C6H11NO4
atau disebut [poli (2-amina-2-deoksi-β-(1,4)-D-glukopiranosa] (Fernandez-Kim, 2004). Salah satu polimer polikationik yang akan digunakan sebagai penghantar adalah kitosan yang merupakan polimer yang mempunyai toksisitas rendah,
bidegradabel dan biokompatibel, larut dalam asam encer dan mempunyai muatan positif (Aranaz dkk., 2010).
Kitosan merupakan basa lemah dengan nilai pKa 6,5 yang larut dalam medium asam seperti asam asetat, asam sitrat, asam aspartat, dan tidak larut dalam suasana pH netral dan alkali (Guliyeva dkk., 2006). Kitosan merupakan senyawa yang tidak larut dalam air, larutan basa kuat, asam sulfat, dan beberapa pelarut organik seperti alkohol, aseton, dimetilformamida, dan dimetilsulfoksida. Kitosan sedikit larut dalam asam klorida,asam nitrat, dan asam fosfat 0,5% dan larut baik
dalam asam asetat (Knorr, 1984). Kitosan pada kondisi asam akan bermuatan positif dan dapat membentuk kompleks polielektrolit dengan senyawa yang memiliki muatan negatif (Muzzarelli, 1996).
Gambar 4.Struktur kimia kitosan (Hermawan, 2012)
Adanya gugus amina primer menyebabkan kitosan mempunyai reaktivitas kimia yang tinggi dan menyumbangkan sifat elektrolit polikation. Kelarutan kitosan tergantung pada distribusi gugus amina primer dan N-asetil. Dalam pelarut asam (pH<6) umumnya pada pH 4-6, gugus amina primer akan terprotonasi membentuk gugus amina kationik (-NH3+) membuat molekul kitosan menjadi mudah larut.
Pasangan elektron bebas pada gugus amina primer bersifat nukleofilik yang sebagai akseptor proton sehingga gugus amina ini dapat terprotonasi.
5. Inflamasi
Inflamasi merupakan respon terhadap cedera jaringan dan infeksi. Ketika proses inflamasi berlangsung, terjadi reaksi vaskular dimana cairan, elemen-elemen darah, sel darah putih dan mediator kimia berkumpul pada tempat cedera. Proses inflamasi merupakan suatu mekanisme perlindungan tubuh untuk menetralisir dan membasmi agen-agen yang berbahaya pada tempat cedera dan mempersiapkan keadaan untuk perbaikan jaringan (Kee dan Hayes, 1996).
Ciri khas inflamasi dikenal dengan tanda-tanda utama inflamasi, yaitu : a. Eritema (kemerahan)
Kemerahan terjadi pada tahap pertama dari proses inflamasi. Darah berkumpul pada daerah cedera jaringan akibat pelepasan mediator-mediator kimia tubuh (kinin, prostaglandin, histamin).
b. Edema (pembengkakan)
Pembengkakan merupakan tahap kedua dari inflamasi. Plasma merembes ke dalam jaringan intestinal pada tempat cedera. Kinin mendilatasi arteriol meningkatkan permeabilitas kapiler.
c. Kolor (panas)
Panas pada tempat inflamasi disebabkan oleh bertambahnya pengumpulan darah dan mungkin juga karena pirogen (substansi yang menimbulkan demam) yang mengganggu pusat pengatur panas pada hipotalamus.
d. Dolor (nyeri)
Nyeri disebabkan oleh pembengkakan dan pelepasan mediator-mediator kimia.
e. Functio laesa (hilangnya fungsi)
Karena penumpukan cairan pada tempat cedera jaringan dan adanya rasa nyeri akan mengurangi mobilitas pada daerah yang terkena cedera (Kee dan Hayes, 1996).
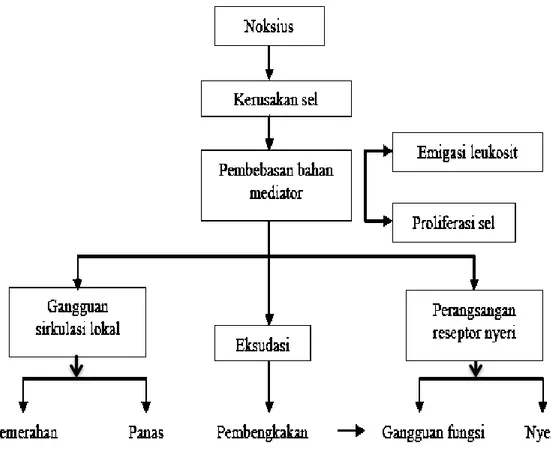
Tanda-tanda diatas merupakan akibat dari gangguan aliran darah yang terjadi akibat kerusakan jaringan dalam pembuluh pengalir terminal, eksudasi, dan perangsangan reseptor nyeri. Radang dapat dihentikan dengan meniadakan noksi
atau dengan menghentikan kerja yang merusak. Walaupun demikian, seringkali pada gangguan darah regional dan eksudasi terjadi emigrasi sel-sel darah ke dalam ruang ekstrasel serta proliferasi histiosit fibroblas. Proses-proses ini juga berfungsi primer pada perlawanan terhadap kerusakan serta pemulihan ke kondisi asalnya, walaupun demikian juga dapat bekerja negatif. Reaksi ini disebabkan oleh pembebasan bahan-bahan mediator (histamin, serotonin, prostaglandin, dan kinin). Proses patogenesis tersebut dapat dilihat pada gambar 5 (Mutschler, 1986).
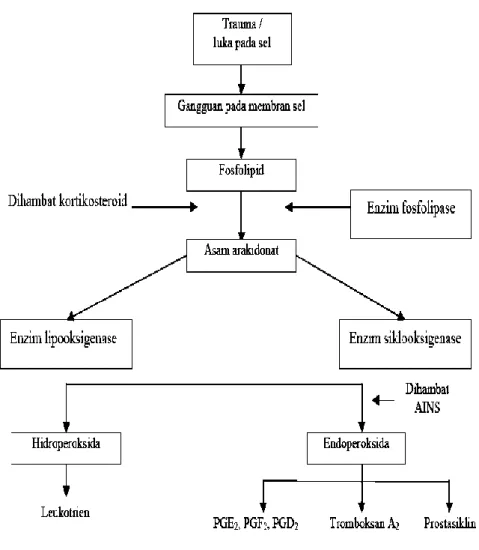
Prostaglandin dilepaskan menyebabkan bertambahnya vasodilatasi, permeabilitas kapiler, nyeri dan demam. Sintesisnya dapat dilihat dari gambar 6 yaitu bila membran sel mengalami kerusakan oleh suatu rangsangan kimia, fisik atau mekanis, maka enzim fosfolipase diaktifkan untuk mengubah fosfolipida menjadi asam arakidonat. Kemudian asam lemak tak jenuh ini sebagian diubah oleh enzim siklooksigenase menjadi endoperoksida dan seterusnya menjadi zat-zat prostaglandin (Tjay dan Rahardja, 2002).
Gambar 6. Perombakan Asam Arakhidonat (Mutschler, 1986)
Siklooksigenase terdiri dari dua isoenzim yaitu COX-1 dan COX-2. COX-1 berperan pada pemeliharaan fungsi ginjal, homeostasis vaskuler dan melindungi lambung dengan cara membentuk bikarbonat dan lendir, serta menghambat produksi asam. COX-2 dalam keadaan normal tidak terdapat di dalam jaringan, tetapi dibentuk selama proses peradangan oleh sel-sel radang dan kadarnya dalam sel meningkat sampai 80 kali. Bagian lain dari arakidonat diubah oleh enzim lipooksigenase menjadi zat-zat leukotrien. Baik prostaglandin maupun leukotrien bertanggung jawab bagi sebagian besar dari gejala peradangan. Menurut
perkiraan, penghambatan COX-2 ini yang memberikan NSAID memiliki efek antiinflamasi (Tjay dan Rahardja, 2002). Obat-obat inflamasi seperti obat-obat antiinflamasi nonsteroid dan steroid menghambat mediator kimia sehingga mengurangi proses inflamasi (Kee dan Hayes, 1996).
Pengobatan inflamasi mempunyai 2 tujuan utama, yaitu meringankan rasa nyeri yang sering kali gejala awal yang terlihat dan keluhan utama yang terus menerus dari pasien dan memperlambat atau membatasi proses perusakan jaringan. Pengurangan inflamasi dengan NSAID sering berakibat meredanya rasa nyeri selama periode yang bermakna. Lebih jauh lagi, sebagian besar non-opioid analgesik mempunyai efek antiinflamasi, jadi tepat digunakan untuk pengobatan inflamasi akut maupun kronis (Katzung, 2001).
F. Landasan Teori
Kurkumin dan GVT-0 merupakan senyawa yang memiliki aktivitas antiinflamasi dimana GVT-0 lebih stabil karena tidak memiliki gugus metilen aktif (Sardjiman, 2000). Mekanisme kedua senyawa sebagai anti inflamasi dengan menghambat produksi prostaglandin yang dapat diperantarai melalui penghambatan aktivitas enzim siklooksigenase (Sudjarwo, 2004). Kedua senyawa tersebut memiliki kelemahan yakni susah larut dalam air yang menyebabkan bioavailabilitas dalam tubuhnya rendah. Dengan formulasi pada kedua senyawa menghasilkan nanopartikel kurkumin dan nanopartikel GVT-0 akan meningkatkan bioavailabilitasnya di dalam tubuh (Sakuma dkk, 2011).
Formulasi nanopartikel kurkumin dan nanopartikel GVT-0 dapat dibuat menggunakan metode ionik gelasi yang mana kurkumin dan GVT-0 berlaku
sebagai ligan karena kedua senyawa tersebut memiliki gugus karbonil dan hidroksi yang dapat menyumbang muatan negatif kepada gugus amina bebas pada polimer kitosan yang bermuatan positif pada kondisi asam (pH 4-6). Kitosan sebagai matriks dalam pembentukan kompleks dapat secara spontan mengenkapsulasi ligan sehingga terbentuk suatu nanopartikel.Gugus yang tersisa pada polimer kitosan dalam satu kompleks partikel akan saling tolak menolak satu sama lain yang menyebabkan ketidakstabilan kompleks. Agen penstabil yang digunakan untuk menstabilkan suatu kompleks nanopartikel dengan kitosan sebagai matriks adalah tripolifosfat (TPP). Penambahan TPP akan mengaitkan polimer kitosan satu dengan yang lain sehingga akan mencegah kitosan yang sudah mengenkapsulasi kurkumin atau GVT-0 untuk terlepas. Hal ini akan meningkatkan kestabilan partikel yang telah terbentuk sebelumnya.
Partikel dalam ukuran nano dapat melewati membran dengan mudah karena partikel berukuran lebih kecil dan ukuran kapiler lebih besar. Mudah masuknya partikel dapat meningkatkan efisiensi obat. Nanopartikel dapat melakukan penetrasi secara fisik melalui celah antar sel maupun celah lain yang kecil yang tidak dapat ditembus oleh partikel dengan ukuran mikro atau makro (Bisht dkk., 2007). Selain itu, matriks pembentuk nanopartikel juga sangat berperan penting dalam penetrasinya, dimana matriks yang tepat akan dapat mendukung absorpsi partikel melalui beberapa kemungkinan mekanisme, diantaranya dengan berinteraksi dengan membran sel yang akan memperlama kontak obat dengan sel, atau dengan melindungi zat aktif dari metabolism sehingga memungkinkan pelepasan obat secara konstan dalam waktu yang lama
Ponchel dkk., 1997; Mohanraj dan Chen, 2006). Dengan kelebihan penggunaan nanopartikel tersebut akan meningkatkan daya antiinflamasi nanopartikel kurkumin dan nanopartikel 0 jika dibandingkan dengan kurkumin dan GVT-0 tidak termodifikasi. Dengan tingkat stabilitas yang lebih tinggi, maka efektivitas daya antiinflmasi nanopartikel GVT-0 akan lebih baik daripada nanopartikel kurkumin.
G. Hipotesis
Dari kajian pustaka yang telah dilakukan, dapat diajukan hipotesis sebagai berikut :
1. Modifikasi senyawa kurkumin dan GVT-0 menjadi bentuk nanopartikel dengan kitosan akan meningkatkan efektivitas daya antiinflamasi kedua senyawa
2. Nanopartikel GVT-0 memiliki efektivitas daya antiinflamasi yang lebih baik daripada nanopartikel kurkumin