FMIPA IPB, Dramaga, Bogor untuk penghitungan jumlah leukosit.
Isolasi Bakteri
Sampel feses dari larutan PBS masing-masing disebar sebanyak dua ulangan pada media cawan Salmonella-Shigella agar (Criterion). Sampel diinkubasi menggunakan inkubator (Gemmyco IN-010) selama 24 jam pada suhu 37 oC. Koloni yang memberikan penampakan kusam atau tidak berwarna diambil dan dilakukan pemurnian dengan metode cawan kuadran. Koloni yang telah murni selanjutnya disimpan pada media
Salmonella-Shigella agar (SSA) miring.
Penghitungan Leukosit
Darah dikeluarkan dari dalam hematokrit dan ditempatkan dalam tabung eppendorf. Darah diambil menggunakan pipet Thoma sampai batas 0.5. Setelah itu larutan pengencer dipipet sampai batas 11. Pipet dikocok membentuk gerakan angka delapan selama 12 kali untuk mencampurkan darah dengan larutan Turk. Darah diteteskan ke hemasitometer dan ditutup dengan kaca penutup. Leukosit dihitung pada empat kotak terbesar yang terletak di tiap sudut hemasitometer. Leukosit kemudian dihitung menggunakan rumus: V = plt V = (1)(1)(1/10) mm3 V untuk 4 kotak = (4)(1/10) mm3 = 0.4 mm3 Faktor pengenceran = 1/20
Σ leukosit ml-1 = (Σ leukosit hitungan) /
[(0.4 mm3 )(1/20)] (Simmon 1976)
Identifikasi Bakteri
Pewarnaan gram dilakukan pada koloni yang diduga Shigella. Satu lup akuades steril diambil dan disebar ke permukaan kaca objek. Setelah itu diambil satu lup bakteri yang berumur 18 jam dan disebar di kaca objek. Olesan bakteri dibiarkan kering udara dan setelah itu dilakukan fiksasi panas. Olesan bakteri kemudian diwarnai dengan perwarna ungu kristal selama 1 menit. Kelebihan zat warna dibilas dengan akuades, dilanjutkan dengan pemberian iodium gram selama 2 menit, lalu dibilas lagi dengan akuades dan dilakukan pemucatan dengan alkohol 95%. Setelah itu, olesan diwarnai dengan safranin selama 30 detik lalu dibilas dengan akuades. Setelah kering, olesan bakteri dilihat di bawah mikroskop dengan perbesaran 1000x, kemudian dilanjutkan dengan uji biokimia.
1. Uji Indol
Uji indole mengunakan media tripton 1% (Oxoid). Sebanyak satu lup koloni Shigella dimasukkan ke dalam kaldu tripton dan diinkubasi selama 24 jam pada suhu 37 oC. Hasil uji dapat diketahui dengan meneteskan reagen Kovac.
2. Uji MR-VP
Sebanyak satu lup koloni Shigella
dimasukkan ke dalam kaldu MR-VP (Difco) dan diinkubasi (Gemmyco IN-010) selama 24 jam untuk uji MR dan 5 hari untuk uji VP pada suhu 37 oC. Uji MR diuji dengan meneteskan 10 tetes indikator merah metil ke dalam kaldu MR/VP. Uji VP dilakukan dengan meneteskan 10 tetes α-naphtol 5% dan 10 tetes larutan KOH 40%, dikocok dan dilihat perubahan warna yang terjadi.
3. Uji urease
Sebanyak satu lup koloni Shigella
dimasukkan ke dalam kaldu urease (Difco) dan diinkubasi selama 5 hari dengan pengamatan setiap hari pada suhu 37 oC. 4. Uji Simmon sitrat
Sebanyak satu lup koloni Shigella
digoreskan dan ditusukkan pada media Simmon sitrat. Inkubasi dilakukan selama 24 jam pada suhu 37 oC.
5. Uji fermentasi karbohidrat dan H2S pada Triple Sugar Iron Agar (TSIA)
Sebanyak satu lup koloni Shigella
digoreskan dan ditusukkan pada media TSIA (Difco). Inkubasi dilakukan selama 24 jam pada suhu 37 oC.
6. Uji fermentasi glukosa
Sebanyak satu lup koloni Shigella
dimasukkan ke dalam larutan glukosa 0.2% steril yang telah diberi Bromthymol Blue (BTB) sebagai indikator pH. Inkubasi selama 1-10 hari (Hall et al 1972) pada suhu 37 oC.
HASIL
Seratus sampel feses diperoleh dari anak-anak penderita diare di ruang Laboratorium Puskesmas Sindang Barang. Penderita diare berasal dari lima kelurahan, yaitu Sindang Barang, Bubulak, Situ Gede, Marga Jaya, dan Balumbang Jaya. Hasil isolasi feses pada media SSA didapatkan 13 isolat dengan penampakan koloni bening yang diduga sebagai koloni Shigella (Gambar 1).
sebagai Shigella pada media SSA. Koloni-koloni yang dicurigai sebagai
Shigella diwarnai dengan pewarnaan gram
dan menunjukkan ciri bakteri gram negatif (Gambar 2). Hasil uji biokimia dapat dilihat pada Tabel 1. Hasil positif uji MR (Metil Red) (Gambar 3) dan VP (Voges-Proskauer) (Gambar 4) ditandai dengan perubahan warna media menjadi merah. Hasil uji H2S negatif
ditandai dengan tidak adanya perubahan warna menjadi hitam pada media TSIA (Gambar 5). Uji sitrat positif ditandai dengan berubahnya warna media menjadi biru (Gambar 6). Uji indole positif ditandai dengan adanya cincin merah setelah diberi reagen kovac (Gambar 7). Uji glukosa positif ditandai dengan berubahnya warna media menjadi kuning, adanya gas dapat dilihat di dalam tabung durham (Gambar 8). Uji Urea positif ditandai dengan berubahnya warna media menjadi merah keunguan (Gambar 9).
Gambar 3 Uji MR Shigella a) Hasil negatif b) Hasil positif.
Gambar 4 Uji VP Shigella a) Hasil negatif b) Hasil positif.
No No Isolat
Uji Biokimia
MR VP Indole H2S TSIA Sitrat Urea
Fermentasi Glukosa 1 25 - - - - S/B M + - + 2 26 - - - - S/B M + - + 3 42 - - - - S/B M + - + 4 50 - - - - S/B M + - + 5 51 + - + - S: K B : M + - + 6 67* - - - - S/B M + + - 7 68* + - + - S: K B : M + + + 8 69* - - - - S/B M + + + 9 70 - - - - S/B M + - + 10 87 + + + - S/B K + - +g 11 89 + + + - S/B K + - +g 12 97* - - - - S/B M - + + 13 98 - - - - S/B M + - +
Tabel 1 Hasil uji biokimia isolat bening pada media SSA
Keterangan: * : Bukan Shigella - : reaksi negatif +: reaksi positif +g : reaksi positif dengan gas M : Merah K : Kuning S : Slant (bagian miring agar) B : Butt (bagian dasar agar) MR : Metil Red VP : Voges-Proskauer TSIA: Triple Sugar Iron Agar
Gambar 5 Uji H2S Shigella pada agar TSIA
dengan uji H2S negatif a) dapat
memfermentasi glukosa, laktosa dan/atau sukrosa b) tidak ada reaksi fermentasi c) dapat memfermentasi glukosa.
Gambar 6 Uji sitrat Shigella pada media simmon sitrat a) Hasil positif
b) Hasil negatif.
Gambar 7 Uji indole Shigella pada media tripton 1% a) Hasil negatif b) Hasil positif.
Gambar 8 Uji fermentasi glukosa Shigella a) Hasil positif b) Hasil negatif c) Hasil positif dengan gas.
Gambar 9 Uji urease Shigella pada media urea a) Hasil negatif b) Hasil positif.
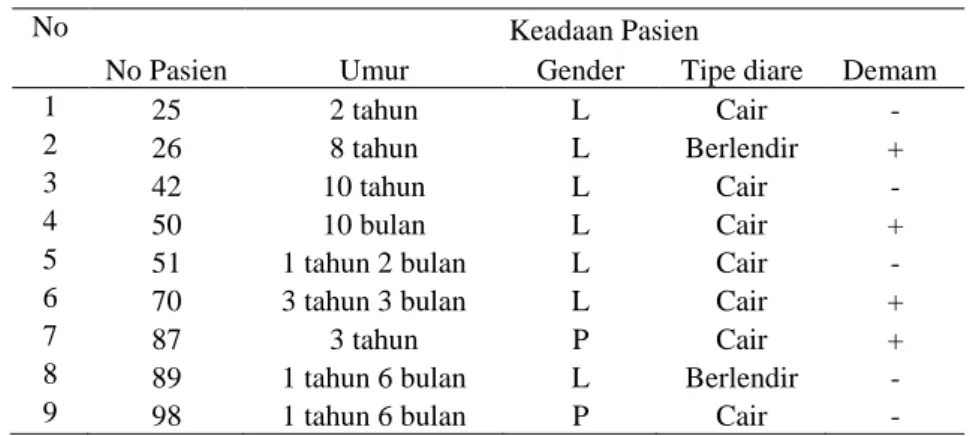
Hasil perhitungan jumlah leukosit bervariasi dari leukopenia hingga normal. Keadaan pasien dapat dilihat pada Tabel 2 dan hasil penghitungan leukosit dapat dilihat pada Tabel 3.
No
No Pasien
Keadaan Pasien
Umur Gender Tipe diare Demam
1 25 2 tahun L Cair -
2 26 8 tahun L Berlendir +
3 42 10 tahun L Cair -
4 50 10 bulan L Cair +
5 51 1 tahun 2 bulan L Cair -
6 70 3 tahun 3 bulan L Cair +
7 87 3 tahun P Cair +
8 89 1 tahun 6 bulan L Berlendir -
9 98 1 tahun 6 bulan P Cair -
Tabel 2 Keadaan pasien yang pada fesesnya terdapat Shigella
PEMBAHASAN
Koloni yang bersifat laktosa negatif akan memberikan penampakan koloni tidak berwarna pada media SSA. Koloni yang dapat memfermentasi laktosa akan memberikan penampakan koloni berwarna merah, hal itu disebabkan oleh fermentasi laktosa yang menghasilkan asam dan dengan adanya indikator neutral red akan memberikan warna merah pada koloni (Cherry 1961).
Uji MR dan uji VP menggunakan media yang sama yaitu kaldu glukosa. Fermentasi asam campuran dilihat dengan uji MR. Fermentasi asam campuran menyebabkan pH media menjadi asam. Merah metil merupakan indikator yang akan berwarna merah pada keadaan asam. Hasil positif uji MR diperlihatkan dengan berubahnya warna media menjadi merah ketika ditetesi indikator merah metil (Winn et al. 2005). Shigella memiliki hasil MR positif, namun dari uji biokimia hanya ditemukan dua dari isolat yang memiliki hasil uji MR positif. Walupun begitu, Dodd dan Jones (1982) melaporkan bahwa terdapat spesies dari Shigella yang menunjukkan hasil uji MR negatif, yaitu S.
flexneri.
Uji VP merupakan uji untuk mendeteksi
pembentukan 2,3 butanadiol secara tidak langsung. Senyawa acetoin (acetil methylcarbinol) merupakan senyawa prekursor bagi
2,3 butanadiol. Penambahan KOH menyebabkan berubahnya acetoin menjadi diasetil. Diasetil akan membentuk suatu kompleks berwarna merah ketika ditambahkan α-naphtol. Warna merah ini menunjukkan hasil positif. Bakteri yang membentuk 2,3 butanadiol menghasilkan sedikit asam campuran yang jumlahnya tidak cukup untuk mengubah pH media menjadi asam (Winn et al. 2005).
(Winn et al. 2005). Reed (1942) melaporkan beberapa bakteri genus Clostridium dapat membentuk indol dan dengan cepat memecah kembali indol yang dihasilkan sehingga didapat hasil negatif semu.
Agar miring TSI memberikan empat macam pola reaksi. Pola reaksi pertama berupa warna merah pada slant (bagian miring agar) dan butt (bagian dasar agar) yang menunjukkan tidak ada reaksi fermentasi glukosa. Pola reaksi kedua berupa warna merah pada slant dan warna kuning pada butt yang menunjukkan terjadinya fermentasi glukosa. Pola reaksi ketiga slant dan butt berwarna kuning yang menunjukkan fermentasi glukosa, laktosa, dan/atau sukrosa. Pola reaksi keempat adanya warna hitam yang menandakan terjadinya pembentukan gas H2S
(Madigan et al. 2009). Isolat 87 dan 89 menghasilkan warna kuning pada seluruh bagian agar hal ini menandakan dapat difermentasikannya glukosa, laktosa, dan/atau sukrosa. Shigella dysenteriae 1 dan S. sonnei dapat memfermentasi laktosa secara lambat (Ito et al. 1991). Uji H2S dilakukan untuk
mengetahui dihasilkannya gas H2S oleh
bakteri. Produksi gas ini ditandai dengan berubahnya warna media menjadi hitam. Gas H2S yang bereaksi dengan FeSO4 akan
membentuk FeS yang berwarna hitam (Winn
et al 2005).
Hasil positif uji fermentasi glukosa ditandai dengan adanya perubahan warna media menggunakan indikator bromthymol
blue (BTB) dari biru ke jingga. Hal ini terjadi
karena bakteri menurunkan pH media sebagai akibat dari terjadinya fermentasi glukosa (Gubash et al. 1988). Shigella pada umumnya memfermentasi glukosa tanpa menghasilkan gas namun S. flexneri 6, S. boydii 13 dan 14 dan S. dysenteriae 3 menghasilkan gas (Germani & Sansonetti 2006).
Media Simmon sitrat digunakan untuk menguji kemampuan bakteri memanfaatkan sodium sitrat sebagai sumber karbon dan ammonium fosfat sebagai sumber nitrogen. Media ini menggunakan BTB sebagai indikator pH. Perubahan warna media menjadi biru menunjukkan perubahan pH media menjadi basa dan uji sitrat positif. Karbon dan
4 50 2 950 5 51 7 500 6 70 1 494 7 87 1 850 8 89 3 400 9 98 4 350
nitrogen yang berasal dari dinding sel bakteri dalam jumlah yang cukup dapat memberikan hasil positif palsu. Hal ini dapat terjadi pada penggoresan inokulum yang terlalu banyak (Winn et al. 2005). Asagi et al. (1980) melaporkan sifat sitrat positif dapat ditranferkan kepada Shigella yaitu S. sonnei dan S. flexneri yang tadinya memiliki sifat sitrat negatif.
Uji urease menggunakan media kaldu urea dengan indikator merah fenol yang akan berwarna keunguan pada kondisi basa. Bakteri yang memiliki enzim urease dapat menghidrolisis urea menjadi ammonia dan menyebabkan suasana basa (Goh et al. 1994). Buffer fosfat terkandung di dalam kaldu urea yang mempertahankan pH 6.8 sehingga dibutuhkan ammonia dalam jumlah besar untuk menaikkan pH media. Shigella
memiliki hasil uji urease negatif (Dodd & Jones 1982) sehingga dapat dikatakan bahwa isolat 67, 68, 69, dan 97 bukan Shigella. Pernah dilakukan identifikasi menggunakan kit (Microbact) pada isolat 68. Hasil yang diperoleh setelah data dianalisis dengan program Microbact adalah Providencia rettgeri.
Dua tipe diare yang diamati dari pasien yaitu cair dan berlendir. Manifestasi tipe diare oleh Shigella bervariasi mulai dari diare yang bersifat cair hingga diare yang mengandung darah (Katz 2004). Frekuensi kejadian diare, dalam pengamatan ini lebih tinggi pada laki-laki daripada perempuan. Wilunda dan Panza (2009) pernah melaporkan hal yang sama. Dari tiga belas pasien, lima diantaranya mengalami demam. Shigella diketahui memiliki kemampuan untuk masuk ke dalam sel dan menyebar antar sel membuat sel mengeluarkan interleukin-8 yang memicu terjadinya inflamasi. Reaksi inflamasi ini juga disebabkan oleh polymorphonuclear leukocyte (PMN) yang mengganggu hubungan antar sel sehingga Shigella dapat masuk ke bagian basolateral sel yang memudahkan kolonisasi.
Shigella pada akhirnya dibunuh oleh PMN
(Cersini et al. 2003; Mandic-Mulec et al. 1997). Kotloff et al. (2000) melakukan penelitian menggunakan mutasi S. flexneri yang diinokulasikan pada probandus, beberapa probandus tidak mengalami demam. Pasien dalam penelitian ini yang tidak demam kemungkinan terinfeksi oleh Shigella yang telah bermutasi.
Perhitungan leukosit memperlihatkan hasil yang bervariasi dari leukopenia hingga normal, nilai kisaran normal leukosit adalah 5000-10000 leukosit ml-1 (Simmons 1976).
Fried et al. (1981) juga pernah melaporkan hal yang sama. Malnutrisi dapat menjadi penyebab turunnya jumlah leukosit. Nassar et
al. (2009) melaporkan bahwa pada anak yang
menderita kekurangan protein dan energi menyebabkan terganggunya fungsi imun tubuh sehingga tubuh tidak dapat menghadapi infeksi.
SIMPULAN DAN SARAN
Simpulan
Persentase Shigella yang didapatkan dari 100 anak penderita diare sebesar 9%. Sembilan isolat Shigella dapat memfermentasi glukosa dan dua di antaranya menghasilkan gas CO2, tidak ada yang dapat menghidrolisis
urea, dapat menggunakan Natrium sitrat sebagai sumber karbon, tidak menghasilkan H2S, tiga dapat menghasilkan indol, dua dapat
menghasilkan asetoin, dan tiga menghasilkan asam campuran. Jumlah leukosit yang didapat bervariasi dari leukopenia hingga normal. Saran
Perlu dilakukan pengujian serotipe agar diketahui spesies dari isolat Shigella yang telah diisolasi dari anak-anak penderita diare.
DAFTAR PUSTAKA
Adkins HJ, Santiago LT. 1987. Increase of enteric pathogens by use of both stool and rectal swab specimens. Am Soc Microbiol 25 (1): 158-159.
Al-Gallas, Bahri O, Bouratbeen A, Assian Ben Haasen, Ridha Ben Aissa. 2007. Etiology of acute diarrhea in children and adults in Tunis, Tunisia, with emphasis on diarrheagenic Escherichia coli:
prevalence, phenotyping, and molecular epidemologi. Am J Trop Med Hyg 77: 571-582.
Asagi M, Ishiguro N, Oka C, Sato G, Terakado N. 1980. Characterization of utilizing (Cit) ability of citrate-positive Escherichia coli variants: stability and transferability of citrate utilization among Escherichia coli, Shigella, and Salmonella strains. Jpn J Vet Sci 42:407-415.
Bergey DH, Holt JG. 1994. Bergey’s Manual
Of Determinative Bacteriology. USA:
Lippincott Williams & Wilkins.
Cersini A Martino MC, Martini I, Rossi G, Bernardini ML. 2003. Analysis of virulence and inflammatory potential of
Shigella flexineri purine biosynthesis