BAB 2
TINJAUAN PUSTAKA
2.1 Karat dan Akibatnya
Oleh sebagian orang, korosi diartikan sebagai karat, yakni sesuatu yang hampir dianggap musuh umum masyarakat. Karat (rust), tentu saja, adalah sebutan yang belakangan ini hanya dikhususkan bagi korosi pada besi, sedangkan korosi adalah gejala destruktif yang mempengaruhi hampir semua logam. Korosi terbukti membebani peradaban dalam tiga cara disertai fakta sebagai berikut:
a. Dari segi biaya korosi itu sangat mahal
Kasus nyata: Dalam tahun 1980 di Amerika Serikat, Institut Battelle menaksir bahwa setiap tahun perekonomian Amerika rugi 70 milyar dolar akibat korosi.
b. Korosi sangat memboroskan sumber daya alam
Kasus nyata: telah dihitung bahwa di Inggris, 1 ton baja diubah seluruhnya menjadi karat setiap 90 detik. Disamping tersia-sianya logam itu, energi yang dibutuhkan untuk memproduksi 1 ton baja dari bijih besi cukup
untuk memasok kebutuhan energi satu keluarga selama tiga bulan.
c. Korosi sangat tidak nyaman bagi manusia, dan kadang-kadang bahkan
mendatangkan maut
2.2 Teori Korosi
2.2.1 Energi Dan Hukum Yang Mendasarinya
Korosi adalah gejala yang timbul secara alami: pengaruhnya dialami oleh hampir
semua zat dan diatur oleh perubahan-perubahan energi. Pengkajian tentang perubahan energi disebut termodinamika, suatu bidang yang kaya sekali dengan definisi, besaran-besaran variabel (juga disebut parameter) dan persamaan-persamaan. Sistem didefinisikan sebagai suatu massa tertentu zat yang kita minati. Di sekeliling sistem itu kita membayangkan suatu dinding pembatas khayal yang memisahkannya dari lingkungan sekitar.
Hukum: Energi tidak dapat diciptakan ataupun dimusnahkan.
Kaidah: Semua perubahan spontan terjadi disertai pelepasan energi bebas dari sistem ke lingkungan sekitar pada temperatur dan tekanan spontan.
Pernyataan pertama adalah Hukum Pertama Termodinamika yang penting sekali dalam pengkajian perubahan-perubahan yang terjadi ketika logam mengalami korosi. Pernyataan kedua adalah salah satu bentuk Hukum Kedua Termodinamika. Ketika korosi berlangsung secara alami proses yang terjadi bersifat spontan sehingga karena itu disertai pelepasan energi bebas. Hukum termodinamika mengungkapkan kepada kita tentang kuatnya kecenderungan keadaan energi tinggi untuk berubah ke keadaan energi rendah. Kecenderungan
inilah yang membuat logam-logam bergabung kembali dengan unsur-unsur yang ada di lingkungan, yang akhirnya membentuk gejala yang disebut korosi. Karena
Sebuah konsep penting yang membantu menjelaskan laju reaksi korosi adalah Teori Keadaan Peralihan (Transition State Theory). Perhatikan persamaan
berikut:
A + B C + D (2.1)
Dimana dua zat A dan B, yang dikenal sebagai reaktan, saling berinteraksi sedemikian rupa untuk membentuk dua zat baru, C dan D, yang disebut hasil reaksi. Agar dapat menghasilkan zat – zat baru, A dan B bukan hanya harus saling sentuh melainkan juga harus berpadu secara fisik guna membentuk suatu zat antara AB. AB disebut keadaan peralihan, dan reorganisasi keadaan peralihan inilah yang kemudian langsung menghasilkan C + D.
Dalam bentuk paling sederhana, laju reaksi korosi dapat diekspresikan demikian:
Laju = tetapan laju x[reaktan – reaktan] (2.2)
Besaran dalam kurung persegi menunjukkan ukuran banyaknya zat. Tetapan laju dapat dinyatakan dalam hubungan dengan ukuran penghalang energi bebas(∆𝐺𝐺+):
Tetapan laju = C eksp (-ΔG+/RT) (2.3)
Dengan C dan R adalah tetapan-tetapan, dan T adalah temperatur mutlak. Persamaan tersebut merupakan bentuk modifikasi dari sebuah persamaan penting yang disebut Persamaan Arhenius (Trethewey, 1991).
2.2.2 Pengertian Korosi
dari logam seperti peralatan pabrik, peralatan kimia, pembuatan jembatan dan sebagainya. Peristiwa korosi tidak akan terjadi dengan sendirinya melainkan ada
factor-faktor tertentu yang menyebabkan timbulnya peristiwa korosi. Faktor tersebut dapat menimbulkan terjadinya peristiwa korosi apabila
komponen-komponen tersebut terjadi hubungan satu sama lain yang menimbulkan terjadinya aliran elektron. Korosi juga dapat mengakibatkan suatu material mengalami suatu reaksi oksidasi yang jika dibiarkan terus menerus akan menyebabkan material terdegradasi. Degradasi tersebut menyebabkan logam menipis, berlubang, terjadi perambatan reaktan, sifat mekanik berubah sehingga terjadi kegagalan tiba – tiba pada struktur, sifat fisik dan penampilan logam berubah (Fachri, 2011).
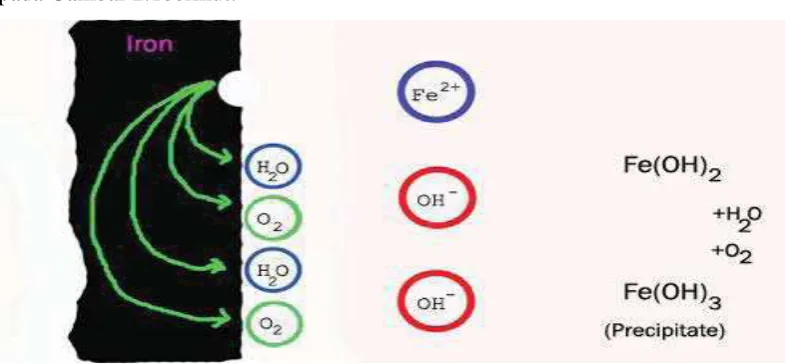
Korosi diartikan sebagai penurunan mutu logam akibat reaksi elektriokimia dengan lingkungannya. Korosi dapat digambarkan sebagai sel galvani yang mempunyai “hubungan pendek” dimana beberapa daerah permukaan logam bertindak sebagai katoda dan lainnya sebagai anoda, dan “rangkaian listrik” dilengkapi oleh rangkaian electron menuju besi itu sendiri seperti di ilustrasikan pada Gambar 2.1berikut:
Gambar 2.1. Pembentukan Karat (Haryono, 2010)
Kinetika korosi dapat memprediksi bagaimana suatu korosi berjalan dalam waktu dan jarak. Berbeda dari termodinamika, kinetika korosi digunakan untuk mengetahui laju atau kecepatan korosi itu terjadi. Laju korosi ditentukan dengan menggunakan arus untuk menghasilkan suatu kurva polarisasi (tingkat perubahan
yang laju korosinya sedang ditentukan. Ketika potensial pada permukaan logam terpolarisasi menggunakan arus pada arah positif, bisa dikatakan sebagai
terpolarisasi secara anodik. Bila menggunakan arus pada arah negatif disebut terpolarisasi secara katodik. Tingkat polarisasi adalah ukuran bagaimana laju dari
reaksi pada anoda dan katoda dihambat oleh bermacam lingkungan (konsentrasi dari ion logam, oksigen terlarut) dan/atau faktor proses permukaan (adsorbsi, pembentukan lapisan, kemudahan dalam melepaskan elektron). Variasi dari potensial sebagai fungsi dari arus (kurva polarisasi memungkinkan untuk mengetahui pengaruh dari proses konsentrasi dan aktivasi pada tingkat dimana reaksi anoda maupun katoda dapat memberi ataupun menerima elektron. Karenanya, pengukuran polarisasi dapat menentukan laju reaksi yang terlibat dalam proses korosi (Trethewey, 1991). Proses korosi berkembang dengan cepat setelah mengalami gangguan dari luar dan bersamaan dengan beberapa reaksi yang merubah komposisi dan sifat dari permukaan logam dan lingkungan sekitarnya, contohnya pembentukan oksida logam, difusi dari kation logam terhadap matriks, berubahnya pH, dan berubahnya potensial elektrokimia (Rani, 2012).
2.3 Jenis Korosi
Untuk mengetahui lebih lanjut mengenai korosi, dibawah ini dijelaskan mengenai beberapa jenis korosi, yaitu:
1. Korosi Merata (uniform corrosion), yaitu korosi yang terjadi pada seluruh permukaan logam atau paduan yang bersentuhan dengan elektrolit pada
intensitas sama sebagaimana ditunjukkan pada Gambar 2.2 berikut:
2. Korosi Galvanik (galvanic corrosion), yaitu korosi terjadi bila dua logam yang berbeda berada dalam satu elektrolit, dalam keadaan ini logam yang
kurang mulia (anodic) akan terkorosi, bahkan lebih hebat bila paduan tersebut tidak bersenyawa dengan logam lain.
3. Korosi Celah (crevice corrosion), yaitu korosi lokal yang biasanya terjadi pada sela – sela sambungan logam yang sejenis atau pada retakan di permukaan logam seperti Gambar 2.3. Hal ini disebabkan perbedaan konsentrasi ion logam atau konsentrasi oksigen antara celah dan lingkungannya.
Gambar 2.3. Korosi Celah (Kopeliovich, 2012)
4. Korosi Sumuran (pitting corrosion). Korosi ini terjadi akibat adanya sistem anoda pada logam, dimana daerah tersebut terdapat konsentrasi ion Cl- yang tinggi. Korosi jenis ini sangat berbahaya karena pada bagian permukaan hanya lubang kecil, sedangkan pada bagian dalamnya terjadi proses korosi membentuk “sumur” yang tidak tampak.
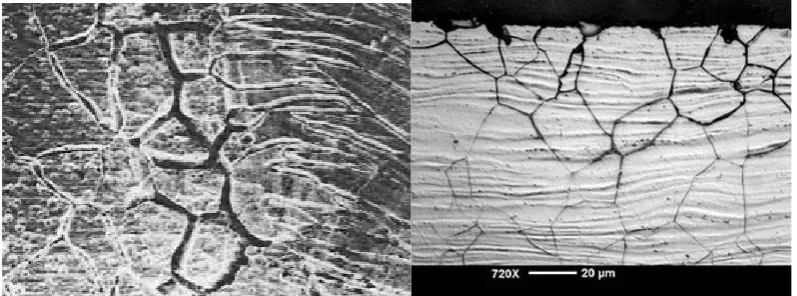
5. Korosi batas butir (intergranular corrosion), yaitu korosi yang terjadi pada batas butir, dimana batas butir sering kali merupakan tempat mengumpulnya impurity atau suatu presipitat dan lebih tegang seperti yang
terlihat pada Gambar 2.4. Jika suatu logam terkorosi secara merata akan terlihat jelas lebih reaktif dibandingkan pada butir material tersebut. Pada
Gambar 2.4. Korosi Batas Butir (Green, 1997)
6. Selective leaching corrosion yaitu larutnya salah satu komponen dari suatu paduan, dan ini mengakibatkan paduan yang tersisa akan menjadi berpori sehingga ketahanan korosinya akan berkurang, seperti di ilustrasikan pada Gambar 2.5 berikut:
Gambar 2.5. Selective Leaching Corrosion (Green, 1997)
7. Korosi Erosi, yaitu korosi yang terjadi akibat pergerakan relatif antara fluida korosif dengan permuakaan logam. Pada umumnya, pergerakan yang terjadi cukup cepat, sehingga terjadi efek keausan mekanis atau abrasi. Pergerakan yang cepat dari fluida korosif mengkorosi secara fisik dan menghilangkan lapisan pasif. Pasir dan padatan lumpur mempercepat
korosi erosi.
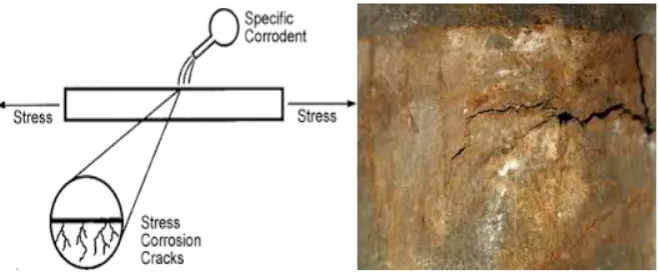
8. Korosi Tegangan (stress corrosion), yaitu korosi yang terjadi sebagai akibat
Gambar 2.6. Korosi Tegangan (Kopeliovich, 2012)
2.4 Prinsip Dasar Pengendalian Korosi
Korosi telah didefinisikan sebagai penurunan mutu logam oleh reaksi elektrokimia dengan lingkungannya. Pada kebanyakan situasi praktis serangan ini tidak dapat dicegah, kita hanya dapat berupaya mengendalikannya sehingga struktur atau komponen mempunyai masa pakai yang lebih panjang. Adapun pengendalian korosi bisa dilakukan dengan berbagai cara, diantaranya yang paling penting
adalah:
a. Modifikasi rancangan
b. Modifikasi lingkungan c. Pemberian lapisan pelindung d. Pemilihan bahan
e. Proteksi katodik dan anodik
2.4.1 Pengendalian Korosi melalui Perancangan
2.4.2 Pengendalian Korosi Melalui Pengubahan Lingkungan
Menurut Haryono, (2010), terdapat beberapa faktor lingkungan yang dapat mempengaruhi proses korosi antara lain, yaitu:
1. Suhu
Kenaikan suhu akan menyebabkan bertambahnya kecepatan reaksi korosi. Hal ini terjadi karena semakin tingginya energi kinetik dari partikel-partikel yang bereaksi sehingga melampaui besarnya harga energi aktivasi dan akibatnya laju korosi juga akan semakin cepat, begitu juga sebaliknya. 2. Kecepatan alir fluida atau kecepatan pengadukan
Laju korosi cenderung bertambah jika laju atau kecepatan aliran fluida bertambah besar. Hal ini karena kontak antara zat perekasi dan logam akan makin banyak yang lepas sehingga logam akan mengalami kerapuhan (korosi).
3. Konsentrasi bahan korosif
Hal ini berhubungan dengan pH atau keasaman dan kebasaan suatu larutan. Larutan yang bersifat asam sangat korosif terhadap logam dimana logam yang berada di dalam media larutan asam akan lebih cepat terkorosi karena merupakan reaksi anoda. Sedangkan larutan yang bersifat basa dapat menyebabkan korosi pada katodanya karena reaksi katoda selalu serentak dengan reaksi anoda.
4. Oksigen
Adanya oksigen yang terdapat di dalam udara dapat bersentuhan dengan permukaan logam yang lembab. Sehingga kemungkinan menjadi korosi
5. Waktu kontak
Aksi inhibitor diharapkan dapat membuat ketahanan logam terhadap korosi
lebih besar. Dengan adanya penambahan inhibitor ke dalam larutan, maka akan menyebabkan laju reaksi menjadi lebih rendah, sehingga waktu kerja
inhibitor untuk melindungi logam dari korosi akan hilang atau habis pada waktu tertentu. Hal itu dikarenakan semakin lama waktunya maka inhibitor akan semakin habis terserang oleh larutan.
Baik proses korosi di udara maupun proses korosi basah dapat dikendalikan menggunakan bahan kimia khusus yang disebut inhibitor. Apabila bahan ini ditambahkan ke dalam lingkungan, laju serangan korosi akan berkurang (Trethewey, 1991). Korosi dapat dikurangi dengan berbagai macam cara, dan cara yang paling mudah dan paling murah adalah dengan menambahkan inhibitor ke dalam media. Inhibitor berasal dari kata inhibisi: menghambat, jadi inhibitor ditambahkan untuk menghambat reaksi antarmuka antara material dengan lingkungan. Inhibitor terdiri dari dua jenis yaitu inhibitor organik dan anorganik. Inhibitor dapat dianggap sebagai katalisator yang memperlambat (retarding catalyst) (Haryono, 2010).
Rina, (2012) menyebutkan bahwa inhibitor akan mereduksi kecepatan korosi dengan cara:
1. Adsorpsi ion/molekul inhibitor ke permukaan logam
2. Meningkatkan atau menurunkan reaksi anoda dan atau katoda 3. Menurunkan kecepatan difusi reaktan ke permukaan logam
4. Menurunkan hambatan listrik dari permukaan logam
5. Inhibitor mudah membentuk lapisan in situ pada permukaan logam
nitrogen sangat baik untuk mereduksi serangan korosi pada baja. Beberapa faktor yang mempengaruhi kerja inhibitor adalah panjang rantai, berat molekul, ikatan
(aromatis atau konjugasi), kemungkinan ikat silang, serta kelarutannya dalam lingkungan yang digunakan. Inhibitor bahan alam (green inhibitor) bersifat
biodegradable (mudah terurai) dan tidak mengandung logam berat atau senyawa racun lainnya. Beberapa penelitian telah melaporkan keberhasilan penggunaan senyawa bahan alam untuk menghambat korosi dari logam dalam lingkungan asam dan basa. Green inhibitor yang cocok untuk baja karbon adalah inhibitor yang mengandung asam amino alami seperti alanin, glisin dan leusin (Rina, 2012).
Inhibitor organik bekerja dengan membentuk senyawa kompleks yang mengendap pada permukaan logam sebagai lapisan pelindung yang bersifat hidrofobik yang dapat menghambat reaksi logam dengan lingkungannya. Reaksi yang terjadi dapat berupa reaksi katodik, anodik, atau keduanya. Hal ini bergantung dari reaksi pada permukaan logam dan potensial logam tersebut. Selain itu juga dapat berfungsi untuk menetralisir konstituen korosif dan mengabsorbsi konstituen korosif tersebut. Penggunaan dengan konsentrasi yang tepat dapat mengoptimalkan perlindungan pada seluruh logam. Inhibitor organik akan teradsorbsi pada permukaan tergantung dari muatan inhibitor dan muatan logam untuk membentuk ikatan dari senyawa kompleks tersebut sebagi contoh kation inhibitor seperti amin atau anion inhibitor seperti sulfonat akan teradsorbsi tergantung muatan logam tersebut apakah negatif atau positif. Efektifitas dari
inhibitor organik dipengaruhi oleh komposisi kimia, struktur molekul, dan gugus fungsi, ukuran dan berat molekul, serta afinitas inhibitor terhadap logamnya.
NaCl Na+ + Cl- (2.4)
MgCl2 Mg2+ + 2Cl- (2.5)
KCl K+ + Cl- (2.6)
Ion klorida pada reaksi diatas akan menyerang logam besi (Fe) sehingga besi akan terkorosi menjadi:
2Cl- + Fe2+ FeCl2 (2.7)
Dan reaksi antara Fe2+ dengan inhibitor ekstrak bahan alam menghasilkan senyawa kompleks. Inhibitor ekstrak bahan alam yang mengandung nitrogen mendonorkan sepasang elektronnya pada permukaan logam mild steel ketika ion Fe2+ terdifusi ke dalam larutan elektrolit, reaksinya adalah:
Fe Fe2+ + 2e- (melepaskan elektron) (2.8) Fe2+ + 2e- Fe (menerima elektron) (2.9)
Mekanisme inhibisi ekstrak bahan alam ditunjukkan pada Gambar 2.7 berikut:
Gambar 2.7. Mekanisme Inhibisi Ekstrak Bahan Alam (Ilim, 2008)
Produk yang terbentuk diatas mempunyai kestabilan yang tinggi dibanding dengan Fe saja, sehingga sampel besi/baja yang diberikan inhibitor ekstrak bahan alam akan lebih tahan (terproteksi) terhadap korosi (Haryono, 2010).
Inhibitor akan membentuk lapisan pelindung in situ karena reaksi antara
korosi lebih lanjut. Adsorpsi inhibitor ke permukaan logam disebabkan oleh gaya tarik elektrostatik antara muatan ion dengan muatan listrik antarmuka logam.
Secara keseluruhan, senyawa inhibitor adalah netral. Tetapi, gugus nitrogen pada senyawa tersebut memiliki pasangan elektron bebas yang menyebabkan inhibitor
cenderung bermuatan negatif sehingga inhibitor akan tertarik ke permukaan logam dan membentuk lapisan (Purwanto, 2013).
2.4.3 Pengendalian Korosi dengan Lapisan Pelindung
Salah satu cara pengendalian korosi dengan cara memberi lapisan perlindungan (coating protection). Pelapisan biasanya dimaksudkan untuk memberikan suatu lapisan padat dan merata sebagai bahan isolator atau penghambat aliran listrik diseluruh permukaan logam yang dilindungi, fungsi dari lapisan tersebut adalah untuk mencegah logam dari kontak langsung dengan elektrolit dan lingkungan sehingga reaksi logam dan lingkungan terhambat (Fachri, 2011).
Lapisan penghalang yang dikenakan ke permukaan logam dimaksudkan baik untuk memisahkan lingkungan dari logam, maupun untuk mengendalikan lingkungan mikro pada permukaan logam. Banyak cara pelapisan yang digunakan untuk maksud ini termasuk cat, selaput organik, vernis, lapisan logam, dan enamel. Sejauh ini yang paling umum adalah cat (Trethewey, 1991).
2.4.4 Pengendalian Korosi dengan Pemilihan Bahan
Sifat menghambat korosi yang sudah ada dengan sendirinya pada suatu
bahan, umumnya hampir tidak berperan dalam proses pemilihan. Seorang perekayasa akan mencari lapisan penghalang atau cara lain unttuk menghambat
rusak atau hilangnya logam. Paduan-paduan canggih yang memiliki sifat tahan korosi hanya akan digunakan dalam situasi-situasi khusus yang selalu dihantui bencana, misalnya industri minyak serta kimia, atau bila keandalan merupakan faktor pertimbangan yang luar biasa penting (Trethewey, 1991).
2.4.5 Proteksi Katodik dan Anodik
Proteksi katodik adalah suatu perlindungan permukaan logam dengan cara melakukan arus searah yang memadai ke permukaan logam dan mengkonversikan semua daerah anoda di permukaan logam menjadi daerah katodik. Sistem ini hanya efektif untuk system-sistem yang terbenam dalam air atau di dalam tanah. Sedangkan pada perlindungan secara anodik, tegangan sistem yang dilindungi dinaikkan sehingga memasuki daerah anodiknya. Pada kondisi ini sistem terlindungi karena terbentuknya lapisan pasif. Syarat yang harus dipenuhi agar sistem ini berjalan dengan baik adalah bahwa karakteristik lingkungannya harus stabil. Pada jenis lingkungan yang tidak stabil (berfluktuasi) penerapan sistem proteksi anodik tidak dianjurkan (Fachri, 2011).
2.5 Baja Karbon
Baja dapat didefinisikan sebagai suatu campuran besi dan karbon, dimana unsur karbon menjadi dasar campurannya. Disamping itu, mengandung unsur campuran lainnya seperti sulfur (S), fosfor (P), silikon (Si), dan mangan (Mn) yang jumlahnya dibatasi (Azmi, 2013).
melebihi 60 persen. Begitu lapisan butir – butir air terbentuk pada permukaannya, laju korosi ditentukan oleh berbagai faktor lingkungan; tetapi yang paling penting
adalah pasokan oksigen, pH, dan hadirnya ion-ion agresif, terutama oksida-oksida belerang dan klorida.
Baja paduan rendah mengandung berbagai unsur pembentuk paduan, misalnya Cr, Ni, Cu, Mn, V, dan Mo, hingga 2 atau 3 persen. Penambahan unsur pemadu ini memperbaiki sifat – sifat mekanik; tetapi efeknya kecil terhadap laju korosi komponen-komponen yang terendam atau terkubur, karena disitu baja lunak, baja paduan rendah, atau baja tempa akan terkorosi dengan laju yang kurang lebih sama. Penambahan krom yang sedikit lebih banyak, diketahui mendatangkan perbaikan yang cukup mencolok dalam perilaku korosi; sedangkan tembaga dalam jumlah kecil, diketahui mengurangi korosi sumuran pada ketel-ketel baja, walaupun korosi biasa agak meningkat (Trethewey, 1991).
2.6 Natrium Klorida
Menurut Kurlansky (2002), Natrium Klorida, yang juga dikenal sebagai garam meja, atau garam karang, merupakan senyawa ion dengan rumus NaCl. Natrium klorida adalah garam yang berbentuk kristal atau bubuk berwarna putih yang tidak berbau. NaCl dapat larut dalam air tetapi tidak larut dalam alkohol. Adapun beberapa sifat fisis dari Natrium Klorida antara lain:
Rumus molekul : NaCl Berat molekul : 58,45 g/mol
Titik didih : 1413oC pada 1 atm Titik beku : 800,4oC pada 1 atm Bentuk : Kristal kubik padat
Warna : putih
2.7 Lamtoro
Lamtoro dalam istilah ilmiah bernama Leucaena Leucocephala L. Lamtoro umumnya berasal dari Filipina dengan nama Giant ipil-ipil yang apabila
diterjemahkan secara bebas berarti “Giant” adalah raksasa sedangkan “ipil-ipil” berasal dari bahasa Filipina yang berarti lamtoro. Jadi Giant ipil-ipil berarti lamtoro raksasa, tetapi lamtoro di Indonesia menjadi lamtoro gung. Adapun sistematika tanaman lamtoro adalah sebagai berikut:
Kingdom : Plantae
Divisi : Magnoliophytea Kelas : Magnoleopsida Ordo : Fabales
Famili : Fabaceae Genus : Leucaena
Spesies : Leucaena leucocephala L.
Lamtoro mudah beradaptasi diberbagai daerah tropis di Asia dan Afrika termasuk pula di Indonesia. Tanaman semak atau pohon tinggi sampai 2-10 meter, bercabang banyak, dan kuat, dengan kulit batang abu-abu. Daun bersirip dua dengan 3-10 pasang sirip, bervariasi dalam panjang hingga 35 cm, dengan
glandula besar (sampai 5 mm) pada dasar petiole, helai daun 11-22 pasang per sirip, 8-16 mm x 1-2 mm. Memiliki bunga sangat banyak dengan diameter kepala
2-5 cm, stamen (10 per bunga) dan pistil sepanjang 10 mm. Menghasilkan buah polong 14-26 cm x 1,5-2 cm, berwarna coklat pada saat tua. Jumlah biji 15-30 per
buah polong, berwarna coklat.
Daun lamtoro berbentuk simetris kecil-kecil berpasangan tapi tidak pernah gugur. Warna daun hijau pupus dan berfungsi untuk memasak makanan sekaligus
penyerap nitrogen (N2) dan karbondioksida (CO2) dari udara bebas. Nitrogen dan karbondioksida ini berasal dari sisa-sisa pembakaran yang kemudian mengotori
udara (polusi). Daun-daun lamtoro juga kerap digunakan sebagai mulsa dan pupuk hijau. Daun lamtoro cepat mengalami dekomposisi (Simanjuntak, 2012). Bentuk daun lamtoro dapat dilihat pada Gambar 2.8 berikut:
Gambar 2.8. Lamtoro (Leucaena leucocephala L) (De Wit, 1961)
Lamtoro merupakan leguminosa pohon yang mempunyai perakaran yang dalam dan mampu beradaptasi pada tanah yang berdrainase baik di daerah beriklim sedang dengan curah hujan tahunan diatas 760 mm. Daun lamtoro mengandung protein kasar yang cukup tinggi yakni 27 – 34 % dari bahan kering
dan telah umum digunakan sebagai makanan ternak. Komposisi kimianya dalam bahan kering terdiri atas 25,90 % protein kasar, 20,40 % serat kasar dan 11 % abu
(2,30 % Ca dan 0,23 % P), karoten 530,00 mg/kg dan tannin 10,15 mg/kg (Haris, 2012).
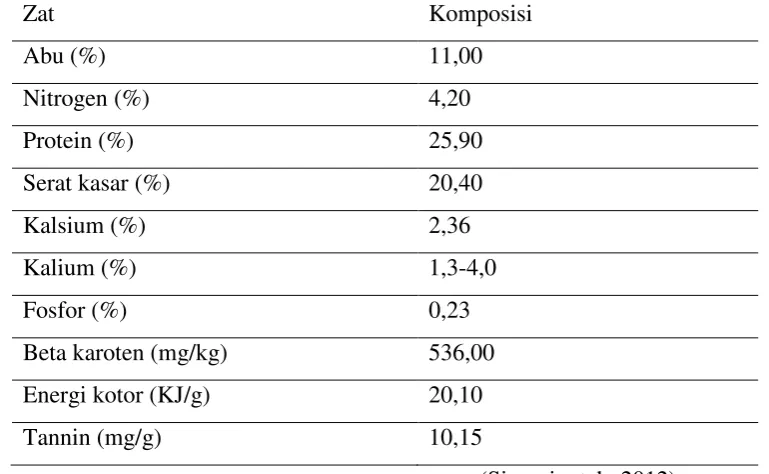
Tabel 2.1. Kandungan daun lamtoro (Laucaena leucocepala L.)
Zat Komposisi
Abu (%) 11,00
Nitrogen (%) 4,20
Protein (%) 25,90
Serat kasar (%) 20,40
Kalsium (%) 2,36
Kalium (%) 1,3-4,0
Fosfor (%) 0,23
Beta karoten (mg/kg) 536,00
Energi kotor (KJ/g) 20,10
Tannin (mg/g) 10,15
(Simanjuntak, 2012)
2.8 Metode Pengukuran Laju Korosi dan Efisiensi Inhibitor
2.8.1 Pengukuran Laju Korosi dengan Metode Weight Loss coupons
Weight Loss coupons adalah metode monitoring korosi yang paling banyak digunakan. Coupons merupakan lempengan logam yang ditempatkan di dalam sistem dan dibiarkan untuk terkorosi. Coupons digunakan untuk mengetahui laju
korosi melalui weight loss.
Corrosion coupons kemungkinan paling banyak digunakan untuk material konstruksi untuk mendeteksi serangan permanen dari perubahan korosifitas.
kerusakan pada spesimen. Dengan menggunakan rumus berikut maka akan diketahui laju korosi pada lingkungan tersebut:
Laju korosi = 𝐾𝐾.𝑊𝑊
𝐷𝐷.𝐴𝐴.𝑇𝑇 (2.10)
Keterangan:
K = konstanta (mpy = 3,45 x 106) W = kehilangan berat (gram) D = densitas (gram/cm3)
A = luas permukaan yang terendam (cm2) T = waktu (jam)
Beberapa keuntungan dari Metode Weight Loss adalah biayanya murah, mudah dilakukan, coupons terbuat dari material yang sama dengan struktur, pemeriksaan visual dapat mengidentifikasi jenis serangan, coupons tersebut dapat dianalisa scale, dan kerugiannya antara lain laju korosi yang diperoleh merupakan laju korosi rata – rata, kalkulasi laju korosi diasumsikan sebagai korosi seragam, pengambilan data berlangsung lama dan memerlukan pemasangan dan pengambilan yang dapat mempengaruhi proses keselamatan (Fachri, 2011).
2.8.2 Efisiensi inhibitor
Dalam penggunaan inhibitor dapat ditentukan efisiensi dari penggunaan inhibitor tersebut. Semakin besar efisiensi inhibitor tersebut maka semakin baik inhibitor tersebut untuk diaplikasikan di lapangan. Penghitungan efisiensi didapatkan melalui persentase penurunan laju korosi dengan adanya penambahan dibandingkan dengan laju korosi tanpa ditambahkan inhibitor. Perhitungan itu dapat dijabarkan sebagai berikut:
𝑒𝑒𝑒𝑒𝑒𝑒𝑒𝑒𝑒𝑒𝑒𝑒𝑒𝑒𝑒𝑒𝑒𝑒𝑒𝑒𝑒𝑒ℎ𝑒𝑒𝑖𝑖𝑒𝑒𝑖𝑖𝑖𝑖𝑖𝑖 = 𝑥𝑥𝑎𝑎−𝑥𝑥𝑖𝑖
𝑥𝑥𝑖𝑖 𝑥𝑥 100% (2.11) (Fachri, 2011) Keterangan