Abstrak
Geraldi Kusuma Arnanto
Ikna Qonita
2010, PELAPISAN PLAT BESI DENGAN TEMBAGA DENGAN PERBEDAAN
WAKTU DAN MOLARITAS LARUTAN ELEKTROLIT
The purpose of writing this scientific paper is to determine the correct time needed and the concentration of the solution to coat iron metal foil with copper foil with electrolysis process. This research is using experiment method. The object of this experiment is a thin iron metal foil. The preparation of the experiment includes preparation of the objects, cleaning of the objects, then the mass measurement of the iron before the coating process. In this research, respectively there are 3 time variables, 2 minutes, 4 minutes, and 6 minutes. The tools used in this reasearch are beker glass, measuring cup, funnel, pasteur pippete, abrasive paper, 2 electrical cables, stopwatch, measuring scale, and measuring flask. As cathode electrode is the iron foil and as anode electrode is the copper foil. The result can be conclude that there is a mass difference of the coating of iron when using a 1 M CuSO4 and a 2 M CuSO4 solution with time
Kata Pengantar
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah melimpahkan
rahmat dan karunianya sehingga proses penelitian sekaligus
penulisan karya tulis ilmiah yang berjudul “PELAPISAN PLAT BESI DENGAN
TEMBAGA DENGAN PERBEDAAN WAKTU DAN MOLARITAS LARUTAN
ELEKTROLIT” dapat berjalan lancar.
Karya tulis ini dibuat untuk memenuhi LKTI (Lomba Karya Tulis Ilmiah) yang
diselenggarakan oleh Himpunan Mahasiswa Metalurgi (HIMAMET) Fakultas Teknik
Universitas Sultan Ageng Tirtayasa.
Penulis menyadari tanpa bantuan dan bimbingan dari berbagai pihak, penulisan
karya ilmiah ini tidak akan terlaksana dengan baik. Oleh sebab itu penulis mengucapkan
banyak terimakasih kepada guru pembimbing dan segenap teman-teman yang ikut
mendukung demi terselesaikannya penulisan karya ilmiah ini.
Penulis menyadari bahwa di dalam penulisan karya ilmiah ini banyak terdapat
kesalahan. Untuk itu penulis memohon maaf apabila ada yang kurang sesuai di dalam
penulisan awal maupun hasil dan pembahasan. Semoga karya tulis ilmiah ini dapat
dimanfaatkan oleh banyak pihak yang membutuhkan.
Serang, 17 November 2010
Daftar Isi
Abstrak………...……….1
Kata Pengantar ………...……….2
Daftar Isi ……….3
Bab I. Pendahuluan : A. Latar Belakang………..….………….…………..………4
B. Tujuan ………...……….………5
C. Manfaat ………...….……….……….………..5
D. Landasan Teori : 1. Pengertian Elektroplating………...6
2. Dasar Teori dan Prinsip Kerja………7
3. Besi……….7
4. Tembaga……….8
Bab II. Bahan dan Metode : A. Katoda-Anoda……….………9
B. Variabel Percobaan……….………9
C. Alat dan Bahan Percobaan………..………...10
D. Prosedur Penelitian………..………...10
Bab III. Hasil dan Pembahasan : A. Hasil penelitian...12
B. Pembahasan...16
Bab IV. Simpulan...18
Bab V. Daftar Pustaka...19
I
Pendahuluan
A. Latar Belakang
Di jaman globalisasi yang penuh dengan perkembangan dan
perubahan ini, salah satunya di bidang teknologi, setiap Negara terus
berlomba-lomba untuk memajukan negaranya dengan berbagai
perkembangan ilmu pengetahuan dan teknologi (IPTEK) yang
masing-masing dimilikinya. Bukan hanya menciptakan benda-benda terbaru atau
alat-alat terbaru saja, tetapi yang dapat menciptakan sesuatu yang berasal
dari pemanfaatan barang-barang yang telah ada tentunya dengan bekal
ilmu pengetahuan bagi setiap penghuni negaranya. Salah satu contohnya
adalah penggunaan logam.
Penggunaan logam tidak bisa dipisahkan dari kehidupan
manusia. Dengan demikian logam harus tampil sesuai dengan kondisi
yang dibutuhkan, misalnya untuk penggunaan logam untuk berbagai
perhiasan, maka logam harus tampil indah dan menarik. Untuk peralatan
rumah tangga harus kuat dan awet, dan untuk bidang kelistrikan harus
memperhitungkan antara hambatan dan hantaran listriknya. Atas dasar
tersebut, perlu adanya tindakan untuk membuat nyata hal tersebut yaitu
seperti pelapisan pada logam. Suatu logam dilapisi dengan logam lain
dapat membuat logam yang dilapisi tersebut mengalami perubahan
tampilan juga daya guna. Hal ini dapat dilihat dari berbagai sudut
pandang kegunaannya masing-masing. Selain itu, digunakan pula
berbagai proses pelapisan dengan memperhatikan sifat dari suatu logam
yang akan dilapisi maupun yang melapisi.
Pelapisan logam dapat dilakukan dengan beberapa cara yaitu
secara pelelehan, semprot, endap, vakum, dan electroplating (elektrolisis). Untuk melindungi logam dengan proses electroplating
dibutuhkan listrik arus searah (DC), elektrolit yang disesuaikan dengan
lapisan yang akan diinginkan, logam pelapis (anoda), dan benda kerja
pelapis yang sering digunakan dalam proses pelapisan secara
elektroplating, yaitu tembaga (Cu), Nikel (Ni), dan krom (Cr).
Pada umumnya digunakan proses elektrolisis terhadap suatu logam tersebut guna memisahkan atom dari suatu senyawa dengan
bantuan energi listrik karena proses elektrolisis memang sudah terkenal
disekitar pengrajin logam atau pun para pekerja pabrik logam. Proses ini
juga adalah salah satu yang mudah dilakukan tentunya dengan
memperhatikan hasil akhir dan tujuan awal masing-masing pengguna
proses tersebut.
Tembaga merupakan logam yang banyak digunakan dalam
industri pelapisan logam. Tembaga mempunyai sifat yang tahan terhadap
korosi, berwarna kemerah-merahan, serta memiliki daya hantar listrik
yang baik. Sehingga apabila digunakan untuk melapisi suatu logam lain
(besi) yang tingkatan daya hantar listriknya berada dibawahnya akan
menjadi lebih baik. Pelapisan besi dengan tembaga ini akan digunakan
untuk benda hiasan (bandul kalung atau gantungan)setelah dilapisi
tembaga untuk kegunaan lainnya dengan varian waktu dan molaritas
larutan elektrolit yang akan membedakan berat dan kualitas besi yang
telah dilapisi oleh tembaga.
B. Tujuan
Penulisan karya tulis ilmiah ini bertujuan untuk :
1. mengetahui waktu dan molaritas larutan elektrolit yang pas untuk
melapisi besi dengan tembaga
2. mambandingkan waktu dan molaritas larutan elektrolit yang digunakan
untuk melapisi tembaga dan pengaruhnya terhadap massa logam yang
dilapisi
3. mencari cara terefisien untuk melapisi logam yang ekonomis dan ramah
lingkungan
C. Manfaat
1. sebagai bahan praktek langsung maupun mainan bagi para remaja dan
2. mendapatkan hasil pelapisan yang baik setelah meneliti waktu
elektrolisis dan molaritas larutan elektrolitnya
3. diharapkan dapat memberikan hasil yang merata dengan waktu yang
optimum
D. Landasan Teori
Elektrolisis merupakan proses kimia yang mengubah energi listrik menjadi energi kimia. Komponen yang terpenting dari proses elektrolisis ini
adalah elektroda dan elektrolit.
Elektroda yang digunakan dalam proses elektolisis dapat digolongkan
menjadi dua, yaitu:
• Elektroda inert, seperti kalsium (Ca), potasium, grafit (C), Platina
(Pt), dan emas (Au).
• Elektroda aktif, seperti seng (Zn), tembaga (Cu), dan perak (Ag).
Elektrolitnya dapat berupa larutan berupa asam, basa, atau garam, dapat
pula leburan garam halida atau leburan oksida. Kombinasi antara elektrolit dan
elektroda menghasilkan tiga kategori penting elektrolisis, yaitu:
1. Elektrolisis larutan dengan elektroda inert
2. Elektrolisis larutan dengan elektroda aktif
3. Elektrolisis leburan dengan elektroda inert
Pada elektrolisis, katoda merupakan kutub negatif dan anoda merupakan
kutub positif. Pada katoda akan terjadi reaksi reduksi dan pada anoda terjadi
reaksi oksidasi.
1. Pengertian electroplating
Pelapisan secara listrik electroplating adalah electrodeposisi. Pelapisan/coating logam melekat ke elektroda untuk menjaga substrat dengan
memberikan permukaan dengan sifat dan dimensi berbeda dari pada logam
basisnya tersebut, sedangkan pengertian electroplating yang lain adalah suatu proses pengerjaan permukaan material baik logam maupun bukan logam dan
upaya meningkatkan sifat-sifat material tersebut. Sifat-sifat yang akan
a. Daya tahan korosi (corrosion resistence) b. Tampak rupa (appearance)
c. Daya tahan gores / aus (abrasion resistence) d. Harga / nilai (value)
e. Mampu solder (solderability) f. Karet pengikat (bonding of rubber)
g. Daya kontak listrik (electrcal contact resistence)
h. Mampu pantul / bias cahaya (reflectivity) i. Penyebaran rintangan (diffusion barrier) j. Mampu sikat kawat (wive bondability)
k. Daya tahan temperatur tinggi (high temperature resistence)
2. Dasar teori dan prinsip kerja electroplating
Bila arus listrik searah (DC) dialirkan antara kedua elektroda anoda dan
katoda dalam larutan elektrolit dengan waktu proses pelapisan yang telah
ditentukan maka pada anoda terjadi oksidasi sehingga akan terbentuk ion-ion
positif, pada larutan elektrolit terjadi elektrolisis garam-garam logam. Anoda
yang telah mengalami oksidasi meluruh dan larut dalam larutan elektrolit. Anoda
yang meluruh menggantikan ion logam dalam larutan elektrolit yang ditarik oleh
elektroda negatif (katoda). Dengan adanya hal tersebut akan terbentuk endapan
pada katoda yang berupa massa lapisan. Contoh plat besi yang akan dilapisi
tembaga.
Ion Cu2+ bergerak ke katoda, mengambil elektron dan menjadi logam
tembaga yang menempel pada besi katoda.
Katoda : Cu2+(aq) + 2e
-à Cu(s)
Ion SO42- bergerak ke anoda memberikan elektron dan bereaksi dengan
tembaga anoda.
Anoda : Cu(s)à Cu2+(aq) + 2e-
3. Besi
adalah logam yang berasal dari bijih besi (tambang) yang banyak
digunakan untuk kehidupan manusia sehari-hari dari yang bermanfaat sampai
dengan yang merusakkan. Dalam tabel periodik, besi mempunyai simbol Fe dan
logam yang paling banyak dan paling beragam penggunaannya. Hal itu karena
beberapa hal, diantaranya:
• Kelimpahan besi di kulit bumi cukup besar,
• Pengolahannya relatif mudah dan murah, dan
• Besi mempunyai sifat-sifat yang menguntungkan dan mudah
dimodifikasi.
4. Tembaga (Cu)
Tembaga dengan nama kimia Cupprum dilambangkan dengan Cu, unsur
logam ini berbentuk kristal dengan warna kemerahan. Dalam tabel periodik
unsur-unsur kimia tembaga menempati posisi dengan nomor atom (NA) 29 dan
mempunyai bobot atom (BA) 63,546.
Unsur tambahan di alam dapat ditemukan dalam bentuk persenyawaan
atau dalam senyawa padat dalam bentuk mineral. Dalam badan perairan laut
tembaga dapat ditemukan dalam bentuk persenyawaan ion seperti CuCO3, CuOH,
dan sebagainya (Fribeg, 1977).
Tembaga merupakan suatu unsur yang sangat penting dan berguna untuk
metabolisme. Batas konsentrasi dari unsur ini yang mempengaruhi pada air
berkisar antara 1 – 5 mg/l merupakan konsentrasi tertinggi. Dalam industri,
tembaga banyak digunakan dalam industri cat, industri fungisida serta dapat
digunakan sebagai katalis, baterai elektroda, sebagai pencegah pertumbuhan
lumut, turunan senyawa-senyawa karbonat banyak digunakan sebagai pigmen
dan pewarna kuningan. Tembaga berperan khususnya dalam beberapa kegiatan
seperti enzim pernapasan sebagai tirosinase dan silokron oksidasi. Tembaga juga
diperlukan dalam proses pertumbuhan sel darah merah yang masih muda, bila
kekurangan sel darah merah yang dihasilkan akan berkurang (Heryando Palar,
II
Bahan dan Metode
A. Katoda-Anoda
1. Katoda
Katoda yaitu elektroda negatif yang pada logamnya terjadi
pelepasan ion positif (reaksi reduksi). Pada proses electroplating kutub negative sumber arus berhubungan dengan katoda yaitu benda kerja yang
akan dilapisi logam. Pada proses kerjanya digunakan gelas kimia yang
sedikit besar dan katoda dijepit kabel elektrolisis negative untuk
dicelupkan pada larutan elektrolit sebagian.
2. Anoda
Anoda untuk pelapisan besi (Fe) digunakan tembaga tipis dan
digantung pada kawat tembaga yang dihubungkan langsung dengan arus
positif. Agar aliran arus listrik lancar di anjurkan kawat tembaga
dibersihkan sesering mungkin dengan amplas email.
3. Mengatur jarak katoda-anoda
Jarak katoda-anoda yang digunakan yaitu 8 cm sebab apabila
terlalu dekat hasil pelapisan akan berwarna hitam (gosong) namun bila
terlalu jauh maka proses pelapisan akan terlalu lama dan hasil pelapisan
tidak merata.
B. Variabel Percobaan
Didalam suatu percobaan didapati variabel-variabel percobaan
yaitu sebagai berikut :
a. Variabel bebas
Sebagai variabel bebasnya adalah perbedaan waktu
mengelektrolisis besi dan tembaga juga besarnya molaritas
larutan elektrolit yang digunakan.
b. Variabel terikat
c. Variabel kontrol
Semua faktor yang mempengaruhi pelapisan seperti tembaga
dan kuat arus.
Penelitian ini menggunakan metode eksperimen yaitu suatu
metode pengumpulan data dengan cara melakukan percobaan langsung.
Penelitian ini dilakukan melalui tahapan-tahapan sebagai berikut :
- Pekerjaan pembersihan
- Bilas dengan air
- Pengukuran massa tembaga yang akan ditambahkan
- Proses pelapisan besi (Fe)
- Bilas dengan air
- Pengeringan
- Pengukuran perbedaan massa logam besi
Langkah Kerja Elektrolisis :
1. siapkan alat dan bahan
2. bersihkan besi dan tembaga dengan menggunakan amplas
3. bentuk besi sesuai yang diinginkan
4. pengukuran massa awal
5. melakukan proses pelapisan dengan tembaga (Cu) dengan
cara menyelupkan sebagian besi dan tembaga kedalam
larutan elektrolit dengan penjepit. Komposisi larutan
elektrolit yang digunakan pada gelas kimia adalah sebagai
berikut :
CuSO4 : 16 gram / liter
6. setelah benda uji dilapisi dengan tembaga selanjutnya
bersihkan dengan air untuk menghilangkan sisa-sisa larutan
dari proses pelapisan tembaga
7. pengukuran massa
8. melakukan proses pelapisan dengan logam besi (Fe) dengan
perlakuan : benda kerja yang dilapisi tembaga, untuk variasi
waktu mulai dari 2 menit, 4 menit, dan 6 menit (rentang
waktu 2 menit)
9. pengukuran massa setelah proses pelapisan besi. Setelah
proses pelapisan besi selesai, benda uji diukur kembali
massanya, sehingga didapat massa hasil pelapisan besi
III
Hasil dan Pembahasan
A. Hasil Penelitian
Penelitian yang dilakukan mengenai perbedaan massa lapisan tembaga terhadap
besi dengan varian waktu dan molaritas larutan elektrolit yang digunakan sebagai
penghantar listrik menghasilkan data berupa angka-angka yang menyatakan perbedaan
massa, waktu dan molaritas larutan elektrolitnya.
Coba kita lihat massa awal besi yang seragam sebelum dilapisi tembaga :
Besi Massa awal besi
Sebelum dilapisi tembaga atau belum mengalami proses elektrolisis, besi
mempunyai massa yang seragam/sama. Ketika proses elektrolisis dilakukan, terjadi
oksidasi pada besi (katoda) dan reduksi pada tembaga (anoda), massa tembaga pun
berpindah ke besi yang dielektrolisis setelah dicelupkan kedalam larutan elektrolit yang
dialiri arus listrik 12 volt (tegangan dibuat sama, juga dalam keadaan pH yang sama).
Setelah dielektrolisis dengan perbedaan waktu dan molaritas larutan CuSO4 yang
ditambahkan, terdapat perbedaan hasil terhadap masing-masing besi, yaitu sebagai
berikut :
Besi
Waktu elektrolisis Hasil Molaritas CuSO4 2 M Hasil Molaritas CuSO4 1 M
I 2 menit Sedikit menguning, tak tebal Sedikit kuning
II 4 menit Tampak kuning bagus, sedikit tebal Tampak kuning dan tipis
Dari tabel diatas, tampak bahwa semakin lama waktu yang digunakan untuk
proses elektrolisis, semakin bagus pula hasilnya. Hal ini dikarenakan tembaga akan
tereduksi sempurna dan besi teroksidasi sempurna sehingga keduanya dapat saling
melepas dan menerima elektron akibatnya besi tampak lebih menguning. Sedangkan
waktu optimum untuk besi yang telah terlapisi tampak lebih bagus yaitu pada waktu 4
menit.
Selain perbedaan sifat yang tampak dari luar (seperti warna dan ketebalannya),
perbedaan waktu yang digunakan pada proses elektrolisis dan molaritas larutan elektrolit
CuSO4 juga mempengaruhi massa tembaga yang melapisi besi. Dengan waktu dan
molaritas yang berbeda, maka dihasilkan pula massa akhir yang berbeda-beda (sesuai
dengan hukum Faraday) seperti yang terlihat pada tabel berikut ini :
Konsentrasi larutan elektrolit CuSO4 2 M
Besi Waktu
elektrolisis Massa awal besi (gram)
Massa akhir besi
(gram)
Massa tembaga yang
menempel
I 2 menit 0,5 0,6 0,10
II 4 menit 0,5 0,66 0,16
Konsentrasi larutan elektrolit CuSO4 1 M
Besi Waktu
elektrolisis Massa awal besi (gram)
Massa akhir besi
(gram)
Massa tembaga yang
menempel
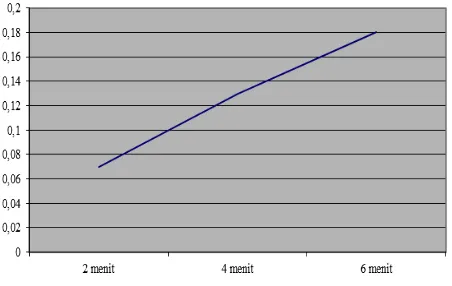
I 2 menit 0,5 0,57 0,07
II 4 menit 0,5 0,63 0,13
III 6 menit 0,5 0,68 0,18
Pada tabel diatas terlihat perbedaan massa tembaga yang menmpel pada besi
yang didapatkan dengan cara mengukur massa akhir benda dikurangi massa awal benda.
Hal ini akibat dari pengaruh waktu yaitu pada hukum faraday 1 :
W = i t / 96.500 (Ar / n) (dibuat rumus)
Dari rumus diatas, tampak bahwa waktu mempengaruhi massa tembaga yang
melapisi besi. Selain itu, kuat arus (yang pada percobaan ini disetarakan) juga ikut
Grafik hubungan massa tembaga dengan waktu pada larutan elektrolit CuSO4 2 M
Grafik hubungan massa tembaga dengan waktu pada larutan elektrolit CuSO4 1 M
pada selang waktu 2 menit, massa tembaga yang menempel pada besi dalam larutan
elektrolit yang berkonsentrasi 2 M sedikit berubah yaitu menjadi 0,6 gram dari 0,5 gram.
Ini menunjukkan jumlah tembaga yang menempel masih relatif kecil yaitu 0,1 gram.
Ketika dilakukan proses elektrolisis selama 4 menit dan masih dalam keadaan konsentrasi
larutan CuSO4 2 M, massa besi berubah dari 0,5 gram ke 0,66 gram, yaitu naik 0,16 gram.
elektrolit CuSO4 yang sama, massa besi berubah dari 0,5 gram ke 0,71 gram, naik 0,21
gram. Tetapi dari segi penampakan sedikit lebih gosong atau rusak.
Pada proses elektrolisis yang menggunakan konsentrasi larutan
elektrolit CuSO4 1 M, pada selang waktu 2 menit, tampak sedikit penambahan massa besi
setelah dilapisi tembaga yaitu dari 0,5 gram ke 0,57 gram, berarti massa tembaga yang
melapisi besi adalah 0,07 gram. Ketika proses elektrolisis menggunakan waktu selama 4
menit dengan konsentrasi larutan elektrolit CuSO4 yang sama yaitu 1 M, massa besi
mengalami kenaikan dari 0,5 gram ke 0,63 gram, berarti massa tembaga yang melapisi
besi menjadi 0,13 gram.
Pada saat pelaksanaan proses elektrolisis dengan penggunaan waktu
selama 6 menit, massa besi setelah dilapisi tembaga berubah dari massa awal sebesar 0,5
gram ke 0,68 gram, berarti massa tembaga yang melapisi besi mengalami kenaikan
sebanding dengan waktunya. Tetapi, bentuk luar dari hasil pelapisan besi oleh tembaga
pada waktu 6 menit tidak lebih baik dari pada yang selama 4 menit.
Dari uraian diatas, dapat diketahui bahwa waktu yang optimum
yang digunakan dalam proses elektrolisis agar hasilnya menjadi lebih baik adalah selama
4 menit. Dan konsentrasi larutan elektrolit yang optimumnya adalah sebesar 2 M.
B. Pembahasan
Hasil proses electroplating besi akibat penggunaan lapisan dasar Cu dengan variasi waktu dilihat dari tampak rupa yang menunjukkan perbedaan akibat pengaruh
waktu dan konsentrasi larutan elektrolit CuSO4. Pada pemakaian lapisan dasar Cu dan
rentang waktu antara 4 menit dan 6 menit menunjukkan hasil pelapisan yang mempunyai
bobot lebih besar dan secara tampak lebih bagus karena cukup waktu. Sedangkan pada
waktu pelapisan 3 menit dan 6 menit menghasilkan pelapisan yang kurang bagus. Untuk
proses electroplating besi dengan konsentrasi larutan 1 M menghasilkan bobot lapisan yang lebih kecil bila dibandingkan dengan yang konsentrasinya 2 M. Adanya lapisan
yang kurang bagus pada proses electroplating besi secara umum baik itu yang menggunakan konsentrasi larutan CuSO4 1 M atau 2 M, disebabkan karena
partikel-partikel tembaga yang menempel pada besi masih terlalu sedikit akibat kurangnya waktu
yang dibutuhkan dalam proses electroplating besi. Berdasarkan data yang diperoleh dari
hasil penelitian, penggunaan konsentrasi larutan CuSO4 dalam proses electroplating pada
berbagai tingkatan waktu memberikan hasil massa lapisan yang berbeda-beda. Perbedaan
lapisan yang terbentuk cenderung semakin besar. Tetapi dalam segi kenampakan (segi
luar) waktu optimum agar hasil yang lebih baik pada kedua percobaan dengan perbedaan
IV
Simpulan
Berdasarkan hasil penelitian tentang pelapisan besi (Fe) oleh tembaga (Cu) dan
pengaruh perbedaan waktu pelapisan terhadap massa logam yang dilapisi juga kekuatan
daya hantar listrik adalah sebagai berikut :
1. Ada perbedaan massa hasil pelapisan besi akibat penggunaan pelapis Cu
dengan perbedaan waktu, yaitu waktu yang optimum yang dalam melakukan
elektrolisis ini selama 4 menit supaya tembaga dapat menempel sempurna
pada permukaan besi
2. Ada perbedaan massa hasil pelapisan besi oleh tembaga akibat perbedaan
konsentrasi larutan elektrolit CuSO4, yaitu semakin besar konsentrasi larutan
elektrolit CuSO4, semakin banyak pula tembaga yang akan terelektrolisis
3. Ada perbedaan hasil akhir berupa tampak luar akibat perbedaan waktu dan
konsentrasi larutan elektrolit CuSO4, yaitu pada saat 4 menit (waktu
optimum) dan konsentrasi 2 M (lebih besar) akan dihasilkan hasil pelapisan
V
Daftar Pustaka
• Prayitno, D., 2006, “Perbedaan Massa Hasil Pelapisan Nikel Akibat Penggunaan
Lapisan Dasar Cu dan Tanpa Lapisan Dasar Cu Pada Bahan Baja Karbon
Rendah”,
http://docs.google.com/viewer?a=v&q=cache:CC95xFeOnzwJ:digilib.unnes.ac.id
/gsdl/collect/skripsi.
• Taufik, Tatang, 2009, “Cara Pelapisan Logam Secara Listrik (Elektroplating)”,
http://www.chem-is-try.org/artikel_kimia/teknologi_tepat_guna/cara-pelapisan-logam-secara-listrik-elektroplating/.
Kata Kunci/Istilah dalam Bahasa Inggris
• corrosion resistence
• appearance
• abrasion resistence
• value
• solderability • bonding of rubber
• electrcal contact resistence
• reflectivity • diffusion barrier
• wive bondability