1
PENDAHULUAN
A. LATAR BELAKANG
Saat ini fenomena perpindahan massa liquid-solid dalam kolom banyak dijumpai dalam proses-proses di industri kimia, terutama pada proses ekstraksi dan kristalisasi. Salah satu contohnya adalah proses perpindahan massa yang ditandai dengan perubahan konsentrasi. Proses perpindahan masa antara fasa liquid dan fasa solid banyak dipakai dalam industri, oleh karena itu data-data berhubungan dengan proses perpindahan masa tersebut sangat dibutuhkan. Salah satu alat yang dapat digunakan untuk memperoleh data yang berhubungan dengan koefisien perpindahan masa adalah Packed Bed.
Packed Bed adalah salah satu jenis kolom yang popular merupakan suatu silinder
panjang, biasanya berdiri tegak dan berisi packing yang diam didalamnya. Karena penggunaannya yang sangat luas, maka diperlukan lebih banyak lagi informasi dan studi untuk memperkirakan koefisien perpindahan massa dalam kolom Packed Bed.
Pada adsorpsi di dalam kolom packed bed, konsentrasi liquid dan fase padat berubah menurut waktu dan posisi tinggi packing. Pada umumnya sebagian besar perpindahan massa berlangsung didekat tempat masuk kolom, pada daerah tersebut fluida berkontak dengan adsorben “segar”. Jika zat padat itu tidak mengandung adsorbat pada awal operasi, konsentrasi adsorbat akan menurun secara eksponensial terhadap jarak packing. (Foust, 1991)
Pada praktikum ini, digunakan asam asetat sebagai adsorbat dan digunakan arang aktif sebagai adsorben. Asam asetat sebagai adsorbat akan dialirkan dari bagian bawah kolom dengan bantuan gravity force, lalu ketika asam asetat melewati tumpukan bahan isian, bahan isian tersebut (arang aktif) akan menjerap asam asetat tersebut. Asam asetat dan arang aktif dipilih sebagai bahan baku percobaan ini karena relatif lebih murah dan mudah di dapat.
2
B. TUJUAN PERCOBAAN
Tujuan dari percobaan ini adalah :
1. Membuat pemodelan matematis proses adsorpsi dalam Packed Bed dan menentukan model kesetimbangan yang sesuai untuk adsorpsi asam asetat dengan karbon aktif
2. Menentukan nilai koefisien perpindahan massa (𝐾𝑐𝑎) adsorpsi asam asetat dengan karbon aktif.
C. TINJAUAN PUSTAKA
Adsorpsi merupakan salah satu bentuk dari sorption operation. Dua komponen penting dalam adsorpsi yakni fase bergerak (adsorbat) dan penjerap (adsorbent). Sedangkan jenis sorption operation yang lain yaitu desorpsi. Pada percobaan ini adsorbat yang digunakan adalah asam asetat yang berada dalam air dan adsorben berupa arang aktif.
Arang adalah suatu bahan padat yang berpori dan merupakan hasil pembakaran dari bahan yang mengandung karbon melalui proses pirolisis. Sedangkan arang aktif adalah arang yang telah mangalami proses aktivasi untuk meningkatkan luas permukaan melalui pembukaan pori-pori sehingga daya adsorpsi dapat ditingkatkan. Luas permukaan dari arang aktif sekitar 300 sampai dengan 2000 m2/g. Permukaan arang aktif yang semakin meluas ini menyebabkan daya adsorpsinya terhadap gas atau cairan makin tinggi (Kirk dan Othmer, 1964).
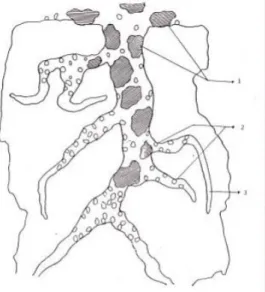
3 Keterangan :
1. Daerah yang memungkinkan pelarut dan bahan yang adsorbat dapat masuk
2. Daerah yang memungkinkan pelarut dan bahan yang lebih kecil yang akan dijerap dapat masuk
3. Daerah yang hanya dimasuki pelarut.
Mekanisme proses adsorpsi pada dasarnya adalah proses penjerapan yang terjadi pada permukaan padatan. Mula-mula molekul adsorbat berdifusi melalui suatu lapisan batas ke permukaan luar adsorben, sebagian ada yang teradsorpsi di permukaan luar, sebagian besar berdifusi lanjut di dalam pori-pori adsorben. Pada adsorpsi pada arang aktif terjadi melalui tiga tahap dasar, yaitu zat terjerap pada bagian luar, zat bergerak menuju pori-pori arang dan zat terjerap ke dinding bagian dalam dari arang. Adsorben memiliki kapasitas penjerapan masing-masing, sehingga apabila molekul yang terjerap melebihi kapasitas adsorben akan terjadi desorpsi dari padatan adsorben ke larutan. Pada saat kecepatan transfer massa adsorpsi sama dengan kecepatan transfer massa desorpsi maka terjadilah kondisi kesetimbangan (Oscik, 1991).
Kesetimbangan adsorpsi adalah suatu keadaan dimana kecepatan transfer massa adsorbat masuk (adsorpsi) sama dengan kecepatan transfer massa adsorbat keluar (desorpsi), sehingga tidak ada lagi perubahan komposisi adsorbat di dalam adsorben atau adsorben dalam keadaaan jenuh. Kesetimbangan adsorpsi dipelajari sebagai fungsi tekanan parsial (pada gas) atau konsentrasi (pada cairan) adsorbat pada keadaan isotermal, sehingga sering disebut sebagai isothermal adsorption.
Adsorpsi sendiri terbagi atas dua jenis yaitu, adsorpsi fisik dan adsorpsi kimia. Adsorpsi fisik adalah adsorpsi yang disebabkan oleh perbedaan gaya tarik menarik elektrik (gaya Van der Waals) sehingga molekul-molekul adsorbat secara fisik terikat pada molekul adsorben. Jenis adsorpsi ini umumnya akan membentuk lapisan film ganda (multi layer) yang dalam hal ini tiap lapisan molekul terbentuk di atas lapisan-lapisan yang proporsional dengan konsentrasi kontaminan. Makin besar konsentrasi kontaminan dalam suatu larutan maka makin banyak lapisan molekul yang terbentuk pada adsorben. Adsorpsi jenis ini bersifat dapat balik (reversible) yang berarti atom-atom atau ion-ion yang terikat dapat dilepaskan kembali dengan pelarut tertentu yang sesuai dengan sifat ion-ion yang diikat. Adsorpsi kimia adalah adsorpsi yang disebabkan oleh pembentukan atau pemecahan ikatan kimia. Adsorpsi ini merupakan proses eksotermis dengan panas adsorpsi 10-100 kcal/gmol. Energi
4 aktivasinya relatif tinggi, yaitu di atas 20 kcal/mol untuk desorpsi, kecuali untuk adsorpsi kimia pada permukaan yang tidak diaktifkan. Dalam percobaan ini adsorpsi yang terjadi adalah adsorpsi fisik.
Faktor-faktor yang mempengaruhi adsorpsi yaitu: 1. Sifat adsorbat
Jika kelarutan adsorbat pada pelarutnya besar, maka ikatan antara zat pelarut dengan adsorbat semakin kuat sehingga diperlukan energi yang lebih besar untuk memecah ikatan antara adsorbat dan zat pelarutnya.
2. Konsentrasi adsorbat
Pada umumnya kecepatan adsorpsi akan berbanding lurus dengan kenaikan konsentrasi adsorbat, namun akan mencapai kondisi maksimum. Adsorpsi akan konstan apabila terjadi kesetimbangan antara konsentrasi adsorbat yang terjerap dengan konsentrasi yang tersisa pada larutan.
3. Sifat adsorben
Banyaknya adsorbat yang dapat dijerap tergantung pada porositas dan luar permukaan adsorben, yaitu sebagai penyedia tempat adsorpsi. Semakin besar luas permukaan adsorben maka akan semakin besar adsorpsi yang terjadi.
4. Temperatur
Hal ini berhubungan dengan energi untuk melepas ikatan antara adsorbat dengan zat pelarutnya. Umumnya adsorpsi bersifat eksotermis, sehingga akan semakin baik dengan temperatur operasi yang lebih rendah.
5. Waktu kontak
Waktu kontak yang cukup diperlukan untuk mencapai kesetimbangan adsorpsi.
(Oscik,1991)
Banyaknya adsorbat yang terdapat dalam larutan dinyatakan dengan massa asam asetat yang terdapat pada satuan volume larutan dengan persamaan sebagai berikut:
Ca= (1)
Sedangakan banyaknya adsorbat yang terjerap dinyatakan dengan kadar asam asetat yang terdapat pada satuan volume bulk adsorben, dinyatakan dengan persamaan sebagai berikut:
Xa=
5 Pada keadaan setimbang adsorbat yang terjerap dievaluasi dengan neraca massa. Massa adsorbat pada larutan mula-mula sama dengan massa adsorbat pada adsorben dan massa adsorbat pada larutan saat kesetimbangan.
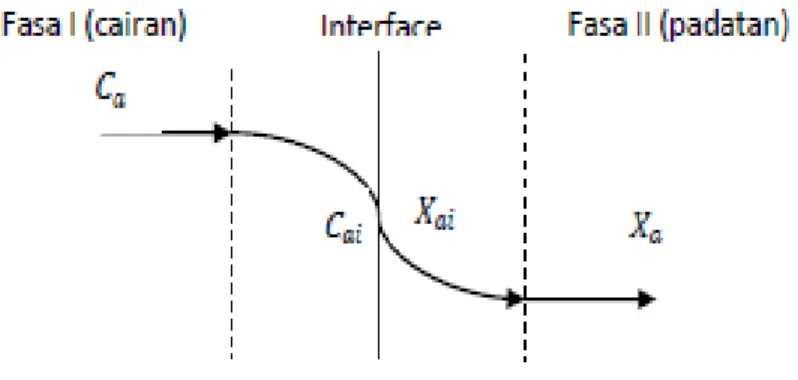
Proses adsorpsi terjadi karena adanya transfer massa dari larutan (fasa I) ke permukaan adsorben (fasa II) karena adanya perbedaan kadar asam asetat pada larutan dan kadar asam asetat dalam adsorben dengan mekanisme sebagai berikut:
1. Transfer massa dari fasa I ke lapisan film fasa I.
2. Transfer massa dari lapisan film fasa I ke lapisan film fasa II melalui interface. 3. Transfer massa dari lapisan film fasa II ke fasa II.
Gambar 2. Mekanisme Transfer Massa Dua Fasa
Pada kondisi steady state, transfer massa asam asetat pada lapisan film cairan maupun pada lapisan film padatan sama. Berdasarkan hukum Fick’s, fluks transfer massa dapat dinyatakan dengan (Metcalf and Eddy,2003):
Na=kc(Ca-Cai)= kx(Xai-Xa) (3)
dengan:
Na : besar fluks transfer massa tiap waktu
kc : koefisien transfer massa asam asetat pada lapisan film cairan
Ca : konsentrasi asam asetat pada larutan
Cai : konsentrasi asam asetat pada interface yang berkeseimbangan dengan kadar asam asetat (Xai)
6 kx : koefisien transfer massa asam asetat pada lapisan film padatan
Xa : kadar asam asetat pada padatan
Xai : kadar asam asetat pada interface yang berkeseimbangan dengan konsentrasi asam asetat (Cai)
pada cairan
Konsentrasi asam asetat pada interface sangnat sulit diukur, sehingga koefisien transfer massa dinyatakan sebagai koefisien transfer massa overall (treyball,1981). Dalam menentukan koefisien transfer massa overall digunakan metode film gabungan:
Gambar 3. Metode Film Gabungan
Ca* merupakan kadar asam asetat dalam larutan yang seimbang dengan kadar asam asetat
pada adsorben. Hubungan antara Ca* dan Xa adalah:
Ca*=k Xa (4)
Dengan k merupakan konstanta kesetimbangan. Maka persamaan transfer massa yang terjadi hasil penggabungan persamaan (3) dan (4) adalah:
kNa=kxk(Xai-Xa)
kNa=kx(Cai-Ca*) (5)
Penggabungan transfer massa pada lapisan film cairan dan lapisan film cairan diperoleh:
( ) ( )
7
jika ( ) maka
𝐾 ( ) (7) Dengan 𝐾 menyatakan koefisien transfer massa overall.
Untuk menentukan koefisien transfer massa overall, perlu ditinjau neraca massa pada sistem menara. digunakan asumsi sebagai berikut:
1. Kecepatan aliran cairan masuk kolom sama dengan kecepatan aliran keluar kolom. 2. Ukuran adsorben relatif kecil, sehingga transfer massa berlangsung cepat.
3. Adsorpsi yang terjad hanya adsorpsi fisik.
4. Volume padatan yang ditinjau adalah volume bulk nya.
8 Gambar 5. Elemen Volume pada Kolom Adsorpsi
Neraca massa asam asetat pada cairan di elemen volume A∆z:
𝑎 𝑎 𝑎 𝑎 𝑎 𝑎 𝑎𝑐𝑐 𝑎
( 𝑎| 𝑎| ) 𝑎 (8)
Dimana nilai Na volumetrik adalah sebagai berikut :
𝐾 ( ) (9)
Ditambah dengan nilai Ca* menurut teori kesetimbangan adalah:
𝑎 (10)
( | | )
𝐾 ( 𝑎)
Sehingga persamaan menjadi
𝐾 ( 𝑎)
(11)
dengan Initial Condition: CA(z,0)=0
Boundary Condition: 1. CA(0,t) =Ca1
2. CA(z,∞) =Ca1
Neraca massa asam asetat pada padatan di elemen volume A∆z:
𝑎 𝑎 𝑎 𝑎 𝑎 𝑎 𝑎𝑐𝑐 𝑎 𝑎
(12)
Dimana nilai Na volumetrik adalah sebagai berikut : 𝐾 ( )
Ditambah dengan nilai Ca* menurut teori kesetimbangan adalah: 𝑎
Sehingga persamaan menjadi:
𝐾 ( 𝑎)
𝐾 ( 𝑎 𝑎) (13)
9 Boundary Condition : Xa(z,t)=f(Ca)
Dengan,
𝐾𝑐𝑎 : koefisien perpindahan massa overall, 1/s
: kecepatan aliran larutan di dalam kolom, m3/s A : luas penampang kolom, m2
ℎ : tinggi kolom, m
𝑎 : konsentrasi asam asetat dalam larutan, mol/m3 (mol asam asetat di larutan/volume larutan)
𝑎 : konsentrasi asam asetat dalam larutan yang berkesetimbangan dengan konsentrasi asam asetat didalam padatan (arang aktif), m3/s (mol asam asetat di larutan/volume larutan)
: konstanta kesetimbangan
𝑎 : konsentrasi asam asetat didalam padatan (arang aktif), mol/m3
(mol asam asetat di dalam padatan/volum bulk padatan di elemen volume)
PELAKSANAAN PERCOBAAN A. BAHAN DAN RANGKAIAN ALAT
Bahan yang digunakan pada percobaan ini adalah :
1. Aquadest yang diperoleh dari Laboratorium Proses Pemisahan Jurusan Teknik Kimia Fakultas Teknik Universitas Gadjah Mada.
2. Asam asetat glasial yang diperoleh dari Laboratorium Proses Pemisahan Jurusan Teknik Kimia Fakultas Teknik Universitas Gadjah Mada.
3. Arang aktif yang diperoleh dari Laboratorium Proses Pemisahan Jurusan Teknik Kimia Fakultas Teknik Universitas Gadjah Mada.
10 Rangkaian Alat Percobaan
arah aliran fluida.
11
B. CARA KERJA
Asam oksalat ditimbang sebanyak 4.5 gram dengan gelas arloji meggunakan neraca analitis digital lalu di tuang ke dalam gelas beker 250 ml. Aquadest ditambahkan sebanyak 50 ml ke dalam gelas beker. Larutan dimasukkan ke dalam labu ukur 100 ml lalu aquadest ditambahkan hingga tanda batas. Larutan di gojog hingga homogen.
NaOH ditimbang sebanyak 2 gram dengan gelas arloji menggunakan analitis digital lalu dituang ke dalam gelas beker 250 ml. Aquadest ditambahkan sebanyak 50 ml ke dalam gelas beker. Larutan dimasukkan kedalam labu ukur 100 ml lalu aquadest ditambahkan hingga tanda batas. Larutan di gojog hingga homogen.
Larutan asam oksalat diambil sebanyak 10 ml dengan menggunakan pipet volum, lalu dimasukkan ke dalam erlenmeyer 125 ml. Indikator phenolphtaelin ditambahkan sebanyak 3 tetes. Kemudian larutan asam oksalat di titrasi dengan larutan NaOH hingga terjadi perubahan warna bening menjadi ungu. Langkah diulangi sampai diperoleh 2 buah data.
Larutan asam asetat dibuat dengan cara melarutkan 858 ml asam asetat glasial dengan aquadest sebanyak 15 liter dalam tangki penampung.
Larutan asam asetat x N sebagai sampel diambil sebanyak 10 ml menggunakan pipet volum dan dituang ke dalam gelas erlenmeyer 125 ml. Larutan kemudian ditambahkan 3 tetes indikator phenolpthalein. Buret diisi dengan larutan NaOH yang disediakan hingga penuh. Larutan asam asetat dititrasi dengan larutan NaOH hingga terjadi perubahan warna dari bening menjadi merah muda keunguan. Volume larutan NaOH yang diperlukan dicatat. Langkah diulangi hingga diperoleh 2 buah data.
Langkah selanjutnya adalah pembuatan kurva standar konduktansi versus konsentrasi larutan asam asetat.Larutan asam asetat xN diambil sebanyak 10 ml dengan pipet volum 10 ml ke dalam labu takar 100 ml, kemudian diencerkan dengan ditambahkan aquadest sampai tanda batas lalu digojog hingga homogen. Lalu sampel dari larutan hasil pengenceran pertama diambil dan diukur konduktansinya dengan konduktometer. Kemudian larutan asam asetat hasil pengenceran pertama diambil 50 ml dan dimasukkan ke dalam labu takar 100 ml lalu diencerkan dengan menambahkan aquadest sampai tanda batas dan digojog hingga homogen. Larutan asam asetat hasil pengenceran kedua kemudian diukur konduktansinya menggunakan konduktometer. Kemudian langkah pada pengenceran ke-2 sampai pengukuran konduktansi ke-2 diulangi sampai diperoleh 9 buah data
12 konduktansi larutan asam asetat pada berbagai konsentrasi. Kemudian konduktansi aquadest diukur dengan konduktometer.
Larutan asam asetat sebanyak 15 L kemudian dituang dalam tangki penampung. Pada saat larutan hasil adsorpsi keluar dari kolom pertama kali, sampel ditampung dengan gelas ukur sebanyak 10 ml, kemudiang dituang dalam gelas beker yang telah diberi label. Waktu pada saat aliran keluar pertama kali terhitung sebagai waktu ke 0 dan stopwatch dinyalakan. Selanjutnya setiap 3 menit, sampel ditampung hingga menit ke 30 sehingga diperoleh 11 sampel.
Larutan asam asetat yang di ambil dari kolom sebagai sampel diambil sebanyak ±5 ml dan dituang ke tabung reaksi. Larutan kemudian diukur konduktansinya menggunakan konduktometer. Langkah diulangi untuk 10 sampel larutan asam asetat yang keluar dari kolom tiap waktu selanjutnya. Kemudian data yang diperoleh dicatat.
Selanjutnya dilakukan pengukuran kecepatan aliran. Larutan yang mengalir dari kolom ditampung dengan gelas ukur selama ±3 detik. Volume larutan tertampung dan waktu yang diperlukan dicatat. Langkah diulangi hingga diperoleh 3 data, kemudian data yang diperoleh dicatat.
C. ANALISIS DATA
1. Standardisasi larutan NaOH oleh asam oksalat (H2C2O4)
Densitas konsentrasi larutan asam oksalat dapat dihitung dengan :
(14)
Sehingga konsentrasi larutan NaOH yang digunakan untuk menera konsentrasi larutan asam asetat adalah :
H2C2O4𝑉H2C2O4= 𝑎𝑂𝐻𝑉 𝑎𝑂𝐻 (15)
(16)
Dengan,
: konsentrasi asam oksalat, N : massa asam oksalat, gram
: berat molekul asam oksalat, gram/gmol : volume larutan asam oksalat, ml
𝑉H2C2O4 : volume larutan asam oksalat untuk titrasi, ml 𝑎𝑂𝐻 : konsentrasi larutan NaOH untuk titrasi, N
13 V 𝑎𝑂𝐻 : volume larutan NaOH untuk titrasi, ml
2. Menghitung konsentrasi asam asetat dalam larutan
Konsentrasi asam asetat sebelum adsorpsi diukur dengan menggunakan titrasi.
𝐻3 𝑂𝑂𝐻𝑉 𝐻3 𝑂𝑂𝐻= 𝑎𝑂𝐻𝑉 𝑎𝑂𝐻 (17)
(18)
Dengan,
𝐻3 𝑂𝑂𝐻 : konsentrasi larutan asam asetat sebelum adsorpsi, N 𝑉 𝐻3 𝑂𝑂𝐻 : volume larutan asam asetat yang dititrasi, ml
𝑎𝑂𝐻 : konsentrasi larutan NaOH untuk titrasi, N 𝑉 𝐻3 𝑂𝑂𝐻 : volume larutan NaOH untuk titrasi, ml
2. Menghitung nilai koefisien perpindahan massa (𝐾𝑐𝑎)
Nilai koefisien perpindahan massa dapat ditentukan dari persamaan (11) dan (13).
𝐾 ( 𝑎)
dengan Initial Condition : CA(z,0)=0
Boundary Condition : 1. CA(0,t)=Ca1
2. CA(z,∞)=Ca1
𝐾 ( 𝑎 𝑎)
dengan Initial Condition : Xa(z,0)=0 Boundary Condition : Xa(z,t)=f(Ca)
Dengan,
𝐾𝑐𝑎 : koefisien perpindahan massa overall, m3/(s.mol)
: kecepatan aliran larutan di dalam kolom, m3/s A : luas penampang kolom, m2
𝑎 : konsentrasi asam asetat dalam larutan, mol/m3 : konstanta kesetimbangan
14 𝑎 : konsentrasi asam asetat didalam padatan (arang aktif), mol/m3
(mol asam asetat di dalam padatan/volum bulk padatan dielemen volume)
Untuk menghitung 𝐾𝑐𝑎 diperlukan nilai .
2. Nilai ditentukan dengan :
(19)
Pada percobaan diperoleh 3 data, maka kecepatan aliran rata-rata :
(20)
Dengan,
V : volume larutan tertampung, ml t : waktu, detik
b. Perhitungan nilai Kca dan Ca* dilakukan dengan menggunakan bantuan program komputer. Dalam kasus ini kami lebih memilih untuk menggunakan program matlab. Algoritma perhitungan untuk penyelesaian program ini adalah:
1. Menyusun persamaan differential parsial menjadi persamaan untuk penyelesaian dengan metode eksplisit. Sehingga persamaan (13) akan menjadi:
𝑎( ) 𝑎( )
𝐾 ( 𝑎( ) 𝑎( ))
𝑎( )
𝐾
𝑐𝑎𝑎
(
)
(𝐾
𝑐𝑎) 𝑎
(
)
(21) Dengan cara yang sama maka persamaan (11) akan menjadi:( ) ( )
( ) ( )
𝐾
( 𝑎( ) 𝑎( ))
𝑎( ) ( 𝐾 ) 𝑎( ) 𝑎( ) 𝐾 𝑎(
)
(22)Dengan, I : inkremen jarak j : inkremen waktu
15 2. Men-trial nilai 𝐾 dan k
3. Menetapkan nilai awal untuk Ca dan Xa dengan memperhitungkan kondisi batas dan kondisi awal sistem. Untuk nilai Ca pada z=0 meter pada semua inkremen waktu akan bernilai Ca1. Sedangkan nilai Ca dan Xa pada t=0 sekon pada semua inkremen jarak akan bernilai 0 (karena belum terjadi proses penyerapan asam asetat dalam sestem).
4. Penyelesaian dari persamaan (21) dan (22) diselesaikan dengan metode eksplisit dan simultan.
5. Perhitungan dilakukan sampai semua nilai Ca pada titik h (atas menara) pada berbagai inkremen waktu diketahui. Nilai Ca yang didapat akan menjadi nilai Ca persamaan.
6. Nilai Ca persamaan akan dibandingkan dengan nilai Ca percobaan untuk perhitungan nilai Sum Square of Error sebagai berikut:
∑(| 𝑎 𝑐 𝑎𝑎 𝑎 𝑎 𝑎𝑎 |)
7. Jika nilai SSE telah memenuhi batas toleransi yang telah ditetapkan maka nilai trial 𝐾 dan k sudah sesuai. Namun jika nilai SSE masih besar maka nilai 𝐾 dan k di-trial lagi sampai menghasilkan nilai SSE yang sama dengan atau lebih kecil dari batas toleransi. Dalam meminimasi nilai SSE ini bisa menggunakan metode Hooke-Jeeves.
16
DAFTAR PUSTAKA
Coulson, J.M. and Richardson, J.F., 1987, “Chemical Engineering”, 3.ed., pp. 526-544, Pergamon Press, New York.
McCabe, W.C., Smith, J.C., and Harriot, P., 1985 “Unit Operation of Chemical Engineering”, 4.ed., PP.686-704, McGraw-Hill International, New York.
Oscik, J., 1991, “Adsorption”, Edition Cooper, pp. 128-129, John Wiley and Sons, New York. Perry, R.H., 1984, “Perry’s Chemical Engineers Handbook”, 6.ed., pp. 16.5-16.48, McGraw-Hill
International, New York.
Treybal, R.E., 1981, “Mass Transfer Operation”, 3.ed., pp. 106-111, 187, McGraw-Hill Book Co. Inc., New York 19
17 Disusun oleh
Nama NIM Tanda Tangan
Maulana Gilar Nugraha 10/300881/TK/36681
Muhammad Silvano Ibrahim Aiwan 10/302106/TK/37292
Ahmad Rizky Ramdani 10/301652/TK/37090
Rizky Chusnul Fadli 10/298041/TK/36539
Ilham Maulana 10/296355/TK/36115
Lembar Firdillah Kurniawan 10/296780/TK/36210
Yogyakarta, 23 Mei 2013
Dosen Pembimbing Praktikan Asisten
Dr. Ir. Edia Rahayuningsih M.S Tri Mayga Santoso
NIP. 19600730 198503 2 002
Mengetahui,
Koordinator Praktikum OTK
Prof. Ir. Wahyudi Budi Sediawan, SU., Ph. D.
18
LAPORAN SEMENTARA
LAJU ADSORBSI ASAM ASETAT DENGAN ARANG AKTIF PADA KOLOM PACKED BED
Nama: NIM: 1. 1. 2. 2. 3. 3. 4. 4. 5. 5. 6. 6. Hari, tanggal :
Asisten : Tri Mayga Santoso
a. Penentuan Normalitas asam oksalat
Suhu Percobaan : oC
Massa Asam Oksalat : gram
Volume Larutan Asam Oksalat : gram
Berat Molekul Asam Oksalat : gram
b. Penentuan Konsentrasi Larutan NaOH dengan asam oksalat
Normalitas larutan asam oksalat : N
Daftar I. Data Titrasi Larutan NaOH
No. Volume NaOH, ml Volume asam oksalat untuk Titrasi, ml
1. 2.
19
c. Penentuan Konsentrasi Larutan Asam Asetat Mula-mula
Normalitas larutan NaOH : N
Daftar II. Data Titrasi Larutan Asam Asetat Sebelum Adsorpsi
No. Volume Asam Asetat, ml Volume NaOH untuk Titrasi, ml 1.
2.
d. Data Percobaan untuk Pembuatan Kurva Standar
Daftar III. Data Percobaan Pengukuran Konduktivitas untuk Berbagai Konsentrasi Asam Asetat untuk Pembuatan Kurva Standar
No. Konsentrasi larutan asam asetat Konduktansi larutan asam asetat 1. 2. 3. 4. 5. 6. 7. 8. 9. 10.
20
e. Adsorpsi Asam Asetat pada Kolom Karbon Aktif
Luas Permukaan Kolom : cm2
Tinggi Kolom : cm
Daftar IV. Data Kalibrasi Aliran
No. Volume tertampung, ml Waktu, detik 1.
2. 3.
Daftar V. Data Percobaan Pengukuran Konduktivitas untuk Berbagai Konsentrasi Asam Asetat No. Waktu, Menit Konduktansi larutan asam asetat
1. 0 2. 3 3. 6 4. 9 5. 12 6. 15 7. 18 8. 21 9. 24 10. 27 11. 30