IV. HASIL DAN PEMBAHASAN
A. KARAKTERISTIK MINYAK IKAN
Karakterisasi minyak ikan meliputi karakteristik fisiko-kimia dan analisa komponen-komponen yang terkandung dalam minyak ikan. Karakteristik fisiko-kimia dilakukan melalui analisa bilangan asam, bilangan penyabunan, dan penentuan kadar asam lemak bebas. Sementara analisa komponen yang terkandung dalam minyak ikan dilakukan melalui analisa Gas Chromatography
Mass Spectrometry (GC-MS).
1. Sifat fisiko kimia minyak ikan
Hasil analisa karakterisasi minyak ikan dapat dilihat pada Tabel 7. Tabel 7. Karakterisasi bahan baku minyak ikan
Karakterisasi Nilai Rujukan
Bilangan asam 3,29 10,15a
Kadar asam lemak bebas (%) 1,49 4,6a Bilangan penyabunan 204,81 187,4a Sumber : a Celik (2002)
Berdasarkan Tabel 7 diatas, minyak ikan yang digunakan memiliki kualitas yang cukup baik, karena memiliki bilangan asam yang kurang dari 5. Menurut Wallace (1935), bilangan asam minyak ikan yang dapat digunakan proses pemurnian lebih lanjut harus kurang dari 5.
Berdasarkan analisa yang dilakukan Celik (2002), minyak ikan komersial memiliki bilangan asam 10,15 dengan kadar asam lemak bebasnya sebesar 4,6%. Berdasarkan hasil pengukuran analisa sifat fisiko kimia minyak ikan, bahan baku minyak ikan yang digunakan dalam penelitian ini memiliki bilangan asam sebesar 3,29 dengan kadar asam lemak bebasnya sebesar 1,49%. Dengan demikian, minyak ikan yang digunakan dalam penelitian memiliki kualitas yang baik dan layak digunakan sebagai bahan baku untuk hidrolisis enzimatik. Hal ini dikarenakan bahan baku minyak ikan masih berada dalam batas maksimal kandungan bilangan asam dan kadar asam lemak bebas pada minyak ikan komersial.
Menurut Ketaren (1996), bilangan asam menunjukkan ukuran jumlah asam lemak bebas. Menurut Ketaren (1986), kandungan asam lemak bebas terbaik adalah serendah mungkin (± 2 %). Tingginya bilangan asam pada minyak ikan mempengaruhi aktivitas katalitik enzim lipase pada reaksi hidrolisis.
Bilangan penyabunan menunjukkan banyaknya total asam lemak yang dapat dinetralkan oleh sejumlah alkali. Menurut Celik (2002), bilangan penyabunan minyak ikan komersial adalah 187,4. Namun, analisa bilangan penyabunan menunjukkan bahwa minyak mengandung total asam lemak sejumlah 204,81. Hal ini menunjukkan bahwa, minyak ikan yang digunakan dalam penelitian ini telah mulai teroksidasi. Hasil dari reaksi oksidasi minyak adalah senyawa keton atau aldehid. Kandungan senyawa lain dalam minyak seperti aldehid atau keton dalam minyak diduga dapat menyebabkan nilai bilangan penyabunan meningkat. Menurut Ketaren (1996), minyak yang memiliki bobot molekul tinggi akan memiliki jumlah bilangan penyabunan yang lebih rendah daripada minyak yang berbobot molekul rendah. Minyak ikan memiliki bobot molekul 903,01g/mol (Roberto et al., 2007) dengan bilangan penyabunan yang rendah yaitu 187,4 (Celik, 2002).
2. Komponen kimia di dalam minyak ikan
Asam lemak tak jenuh dalam minyak ikan merupakan komponen terbesar dalam minyak ikan. Asam lemak tak jenuh berkisar antara 75-90% dari total asam lemak yang ada dalam minyak (Celik, 2002). Komponen yang terkandung dalam minyak dapat diketahui melalui analisa Gas
Chromatography Mass Spectrometry (GC-MS). Analisa GC MS yang
dilakukan dalam penelitian ini adalah untuk mengetahui komposisi asam lemak dalam minyak ikan serta komponen lain yang terlarut dalam minyak ikan dari ikan sarden. Hasil dari analisa GC-MS dapat dilihat pada Tabel 8.
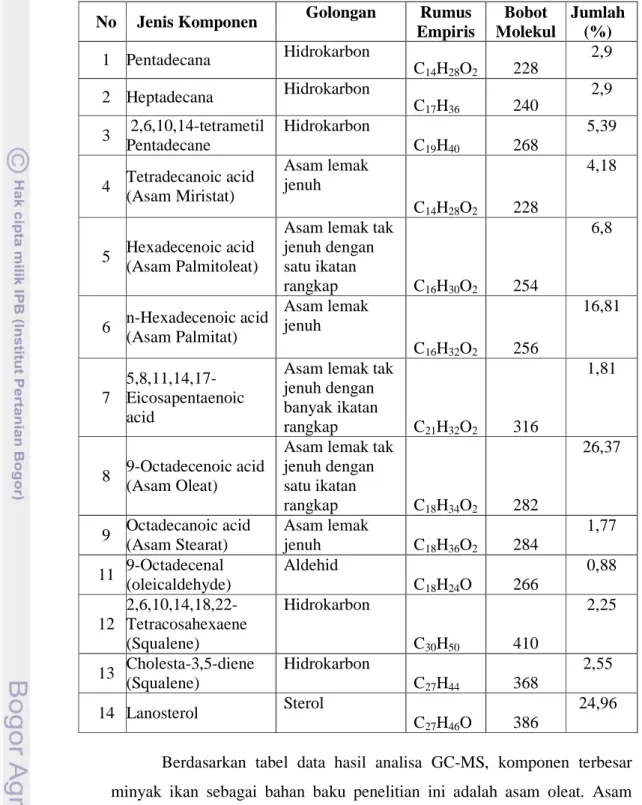
Tabel 8. Komponen kimia bahan baku minyak ikan
Berdasarkan tabel data hasil analisa GC-MS, komponen terbesar minyak ikan sebagai bahan baku penelitian ini adalah asam oleat. Asam lemak tak jenuh yang terdapat pada minyak ikan sebesar 34,98% dimana sebagian besar merupakan asam lemak tidak jenuh dengan satu ikatan rangkap (monounsaturated fatty acid) dengan presentase 33,17%, sedangkan asam lemak jenuh (saturated fatty acid) sebesar 22,76%, sisanya adalah No Jenis Komponen Golongan Rumus
Empiris Bobot Molekul Jumlah (%) 1 Pentadecana Hidrokarbon C14H28O2 228 2,9 2 Heptadecana Hidrokarbon C17H36 240 2,9 3 2,6,10,14-tetrametil Pentadecane Hidrokarbon C19H40 268 5,39 4 Tetradecanoic acid (Asam Miristat) Asam lemak jenuh C14H28O2 228 4,18 5 Hexadecenoic acid (Asam Palmitoleat)
Asam lemak tak jenuh dengan satu ikatan rangkap C16H30O2 254 6,8 6 n-Hexadecenoic acid (Asam Palmitat) Asam lemak jenuh C16H32O2 256 16,81 7 5,8,11,14,17- Eicosapentaenoic acid
Asam lemak tak jenuh dengan banyak ikatan rangkap C21H32O2 316 1,81 8 9-Octadecenoic acid (Asam Oleat)
Asam lemak tak jenuh dengan satu ikatan rangkap C18H34O2 282 26,37 9 Octadecanoic acid (Asam Stearat) Asam lemak jenuh C18H36O2 284 1,77 11 9-Octadecenal (oleicaldehyde) Aldehid C18H24O 266 0,88 12 2,6,10,14,18,22-Tetracosahexaene (Squalene) Hidrokarbon C30H50 410 2,25 13 Cholesta-3,5-diene (Squalene) Hidrokarbon C27H44 368 2,55 14 Lanosterol Sterol C27H46O 386 24,96
alkana (11,19%), aldehid (0,88%), squalene (4,8%), dan lanosterol (24,96%). Persentase perbandingan jumlah asam lemak tidak jenuh dan asam lemak jenuh menunjukkan bahwa minyak ikan sebagian besar tersusun dari asam lemak tak jenuh. Tingginya jumlah asam lemah tak jenuh, memungkinkan adanya oksidasi terhadap asam lemak tersebut. Komponen lain seperti oktadecenal yang terdapat dalam minyak ikan ini kemungkinan berasal dari oksidasi asam lemak tersebut. Hasil oksidasi tersebut adalah golongan aldehid, atau keton yang bereaksi dengan basa yang dapat meningkatkan bilangan penyabunan.
B. AKTIVITAS ENZIM
Aktitas enzim dinyatakan dalam Unit per gram enzim (U/g). Unit tersebut menunjukkan banyaknya mikromol asam lemak yang dihasilkan atau mikromol substrat yang digunakan dalam waktu 30 menit pada kondisi standar. Kondisi standar untuk pengukuran aktivitas enzim berdasarkan Sigma aldrich adalah suhu 35oC dan pH 7. Pengukuran aktivitas enzim dapat dilakukan dengan berbagai cara, salah satu diantaranya adalah dengan metode spektrofotometri. Pada metode spektrofotometri tersebut digunakan substrat paranitrofenil butirat. Pada dasarnya, substrat untuk perhitungan aktivitas lipase dengan metode spektrofotometri adalah paranitrofenil asil ester.
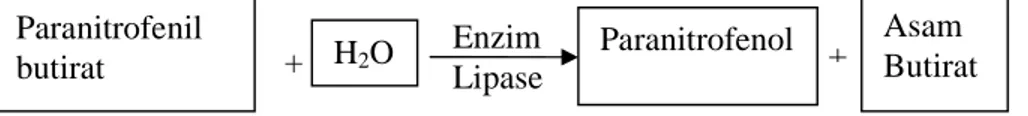
Dasar dari prosedur ini adalah lipase mempengaruhi secara umum aktivitas katalitik ikatan ester terhadap berbagai macam substrat karboksil ester. Substrat paranitrofenil asil ester dihidrolisis untuk menghasilkan asam lemak dan paranitrofenol. Paranitrofenol yang dihasilkan membawa warna kekuningan yang dapat terbaca pada panjang gelombang λ 400 nm sampai 410 nm.
Menurut Shirai et al. (1982) prinsip kerja katalitik enzim lipase terhadap substrat dapat dilihat pada Gambar 14.
Gambar 9. Mekanisme katalitik enzim lipase pada paranitrofenil butirat (Shirai
et al., 1982) + H2O Paranitrofenol + Paranitrofenil butirat Asam Butirat + Enzim Lipase
Metode perhitungan aktivitas enzim lipase Aspergillus niger pada penelitian ini menghitung banyaknya paranitrofenol yang dilepaskan setelah hidrolisis paranitrofenil butirat oleh lipase. Paranitrofenol yang dibebaskan akan berwarna kuning dan dapat terbaca pada spektrofotometer. Aktivitas lipase dihitung dengan membandingkan paranitrofenol yang dihasilkan dari pengukuran aktivitas enzim dengan kurva paranitrofenol standar pada nilai absorbansi sampel pada λ 410 nm. Berdasarkan perhitungan aktivitas lipase dengan metode spektrofotometri tersebut, diperoleh aktivitas lipase Aspergillus
niger Amano Pharmaceutical Manufacturing Co sebesar 7939,98 Unit/gram.
Menurut Amano Pharmaceutical Manufacturing Co aktivitas enzim lipase
Aspergillus niger yang tertera pada label kemasan adalah 12000U/g. Lebih
rendahnya hasil pengukuran aktivitas enzim lipase Aspergillus niger pada penelitian ini diduga dikarenakan kondisi lingkungan yang kurang sesuai selama penyimpanan atau pada saat distribusi sehingga mempengaruhi nilai aktivitasnya.
C. HUBUNGAN DERAJAT KEASAMAN DAN SUHU TERHADAP TINGKAT HIDROLISIS ENZIMATIK MINYAK IKAN
Reaksi hidrolisis merupakan yaitu pembentukan gliserol dan asam lemak bebas melalui pemecahan molekul trigliserida dengan penambahan air. Pada reaksi hidrolisis trigliserida, satu molekul trigliserida bereaksi dengan tiga molekul air untuk memproduksi satu molekul gliserol dan tiga molekul asam lemak bebas.
Selama ini, proses produksi asam lemak dilakukan dengan metode kimia atau fisik. Kamarudin et al. (2008) menyatakan, industri yang telah ada menghidrolisis minyak/lemak menjadi asam lemak dan gliserol pada suhu 250oC dan tekanan 50 bar. Pada kondisi ini, polimerisasi lemak akan terjadi. Dengan demikian asam lemak akan berwarna gelap dan terjadi pemucatan larutan gliserol. Selain itu, penerapan proses ini untuk aplikasi industri memerlukan biaya yang cukup besar dan investasi peralatan yang mahal.
Reaksi hidrolisis dapat dikatalisasi oleh asam, basa, dan enzim. Pemilihan katalis enzim pada reaksi hidrolisis lebih diutamakan untuk industri
pangan karena aman, membutuhkan peralatan yang sederhana, dan hanya mengkonsumsi energi yang relatif rendah (Kamarudin et al., 2008). Reaksi hidrolisis minyak atau lemak dapat menggunakan katalis enzim lipase.
Mekanisme pengikatan enzim terhadap substrat minyak diawali dengan pembentukan kompleks substrat-enzim. Hal ini dikemukakan oleh Michaelis Menten (Lehninger, 1982). Enzim bergabung dengan molekul substrat sebagai tahap yang harus dilalui dalam katalitik enzim. Enzim pertama-tama bergabung dengan molekul substrat dalam reaksi yang reversibel membentuk kompleks enzim-substrat (ES) dimana reaksi ini berlangsung dengan cepat. Kompleks ES kemudian terurai dalam reaksi reversibel kedua menghasilkan produk dan enzim dibebaskan. Mekanisme tersebut ditunjukkan pada Gambar 15.
Gambar 10. Mekanisme pembentukan kompleks substrat-enzim (Lehninger, 1982)
Aktivitas enzim dapat dilihat dari tinggi rendahnya tingkat hidrolisis enzim terhadap substrat minyak ikan untuk menghasilkan asam lemak bebas. Aktivitas enzim lipase dipengaruhi oleh faktor suhu dan derajat keasaman atau pH (Handayani, 2005). Faktor pengaruh suhu dan pH tersebut akan dibahas lebih lanjut karena berpengaruh pada tingkat hidrolisis enzim lipase terhadap minyak ikan.
1. Hubungan Derajat Keasaman (pH) dengan Tingkat Hidrolisis
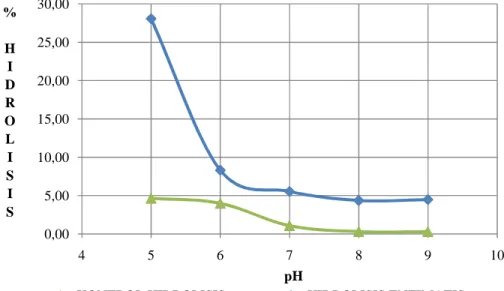
Data hubungan derajat keasaman dengan tingkat hidrolisis minyak ikan dapat dilihat pada Gambar 11. Pola pembentukan kurva seperti pada Gambar 11 membuktikan bahwa terdapat adanya pengaruh pH terhadap aktivitas hidrolisis enzim lipase terhadap substrat minyak ikan. Pada substrat minyak ikan, enzim lipase Aspergillus niger menunjukkan aktivitas katalisis optimum di pH 5. Hal ini menunjukkan bahwa, lingkungan asam sesuai untuk aktivitas enzim lipase Aspergillus niger. Enzim lipase dari kapang
Aspergillus niger memiliki titik isoelektrik 4,3 (Saxena et al., 2009). Pada
titik isoelektrik, kelarutan enzim dalam air sangat kecil. Hal ini menyebabkan aktivitas katalitiknya rendah, karena enzim dalam melakukan
E + S ES
aktivitas katalitik, membutuhkan air secukupnya. Air yang dibutuhkan digunakan sebagai pembentuk fleksibilitas struktur tiga dimensinya.
Gambar 11. Kurva hubungan tingkat hidrolisis dengan pH pada reaksi hidrolisis enzimatik, minyak ikan (4 gram), enzim (0,1 gram atau 800U), suhu reaksi (45oC), waktu reaksi (48 jam), buffer fosfat (0,1M)
Hasil yang diperoleh pada penelitian ini dimana enzim lipase
Aspergillus niger memiliki aktivitas katalitik tertinggi pada pH asam
didukung oleh beberapa penelitian sebelumnya. Menurut Saxena et al. (2009), optimasi produksi enzim lipase secara ekstraseluler oleh kapang
Aspergillus niger pada substrat minyak sawit adalah pada kondisi pH 5,6
dan suhu 25oC. Pada kondisi tersebut enzim lipase yang dihasilkan memiliki aktivitas spesifik 19 Unit/mg. Menurut Shahidi dan Wanasundara. (1998), enzim lipase Aspergillus niger melakukan katalitik pada pH optimum 5-7 pada substrat minyak sawit. Pada penelitian dengan substrat minyak ikan, enzim lipase melakukan katalitik optimal pada pH 5.
Pada penelitian ini, dimana reaksi hidrolisis dilakukan pada kondisi asam dan pada suhu 45 oC, menunjukkan aktivitas katalitis yang rendah. Hal ini dikarenakan enzim mengalami denaturasi. Denaturasi sisi aktif enzim dikarenakan ion H+ berikatan dengan NH3+ pada struktur asam amino protein membentuk –NH4. Proses pengikatan tersebut menyebabkan ikatan antara atom nitrogen dengan atom hidrogen lainnya terputus, sehingga
0,00 5,00 10,00 15,00 20,00 25,00 30,00 4 5 6 7 8 9 10 % H I D R O L I S I S pH
enzim terdenaturasi. Disisi lain, pada kondisi basa atau mendekati basa, enzim juga akan inaktif. Rusaknya struktur enzim ini dikarenakan pada kondisi tersebut gugus OH- dari lingkungan akan berikatan dengan ion H dari gugus COO- sisi aktif enzim membentuk H2O. Hal ini akan menyebabkan struktur enzim mengalami kerusakan.
2. Hubungan Suhu dengan Tingkat Hidrolisis
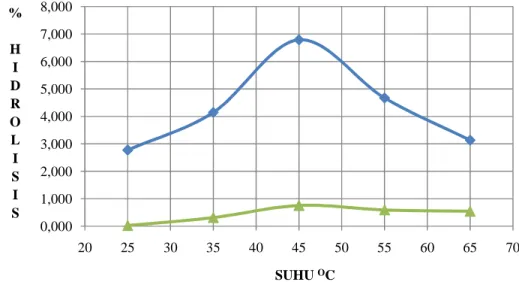
Data hubungan suhu reaksi dengan tingkat hidrolisis minyak ikan dapat dilihat pada Gambar 12.
Gambar 12. Kurva hubungan tingkat hidrolisis dengan suhu reaksi pada reaksi hidrolisis enzimatik, minyak ikan (4 gram), enzim (0,1 gram atau 800U), waktu reaksi (48 jam), buffer fosfat (0,1M) pH 7
Berdasarkan pola pembentukan kurva pada Gambar 12 membuktikan bahwa enzim lipase dapat melakukan katalitik optimum pada suhu 45oC. Semakin rendah suhu reaksi, semakin kecil asam lemak yang dihasilkan yang berdampak pada semakin rendahnya tingkat hidrolisis. Hal ini dikarenakan reaksi yang terjadi tidak berjalan optimal. Semakin tinggi suhu reaksi, asam lemak bebas yang dihasilkan setelah reaksi semakin kecil juga. Hal ini berakibat semakin rendah tingkat hidrolisis enzim lipase tersebut terhadap minyak ikan.
0,000 1,000 2,000 3,000 4,000 5,000 6,000 7,000 8,000 20 25 30 35 40 45 50 55 60 65 70 % H I D R O L I S I S SUHU OC
Suhu dapat berpengaruh positif terhadap reaksi hidrolisis maupun sebaliknya. Kenaikan suhu akan meningkatkan laju reaksi. Pada reaksi hidrolisis enzimatik, menurut Kamarudin et al. (2008), pada reaksi menggunakan suhu tinggi struktur tersier enzim terganggu akibat terjadi denaturasi. Padahal struktur tersier, sekunder, dan struktur primer enzim mempengaruhi aktivitas katalitiknya. Berdasarkan data, pada suhu 55oC dan 65oC nilai tingkat konversinya berubah menjadi lebih rendah, sedangkan suhu 45oC merupakan suhu dimana tingkat hidrolisis tertinggi enzim lipase terhadap ikatan ester terjadi. Pada suhu diatas 45oC tingkat konversi minyak menjadi asam lemak turun secara tiba-tiba dikarenakan enzim mengalami denaturasi.
Suhu berpengaruh terhadap kecepatan reaksi pembentukan produk (asam lemak bebas) dalam reaksi hidrolisis. Peningkatan suhu reaksi pada reaksi hidrolisis akan mempercepat kenaikan konsentrasi asam lemak bebas, memperbesar penurunan konsentrasi air, atau dengan kata lain menaikan hasil konversi. Hal ini disebabkan karena dengan naiknya suhu reaksi, maka suplai energi untuk mengaktifkan katalis dan tumbukan antar pereaksi untuk menghasilkan reaksi juga akan bertambah, sehingga produk yang dihasilkan menjadi lebih banyak. Nilai konstanta kecepatan reaksi (k) meningkat dengan kenaikan suhu reaksi. Hal ini sesuai dengan teori Arrhenius bahwa kenaikan suhu akan menaikkan nilai konstanta kecepatan reaksi, di mana kenaikan 10°C suhu reaksi menaikan konstanta kecepatan reaksi sebanyak 2 kali dari nilai awal.
Pada penelitian hidrolisis minyak ikan, setiap peningkatan suhu 10oC akan meningkatkan konsentrasi asam lemak bebas. Apabila suhu reaksi yang digunakan terlalu rendah maka laju reaksi berjalan lambat akibatnya tumbukan antar pereaksi rendah dan minyak tidak terhidrolisis secara sempurna. Dengan demikian, asam lemak bebas yang terbentuk juga rendah. Peningkatan suhu dari 25oC menjadi 35oC, akan meningkatkan nilai persentase hidrolisis sebesar 1,37%. Nilai persentase kenaikan tersebut adalah sebesar 49% dari persentase hidrolisis pada kondisi suhu 25oC. Pada peningkatan suhu dari 35oC menjadi 45oC akan meningkatkan nilai
persentase hidrolisis sebesar 2,64%. Nilai persentase kenaikan tersebut sebesar 63,7% terhadap nilai persentase hidrolisis pada kondisi suhu 35oC. Peningkatan persentase hidrolisis terjadi pada setiap kenaikan suhu. Persentase hidrolisis tersebut mencapai titik maksimum pada suhu 45oC reaksi. Pada hidrolisis enzimatik dengan substrat minyak ikan, suhu reaksi 45oC merupakan suhu optimal.
Pada suhu diatas suhu optimal, tingkat konversi asam lemak menjadi lebih rendah. Semakin tinggi suhu reaksi, semakin rendah pula tingkat konversi asam lemak yang terjadi. Pada kenaikan 10oC diatas suhu optimum yaitu pada suhu 55oC, tingkat hidrolisis enzimatik minyak ikan turun sebesar 2,1%. Persentase penurunan tersebut sebesar 45% dari nilai persentase hidrolisis pada suhu optimum. Pada kenaikan 10oC berikutnya yaitu suhu 65oC, tingkat hidrolisis enzimatik minyak ikan turun menjadi 1,54%. Persentase penurunan tersebut sebesar 49% dari nilai persentase hidrolisis pada kondisi suhu 55oC. Semakin rendahnya tingkat hidrolisis disebabkan karena terjadi denaturasi enzim pada suhu tinggi.
Enzim merupakan polipetida yang tersusun dari asam amino melalui ikatan kovalen membentuk struktur tiga dimensi. Suhu yang tinggi akan merusak struktur tiga dimensi dari enzim tersebut melalui pemutusan ikatan peptida yang membentuk struktur tiga dimensinya. Sementara, aktivitas katalitik enzim dipengaruhi oleh bentuk primer, sekunder, dan tersier dari enzim. Pada penelitian reaksi hidrolisis enzimatik pada suhu 55oC dan suhu 65oC, penurunan tingkat hidrolisis disebabkan karena denaturasi enzim oleh panas. Denaturasi ini dikarenakan berubahnya struktur tersier atau struktur tiga dimensi dari enzim lipase Aspergillus niger. Perubahan ini semakin berlanjut dengan semakin tingginya suhu reaksi hidrolisis. Oleh sebab itu, aktivitas katalitiknya semakin rendah pada setiap peningkatan suhu.
D. HUBUNGAN PENAMBAHAN AIR, DERAJAT KEASAMAN, DAN SUHU, TERHADAP TINGKAT HIDROLISIS ENZIMATIK MINYAK IKAN PADA MEDIA YANG DITAMBAHKAN HEPTANA
Enzim tersusun dari protein dimana pada suhu tinggi akan terdenaturasi. Termostabilitas enzim merupakan faktor utama dalam aplikasi enzim di Industri karena sifat thermo degradation yang dimiliki oleh enzim. Penelitian mengenai penggunaan enzim sebagai biokatalis berkembang, terutama dalam rangka peningkatan aktivitas atau stabilitas serta kemudahannya dalam hal pemisahan. Hal ini berhubungan dengan penurunan biaya produksi pada penggunaan enzim di industri. Oleh karena itu, dikembangkan rekayasa enzim untuk peningkatan aktivitas atau stabilitasnya dengan penambahan pelarut hidrofobik. Menurut Kim et al. (2004) penggunaan pelarut akan meningkatkan migrasi alkil pada sistem reaksi sekitar 18% selama selang waktu 24 jam. Penggunaan pelarut juga akan memudahkan proses pemisahan konsentrat dengan by productnya. Migrasi alkil ini terjadi dengan katalis enzim lipase dan dipengaruhi oleh banyaknya air, suhu, waktu reaksi, jumlah enzim, sistem reaksi, dan jenis reaktor. Menurut Zaverucke dan Wimmer (2008), hidrolisis enzimatik dipengaruhi oleh suhu, pH, konsentrasi subsrat, dan adanya senyawa penghambat, dan penambahan air.
1. Hubungan Penambahan Air dengan Tingkat Hidrolisis
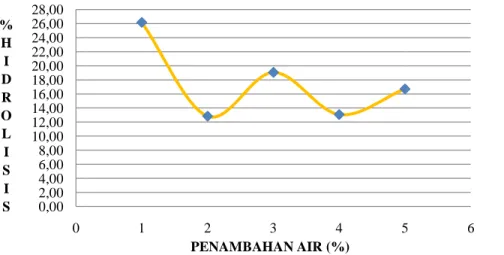
Data hubungan penambahan air dengan tingkat hidrolisis minyak ikan pada media yang ditambahkan pelarut heptana dapat dilihat pada Gambar 13.
Berdasarkan pola pembentukan kurva pada Gambar 13 membuktikan bahwa enzim lipase dapat melakukan katalitik optimum pada penambahan air 1% terhadap volume larutan. Jumlah air tersebut menunjukkan banyakya air yang dibutuhkan untuk melapisi satu layer molekul enzim. Dengan demikian, air yang dapat melapisi secara optimum membentuk satu layer melingkupi molekul enzim sebesar 1%.
Gambar 13. Kurva hubungan tingkat hidrolisis
penambahan air pada media yang ditambahkan pelarut heptana minyak ikan (4 gram), enzim (0,1 gram at
reaksi (48 jam), buffer fosfat (0,1M) pH 7
Gambar 14. Mekanisme katalisis enzim lipase regioselektif
niger 0,00 2,00 4,00 6,00 8,00 10,00 12,00 14,00 16,00 18,00 20,00 22,00 24,00 26,00 28,00 0 % H I D R O L I S I S
HIDROLISIS MINYAK IKAN
CH-O-C-R CH2-O-C-R CH2-O-C-R O O O
. Kurva hubungan tingkat hidrolisis enzimatik dengan
penambahan air pada media yang ditambahkan pelarut heptana minyak ikan (4 gram), enzim (0,1 gram atau 800U), waktu reaksi (48 jam), buffer fosfat (0,1M) pH 7, suhu reaksi (45
Gambar 14. Mekanisme katalisis enzim lipase regioselektif
niger pada media organik
1 2 3 4 5
PENAMBAHAN AIR (%)
HIDROLISIS MINYAK IKAN KONTROL HIDROLISIS
+
LIPASE-OH H2O RCOOH+
LIPASE-OH R R R CH2-O-C-R CH-O-C-R CH2-O-C-R O-OH O O dengan persentase penambahan air pada media yang ditambahkan pelarut heptana, au 800U), waktu , suhu reaksi (45oC)Gambar 14. Mekanisme katalisis enzim lipase regioselektif Aspergillus
5 6 KONTROL HIDROLISIS DIGLISERID A CH2-OH CH-O-C-R CH2-O-C-R O O
Schneider dan Berger (1991) menyatakan bahwa monoasilgliserol dan diasilgliserol cukup stabil terhadap migrasi alkil pada media organik dengan kadar air kurang dari 2%. Mekanisme katalitik enzim lipase regioselektif Aspergillus niger pada reaksi hidrolisis ditunjukkan oleh Gambar 14.
2. Hubungan Derajat Keasaman (pH) dengan Tingkat Hidrolisis
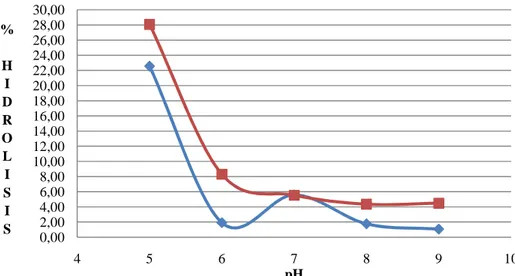
Data hubungan derajat keasaman dengan tingkat hidrolisis minyak ikan pada media yang ditambahkan pelarut heptana dapat dilihat pada Gambar 15.
Gambar 15. Kurva hubungan tingkat hidrolisis dengan pH pada reaksi hidrolisis enzimatik tanpa penambahan heptana dan reaksi hidrolisis enzimatik pada media yang ditambahkan heptana, minyak ikan (4 gram), enzim (0,1 gram atau 800U), waktu reaksi (48 jam), buffer fosfat (0,1M), suhu reaksi (45oC), kadar air (1%)
Berdasarkan pola pembentukan kurva pada Gambar 15, titik pH yang menghasilkan tingkat hidrolisis tertinggi pada reaksi hidrolisis enzimatik pada media yang ditambahkan heptana adalah pH 5. Hal ini sesuai dengan pernyataan Saxena et al. (2009) yang menyebutkan bahwa aktivitas katalitik enzim Aspergillus niger adalah pada kondisi asam pada substrat minyak.
0,00 2,00 4,00 6,00 8,00 10,00 12,00 14,00 16,00 18,00 20,00 22,00 24,00 26,00 28,00 30,00 4 5 6 7 8 9 10 % H I D R O L I S I S pH
HIDROLISIS ENZIMATIS DENGAN PENAMBAHAN HEPTANA HIDROLISIS ENZIMATIS TANPA PENAMBAHAN HEPTANA
Lingkungan asam sesuai untuk siklus hidup kapang Aspergillus niger serta sesuai untuk aktivitas katalitiknya. Terlihat juga pada percobaan Saxena et
al. (2009) dimana enzim lipase ekstraseluler dihasilkan pada kondisi asam
pada suhu mendekati suhu ruang. Pada pH 7, enzim mengalami peningkatan aktivitas. Hal ini menunjukkan bahwa terjadi peningkatan kestabilan sisi katalitik enzim lipase pada pH 7 apabila media reaksi ditambah heptana. Stauffer, E.D (1989) menyatakan bahwa perubahan pH akan mempengaruhi enzim. Perubahan ini dikarenakan protonasi atau deprotonasi grup ion pada sisi aktif atau pada kompleks substrat-enzim.
Data pada Gambar 15 membandingkan aktivitas enzim lipase
Aspergillus niger yang direpresentasikan melalui tingkat hidrolisis antara
hidrolisis enzimatik dengan hidrolisis enzimatik pada media yang ditambahkan heptana. Berdasarkan pola pembentukan kurva, pada setiap perlakuan pH yaitu pada pH 5, 6, 8, dan 9, aktivitas katalitik enzim lipase mengalami penurunan. Namun, pada pH 7, aktivitas katalitik enzim pada reaksi hidrolisis enzimatik minyak ikan yang ditambahkan heptana tidak mengalami perubahan dari hidrolisis enzimatik tanpa penambahan heptana. Penurunan tingkat hidrolisis ini disebabkan karena terjadi perubahan status ionisasi ketika heptana ditambahkan. Hal ini menunjukkan bahwa penambahan pelarut heptana yang cenderung hidrofobik akan menghambat sisi aktif enzim untuk melakukan katalitik ikatan ester pada triasilgliserol. Penghambatan terjadi karena perubahan status ionisasi enzim yang membuat salah satu asam amino enzim inaktivasi.
Tingginya kepolaran suatu pelarut organik tidak mempengaruhi tingginya aktivitas katalitik enzim. Hal ini terlihat pada data percobaan hidrolisis enzimatik pada substrat minyak ikan, penggunaan heptana sebagai media akan menurunkan tingkat hidrolisis dimana tingkat hidrolisis ini merepresentasikan aktivitas katalitik enzim terhadap substrat minyak ikan. Semakin tingginya kepolaran suatu media tidak berpengaruh nyata terhadap aktivitas katalitik enzim. Hal ini didukung oleh percobaan Kim et al. (2000) yang menyatakan bahwa pada reaksi esterifikasi trikaprilat dengan asam linoleat dengan menggunakan enzim lipase Rhizomucor miehei sebagai
katalis menghasilkan tingkat esterifikasi 57% pada media n-heksana dan 52% pada media isooktana. Padahal, kepolaran isooktana lebih tinggi daripada heksana. Isooktana memiliki nilai kepolaran 4,2 sedangkan n-heksana memiliki nilai kepolaran 3,5.
Kurva diatas juga menunjukkan tidak adanya perubahan aktivitas katalisis enzim pada media yang ditambahkan pelarut heptana pada pH 7 bila dibandingkan dengan hidrolisis enzimatik tanpa penambahan pelarut heptana. Dengan demikian, pada pH netral, enzim tidak akan mengalami penurunan aktivitas karena tidak terjadi perubahan status ionisasi pada struktur enzim. Hal ini sesuai dengan Medina et al. (2003) yang menyebutkan bahwa penambahan pelarut organik tidak mengubah stabilitas enzim terhadap berbagai pH.
3. Hubungan Suhu dengan Tingkat Hidrolisis
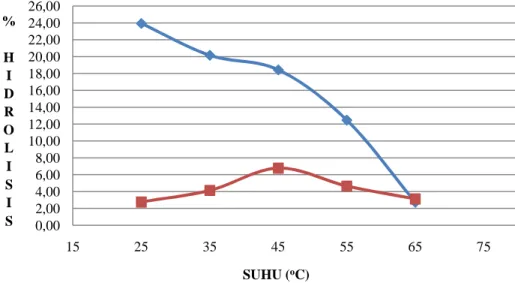
Data hubungan suhu dengan tingkat hidrolisis minyak ikan pada media yang ditambahkan pelarut heptana dapat dilihat pada Gambar 16.
Gambar 16. Kurva hubungan tingkat hidrolisis dengan suhu pada reaksi hidrolisis enzimatik dengan penambahan heptana dan pada reaksi hidrolisis enzimatik tanpa penambahan pelarut heptana, minyak ikan (4 gram), enzim (0,1 gram atau 800U), waktu reaksi (48 jam), buffer fosfat (0,1M) pH 7, kadar air (1%) 0,00 2,00 4,00 6,00 8,00 10,00 12,00 14,00 16,00 18,00 20,00 22,00 24,00 26,00 15 25 35 45 55 65 75 % H I D R O L I S I S SUHU (oC)
HIDROLISIS ENZIM DENGAN PENAMBAHAN HEPTANA HIDROLISIS ENZIM TANPA PENAMBAHAN HEPTANA
Berdasarkan data pada Gambar 16, diperoleh tingkat hidrolisis minyak ikan tertinggi untuk enzim lipase Aspergillus niger terhadap substrat minyak ikan dengan penambahan pelarut heptana adalah pada suhu 25oC. Pada suhu reaksi hidrolisis yang semakin meningkat, asam lemak bebas yang dihasilkan semakin rendah. Hal ini menunjukkan bahwa tingkat hidrolisis enzimatik minyak ikan pada pelarut organik semakin rendah seiring dengan peningkatan suhu reaksi.
Pelarut organik khususnya pelarut dengan nilai hidrofobitas yang tinggi (Log p>4) dapat mempertahankan konformitas bentuk enzim khususnya pada media non akueous. Penambahan pelarut organik merupakan salah satu cara dalam merekayasa enzim. Rekayasa enzim meliputi mengubah aktivitas dan stabilitasnya. Rekayasa enzim melalui media reaksi dapat meningkatkan termostabilitas enzim lipase. Hal ini terbukti dari perubahan sifat enzim lipase Candida cylindracea dari mesofilik menjadi termofilik (Gubicza, 2000). Penggunaan pelarut organik juga dapat mengubah aktivitas katalitik dari enzim lipase karena akan meningkatkan migrasi alkil. Migrasi alkil akan meningkat dengan penggunaan pelarut organik sebagai media (Kim et al., 2004)
Berdasarkan pembentukan pola kurva hidrolisis pada Gambar 16, terlihat bahwa penambahan pelarut heptana dapat meningkatkan stabilitas enzim dan meningkatkan aktivitas enzim. Aktivitas enzim lipase
Aspergillus niger pada reaksi hidrolisis enzimatik pada media tanpa
penambahan pelarut heptana memiliki tingkat hidrolisis tertinggi pada suhu 45oC. Namun, pada penambahan pelarut heptana sebagai media reaksi, suhu yang menghasilkan tingkat hidrolisis tertinggi berubah menjadi 25oC. Hal ini membuktikan bahwa dengan penambahan pelarut organik, terjadi pergeseran stabilitas enzim. Hal ini sesuai dengan Medina et al.,2003 yang menunjukkan bahwa stabilitas suhu meningkat dengan penambahan pelarut organik sebagai media reaksi. Pada penelitian hidrolisis enzimatik minyak ikan, penambahan heptana sebagai media reaksi meningkatkan stabilitas enzim terhadap suhu rendah.
Berdasarkan pola pembentukan kurva dan dengan membandingkan antara kurva hidrolisis enzimatik dengan kurva hidrolisis enzimatik dengan penambahan pelarut heptana, diketahui bahwa tingkat hidrolisis enzim pada media yang ditambahkan pelarut heptana memiliki aktivitas yang lebih tinggi. Hal ini diketahui dari tingkat hidrolisis yang lebih tinggi pada setiap perlakuan suhu. Pada perlakuan suhu 25oC, aktivitas enzim pada media yang ditambahkan pelarut heptana mengalami peningkatan 80% terhadap aktivitas enzim pada reaksi hidrolisis tanpa penambahan pelarut. Pada perlakuan suhu 35oC, penambahan pelarut heptana meningkatkan aktivitas sebesar 30%. Pada suhu 45oC dan 55oC, hidrolisis enzimatik dengan penambahan pelarut heptana meningkatkan aktivitas enzim sebesar 17% dan 16%. Namun, pada suhu 65oC, penambahan pelarut heptana tidak mengubah aktivitas. Hal ini dikarenakan pada suhu 65oC enzim telah terdenaturasi. Denaturasi enzim disebabkan suhu yang semakin tinggi akan menyebabkan terputusnya ikatan antar asam amino yang membentuk molekul tiga dimensi. Oleh sebab itu, dengan terputusnya ikatan tersebut, membuat struktur tiga dimensi enzim berubah. Berubahnya struktur tiga dimensi akan menyebabkan perubahan pada aktivitas katalitiknya. Berdasarkan fenomena ini, dapat dikatakan bahwa enzim lipase yang diproduksi oleh kapang Aspergillus niger mampu melakukan katalitik dan meningkatkan aktivitas katalitiknya dengan toleransi suhu hingga 65oC pada media reaksi yang ditambahkan pelarut heptana.
E. HUBUNGAN TINGKAT HIDROLISIS DENGAN KANDUNGAN TOTAL OMEGA-3
Asam lemak omega-3 merupakan asam lemak jenuh rantai panjang dengan ikatan rangkap pada atom karbon ketiga dan keempat dari gugus metil omega. Asam lemak omega-3 terdiri dari asam eikosapentanoat, asam eikosatetranoat, asam eikosatrienoat, asam dokosaheksanoat, asam heksadekatrienoat, asam oktadekatetranoat, asam oktadekatrienoat, asam dokosapentanoat, asam tetrakosanoat, asam tetrakosapentanoat.
Pengkayaan asam lemak omega enzimatik. Enzim lipas
merupakan enzim yang selektif terhadap ikatan ester
reaksi hidrolisis, enzim lipase akan memotong ikatan ester triasilgliserol pada posisi tersebut secara parsial menjadi monoasi
lemak. Penggunaan enzim yang bersifat regioselektif terhadap sn dikarenakan menurut Roberto
sn-1 dan sn-3 gliserol. Oleh sebab itu, digunakan enzim lipase ter mengkatalitik ikatan ester pada sn
lemak jenuh sehingga diperoleh asilgliserol yang kaya asam lemak tidak jenuh omega-3 pada sn-2 gliserol. Kemampuan enzim dalam memecah triasilgliserol menjadi monoasilg
tingkat hidrolisis.
Pada pembahasan ini akan dijelaskan lebih lanjut mengenai hubungan tingkat hidrolisis dengan persentase total omega
Hubungan tingkat hidrolisis enzimati
Omega-3 dibuat berdasarkan data pada Gambar 17.
Gambar 17. Kurva hubungan tingkat hidrolisis reaksi hidrolisis enzimatik
optimum faktor reaksi
800U), waktu reaksi (48 jam), buffer fosfat (0,1M) 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 minyak awal 0 P E R S E N T A S E
TINGKAT HIDROLISIS ENZIMATIS MINYAK IKAN
Pengkayaan asam lemak omega-3 dapat dilakukan dengan hidrolisis enzimatik. Enzim lipase yang diproduksi dari kapang Aspergillus niger merupakan enzim yang selektif terhadap ikatan ester sn-1 atau sn-3
reaksi hidrolisis, enzim lipase akan memotong ikatan ester triasilgliserol pada posisi tersebut secara parsial menjadi monoasilgliserol, diasilgliserol, dan asam lemak. Penggunaan enzim yang bersifat regioselektif terhadap sn
dikarenakan menurut Roberto et al. (2007), asam lemak jenuh berada pada posisi 3 gliserol. Oleh sebab itu, digunakan enzim lipase ter
mengkatalitik ikatan ester pada sn-1 dan sn-3 gliserol yang mengandung asam lemak jenuh sehingga diperoleh asilgliserol yang kaya asam lemak tidak jenuh 2 gliserol. Kemampuan enzim dalam memecah triasilgliserol menjadi monoasilgliserol, diasilgliserol dan asam lemak dinyatakan dalam
Pada pembahasan ini akan dijelaskan lebih lanjut mengenai hubungan tingkat hidrolisis dengan persentase total omega-3 hasil reaksi hidrolisis. Hubungan tingkat hidrolisis enzimatik minyak ikan dengan persentase total
3 dibuat berdasarkan data pada Gambar 17.
. Kurva hubungan tingkat hidrolisis dan asam eikosapentanoat reaksi hidrolisis enzimatik terhadap setiap perlakuan pada kondisi optimum faktor reaksi, minyak ikan (4 gram), enzim (0,1 gram atau 800U), waktu reaksi (48 jam), buffer fosfat (0,1M)
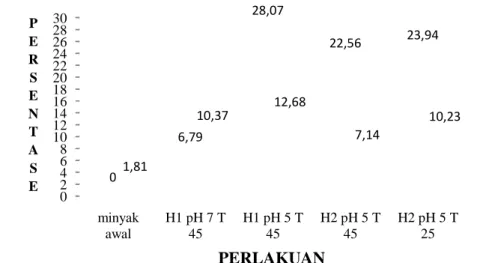
minyak awal H1 pH 7 T 45 H1 pH 5 T 45 H2 pH 5 T 45 H2 pH 5 T 25 0 6,79 28,07 22,56 23,94 1,81 10,37 12,68 7,14 10,23 PERLAKUAN
TINGKAT HIDROLISIS ENZIMATIS MINYAK IKAN
3 dapat dilakukan dengan hidrolisis
Aspergillus niger 3 gliserol. Pada
reaksi hidrolisis, enzim lipase akan memotong ikatan ester triasilgliserol pada lgliserol, diasilgliserol, dan asam lemak. Penggunaan enzim yang bersifat regioselektif terhadap sn-1 dan sn-3 (2007), asam lemak jenuh berada pada posisi 3 gliserol. Oleh sebab itu, digunakan enzim lipase tersebut untuk 3 gliserol yang mengandung asam lemak jenuh sehingga diperoleh asilgliserol yang kaya asam lemak tidak jenuh 2 gliserol. Kemampuan enzim dalam memecah triasilgliserol liserol, diasilgliserol dan asam lemak dinyatakan dalam
Pada pembahasan ini akan dijelaskan lebih lanjut mengenai hubungan 3 hasil reaksi hidrolisis. k minyak ikan dengan persentase total
dan asam eikosapentanoat pada terhadap setiap perlakuan pada kondisi yak ikan (4 gram), enzim (0,1 gram atau
H2 pH 5 T 25 23,94
10,23
Analisa GC MS dilakukan pada kondisi optimum pada reaksi hidrolisis enzimatik pada media yang ditambahkan pelarut heptana dan pada reaksi hidrolisis enzimatik pada media tanpa penambahan pelarut heptana. Pada penelitian ini diambil titik optimum faktor reaksi dari hasil reaksi hidrolisis dengan parameter optimum adalah tingkat hidrolisis yang tertinggi. Pada reaksi hidrolisis enzimatik tanpa penambahan pelarut heptana, titik optimum tersebut yaitu titik pH 5 dan suhu 45oC yang diperoleh dari perlakuan pH pada reaksi hidrolisis enzimatik dan pH 7 dan suhu 45oC yang diperoleh dari perlakuan suhu pada reaksi hidrolisis enzimatik. Kode H1 pH5 T45 menunjukkan perlakuan pH 5 dan suhu 45oC, sedangkan kode H1pH7 T45menunjukkan perlakuan pH 7 dan suhu 45oC. Analisa GC-MS untuk reaksi hidrolisis enzimatik pada media yang ditambahkan pelarut heptana juga mengambil titik optimum faktor reaksi dengan parameter optimum adalah tingkat hidrolisis. Titik optimum tersebut yaitu titik pH 5, penambahan air 1%, dan suhu 25oC yang diperoleh dari perlakuan suhu pada reaksi hidrolisis enzimatik serta pH 5, penambahan air 1%, dan suhu 45oC yang diperoleh dari perlakuan pH pada reaksi hidrolisis enzimatik tersebut. Kode H2 pH5 T45 menunjukkan perlakuan pH 5, penambahan air 1%, dan suhu 45oC, sedangkan kode H2 pH5 T25 menunjukkan perlakuan pH 5, penambahan air 1%, dan suhu 25oC.
Berdasarkan data Gambar 17, diketahui minyak awal telah mengandung EPA sebesar 1,81%. Reaksi hidrolisis sebagai salah satu upaya pengkayaan komponen omega-3 telah terbukti meningkatkan kandungan EPA pada konsentrat hasil reaksi. Hal ini dapat dilihat dari data pada Gambar 22, bahwa perlakuan suhu 45oC dan pH 5 dengan tingkat hidrolisis enzimatik 28,07%, kandungan EPA meningkat menjadi 12,68%. Peningkatan EPA pada perlakuan ini sebesar 10,87% dari kandungan asam eikosapentanoat minyak awal. Sementara itu, pada perlakuan suhu 45oC dan pH 7 dengan tingkat hidrolisis sebesar 6,79%, kandungan EPA sebesar 10,37%. Pada perlakuan ini, peningkatan omega-3 yang terjadi sebesar 8,56% dari kandungan minyak awal. Hal ini membuktikan bahwa, pada reaksi hidrolisis enzimatik, semakin tinggi tingkat hidrolisis, tidak menunjukkan peningkatan total asam eikosapentanoat
yang dihasilkan. Dengan demikian, berdasarkan hasil hidrolisis enzimatik tanpa penambahan pelarut heptana, pengkayaan EPA lebih baik dilakukan pada pH 5.
Gambar 18. Kurva hubungan tingkat hidrolisis reaksi hidrolisis enzimatik
optimum faktor reaksi
800U), waktu reaksi (48 jam), buffer fosfat (0,1M)
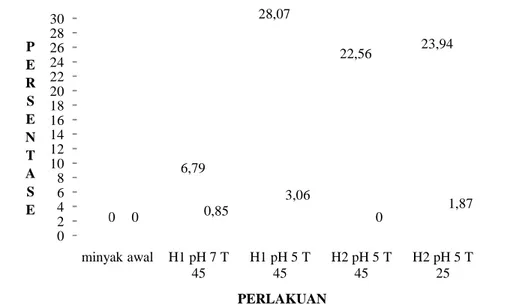
Berdasarkan data Gambar 18, diketahui minyak awal tidak mengandung DHA. Peningkatan kandungan DHA terjadi setelah minyak ikan dihidrolisis. Hal ini dapat dilihat dari data pada Gambar 18, bahwa perlakuan suhu 45
dengan tingkat hidrolisis enzimatik 28,07%, kandungan DHA meningkat menjadi 3,06%. Sementara itu, pada
tingkat hidrolisis sebesar 6,79%, kandungan DHA sebesar 0,85%. 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 minyak awal 0 P E R S E N T A S E
TINGKAT HIDROLISIS ENZIMATIS MINYAK IKAN
yang dihasilkan. Dengan demikian, berdasarkan hasil hidrolisis enzimatik tanpa penambahan pelarut heptana, pengkayaan EPA lebih baik dilakukan pada pH 5.
. Kurva hubungan tingkat hidrolisis dan asam dokosaheksanoat reaksi hidrolisis enzimatik terhadap setiap perlakuan pada kondisi optimum faktor reaksi, minyak ikan (4 gram), enzim (0,1 gram atau 800U), waktu reaksi (48 jam), buffer fosfat (0,1M)
Berdasarkan data Gambar 18, diketahui minyak awal tidak mengandung A. Peningkatan kandungan DHA terjadi setelah minyak ikan dihidrolisis. Hal ini dapat dilihat dari data pada Gambar 18, bahwa perlakuan suhu 45
dengan tingkat hidrolisis enzimatik 28,07%, kandungan DHA meningkat menjadi 3,06%. Sementara itu, pada perlakuan suhu 45oC dan pH 7 dengan tingkat hidrolisis sebesar 6,79%, kandungan DHA sebesar 0,85%.
minyak awal H1 pH 7 T 45 H1 pH 5 T 45 H2 pH 5 T 45 H2 pH 5 T 0 6,79 28,07 22,56 23,94 0 0,85 3,06 0 PERLAKUAN TINGKAT HIDROLISIS ENZIMATIS MINYAK IKAN
yang dihasilkan. Dengan demikian, berdasarkan hasil hidrolisis enzimatik tanpa penambahan pelarut heptana, pengkayaan EPA lebih baik dilakukan pada pH 5.
dan asam dokosaheksanoat pada terhadap setiap perlakuan pada kondisi , minyak ikan (4 gram), enzim (0,1 gram atau
Berdasarkan data Gambar 18, diketahui minyak awal tidak mengandung A. Peningkatan kandungan DHA terjadi setelah minyak ikan dihidrolisis. Hal ini dapat dilihat dari data pada Gambar 18, bahwa perlakuan suhu 45oC dan pH 5 dengan tingkat hidrolisis enzimatik 28,07%, kandungan DHA meningkat C dan pH 7 dengan H2 pH 5 T 25 23,94 1,87 DHA
Gambar 19. Kurva hubungan tingkat hidrolisis hidrolisis enzimatik
optimum faktor rea
800U), waktu reaksi (48 jam), buffer fosfat (0,1M)
Berdasarkan data Gambar 19, diketahui minyak awal dengan tingkat hidrolisis 0% telah mengandung komponen omega
hidrolisis sebagai sa
meningkatkan kandungan total omega
dapat dilihat dari data pada Gambar 19, bahwa perlakuan suhu 45 kandungan
omega-sebesar 28,07%. Peningkatan omega
kandungan omega-3 minyak awal. Sementara itu, pada perlakuan suhu 45 pH 7, kandungan omega
perlakuan ini, peningkatan omega
minyak awal. Hal ini membuktikan bahwa, pada reaksi hidrolisis enzimatik, semakin tinggi tingkat hidrolisis, semakin besar pula pengkayaan omega
terjadi.
Pada data yang ditunjukkan oleh Lampir
konsentrat hasil reaksi hidrolisis enzimatik pada kondisi optimum faktor reaksi 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 minyak awal 0 P E R S E N T A S E
TINGKAT HIDROLISIS ENZIMATIS MINYAK IKAN TOTAL OMEGA 3
. Kurva hubungan tingkat hidrolisis dan total
omega-hidrolisis enzimatik terhadap setiap perlakuan pada kondisi optimum faktor reaksi, minyak ikan (4 gram), enzim (0,1 gram atau 800U), waktu reaksi (48 jam), buffer fosfat (0,1M)
Berdasarkan data Gambar 19, diketahui minyak awal dengan tingkat hidrolisis 0% telah mengandung komponen omega-3 sebesar 1,81%. Reaksi hidrolisis sebagai salah satu upaya pengkayaan omega-3 telah terbukti meningkatkan kandungan total omega-3 pada konsentrat hasil reaksi. Hal ini dapat dilihat dari data pada Gambar 19, bahwa perlakuan suhu 45
-3 meningkat menjadi 17,51% dengan tingka
sebesar 28,07%. Peningkatan omega-3 pada perlakuan ini sebesar 15,7% dari 3 minyak awal. Sementara itu, pada perlakuan suhu 45
pH 7, kandungan omega-3 sebesar 16,89% dengan tingkat hidrolisis 6,79%. Pada ningkatan omega-3 sebesar 15,08% dari kandungan omega minyak awal. Hal ini membuktikan bahwa, pada reaksi hidrolisis enzimatik, semakin tinggi tingkat hidrolisis, semakin besar pula pengkayaan omega
Pada data yang ditunjukkan oleh Lampiran 7 yaitu pada data hasil analisa konsentrat hasil reaksi hidrolisis enzimatik pada kondisi optimum faktor reaksi
minyak awal H1 pH 7 T 45 H1 pH 5 T 45 H2 pH 5 T 45 H2 pH 5 T 25 0 6,79 28,07 22,56 23,94 1,81 16,89 17,51 7,14 10,48 PERLAKUAN
TINGKAT HIDROLISIS ENZIMATIS MINYAK IKAN TOTAL OMEGA 3
-3 pada reaksi terhadap setiap perlakuan pada kondisi , minyak ikan (4 gram), enzim (0,1 gram atau
Berdasarkan data Gambar 19, diketahui minyak awal dengan tingkat 3 sebesar 1,81%. Reaksi 3 telah terbukti 3 pada konsentrat hasil reaksi. Hal ini dapat dilihat dari data pada Gambar 19, bahwa perlakuan suhu 45oC dan pH 5, 3 meningkat menjadi 17,51% dengan tingkat hidrolisis 3 pada perlakuan ini sebesar 15,7% dari 3 minyak awal. Sementara itu, pada perlakuan suhu 45oC dan 3 sebesar 16,89% dengan tingkat hidrolisis 6,79%. Pada 3 sebesar 15,08% dari kandungan omega-3 minyak awal. Hal ini membuktikan bahwa, pada reaksi hidrolisis enzimatik, semakin tinggi tingkat hidrolisis, semakin besar pula pengkayaan omega-3 yang
an 7 yaitu pada data hasil analisa konsentrat hasil reaksi hidrolisis enzimatik pada kondisi optimum faktor reaksi
H2 pH 5 T 25 23,94
10,48
menggunakan GC-MS, terlihat asam lemak omega-3 yang terkandung dalam minyak awal adalah asam eikosapentanoat. Namun, pada hasil reaksi hidrolisis enzimatik asam lemak omega-3 meliputi metil heksadekatrienoat, metil dokosaheksanoat, metil eikosapentanoat, metil eikosatetranoat, dan metil oktadekatrienoat. Senyawa asam lemak tersebut merupakan bentuk turunan dari asam linoleat. Menurut Zaverucke dan Wimmer (2008), asam linoleat dapat berubah menjadi asam lemak C18 ω3 dan ω6, asam α-linolenat (ALA), asam γ-linolenat, sampai C20 (asam arachidonat, AA) dan asam dihomo-γ-linolenat melalui biosintetis pathway. Asam α-linolenat sendiri dapat berubah menjadi asam lemak omega-3 seperti asam eikosapentanoat (EPA) dan asam dokosaheksanoat (DHA). Mekanisme pathway metabolisme Polyunsaturated
Fatty Acids ditunjukkan oleh Gambar 20.
Gambar 20. Pathway metabolisme polyunsaturated fatty acid (Zaverucke dan Wimmer, 2008)
Berdasarkan data pada Gambar 17, diketahui bahwa pada hasil reaksi hidrolisis enzimatik pada media yang ditambahkan pelarut heptana pada perlakuan suhu 45oC dan pH 5, kandungan EPA sebesar 7,14% dari total jumlah asam lemak dalam konsentrat, dengan tingkat hidrolisis pada perlakuan ini sebesar 22,56%. Peningkatan EPA pada perlakuan ini sebesar 5,33% dari
kandungan EPA minyak awal. Sementara itu, pada perlakuan suhu 25oC dan pH 5, kandungan EPA sebesar 10,23% pada tingkat hidrolisis 23,94%. Pada perlakuan ini, peningkatan EPA sebesar 8,42% dari kandungan EPA minyak awal. Reaksi hidrolisis enzimatik dengan penambahan heptana terbukti mampu memperkaya kandungan asam eikosapentanoat.
Berdasarkan data pada Gambar 18, diketahui bahwa pada hasil reaksi hidrolisis enzimatik pada media yang ditambahkan pelarut heptana pada perlakuan suhu 45oC dan pH 5 dengan tingkat hidrolisis 22,56%, konsentrat hasil reaksi tidak mengandung DHA. Sementara itu, pada perlakuan suhu 25oC dan pH 5, dengan tingkat hidrolisis 23,94%, konsentrat mengandung DHA sebesar 1,87%.
Berdasarkan data pada Gambar 19, diketahui bahwa pada hasil reaksi hidrolisis enzimatik pada media yang ditambahkan pelarut heptana pada perlakuan suhu 45oC dan pH 5, kandungan omega-3 sebesar 7,14%, dengan tingkat hidrolisis pada perlakuan ini sebesar 22,56%. Peningkatan omega-3 pada perlakuan ini sebesar 5,33% dari kandungan omega-3 minyak awal. Sementara itu, pada perlakuan suhu 25oC dan pH 5, kandungan omega-3 sebesar 10,48% pada tingkat hidrolisis 23,94%. Pada perlakuan ini, peningkatan omega-3 sebesar 8,42% dari kandungan omega-3 minyak awal. Reaksi hidrolisis enzimatik dengan penambahan heptana terbukti mampu memperkaya kandungan omega-3. Namun, penambahan heptana sebagai media reaksi untuk reaksi hidrolisis enzimatik tidak meningkatkan persentase hidrolisis dan kandungan total omega-3 pada konsentrat hasil reaksi bila dibandingkan pada reaksi hidrolisis tanpa penambahan pelarut heptana.
Berdasarkan data pada Lampiran 7 yaitu pada data hasil analisa konsentrat hasil reaksi hidrolisis enzimatik pada kondisi optimum faktor reaksi menggunakan GC-MS, dan dengan membandingkan kandungan omega-3 hasil reaksi hidrolisis pada kondisi yang sama yaitu suhu 45oC dan pH 5 antara reaksi dengan penambahan pelarut heptana dan tanpa penambahan pelarut heptana, diperoleh konsentrat hasil hidrolisis untuk konsentrat hasil reaksi hidrolisis enzimatik tanpa penambahan pelarut heptana memiliki kandungan omega-3 yang lebih rendah daripada konsentrat hasil reaksi hidrolisis enzimatik pada media
yang ditambahkan pelarut heptana. Perbedaan kandungan total omega-3 pada kondisi pH 5 dan suhu 45oC tersebut sebesar 10,37%. Tingginya kandungan omega-3 pada konsentrat hasil reaksi hidrolisis tanpa penambahan pelarut heptana disebabkan karena tingkat hidrolisis yang lebih tinggi pula. Penambahan pelarut heptana pada reaksi hidrolisis enzimatik tidak meningkatkan aktivitas katalitik enzim. Hal ini kemungkinan dikarenakan kepolaran heptana yang terlalu besar (log p=4) tidak mendukung stabilitas enzim lipase tersebut pada reaksi hidrolisis. Pelarut heptana membuat struktur tiga dimensi enzim lipase berubah. Namun perubahan yang terjadi membuat aktivitas katalitik enzim lipase menurun. Semakin tinggi kepolaran media hidrofobik yang digunakan untuk media reaksi secara enzimatik tidak menentukan tingginya aktivitas lipolitik yang terjadi. Hal ini juga didukung oleh penelitian Kim et al. (2000) yang menunjukkan bahwa aktivitas lipolitik pada media n-heksana ternyata lebih tinggi daripada pada media isooktana. Padahal kepolaran isooktana lebih tinggi daripada n-heksana.