vi
Singkatan Nama Pemakaian pertama kali
pada halaman PAHs DBT MEOR ATP DMSO OD MB PP PCR MATH DNA GC/MS
Polycyclic Aromatic Hydrocarbon Dibenzothiophene
Microbial Enhance Oil Recovery Adenosin Tripospat
Dimethyl Sulfoxide Optical Density Marine Broth Polypepton
Polymerase Chain reaction
Micribial Adhesion to Hydrocarbon Dioxyribonucleotida
Gas Chromatography Mass Spectrophotometry 1 1 1 17 23 24 24 24 24 26 27 51 Simbol Arti λ Panjang Gelombang 24 v/v Volume/volume 24
µ Kecepatan Pertumbuhan Spesifik 25
vii
Halaman
HALAMAN SAMPUL i
HALAMAN JUDUL ii
HALAMAN PENGESAHAN iii
KATA PENGANTAR iv
DAFTAR SIMBOL DAN SINGKATAN vi
DAFTAR ISI vii
DAFTAR TABEL x
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xiii
INTISARI xiv ABSTRACT xv I. PENDAHULUAN A. Latar Belakang 1 B. Permasalahan 3 C. Tujuan 3 D. Manfaat 4
II. TINJAUAN PUSTAKA DAN HIPOTESIS A. TINJAUAN PUSTAKA 1. Komposisi Minyak Bumi 5
1.1. Hidrokarbon jenuh 5
1.2. Aromatik 6
1.3. Resins dan Asphaltenes 8
2. Pencemaran Minyak Bumi di Laut 9
3. Remediasi Pencemaran Minyak Bumi di Laut 12
3.1. Fisikawi 13
3.2. Kimiawi 14
3.3. Bioremediasi 15
4. Bakteri Laut Pendegradasi Hidrokarbon 15
viii
B. Deteksi Kemampuan Mikrobia Mendegradasi Crude Oil 22
C. Deteksi Kemampuan Mikrobia Mendegradasi PAHs 22
D. Uji Konfirmasi Kemampuan Mikrobia Mendegradasi Crude Oil 22
E. Isolasi dan Purifikasi Bakteri Pendegradasi Crude oil 23
F. Uji Konfirmasi Kemampuan Bakteri Mendegradasi PAHs dan Paraffin 23
G. Karakterisasi Pertumbuhan Isolat Bakteri pendegradasi phenanthrene, DBT, dan paraffin 1. Pertumbuhan pada Marine Broth dan Polypepton 24
2. Pertumbuhan pada phenanthrene, DBT, dan paraffin oil 24
H. Deteksi Aktivitas metabolisme Bakteri dengan Pengukuran Fosfat dan Amonium 25
I. Uji Microbial Adhesion to Hydrocarbon (MATH) 26
J. Karakterisasi dan Identifikasi Isolat Bakteri Pendegradasi Crude Oil, Phenanthrene, DBT, dan Paraffin 1. Pengecatan Gram 27
2. Identifikasi dengan kit API 20 NE 27
3. Sequencing 16S rRNA 28
IV. HASIL DAN PEMBAHASAN 1. Kemampuan Mikrobia dalam Sampel Mendegradasi Crude Oil 30
2. Isolasi Bakteri pendegradasi PAHs 31
3. Uji Konfirmasi Kemampuan Bakteri Pendegradasi PAHs dalam Mendegradasi Crude Oil 32
4. Isolasi dan Purifikasi Bakteri Pendegradasi Crude Oil 34
5. Uji Kemampuan Isolat Bakteri Mendegradasi Phenanthrene dan DBT 36
6. Uji Kemampuan Isolat Bakteri Mendegradasi Paraffin 37
7. Uji Konfirmasi Kemampuan Isolat Bakteri Mendegradasi Phenanthrene, DBT, dan Paraffin 38
8. Kurva Pertumbuhan Isolat Bakteri Terpilih dalam Medium Polypepton, Marine Broth, Medium yang Mengandung Phenanthrene, DBT, dan Paraffin 40
8.1. Kurva Pertumbuhan Isolat Bakteri Terpilih dalam Medium Polypepton dan Marine Broth 41
ix
8.3. Kurva Pertumbuhan Isolat Bakteri Terpilih dalam Medium
yang Mengandung DBT 44
8.4. Kurva Pertumbuhan Isolat Bakteri Terpilih dalam Medium yang Mengandung Paraffin 46
9. Parameter Kinetika Pertumbuhan isolat Bakteri dalam Medium yang mengandung Phenanthrene, DBT, dan Paraffin 48
10. Daya Adhesi Mikrobia Kepada Hidrokarbon / (MATH) Microbial Adhesion to Hydrocarbon 50
11. Karakterisasi dan Identifikasi Isolat Bakteri Terpilih 11.1. Morfologi Koloni, Morfologi Sel, dan Sifat Pengecatan Gram 53
11.2. Karakterisasi Isolat Bakteri dengan Kit API 20 NE 54
11.3. Identifikasi Bakteri dengan Metode Identifikasi Molekular Sequencing 16S rRNA. 55
V KESIMPULAN DAN SARAN A.KESIMPULAN 58
B. SARAN 58
DAFTAR PUSTAKA 59
x
Tabel Halaman 1. Beberapa Sifat dari Polycyclic Aromatic Hydrocarbon (PAHs) 7 2. Kasus Tumpahan Minyak di Perairan Indonesia 11 3. Kemampuan Mikrobia dari 6 macam fertilizer dalam membentuk
zona bening 30 4. Uji Konfirmasi Degradasi crude oil pada 6 macam fertilizer yang berbeda 33 5. Isolat Potensial Pendegradasi crude oil 35 6. Nilai µ dan g isolat Dn pada substrat yang berbeda dengan kadar NaCl 2% dan 5% 48 7. Kemiripan Bakteri Isolat Pulau Pari Berdasarkan Sequence 16S rRNA 56
xi
Gambar Halaman
1. Komposisi Crude Oil 5
2. Contoh Hidrokarbon Jenuh Pada Crude Oil 6
3. Berbagai Contoh Hidrokarbon Aromatik 7
4. Proses Mineralisasi yang Terjadi Pada PAHs 8
5. Struktur Molekul Asphaltenes 9
6. Proses yang Terjadi Pada Tumpahan Minyak di Laut 13
7. Mekanisme Molekul Surfaktan mengikat Crude oil 16
8. Mineralisasi Phenanthrene menjadi CO2 dan H2O pada Burkholderia cepacia F297 18
9. Biodesulfurisasi Dibenzotiophene oleh Rhodococcus erythropolis dalam keadaan aerobik 19
10. Jalur degradasi paraffin oleh Bakteri 20
11. Letak Wilayah Pulau Pari 21
12. Column Reactor 21
13. Metode Sublimasi PAHs 24
14. Pembentukan zona bening oleh mikrobia pada Hi-Control hari ke 7 (A) dan pada Super IB hari ke 7 (B) 31
15. Isolasi Bakteri Pendegradasi PAHs 32
16. Uji kemampuan bakteri dari Hi-control (A) dan Chitosan (B) dalam mendegradasi PAHs 34
17. Hasil isolasi dan purifikasi Isolat bakteri Dh (A) dan Duric (B) pendegradasi crude oil 36
18. Hasil degradasi Phenanthrene dan DBT oleh isolat bakteri 37
19. Degradasi paraffin padat pada Kontrol(A), Chitosan(B), dan Super IB(C) 38
20. Aktivitas emulsifikasi dari paraffin oleh Isolat Bakteri 38
21. Contoh Hasil Positif Isolat Bakteri Duric untuk degradasi Phenanthrene dengan Urea sebagai sumber N 39
22. Contoh Hasil Positif untuk degradasi DBT dengan Yeast Extract sebagai sumber N 39
23. Contoh Degradasi paraffin oleh isolat D5 dengan Yeast Extract sebagai sumber N 40
xii
25. Kurva Pertumbuhan Isolat Bakteri Dn pada medium yang mengandung
Phenanthrene dengan kadar NaCl 2% & 5% dan Suhu 30 °C 44
26. Kurva Pertumbuhan Isolat Bakteri Dn pada medium yang mengandung DBT dengan kadar NaCl 2% & 5% dan Suhu 30 °C 45 27. Kurva Pertumbuhan Isolat Bakteri Dn pada medium yang mengandung
Paraffin dengan kadar NaCl 2% & 5% dan Suhu 30 °C 46
28. Nilai MATH isolat Dn pada phenantrene(1), paraffin padat(2),
paraffin cair (3), dan glukosa(4) 50 29. Morfologi koloni (A) dan Hasil Pengecatan Gram (B) Isolat Bakteri Dn 54 30. Phylogenetic Tree Isolat Bakteri Terpilih 55
xiii
Lampiran Halaman
1. Hasil Uji Degradasi Paraffin (OD, pH, fosfat, amonium, dan nitrat) 63
2. Hasil Uji Degradasi Phenentrene dan DBT (OD, pH, fosfat, dan amonium) 64
3. Nilai OD, kandungan fosfat dan amonium pada medium yang mengandung phenanthrene, DBT, dan paraffin 65
4. Kurva Pertumbuhan pada Praperlakuan Isolat Dn pada medium ONR7a yang ditumbuhkan pada suhu 25°C (A), 30°C (B), dan 40°C (C) 66
5. Kurva Pertumbuhan Praperlakuan Isolat Dn pada medium ONR7 dengan kadar NaCl 2% (A), 5% (B), 10% (C), dan 20% (D) pada suhu 30°C 67
6. Persamaan Linier dari Kurva Pertumbuhan Isolat Dn Pada Medium Polypepton dan Marine Broth 68
7. Persamaan Linier dari Kurva Pertumbuhan Isolat Dn pada medium yang mengandung Phenanthrene, DBT, dan Paraffin 70
8. Kurva Standar Fosfat dan Amonium 72
9. Interpretasi Hasil Reaksi dengan Kit api 20 NE 73
10. Cara Pembuatan Medium ONR7a 74
11. Cara Pembuatan Medium Polypepton 74
12. Cara Pembuatan Medium Yang Mengandung Phenanthrene, DBT, dan Paraffin pada Uji Konfirmasi Pertumbuhan 75
13. Cara pembuatan Reagen Fosfat 75
14. Cara Pembuatan Reagen Amonium 76
15. Homologi Isolat bakteri terpilih berdasarkan sequence 16S rRNA & accession number 77
xiv
Oleh
DHAMA SUSANTHI
Fakultas Biologi Universitas Gadjah Mada
INTISARI
Dalam upaya untuk melakukan bioremediasi tumpahan minyak bumi dilakukan penelitian bakteri laut yang mampu mendegradasi komponen crude oil yaitu phenanthrene, DBT, dan paraffin. Sampel air laut Pulau Pari, DKI Jakarta diaklimasi dalam column reactor selama 2 bulan dengan 6 variasi fertilizer (Super IB, NH4NO3, Uric Acid, Hi-Control, Osmocoat, dan Chitosan). Kemudian sampel
bakteri diisolasi pada medium ONR7a padat yang ditambah dengan 100 µl crude oil. Bakteri potensial pendegradasi crude oil diisolasi dan dipurifikasi pada medium marine agar secara streak plate dan disubkultur. Enambelas isolat terpilih diuji kemampuan mendegradasi terhadap phenanthrene, DBT, dan paraffin. Isolat bakteri terpilih yaitu isolat Dn terbukti dapat mendegradasi ketiga komponen crude oil. Selanjutnya isolat bakteri tersebut diuji pertumbuhannya pada 5 macam medium yaitu marine broth, polypepton, medium yang mengandung phenanthrene, DBT, dan paraffin. Uji pertumbuhan dilakukan pada kadar NaCl 2% & 5% dengan suhu 30 °C serta rasio C/N/P = 100:20:3. Waktu generasi isolat Dn tercepat pada medium yang mengandung DBT dengan kadar NaCl 2% sebesar 3,029 jam. Sedangkan pada medium yang mengandung paraffin kadar NaCl 2% memerlukan waktu terlama yaitu 9,342 jam. Pengukuran adhesi hirokarbon kepada sel bakteri (MATH) menunjukkan bahwa nilai adhesi tertinggi pada substrat phenanthrene (89,23%). Berdasarkan karakterisasi morfologi koloni, morfologi sel, pengecatan gram, metode kit API 20 NE, diketahui bahwa isolat Dn berbentuk diplococcus, bersifat gram negatif, dan bersifat denitrifier. Identifikasi molekular sequencing 16S rRNA isolat Dn sangat mirip dengan sequence 16S rRNA Marinobacter hydrocarbonoclasticus VT8. Dapat disimpulkan bahwa isolat bakteri laut Pulau Pari cukup beragam dan terdapat bakteri yang mampu mendegradasi komponen crude oil.
Kata Kunci : Bakteri Laut Pulau Pari, Crude Oil, Phenanthrene, DBT, Paraffin, Bioremediasi.
xv
By
DHAMA SUSANTHI
Biology Faculty of Gadjah Mada University
ABSTRACT
This study concerns the degradation of crude oil components including phenanthrene, dibenzothiophene, ang paraffin by marine bacteria isolates Pari Island for bioremediation of spilled oil. Sea water from Pari Island, DKI Jakarta was acclimated in column reactor with 6 different kinds of fertilizer (Super IB, NH4NO3, Uric Acid, Hi-Control, Osmocoat, dan Chitosan). Enrichment cultures
were examined in ONR7a medium supplemented with 100 µl crude oil. Potensials bacteria that could degrade crude oil were isolated in marine agar with streak plate technique and purified. Sixteen selected isolates were tested for the ability to degraded phananthrene, dibenzothiophene, and paraffin. The isolate Dn was examine in marine broth medium, polypeptone medium, medium suplemented with phenanthrene, dibenzothiophene, and paraffin. Growth tests were done in NaCl 2% & 5% at 30 °C. The C/N/P rasio was set to be about 100:20:3. The generation time (g) of bacteria in medium supplemented with DBT in NaCl 2% was 3,029 h and the lowest generation time was 9,342 h when bacteria was growth in medium supplemented with paraffin in NaCl 2%. The cell hydrophobisity to hydrocarbon measured by MATH. The adhesion of cell to phenanthrene was 89,23%. The characteristics of isolate Dn were diplococcus, gram negative, and denitrifier bacteria based on morfology, gram stainning and API 20 NE analysis. Isolate Dn closely related to the 16S rRNA sequence of Marinobacter hydrocarbonoclasticus VT8. These observations suggest that marine bacteria of Pari Island were various in spesies and some bacteria could degrade the crude oil components.
Key Words : Marine Bacteria Isolates Pari Island, Crude Oil, Phenanthrene, DBT, Paraffin, Bioremediasi.
1
I. PENDAHULUAN
A. Latar Belakang
Minyak mentah (crude oil) merupakan bahan dasar untuk keperluan bahan bakar dan industri. Kegiatan eksplorasi, transportasi, dan distribusi minyak mentah terutama melalui lautan sering terjadi kebocoran (Sudrajad, 2006). Negara penghasil minyak bumi seperti Indonesia yang juga merupakan jalur transportasi kapal pengangkut minyak menambah resiko terjadinya oil spill tersebut. Oleh karena itu, tumpahan minyak di laut menjadi salah satu masalah yang serius karena mengakibatkan kerusakan lingkungan dan menimbulkan dampak negatif untuk organisme hidup termasuk manusia.
Minyak mentah terdiri dari banyak komponen penyusun. Menurut Cohen (2002) komponen penyusun minyak mentah dibagi dalam 4 kelompok yaitu hidrokarbon jenuh, aromatik, resins, dan aspalthenes. Salah satu komponen penyusun minyak mentah yaitu aromatik atau Polycyclic Aromatic Hydrocarbons (PAHs) merupakan salah satu komponen yang sulit terdegradasi dan berbahaya bagi makhluk hidup karena dapat terakumulasi dalam rantai makanan (Hughes et al., 2003). Komponen PAHs yang terkenal sulit terdegradasi dan bersifat toksik, mutagenik, dan karsinogenik ini adalah phenanthrene dan dibenzothiophene (Kasai et al., 2002).
Sulfur merupakan salah satu dari Polycyclic Aromatic Hydrocarbons (PAHs) dan merupakan komponen terbanyak ketiga dalam minyak mentah setelah asphalthenes dan wax (Minai-Tehrani & Heffatmanesh, 2007). Kandungan sulfur dalam minyak mentah ini bisa mencapai 0,05-5% (Van Hamme et al., 2003). Sulfur dalam minyak mentah biasanya ditemui dalam bentuk dibenzothiophene.Untuk menghilangkan sulfur dari crude oil dilakukan dengan hydrodesulfurisasi yang membutuhkan biaya yang relatif mahal. Oleh karena itu diperlukan metode biologis yang murah dan aman bagi lingkungan seperti biodesulfurisasi dengan menggunakan mikrobia.
Paraffin merupakan komponen minyak mentah dan termasuk dalam alkana rantai panjang. Degradasi paraffin sangat penting peranannya dalam bioremediasi khususnya bioremediasi in situ yang dikenal dengan MEOR (Microbial Enhance
Oil Recovery). Hal ini berkaitan dengan sifat minyak yang memiliki pour point tertentu yaitu tingkat temperatur yang mengubah minyak menjadi memadat atau berhenti mengalir sehingga penting dalam prediksi kelakuan minyak di air dan penetapan strategi pembersihan minyak (Mangkoedihardjo, 2005). Penelitian membuktikan bahwa bakteri pendegradasi paraffin dapat menurunkan pour point minyak mentah Limbadora dari 37°C menjadi 31°C sehingga memudahkan dalam recovery dan remediasi (Anonim, 2008a).
Ada 3 cara untuk remediasi pencemar yaitu secara fisikawi, kimiawi, dan bilogis Remediasi secara fisikawi dan kimiawi bersifat sementara dan tidak tuntas dalam menghilangkan minyak dari lingkungan. Remediasi secara kimiawi juga kurang efektif karena menambah beban lingkungan dengan bahan kimia yang diintroduksikan. Akan tetapi, remediasi secara biologis merupakan alternatif remediasi yang ramah lingkungan. Remediasi secara biologis atau yang lebih dikenal dengan bioremediasi ini merupakan teknologi yang menggunakan mikrobia untuk mengolah pencemar melalui mekanisme biodegradasi alamiah (intrinsic biodegradation) atau meningkatkan mekanisme biodegradasi dengan menambah mikrobia, nutrien, donor elektron atau akseptor elektron (enhanced bioremediation) (Anonim, 2008b). Tujuan utama bioremediasi adalah untuk menghilangkan kontaminan dalam lingkungan sehingga dapat mengurangi dampak negatif terhadap lingkungan (Bonner et al., 1997).
Sebagai usaha untuk meningkatkan bioremediasi di perairan Indonesia, perlu adanya pencarian mikrobia lokal yang berpotensi tinggi untuk mendegradasi pencemar. Bioremediasi secara umum menggunakan mikrobia yang diisolasi dari lingkungan terkontaminasi dengan penambahan growth factor, nutrien, donor elektron atau akseptor elektron dan hal ini telah dilakukan pada operasi skala besar untuk bioremediasi oil spill Exxon Valdez di Alaska (Cohen, 2002). Akan tetapi penggunaan bakteri introduced untuk bioremediasi jarang diterapkan. Beberapa ilmuwan menganggap bahwa penggunaan indigenous bakteri lebih unggul dari pada bakteri introduced. Oleh karena itu, diperlukan penelitian tentang potensi bakteri introduced dalam mendegradasi crude oil dan komponen penyusunnya yang sulit terdegradasi yaitu phenanthrene, dibenzothiophene, dan paraffin.
B. Permasalahan
Keragaman dan potensi bakteri laut dalam mendegradasi crude oil, phenanthrene, dibenzothiophene, dan paraffin belum banyak diketahui dan terus digali. Rahardito (2007) berhasil mengisolasi bakteri laut Pulau Pari yang dapat mendegradasi phenanthrene dengan menggunakan tambahan sumber N dan P. Oleh karena itu, masalah dalam penelitian ini adalah :
1. Apakah bakteri laut Pulau Pari yang telah diaklimasi selama 2 bulan dalam column reactor dengan 6 variasi fertilizer yaitu Super IB, Chithosan, Osmocoat, Hi-Control, NH4NO3, dan Uric acid mampu mendegradasi
komponen crude oil yaitu phenanthrene, DBT, dan paraffin ?.
2. Apakah faktor yang mempengaruhi degradasi crude oil, phenanthrene, DBT, dan paraffin ?.
3. Apakah variasi salinitas mempengaruhi pertumbuhan biomassa, konsumsi N dan P dan degradasi crude oil, phenanthrene, DBT, dan paraffin ?.
4. Bagaimana keanekaragaman bakteri yang dapat mendegradasi crude oil, phenanthrene, DBT, dan paraffin ?.
C. Tujuan
Tujuan penelitian tentang teknik bioremediasi ini adalah :
1. Memperoleh bakteri potensial pendegradasi crude oil, phenenthrene, DBT, dan paraffin dari air laut Pulau Pari yang diaklimasi dalam column reactor dengan variasi fertilizer yaitu Super IB, Chithosan, Osmocoat, Hi-Control, NH4NO3,
dan Uric acid.
2. Mengoptimalkan degradasi phenanthrene, DBT, dan paraffin oleh bakteri terseleksi dalam skala laboratorium.
3. Mengetahui karakteristik morfologis dan fisiologis bakteri pendegradasi phenanthrene, DBT, dan paraffin.
D. Manfaat
Penelitian ini diharapakan dapat bermanfaat untuk :
1. Menyumbang informasi ilmiah untuk penerapan bioaugmentasi di lapangan. 2. Pemanfaatan kekayaan mikrobia asli Indonesia terutama bakteri introduced
5
II. TINJAUAN PUSTAKA DAN HIPOTESIS
A. TINJAUAN PUSTAKA
1. Komposisi Minyak Bumi
Minyak bumi merupakan sumber daya alam yang tidak dapat diperbaharui karena proses pembentukannya yang membutuhkan waktu yang sangat lama. Minyak bumi juga dikenal mengandung berbagai macam komponen yang toksik bagi organisme hidup dan lingkungan. Minyak mentah (crude oil) adalah cairan coklat kehijauan sampai hitam. Minyak mentah tersusun dari hidrokarbon yang komplek. Menurut Hunt (1996), hidrokarbon dalam minyak mentah tersusun dari hidrogen dan karbon. Menurut (Putra, 2008), minyak bumi memiliki campuran senyawa hidrokarbon sebanyak 50-98%, sisanya terdiri atas zat-zat organik yang mengandung belerang, oksigen, dan nitrogen serta senyawa-senyawa anorganik seperti vanadium, nikel, natrium, besi, aluminium, kalsium, dan magnesium.
Gambar 1. Komposisi Crude Oil (Aske, 2001).
Secara garis besar, menurut Aske (2001) crude oil dibedakan menjadi 4 kelompok yaitu hidrokarbon jenuh, aromatik, resin, dan asphaltenes (Gambar 1). 1.1. Hidrokarbon Jenuh
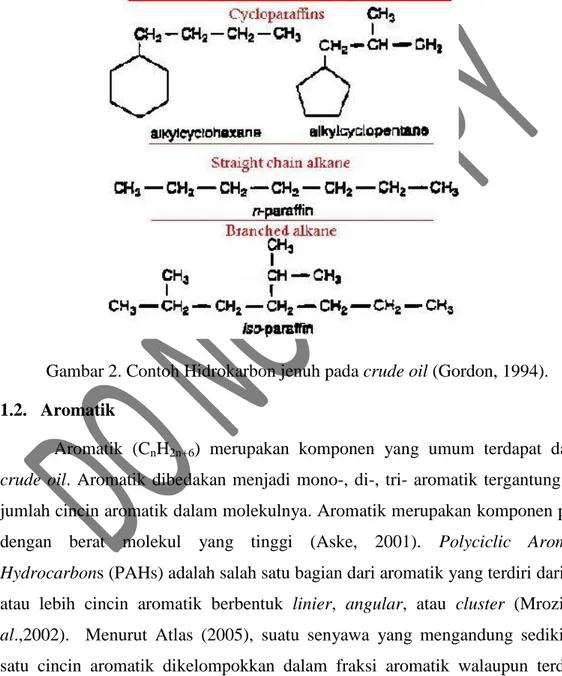
Hidrokarbon jenuh atau aliphatik adalah hidrokarbon non polar tanpa ikatan rangkap (Gambar 2). Hidrokarbon jenuh yang termasuk dalam kelompok ini adalah n-paraffin, cyclic paraffin, dan alycyclic hidrokarbon (cyclo paraffin) (Aske, 2001). Hidrokarbon berantai lurus / alkana (CnH2n+2) yang terdapat dalam
crude oil mencapai 15-20%, salah satunya berupa paraffin (Atlas et al., 1972). Di alam jumlah senyawa yang tergolong dalam isoparaffin lebih banyak daripada n-paraffin. Tetapi dalam minyak bumi mentah (crude oil) n-paraffin lebih banyak daripada isoparaffin (Putra, 2008). Paraffin akan mengalami presipitasi menjadi bentuk padat pada temperatur rendah dan mempengaruhi stabilitas emulsi dari crude oil (Aske, 2001).
Gambar 2. Contoh Hidrokarbon jenuh pada crude oil (Gordon, 1994). 1.2. Aromatik
Aromatik (CnH2n+6) merupakan komponen yang umum terdapat dalam
crude oil. Aromatik dibedakan menjadi mono-, di-, tri- aromatik tergantung dari jumlah cincin aromatik dalam molekulnya. Aromatik merupakan komponen polar dengan berat molekul yang tinggi (Aske, 2001). Polyciclic Aromatic Hydrocarbons (PAHs) adalah salah satu bagian dari aromatik yang terdiri dari dua atau lebih cincin aromatik berbentuk linier, angular, atau cluster (Mrozik et al.,2002). Menurut Atlas (2005), suatu senyawa yang mengandung sedikitnya satu cincin aromatik dikelompokkan dalam fraksi aromatik walaupun terdapat gugus lain seperti dibenzothiophene (C12H8S).
PAHs terdiri dari bay region dan K-region (Mrozik et al., 2002). Phenanthrene (C14H10) merupakan contoh dari hidrokarbon aromatik yang
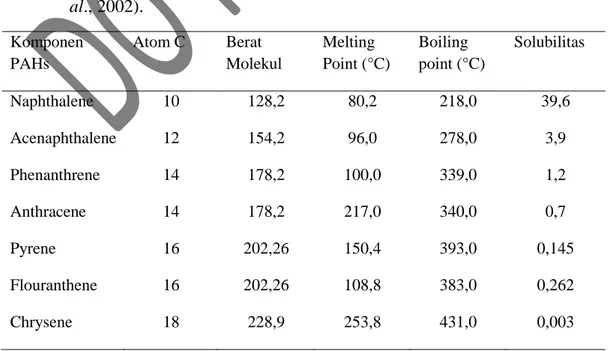
mengandung daerah tersebut (Gambar 3). Bay region pada phenanthrene terdapat diantara atom karbon nomor 4 dan 5, sedangkan K region pada 9,10 ikatan rangkap dengan kandungan elektron yang tinggi (Mrozik et al.,2002). Daerah K merupakan daerah yang lebih karsinogenik daripada rantai hidrokarbonnya (Irwin, 1997). Menurut Van Hamme et al. (2003), PAHs terdiri dari dua kelompok besar yaitu Low malecular PAHs dengan 2 atau 3 cincin lebih volatile, soluble daripada high molecular weight (4 cincin atau lebih). Selain itu PAHs juga mempunyai berat molekul dan titik didih yang bervariasi (Tabel 1).
Gambar 3. Contoh Hidrokarbon Aromatik (Mrozik et al.,2002). Tabel 1. Beberapa sifat dari Polycilic Aromatic Hydrocarbon (PAHs) (Mrozik et
al., 2002). Komponen PAHs Atom C Berat Molekul Melting Point (°C) Boiling point (°C) Solubilitas Naphthalene 10 128,2 80,2 218,0 39,6 Acenaphthalene 12 154,2 96,0 278,0 3,9 Phenanthrene 14 178,2 100,0 339,0 1,2 Anthracene 14 178,2 217,0 340,0 0,7 Pyrene 16 202,26 150,4 393,0 0,145 Flouranthene 16 202,26 108,8 383,0 0,262 Chrysene 18 228,9 253,8 431,0 0,003
Aromatik dengan 5 cincin atau lebih sulit terdegradasi dan persisten di lingkungan untuk waktu yang lama. Mikrobia dapat menggunakan PAHs dan mengubahnya menjadi komponen yang tidak berbahaya. PAHs akan diubah menjadi CO2 dan H2O melalui proses mineralisasi (Sikemma et al., 1995).
Pertama kali PAHs akan mengalami ortho atau meta cleveage dengan terbukanya cincin aromatik, selanjutnya proses tersebut diakhiri dengan terbentuknya Acetyl Co A atau asam pyruvat (Gordon, 1994). Secara umum, mineralisasi ini melibatkan proses karboksilasi, hidrasi, dan pemutusan cincin (Gambar 4).
Gambar 4. Proses mineralisasi yang terjadi pada PAHs (Sikemma et al., 1995). 1.3. Resins dan Asphalthenes
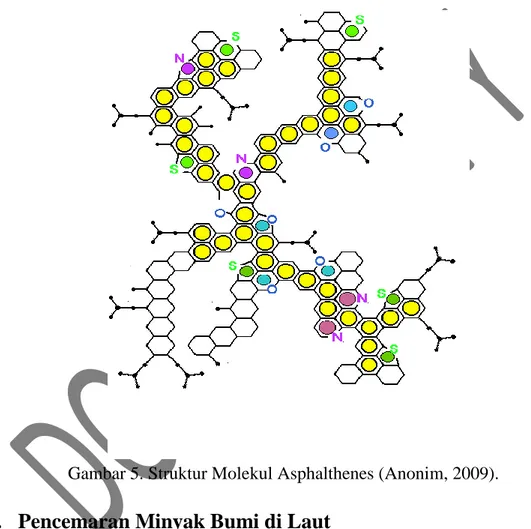
Resins merupakan salah satu hidrokarbon aromatik dengan high molecular weight yang tersusun oleh heteroatom seperti nitrogen, oksigen, atau sulfur (Kim et al., 1996). Resins dapat larut dalam pentana dan heptana tetapi tidak larut dalam propana (Aske, 2001). Struktur dari resins hampir sama dengan aspalthene tetapi berat molekulnya lebih rendah. Ada yang menyebutkan bahwa Aasphalthenes terbentuk dari oksidasi resins (Anonim, 2009). Sehingga antara
resins dan asphalthenes sulit untuk dipisahkan. Akan tetapi secara fisio kimiawi antara resins dan asphalthenes berbeda. Asphaltene merupakan komponen penyusun crude oil yang dapat larut dalam pelarut aromatik seperti toulena dan benzene, sedangkan fraksi asphaltenes terdiri dari heteroatom (O, S, N) dan konstituen organometalik (Mi, V, Fe) dalam crude oil (Aske, 2001). Pada suhu 300-400°C, asphalthenes tidak melebur tetapi terdekomposisi menjadi karbon dan komponen yang volatile serta tidak dapat terkristalisasi (Anonim, 2009).
Gambar 5. Struktur Molekul Asphalthenes (Anonim, 2009).
2. Pencemaran Minyak Bumi di Laut
Indonesiamerupakan negara kepulauan yang diapit oleh dua benua dan dua samudera. Hal ini menjadikan Indonesia sangat strategis untuk transportasi dan jalur perdagangan melalui lautan. Kapal-kapal pengangkut minyak keluar masuk perairan Indonesia yang menyebabkan negara ini rentan terhadap pencemaran di laut. Tumpahan minyak di laut (oil spill) telah berdampak pada pencemaran multidimensi bagi makhluk hayati laut, usaha perikanan, usaha turisme, sampai kepada tingkat kerusakan laut (Mangkoedihardjo, 2005).
Sumber tumpahan minyak di laut berasal dari berbagai aktivitas yang berhubungan dengan pengalian dan transportasi minyak. Menurut Sudrajad (2006), sumber tumpahan minyak di laut ini berasal dari kecelakaan kapal tanker pengangkut minyak, operasi kapal di laut, dan berdirinya bangunan pengeboran minyak di lepas pantai. Kasus tumpahan minyak di perairan Indonesia sangat memprihatinkan. Mulai tahun 1975-2005 saja telah terjadi banyak kasus tumpahan minyak yang menyebabkan kerusakan di perairan Indonesia (Tabel 2).
Polusi tumpahan minyak di laut menjadi pusat perhatian masyarakat luas. Badan dunia Group of Expert on Scientific Aspect of Marine Pollution (GESAMP) mencatat sekitar 6,44 juta ton pertahun hidrokarbon masuk ke dalam perairan laut dunia melalui transportasi laut 4,63 juta ton/tahun, pengeboran lepas pantai 0,18 juta ton/tahun dan industri serta pemukiman 1,38 juta ton/tahun (Sudrajad, 2007). Sander et al. (1980) cit Griffith et al. (1981) mengatakan bahwa minyak mentah dengan kualitas no.2 dapat bertahan pada sedimen laut sampai 5 tahun. Oleh karena itu dapat dibayangkan efek toksik yang dapat ditimbulkan pada ekosistem laut.
Batas toleransi minyak terhadap air laut berkisar antara 0,001-0.01 ppm dan apabila melebihi ambang batas tersebut maka bau minyak mulai muncul (Misran, 2002). Akibat yang ditimbulkan dari tumpahan minyak di laut sangat merugikan bagi organisme hidup dan lingkungannya. Penelitian tentang efek jangka panjang crude oil pada Kasitsna Bay menunjukkan bahwa setelah terjadi tumpahan minyak selama 1,5 dan 5 bulan, ada penurunan signifikan (36 dan 46%) konsentrasi bakteri dalam sediment (Griffiths et al., 1981). Padahal bakteri sangat penting peranannya dalam rantai makanan dan akan mempengaruhi tingkat trofik yang lebih tinggi. Salah satu kasus pencemaran minyak yang cukup tragis adalah kasus pecahnya kapal tanker Torrey canyon yang mengakibatkan matinya 10.000 ekor burung di sepanjang pantai dan 30.000 ekor burung tergenang dalam tumpahan minyak (Misran, 2002).
Tabel 2. Kasus tumpahan minyak di perairan Indonesia (Sudrajad, 2006).
No. Tahun Lokasi Keterangan
1 1975 Selat Malaka Kapal Tanker Showa Maru kandas, minyak
tumpah 1 juta barel solar
2 Januari 1975 Selat Malaka Tabrakan Kapal Isogawa Marui dan Silver
Palace
3 Desember 1979 Pelabuhan
Buleleng Bali
Kecelakaan Kapal Choya Maru, tumpah 300 ton bensin
4 Februari 1979 Selat Malaka Minyak tanah 1500 kilo tumpah
5 September 1992 Selat Malaka Tabrakan Tanker menumpahkan 13000 ton
minyak
6 Januari 1996 Selat Malaka Kapal Tanker Navigator kandas
7 April 1994 Pelabuhan
Cilacap
Terjadi tabrakan antar kapal tanker
8 1998 Natuna Kapal KM Batamas II memuat MFO
tenggelam
9 Oktober 1997 Selat
Singapura
Tabrakan Kapal Tanker
10 1998 Tanjung
Priok
Kandasnya kapal Pertamina yang memuat solar
11 1999-2000 Cilacap Minyak tumpah 4000 barel
12 Oktober 2000 Batam Kapal MT Natuna Sea kandas dan
menumpahkan 4000 barel
13 2001
Tegal-Cirebon
Kapal Tanker tenggelam dan limbah minyak tumpah 1200 ton
14 2003-2005 Kepulauan
seribu
Tergenangnya tumpahan minyak
15 Juli 2003 Palembang Sungai Musi tercemar 363 kiloliter IDF
16 Juli 2004 Kep. Riau Limbah minyak tumpah sebanyak 200 ton
17 September 2004 Cilacap Syris Crude oil tumpah sebanyak 8000 barel
dan menyebar sejauh 5 km sepanjang pantai
18 Oktober 2004 Pantai
Indramayu
Tumpahan minyak mentah Pertamina
merusak terumbu karang
19 2004 Balikpapan Tumpahan minyak oleh perusahaan Total
E&P
20 Agustus 2005 Teluk Ambon Kapal ikan MV Fu Yuan Fu F88 dan
3. Remediasi Tumpahan Minyak Bumi di Laut
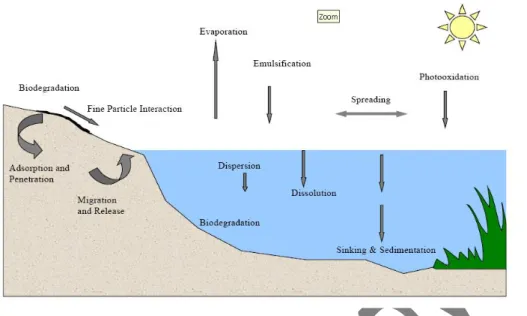
Minyak yang tumpah di laut langsung mengalami proses perubahan fisikawi, kimiawi, dan biologis (Gambar 6). Proses ini meliputi spreading, evaporasi, pelarutan, fotooksidasi, dispersi, dan emulsifikasi (Xueqing Zhu et al., 2001). Apabila minyak terpapar ke lingkungan perairan maka akan terjadi proses awal yaitu spreading atau perluasan minyak yang dilanjutkan dengan evaporasi atau penguapan fraksi minyak yang berat molekulnya rendah (Mangkoediharjo, 2005). Proses selanjutnya adalah fotooksidasi, dispersi, dan emulsifikasi. Fotooksidasi secara tidak langsung dibantu oleh sinar matahari dan sangat dipengaruhi oleh disolusi dari minyak. Fotooksidasi dapat membantu untuk mengubah komponen aromatik menjadi komponen yang lebih sederhana. Setelah itu minyak akan mengalami proses dispersi atau penyebaran akibat terjadi gradien konsentrasi dengan membentuk formasi minyak-air. Apabila sudah terdispersi maka akan terjadi proses selanjutnya secara alamiah yaitu emulsifikasi. Emulsifikasi merupakan proses perubahan status dari butiran minyak dalam air menjadi butiran air dalam minyak atau yang sering disebut chocolate mouse (Xueqing Zhu et al., 2001).
Crude oil tersusun dari berbagai macam komponen penyusun dengan berat molekul yang berbeda-beda. Bahan penyusun crude oil yang berat molekulnya tinggi tidak mudah hilang secara alamiah melalui proses diatas. Komponen ini akan mengalami sedimentasi/sinking. Sinking meruapakn proses adhesi antara partikel/sedimen maupun material organik yang berada di laut dengan komponen minyak. Selain itu, minyak dengan berat molekul tinggi tidak solubel dan mengendap kedasar sedimen sehingga membentuk film yang mempengaruhi organisme yang hidup didasar laut (Aynechi, 1998). Apabila terjadi kebakaran terhadap tumpahan minyak dengan berat molekul tinggi tersebut, maka residu yang terbentuk akan menambah densitas sinking (Anonim, 2008c). Proses secara alamiah ini berjalan sangat lambat. Apabila berton-ton minyak tumpah ke perairan maka akan membutuhkan waktu yang sangat lama untuk membersihkan minyak tersebut. Oleh karena itu diperlukan alternatif pembersihan tumpahan minyak dari perairan.
Gambar 6. Proses yang terjadi pada tumpahan minyak di laut (Xueqing Zhu et al., 2001).
Ada 3 macam remediasi tumpahan minyak yang telah diterapkan yaitu remediasi fisikawi, remediasi kimiawi, dan remediasi biologis (bioremediasi). 3.1. Remediasi Fisikawi
Remediasi fisikawi merupakan langkah remediasi yang menggunakan bantuan alat. Remediasi ini sangat bergantung pada faktor ketersediaan alat dan sumber daya manusia. Remediasi ini bertujuan untuk mengambil semaksimal mungkin tumpahan minyak. Selain itu faktor geografis, luas area tumpahan, dan faktor alam lainnya juga sangat berpengaruh pada jenis alat yang digunakan. Sehingga remediasi fisikawi ini hanya dapat diterapkan sebagai pertolongan pertama pada saat tumpahan minyak terjadi.
Remediasi fisikawi yang sudah banyak diterapkan yaitu dengan menggunakan teknik booming dan skiming, wiping, pencucian, relokasi sedimen dan tilling, serta burning (Mangkoedihardjo, 2005). Booming dan skiming menggunakan bantuan alat berupa booms dan skimmer yang berfungsi untuk mengumpulkan tumpahan minyak sehingga tumpahan minyak terlokalisasi pada daerah yang sempit (Misran, 2002).
Teknik Wiping adalah teknik dengan menggunakan absorben yang berfungsi untuk menyeka minyak dari permukaan air. Sedangkan teknik
pencucian merupakan remediasi fisikawi dengan menggunakan air dingin bertekanan rendah sampai air panas bertekanan tinggi (Mangkoedihardjo, 2005). Burning adalah teknik pembakaran tumpahan minyak di laut. Komponen minyak yang mudah menguap akan segera habis saat minyak terpapar di laut sehingga burning akan efektif dalam jangka waktu tertentu saja. Teknik Burning banyak dilakukan dikawasan pesisir pantai (Aynechi, 1998). Menurut Misran (2002) pembakaran tumpahan minyak tidak dapat membersihkan tumpahan minyak secara menyeluruh dan menimbulkan dampak lain berupa asap sisa pembakaran yang toksik bagi lingkungan sekitar.
3.2. Remediasi Kimiawi
Remediasi kimiawi adalah metode pembersihan tumpahan minyak menggunakan bahan kimia. Remediasi kimiawi yang sering dipraktekkan adalah menggunakan dispersan, demulsifier, solidifier, surface film chemicha (Mangkoedihardjo, 2005). Dispersan digunakan untuk mendispersi minyak menjadi butiran dalam air karena adanya kandungan surfaktan. Dispersan ini merupakan campuran bahan-bahan kimia yang berdampak negatif bagi ekosistem laut. Dispersan pernah diaplikasikan untuk remediasi tumpahan minyak di daerah Texas dan Louisiana. Akan tetapi menimbulkan dampak negatif karena kelarutannya dan toksisitasnya (Bonner et al., 2008).
Demulsifier digunakan untuk memutus emulsi minyak-air dan mempercepat dispersi alamiah (Mangkoedihardjo, 2005). Demulsifier ini biasanya menggunakan surfaktan sintetis yang digunakan untuk meningkatkan kelarutan hidrokarbon. Penggunaan surfaktan sintetis ini terbukti menimbulkan masalah bagi organisme hidup karena bersifat toksik, sulit terdegradasi, dan dapat menghambat degradasi oleh mikrobia (Fatimah, 2007). Sedangkan solidifier berguna untuk menstabilkan minyak sehingga meminimalkan penyebaran. Teknik remediasi menggunakan Surface film chemichal berfungsi untuk mencegah minyak tertarik ke laut lepas (Mangkoedihardjo, 2005).
3.3. Bioremediasi
Remediasi fisik dan kimia tersebut hanya efektif dalam jangka waktu tertentu dan tidak membersihkan minyak secara keseluruhan. Selain itu bahan kimia yang digunakan menambah pencemaran di perairan. Oleh karena itu perlu dicari alternatif remediasi yang tidak berbahaya dan aman bagi lingkungan serta makluk hidup disekitarnya. Remediasi ini menggunakan jasa dari mikrobia dan sering disebut dengan bioremediasi. Bioremediasi digunakan pertama kali saat terjadi tumpahan minyak Exxon Valdez tahun 1989 (Cohen, 2002). Bioremediasi adalah suatu teknik remediasi yang menggunakan bakteri atau mikrobia lain untuk mengolah tumpahan minyak menjadi bahan yang tidak berbahaya seperti asam lemak dan karbon dioksida (Aldrett, 1997). Proses ini dapat dipercepat dengan menambah sumber fosfat dan nitrogen untuk pertumbuhan mikrobia. Teknik ini efektif dengan menggunakan fertilizer yang larut dalam air atau dalam bentuk pelet (Anonim, 2008d).
Bioremediasi dipengaruhi oleh beberapa faktor antara lain tipe bakteri yang ada dalam wilayah tersebut, kerakteristik fisik dan kimia dari minyak, dan luas area yang terkena tumpahan minyak. Ada dua pendekatan kajian bioremediasi yaitu bioaugmentasi dan biostimulasi (Munawar et al., 2008). Bioaugmentasi merupakan teknik remediasi dengan menambahkan bakteri potensial pendegradasi minyak ke lingkungan yang tercemar minyak dimana terdapat barmacam-macam mikroorganisme (Mangkoedihardjo, 2005). Sedangkan biostimulasi adalah teknik remediasi yang diterapkan dengan menambah nutrien atau substansi pertumbuhan lain untuk menstimulasi pertumbuhan dari bakteri indigenous pendegradasi minyak (Anonim, 2000e).
4. Bakteri Laut Pendegradasi Hidrokarbon
Bakteri laut dikenal dapat mendegradasi hidrokarbon seperti alkana dan aromatik (Van Hamme et al., 2003). Beberapa bakteri laut diketahui sebagai pendegradasi PAHs. Bakteri ini ternasuk dalam genus Cyclocaticus, Flavobacterium, Marinobacter, Moraxella, Pseudomonas, Sphingomonas, dan Vibrio (Kasai et al., 2002). Selain itu strain anggota genus Pseudomonas,
Arthrobacter, Brevibacterium, Mycobacterium, dan Nocardia dapat menggunakan phenanthrene sebagai sumber karbon dan membantu dalam degradasi phenanthrene (Mrozik et al., 2002). Bakteri aerob yang dapat menggunakan sulfur seperti anggota spesies Rhodococcus erythropolis, Nocardia spp., dan Mycobacterium spp. dapat membantu dalam mendegradasi komponen crude oil yang mengandung sulfur seperti dibenzothiphene (Van Hamme et al., 2003). Menurut Marino (1998), Arthrobacter paraffineus dapat menggunakan paraffin sebagai sumber karbon.
Bioremediasi memanfaatkan biosurfaktan yang dihasilkan mikrobia untuk membantu mendegradasi komponen crude oil (Gambar 7). Biosurfaktan merupakan komponen mikroorganisme yang terdiri dari molekul hidrofobik dan hidrofilik yang mampu mengikat molekul hidrokarbon yang tidak larut air dan menurunkan tegangan permukaan (Koch et al., 1991). Beberapa biosurfaktan yang diproduksi oleh mikrobia terdiri dari low molecular weigth (rhampolipids, trehalose lipids, sophorose lipids, viscosin, dan surfactin) dan high molecular weigth (alasan, emulsan, biodispersan, liposan, dan mannan-lipoprotein) (Van Hamme et al., 1995). Menurut Fatimah (2007), biosurfaktan meningkatkan ketersediaan substrat tidak larut seperti crude oil. Substrat yang berbentuk cair akan teremulsi ke permukaan bakteri, sedangkan substrat yang berbentuk padatan akan terpecah dengan bantuan biosurfaktan sehingga mudah masuk ke dalam sel bakteri.
Bakteri yang termasuk dalam Proteobacteria, Firmicutes (gram positif), dan Cythophaga-Flexibacter-bacteriodetes diketahui menghasilkan biosurfaktan (Bodour et al., 2003). Pseudomonas aeruginosa menghasilkan biosurfaktan rhamnolipids dan Arthrobacter paraffineus menghasilkan trehalosa lipid dan fatty acids (Van hamme et al., 2003). Biosurfaktan yang termasuk dalam golongan lipoprotein dihasilkan oleh Bacillus sp., dan anggota genus Arthrobacter, dan Pseudomonas (Bodour et al., 2003).
Hidrokarbon yaitu phenanthrene, DBT, dan paraffin masuk ke dalam sel dapat melalui transpor aktif dan pasif. Transpor aktif memerlukan tenaga (ATP) atau menggunakan gradien ion. Sedangkan difusi menggunakan perbedaan konsentrasi dan tidak memerlukan ATP. Menurut Sikemma et al. (1995) proses transpor khusus memegang peranan dalam mineralisasi hidrokarbon terutama diffusi pasif.
Bakteri menggunakan fraksi crude oil seperti phenanthrene, DBT, dan paraffin sebagai sumber karbon dan mengubahnya menjadi komponen non toksik seperti CO2 (Cerniglia et al., 1992). Hal inilah yang menyebabkan bioremediasi
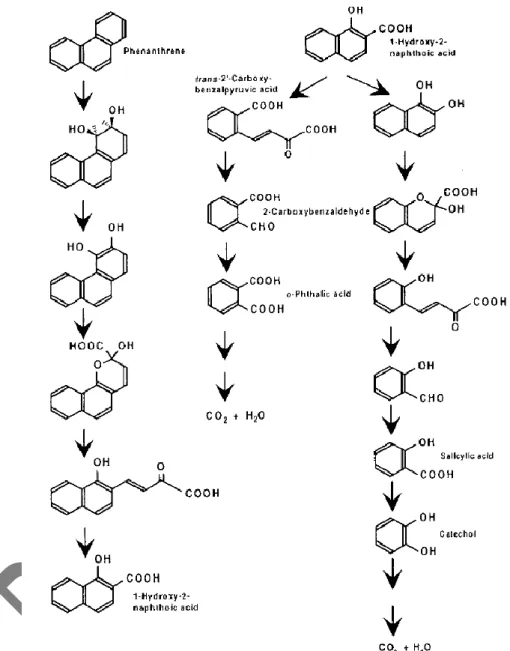
menjadi pilihan dalam remediasi tumpahan minyak. Bioremediasi ini melalui prose mineralisasi yang terjadi pada cincin aromatik PAHs dan dikatalis oleh enzim monooxygenase atau dioxygenase yang berjalan ketika ada molekul oksigen untuk pemutusan rantai (Karthikeyan dan Bhandari, 2001). Pada degradasi Phenanthrene dikenal ada berbagai macam pola degradasi, salah satunya degradasi yang diusulkan oleh Iwabuchi (1997). Phenanthrene didegradasi sampai membentuk intermediate 1-hidroxy-2-napthoic acid dan berujung pada pembentukan CO2 + H2O. Seperti yang ditemui juga pada
biodegradasi phenanthrene oleh bakteri Burkholderia cepacia F297 (Iwabuchi, 1997).
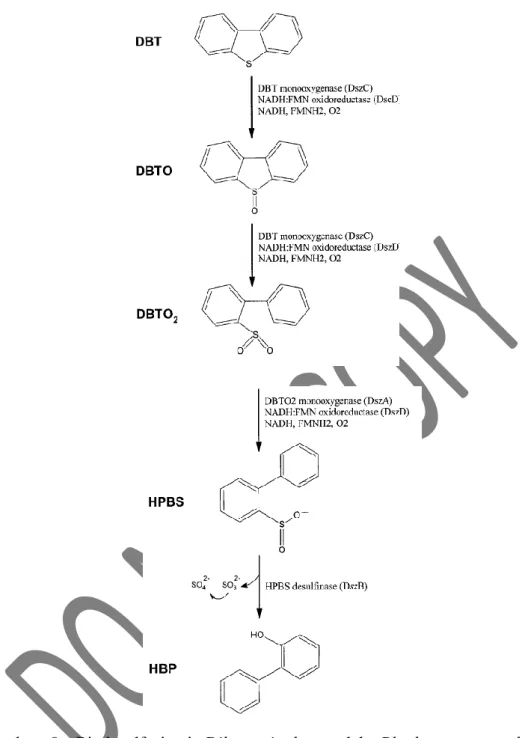
Beberapa bakteri dapat mendegradasi sulfur yang terkandung di dalam dibenzothiophene. Bakteri menggunakan sulfur melalui biodesulfurisasi. Jalur degradasi dibenzothiophene oleh bakteri bermacam-macam. Ada beberapa bakteri yang menghilangkan sulfur tanpa merombak rantai karbonnya (Gambar 9).
Biodesulfurisasi ini terjadi pada kondisi aerob seperti pada Rhodococcus erythropolis (Van Hamme et al., 2003).
Gambar 8. Mineralisasi Phenanthrene menjadi CO2 dan H2O pada Burkholderia
Gambar 9. Biodesulfurisasi Dibenzotiophene oleh Rhodococcus erythropolis dalam keadaan aerobik (Van Hamme et al., 2003).
Paraffin yang terkandung dalam crude oil dapat digunakan oleh beberapa bakteri sebagai sumber karbon dan sumber energi. Degradasi paraffin sangat penting untuk menurunkan pour point crude oil yang mempengaruhi kecepatan degradasinya. Secara umum jalur degradasi paraffin ada 2 yaitu n alkana metabolic pathway dan β oxidation metabolic pathway (Marino, 1998).
Gambar 10. Jalur degradasi paraffin oleh Bakteri (Marino, 1998).
B. HIPOTESIS
Bakteri mempunyai kemampuan untuk menggunakan hidrokarbon sebagai sumber energi. Beberapa bakteri laut juga diketahui mampu mendegradasi komponen minyak bumi. Bakteri laut isolat Pulau Pari dapat mendegradasi komponen crude oil yaitu phenanthrene, dibenzothiophene, dan paraffin.
III. METODE PENELITIAN
A. Pengambilan
Sampel
dan
Aklimasi
dalam
COLUMN
REACTOR
Sampel penelitian diambil dari Pulau Pari, Kepulauan Seribu DKI Jakarta (Gambar 11). Pulau Pari terletak di sebelah utara teluk Jakarta. Sampel air laut diambil dari sumur penampungan yang telah disiapkan. Setelah itu sampel air laut diaklimasi dalam column reactor selama 2 bulan. Ada 6 macam kolom dengan 6 macam fertilizer yang berbeda yaitu Super IB, NH4NO3, Uric Acid, Hi-Control,
Osmocoat, dan Chitosan (Gambar 12). Column reactor digunakan agar tidak terjadi kontaminasi dan menjaga agar air laut dalam kondisi mengalir sehingga kebutuhan oksigen tetap tercukupi. Sedangkan fertilizer berfungsi untuk mengoptimalkan pertumbuhan mikrobia dan memperbanyak populasi mikrobia.
Gambar 11. Letak Wilayah Pulau Pari
Gambar 12. Column Reactor
106.5°E 106.6°E 106.7°E 106.8°E 106.9°E 107°E -6.15°S -6.10°S -6.05°S -6.00°S -5.95°S -5.90°S -5.85°S -5.80°S 1 2 3 4 5 6 7 8 9 J A K A R T A B A Y P.Rambut P.Pari P.Pramuka T A N G E R A N G J A K A R T A N 21
B. Deteksi Kemampuan Mikrobia Mendegradasi Crude Oil
Medium yang digunakan untuk isolasi adalah medium ONR7a (Lampiran 10). Medium OnR7a dibuat dalam 3 larutan stok. Larutan stok tersebut digunakan untuk 4 L medium. Sebanyak 100 µl suspensi yang diambil dari 6 macam fertilizer dengan menggunakan mikropipet diletakkan pada medium ONR7a yang ditambah dengan 100 µl Arabian Light crude oil dan diratakan dengan drigalski. Setelah itu diinkubasikan selama 7 hari pada suhu 27°C untuk melihat aktivitasnya. Apabila terbentuk zona bening di sekitarnya menunjukkan bahwa bakteri yang terdapat dalam koloni dapat mendegradasi crude oil.
C. Deteksi Kemampuan Mikrobia Mendegradasi PAHs
Koloni bakteri yang potensial sebagai pendegradasi crude oil diisolasi dengan cara streak plate pada medium ONR7a yang ditambah dengan CH3COONa 5g/L. Setelah itu, medium yang berisi koloni mikrobia disublimasi
(Gambar 13) dengan PAHs (Phenanthrene (Wako Lot WKF0060) dan DBT Lot JK01 TCL). Teknik sublimasi dilakukan dengan cara memanaskan PAHs pada suhu (80-130°C) selama ±5 menit untuk menguapkan PAHs tersebut. Senyawa PAHs yang menguap akan menyublim dan terperangkap pada medium ONR7a yang diberi pendingin es batu. Setelah itu diinkubasikan selama 7 hari pada suhu 27°C. Zona bening yang terbentuk di sekitar koloni menunjukkan bahwa mikrobia dapat mendegradasi PAHs.
D. Uji Konfirmasi Kemampuan Isolat Bakteri Mendegradasi
Crude Oil
Koloni yang tumbuh pada medium ONR7a+CH3COONa diambil sebanyak
1 ose dan dimasukkan kedalam medium ONR7a cair yang ditambah dengan yeast extract (5g/L) dan ferric sitrat (4g/L). Lima mililiter medium diletakkan dalam tabung reaksi yang ditambah dengan 100 µl crude oil, kemudian diinkubasikan selama 3 hari pada 27°C. Hasil positif ditunjukkan dengan terdegradasinya crude oil. Crude oil yang semula kental dan berada di permukaan menjadi butiran yang lebih kecil dan tersebar di seluruh permukaan tabung.
E. Isolasi dan Purifikasi Bakteri Pendegradasi Crude Oil
Sebanyak 100 µl suspensi bakteri dari medium ONR7a cair + Crude oil diambil dengan mikropipet dan diencerkan sampai pengenceran 10-8. Setelah itu sebanyak 50 µl dari masing-masing pengenceran tersebut diambil dan diinokulasikan pada medium Difco marine agar 2216 secara pour plate. Koloni yang tumbuh dipisahkan lagi ke dalam medium marine agar yang baru sampai murni. Kriteria kemurnian ini dapat diketahui bahwa dalam satu plate tumbuh koloni yang seragam mulai dari warna, bentuk, dan tekstur koloni. Kemudian dipilih 16 isolat secara acak untuk diberi perlakuan selanjutnya.
F. Uji Konfirmasi Kemampuan Isolat Bakteri Mendegradasi
PAHs dan Paraffin
Uji konfirmasi digunakan untuk memastikan bahwa isolat bakteri dapat mendegradasi PAHs. Uji konfirmasi dilakukan terhadap 16 isolat bakteri terpilih dari hasil isolasi dan purifikasi. Uji konfirmasi I dilakukan dengan menginokulasikan 16 isolat bakteri pada medium ONR7a yang ditambah phenantrene dan DBT dengan cara menyublimkan senyawa tersebut (Gambar 8) serta diamati pembentukan zona bening atau perubahan warna medium. Uji konfirmasi II dilakukan pada medium air laut steril sebanyak 50 ml ditambah dengan sumber C, N, dan P dengan rasio C/N/P=100:20:3 (Lampiran 1). Sumber N terdiri dari yeast ekstrak, KNO3, (NH4)2SO4, dan Urea. Sedangkan sumber P
adalah KH2PO4.
PAHs tidak larut di dalam air sehingga untuk melarutkannya digunakan pelarut organik DMSO (Dimethyl sulfoxide 99.5% GC Sigma). Sebanyak 0,01 gram PAHs dilarutkan dalam 600 µl DMSO dan diencerkan menjadi 10 ml dengan akuades. Lima mililiter campuran tersebut ditambahkan ke dalam medium air laut steril. Untuk uji konfirmasi II ini diamati perubahan warna medium atau tingkat kekeruhan medium. Selanjutnya uji konfirmasi degradasi paraffin dilakukan dengan paraffin padat. Sebanyak 100 µl suspensi bakteri dari 6 macam fertilizer ditambahkan ke dalam medium ONR7a cair yang ditambah 5 gram paraffin. Uji konfirmasi degradasi paraffin ini dilakukan dengan mengamati tingkat kekeruhan medium dan keteruraian padatan paraffin.
Gambar 13. Metode Sublimasi PAHs
G. Karakterisasi Pertumbuhan Isolat Bakteri Pendegradasi
Phenanthrene, DBT, dan Paraffin
Uji pertumbuhan isolat murni terseleksi pendegradasi phenanthrene, DBT, dan paraffin dilakukan dengan variasi salinitas 2% dan 5% serta suhu 30°C. 1. Pertumbuhan Pada Marine Broth dan Polypepton
Uji pertumbuhan pada marine broth dan polypepton (Lampiran 11) digunakan sebagai pembanding terhadap pertumbuhan pada substrat phenanthrene, DBT, dan paraffin. Sebelum diinokulasikan, dilakukan prekultur pada medium marine broth. Satu ose bakteri dimasukkan kedalam 6 ml Difco marine broth 2216 dan diinkubasikan selama 18 jam pada suhu 30 °C. Setelah itu disentrifugasi dengan centrifuge 5411R dengan kecepatan 8000 rpm selama 20 menit pada suhu 25°C, selanjutnya pelet dicuci dengan akuades dan disentrifugasi dengan kecepatan yang sama. Setelah itu inokulan dengan konsentrasi akhir 3% v/v dimasukkan pada medium 50 ml marine broth dan polypepton dengan variasi salinitas 2%, 5%, dan 10%. Kemudian ditentukan kekeruhannya (OD) secara spektrofotometris pada λ = 600 nm tiap 6 jam sekali selama 36 jam dengan Biospec 1601-Shimadzu.
2. Pertumbuhan pada Phenanthrene, DBT, dan Paraffin Oil
Medium yang digunakan untuk uji pertumbuhan adalah akuades steril yang ditambah dengan sumber C, N, dan P dengan rasio C/N/P=100:20:3. Medium (Lampiran 12) sebanyak 50 ml ditambah dengan 5 ml phenanthrene Wako Lot WKF0060, DBT lot JK01 TCL, dan paraffin oil JT Baker Lot T18H00. Kemudian ditentukan kekeruhannya (OD) pada λ = 600 nm untuk tiap 3 jam selama 15 jam dengan Biospec 1601-Shimadzu. Selain itu dilakukan pula pengukuran pH setiap
3 jam sekali dengan pH meter Horiba. Konsumsi pospat dan ammonium juga dihitung serta diukur secara spektrofotometris dengan Biospec 1601-Shimadzu pada λ = 630 nm dan λ = 880 nm.
Uji pertumbuhan ini berguna untuk menentukan konstanta kecepatan pertumbuhan spesifik (µ) dan waktu generasi (g). Nilai OD yang diperoleh dengan spektrofotometris digunakan untuk memperoleh nilai µ dan g tersebut. Nilai OD 1 mewakili 109 sel/ml. Nilai OD yang diperoleh ini diubah ke dalam nilai ln N. Setelah kurva ln N diperoleh, dicari persamaan liniernya. Dari persamaan linier ini, dapat diketahui nilai µ. Sedangkan nilai g diperoleh dengan cara menghitung ln 2/µ.
H. Deteksi Aktivitas Metabolisme Bakteri dengan Pengukuran
Fosfat dan Amonium
Fosfat dan amonium diukur untuk melihat adanya aktivitas metabolisme. Untuk mengukur fosfat dan amonium dibutuhkan reagen yang spesifik. Reagen dibuat berdasarkan Standard Method edisi 18 (Greenberg et al., 1992). Kandungan fosfat diukur dengan menggunkan reagen fosfat (Lampiran 13). Reagen fosfat ini dibuat berdasarkan metode ascorbic acid. Untuk mengukur kandungan fosfat digunakan 2 ml sampel dan ditambah 0,32 ml reagen fosfat. Setelah itu kekeruhannya diukur secara spektrofotometris dengan Biospec 1601-Shimadzu pada λ = 880 nm. Selain itu dibuat kurva standard fosfat yang digunakan untuk mengetahui konsentrasi fosfat yang sebenarnya.
Kandungan Amonium diukur dengan menggunakan reagen amonium (Lampiran 14). Reagen amonium ini dibuat dengan metode phenate. Untuk 1 ml sampel ditambah 0,005 ml MnSO4; 0,05 hypoclorous acid; 0,06 phenate dan diukur kekeruhannya secara spektrofotometris pada λ = 630 nm dengan Biospec 1601-Shimadzu. Konsentrasi amonium dihitung dengan menggunakan konversi berdasarkan kurva standar ammonium.
I. Uji Microbial Adhesion to Hydrocarbon (MATH)
Uji MATH ini dilakukan berdasarkan metode Bahrens et al. (1978) yang dimodifikasi. Sumber N dan alkalinitas medium MATH ini adalah 3 g/L NH4Cl;
0,70 g/L KH2PO4; 0,35 g/L MgSO4.7H2O; 0,035 g/L ferric sitrat; 0,2 g/L
MnSO4.5H2O dan 0,285 g/L H3BO3 yang dimasukkan dalam 1L air laut steril.
Suspensi bakteri sebanyak 3% v/v yang sebelumnya telah diprekultur dalam medium MB selama 48 jam, dimasukkan ke dalam 50 ml medium MATH. Lima mililiter phenanthrene, DBT, dan paraffin padat dimasukkan ke dalam masing-masing botol yang berisi medium MATH. Glukosa sebanyak 5 gram juga dimasukkan ke dalam 50 ml medium sebagai kontrol. Medium diinkubasikan selama 2x24 jam pada suhu 30°C.
Satu mililiter suspensi bakteri dari masing-masing perlakuan disentrifugasi dengan kecepatan 8000 rpm lalu pelet dicuci dua kali dengan NaCl 2% dan disentrifugasi lagi pada kecepatan yang sama setelah pencucian. Pelet diresuspensi dengan NaCl 2% sampai volume menjadi 1 ml. Kemudian kekeruhannya (OD) diukur secara spektrofotometris dengan menggunakan Biospec 1601-Shimadzu pada λ = 600 nm. Nilai OD yang pertama ini menunjukkan adanya hidrokarbon dalam sel bakteri (A0). Selain itu 5 ml suspensi
bakteri dari masing-masing perlakuan juga diambil dan ditambah 500 µl paraffin oil dan divortek selama 2 menit. Setelah didiamkan selama 10 menit, OD pada λ = 600 nm dari suspensi bakteri diukur kembali. Nilai OD yang kedua ini menunjukkan besarnya hidrokarbon yang terlepas dari sel bakteri (A1). MATH
diukur berdasarkan rumus dari Kaczorek et al., 2007.
1-(A0-A1) X 100%
A0
Keterangan : A0 = OD bakteri + hidrokarbon dalam sel bakteri
A1 = OD hidrokarbon yang dilepaskan sel bakteri
J. Karakterisasi dan Identifikasi Isolat Bakteri Pendegradasi
Crude Oil, Phenanthrene, DBT, dan Paraffin
Karakterisasi isolat bakteri dilakukan untuk tujuan identifikasi. Karakterisasi dilakukan meliputi karakter morfologi koloni dan pengecatan gram. Disamping itu dilakukan pula identifikasi dengan kit API 20 NE dan metode identifikasi molekular (sequencing DNA).
1. Pengecatan Gram
Pengecatan gram meliputi 4 tahapan yaitu pemberian warna utama, mordan, dekolorisasi, dan pemberian warna penutup (Anonim, 2005). Gelas benda dibersihkan dengan alkohol 90% dan dilewatkan pada nyala api. Kemudian 1 tetes akuades steril diletakkan pada gelas benda dan ditambah dengan 1 ose bakteri. Setelah difiksasi di atas nyala api, ditambah dengan 2-3 tetes larutan kristal violet dan didiamkan selama 1 menit. Larutan iodine diteteskan di atasnya selama 1 menit. Setelah itu dicuci dengan air mengalir dan dikeringkan. Kemudian dicuci dengan alkohol 95% selama 30 detik dan dilanjutkan dengan air mengalir. Pewarna penutup yaitu safranin diberikan selama 2 menit lalu dicuci dengan air mengalir dan dikeringkan.
Pengamatan dilakukan di bawah mikroskop pada perbesaran 10x40. Warna ungu menunjukkan bahwa mikrobia tersebut bersifat gram positif, sedangkan warna merah menunjukkan bahwa mikrobia bersifat gram negatif.
2. Identifikasi dengan Kit API 20 NE
API 20 NE adalah kit untuk mengidentifikasi bakteri rod gram negatif non fastidious yang tidak termasuk dalam Enterobacteriaceae. Oleh karena itu, dipastikan terlebih dahulu bahwa bakteri bersifat gram negatif. API 20 NE terdiri dari 20 mikrotube yang mengandung media terdehidrasi dan substrat.
Sebanyak 3 ml larutan NaCl 2% diletakkan dalam cawan petri steril. Kemudian 1 ose koloni bakteri diinokulasikan ke dalam larutan garam tersebut. Nampan inkubasi dan tutupnya dipersiapkan untuk meletakkan strip mikrotube. Akuades sebanyak 5 ml dituangkan ke dalam nampan untuk menjaga kelembabannya.
Nampan inkubasi API 20 NE dimiringkan dan mikrotube dari golongan TUBE NO3 sampai PNPG diisi terlebih dahulu dengan menggunakan pipet tip.
dalamnya. Kemudian dicampur dengan baik dan dijaga agar tidak terbentuk gelembung udara. Mikrotube golongan TUBE NO3 sampai PNPG dan CUPULE
[GLU] sampai [PAC] diisi dengan medium AUX yang telah berisi suspensi bakteri. Setelah itu nampan API 20 NE ditutup dan diinkubasikan selama 24 jam pada suhu 30°C di dalam inkubator non CO2 .
Tes nitrat dilakukan dengan menambahkan NIT 1 dan NIT 2 ke dalam TUBE NO3. Setelah 5 menit, reaksi positif ditunjukkan dengan warna merah. Jika
tidak terjadi reaksi maka ditambah dengan debu seng ke TUBE NO3. Setelah 5
menit, cupule yang tidak berwarna menunjukkan reaksi positif dan cupule yang berwarna merah jambu menunjukkan reaksi negatif. Untuk tes asimilasi ditunjukkan dengan kekeruhan pada cupule yang menunjukkan reaksi positif. Intrepretasi hasil dengan menggunakan indeks profil API 20 NE.
3. Sequencing 16S rRNA
Metode sequencing dengan 16S rRNA ini digunakan untuk mengidentifikasi bakteri. Preparasi DNA dilakukan dengan ekstraksi menggunakan metode Biosystem Prepman Ultra. Sebanyak 25 µl prepman ditambah dengan 1 loopfull koloni bakteri dan divortek selama 10-30 detik. Setelah itu dipanaskan selama 10 menit (100°C) dengan Astec Program temperatur Control system. Kemudian dilakukan sentrifugasi selama 3 menit dengan kecepatan 12000 rpm dan diambil sepernatannya. Ada tidaknya DNA dicek dengan elektroforesis.
Setelah diperoleh produk DNA maka dilakukan amplifikasi 16S PCR dengan 2 primer yaitu primer F27 (5’ AGAGTTGATCCTGGCTG 3’) dan primer R1541 (5’ AAGGAGGTGATCCAGCCGCA 3’). PCR dilakukan dengan 30 cycle yaitu 4 menit pada suhu 94°C (denaturasi), 1 menit pada suhu 55°C (annealing), dan 2 menit pada suhu 72°C (extension). Pada cycle terakhir dilakukan inkubasi selama 10 menit pada suhu 72°C. Kemudian untuk mendapatkan hasil yang maksimal dilakukan purifikasi produk PCR dengan qiagen purification kit. Apabila sudah murni maka dilanjutkan dengan cycle sequencing dan sequencing. Sekuen nukleotida ditentukan dengan Big Dye terminatorv3.1. Sequencing menggunakan DNA Sequencer model 377 (Applied Biosystem).
Sequence nukleotida yang diperoleh didepositkan pada pangkalan data DDBJ (DNA Database Japan) dengan accession number. Kemudian sequence nukleotida tersebut dimasukkan ke dalam Clustal X, versi 1.8 (Alignment). Setelah itu untuk mengetahui kemiripan nama isolat bakteri dengan sequence 16S rRNA baketri yang telah teridentifikasi sebelumnya, maka hasil sequence nukleotida dimasukkan dalam sequence request DDBJ (http// homology.ddbj. nig.ac.jp/). Setelah itu dilakukan konstruksi phylogenetic tree dari data evolusionary distance menggunakan neighbour joining method. Konstruksi phylogenetic tree ini menggunakan reference strain yang terdapat pada pangkalan data NCBI. Kemudian dilakukan resampling dengan 1000 replikasi dengan menggunakan Bootstrap method untuk mengevaluasi kedekatan jarak pada cabang di dalam phylogenetic tree.
IV. HASIL PENELITIAN DAN PEMBAHASAN
1. Kemampuan Mikrobia dalam Sampel Mendegradasi Crude Oil
Bakteri laut Pulau Pari diisolasi pada column reactor dengan 6 variasi N yang berbeda sebagai stimulasi pertumbuhan yaitu Super IB, Chitosan, Osmocoat, Hi-Control, NH4NO3, dan Uric acid. Fertilizer digunakan sebagai sumber N dan
P. Perbedaan dari keenam fertilizer tersebut adalah Super IB, Chitosan, Hi-Control, NH4NO3, dan Uric acid sebagai sumber N. Sedangkan Osmocoat adalah
sumber N dan P. Penambahan nutrien ini juga bertujuan untuk mengoptimalkan pertumbuhan mikrobia dan memperbanyak populasi mikrobia.
Mikrobia dari 6 macam fertilizer yang berbeda ini ditumbuhkan pada medium ONR7a. Medium tersebut merupakan medium minimum dan selektif untuk mikrobia laut. Hasil degradasi crude oil pada minimum medium menunjukkan bahwa mikrobia dari 6 macam fertilizer dapat mendegradasi crude oil. Akan tetapi mikrobia dari Hi-control menghasilkan zona bening terluas dan tercepat (Tabel 3). Pada hari ke 3 setelah inkubasi, zona bening pada Hi-control sudah terbentuk dan semakin lama bertambah luas. Sedangkan untuk 5 perlakuan lainnya, zona bening mulai terbentuk pada hari ke 7 setelah inkubasi.
Tabel 3. Kemampuan Mikrobia dari 6 macam fertilizer dalam membentuk zona bening.
No. Macam Fertilizer Pembentukan Zona Bening
1. NH4NO3 Terbentuk zona bening yang sempit pada hari ke 7
2. Osmocoat Terbentuk zona bening yang cukup luas pada hari ke 7 3. Super IB Terbentuk zona bening yang cukup luas pada hari ke 7 4. Hi-Control Terbentuk zona bening yang sangat luas mulai hari ke 3 5. Chitosan Terbentuk zona bening yang sempit pada hari ke 7 6. Uric acid Terbentuk zona bening yang sangat sempit pada hari ke 7
30
Zona bening terbentuk apabila mikrobia dapat menggunakan sumber karbon dari crude oil. Menurut Koch et al.(1991) zona bening juga mengindikasikan bahwa mikrobia menghasilkan biosurfaktan yang membantu untuk mendegradasi crude oil. Pembentukan zona bening terluas dan tercepat berasal dari Hi-Control
(Gambar 14), sedangkan zona bening tersempit berasal dari Uric acid.
A B
Gambar 14. Pembentukan zona bening oleh mikrobia pada Hi-Control hari ke 7 (A) dan pada Super IB hari ke 7 (B).
Pada gambar 14 terlihat perbedaan antara kontrol dan perlakuan pada Hi-control dan Super IB. Pada kontrol tidak terlihat perubahan dan terbentuk zona bening karena tidak ada akivitas mikrobia. Pola degradasi mikrobia dari 6 macam fertilizer juga menunjukkan perbedaan. Adanya perbedaan pola degradasi ini disebabkan oleh diversitas mikrobia. Diversitas mikrobia dapat diketahui melalui isolasi dan purifikasi. Oleh karena itu, dilakukan isolasi koloni mikrobia dari 6 macam fertilizer tersebut. Isolasi dilakukan dengan metode streak plate. Koloni yang berada di daerah zona bening diambil secara acak meliputi daerah tengah dan pinggir plate dengan masing-masing 6 kali ulangan. Pengambilan koloni dilakukan secara acak karena koloni terkumpul menjadi satu dan hanya membentuk lapisan tipis di dalam zona bening. Sedangkan banyaknya ulangan diharapkan dapat merepresentasikan diversitas mikrobia dan semua mikrobia dapat terambil.
2. Isolasi Bakteri Pendegradasi PAHs
Bakteri potensial pendegradasi crude oil diisolasi pada medium ONR7a yang telah ditambah dengan CH3COONa secara streak plate. Adanya
pertumbuhan pada medium tersebut menunjukkan bahwa bakteri bersifat alkanivorax (Gambar 15). Semua bakteri dari 6 macam fertilizer yang berbeda bersifat alkanivorax yang berarti dapat tumbuh dan memanfaatkan sumber karbon dari CH3COONa dan Isolat bakteri tersebut tidak dapat menggunakan glukosa
sebagai sumber karbon.
Gambar 15. Isolasi Bakteri Pendegradasi PAHs.
Isolasi bakteri pendegradasi PAHS dilakukan dengan menyublimkan PAHs ke dalam medium yang berisi koloni bakteri pendegradasi crude oil. Isolasi ini merupakan isolasi yang dilakukan untuk menyeleksi bakteri yang mampu mendegradasi PAHs. Koloni bakteri yang mampu mendegradasi PAHs akan membentuk zona bening disekitar koloni. Semua koloni bakteri dari 6 macam fertilizer membentuk zona bening di sekitar koloni.
3. Uji Konfirmasi Kemampuan Bakteri Pendegradasi PAHs dalam Mendegradasi Crude Oil
Koloni isolat bakteri yang tumbuh pada medium ONR7a+CH3COONa
ditumbuhkan dalam medium ONR7a cair yang ditambah Yeast Extract dan ditambah dengan crude oil. Hasil positif ditunjukkan dengan terdegradasinya crude oil. Untuk setiap koloni bakteri dari 5 macam fertilizer dilakukan satu kali ulangan. Bakteri dari Hi-Control diperkirakan diversitasnya sangat beragam sehingga dilakukan 8 kali ulangan. Pola degradasi dari masing-masing ulangan berbeda yang menunjukkan diversitas bakteri yang berbeda (Tabel 4). Hasil uji konfirmasi kemampuan bakteri mendegradasi crude oil dari 5 fertilizer yaitu Super IB, Chitosan, Osmocoat, Hi-Control, dan NH4NO3 menunjukkan hasil
Tabel 4. Uji Konfirmasi Degradasi crude oil pada 6 macam fertilizer yang berbeda.
SUMBER BAKTERI
KETERANGAN Hi-Control 1. Medium berwarna putih kehitaman, di atas dan di bawah
medium terdapat endapan berwarna hitam.
2. Medium keruh coklat kehitaman, di bawah dan di atas medium terdapat endapan hitam.
3. Warna medium kuning pucat, semua minyak terdegradasi sempurna.
4. Warna medium kuning pucat, masih ada sisa minyak 5. Warna medium kuning pucat dan semua minyak
terdegradasi sempurna.
6. Warna medium kuning pucat dan semua minyak terdegradasi sempurna.
7. Warna medium kuning pucat dan semua minyak terdegradasi sempurna.
8. Warna medium kuning pucat dan semua minyak terdegradasi sempurna.
Super IB 1. Medium semakin jernih, terdapat endapan hitam halus di bawah dan sedikit gumpalan minyak diatas.
2. Warna kuning jernih dan semua minyak habis terdegradasi.
Chitosan 1. Medium putih susu, semua minyak terdegradasi sempurna dan terdapat endapan hitam di bawah medium.
2. Warna medium putih susu dan semua minyak terdegradasi sempurna.
Osmocoat 1. Medium putih susu, semua minyak telarut dan terdapat endapan di bawahnya.
2. Medium putih susu dan semua minyak terdegradasi sempurna.
NH4NO3
Uric acid
1. Warna medium kuning pucat dan minyak terdegradasi sempurna.
2. Warna medium kuning pucat dan minyak terdegradasi sempurna.
1. Warna medium tetap kuning dan minya masih menggumpal dipermukaan.
A B
Gambar 16. Uji kemampuan bakteri dari Hi-control (A) dan Chitosan (B) dalam mendegradasi PAHs.
Berdasarkan Tabel 4 diketahui bahwa pola degradasi dari masing-masing sumber bakteri dari 6 fertilizer cukup bervariasi. Untuk bakteri dari Hi-Control yang diulang sebanyak 8 kali juga ada yang berbeda walaupun sumber bakteri sama. Hal ini dikarenakan perbedaan komposisi bakteri yang terambil sehinga mempengaruhi degradasinya. Bakteri dengan penambahan fertilizer Uric acid tidak menunjukkan reaksi degradasi. Crude oil yang ditambahkan dan berada di permukaan atas tabung tetap menggumpal di permukaan. Sejak awal perlakuan yaitu pada uji kemampuan mendegradasi crude oil pada medium ONR7a, sumber bakteri dari Uric acid juga menunjukkan degradasi yang lemah dibanding yang lainnya. Zona bening yang terbentuk sangat sedikit dibanding bakteri dari 5 fertilizer lainnya.
4. Isolasi dan Purifikasi Bakteri Pendegradasi Crude Oil
Bakteri potensial pendegradasi crude oil dari medium ONR7a cair diisolasi pada medium marine agar. Bakteri dari 6 macam fertilizer sangat beragam. Diversitas yang paling banyak berasal dari Super IB apabila dilihat dari keragaman warna dan struktur koloni. Sedangkan dari Uric Acid hanya ditemukan satu macam koloni. Setelah isolasi dan purifikasi diketahui bahwa isolat bakteri dari sumber fertilizer Uric acid hanya teridiri dari satu macam bakteri. Hal ini yang menyebabkan aktivitas degradasi crude oil dalam medium ONR7a maupun