76
Lampiran A.4
Format Validasi Ahli
terhadap Buku Ajar Reaksi Redoks dengan Konteks Kembang Api
Assalamu’alaikum wr.wb Yth. Bapak/ Ibu Di
Sehubungan dengan penelitian yang saya lakukan dengan judul “Pengembangan Buku Ajar Reaksi Redoks Menggunakan Konteks Kembang Api untuk Meningkatkan Literasi
Sains Peserta Didik SMA”. Saya berharap Bapak/Ibu dapat berkenan menjadi validator terhadap rancangan buku ajar ini. Hasil validasi ini ke depannya akan saya jadikan sebagai rujukan dalam melakukan perbaikan teks buku ajar Reaksi Redoks berbasis konteks kembang api. Sebagai bahan pertimbangan Bapak/Ibu, berikut saya lampirkan: (1) Kompetensi Inti dan
Kompetensi Dasar, (2) Indikator dan Tujuan Pembelajaran, (3) Tahapan STL (Scientific and Technological Literacy) dalam teks buku ajar, serta (4) gambaran urutan isi bahan ajar (text
sequence map).
Besar harapan bapak/ibu bersedia untuk memberikan masukan melalui lembar validasi ini. Sebelumnya saya ucapkan terima kasih.
Mengetahui,
Wassalam,
Feri Andi Syuhada NIM. 1204848 Pembimbing 1
Dr. Hernani, M.Si NIP. 196711091991012001
Pembimbing 2
77 Identitas Validator
No Identitas Validator Tanggapan
1 Nama 2 Jenis Kelamin
(Laki-laki/Perempuan)*
3 Umur (20-29/ 30-39/40-49/50-59/60+)*
4 Riwayat pendidikan terakhir
5 Pengalaman mengajar Tahun
*Berilah strip dua ( )pada bagian yang bukan identitas Bapak/Ibu
Kompetensi Inti dan Kompetensi Dasar
No. Kompetensi Inti Kompetensi Dasar
1. Menghayati dan mengamalkan perilaku jujur, disiplin, tanggungjawab, peduli (gotong royong, kerjasama, toleran, damai), santun, responsif dan pro-aktif dan menunjukkan sikap sebagai bagian dari solusi atas berbagai permasalahan dalam berinteraksi secara efektif dengan lingkungan sosial dan alam serta dalam menempatkan diri sebagai cerminan bangsa dalam pergaulan dunia.
Menunjukkan prilaku responsif dan proaktif serta bijaksana sebagai wujud kemampuan memecahkan masalah dan membuat keputusan.
2. Memahami, menerapkan, menganalisis pengetahuan faktual, konseptual, prosedural berdasarkan rasa ingintahunya tentang ilmu pengetahuan, teknologi, seni, budaya, dan humaniora dengan wawasan kemanusiaan, kebangsaan, kenegaraan, dan peradaban terkait penyebab fenomena dan kejadian, serta menerapkan pengetahuan prosedural pada bidang kajian yang spesifik sesuai dengan bakat dan minatnya untuk memecahkan masalah.
Menganalisis perkembangan konsep reaksi oksidasi-reduksi serta menentukan bilangan oksidasi atom dalam molekul atau ion.
3. Mengolah, menalar, dan menyaji dalam ranah konkret dan ranah abstrak terkait dengan pengembangan dari yang dipelajarinya di sekolah secara mandiri, bertindak secara efektif dan kreatif, serta mampu menggunakan metoda sesuai dengan kaidah keilmuan
Merancang, melakukan, dan menyimpulkan serta menyajikan hasil percobaan reaksi oksidasi-reduksi.
Indikator dan Tujuan pembelajaran Buku Ajar Reaksi Redoks dengan Konteks Kembang Api
Kompetensi Pengetahuan
No Indikator No Tujuan Pembelajaran
1. Menjelaskan keterkaitan antara komponen penyusun kembang api dengan konsep reaksi oksidasi reduksi.
1.1 Peserta didik mampu menjelaskan bagaimana keterkaitan antara komponen penyusun kembang api dengan konsep reaksi oksidasi reduksi.
2. Menjelaskan karakteristik dan fungsi komponen penyusun kembang api (zat pengoksidasi, bahan bakar, binder (pengikat) dan zat pemberi warna) berdasarkan fenomena ilmiah.
2.1 Peserta didik mampu menjelaskan karakteristik dan fungsi dari zat pengoksidasi dalam kembang api.
2.2 Peserta didik mampu memberikan contoh zat pengoksidasi pada kembang api beserta sifatnya.
78
No Indikator No Tujuan Pembelajaran
kembang api.
2.4 Peserta didik mampu menjelaskan karakteristik dan fungsi dari binder (pengikat) dalam kembang api.
2.5 Peserta didik mampu menjelaskan karakteristik dan fungsi dari zat pemberi warna dalam kembang api.
3. Menjelaskan konsep reaksi oksidasi-reduksi berdasarkan pelepasan dan pengikatan oksigen.
3.1 Peserta didik mampu menjelaskan pengertian oksidasi-reduksi berdasarkan pelepasan dan pengikatan oksigen.
3.2 Peserta didik mampu menjelaskan kaitan konsep reaksi oksidasi-reduksi berdasarkan pelepasan dan pengikatan oksigen dengan penggunaan komponen bahan kembang api.
3.3 Peserta didik mampu menjelaskan konsep zat pengoksidasi (oksidator) dan zat pereduksi (reduktor) berdasarkan konsep pelepasan dan pengikatan oksigen. 4. Menjelaskan konsep reaksi oksidasi-reduksi berdasarkan pelepasan dan
pengikatan elektron.
4.1 Peserta didik mampu menjelaskan pengertian oksidasi-reduksi berdasarkan pelepasan dan pengikatan elektron.
4.2 Peserta didik mampu menjelaskan kaitan konsep reaksi oksidasi-reduksi berdasarkan pelepasan dan pengikatan elektron dengan penggunaan komponen bahan kembang api 4.3 Peserta didik mampu menjelaskan konsep zat pengoksidasi (oksidator) dan zat
pereduksi (reduktor) berdasarkan konsep pelepasan dan pengikatan elektron. 5. Membedakan persamaan reaksi oksidasi-reduksi berdasarkan fenomena ilmiah
terkait pelepasan dan pengikatan oksigen dengan pelepasan dan pengikatan elektron.
5.1 Peserta didik mampu mengelompokkan contoh persamaan reaksi oksidasi-reduksi berdasarkan pelepasan dan pengikatan oksigen & pelepasan dan pengikatan elektron dari penggunaan komponen bahan kembang api.
6. Menjelaskan konsep bilangan oksidasi. 6.1 Peserta didik mampu menjelaskan konsep bilangan oksidasi.
7. Menentukan bilangan oksidasi atom dalam molekul atau ion berdasarkan pengetahuan yang dimiliki terkait aturan yang berlaku.
7.1 Peserta didik mampu menentukan bilangan oksidasi atom dalam molekul dari komponen kembang api berdasarkan aturan yang berlaku.
7.2 Peserta didik mampu menentukan bilangan oksidasi atom dalam ion dari komponen kembang api berdasarkan aturan yang berlaku.
8. Menjelaskan konsep reaksi oksidasi-reduksi berdasarkan perubahan bilangan oksidasi.
8.1 Peserta didik mampu menjelaskan kaitan konsep reaksi oksidasi-reduksi berdasarkan perubahan bilangan oksidasi dengan penggunaan komponen bahan kembang api 8.2 Peserta didik mampu menjelaskan konsep zat pengoksidasi (oksidator) dan zat
pereduksi (reduktor) berdasarkan konsep perubahan bilangan oksidasi. 9. Membedakan persamaan reaksi oksidasi-reduksi berdasarkan fenomena ilmiah
terkait pelepasan dan pengikatan oksigen, pelepasan dan pengikatan elektron, serta perubahan biloks.
9.1 Peserta didik mampu membedakan konsep reaksi oksidasi-reduksi dari persamaan reaksi berdasarkan pelepasan dan pengikatan oksigen, pelepasan dan pengikatan elektron serta perubahan biloks dari penggunaan komponen bahan kembang api. 10. Melakukan percobaan reaksi oksidasi-reduksi berdasarkan prosedur
percobaan.
10.1 Peserta didik mampu melakukan percobaan reaksi oksidasi-reduksi sesuai prosedur percobaan yang diberikan.
79
ilmiah. berdasarkan hasil pengamatan.
12. Menyajikan hasil percobaan reaksi oksidasi-reduksi berdasarkan asumsi, bukti dan alasan sesuai dengan hasil pengamatan.
12.1 Peserta didik mampu menyajikan hasil percobaan reaksi oksidasi-reduksi berdasarkan asumsi, bukti dan alasan sesuai dengan hasil pengamatan.
Kompetensi Sikap
Tahapan STL (Scientific and Technological Literacy) pada buku ajar
Sampai saat ini belum ada aturan baku mengenai tahapan-tahapan dalam pembelajaran berbasis STL, maka dengan mengadopsi, dan memodifikasi tahapan-tahapan pembelajaran
berdasarkan proyek chemie in context dalam Nentwig et al (2002) dan penyisipan langkah seperti yang disarankan oleh Holbrook (2005), diperoleh tahapan penyusunan bahan ajar
sebagai berikut:
1. Tahap Kontak (Contact Phase)
Pada tahap ini dikembangkan isu-isu, masalah yang ada di masyarakat atau menggali berbagai peristiwa yang terjadi disekitar siswa dan mengaitkannya dengan materi yang akan
dipelajari sehingga siswa menyadari pentingnya memahami materi tersebut.
2. Tahap Kuriositi (Curiosity Phase)
Pada tahap ini dikemukakan pertanyaan-pertanyaan, dimana jawabannya membutuhkan pengetahuan kimia yang dapat mengundang rasa penasaran dan keingintahuan siswa.
3. Tahap Elaborasi (Elaboration Phase)
Pada tahap ini dilakukan eksplorasi, pembentukan dan pemantapan konsep sampai pertanyaan pada tahap kuriositi dapat terjawab. Eksplorasi, pembentukan dan pemantapan konsep
tersebut dapat dilakukan dengan berbagai metode, misalnya ceramah bermakna, diskusi dan kegiatan praktikum, atau gabungan dari ketiganya. Melalui kegiatan inilah berbagai
kemampuan siswa akan tergali lebih dalam, baik aspek pengetahuan, keterampilan proses maupun sikap dan nilai.
No Indikator Tujuan Pembelajaran
1. Menunjukkan ketertarikan terhadap informasi terrkait dengan reaksi oksidasi-reduksi yang menggunakan contoh dikehidupan sehari-hari.
Peserta didik menunjukkan ketertarikan terhadap informasi berkaitan dengan reaksi oksidasi-reduksi yang menggunakan contoh kembang api.
2. Menunjukkan kepedulian terhadap dampak yang ditimbulkan dari kembang api.
Peserta didik menunjukkan kepedulian terhadap dampak yang ditimbulkan dari kembang api.
3. Berinisiatif dalam menyelesaikan setiap permasalahan yang diberikan dalam pembelajaran materi reaksi oksidasi-reduksi.
80
4. Tahap Pengambilan Keputusan (Decision Making Phase)
Pada tahap ini dilakukan proses pengambilan keputusan melalui diskusi berkaitan dengan permasalahan yang dibahas dalam pembelajaran, khususnya yang dikemukakan pada
tahap kuriositi.
5. Tahap Nexus (Nexus Phase)
Pada tahap ini dilakukan proses pengambilan intisari dari materi yang dipelajari (dekontekstualisasi), kemudian mengaplikasikannya pada konteks yang lain (rekontekstualisasi)
81
1. Format validasi ini diisi dengan membubuhkan tanda ceklis (√) pada kolom Ya (Y) atau Tidak (T).
2. Penyajian buku ajar ini didasarkan pada urutan text sequence map tahapan STL (lihat pada lampiran 4).
3. Pembubuhan tanda ceklis (√) pada tahap kontak, kuriositi, elaborasi dan pengambilan keputusan diberikan per tujuan pembelajaran.
4. Pembubuhan tanda ceklis pada tahap nexus, diberikan per bagian yang meliputi dekontekstualisasi (rangkuman) dan
rekontekstualisasi.
5. Jika ada koreksian terhadap penulisan buku ajar ini, dapat dituliskan langsung di dekat teks tersebut.
6. Saran perbaikan dan tanggapan dapat dituliskan pada halaman akhir lembar validasi.
82 Format Validasi Ahli terhadap Buku Ajar Reaksi Redoks dengan Konteks Kembang Api
Keterangan:
Berilah tanda ceklis (√) pada kolom validasi berikut ini
Tujuan Pembelajaran Teks Keluaran
Ketepatan isi
Kembang api merupakan bahan peledak berdaya ledak rendah yang umumnya digunakan untuk hiburan dan merupakan salah satu bagian dari piroteknik. Istilah piroteknik merujuk kepada suatu bidang yang melibatkan bahan ledakan terutama untuk tujuan pencahayaan. Salah satu bentuk kembang api yang sering kita temui yaitu pada pertunjukan kembang api. Secara umum, kembang api menghasilkan empat efek, yaitu suara, cahaya, asap, dan dapat terbang. Kembang api dirancang agar dapat meledak sedemikian rupa dan menghasilkan cahaya yang berwarna-warni seperti merah, jingga, kuning, hijau, biru, ataupun ungu.
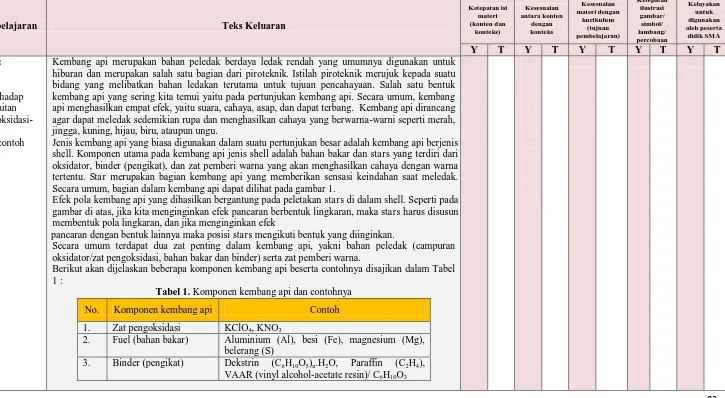
Jenis kembang api yang biasa digunakan dalam suatu pertunjukan besar adalah kembang api berjenis shell. Komponen utama pada kembang api jenis shell adalah bahan bakar dan stars yang terdiri dari oksidator, binder (pengikat), dan zat pemberi warna yang akan menghasilkan cahaya dengan warna tertentu. Star merupakan bagian kembang api yang memberikan sensasi keindahan saat meledak. Secara umum, bagian dalam kembang api dapat dilihat pada gambar 1.
Efek pola kembang api yang dihasilkan bergantung pada peletakan stars di dalam shell. Seperti pada gambar di atas, jika kita menginginkan efek pancaran berbentuk lingkaran, maka stars harus disusun membentuk pola lingkaran, dan jika menginginkan efek
pancaran dengan bentuk lainnya maka posisi stars mengikuti bentuk yang diinginkan.
Secara umum terdapat dua zat penting dalam kembang api, yakni bahan peledak (campuran oksidator/zat pengoksidasi, bahan bakar dan binder) serta zat pemberi warna.
Berikut akan dijelaskan beberapa komponen kembang api beserta contohnya disajikan dalam Tabel 1 :
Tabel 1. Komponen kembang api dan contohnya
No. Komponen kembang api Contoh
1. Zat pengoksidasi KClO4, KNO3
2. Fuel (bahan bakar) Aluminium (Al), besi (Fe), magnesium (Mg), belerang (S)
3. Binder (pengikat) Dekstrin (C6H10O5)n.H2O, Paraffin (C2H4),
VAAR (vinyl alcohol-acetate resin)/ C6H10O3
83
Tujuan Pembelajaran Teks Keluaran
Ketepatan isi materi (konten dan
konteks)
Kesesuaian antara konten
dengan konteks
materi dengan kurikulum
(tujuan pembelajaran)
ilustrasi gambar/ simbol/ lambang/ percobaan
untuk digunakan oleh peserta
didik SMA
Y T Y T Y T Y T Y T
4. Zat pemberi warna SrCl2 (merah), BaCl2 (hijau), CuCl (biru), Mg
84
Tujuan Pembelajaran Teks Keluaran
Ketepatan isi
1.1 Peserta didik mampu menjelaskan
Berdasarkan pengantar kembang api di atas, jelaskan bagaimana keterkaitan komponen penyusun kembang api dengan konsep-konsep reaksi oksidasi reduksi?
2.1 Peserta didik
Zat pengoksidasi biasanya merupakan padatan ionik yang kaya oksigen yang terdekomposisi pada suhu tinggi membebaskan gas oksigen. Bahan-bahan ini harus tesedia dalam bentuk murni, dalam ukuran partikel yang tepat dan harga yang terjangkau. Zat pengoksidasi harus memberikan reaksi netral saat basah, dan stabil pada suhu (hingga 100oC), dan mudah terurai untuk melepaskan oksigen pada suhu yang lebih tinggi. Untuk penggunaan kimia piroteknik, spesis ion negatif (anion) yang digunakan beragam, biasanya mengandung ikatan berenergi tinggi seperti Cl-O atau N-O. Beberapa contoh ion dari zat pengoksidasi yaitu ion nitrat (NO3-), ion perklorat (ClO4-), ion oksida (O-2), serta
ion klorat (ClO3-). Reaksi redoks yang dapat terbentuk dari beberapa zat pengoksidasi ialah, sebagai
berikut:
KClO4 KCl + 2O2 (1.1)
4KNO3 + 5S 2K2O + 2N2 + 5SO2 (1.2) Gambar 1. Bagian dalam kembang api
Terkait dengan konsep reaksi oksidasi reduksi berdasarkan pelepasan dan pengikatan oksigen.
Terkait dengan konsep reaksi oksidasi reduksi berdasarkan perubahan biloks.
Terkait dengan konsep reaksi oksidasi reduksi berdasarkan pelepasan dan pengikatan elektron
85
Tujuan Pembelajaran Teks Keluaran
Ketepatan isi
Beberapa sifat yang harus dipenuhi oleh zat pengoksidasi diantaranya harus rendah tingkat higroskopiknya, yaitu kecenderungan untuk memperoleh kelembaban dari atmosfer. Logam alkali (Li, Na dan K) dan logam alkali tanah (Ca, Sr dan Ba) lebih disukai untuk ion positif. Logam ini merupakan donor elektron yang baik dan tidak akan bereaksi selama penyimpanan dengan bahan bakar logam aktif seperti Mg dan Al. Selain itu, zat pengoksidasi harus memiliki panas yang baik saat terdekomposisi. Sifat yang terlalu eksotermik dapat menghasilkan ledakan atau campuran dengan sensitivitas tinggi, sedangkan sifat yang terlalu endotermik akan menyebabkan kesulitan dalam penyulutan, serta perambatan yang kurang baik pada saat pembakaran. Perhatikan contoh zat pengoksidasi KClO4 yang direaksikan dengan bahan bakar Mg dalam reaksi berikut:
3KClO4 + 12Mg 3KCl + 12MgO (1.3)
Berikut beberapa contoh zat pengoksidasi yang sering digunakan dalam kembang api sebagai komponen penyusunnya :
Kalium Nitrat (KNO3)
Oksidator padat yang digunakan dalam campuran berenergi-tinggi ialah kalium nitrat. Kelebihan yang dimiliki kalium nitrat sebagai oksidator ialah memiliki sifat bahan dengan kemurnian tinggi serta biaya yang terjangkau, memiliki tingkat higroskopik yang rendah sehingga pembakaran lebih mudah untuk dilakukan, memiliki kandungan oksigen aktif yang tinggi sekitar 39,6%, dan dapat terurai pada suhu tinggi. Persamaan reaksinya dapat dilihat sebagai berikut :
2KNO3 K2O + N2 + 2,5O2
Ketika dicampurkan dengan bahan bakar organik sederhana seperti laktosa, kalium nitrat akan sulit terbakar dan berhenti membentuk senyawa kalium nitrit dengan persamaan:
KNO3 KNO2 + 1/2O2
Sedangkan dengan bahan bakar yang baik, (seperti arang dan logam aktif), kalium nitrat akan bereaksi dengan baik.
Kalium perklorat (KClO4)
Kalium perklorat memiliki karakteristik berwarna putih, bahan kristal nonhigroskopik dengan titik leleh 610oC. Mengalami dekomposisi pada suhu tinggi membentuk kalium klorida dan gas oksigen, dengan persamaan:
Panas
KClO4 KCl + 2O2
Reaksi tersebut bersifat eksotermik dan menghasilkan oksigen yang cukup besar. Kandungan oksigen aktif dari KClO4 sekitar 46,2%, ini merupakan satu yang tertinggi yang tersedia untuk
86
Tujuan Pembelajaran Teks Keluaran
Ketepatan isi
piroteknik. Kalium perklorat dapat digunakan untuk menghasilkan warna api (seperti merah ketika dikombinasikan dengan strontium nitrat), kebisingan (dengan aluminium, dalam campuran flash dan suara), dan cahaya (dalam campuran potoplash dengan magnesium). Beberapa zat lainnya juga menunjukkan perubahan warna ketika bereaksi. Misalnya pada reaksi pembentukan warna dalam kembang api oleh SrCl2, BaCl2 dan CuCl. menghasilkan asap. Kebanyakan reaksi peledak dan piroteknik menghasilkan jumlah asap yang cukup bayak. Meskipun pada dasarnya, fenomena tersebut tidak diinginkan karena dapat mengganggu kesehatan. Tidak hanya itu, gas lain seperti SO2 (lihat persamaan reaksi 1.2) juga
merupakan gas yang dapat memberikan efek yang kurang baik karena bersifat racun. Oleh karena itu, untuk menghindari keracunan gas tersebut maka pembakaran harus dilakukan di tempat terbuka atau dengan ventilasi yang baik.
2.3 Peserta didik mampu menjelaskan
Selain zat pengoksidasi, campuran piroteknik juga berisi satu atau lebih bahan bakar yang bereaksi dengan oksigen yang dibebaskan dari zat pengoksidasi untuk menghasilkan panas dan produk yang teroksidasi. Panas ini yang nantinya dapat menghasilkan berbagai efek seperti warna, gerak, cahaya, asap atau bunyi. Misalnya campuran zat pengoksidasi seperti KClO4 atau KClO3 dan bahan bakar
logam, dapat menghasilkan bunyi ledakan yang keras.
Efek piroteknik yang diinginkan harus dipertimbangkan dengan cermat ketika bahan bakar yang dipilih dipasangkan dengan zat pengoksidasi. Suhu nyala api yang akan diproduksi dan sifat dari produk reaksi merupakan faktor penting yang harus diperhatikan. Persyaratan yang harus dipenuhi sebagai suatu bahan bakar untuk beberapa kategori piroteknik ialah sebagai berikut:
Bahan pendorong (terbang); merupakan kombinasi penghasil suhu reaksi yang tinggi, berat molekul gas yang rendah, dan tingkat pembakaran yang cepat. Senyawa organik (mengandung karbon) seperti glukosa sering digunakan sebagai komponen, karena selain memberikan panas, bahan bakar ini juga dapat menghasilkan tekanan gas yang signifikan melalui produksi karbondioksida (CO2), sehingga kembang api dapat terdorong ke atas. Persamaan reaksi yang
dihasilkan dapat dilihat sebagai berikut:
3KClO4 + C6H12O6 6CO2 + 6H2O + 3KCl
(glukosa)
Komponen yang menerangi; magnesium umumnya ditemukan dalam campuran karena
87
Tujuan Pembelajaran Teks Keluaran
Ketepatan isi
Komponen warna nyala; suhu reaksi yang tinggi menghasilkan intensitas cahaya yang
maksimum, tetapi kualitas warna tergantung pada penghasil warna yang ada dalam nyala. Magnesium kadang-kadang ditambahkan ke campuran warna nyala untuk menghasilkan intensitas yang lebih tinggi, tetapi kualitas warna mungkin sedikit karena partikel MgO memiliki emisi yang luas.
Berbagai material dapat digunakan sebagai bahan bakar dalam campuran, dan pemilihan bahan dipengaruhi oleh beberapa faktor, seperti jumlah maupun laju pelepasan panas yang dibutuhkan, biaya bahan, stabilitas bahan bakar dan jumlah produk gas yang diinginkan.
2.4 Peserta didik
Suatu komponen piroteknik biasanya akan berisi 2-6% binder, yang berfungsi menahan semua komponen dalam campuran dan memberikan kekuatan mekanik hingga dihasilkan komponen dalam bentuk butiran. Binder merupakan senyawa organik, yang juga berfungsi sebagai bahan bakar dalam campuran dan menghasilkan produk reaksi berupa gas. Tanpa binder, campuran komponen mungkin akan terpisah selama pembuatan dan penyimpanan dikarenakan variasi kerapatan dan ukuran partikel yang dimiliki oleh komponen. Proses pembutiran, dimana zat pengoksidasi, bahan bakar dan komponen lainnya yang dicampur dengan binder untuk menghasilkan butiran komposisi yang homogen, merupakan langkah penting dalam proses pembuatan.
Selain membantu dalam mencapai dan mempertahankan kehomogenan dalam komponen, binder juga berfungsi mengurangi debu dalam produk yang dihasilkan serta pengontrolan kerapatan pada saat pembutiran. Dekstrin ((C6H10O5)n.H2O) yang dihasilkan dari pati jagung merupakan salah satu
contoh binder yang cukup banyak digunakan dalam industri kembang api. Tidak hanya itu, dalam pencampuran air juga digunakan sebagai bahan pembasah/pengaktivasi dekstrin, namun hanya dapat digunakan ketika air tidak bereaksi dengan satu atau lebih komponen campuran. Hal ini dikarenakan ketika terjadi reaksi, dapat mengakibatkan perubahan ukuran partikel dalam komponen. Bahan organik juga akan mengurangi suhu nyala dari komponen yang mengandung bahan bakar logam, dan dapat memberikan warna jingga untuk api jika pembakaran tidak sempurna terjadi pada binder. Persamaan reaksinya dapat dilihat sebagai berikut:
C6H10O5 + 3O2 6CO + 5H2O
88
Tujuan Pembelajaran Teks Keluaran
Ketepatan isi materi (konten dan
konteks)
Kesesuaian antara konten
dengan konteks
Kesesuaian materi dengan
kurikulum (tujuan pembelajaran)
Ketepatan ilustrasi gambar/ simbol/ lambang/ percobaan
Kelayakan untuk digunakan oleh peserta
didik SMA
Y T Y T Y T Y T Y T
2.5 Peserta didik mampu menjelaskan karakteristik dan fungsi dari zat pemberi warna dalam kembang api.
4. Zat Pemberi Warna
Produksi cahaya terang dengan warna yang cerah, merupakan tujuan utama dari komponen piroteknik. Komponen penghasil warna dapat diletakkan dalam tabung sebagai tempat campuran komponen kembang api untuk menghasilkan berbagai percikan api dari berbagai pembakaran, dapat juga dijadikan butiran (stars) yang kemudian dikeluarkan ke udara dan dihasilkan percikan berbagai warna seperti putih, merah, hijau atau biru. Beberapa warna yang dapat dihasilkan dari percikan kembang api beserta komponen pembawanya ditunjukkan oleh gambar berikut ini:
Reaksi kimia yang dihasilkan dari masing-masing warna pada gambar kembang api di atas, ialah sebagai berikut:
2Mg + O2 2MgO (menghasilkan warna putih)
Gambar 2. Warna putih kembang api yang berasal
dari unsur Mg.
Gambar 3.
Warna merah kembang api yang diproduksi dari stronsium klorida (SrCl2).
Gambar 5. Warna hijau kembang api yang
diproduksi dari BaCl2. Gambar 4. Warna biru kembang api yang
89
Tujuan Pembelajaran Teks Keluaran
Ketepatan isi materi (konten dan
konteks)
Kesesuaian antara konten
dengan konteks
materi dengan kurikulum
(tujuan pembelajaran)
ilustrasi gambar/ simbol/ lambang/ percobaan
untuk digunakan oleh peserta
didik SMA
Y T Y T Y T Y T Y T
2SrCl2 + O2 2SrO + 2Cl2 (menghasilkan warna merah)
2CuCl + O2 2CuO + Cl2 (menghasilkan warna biru)
2BaCl2 + O2 2BaO + 2Cl2 (menghasilkan warna hijau)
3.1 Peserta didik mampu menjelaskan
pengertian oksidasi-reduksi berdasarkan pelepasan dan pengikatan oksigen.
1. Konsep reaksi oksidasi-reduksi berdasarkan pelepasan dan pengikatan oksigen
Berdasarkan persamaan reaksi 1.3 ada senyawa yang mengalami oksidasi dan ada juga yang mengalami reduksi. Senyawa KClO4 dalam reaktan berubah menjadi KCl dalam produknya, proses
tersebut dikatakan telah terjadi reduksi. Sedangkan unsur Mg dalam reaktan berubah menjadi MgO dalam produknya, proses tersebut dikatakan telah terjadi oksidasi. Dari uraian tersebut, dapatkah kamu mendefinisikan apa itu reduksi dan oksidasi?
Berkaitan dengan contoh tersebut, dalam komponen penyusun kembang api, ditemukan beberapa reaksi dengan konsep yang sama dari oksidasi maupun reduksi di dalamnya. Misalnya pada komponen zat pengoksidasi. Pada penerapannya, zat pengoksidasi biasanya merupakan padatan yang kaya oksigen yang kemudian terdekomposisi pada suhu tinggi dan membebaskan gas oksigen. Sebagai contoh, senyawa kalium perklorat (KClO4).
Senyawa kalium perklorat merupakan salah satu contoh senyawa yang memenuhi fungsi sebagai zat pengoksidasi, yang mengalami dekomposisi pada suhu tinggi membentuk kalium klorida dan gas oksigen, dengan reaksi :
Panas
KClO4 KCl + 2O2 (1.4)
Reaksi tersebut merupakan reaksi reduksi yang bersifat eksotermik dan menghasilkan oksigen yang cukup besar. Selanjutnya, oksigen yang dibebaskan akan bereaksi dengan fuel (bahan bakar) dalam kembang api dan terjadi reaksi oksidasi.
Bahan bakar yang baik akan bereaksi dengan oksigen untuk membentuk senyawa yang stabil dan menghasilkan panas yang cukup tinggi. Pemilihan material sebagai bahan bakar pada kembang api didasarkan kepada beberapa faktor yaitu jumlah output panas yang dibutuhkan, stabilitas bahan bakar, jumlah gas yang ingin dihasilkan, hingga ke harga bahan bakar tersebut. Beberapa unsur beserta sifatnya yang tergolong ke dalam bahan bakar disajikan dalam Tabel 2 berikut :
Tabel 2. Sifat bahan bakar
90
Tujuan Pembelajaran Teks Keluaran
Ketepatan isi proses oksidasi,logam magnesium akan berikatan dengan oksigen yang dibebaskan dari zat pengoksidasi dan dihasilkan panas yang cukup tinggi serta produk reaksi yaitu magnesium oksida (MgO). Persamaan reaksinya sebagai berikut :
Magnesium + Oksigen Magnesium oksida
2Mg(s) + O2(g) MgO(s) (1.5)
Perhatikan kembali persamaan reaksi 1.4 dan 1.5. Jadi apa perbedaan oksidasi dibandingkan dengan reduksi jika dikaitkan dengan oksigen?
3.2 Peserta didik mampu mengaitkan konsep
Untuk memperkuat kembali pengertian dari oksidasi dan reduksi berdasarkan konsep pelepasan dan pengikatan oksigen, mari kita lihat contoh reaksi redoks lainnya yang terjadi pada komponen kembang api, misalnya pada zat pengoksidasi KClO4 dengan bahan bakar Fe, persamaan reaksinya
sebagai berikut :
3KClO4 + 8Fe 3KCl + 4Fe2O3
Logam Fe sebagai bahan bakar telah mengalami oksidasi yaitu berikatan dengan atom oksigen yang dilepaskan dari zat pengoksidasi KClO4 dan disebut juga sebagai reduktor. Sedangkan dengan kata
lain KClO4 mengalami reduksi dan disebut juga sebagai oksidator. Jadi, apa perbedaan antara
oksidator dan reduktor? 3.3 Peserta didik mampu
menjelaskan konsep
Oksidasi adalah kombinasi suatu unsur dengan oksigen untuk menghasilkan oksida,
sedangkan reduksi adalah pelepasan oksigen dari oksida untuk menghasilkan unsur.
Oksidasi
Reduksi
Oksidator adalah zat yang mengalami reduksi (melepaskan oksigen),
91
Tujuan Pembelajaran Teks Keluaran
Ketepatan isi materi (konten dan
konteks)
Kesesuaian antara konten
dengan konteks
materi dengan kurikulum
(tujuan pembelajaran)
ilustrasi gambar/ simbol/ lambang/ percobaan
untuk digunakan oleh peserta
didik SMA
Y T Y T Y T Y T Y T
4.1 Peserta didik mampu menjelaskan
pengertian oksidasi-reduksi berdasarkan pelepasan dan pengikatan elektron.
2. Konsep reaksi oksidasi-reduksi berdasarkan pelepasan dan pengikatan elektron
Pada perkembangannya, tidak semua reaksi redoks dapat dijelaskan berdasarkan konsep pelepasan dan pengikatan oksigen. Sehingga, istilah oksidasi dan reduksi harus memiliki arti yang lebih luas, yang berlaku juga untuk reaksi-reaksi yang tidak melibatkan oksigen namun tetap mengalami proses reaksi oksidasi-reduksi. Konsep reaksi ini yakni melibatkan pelepasan dan pengikatan elektron oleh suatu zat.
Misalnya pada reaksi pembentukan magnesium oksida (MgO), sebagai hasil dari pembakaran Mg pada kembang api. Proses ini dapat dibuat menjadi dua tahap terpisah, tahap yang satu melibatkan hilangnya empat elektron dari dua atom Mg dan tahap yang lain melibatkan penangkapan empat elektron oleh molekul O2. Masing-masing tahap tersebut dinamakan reaksi setengah-sel, reaksinya
ialah sebagai berikut :
2Mg 2Mg2+ + 4e- (oksidasi) O2 + 4e- 2O2- (reduksi)
Sekilas, dari reaksi setengah sel di atas, dapatkah kamu menjelaskan apa itu oksidasi dan reduksi jika dikaitkan dengan elektron?
Untuk lebih mengetahui apa itu oksidasi dan reduksi jika dikaitkan dengan elektron, mari kita perhatikan penjelasan dari gambar berikut ini:
Jumlah dari kedua reaksi setengah-sel di atas memberikan reaksi keseluruhan, dengan menghapus elektron-elektron dari kedua sisi persamaan reaksi, menjadi :
2Mg(s) + O2(g) 2MgO(s)
Reduksi adalah ……… Oksidasi adalah ………..….
Gambar 6.
92
Tujuan Pembelajaran Teks Keluaran
Ketepatan isi materi (konten dan
konteks)
Kesesuaian antara konten
dengan konteks
Kesesuaian materi dengan
kurikulum (tujuan pembelajaran)
Ketepatan ilustrasi gambar/ simbol/ lambang/ percobaan
Kelayakan untuk digunakan oleh peserta
didik SMA
Y T Y T Y T Y T Y T
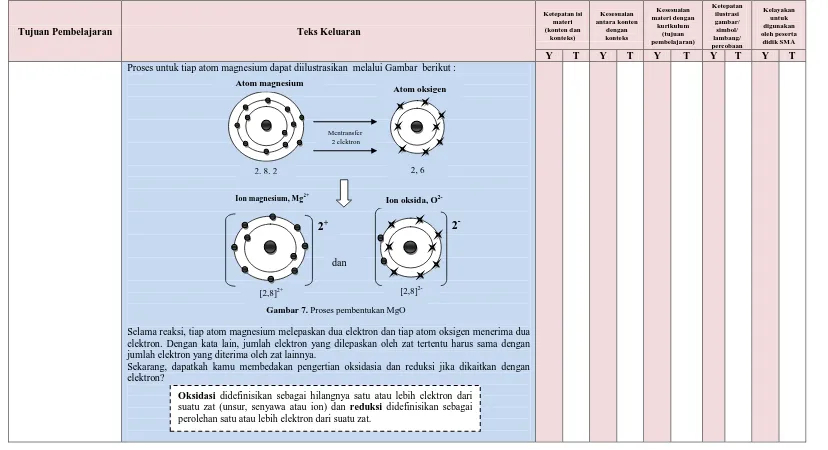
Proses untuk tiap atom magnesium dapat diilustrasikan melalui Gambar berikut :
Selama reaksi, tiap atom magnesium melepaskan dua elektron dan tiap atom oksigen menerima dua elektron. Dengan kata lain, jumlah elektron yang dilepaskan oleh zat tertentu harus sama dengan jumlah elektron yang diterima oleh zat lainnya.
Sekarang, dapatkah kamu membedakan pengertian oksidasia dan reduksi jika dikaitkan dengan elektron?
dan
Gambar 7. Proses pembentukan MgO Atom magnesium
2, 8, 2
Atom oksigen
2, 6 Mentransfer
2 elektron
2
-[2,8]
2-Ion oksida, O
2-2
+[2,8]2+
Ion magnesium, Mg2+
Oksidasi didefinisikan sebagai hilangnya satu atau lebih elektron dari
93
Feri Andi Syuhada, 2014
PENGEMBANGAN BUKU AJAR REAKSI REDOKS MENGGUNAKAN KONTEKS KEMBANG API UNTUK MENINGKATKAN LITERASI SAINS PESERTA DIDIK SMA Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
Tujuan Pembelajaran Teks Keluaran
Ketepatan isi
4.2 Peserta didik mampu mengaitkan konsep
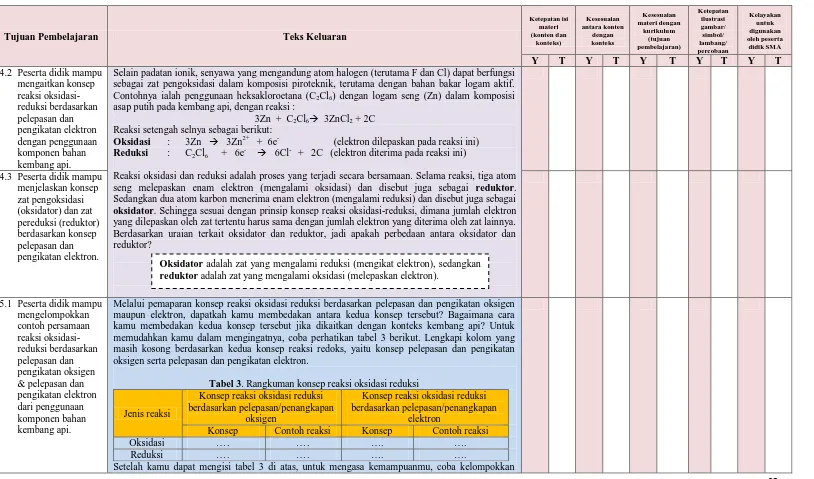
Selain padatan ionik, senyawa yang mengandung atom halogen (terutama F dan Cl) dapat berfungsi sebagai zat pengoksidasi dalam komposisi piroteknik, terutama dengan bahan bakar logam aktif. Contohnya ialah penggunaan heksakloroetana (C2Cl6) dengan logam seng (Zn) dalam komposisi
asap putih pada kembang api, dengan reaksi :
3Zn + C2Cl6 3ZnCl2 + 2C
Reaksi setengah selnya sebagai berikut:
Oksidasi : 3Zn 3Zn2+ + 6e- (elektron dilepaskan pada reaksi ini)
Reduksi : C2Cl6 + 6e- 6Cl- + 2C (elektron diterima pada reaksi ini)
Reaksi oksidasi dan reduksi adalah proses yang terjadi secara bersamaan. Selama reaksi, tiga atom seng melepaskan enam elektron (mengalami oksidasi) dan disebut juga sebagai reduktor. Sedangkan dua atom karbon menerima enam elektron (mengalami reduksi) dan disebut juga sebagai
oksidator. Sehingga sesuai dengan prinsip konsep reaksi oksidasi-reduksi, dimana jumlah elektron
yang dilepaskan oleh zat tertentu harus sama dengan jumlah elektron yang diterima oleh zat lainnya. Berdasarkan uraian terkait oksidator dan reduktor, jadi apakah perbedaan antara oksidator dan reduktor?
4.3 Peserta didik mampu menjelaskan konsep
5.1 Peserta didik mampu mengelompokkan
Melalui pemaparan konsep reaksi oksidasi reduksi berdasarkan pelepasan dan pengikatan oksigen maupun elektron, dapatkah kamu membedakan antara kedua konsep tersebut? Bagaimana cara kamu membedakan kedua konsep tersebut jika dikaitkan dengan konteks kembang api? Untuk memudahkan kamu dalam mengingatnya, coba perhatikan tabel 3 berikut. Lengkapi kolom yang masih kosong berdasarkan kedua konsep reaksi redoks, yaitu konsep pelepasan dan pengikatan oksigen serta pelepasan dan pengikatan elektron.
Tabel 3. Rangkuman konsep reaksi oksidasi reduksi
Jenis reaksi
Konsep reaksi oksidasi reduksi berdasarkan pelepasan/penangkapan
oksigen
Konsep reaksi oksidasi reduksi berdasarkan pelepasan/penangkapan
elektron
Konsep Contoh reaksi Konsep Contoh reaksi
Oksidasi …. …. …. ….
Reduksi …. …. …. ….
Setelah kamu dapat mengisi tabel 3 di atas, untuk mengasa kemampuanmu, coba kelompokkan
Oksidator adalah zat yang mengalami reduksi (mengikat elektron), sedangkan reduktor adalah zat yang mengalami oksidasi (melepaskan elektron).
c) FeF3 + Al AlF3 + Fe
94
Tujuan Pembelajaran Teks Keluaran
Ketepatan isi
reaksi-reaksi redoks yang terjadi pada kembang api di bawah ini berdasarkan kedua konsep reaksi redoks yang telah kamu pahami.
a) S + O2 SO2 6.1 Peserta didik mampu
menjelaskan konsep bilangan oksidasi berdasarkan aturan penentuan bilangan oksidasi.
3. Konsep reaksi oksidasi-reduksi berdasarkan perubahan biloks
a) Bilangan oksidasi (biloks)
Bilangan oksidasi (tingkat oksidasi) ialah jumlah elektron yang diperoleh atau yang hilang oleh
atom dari suatu unsur ketika membentuk suatu senyawa. Dalam reaksi redoks, perpindahan elektron menyebabkan terjadinya perubahan bilangan oksidasi. Oleh karena itu, penentuan bilangan oksidasi sangat penting untuk mengetahui apakah suatu reaksi berlangsung melalui proses redoks atau bukan. Perhatikan kembali biloks yang terdapat pada tiap atom dalam persamaan reaksi 1.2. Mengapa biloks pada atom N dalam senyawa KNO3 +5? Sedangkan dalam senyawa N2 memiliki biloks 0?
Begitu juga pada atom S dalam unsur bebas memiliki biloks 0 sedangkan dalam senyawa SO2
memiliki biloks +4. Untuk mengetahui mengapa biloks tersebut dapat berbeda-beda, mari kita bahas aturan dalam penentuan bilangan oksidasi berikut:
Aturan penentuan bilangan oksidasi :
1) Dalam unsur bebas (yaitu dalam keadaan tidak bergabung), setiap atom memiliki bilangan oksidasi nol.
Contoh :
2) Untuk ion-ion yang tersusun atas satu atom saja, bilanganoksidasinya sama dengan muatan ion tersebut.
Contoh :
Na+ Ca2+ Al3+ Cl- O2-
95
Tujuan Pembelajaran Teks Keluaran
Ketepatan isi materi (konten dan
konteks)
Kesesuaian antara konten
dengan konteks
materi dengan kurikulum
(tujuan pembelajaran)
ilustrasi gambar/ simbol/ lambang/ percobaan
untuk digunakan oleh peserta
didik SMA
Y T Y T Y T Y T Y T
+1 +2 +3 -1 -2
Jadi, untuk contoh yang lain, Li+ memiliki bilangan oksidasi +1; ion Ba2+, +2; ion Fe3+, +3; ion I-, -1 dan seterusnya. Semua logam alkali memiliki bilangan oksidasi +1, dan semua logam alkali tanah memiliki bilangan oksidasi +2 dalam senyawanya. Aluminium memiliki bilangan oksidasi +3 dalam semua senyawanya.
3) Sebuah atom dalam ion poliatomik atau senyawa molekul biasanya memiliki bilangan oksidasi
yang sama, seperti dalam bentuk ion monoatomik.
Dalam ion hidroksida (OH-) misalnya, atom oksigen memiliki bilangan oksidasi -2, seperti dalam ion monoatomik O2-, dan atom hidrogen memiliki bilangan oksidasi +1, seperti dalam bentuk H+.
Secara umum, semakin ke kiri suatu unsur dalam tabel periodik, semakin besar kemungkinan atom bersifat kation. Oleh karena itu, logam biasanya memiliki bilangan oksidasi positif. Semakin ke kanan suatu unsur dalam tabel periodik, semakin besar kemungkinan bahwa atom bersifat anion. Nonlogam seperti O, N, dan halogen biasanya memiliki bilangan oksidasi negatif.
a)
Hidrogen dapat memiliki biloks +1 atau -1. Ketika berikatan dengan logam, seperti Naatau Ca, hidrogen memiliki biloks -1. Ketika berikatan dengan nonlogam, seperti C, N, O atau Cl, hidrogen memiliki biloks +1.
b)
Oksigen biasanya memiliki biloks -2. Kecuali pada senyawa peroksida, yang mengandung ion O22- atau ikatan kovalen O – O dalam molekul. Setiap atom oksigendalam peroksida memiliki biloks -1.
Bilangan oksidasi
96
Tujuan Pembelajaran Teks Keluaran
Ketepatan isi materi (konten dan
konteks)
Kesesuaian antara konten
dengan konteks
Kesesuaian materi dengan
kurikulum (tujuan pembelajaran)
Ketepatan ilustrasi gambar/ simbol/ lambang/ percobaan
Kelayakan untuk digunakan oleh peserta
didik SMA
Y T Y T Y T Y T Y T
c)
Halogen biasanya memiliki biloks -1. Kecuali dalam suatu senyawa, dimana atomhalogen (klorin, bromine, atau iodin) berikatan dengan oksigen. Dalam kasus tersebut oksigen memiliki biloks -2, dan halogen memiliki biloks positif. Dalam Cl2O sebagai
contoh, atom O memiliki biloks -2 dan setiap atom Cl memiliki biloks +1.
4) Dalam molekul netral, jumlah bilangan oksidasi semua atom penyusunnya harus nol. Dalam
ion poliatomik, jumlah bilangan oksidasi semua unsur dalam ion tersebut harus sama dengan muatan total ion.
Contoh 1 :
Menentukan biloks atom sulfur dalam asam sulfat (H2SO4). Karena setiap atom H +1 dan
atom O -2, atom S harus memiliki biloks +6 untuk senyawa yang tidak memiliki muatan total :
Contoh 2 :
Menentukan biloks atom klorin dalam anion perklorat (ClO4-), kita mengetahui bahwa setiap
atom oksigen adalah -2, sehingga atom Cl harus memiliki biloks +7, agar muatan totalnya -1
Contoh 3 :
Untuk menentukan biloks atom nitrogen dalam kation amonium (NH4+), kita tahu bahwa Muatan total
97
Tujuan Pembelajaran Teks Keluaran
Ketepatan isi
setiap atom H +1, atom N harus memiliki biloks -3, agar muatan totalnya +1.
5) Bilangan oksidasi tidak harus bilangan bulat. Sebagai contoh, bilangan oksidasi O dalam ion
superoksida (O2-) adalah -1/2.
7.1 Peserta didik mampu menentukan 7.2 Peserta didik mampu
menentukan bilangan oksidasi atom dalam ion dari komponen kembang api berdasarkan aturan yang berlaku 8.1 Peserta didik mampu
mengaitkan konsep
b) Perubahan bilangan oksidasi dalam reaksi redoks
Perkembangan reaksi redoks lebih lanjut dikaitkan dengan konsep yang disebut dengan perubahan bilangan oksidasi. Perubahan bilangan oksidasi terjadi pada atom dalam unsur atau senyawa dalam suatu rekasi tertentu. Perhatikan persamaan reaksi antara heksakloroetana (C2C16)
dengan logam seng (Zn) berikut:
3Zn + C2Cl6 3ZnCl2 + 2C Muatan total
Untuk menguji pemahamanmu dalam memahami beberapa aturan penentuan biloks, coba kamu tentukan biloks dari tiap atom dalam molekul dan ion berikut ini:
98
Tujuan Pembelajaran Teks Keluaran
Ketepatan isi materi (konten dan
konteks)
Kesesuaian antara konten
dengan konteks
Kesesuaian materi dengan
kurikulum (tujuan pembelajaran)
Ketepatan ilustrasi gambar/ simbol/ lambang/ percobaan
Kelayakan untuk digunakan oleh peserta
didik SMA
Y T Y T Y T Y T Y T
8.2 Peserta didik mampu menjelaskan konsep zat pengoksidasi (oksidator) dan zat pereduksi (reduktor) berdasarkan konsep perubahan bilangan oksidasi.
Reaksi di atas sebelumnya telah dibahas pada konsep pelepasan dan pengikatan elektron. Namun, reaksi tersebut juga mengalami perubahan bilangan oksidasi. Perhatikan bagaimana bilangan oksidasi berubah selama reaksi. Berdasarkan aturan penentuan bilangan oksidasi, bilangan oksidasi Zn berubah dari 0 ke +2, artinya tiap atom seng melepaskan dua elektron selama reaksi, untuk membentuk ion Zn2+. Sedangkan atom karbon dari reaktan C2Cl6 mengalami penurunan bilangan
oksidasi yaitu dari +3 ke 0, artinya tiap atom karbon memperoleh tiga elektron, untuk membentuk C.
Jadi apa perbedaan oksidasi dibandingkan dengan reduksi, jika ditinjau dari perubahan bilangan oksidasinya?
Persamaan reaksi 1.3 memenuhi konsep reaksi redoks berdasarkan perubahan bilangan oksidasi, ini dapat dilihat dari bilangan oksidasi masing atom penyusunnya. Perhatikan biloks masing-masing atom dalam reaksi di bawah ini:
3KClO4 + 12Mg 3KCl + 12MgO
Prinsip ini juga dapat kita terapkan pada reaksi-reaksi lainnya yang terjadi dalam kembang api. Misalnya pada zat pengoksidasi KNO3. Ketika zat pengoksidasi KNO3 bereaksi dengan bahan bakar
sulfur (S), maka akan terbentuk beberapa senyawa sebagai produknya. Berikut persamaan beserta bilangan oksidasinya :
4KNO3 + 5S 2K2O + 2N2 + 5SO2
Oksidasi didefinisikan sebagai kenaikan bilangan oskidasi atom dalam
unsur atau senyawa tertentu, sedangkan reduksi didefinisikan sebagai penurunan bilangan oksidasi atom dalam unsur atau senyawa tertentu.
Reduksi
+1 +7 -2 0 +1 -1 +2 -2
Oksidasi
99
Tujuan Pembelajaran Teks Keluaran
Ketepatan isi
Mengacu pada aturan penentuan bilangan oskidasi, dalam reaksi di atas terjadi perubahan bilangan oksidasi, yaitu pada atom N dan S. Dimana atom N mengalami penurunan bilangan oksidasi dari +5 ke 0, sehingga N mengalami reduksi dan disebut sebagai oksidator, sedangkan atom S mengalami kenaikan bilangan oksidasi dari 0 ke +4, sehingga S mengalami oksidasi dan disebut sebagai reduktor. Berdasarkan uraian tersebut, jadi apakah perbedaan antara oksidator dan reduktor?
10.1 Peserta didik
Kembang api dapat menghasilkan berbagai macam warna, seperti merah, hijau, biru ataupun putih. Seperti yang telah kamu pelajari sebelumnya, tentunya kamu sudah mengetahui senyawa-senyawa yang terkandung dalam kembang api yang dapat memancarkan warna tersebut. Berikut beberapa reaksi yang terjadi dalam zat pemberi warna :
1. Mg + O2 MgO
2. 2SrCl2 + O2 2SrO + 2Cl2
3. 2CuCl + O2 2CuO + Cl2
4. 2BaCl2 + O2 2BaO + 2Cl2
Dari masing-masing reaksi di atas, tunjukkan senyawa mana yang mengalami oksidasi dan senyawa mana yang mengalami reduksi (jika ada) berdasarkan konsep:
a. Pengikatan dan pelepasan oksigen b. Pengikatan dan pelepasan elektron c. Perubahan biloks.
1. Melakukan uji logam menggunakan nyala api 2. Mengamati prilaku logam dalam nyala api
Reduksi Oksidasi
Oksidator adalah zat yang mengalami reduksi (mengalami penurunan bilangan
oksidasi), sedangkan reduktor adalah zat yang mengalami oksidasi (mengalami kenaikan bilangan oksidasi).
100
Tujuan Pembelajaran Teks Keluaran
Ketepatan isi
3. Mengidentifikasi logam melalui warna yang dipancarkan dalam nyala api
B. Alat dan bahan beberapa larutan yang telah disediakan. Kemudian, gunakan hasil di langkah awal untuk menguji warna larutan sampel yang tidak diketahui di langkah berikutnya.
a) Memastikan kawat uji yang nantinya digunakan di percobaan dalam keadaan bersih, tidak terkontaminasi oleh zat apapun. Cara mengujinya ialah dengan membakar kawat uji di atas pembakar Bunsen.
b) Jika kawat uji dalam keadaan bersih, maka tidak akan ada perubahan warna api pada kawat. Tetapi, jika kawat uji tidak bersih (terkontamiansi), akan ada perubahan warna. Maka cara membersihkannya ialah dengan mencelupkan kawat uji ke dalam asam pekat yang telah disediakan, kemudian membakarnya kembali di atas pembakar Bunsen. Ulangi pembersihan ini, sampai tidak ada perubahan warna api pada kawat uji.
c) Tugas selanjutnya ialah melakukan tes uji nyala. Celupkan kawat uji yang sudah bersih ke dalam salah satu larutan (misalnya BaCl2).
d) Panaskan kawat uji di atas pembakar Bunsen. Perhatikan apa yang terjadi. Catat warna nyala dalam tabel hasil pengamatan yang telah kamu buat.
e) Bersihkan kembali kawat uji yang telah digunakan seperti pada langkah di aktivitas 1. Kemudian menguji kembali larutan lainnya (CuCl, SrCl2, NaCl, Ba(NO3)2 dan KCl), catat
hasil pengamatan dalam tabel.
Sebelum ke langkah selanjutnya, mintalah pada guru untuk memeriksanya. Pastikan langkah yang kamu lakukan sudah benar.
101
Tujuan Pembelajaran Teks Keluaran
Ketepatan isi
Ulangi langkah pada point c, tetapi kali ini menggunakan 4 larutan sampel yang belum diketahui. Catat jenis sampel, warna nyala dan logam yang terkandung di dalam sampel tersebut dalam tabel hasil pengamatan yang telah kamu buat.
11.1 Peserta didik
D. Hasil pengamatan dan pembahasan
Tulis dan beri penjelasan dari hasil pengamatanmu dalam percobaan.
E. Kesimpulan
Tuliskan masing-masing kesimpulan dari kedua uji di atas.
12.1 Peserta didik mampu
Tuliskan keseluruhan hasil praktikum dalam kertas A4 dan sajikan untuk didiskusikan di depan kelas bersama kelompok lainnya.
1. Dekonteks-tualisasi Rangkuman
Kembang api merupakan bahan peledak berdaya ledak rendah yang umumnya digunakan untuk
hiburan dan merupakan salah satu bagian dari piroteknik. Istilah piroteknik merujuk kepada suatu bidang yang melibatkan bahan ledakan terutama untuk tujuan pencahayaan. Secara umum terdapat dua zat penting dalam kembang api, yakni bahan peledak (campuran oksidator/zat pengoksidasi, bahan bakar dan binder) serta zat pemberi warna. Beberapa reaksi yang terjadi dalam komponen penyusun kembang api, ialah sebagai berikut :
102
Tujuan Pembelajaran Teks Keluaran
Ketepatan isi materi (konten dan
konteks)
Kesesuaian antara konten
dengan konteks
Kesesuaian materi dengan
kurikulum (tujuan pembelajaran)
Ketepatan ilustrasi gambar/ simbol/ lambang/ percobaan
Kelayakan untuk digunakan oleh peserta
didik SMA
Y T Y T Y T Y T Y T
2Mg + O2 2MgO
3. Binder (pengikat)
C6H10O5 + 3O2 6CO + 5H2O
4. Zat pemberi warna
Mg + O2 MgO (menghasilkan warna putih)
2SrCl2 + O2 2SrO + 2Cl2 (menghasilkan warna merah)
2CuCl + O2 2CuO + Cl2 (menghasilkan warna biru)
2BaCl2 + O2 2BaO + 2Cl2 (menghasilkan warna hijau)
Perkembangan Konsep Reaksi Redoks
1. Konsep reaksi oksidasi-reduksi berdasarkan pelepasan dan pengikatan oksigen
Oksidasi adalah kombinasi suatu unsur dengan oksigen untuk menghasilkan oksida, sedangkan reduksi adalah pelepasan oksigen dari oksida untuk menghasilkan unsur.
Contoh : Panas
KClO4 KCl + 2O2 (reduksi)
2Mg + O2 MgO (oksidasi)
2. Konsep reaksi oksidasi-reduksi berdasarkan pelepasan dan pengikatan elektron
Oksidasi didefinisikan sebagai hilangnya satu atau lebih elektron dari suatu zat (unsur,
senyawa atau ion) dan reduksi didefinisikan sebagai perolehan satu atau lebih elektron dari suatu zat.
Contoh :
2Mg + O2 MgO
2Mg 2Mg2+ + 4e- (oksidasi) O2 + 4e- 2O2- (reduksi)
3. Konsep reaksi oksidasi-reduksi berdasarkan perubahan biloks
Bilangan oksidasi (tingkat oksidasi) ialah jumlah elektron yang diperoleh atau yang hilang
oleh atom dari suatu unsur ketika membentuk suatu senyawa. Pada konsep ini, oksidasi didefinisikan sebagai kenaikan bilangan oskidasi atom dalam unsur atau senyawa tertentu, sedangkan reduksi didefinisikan sebagai penurunan bilangan oksidasi.
Contoh :
4KNO3 + 5S 2K2O + 2N2 + 5SO2
103
Tujuan Pembelajaran Teks Keluaran
Ketepatan isi materi (konten dan
konteks)
Kesesuaian antara konten
dengan konteks
materi dengan kurikulum
(tujuan pembelajaran)
ilustrasi gambar/ simbol/ lambang/ percobaan
untuk digunakan oleh peserta
didik SMA
Y T Y T Y T Y T Y T
Zat pengoksidasi dan zat pereduksi
Zat pengoksidasi (oksidator) didefinisikan sebagai zat yang menyebabkan zat lain
teroksidasi (zat tersebut mengalami reduksi) dengan menerima elektron. Sedangkan zat pereduksi
(reduktor) adalahzat yang menyebabkan zat lain tereduksi (zat tersebut mengalami oksidasi)
dengan memberikan elektron. 2. Rekonteks-tualisasi 1. Redoks dalam Blast Furnace
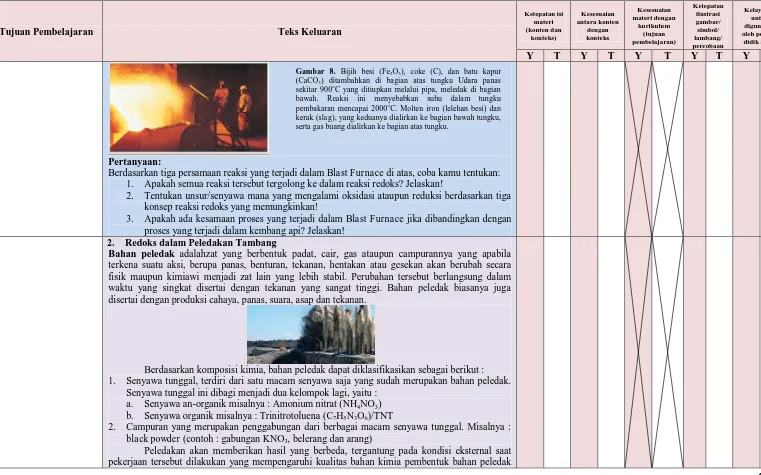
Blast Furnace merupakan jenis tungku yang digunakan untuk peleburan dalam menghasilkan logam industri, misalnya logam besi. Besijarangditemukandalam bentukunsur. Logam besi harus dipisahkan dan dimurnikan dari bijih besi (Fe2O3). Proses ini berlangsung dalam blast furnace
dalam serangkaian reaksi redoks. Di dalam blast furnace, fuel (bahan bakar), bijih besi (iron ore), dan batu kapur(limestone) secara terus menerus disuplai melalui bagian atas tungku, sementara ledakan panas dari udara (kadang-kadang dengan pengayaan oksigen) ditiupkan ke bagian bawah tungku melalui pipa yang disebut tuyeres, sehingga terjadi reaksi kimia sepanjang proses tersebut (lihat gambar 7). Di samping itu juga akan timbul percikan cahaya yang berasal dari serbuk bijih besi. Reaksiutama dari reaksi kimia tersebut ialah bijih besidireduksi menjadilogambesimenggunakangaskarbon monoksidasebagaireduktor.
Proses yang terjadi di dalamnya berawal dari tiupan udara panas yang melalui pipa, menyebabkan karbon (coke) terbakar menghasilkan karbondioksida dan panas. Batu kapur (CaCO3) yang
dicampur dengan bijih besi di dalam tungku, akan terurai membentuk kapur (CaO) dan karbondioksida (CO2). Karbondioksida kemudian mengoksidasi C dalam reaksi redoks untuk
membentuk karbonmonoksida, yang digunakan untuk mereduksi bijih besi menjadi besi. Produk akhir umumnya dalam fasa logam cair (molten iron) dan kerak (slag), yang keduanya dialirkan ke bagian bawah tungku, serta gas buang dialirkan ke bagian atas tungku. Proses tersebut diilustrasikan dalam gambar di bawah ini, dan reaksi yang terjadi sebagai berikut :
CaCO3 (s) CaO(s) + CO2 (g)
CO2 (g) + C(s) 2CO(g)
2Fe3+(s) + 3O2-(s) + 3CO(g) 2Fe(l) + 3CO2(g)
104
Tujuan Pembelajaran Teks Keluaran
Ketepatan isi materi (konten dan
konteks)
Kesesuaian antara konten
dengan konteks
Kesesuaian materi dengan
kurikulum (tujuan pembelajaran)
Ketepatan ilustrasi gambar/ simbol/ lambang/ percobaan
Kelayakan untuk digunakan oleh peserta
didik SMA
Y T Y T Y T Y T Y T
Pertanyaan:
Berdasarkan tiga persamaan reaksi yang terjadi dalam Blast Furnace di atas, coba kamu tentukan: 1. Apakah semua reaksi tersebut tergolong ke dalam reaksi redoks? Jelaskan!
2. Tentukan unsur/senyawa mana yang mengalami oksidasi ataupun reduksi berdasarkan tiga konsep reaksi redoks yang memungkinkan!
3. Apakah ada kesamaan proses yang terjadi dalam Blast Furnace jika dibandingkan dengan proses yang terjadi dalam kembang api? Jelaskan!
2. Redoks dalam Peledakan Tambang
Bahan peledak adalahzat yang berbentuk padat, cair, gas ataupun campurannya yang apabila
terkena suatu aksi, berupa panas, benturan, tekanan, hentakan atau gesekan akan berubah secara fisik maupun kimiawi menjadi zat lain yang lebih stabil. Perubahan tersebut berlangsung dalam waktu yang singkat disertai dengan tekanan yang sangat tinggi. Bahan peledak biasanya juga disertai dengan produksi cahaya, panas, suara, asap dan tekanan.
Berdasarkan komposisi kimia, bahan peledak dapat diklasifikasikan sebagai berikut : 1. Senyawa tunggal, terdiri dari satu macam senyawa saja yang sudah merupakan bahan peledak.
Senyawa tunggal ini dibagi menjadi dua kelompok lagi, yaitu : a. Senyawa an-organik misalnya : Amonium nitrat (NH4NO3)
b. Senyawa organik misalnya : Trinitrotoluena (C7H5N3O6)/TNT
2. Campuran yang merupakan penggabungan dari berbagai macam senyawa tunggal. Misalnya :
black powder (contoh : gabungan KNO3, belerang dan arang)
Peledakan akan memberikan hasil yang berbeda, tergantung pada kondisi eksternal saat pekerjaan tersebut dilakukan yang mempengaruhi kualitas bahan kimia pembentuk bahan peledak
Gambar 8. Bijih besi (Fe2O3), coke (C), dan batu kapur
(CaCO3) ditambahkan di bagian atas tungku Udara panas
sekitar 900oC yang ditiupkan melalui pipa, meledak di bagian
bawah. Reaksi ini menyebabkan suhu dalam tungku pembakaran mencapai 2000oC. Molten iron (lelehan besi) dan
105
Tujuan Pembelajaran Teks Keluaran
Ketepatan isi materi (konten dan
konteks)
Kesesuaian antara konten
dengan konteks
materi dengan kurikulum
(tujuan pembelajaran)
ilustrasi gambar/ simbol/ lambang/ percobaan
untuk digunakan oleh peserta
didik SMA
Y T Y T Y T Y T Y T
tersebut. Umumnya produk yang dikehendaki dari suatu peledakan adalah uap air (H2O),
karbondioksida (CO2), gas nitrogen (N2), dan oksida padat yang semuanya relatif bersifat inert dan
tidak beracun. Panas merupakan awal terjadinya proses dekomposisi bahan kimia pembentuk bahan peledak yang menimbulkan pembakaran, dilanjutkan dengan deflragrasi dan terakhir detonasi. Berikut penjelasan terkait dengan proses dekomposisi tersebut:
1. Pembakaran adalah reaksi permukaan yang eksotermis dan dijaga keberlangsungannya oleh
panas yang dihasilkan dari reaksi itu sendiri dan produknya berupa pelepasan gas-gas. Reaksi pembakaran memerlukan unsur oksigen (O2) baik yang terdapat di alam bebas maupun dari
ikatan molekuler bahan atau material yang terbakar. Contohnya ialah pada reaksi pembakaran minyak diesel, dengan persamaan reaksi:
CH3(CH2)10CH3 + 18½ O2 12 CO2 + 13 H2O
2. Deflagrasi merupakan fenomena reaksi permukaan yang reaksinya meningkat menjadi ledakan.
Contohnya pada reaksi peledakan black powder, dengan persamaan reaksi:
20KNO3 + 30C + 10S 6K2CO3 + K2SO4 + 3K2S + 14CO2 + 10CO + 10N2
3. Detonasi adalah proses kimia-fisika yang mempunyai kecepatan reaksi sangat tinggi, sehingga
menghasilkan gas dan temperature sangat besar. Contoh proses detonasi terjadi pada jenis bahan peledakan berikut, dengan persamaan reaksi:
C3H5N3O9 3CO2 + 2,5 H2O + 1,5 N2 + 0,25 O2 Pertanyaan:
Berdasarkan reaksi-reaksi yang terjadi dalam proses peledakandi atas, coba kamu tentukan: 1. Apakah semua reaksi tersebut tergolong ke dalam reaksi redoks? Jelaskan!
2. Tentukan unsur/senyawa mana yang mengalami oksidasi ataupun reduksi berdasarkan tiga konsep reaksi redoks yang memungkinkan!
3. Apakah ada kesamaan proses yang terjadi dalam peledakanjika dibandingkan dengan proses yang terjadi dalam kembang api? Jelaskan!
3. Redoks dalam Flare
106
Tujuan Pembelajaran Teks Keluaran
Ketepatan isi materi (konten dan
konteks)
Kesesuaian antara konten
dengan konteks
Kesesuaian materi dengan
kurikulum (tujuan pembelajaran)
Ketepatan ilustrasi gambar/ simbol/ lambang/ percobaan
Kelayakan untuk digunakan oleh peserta
didik SMA
Y T Y T Y T Y T Y T
Secara umum flare menghasilkan sebuah cahaya karena pembakaran logam magnesium yang kadang kadang dicampur dengan logam lain untuk menghasilkan warna lain yang akan berbeda dari warna yang aslinya. Flare mempunyai sifat tidak bisa padam atau tidak bisa mati walaupun disiram oleh air karena mempunyai sifat untuk memberi sebuah tanda apabila terjadi hal hal yang sangat penting dan bersifat darurat. Pada umumnya gas ataupun kebulan asap yang dihasilkan oleh flare mempunyai ketebalan asap yang sangat pekat dan bersifat ajeg, atau dalam artian kebulan asap tersebut dapat dengan lama bertahan berputar-putar di udara dengan jangka waktu yang lama karena dipengaruhi oleh sifat gas dalam flare tersebut.
Pertanyaan:
Berdasarkan pemaparan terkait dengan flare, coba tentukan: 1. Persamaan reaksi kimia yang terjadi di dalam flare!
2. Tentukan unsur/senyawa mana yang mengalami oksidasi ataupun reduksi berdasarkan tiga konsep reaksi redoks yang memungkinkan!