Kadar Asetil (ASTM D-678-91) Kandungan asetil ditentukan dengan cara melihat banyaknya NaOH yang dibutuhkan untuk menyabunkan contoh
O
R(O-C-CH3)x Na
O O-C-CH3 xNaOH R(OH)x
Contoh kering sebanyak 1 g dimasukkan ke dalam erlenmeyer kemudian ditambahkan 40 ml etanol 75% (v/v) dan dipanaskan pada penangas air selama 30 menit pada suhu 60°C. Ke dalam contoh ditambahkan 40 ml NaOH 0,5 N dan dipanaskan selama 30 menit pada suhu yang sama. Contoh didiamkan selama 72 jam dan kelebihan NaOH dititrasi dengan HCl 0,5 N menggunakan indikator fenolftalein sampai warna merah muda lenyap. Contoh didiamkan selama 24 jam untuk memberi kesempatan bagi NaOH berdifusi. Selanjutnya contoh dititrasi dengan NaOH 0,5 N sampai terbentuk warna merah muda. Pengukuran blanko dilakukan sama dengan contoh. Kadar asetil (KA) dihitung dengan rumus:
KA (%) = [(D-C)Na + (A-B)Nb] × (F/W) dengan A = volume NaOH yang dibutuhkan
untuk titrasi contoh
B = volume NaOH yang dibutuhkan untuk titrasi blanko
C = volume HCl yang dibutuhkan untuk titrasi contoh
D = volume HCl yang dibutuhkan untuk titrasi blanko
Na = Normalitas HCl Nb = Normalitas NaOH F = 4.305 untuk kadar asetil W = bobot contoh
Rancangan Percobaan
Pengaruh waktu aktivasi dan asetilasi terhadap kadar asetil pektin asetat dianalisis secara statistik dengan metode Rancangan Acak Lengkap (RAL) lalu dilanjutkan dengan uji Duncan dan kontras polinomial ortogonal (Mattjik & Sumertajaya 2002). Model rancangan tersebut adalah
Yijk = µ + τi + βj + (τβ)ij + εijk Keterangan:
Yijk = kadar asetil pektin asetat pada waktu aktivasi ke-i, waktu asetilasi ke-j, serta ulangan ke-k, dengan i = 1, 2, 3, j = 1, 2, 3, dan k = 1, 2, 3, 4. µ = rataan umum
τi = pengaruh waktu aktivasi ke-i βj = pengaruh waktu asetilasi ke-j
(τβ)ij = pengaruh interaksi waktu aktivasi ke-i serta waktu asetilasi ke-j
εijk = pengaruh acak dari waktu aktivasi ke-i, waktu asetilasi ke-j, serta ulangan ke-k.
Hipotesis yang diuji
1 Pengaruh waktu aktivasi
Ho = τ1 = τ2 = τ3 = 0 (waktu aktivasi
memberikan pengaruh yang sama terhadap kadar asetil)
H1 = setidaknya ada satu i dengan τi ≠
0, i = 1, 2, 3
2 Pengaruh waktu asetilasi
Ho = β1 = β2 = β3 = 0 (waktu asetilasi
memberikan pengaruh yang sama terhadap kadar asetil)
H1 = setidaknya ada satu j dengan βj ≠
0, j = 1, 2, 3
3 Pengaruh interaksi antara waktu aktivasi dan waktu asetilasi
Ho = (τβ)ij = 0 untuk semua ij
H1 = setidaknya ada satu (τβ)ij ≠ 0
HASIL DAN PEMBAHASAN
Ciri Bahan Baku
Fungsi pencirian bahan baku ialah menentukan kemurnian dan kelayakan pektin terhadap proses asetilasi. Hasil pencirian disajikan pada Tabel 1.
Tabel 1 Ciri bahan baku
Pencirian Pektin p.a. SNI
Kadar air (%) 8,48±0,03 maks. 12 Kadar abu (%) 2,19±0,03 maks. 10 Bobot Ekuivalen 2,56×103±70,27 - Kadar Metoksil (%) 6,38±0,07 maks. 7 Kadar Galakturonat (%) 43,11±0,57 min. 35
Kadar air yang diperoleh pada pektin sebesar 8,48%±0,03 (Lampiran 2). Kadar air ini sesuai dengan kadar air yang ditetapkan SNI (1979), yaitu maksimum 12%. Kadar air pektin berpengaruh pada jalannya reaksi asetilasi. Reaksi asetilasi bersifat reversibel sehingga kadar air pektin yang terlalu tinggi akan menyebabkan hasil reaksi yang digunakan tidak tercapai karena pektin asetat akan terhidrolisis. Kadar air juga berpengaruh pada anhidrida asetat. Kadar air yang tinggi akan menghidrolisis anhidrida asetat menjadi
asam asetat. Asam asetat ini tidak mampu mengasetilasi gugus hidroksil pektin.
Kadar abu yang diperoleh pada pektin sebesar 2,19%±0,03 (Lampiran 2). Kadar abu yang diperoleh masih memenuhi standar mutu kadar abu yang ditetapkan dalam SNI (1979), yaitu tidak melebihi 10%.
Nilai bobot ekuivalen pektin yang diperoleh sebesar 2,56×103 g/ek±70,27. Hal
tersebut menunjukkan bahwa pektin merupakan makromolekul. Kadar metoksil yang dihasilkan sebesar 6,38%±0,07 (Lampiran 3) berarti pektin tersebut termasuk ke dalam jenis pektin bermetoksil rendah. Kandungan metoksil merupakan faktor yang penting bagi setting time dari pektin, sensitifnya terhadap kation polivalen, dan penggunaannya. Pektin dengan kadar metoksil rendah adalah pektin yang sebagian gugus karboksilnya tidak teresterifikasi. Pektin jenis ini dapat membentuk gel yang baik dengan adanya ion polivalen seperti ion kalsium. Ion kalsium akan membentuk ikatan silang ionik di antara gugus karboksil molekul-molekul pektin yang berdekatan.
Kadar galakturonat dari pektin yang diperoleh sebesar 43,11%±0,57 (Lampiran 3). Hal ini sesuai menurut SNI (1979) kadar galakturonat minimum adalah 35%. Pektin yang sebagian asam galakturonatnya teresterifikasi mengandung 10% atau lebih komponen organik seperti arabinosa, galaktosa, dan gula. Perhitungan kandungan asam galakturonat sangat penting untuk mengetahui kemurnian pektin (Ranganna 1977). Hasil pencirian bahan baku menunjukkan bahwa pektin yang digunakan sudah memenuhi SNI (1979).
Kenampakan Pektin Asetat
Pektin asetat yang dihasilkan pada penelitian ini berbentuk serbuk yang berwarna kuning kecokelatan (Gambar 5). Menurut Fengel dan Wegener (1995), perubahan warna ini disebabkan oleh perubahan-perubahan oksidatif pada molekul pektin yang terbentuk selama proses asetilasi. Perubahan warna yang terjadi dari kuning muda menjadi kuning kecokelatan sudah terlihat ketika dilakukan penambahan anhidrida asetat.
Gambar 5 Pektin asetat hasil sintesis. Reaksi asetilasi diawali dengan aktivasi pektin menggunakan asam asetat glasial dan katalis H2SO4. Menurut Sjostorm (1993),
asam asetat glasial dapat membengkakkan serat-serat polimer sehingga reaktivitasnya semakin meningkat. Kecepatan proses asetilasi dari polisakarida yang sudah teraktivasi tiga kali lebih tinggi dari polisakarida yang tidak teraktivasi.
Reaksi esterifikasi yang terjadi berupa penggantian satu atau dua gugus hidroksil dari unit galakturonat dengan gugus asetil dari anhidrida asetat (Gambar 6).
Ada beberapa senyawa yang digunakan untuk mengasetilasi gugus -OH dari pektin, yaitu:
R-C-NH2 R-C-OR' R-C-O-C-R R-C-Cl
O O O O O
bertambahnya kereaktifan
Amida dan ester sangat lambat untuk bereaksi dengan gugus -OH pektin sedangkan halida asam mempunyai reaktivitas yang sangat tinggi. Oleh karena itu, pereaksi yang dipilih untuk mengasetilasi gugus -OH pektin ialah anhidrida asetat. Hal ini disebabkan anhidrida asetat mempunyai gugus pergi (R-COO-) yang baik dan selektivitasnya lebih
besar dibandingkan dengan halida asam. Syarat terpenting dari proses asetilasi ialah kondisi reaksinya harus bebas air. Apabila terdapat air maka anhidrida asetat akan terhidrolisis menjadi asam asetat (Gambar 7). Asam asetat ini tidak mampu mengasetilasi gugus -OH dari pektin.
O
CH3-C-O-C-CH3 O
H2O 2 CH3-C-OH O
Gambar 7 Reaksi hidrolisis anhidrida asetat.
OH O O OH OH O COOH O O OH COOCH3 O O H3C O CH3 H2SO4 OR O O OR OR O COOH O O OR COOCH3
Gambar 6 Reaksi sintesis pektin asetat, dengan R = H atau -COCH3.
0 10 20 30 40 50 60 70 60 90 120
waktu asetilasi (menit)
kad ar a set il ( % ) aktivasi 2 jam aktivasi 3 jam aktivasi 4 jam
Waktu asetilasi yang digunakan diragamkan selama 60, 90, dan 120 menit. Setelah 60 menit berlangsung, larutan menjadi kental dan warna berubah dari kuning muda menjadi kuning kecokelatan yang menunjukkan pektin sudah terasetilasi. Setelah 120 menit larutan pektin berubah menjadi cokelat tua. Hal ini yang mendasari penggunaan waktu asetilasi selama 60, 90, dan 120 menit.
Kelarutan
Uji kelarutan dilakukan dengan tujuan mengetahui apakah pektin sudah termodifikasi menjadi pektin asetat. Hasil uji kelarutan pada beberapa pelarut polar dan nonpolar disajikan pada Tabel 2.
Tabel 2 Kelarutan pektin dan pektin asetat
Pelarut Pektin Pektin asetat
Air larut tidak larut
Etanol tidak larut tidak larut DMSO tidak larut larut Aseton tidak larut tidak larut Kloroform tidak larut tidak larut
n-heksana tidak larut tidak larut
Berdasarkan uji kelarutan, pekin asetat tidak larut dalam air tetapi larut dalam DMSO. Hal ini menunjukkan bahwa pektin telah terasetilasi menjadi pektin asetat. Secara teoretis, pektin dapat larut dalam air karena mempunyai banyak gugus hidroksil. Setelah pektin diasetilasi, terjadi penggantian satu atau dua gugus hidroksil dengan gugus asetil dari anhidrida asetat sehingga hasil sintesis tidak larut dalam air.
Kadar Asetil
Kadar asetil merupakan ukuran jumlah anhidrida asetat yang diesterifikasi pada rantai pektin. Kadar asetil yang diperoleh pada perlakuan ini berkisar antara 26,57%±0,13 sampai 62,86%±0,20 (Lampiran 4). Kadar asetil pektin asetat yang diperoleh berbeda dengan kadar asetil selulosa asetat, yaitu sebesar 39,0-40,0% (SNI 1991). Perbedaan ini dikarenakan struktur pektin awal mengandung gugus metil ester sedangkan selulosa tidak.
Pada waktu aktivasi 2 jam, kadar asetil pektin asetat semakin menurun sedangkan pada waktu aktivasi 3 dan 4 jam kadar asetil menurun pada selang waktu 60 sampai 90 menit dan meningkat tajam pada selang waktu
90 sampai 120 menit (Gambar 8). Persentase kadar asetil tertinggi didapatkan pada lama aktivasi 3 jam dan lama asetilasi 120 menit. Hal ini diduga bahwa pada waktu aktivasi 3 jam dan asetilasi 120 menit gugus -OH dari pektin secara maksimum sudah digantikan oleh gugus asetil dari anhidrida asetat.
Gambar 8 Hubungan waktu aktivasi dan asetilasi terhadap kadar asetil.
Hasil analisis ragam pada α = 5% menunjukkan bahwa waktu aktivasi, waktu asetilasi, serta interaksi antara keduanya memberikan pengaruh yang nyata terhadap kadar asetil pektin asetat (Lampiran 5). Hal ini menunjukkan bahwa kadar asetil pektin asetat dipengaruhi oleh lama waktu aktivasi dan asetilasi.
Uji lanjut Duncan pada α = 5% menunjukkan bahwa pada waktu aktivasi 2 jam, ketiga waktu asetilasi memberikan pengaruh yang berbeda satu sama lain (Lampiran 6). Waktu asetilasi 60 menit menghasilkan kadar asetil 54,89%±0,20 berbeda nyata dengan waktu asetilasi 90 menit dengan kadar asetil 45,62%±0,41. Waktu asetilasi 90 menit kadar asetil juga berbeda nyata dengan waktu asetilasi 120 menit dengan kadar asetil 42,22%±0,34. Hal tersebut juga terjadi antara waktu asetilasi 60 menit dengan 120 menit yang menghasilkan kadar asetil pektin asetat berbeda nyata. Uji lanjut Duncan pada waktu aktivasi 3 dan 4 jam menunjukkan kesimpulan yang sama dengan waktu aktivasi 2 jam, yaitu bahwa ketiga waktu asetilasi (60, 90, dan 120 menit) memberikan pengaruh yang berbeda satu sama lain (Lampiran 6).
Uji kontras polinomial ortogonal pada α = 5% menunjukkan bahwa hubungan antara waktu aktivasi dengan kadar asetil pektin asetat yang dihasilkan berbentuk kuadratik dengan persamaannya y = 4,47x2 - 30,41x +
79,74. Hal tersebut juga terjadi pada hubungan antara waktu asetilasi dan kadar asetil, yaitu berbentuk kuadratik dengan persamaan y = 1,258x2 - 2,0978x + 121,82
Spektrum FTIR
Gugus fungsi antara pektin dan pektin asetat tidak ada perbedaan yang signifikan (Gambar 6). Keduanya memiliki gugus fungsi -OH karboksilat dan karbonil. Perbedaannya hanya terdapat pada perubahan gugus -OH dari pektin menjadi gugus asetil (-OCOCH3).
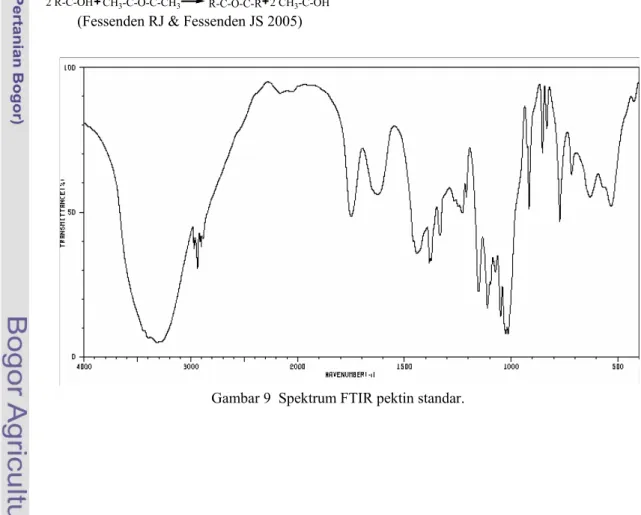
Spektrum FTIR pektin standar dan pektin asetat dapat dilihat pada Gambar 9 dan 10. Kedua spektrum tesebut menunjukkan adanya beberapa perbedaan serapan, yaitu pada bilangan gelombang 3700-3100 dan 1700 cm-1. Pada daerah bilangan gelombang
3700-3100 cm-1, pektin asetat memiliki serapan
yang sangat lebar. Hal tersebut diduga ada pengaruh air pada saat preparasi serta menunjukkan bahwa tidak semua gugus -OH pektin dapat terasetilasi menjadi gugus asetil. Selain itu, serapan tersebut juga menunjukkan bahwa gugus karboksil (-COOH) pektin diduga tidak terasetilasi dengan anhidrida
setat melalui persamaan berikut: a
Tidak terasetilasinya gugus karboksil disebabkan oleh meruahnya gugus di sekitarnya sehingga anhidrida asetat tidak mampu mengasetilasi gugus karboksil tersebut.
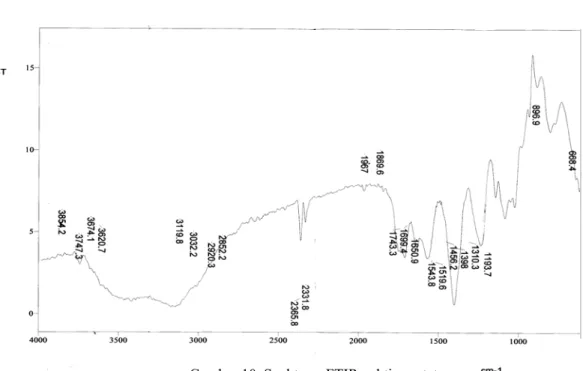
Spektrum FTIR pektin asetat (Gambar 10) memperlihatkan pita serapan pada bilangan gelombang 1699,4 cm-1 yang menunjukkan
adanya gugus karbonil (-C=O). Hal tersebut menunjukkan bahwa gugus -OH pektin telah terasetilasi menjadi gugus asetil. Serapan pada bilangan gelombang 2920,3 cm-1 merupakan
vibrasi ulur dari -CH3 dan pada bilangan
gelombang 1456,2 cm-1 dengan puncak yang
tajam merupakan ciri khas dari serapan vibrasi tekuk -C-H (Shriner et al. 2004). Serapan lainnya ada pada daerah bilangan gelombang 1310,3-1398 cm-1 untuk vibrasi ulur -C-H dan
pada daerah 1310,3 cm-1 untuk vibrasi ulur
-C-O. O 2 R-C-OH O CH3-C-O-C-CH3 O O R-C-O-C-R O 2 CH3-C-OH O
(Fessenden RJ & Fessenden JS 2005)
Analisis Termogravimetri
Kurva TGA dari analisis ini memberikan informasi tentang perubahan massa pektin asetat selama proses pemanasan. Selama peningkatan suhu, sampel mungkin mengalami kenaikan massa akibat proses oksidasi. Akan tetapi, kebanyakan kurva TGA memperlihatkan indikasi pengurangan massa pada suhu ≤ 100°C dan dekomposisi termal pada suhu > 250°C (Zhang 2004). Gambar 11 memperlihatkan pengurangan massa pektin asetat selama analisis termal.
Gambar 10 Spektrum FTIR pektin asetat.
Perubahan massa dapat dibagi menjadi tiga daerah. Daerah pertama, yaitu mulai dari suhu ruang hingga suhu 200°C terjadi pengurangan massa akibat proses penguapan air. Pada daerah ini perubahan massa tidak signifikan dan sampel stabil secara termal. Daerah kedua yang mulai dari suhu 200°C hingga 800°C pektin asetat memperlihatkan kehilangan massa yang besar akibat terjadinya dekomposisi termal. Pada proses ini sebanyak 32,70% dari sampel terdekomposisi sampai menguap. Daerah terakhir terjadi pada suhu 800°C hingga 900°C pektin asetat mengalami dekomposisi termal secara lambat.
TGA
mg Suhu (°C)
900 800
Gambar 11 Kurva TGA pektin asetat.
700 90 600 500 80 400 300 200 70 100
Mikroskop Fotostereo
Struktur permukaan pektin asetat dapat dilihat dengan mikroskop fotostereo. Hasil mikroskop fotostereo (Gambar 12) memperlihatkan struktur permukaan yang tidak seragam. Struktur permukaan dari masing-masing perlakuan berbeda satu sama lain. Pektin asetat dengan perlakuan lama waktu aktivasi 2 jam dan asetilasi 120 menit dengan kadar asetil 42.22%±0.34 memiliki struktur permukaan yang paling rapat. Hal ini dikarenakan kadar asetil pektin asetat dengan perlakuan waktu aktivasi 2 jam dan asetilasi 120 menit mendekati kadar asetil selulosa asetat menurut SNI (1991), yaitu 39,0-40,0%.
Pektin asetat dengan kadar asetil tertinggi, yaitu pada perlakuan waktu aktivasi 3 jam dan asetilasi 120 menit memiliki struktur permukaan yang menggumpal dan memadat. Struktur permukaan pektin asetat dengan kadar asetil terendah (waktu aktivasi 3 jam dan asetilasi 90 menit) cenderung retak-retak.
Gambar 12 Hasil mikroskop fotostereo pektin asetat.
Interpretasi mikroskop fotostereo pektin asetat digunakan untuk tahap lanjut, yaitu pembuatan membran. Pektin asetat yang dipilih sebagai bahan dasar pembuat membran adalah yang memiliki permukaan yang paling rapat, dalam hal ini dipilih pektin asetat dengan perlakuan lama waktu aktivasi 2 jam dan asetilasi 120 menit.
SIMPULAN DAN SARAN
Simpulan
Dari hasil penentuan kadar asetil dan uji kelarutan dapat disimpulkan bahwa pektin dapat terasetilasi menjadi pektin asetat. Kadar asetil tertinggi didapatkan pada pektin dengan lama aktivasi 3 jam dan asetilasi 120 menit, yaitu 62,86%±0,20.
Hasil analisis ragam pada α = 5% menunjukkan bahwa waktu aktivasi, waktu asetilasi, serta interaksi antara keduanya memberikan pengaruh yang nyata terhadap kadar asetil pektin asetat.
Analisis TGA menunjukkan bahwa selama asetilasi tidak ada massa pektin asetat yang hilang. Hasil interpretasi mikroskop fotostereo menunjukkan pektin asetat dengan lama waktu aktivasi 2 jam dan asetilasi 120 menit memiliki struktur permukaan yang paling rapat.
Saran
Perlu dilakukan penelitian lanjutan mengenai aplikasi pektin asetat yang dihasilkan.
2j, 60’ 2j, 90’ Pektin asetat dapat dicoba dibuat melalui
reduksi gugus -COOH dan -COOCH3 terlebih
dahulu dengan menggunakan LiAlH4 sebelum
tahap aktivasi dan asetilasi.
2j, 120’ 3j, 60’
DAFTAR PUSTAKA
AOAC. 1995. Official Methods of Analysis of
the Association of Official Analytical Chemist. Vol IA. Washington DC:
AOAC Int.
3j, 120’ 4j, 90’
ASTM. 1991. ASTM D871: Standard
Methods of Testing Cellulose Acetate.
Philadelphia: American Society for Testing and Materials.
Caplin M. 2004. Pectin. http://www.Isbu. ac.uk/water/hypec.html. [2 Februari 2006]. Fengel D, Wegener G. 1995. Kayu: Kimia,
Ultrastruktur, dan Reaksi-Reaksi.
Sastrohamidjojo H, penerjemah; Yogyakarta: UGM Pr. Terjemahan dari:
Wood: Chemistry, Ultrstructure and Reactions.