LAMPIRAN I
Data Baku Mutu Air Limbah
Berikut adalah tabel data baku mutu limbah sesuai dengan Keputusan Menteri Negara
Lingkungan Hidup No.5/Kep-MenLH/2014 pada pelayanan kesehatan yang melakukan
pengolahan limbah bahan berbahaya dan beracun.
Tabel Baku Mutu Air Limbah
Parameter
Konsentrasi Paling Tinggi
Nilai
Satuan
Senyawa aktif biru metilen (MBAS)
5
mg/L
Fenol
0,5
mg/L
AOX
0,5
mg/L
PCBs
0,005
mg/L
PCDFs
10
mg/L
LAMPIRAN II
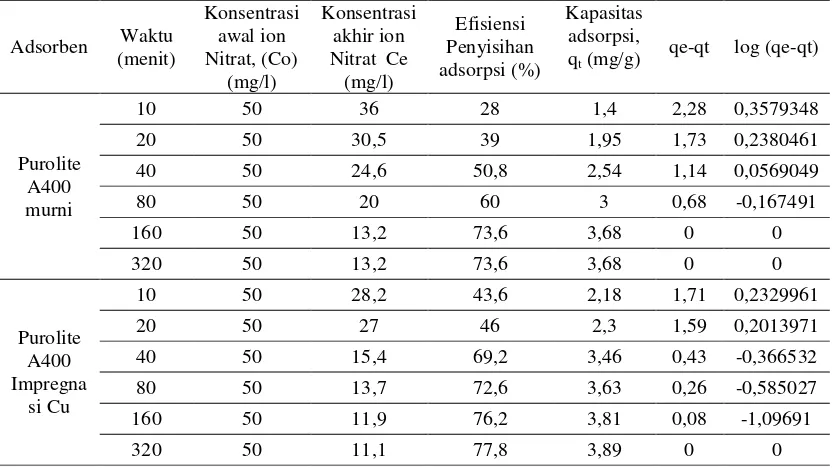
Data Perhitungan Penentuan Waktu kontak Terhadap adsorpsi Ion Nitrat
Massa Adsorben = 1,0 g
Volume larutan ion Nitrat = 100 mL
Adsorben Waktu (menit)
Konsentrasi awal ion Nitrat,
(Co) (mg/l)
Konsentrasi akhir ion Nitrat Ce
(mg/l)
Efisiensi Penyisihan adsorpsi (%)
Kapasitas adsorpsi, qt (mg/g)
Purolite A400 murni
10 50 36 28 1,4
Data Perhitungan Penentuan Waktu kontak Terhadap adsorpsi Ion Nitrit
Massa Adsorben = 1,0 g
Volume larutan ion Nitrit = 100 mL
Adsorben Waktu (menit)
Konsentrasi awal ion Nitrit,
(Co) (mg/l)
Konsentrasi akhir ion Nitrit Ce (mg/l)
Efisiensi Penyisihan adsorpsi (%)
Kapasitas adsorpsi, qt (mg/g)
Purolite A400 murni
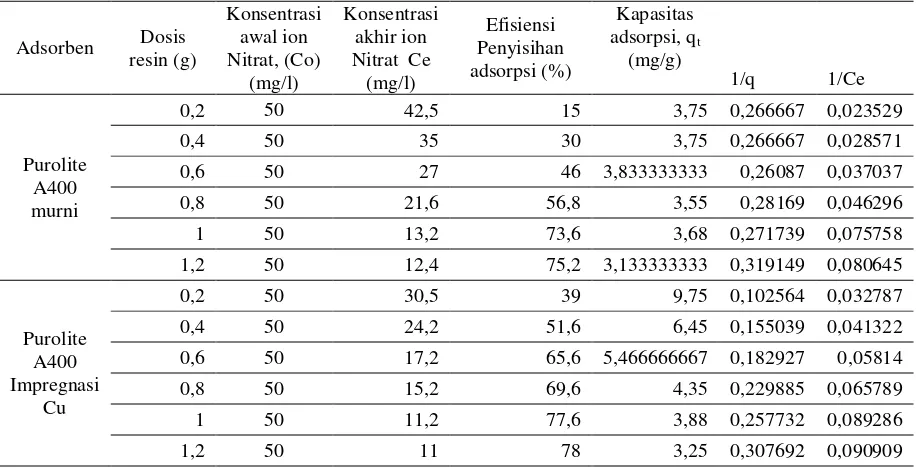
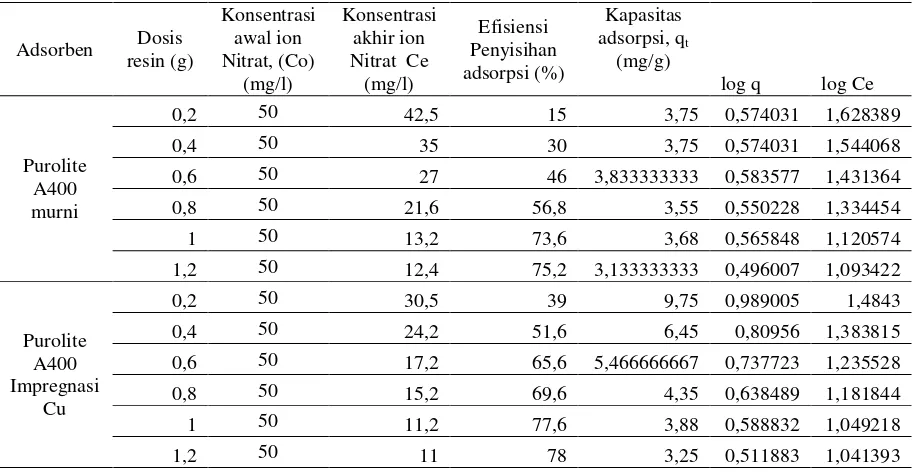
Data Perhitungan Penentuan Dosis Resin Terhadap adsorpsi Ion Nitrat
Volume larutan Ion Nitrat = 100 ml
Adsorben Dosis resin (g)
Konsentrasi awal ion Nitrat,
(Co) (mg/l)
Konsentrasi akhir ion Nitrat Ce
(mg/l)
Efisiensi Penyisihan adsorpsi (%)
Kapasitas adsorpsi, qt (mg/g)
Data Perhitungan Penentuan Dosis Resin Terhadap adsorpsi Ion Nitrit
Volume larutan Ion Nitrit = 100 ml
Adsorben Dosis resin (g)
Konsentrasi awal ion Nitrit,
(Co) (mg/l)
Konsentrasi akhir ion Nitrit Ce (mg/l)
Efisiensi Penyisihan adsorpsi (%)
Kapasitas adsorpsi, qt (mg/g)
Purolite A400 murni
Perhitungan Penentuan Model Kinetika Adsorpsi
Model Pseudo orde pertama:
log (q
e–
q
t) = log q
e–
keterangan :
q
tdan q
e= kapasitas adsorpsi pada waktu t (mg N/g) dan pada waktu kesetimbangan
k
1=konstanta laju kesetimbangan adsorpsi pada orde semu pertama (1/menit)
Tabel Penentuan Pseudo Orde Pertama
Adsorben Waktu (menit)
Diplot kurva log (q
e-q
t) vs t dengan slope adalah k
1. Grafik penentuan kinetika reaksi pseudo
orde pertama ditunjukkan oleh gambar berikut ini.
Gambar Kurva Penentuan Pseudo Orde Pertama
y = -0,0009x - 0,1778
Waktu (menit)
Dari grafik penentuan kinetika reaksi pseudo orde pertama diperoleh persamaan:
Y= -0,0009x
–
0,1778
R
2= 0,0396
Dari persamaan linear diatas ditentukan kapasitas adsorpsi maksimum pseudo orde pertama
(k
1), maka diperoleh:
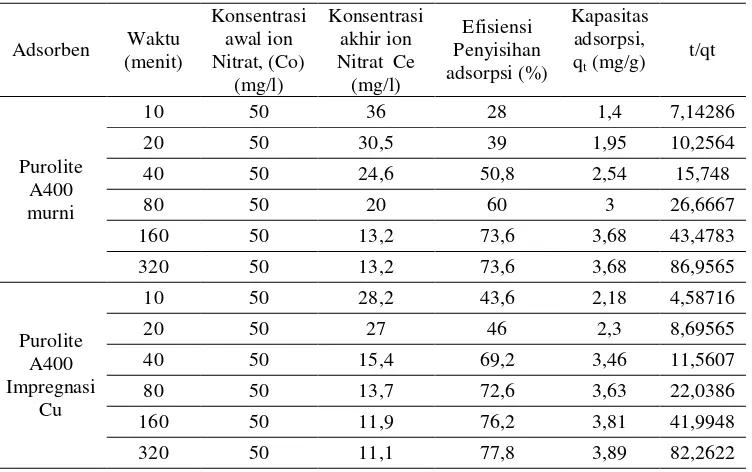
Model Pseudo Orde Kedua :
t
k
2=konstanta laju kesetimbangan adsorpsi pada orde semu kedua (g/mg menit)
Tabel Penentuan Pseudo Orde Kedua
Diplot kurva t/qt vs t dengan slope adalah k
1. Grafik penentuan kinetika reaksi pseudo orde
kedua ditunjukkan oleh gambar berikut ini.
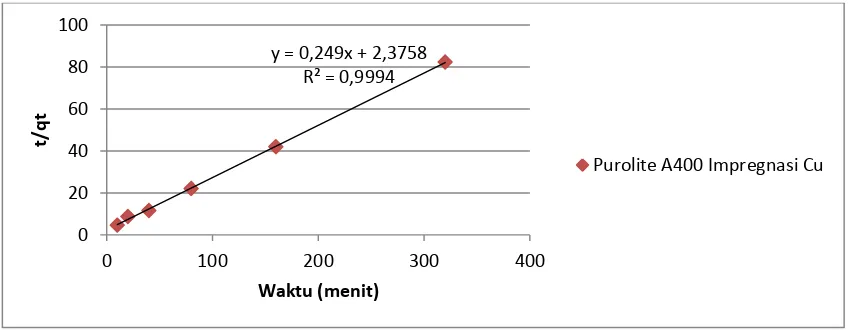
Gambar Kurva Penentuan Pseudo Orde kedua
Dari grafik penentuan kinetika reaksi pseudo orde kedua diperoleh persamaan:
Y= 0,249x + 2,3758
R
2= 0,9994
Dari persamaan linear diatas ditentukan kapasitas adsorpsi maksimum (q
2) dan konstanta untuk
pseudo orde kedua (k
2), maka diperoleh:
t/q
2= 0,249
q
2= 4,016
1/ k
2q
22= 2,3758
1 / 16,1287 k
2= 2,3758
k
2= 0,0260 min
-1y = 0,249x + 2,3758 R² = 0,9994
0 20 40 60 80 100
0 100 200 300 400
t/
q
t
Waktu (menit)
Perhitungan Penentuan Model Isoterm Adsorpsi
Perhitungan Isoterm adsorpsi Langmuir :
Penentuan isoterm Langmuir diberikan dengan persamaan linier berikut ini:
keterangan :
C
e=
konsentrasi nitrat pada saat kesetimbangan (mg N/L)
q
e=
jumlah nitrat yang terserap per satuan massa adsorben pada saat
kesetimbangan (mg N/g)
q
m=
jumlah maksimum nitrat yang terserap per satuan massa adsorben (mg N/g)
K
L=
konstanta
afinitas
Langmuir
yang
berhubungan
denngan
energi
sorpsi.desorpsi (L/mg)
Tabel Penentuan Isoterm adsorpsi Langmuir
Adsorben Dosis resin (g) adsorpsi, qt (mg/g)
Gambar Kurva Linear Penentuan Isoterm adsorpsi Langmuir
Dari grafik penentuan isoterm Langmuir diperoleh persamaan :
Y = 2,9842x + 0,0179
R
2= 0,9368
Nilai-nilai parameter Langmuir q
maxdan k dihitung dari garis miring dan intersep dari plot linear
1/q vs 1/Ce, sehingga diperoleh:
1/q
max= 0,0179
q
max= 55,86
Penentuan Isoterm adsorpsi Freundlich:
Penentuan isoterm Freundlich diberikan dengan persamaan linear berikut ini:
Keterangan:
C
e=konsentrasi nitrat pada saat kesetimbangan (mg N/L)
q
e=jumlah nitrat yang terserap per satuan massa adsorben pada saat kesetimbangan
(mgN/g)
K
f=konstanta isotherm adsorpsi Freundlich yang berkaitan dengan tingkat kapasitas
adsorpsi
n
1
=intensitas adsorpsi, yang bervariasi sesuai dengan heterogenitas bahan (rentang
nilai n=1-10)
y = 2,9842x + 0,0179
Tabel Penentuan Isoterm adsorpsi Freundlich
Adsorben Dosis resin (g) adsorpsi, qt (mg/g)