BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Januari-Juni 2009. Tempat pelaksanaannya di Laboratorium Teknologi Kimia Kayu Departemen Hasil Hutan IPB, Herbarium Bogoriensis Bidang Botani Pusat Penelitian Biologi – LIPI di Cibinong, Laboratorium Kimia Analitik Departemen Kimia IPB. Laboratorium U.S NAMRU-2 (U.S Naval Medical Research Unit Two) di Jakarta Pusat.
Metode Penelitian Bahan tumbuhan
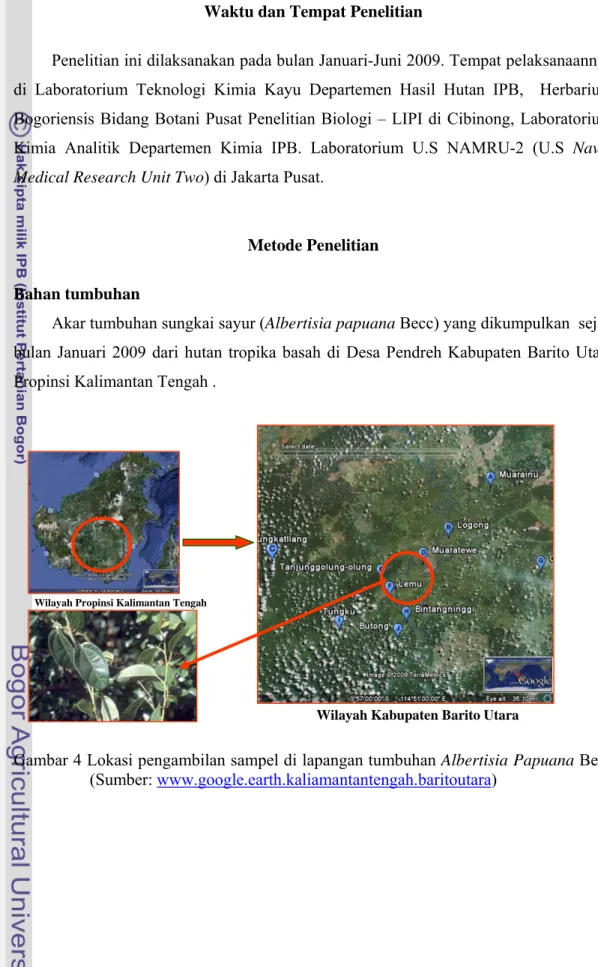
Akar tumbuhan sungkai sayur (Albertisia papuana Becc) yang dikumpulkan sejak bulan Januari 2009 dari hutan tropika basah di Desa Pendreh Kabupaten Barito Utara Propinsi Kalimantan Tengah .
Gambar 4 Lokasi pengambilan sampel di lapangan tumbuhan Albertisia Papuana Becc (Sumber: www.google.earth.kaliamantantengah.baritoutara)
Wilayah Kabupaten Barito Utara
Bahan kimia
Bahan kimia yang digunakan dalam penelitian ini adalah n-heksana yang digunakan untuk menghilangkan lemak pada sampel. Etanol 80 %, HCl 0,1 M, dan CH2Cl2 untuk mengekstrasi bahan, NH4OH 6 % untuk mengendapkan alkaloid. Bahan kimia untuk kromatografi lapis tipis antara lain lempeng KLT silika gel G 60 F254, pelarut pengembang aseton, diklorometana, dan metanol serta reagen iodoplatina. Bahan kimia untuk Kromatografi Kolom (KK) menggunakan glasswool sebagai penyumbat agar eluen tidak keluar dari kolom dan silika gel sebagai fase diam.
Bahan kimia untuk uji anti plasmodium yang digunakan adalah Rosewell Part Memorial Institute (RPMI) 1640 yang mengandung L-glutamin, asam gentamisin sulfat injeksi, NaCl 0,9 % dan 3,5 %; sorbitol 5 %, serum dan sel darah merah (RBC), zat antikoagulan sitrat fosfat dektrosa (CPD), akuabidestilata, pewarna Giemsa, larutan buffer fosfat pH 7,2 alkohol metanol.
Peralatan
Alat-alat yang digunakan adalah timbangan digital, alat untuk ekstraksi seperti gelas piala, seperangkat alat Sokhlet, vacuum rotary evaporator, pengaduk, bejana Kromatografi Lapis Tipis, seperangkat alat Kromatografi Kolom Kilas, Spektrometer UV-Vis dan Spektrometer FTIR,
Alat untuk pengujian anti malaria, yaitu inkubator, membran Milipore ukuran 0,22 dan 0,45 μm, tabung sentrifus ukuran 10 dan 50 mL, lampu UV, ruang Laminar Air Flow, eksikator, alat vortex, dan mikroskop cahaya
Prosedur Penelitian Pengumpulan sampel
Sampel berupa akar tumbuhan Albertisia papuana Becc dikumpulkan dari hutan tropika di Kalimantan Tengah dengan sistem acak tanpa melihat umur tumbuhan dan besarnya batang akar, tetapi diambil dari tumbuhan yang secara fisik sehat dan subur. Determinasi tumbuhan sungkai sayur dilaksanakan di Herbarium Bogoriense Bidang Botani Pusat Penelitian Lembaga Ilmu Pengetahuan Indonesia di Cibinong (Hasil identifikasi pada Lampiran 1).
Preparasi sampel
Sampel akar tumbuhan Albertisia papuana Becc dicuci dengan air mengalir dan dikeringkan dengan cara diangin-anginkan tanpa kontak langsung sinar matahari. Setelah bersih dan kering, dipotong-potong kemudian diserbukkan dengan menggunakan alat Hammer Mill dengan ukuran serbuk 40 mesh (TAPPI T257 cm-85).
Penetapan kadar Air
Cawan porselin dikeringkan pada suhu 105 oC selama 30 menit kemudian di dinginkan dalam desikator dan timbang. Sebanyak 3 g sampel sungkai sayur dimasukkan dalam cawan dan dipanaskan pada suhu 105 oC selama 6 jam sampai diperoleh bobot konstan, kemudian didinginkan dalam desikator dan ditimbang. Hitung kadar airnya denngan persamaan sebagai berikut :
Kadar air (%) = A – B x 100% A
Keterangan :
A adalah berat sampel (g)
B adalah berat sampel setelah dikeringkan (g)
Ekstraksi senyawa bioaktif alkaloid
500 gram serbuk kering sampel yang telah dikeringkan, diekstraksi dengan n-heksana selama 8 jam menggunakan 4 buah Soxhlet secara paralel masing-masing tiga kali pengulangan, untuk menghilangkan kandungan lemaknya (Purwatiningsih 2003). Residu yang dihasilkan dikeringkan atau dihilangkan pelarut n-heksana dengan membiarkan residu selama 1 hari. Selanjutnya dimaserasi menggunakan etanol 80 % selama 1 hari pada suhu kamar dalam maserator. Rendaman disaring menggunakan kertas saring halus dan filtratnya disimpan. Residu dimaserasi kembali dengan pelarut yang sama selama 1 hari sampai diperoleh filtrat yang tidak berwarna. Filtrat yang diperoleh dijadikan satu kemudian dipekatkan dengan vakum rotary evaporator untuk menghasilkan ekstrak kasar dan dilarutkan dalam air. Ekstrak air diasamkan dengan HCl 0,1 M sampai memiliki pH 2-3, biarkan sekurang-kurangnya 4 jam, kemudian di partisi dengan CH2Cl2. Fase asam yang diperoleh diendapkan dengan meneteskan NH4OH 6 % dan pH diatur 9-10. Endapan dikumpulkan dengan pemusingan dan dicuci
dengan NH4OH 1 %. Sehingga diperoleh ekstrak pekat alkaloid kasar selanjutnya dilakukan uji fitokimia dan uji anti plasmodium. Prosedur pengujian ini mengacu pada cara kerja Lohombo-Ekomba et al. (2004). Diagram alir kerja tersebut ditunjukkan pada Lampiran 2.
Fraksinasi senyawa anti malaria
Pemisahan senyawa anti malaria dari ekstrak kasar alkaloid tumbuhan Albertisia papuana Becc dari Kalimantan Tengah dilakukan dengan teknik mencari eluen yang cocok. Eluen yang digunakan dalam KLT adalah eluen menurut Lohombo-Ekomba et al. (2004) yaitu menggunakan campuran pelarut diklorometana : metanol dan aseton : metanol, dengan sistem gradien. Prosedur kerjanya adalah sebagai berikut, lempeng lapis tipis silika gel G 60 F254 dengan ukuran panjang 10 cm dan lebar 1 cm diberi tanda garis dengan pensil pada jarak 1 cm dari salah satu ujung lempeng. Ekstrak aktif antimalaria dilarutkan dalam pelarut asalnya. Eluen yang akan digunakan dimasukkan ke dalam tabung kromatografi hingga 2 cm tingginya dari dasar tabung dan ditaruh kertas saring kemudian ditutup rapat agar jenuh dengan uap eluen. Larutan ekstrak sampel diteteskan dengan pipa kapiler pada lempeng silika gel. Penetesan dilakukan pada jarak 1 cm dari salah satu ujung. Ujung lempeng yang terdekat pada tempat penetesan dicelupkan ke dalam tabung kromatografi yang sudah jenuh dengan eluen. Tabung kemudian ditutup rapat dan dibiarkan pelarut naik sampai batas yang ditentukan yaitu 1 cm dari batas atas. Setelah elusi pada batas tertentu, lempeng diangkat dan selanjutnya dikeringkan pada suhu ruang selama beberapa menit, kemudian dideteksi pada sinar UV dengan panjang gelombang 254 nm.
Kromatografi kolom kilas dan identifikasi senyawa aktif
Sebanyak 1 gram ekstrak pekat alkaloid yang berasal dari Albertisia papuana Becc dilarutkan dalam metanol dan dengan menggunakan eluen terbaik kemudian dipisahkan komponen-komponennya dengan menggunakan kromatografi kolom kilas. Fraksi ditampung tiap 3 ml dalam tabung reaksi yang telah diberi nomor kemudian
diuji dengan KLT. Fraksi yang memiliki Rf dan pola penampakan noda yang sama pada KLT digabung sebagai satu fraksi kemudian di evaporasi dan di uji aktivitas anti malaria untuk mendapatkan fraksi yang paling aktif. Identifikasi senyawa aktif dilakukan dengan menganalisis data spektrum ultra violet dan spektrum inframerah.
Uji aktivitas anti malaria
Pengujian anti malaria dilakukan pada ekstrak kasar alkaloid maupun hasil fraksinasi Kromatografi Kolom Kilas. Prosedur penyiapan pengujiannya mengacu kepada cara kerja Trager dan Jensen (1976) diacu oleh Pharm dan Afshar (1982), Tuti et al. (1994), Jansen (2000), Purwantiningsih (2003) dan prosedur Laboratorium Parasitologi NAMRU (2009). Beberapa tahap awal persiapan pengujian aktivitas anti malaria secara in vitro terhadap P.falciparum yaitu : penyiapan media biakan, penyiapan sel darah merah (steril), pengembangan biakan parasit P. falciparum, pemeliharaan parasit P. falciparum, sinkronisasi, pengujian anti malaria secara in vitro, pemanenan dan evaluasi hasil pengujian. Sebelum tahap pembiakan tersebut dilakukan, perlu disiapkan hal-hal seperti berikut:
Penyiapan media biakan
Tahap ini merupakan penyiapan bahan dan media pembiakan kultur P.falciparum yaitu:
Pembuatan medium dasar RPMI 1640 (RP)
RPMI 1640 sebanyak 10,4 gram ditambahkan 5,96 gram asam N-2-hidroksil etil piperzin-N-2-etana sulfonat (HEPES) untuk mendapatkan kepekatan 25 mM dengan pH 6,75 dan kemudian diaduk hingga homogen. Selanjutnya ditambahkan zat antibiotik gentamisin sulfat sebanyak 50 mg. Larutan tersebut disterilisasi dan disimpan pada suhu 4 oC
Penyiapan larutan NaHCO3 5 % (b/v)
5 gram NaHCO3 dilarutkan dengan air destilat sampai menjadi 100 ml larutan. Selanjutnya larutan ditempatkan dalam botol reagen steril dan disimpan pada suhu 4 oC.
RPMI 1640 + 4,2 mL larutan NaHCO3 5% (b/v), dibuat sebanyak 100 ml untuk mendapatkan media tanpa serum dengan pH 7,4 yang selanjutnya disebut dengan RP. Larutan tersebut disteril dan disimpan pada suhu 4oC.
Pembuatan serum
Darah golongan “O” sebanyak ± 120 ml dimasukkan dalam conical tube 50 ml dan diinkubasi pada suhu ± 37oC dalam NAPCO water jacketed CO2selama 2 jam. Selanjutnya ditimbang dan disentrifus 2000 rpm (high speed) selama 20-30 menit. Diperoleh serum (bagian atas) terpisahkan dari RBC, serum dimasukkan dalam conical tube 15 ml, RBC dibuang. Jika masih ada sisa serum dilakukan lagi sentrifus terhadap RBC seperti cara sebelumnya. Serum diinaktiv pada suhu 56 oC selama 30 menit, diberi label Δ. Sebelum digunakan serum disimpan dalam freezer -20oC
Pembuatan medium lengkap
RPMI 1640 dengan 42 mL larutan NaHCO3 5% (b/v) sebanyak 100 mL sebagai media dasar (b/v) masukan serum dari darah golongan ”O” sebanyak 11,5 ml. Selanjutnya disterilisasi dengan cara filtrasi melalui membran yang berdiameter 0,22 μM. Media ini disimpan pada suhu 4 oC dan hanya bertahan 1 minggu. Media ini dikenal dengan RP+HS.
Pembuatan RBC
CPD dimasukan sebanyak 1,5 ml ke dalam conical tube 50 ml (1,4 ml CPD untuk 10 ml darah). Darah diambil 2 x 10 ml, dimasukkan dalam 2 conical tube yang sudah di isi CPD. Selanjutnya darah golongan “O” + CPD disetrifus 1800 rpm selama 10 menit. Diperoleh plasma dan buffy coat dibuang dengan pipet Pasteur steril. Darah yang tersisa ditambahkan medium transport, dibolak-balik, disentrifus 1800 rpm selama 10 menit tahapan ini disebut washing 1. Supernatan (beserta sisa buffly coat) dibuang. Darah yang tersisa dicuci lagi seperti tahap washing 1, tahapan ini disebut washing 2. Endapan ditambahkan growth medium sebanyak jumlah endapan (rasio 1:1). Selanjutnya dilakukan pencampuran dengan cara up dan down perlahan, jangan digoyang. Simpan diruang pendingin pada suhu 4 oC
Larutan RPMI + 5,94 HEPES + 1 ml gentamisin ke dalam 960 ml aquabides. Larutan distirer hingga homogen, difilter (liter 0,22 µm), dan dipindahkan ke dalam flask 275 ml.
Pembuatan growth medium (GM/RPMI)
100 ml RPMI diambil dan ditempatkan ke dalam flask 200 ml. Tambahkan 4.2 ml NaHCO3, 12 ml serum, dan 2 ml hypoxanthine. Selanjutnya media tersebut disteril dengan filter ukuran 0,22 µM dan dimasukkan ke dalam flask 50 ml baru. Media tersebut disimpan pada suhu 4oC.
Penyiapan sel darah merah yang tidak terinfeksi parasit (RBC 50%)
Darah golongan ”O” sebanyak 10 mL dicampur dengan 1,4 mL larutan zat antikoagulan CPD. Larutan diaduk perlahan-lahan sampai homogen, selanjutnya larutan disentrifus dengan kecepatan putar 1500 rpm selama 15 menit pada suhu kamar. Untuk mendapatkan endapan atau packed cell dengan cara plasma dibuang dengan menggunakan pipet Pasteur, packed cell yang tertinggal dicuci dengan media transport sebanyak dua kali. Packed cell dan media disuspensikan ke dalam media lengkap (RP+HS) dengan perbandingan volume 1:1. Suspensi ini mengandung 50 % eritrosit dan disebut sebagai Red Blood Cell (RBC) 50 %. Suspensi ini disimpan pada suhu 4 oC dan tiap seminggu sekali perlu pengantian RP+HS.
Pengembangbiakan Parasit P. falciparum Pembukaan kultur
Kultur di-thawing, bisa dengan memasukkan ke dalam waterbath 37 oC atau dengan menggunakan tangan. Tambahkan NaCl 3,5 % dengan pipet Pasteur steril ke dalam kultur, dicampur. Selanjutnya kultur dipindahkan ke dalam tube 15 ml, disetrifus 1500 rpm 7 menit. Supernatan dibuang, dimasukkan NaCl lagi dan dicampur.
Lakukan sentrifus ≤ 1000 rpm selama 7 menit, endapan tidak boleh terlalu padat supaya serum bisa berinteraksi dengan kultur. Kemudian sentrifus 1500 rpm 7 menit, selanjutnya supernatan dibuang, dimasukkan washing medium sampai volume larutan total ± 10 ml. Tambahkan 4 tetes RBC,lalu dimasukkan washing medium sampai volume larutan total ± 10 ml. Lakukan lagi sentrifus 1500 rpm 7 menit, endapan yang terbentuk diukur jumlahnya. Supernatan dibuang, endapan dicampur dan diambil
beberapa tetesan untuk pembuatan slide. Ambil sebanyak 8 ml Growth Medium (GM), 4 ml dimasukkan tube kosong, 4 ml dimasukkan ke dalam endapan. GM dan endapan kultur dicampur hingga homogen kemudian dipindahkan ke dalam 2 cawan petri (1 cawan petri berisi ± 2 ml). Sisa growth medium (yang sebelumnya dimasukkan dalam tube kosong) dimasukkan juga ke dalam 2 cawan petri tersebut sehingga volume total isi cawan petri ± 4 ml. Biakan dimasukkan ke dalam candle jar dengan kondisi gas O2 3%, CO2 4 % dan N2 93 %. Untuk mendapatkan kondisi tersebut, caranya dalam candle jar yang telah berisi cawan-cawan petri biakan diletakkan lilin yang menyala. Bila nyala lilin hampir padam, candle jar ditutup sehingga kedap udara. Kemudian candle jar diinkubasi dalam inkubator pada suhu 37 oC. Diagram alir pembukaan kultur P. falciparum ditampilkan pada Lampiran 3.
Pembuatan slide
Pembuatan slide apusan darah tebal, teteskan ± 3 tetes darah, untuk slide darah apusan tipis cukup 1 tetes. Pada apusan tebal, tetesan-tetesan darah diratakan, sedangkan untuk apusan tipis darah digeser dengan kaca slide lain. Apusan tipis dicelup dalam metanol 1% (fiksasi) selama 1 detik, kemudian dikeringkan. Sedangkan apusan tebal tidak difiksasi tetapi langsung dikeringkan. Buat larutan Giemsa 1 : 10 dalam syringe, bolak-balik. Setelah slide kering, dilakukan pewarnaan (slide diteteskan giemsa sampai seluruh permukaan slide tertutup). Inkubasi slide 20 menit pada suhu ruang. Setelah 20 menit, Giemsa dibilas dengan air perlahan. Slide dikeringkan, setelah kering diberi minyak imersi dan dapat dibaca di mikroskop.
Pemeliharaan biakan kultur parasit P.falcifarum
Eritrosit yang terinfeksi parasit disuspensikan dengan eritrosit yang tidak terinfeksi selanjutnya diencerkan dengan media lengkap RP+HS sehingga diperoleh kepadatan parasit 2 % dengan 4 % hematokrit. Suspensi ini dimasukkan ke dalam cawan petri berdiameter 50 mm masing-masing sebanyak 4 mL. Setiap 24 jam media RP+HS diganti dengan media RP+HS yang segar. Cara mengganti media adalah dengan cawan petri dikeluarkan dari candle jar, dimiringkan kira-kira 30 oC dalam ruang steril (laminar air flow) selama 10 menit. Sebelum ditambah media, packed cell diambil satu sampai dua tetes untuk membuat apusan darah tipis dan tebal pada slide mikroskop. Pembuatan apusan darah tipis dan tebal berguna untuk menghitung parasitemia dan
memantau pertumbuhan parasit. Kemudian, cawan petri diletakkan mendatar dan ke dalamnya ditambahkan media RP+HS baru sebanyak 3,5 ml. Cawan petri digoyang perlahan agar suspensi parasit menjadi homogen kembali. Cawan petri diletakkan dalam candle jar dan diinkubasi dalam inkubator.
Penghitungan persentase parasitemia
Persen parasitemia yang terkandung dalam biakan diamati melalui slide apusan darah tipis. Slide diamati dengan mikroskop pada pembesaran 10 x 100. Inti parasit terlihat berwarna merah dan plasmanya berwarna biru. Sel darah merah akan terlihat berwarna merah muda, sedangkan titik-titik Maurer (ciri-ciri bentuk parasit) terlihat berwarna merah tua ditemukan pada stadium ring tua. Pengamatan dilakukan dengan menghitung jumlah parasit yang hidup terhadap 1.000 eritrosit. Bila kadar parasitemianya tinggi maka biakan tersebut perlu diencerkan dengan penambahan sel darah merah (RBC 50 %). Seluruh darah dari cawan petri dikumpulkan dalam conical tube, disentrifus dengan kecepatan 1500 rpm selama 10 menit. Supernatan dibuang dan dihitung banyaknya endapan darah. Endapan darah sebanyak 0,1 – 0,2 dalam conical tube selanjutnya ditambahkan dengan 0,9 ml RBC, dicampur dan ditambahkan dengan medium lengkap sampai 16 ml. Selanjutnya parasit dibagi dalam 4 cawan petri masing-masing 4 ml dan disimpan kembali dalam candle jar. Kadar parasitemia diatur pada kisaran 0,5-1,6 % (WHO 2008).
Teknik sinkronisasi
Teknik sinkronisasi adalah parasit dalam biakan dikumpulkan dan dimasukkan ke dalam tabung sentrifus. Suspensi disentrifus dengan kecepatan 1500 rpm selama 15 menit dan supernatan dibuang dengan bantuan pipet Pasteur. Packed cell yang tertinggal dihitung volumenya. Bila volumenya packed cell kira-kira 1 ml, maka larutan sorbitol 5% yang ditambahkan sampai ± 10 ml. Campuran diaduk perlahan dengan pipet Pasteur sampai terlihat homogen selama 5-10 menit. Selanjutnya campuran tersebut disentrifus dengan kecepatan 1500 rpm selama 15 menit. Supernatan dibuang dengan bantuan pipet Pasteur. Packed cell dicuci lagi dengan media transport sebanyak dua kali pencucian dilakukan dengan cara sentrifus. Packed cell disuspensikan kembali dengan medium lengkap RP+HS sehingga diperoleh kadar hematokrit 4%. Suspensi diinkubasi
dalam inkubator selama 48 jam pada suhu 37 oC. Setelah 48 jam parasit hasil sinkronisasi ini siap digunakan untuk uji in vitro. Setiap 24 jam dipantau kadar parasitemia dan bentuk parasitnya. Bentuk parasit yang dipakai pada uji in vitro adalah bentuk cincin dengan umur tidak boleh lebih dari 48 jam.
Pengujian anti malaria secara in vitro
Pengujian anti malaria mengacu pada prosedur kerja oleh Purwantiningsih (2003) dan NAMRU-2 (2009). Parasit dengan kadar parasetimia 1 % dipersiapkan dengan cara semua parasit dari galur resisten (W2) dan galur sensitif (D6) dikumpulkan dari cawan petri ke masing- masing conical tube yang telah diberi tanda setelah hasil sinkronisasi selama 48 jam. Parasit diambil dengan cara disentrifus selama 15 menit dengan kecepatan 1500 rpm, supernatan dibuang dengan pipet pasteur dan dihitung sisa endapan. Jika endapan terdapat 0,2 ml, maka tambahkan dengan growth medium sampai 10 ml. Pada conical tube lain disiapkan RBC 50 % (eritrosit tak berparasit ) sebanyak 0,4 ml dan ditambahkan growth medium sampai 10 mL. Slide apusan darah tipis sebelumnya sudah memberikan informasi kadar parasetimia galur D6 dan galur W2, misalnya parasetimia D6 2 %, maka dari conical tube yang berisi parasit diambil 1 bagian volume dan diambil 1 bagian volume dari conical tube tak berparasit. Dicampur sampai homogen, dan siap dilakukan uji aktivitas anti malaria. Anti plasmodium dilakukan tiga kali dengan tiga kali replikasi, memakai lempeng sumur mikro 96 lubang. Terbagi menjadi 8 baris (A-H) dan 12 kolom (1-18) dengan rincian sebagai berikut :
- Baris A, kolom 1 - 12 diisi dengan larutan dengan 100 µg tanpa parasit - Baris B, kolom 1 - 12 diisi dengan larutan etanol sebagai kontrol.
- Baris C, kolom 1 - 6 , ekstrak uji dengan konsentrasi 0,01 µg/mL untuk W2 - Baris C, kolom 7 - 12 ekstrak uji dengan konsentrasi 0,01 µg/mL untuk D6 - Baris D, kolom 1-6 ekstrak uji dengan konsentrasi 0,1 µg/mL untuk W2 - Baris D, kolom 7-12 ekstrak uji dengan konsentrasi 0,1 µg/mL untuk D6 - Baris E, kolom 1-6 ekstrak uji dengan konsentrasi 1 µg/mL untuk W2 - Baris E, kolom 7-12 ekstrak uji dengan konsentrasi 1 µg/mL untuk D6 - Baris F, kolom 1-6 ekstrak uji dengan konsentrasi 10 µg/mL untuk W2 - Baris F, kolom 7-12 ekstrak uji dengan konsentrasi 10 µg/mL untuk D6
- Baris G, kolom 1-6 ekstrak uji dengan konsentrasi 100 µg/mL untuk W2 - Baris G, kolom 7-12 ekstrak uji dengan konsentrasi 100 µg/mL untuk D6 - Baris H, kolom 1-6 ekstrak uji dengan konsentrasi 1000 µg/mL untuk W2 - Baris H, kolom 7-12 ekstrak uji dengan konsentrasi 1000 µg/mL untuk D6
Tahapan pengujiannya sebagai berikut :
Lempengan sumur mikro yang telah berisi bahan uji dibiarkan terbuka dalam ruang steril (laminar air flow) sampai semua pelarut menguap dan di dalam lempeng sumur mikro hanya tertinggal contoh uji yang menempel pada dinding sumur. Sebanyak 50 μL suspensi parasit dengan kadar parasitemia 1 % dimasukan ke dalam tiap sumur. Lempengan sumur mikro ditutup dan digoyangkan secara perlahan supaya bahan uji menyatu dengan suspensi parasit. Inkubasikan lempeng sumur tersebut pada suhu 37 oC selama 48 jam dan 72 jam pada eksikator berisi lilin (candle jar).
Pemanenan dan evaluasi hasil pengujian pengaruh antimalaria
Lempeng sumur mikro dikeluarkan dari inkubator dan candle jar. Suspensi bagian atas dibuang ± 20 μL sehingga yang tertinggal hanya supensi yang lebih pekat. Suspensi tersebut diambil dengan pipet Eppendorf selanjutnya diteteskan pada slide mikroskop, untuk dibuat slide hapusan darah tebal. Setiap kolom dibuat slide apusan darah tebal sebanyak tiga kali ulangan (Gambar 5). Semua slide dikeringkan pada suhu kamar selama 1 hari, diwarnai dengan pewarna Giemsa. Biarkan selama 20 menit. Cuci secara hati-hati dengan air mengalir sampai semua larutan Giemsa hilang dan lanjutkan pengeringan kembali diudara. Slide tersebut amati pada mikroskop pada pembesaran 10 x 100 dan hitung jumlah skizon hidup dengan minimal 3 inti terhadap 200 aseksual parasit P. falciparum. Persentase penghambatan parasit P. falciparum hitung dengan cara membandingkan dengan media kontrol dan dirumuskan sebagai berikut :
% Penghambatan = 100 % -[(Nt/Nc) x 100 %]
Keterangan :
Nt = jumlah skizon hidup per 200 aseksual P.falciparum pada sumur pengujian Nc = jumlah skizon hidup per 200 aseksual P.falciparum pada sumur kontrol
Gambar 5 Pola pembuatan slide apusan darah tebal A B C D F G