BAB I
PENDAHULUAN
1.1 Tujuan Percobaan
a. Memahami prinsip analisa dengan menggunakan AAS b. Mampu mengoperasikan alat AAS
c. Membuat kurva standar
d. Menentukan konsentrasi sampel 1.2 Dasar Teori
1.2.1 Definisi Spektormetri Serapan Atom
Spektrometri adalah s uatu metode analisa kimia yang berdasarkan prinsip spektroskopi. Spektroskopi adalah ilmu yang mempelajari interaksi antara radiasi gelombang elektromagnetik dengan materi. Materi bisa berbentuk molekul atau atom. Dalam mempelajari spektroskopi, diperlukan suatu alat yang dapat men ginteraksikan antara cahaya dengan materi (molekul atau atom), AAS adalah salah satunya. AAS merupakan alat yang digunakan untuk menentukan unsur -unsur suatu senyawa dengan kepekaan, ketelitian, dan selektivitas yang tinggi berdasarkan proses penyerapan cahaya oleh atom- atom yang berada pada ti ngkat energi dasar ( ground state). Atom-atom yang tereksitasi akan menyerap cahaya pada panjang gelombang tertentu. Absorbsi terjadi oleh penyerapan caha ya pada sekumpulan atom yang di eksitasi. Bila sampel berupa laru tan, sampel harus diuapkan terlebih dahulu dan diikuti dengan dissosiasi molekul agar tercipta atom bebas. AAS ( Atomic Absorbtion Spectrometry ) dapat digunakan untuk analisa logam -logam dalam sampel. AAS tidak dapat menganalisa unsur nonlogam karena atom-atom logam cenderung menjadi ion ketika unsur tersebut dibakar, sehingga absorbsi oleh cahaya terhadap atom tidak dapat terjadi.
1.2.2 Prinsip Dasar AAS ( Atomic Absorbtion Spectrometry ) Berdasarkan Hukum Lambert Beer
Bila seberkas sinar radiasi dengan intensitas Io dilewatkan
melalui medium yang panjangnya b dan mengandung atom – atom pada tingkat energi dasar dengan konsentrasi C, maka radiasi akan diserap sebagian dan intensitas radiasi akan berkurang menjadi I. Perbandingan cahaya yang diteruskan (I) dengan cahaya yang masuk (Io)
dinamakan Transmitansi di mana dapat dirumuskan sebagai berikut:
Panjang gelombang yang dihasilkan oleh sumber radiasi adalah sama dengan panjang gelombang yang diabsorpsi oleh atom dalam nyala. Absorpsi ini mengikuti hukum Lambert-Beer, yaitu absorbansi berbanding lurus dengan panjang nyala yang dilalui sinar dan konsentrasi uap atom dalam nyala. Kedua variabel ini sulit untuk ditentukan tetapi panjang nyala dapat dibuat konstan sehingga absorbansi hanya berbanding langsung dengan konsentrasi analit dalam larutan sampel.
Aspek kuantitatif dari metode spektrofotometri diterangkan oleh hukum Lambert-Beer, yaitu:
A = ε . b . c atau A = a . b . c Dimana : A = Absorbansi ε = Absorptivitas molar (ppm-1.cm-1) a = Absorptivitas (cm-1) b = Tebal nyala (cm) c = Konsentrasi (ppm)
Absorpsivitas molar (ε) dan absorpsivitas (a) adalah suatu konstanta dan nilainya spesifik untuk jenis zat dan panjang gelombang tertentu, sedangkan tebal media (sel) dalam prakteknya tetap. Dengan demikian absorbansi suatu spesies akan merupakan fungsi linier dari konsentrasi,
ditentukan dengan membandingkannya dengan konsentrasi larutan standar. Dari persamaan ini dapat diketahui bahwa absorbansi berbanding lurus dengan konsentrasi atom pada tingkat energi dasar dalam nyala. Sehingga dapat disimpulkan bahwa absorbansi (A) barbanding lurus dengan absorptivitas molar (ε), semakin besar absorbansi maka semakin besar pula nilai absorptivitas molar.(Day R.A, 2002)
1.2.3 Energi Level (Tingkat Energi) Elektron Pada Atom
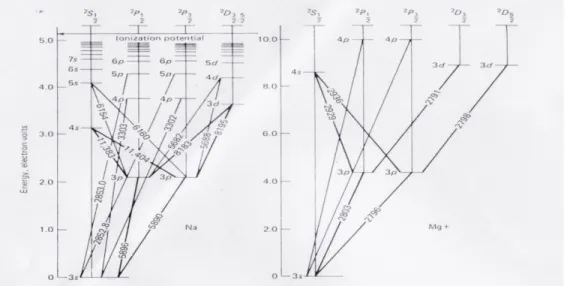
Atom terdiri dari elektron yang mengorbit disekitar inti atom. Orbit elektron pada atom lebih sesuai dinyatakan dengsn tingkat energi. Tingkatan energi ini tergantung pada bilangan kuantum magnetik, bilangan kuantum spin, azimuth utama dan momen anguler magnetik yang dimiliki atom. Setiap atom memiliki nilai bilangan kuantum yang berebeda juga. Energi level tiap atom dapat dilihat dari diagram energi levelnya, seperti diagram energi level untuk Na dan Mg+ berikut :
Gambar 1.1 Energi level atom Na dan Mg+
Pada diagram energi level atom, dapat dilihat jumlah energi yang harus dimiliki elektron pada suatu atom agar dapat berpindah dari tingkat energi yang satu ketingkat energi yang lain. Diagram ini terdiri dari angka
Choper
Signal Processor
Atomizer
Tabung katoda cekung Nyala Monokromator Detektor Display
Motor
yang tersusun vertikal. Angka ini menunjukkan energi dalam elektron volt. Angka yang berada pada garis miring yang menunjukkan panjang gelombang cahaya yang diserap atom. Nilai 0 eV merupakan energi yang dimiliki atom pada keadaan ground state. Letak ground state tiap atom berbeda-beda. Hal ini dapat diketahui dari konfigurasi elektron pada ground state. Misalkan ion Mg+
yang memiliki nomor atom 12, elektronnya II, sehingga konfigurasi elektronnya menjadi 1s2, 2s2, 2p6
, 3s1. Sama seperti konfigurasi pada atom Na.
Dari konfigurasi ini, dapat diketahui bahwa ground state pada atom Mg yaitu terletak pada subkulit 3s karena elektron yang dapat tereksitasi hanya elektron pada subkulit 3s saja. Untuk sub kulit 3 p, energi levelnya terpecah menjadi 2, karena momen anguler momentumnya yang berbeda yaitu 2P
1/2 dan 2P3/2. Jika
dilihat dari diagram energi levelnya dimulai dari 3s, kerena 3s merupakan ground state dari Na dan Mg+..
Berpindahnya elektron ke excited stateyaitu contohnya 3p. Mg+ dan
Na memiliki selisih tingkat energi yang berbeda. Untuk Na, berpindahnya elektron dari 3s ke 3p, selisih tingkat energinya adalah sebesar 2 eV. Sedangkan untuk Mg+, berpindahnya elektron dari 3s ke 3p selisih tingkat
energinya adalah sebesar 4 eV, sehingga panjang gelombangnya juga berbeda. Perbedaan inilah yang menyebabkan suatu unsur dapat dianalisa dengan spektrometri serapan atom (Mc Qurne, D.A., 1983).
1.2.4 Instrumentasi Spektrofotometri Serapan Atom
Alat spektrofotometer serapan atom terdiri dari rangkaian dalam diagram skematik berikut:
Gambar 1.2 Komponen-komponen AAS 1. Sumber Cahaya
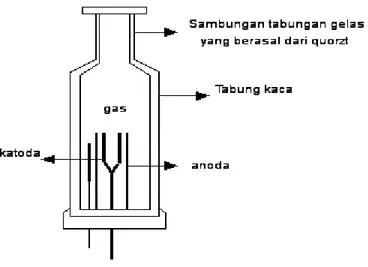
Sebagai sumber radiasi resonansi untuk AAS adalah Hollow Cathode Lamp (lampu katoda berongga). Lampu ini terdiri dari katoda cekung yang silindris yang terbuat dari unsur yang sama dengan unsur yang akan dianal isa dam anoda yang terbuat dari tungsten. Dengan pemberian tegangan pada arus tertentu, logam akan mulai memijar dan atom -atom logam katodanya akan teruapakan. Atom yang tereksitasi kemudian memancarkan radiasi pada panjang gelombang tertentu (Khopkar. 1990). Gambar 1.2 di bawah ini merupakan gambar dari lampu katoda berongga.
Ga mbar 1.3 Lampu Katoda Berongga
Gas-gas pengisi tabung yang biasa digunakan adalah Ne (neon), Ar (argon) dan He (helium). Contoh unsur dari katoda adalah Cu (tembaga), Mg (magnesium),
Na (natrium) dan lain-lain. Jenis lampu logam dengan panjang gelombang tertentu dibedakan berdasarkan logam yang dipasang pada lubang katoda yang berfungsi sebagai pengatur frekuensi radiasi yang dipancarkan dari lampu, sehingga energi ini ole h photomultiplier diubah menjadi energi listrik.
Dalam rangkaian alat terdapat chopper yang berfungsi sebagai pengatur frekuensi radiasi yang dipancarkan dari lampu, sehingga energi ini oleh photomultiplier dubah menjadi energi listrik.
2. Pemilah (Chopper)
Dimuka lampu katoda rongga terdapat komponen yang disebut baling – baling (chopper), yang berfungsi mengatur frekuensi radiasi resonansi yang dipancarkan dari lampu, sehingga energi radiasi ini oleh diubah menjadi arus listrik. Karena chopper berpulsa maka arus listrik tidak sepenuhnya terbaca. Kemudian arus listrik yang tidak terbaca akan difilter. Sehingga setelah difilter arus listrik yang tidak terbaca akan menjadi terbaca.
3. Atomizer
Atomizer adalah alat yang digunakan untuk mengatomkan senyawa yang akan dianalisa (sampel). Atomizer terdiri dari sistem pengabut (nebulizer) dan sistem pembakar (burner), sehingga sistem atomizer ini juga disebut burner nebulizer system/sistem pengabut pembakar. macam-macam atomizer :
Flame bekerja pada temperature atomisasi 1700-3150°C dengan jeniscontinue Inductively coopled argon plasma, bekerja pada temperatur atomisasi
4000-5000°C dengan kontinyu.
Direct current argon plasma, bekerja pada temperature 4000-6000oC, dengan
jenis kontinyu.
Electric thermal, bekerja pada temperature 1200-1300oC, dengan jenis diskrit.
Electric arc, bekerja pada temperature 4000-5000oC, baik untuk jenis diskrit
dan kontinyu.
Sampel analit
zbAHASSSSS Bahan bakar dan oksidan
Atomizer yang biasa digunakan pada spektrofotometer adalah jenis sistem flame. Pada umumnya menggunakan energi panas yang dihasilkan baik dengan listrik ataupun nyala api. Pada umumnya pengagtoman terjadi pada tempat pembakaran sampel, udara, dan gas asetilene yaitu di burner head.
a) Nebulizer system
Sistem ini berfungsi untuk mengubah larutan menjadi butir –butir kabut yang berukuran 15-20 µm, dengan cara menarik larutan melalui kapiler dengan penghisapan pancaran gas bahan bakar dan gas oksidan disemprotkan ke ruang pengabut . Partikel-partikel kabut yang halus kemudian bersama-sama aliran gas bahan bakar masuk ke dalam nyala ,sedang partikel kabut yang besar dialirkan melalui saluran pembuangan.
b) Burner system
Sistem burner/pembakaran ialah suatu system di mana nyala api mengatomkan sampel yang telah dirubah menjadi kabut/uap garam unsur menjadi atom-atom normal. Berikut merupakan gamabar dari atomizer nyala:
Gambar 1.4 atomizer nyala
Dari gambar dapat dijelaskan bahwa, bahan bakar, udara dan sampel diumpankan ke tempat campuran melalui sederet buffle kemudian menuju ke tempat pembakaran. Pemasangan buffle dimaksudkan untuk pencampuran bahan bakar, oksidan dan sampel agar terjadi dengan sempurna. Sampel yang masuk pada alat ini menghasilkan
Nyala
Saluran penampung
cairan bermacam-macam. Tetesan yang besar akan menumbuk buffle sehingga sampai pada nyala api dengan ukuran yang seragam.
4. Monokromator
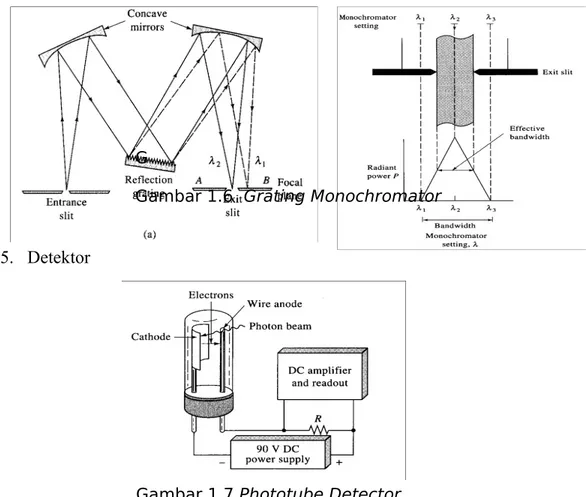
Monokromator merupakan alat yang berfungsi untuk memisahkan radiasi yang tidak diperlukan dari spektrum radiasi lain yang dihasilkan oleh Hallow Cathode Lamp . Atau dengan istilah lain melakukan pemilihan radiasi yang ditemukan. Monokromator terdiri dari dua jenis yaitu Czerny-Turner monochromator (Grating Monochromator) dan Monokromator Prisma.
a. Czerny-Turner monochromator (Grating Monochromator)
Dijelaskan pada gambar 1.6 bahwa cahaya polikromatis masuk melalui entrance slit menuju collimating mirror dipantulkan sejajar kea rah grating. Ketikaberada di grating, sinar diuraikan sesuai panjang gelombang kemudian diteruskan oleh focusing mirror. Sinar kemudian keluar sebagai cahaya monokromatis melalui exit slit.
G
Gambar 1.6 Grating Monochromator
5. Detektor
Gambar 1.7 Phototube Detector
Dalam sebuah detektor untuk suatu spektrofotometer, kita menginginkan kepekaan yang tinggi dalam daerah spektral yang diinginkan, respon yang linear terhadap daya radiasi, waktu respon yang cepat, dapat digandakan dan kesetabilan tinggi atau tingkat bising yang rendah, meskipun dalam praktik perlu mengkompromikan faktor-faktor tersebut di atas.
Detektor berfungsi untuk mengukur intensitas radiasi yang diteruskan yang telah diubah menjadi energi oleh photomultiplier. Hasil pengukuran detektor dilakukan penguatan dan dicatat oleh alat pencatat yang berupa printer dan pengamat angka. Gambar Phototube Detector dapat dilihat pada Gambar 1.7 . (Day R.A, 1986)
- Kepekan yang tinggi
- Perbandingan isyarat atau signal dengan bising tinggi - Respon konstan pada berbagai panjang gelombang. - Waktu respon cepat dan signal minimum tanpa radiasi.
- Signal listrik yang dihasilkan harus sebanding dengan tenaga radiasi.
6. Sistem pengolah / Amplifier (pengganda)
Sistem pengolah berfungsi untuk mengolah kuat arus dari detektor menjadi besaran daya serap atom transmisi yang selanjutnya diubah menjadi data dalam sistem pembacaan.
7. Sistem pembacaan (Meter atau Recorder)
Sistem pembacaan merupakan bagian yang menampilkan suatu angka atau gambar yang dapat dibaca oleh mata.
1.2.5 Teknik Pengukuran AAS
Ada tiga macam pengukuran yang biasa digunakan pada analisis sampel dengan menggunakan AAS, yaitu :
1. Metode Satu Standar
Metode ini sangat praktis, karena hanyya menggunakan satu larutan standar yang telah diketahui konsentrasinya (Cx). Selanjutnya absorbansi larutan standar (Ax) dan absorbansi larutan sampel (As) diukur dengan AAS. Kelemahan sistem ini, jika standar salah, maka hasil analisa yang dilakukan semua akan salah.
Konsentrasi sampel
Y= a+bx Y=absorbansi x= konsentrasi a= intersep b=slope
Absorbansi sampel Absorbansi Konsentrasi As = ε bCs As = ε bCx Cx = Ax As . Cs
dengan, Cx = konsentrasi sampel As = absorbansi larutan standar Ax = absorbansi sampel
Cs = konsentrasi larutan standar 2. Metode Kurva Kalibrasi
Metode kurva kalibrasi / standar yaitu dengan membuat kurva antara konsentrasi larutan standar (sebagi absis) melawan absorbansi (sebagai ordinat) dimana kurva tersebut berupa garis lurus. Kemudian dengan cara menginterpolasikan absorbansi larutan sampel ke dalam kurva standar tersebut dan akan diperoleh konsentrasi larutan sampel.
Gambar 1.8 Kurva Kalibrasi 3. Metode Penambahan Standar
Pada metode ini, dibuat sederetan larutan cuplikan dengan konsentrasi yang sama dan masing-masing ditambahkan larutan standar dengan konsentrasi sama tetapi volumenya divariasikan. Kemudian unsur yang dianalisa dengan volume sama. Absorbsi masing-masing larutan diukur dan dibuat kurva absorbansi terhadap volume larutan standar yang ditambahkan (Skoog dan Leary, 1992).
dimana, y = a + bx y = absorbansi x = volume standar a = intersep
B = slope = tan = ( K . Cs ) / V A = Ax + As = ε b . Cx’ + ε b . Cs’ Cx . Vx = Cx’ . Vlabu Cx’ = (Cx . Vx) / Vlabu Cs’ = (Cs . Vs) / Vlabu A = εb . Cx .Vx Vlabu +εb. Cs Vlabu . Vs = K1 + K2 . Vs K1 K2 =εb .Cx.Vx/Vlabu εb.Cs/Vlabu K1 K2 =Cx. Vx Cs Cx=K1. Cs K2. Vx
1.2.6 Gangguan-Gangguan yang Mungkin Terjadi dan Cara Mengatasinya
Gangguan-gangguan yang mungkin terjadi pada metode AAS adalah gangguan karena serapan latar, gangguan matriks, gangguan akibat pembentukan senyawa refaktori, gangguan ionisasi, gangguan spektra, gangguan serapan emisi dan gangguan fisik alat.
1. Gangguan karena serapan latar, kadang-kadang sinar yang diberikan dari lampu katoda berongga diserap oleh senyawa lain yang terkandung dalam sampel. Adanya serapan ini akan mengganggu pengukuran serapan atom dari unsur yang dianalisis. Gangguan serapan ini disebut serapan latar (background Absorbtion). Serapan latar disebabkan oleh :
a. Serapan molekuler yang disebabkan oleh senyawa-senyawa yang tidak teratomisasi dalam atomizer.
b. Hamburan sinar yang disebabkan oleh partikel-partikel padat yang harus melintang pada berkas sinar.
c. Serapan nyala bahan bakar yang digunakan serapan latar pada umumnya mengganggu pada daerah panjang gelombang dibawah 2.500 Å (daerah ultraviolet)
Gangguan serapan latar dapat dikoreksi dengan cara koreksi dengan garis yang berdekatan dan panjang gelombang sinar kontinyu pada cara ini, serapan latar diukur pada panjang gelombang + 5 Å dari garis serapan atom yang dianalisis. Metode ini mempunyai kekurangan, sebab lampu katoda berongga yang memancarkan sinar kuat pada + 5 Å dari garis analisis unsur yang ditentukan tidak selalu tersedia dan juga serapan atom dan serapan latar tidak diukur pada panjang gelombang yang sama. Sinar yang intensitasnya hampir merata pada daerah 1900-4300 Å , dapat digunakan secara efektifuntuk koreksi serapan latar, yaitu dapat digunakan lampu H2/D2
seperti pada gambar grafik absorbansi melawan panjang gelombang berikut.
Gambar 6. Absorbansi Melawan Panjang Gelombang
Data yang diketahui hanya RP. Sehingga untuk mengetahui RO = RP – OP. Dimana OP diperoleh dari penambahan sumber cahaya kontinyu dari lampu H2/D2, sehingga monokromator diatur pada panjang
gelombang garis analisis dan sinar dari lampu D2 diatur selebar
beberapa Å disekitar panjang gelombang garis analisis dari unsur yang dianalisa, maka serapan latar dapat diukur pada panjang gelombang + 5 Å . Dengan pengurangan serapan latar, maka serapan atom dapat ditentukan dengan mudah.
2. Gangguan matriks, yaitu gangguan yang disebabkan oleh unsur-unsur atau senyawa lain yang terkandung di dalam cuplikan. Adanya matriks ini menyebabkan perbedaan pada proses atomisasinya dan proses penyerrapan energi radiasi oleh atom yang dianalisa dengan standar murni. Gangguan matriks ini dapat diatasi dengan metode penambahan standar.
3. Gangguan akibat pembentukan senyawa refaktori, gangguan ini dapat diakibatkan oleh reaksi antara analit dengan anion yang ada pada larutan sampel, sehingga terbentuk senyawa tahan panas (refraktori). Contohnya pospat akan bereaksi dengan kalsium dalam nyala yang menghasilkan pirofosfat (Ca2P2O7). Hal ini menyebabkan absorbsi
atom kalsium dalam nyala akan berkurang. Gangguan ini dapat diatasi dengan menambahkan releasing agent berupa kation, yaitu stronsium klorida dan lantanium nitrat ke dalam larutan.
4. Gangguan ionisasi, gangguan ini terjadi pada penggunaan suhu yang tinggi sehingga atom-atom yang dianalisa tidak hanya teratomisasikan pada keadaan tingkat energi dasar. Tetapi atom-atom dapat tereksitasi secara termal karena panas attau dapat terionisasi sehingga menghasilkan elektron dengan jumlah yang besar dan menekan proses ionisasi unsur yang akan dianalisis. Biasanya dengan menambah logam Na atau K untuk menekan gangguan ionisasi ini.
5. Gangguan emisi pada konsentrasi tinggi dari unsur yang dianalisis yang mempunyai emisi tinggi sering diperoleh hasil analisis yang
kurang tepat (bila signal berbeda dalam pita spektrum dari sinar yang digunakan). Gangguan dapat diatasi dengan melakukan beberapa cara, yaitu mempersempit lebar celah, menaikan arus lampu, mengencerkan larutan atau menggunakan nyala yang lebih rendah.
6. Gangguan fisik alat, yaitu semua parameter yang dapat mempengaruhi kecepatan sampel sampai ke nyala dan sempurnanya atomisasi. Parameter-parameter tersebut adalah kecepatan aliran gas, berubahnya viskositas sampel akibat suhu nyala. Gangguan ini dapat diatasi dengan lebih sering membuat kalibrasi atau standarisasi.
BAB II
METODOLOGI
2.1 Alat
- AAS Spectra AA-220 - Botol sampel
2.2 Bahan
- Larutan sampel (X1, X2,dan X3)
- Larutan standar ( 1 ppm, 6 ppm, 10 ppm, 16 ppm, 20 ppm, 30 ppm) - Aquadest
2.3 Prosedur Kerja
A. Pengoperasian AAS Spectra AA-220
1. Membuka gas tabung asetylen berlawanan arah jarum jam dan memastikan tekan gas asetylen 11 psig.
2. Mengecek aliran udara dengan melihat tekanan 50 psig pada kompresor. 3. Memasang lampu element Cu kedalam tempatnya.
4. Menghidupkan aliran listrik ke komputer, blower dan spektrometer 5. Memastikan blower sudah nyala
6. Menyalakan komputer
7. Menyalakan alat spectra AA-220
8. Mengklik logo / program spektra AA pada layar komputer 9. Mengklik worksheet
10. Mengklik new
11. Mengklik worksheet details dan mengisi data berikut ini : Name : Kelompok 4A
Analyst : AnceBadrun Sample : 3
12. Mengklik ok
13. Mengklik add metode dan memilih elemen Cu (elemen yang akan dianalisa)
14. Mengklik edit metode dan mengisi form berikut ini : - Type mode
Sampling mode : Manual Instrumen mode : Absorbance Flame type & gas flow : Air/Acetylene Air flow : 13,5 ml/menit Acetylene flow : 2,00 ml/menit
- Measurement
Measurement mode : Integration Measurement time : 3s
Read delay time : 5s
Calibration mode : concentration Replicate standar : 3
Replicate sample : 3 - Optical
Lamp position : 4 (sesuai denmgan posisi lampu) Lamp current : 4,0
Wavelength : 324,8 nm Slit width : 0,5 nm Background correction : off - Standard
Mengisi nilai larutan standar Cu
Standar 1 : 1 ppm Standar 2 : 6 ppm Standar 3 : 10 ppm Standar 4 : 16 ppm Standar 5 : 20 ppm Standar 6 : 30 ppm 15. Mengklik ok
16. Mengklik label dan mengisi nama sampel berikut ini : Pada baris 1 : sampel X1
Pada baris 2 : sampel X2
Pada baris 3 : sampel X3
17. Mengklik analysis
Akan muncul kotak dialog confirm W5127 : please up date the worksheet to use the available instrumen. Mengklik ok pada kotak dialog tersebut. 18. Mengklik optimize, akan muncul beberapa kotak yaitu :
- Kotak unsur pilihan Cu yang diuji, klik ok - Kotak dialog W5127 , klik ok
- Kolom analysis checklist , mengklik ok 19. Mengklik optimize lamp
- mencari % gain hingga berkisar 35-36% dengan cara memutar kedua tombol putaran yang bterdapat dibagian belakang lampu.
- mengklik rescale, setiap indikator cahaya pada monitor mencapai puncak atau maksimum sehingga % gainnya turun, hal ini dilakuklan berulang-ulang hingga mendapat % gain terendah.
20. Mengklik optimize signal
21. Menyalakan flame dengan menekan tombol hitam/ignate hingga nyala api sempurna.
22. Mengklik instrumen zero saat selang terhubung dengan aquadest
23. Memindahkan selang ke salah satu standar (standar dengan konsentrasi yang berada ditengah-tengah , pada praktikum kali ini yaitu 10 ppm). Menggeser burner head sampai diperoleh nilai absorbansi tertinggi. 24. Mengembalikan selang ke aquades lalu menunggu sinyal absorbansinya turun, lalu mengklik ok
25. Kemudian muncul kolom uji Cu, mengklik ok 26. Mengklik start dan muncul beberapa kotak , yaitu :
- kotak confirm W5127 : mengklik ok - kotak analysis : mengklik ok - kotak confirm : mengklik ok
27. Mengikuti perintah yang muncul di monitor untuk dianalisa.
- present instrumen zero (selang terhubung dengan aquades), klil ok - present cal zero (selang bterhubung dengan blanko), klik read
- present standard 1 (selang terhubung dengan standar 1 yaitu 1 ppm) , klik read.
- melakukan hal yang sama untuk standar 2 – standar 6 yaitu larutan dengan konsentrasi 6 ppm, 10 ppm, 16 ppm, 20 ppm, 30 ppm.
- present sample X1 (selang terhubung dengan X1), klik read.
- melakukan hal yang sama untuk sampel X2 dan X3 .
- setelah proses analisa selesai, akan muncul out hon complete, klik ok - apabila kurva standar tidak muncul pada monitor cek standar yang salah
- setelah standar yang salah diketahui mengklik kanan pada standar tersebut, memilih edit replicate, maks, mengklik apply.
28. Untuk mengeprint hasil yang diperoleh, mengklik kanan pada hasil yang diperoleh, kemudian mengklik print.
29. Mematikan alat AAS
- mengklik exit pada menu awal
- mengklik start pada monitor kemudian shutdown - mematikan alat AAS dan melepaskan lampu Cu - menutup kran tabung gas
- mematikan sumber arus listrik
BAB III
DATA PENGAMATAN
3.1 Data Pengamatan
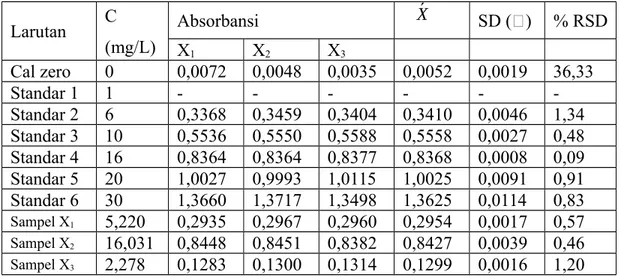
Tabel 1. Data pengamatan Larutan C (mg/L) Absorbansi X´ SD (ɤ) % RSD X1 X2 X3 Cal zero 0 0,0072 0,0048 0,0035 0,0052 0,0019 36,33 Standar 1 1 - - - -Standar 2 6 0,3368 0,3459 0,3404 0,3410 0,0046 1,34 Standar 3 10 0,5536 0,5550 0,5588 0,5558 0,0027 0,48 Standar 4 16 0,8364 0,8364 0,8377 0,8368 0,0008 0,09 Standar 5 20 1,0027 0,9993 1,0115 1,0025 0,0091 0,91 Standar 6 30 1,3660 1,3717 1,3498 1,3625 0,0114 0,83 Sampel X1 5,220 0,2935 0,2967 0,2960 0,2954 0,0017 0,57 Sampel X2 16,031 0,8448 0,8451 0,8382 0,8427 0,0039 0,46 Sampel X3 2,278 0,1283 0,1300 0,1314 0,1299 0,0016 1,20 3.2 Data Perhitungan
Perhitungan rata-rata absorbansi ( X´ ) Rumus , X´=X1+X2+X3n+… …..+Xn Perhitungan untuk larutan blanko
´
X=0,0072+0,0048+0,0035
3
´
X = 0,0052
Dengan cara yang sama untuk menghitung X´ pada larutan standar dan sampel.
Perhitungan standar deviasi (SD)
Rumus , X3−´x ¿ ¿ Xn−´x ¿ ¿ ¿2 (X1−´x)2+(X2−´x)2+¿ ¿ ɤ=√¿
Perhitungan SD untuk larutan blanko 0,0035−0,0052 ¿ ¿ ¿2 (0,0072−0,0052)2+(0,0048−0,0052)2+¿ ¿ ɤ=√¿ ɤ = 0,0019
Dengan cara yang sama untuk mengukur standar deviasi pada larutan standar dan sampel.
Rumus , % RSD = ɤX´ x 100 % Perhitungan % RSD pada larutan blanko
% RSD = 0,00190,0052 x 100% % RSD = 36,33%
Dengan cara yang sama untuk menghitung % RSD pada larutan standar dan sampel.
Hasil perhitungan dari grafik
Dari grafik atau kurva standar yang telah dibuat, diperoleh konsentrasi sampel yang sama dengan hasil interverensi langsung dari alat AAS, yaitu :
Sampel X1 = 5,220 mg/L
Sampel X2 = 16,031 mg/L
Sampel X3 = 2,278 mg/L
BAB IV
PEMBAHASAN
Praktikum instrumentasi dengan alat analitiknya berupa AAS, memiliki beberapa tujuan yang harus dicapai yaitu memahami prinsip analisa dengan menggunakan AAS, mampu mengoperasikan alat AAS, membuat kurva standar, dan menentukan konsentrasi sampel.
Memahami primsip analisa dengan menggunakan AAS merupakan tujuan pertama dalam praktikum ini. Prinsip AAS adalah penyerapan radiasi cahaya oleh atom. Oleh karena itu, sampel / larutaan yang mulanya berbentuk cairan harus diatomkan terlebih dahulu dengan menggunakan suatu atomizer atau alat pengatoman (pembuatan atom) unsur pada sampel. Dalam hal ini digunakan nyala api dari pembakaran acetylen dan udara. Penyerapan energi radiasi oleh atom-atom yang berada pada tingkat energi dasar (ground state). Penyerapan energi tersebut menyebabkan tereksitasinya elektron dalam kulit atom ke tingkat energi yang lebih
tinggi (excited state). Pengurangan intensitas radiasi yang diberikan sebanding dengan jumlah atom pada tingkat energi dasar yang menyerap energi radiasi tersebut. Dengan mengukur intensitas radiasi yang diteruskan (transmisi) atau mengukur intensitas radiasi yang diserap (absorbansi) maka konsentrasi unsur didalam cuplikan dapat ditentukan, dalam hal ini adalah unsur Cu.
Sebagai sumber radiasi digunakan lampu katoda berongga (hollow catode lamp). Dalam hal ini lampu yang digunakan harus sesuai dengan unsur yang akan dianalisis dalam sampel yaitu Cu. Penggunaan hollow catode lamp harus disesuaikan karena radiasi resonansi ini mempunyai panjang gelombang atau frekuensi yang karakteristik untuk setiap unsur. Sebelum hollow catode lamp digunakan untuk proses serapan maka harus disesuaikan terlebih dahulu atau cahaya atau sinar dari hollow catode lamp, dengan menggunakan kertas untuk ketetapan datangnya cahaya agar dalam berlangsungnya penyerapan lebih baik.
Tujuan kedua adalah mampu mengoperasikan alat AAS, hal ini dapat dibuktikan pada bab 2 pada prosedur kerja pengoperasian spectra AA-220. Pada tujuan praktikum berikutnya adalah membuat kurva standar melawan absorbansi (penyerapan cahaya oleh atom-atom dari larutan standar yang diatomkan).
Kemudian tujuan praktikum yang terakhir adalah menentukan konsentrrasi sampel. Terdapat tiga sampel yang harus diketahui konsentrasinya. Masing-masing sampel memiliki konsentrasi yang berbeda. Dalam hal ini terdapat dua metode untuk mengetahui konsentrasi larutan standar, yaitu pertama melalui interverensi langsung dari alat AAS, hasil yang diperoleh adalah sebagai berikut :
- Sampel X1 = 5,220 ppm
- Sampel X2 = 16,031 ppm
- Sampel X3 = 2,278 ppm
Sedangkan metode kedua adalah dengan melihat absorbansi sampel di grafik yang dibuat secara manual dan menentukan konsentrasi sampel melalui grafik . Hasil yang diperoleh tidak jauh berbeda dengan hasil konsentrasi yang langsung ada dari alat AAS, yaitu :
- Sampel X1 = 5,2 ppm - Sampel X2 = 16,0 ppm - Sampel X3 = 2,2 ppm
BAB V
PENUTUP
5.1 KesimpulanBerdasarkan percobaan yang dilakukan dapat disimpulkan bahwa : Prinsip alat AAS adalah berdasarkan pada banyaknya cahaya yang diserap
oleh atom-atom yang ada dalam sampel, dimana banyaknya cahaya yang diserap sebanding dengan banyaknya konsentrasi logam tersebut dalam sampel.
Dari percobaan diperoleh konsentrasi Cu dengan dua metode, yaitu metode pertama nilai konsentrasi sampel diperoleh dari pembacaan langsung oleh alat, yaitu :
Sampel X1 = 5,220 ppm
Sampel X2 = 16,031 ppm
Sampel X3 = 2,278 ppm
Dan metode kedua dari interpolasi pada grafik manual, yaitu : Sampel X1 = 5,2 ppm
Sampel X2 = 16,0 ppm
Tujuan kedua tercapai yaitu mampu mengoperasikan alat AAS, hal ini dapatdibuktikan pada bab 2 pada prosedur percobaanpengoperasian spectra AA-220.
Tujuan ketiga telah tercapai yaitu dapat mebuat kurva standar berdasarkan pada konsentrasi larutan standar vs absorbansi larutan standar.
DAFTAR PUSTAKA
- Khopkar, S.M., 1990, “Konsep Dasar Kimia Analitik”, Jakarta : UI – Press - Mulja, Muhammad., 1995, “Analisis Instrumental”, Surabay : Airlangga
Unibersity Press
- Underwood., AL., Day., RA., Jr., 2002, “Analisa Kimia Kuantitatif Edisi Keenam”, Jakarta : Erlangga
- Widiastuti, Endang, dkk, 1996 , “Petunjuk Praktikum Kimia Analitik Instrumen”, Bandung : Pusat Pengembangan Pendididkan Politeknik