Terumbu karang yang indah terdapat di kawasan perairan Pulau Tioman, Pulau Redang, Pulau Sipadan, dan lain-lain. Batu karang ini terbentuk daripada garam kalsium karbonat, CaCO3. Organisma seni yang hidup di dalam laut dapat memendakkan kalsium karbonat, CaCO3 daripada ion kalsium, Ca2+ dan ion karbonat, CO32– yang terlarut di dalam air laut.
Garam dalam masakan menyedapkan rasa makanan. Garam di dalam tanah menyuburkan tumbuhan. Garam di dalam permata memberikan warnanya. Semua ini menceriakan kehidupan kita.
Adakah semua garam berasa masin? Bagaimanakah garam disediakan?
Mengapakah penyejatan larutan garam sehingga kering tidak digalakkan bagi tujuan memperoleh hablurnya?
137 Setelah mempelajari bab
ini, anda harus dapat: mensintesiskan garam mensintesiskan analisis
kualitatif garam mengamalkan sikap
sistematik dan teliti semasa menjalankan aktiviti Garam Penghabluran semula Tindak balas pemendakan BAB 8.indd 137 BAB 8.indd 137 9/21/11 3:38 PM9/21/11 3:38 PM
138 • Garam
A
Garam
Garam yang biasa kita guna ialah garam yang ditambahkan dalam makanan, iaitu natrium klorida, NaCl. Garam ini berfungsi untuk mengawal pelbagai fungsi organ penting di dalam badan kita. Selain itu, terdapat garam lain yang dapat meningkatkan kualiti hidup kita. Gambar foto 8.1 menunjukkan beberapa kegunaan garam dalam pelbagai bidang.
Gambar foto 8.1 Kegunaan garam dalam kehidupan harian kita
Definisi garam
Adakah anda masih ingat bahawa garam terbentuk daripada tindak balas peneutralan? Garam ialah suatu sebatian ion. Anionnya berasal daripada asid dan kationnya berasal daripada bes. Sebagai contoh, kalium klorida, KCl ialah garam yang terbentuk daripada tindak balas antara kalium hidroksida, KOH dengan asid hidroklorik, HCl.
Anion daripada asid
KOH(ak) + HCl(ak) ⎯→ KCl(ak) + H2O(ce)
Kation daripada bes
Maka, garam dapat ditakrifkan seperti yang berikut:
Garam ialah suatu sebatian yang terbentuk apabila ion hidrogen, H+ dalam asid digantikan dengan ion logam atau ion ammonium, NH4+.
Mari kita jalankan Aktiviti 8.1 untuk mengumpul maklumat tentang garam.
• Aktiviti 8.1, muka surat 111
Anda harus dapat: • menyatakan
contoh-contoh garam dan kegunaannya • menerangkan maksud
garam
• mengenal pasti garam terlarutkan dan garam tak terlarutkan
• menghuraikan proses penyediaan garam terlarutkan dan garam tak terlarutkan • menghuraikan proses penulenan garam terlarutkan melalui penghabluran semula • menyenaraikan ciri-ciri fi zik hablur • menulis persamaan kimia dan persamaan ion bagi tindak balas penyediaan garam • mereka bentuk suatu aktiviti untuk menyediakan garam tertentu
• membina persamaan ion melalui kaedah perubahan berterusan • menyelesaikan masalah
penghitungan kuantiti bahan tindak balas dan hasil tindak balas bagi tindak balas stoikiometri
Rajah 8.1 Pembentukan garam
daripada asid hidroklorik, HCl Na+ NH4+ NH4 Cl Na Cl H Cl Natrium klorida Ammonium klorida
Dalam bidang perubatan, garam digunakan sebagai ubat dan plaster.
Dalam industri kimia, garam digunakan dalam pembuatan plastik, detergen, kaca, cat, dan pewarna.
Dalam bidang pertanian, garam digunakan sebagai baja dan racun serangga.
Dalam industri makanan, garam digunakan sebagai perisa dan pengawet.
BAB 8.indd 138
139
Garam terlarutkan dan garam tak terlarutkan
Garam terlarutkan ialah garam yang larut di dalam air pada suhu bilik. Garam tak terlarutkan ialah garam yang tidak larut di dalam air pada suhu bilik. Jadual 8.1 menunjukkan keterlarutan garam di dalam air.
Mari kita jalankan Eksperimen 8.1 untuk mengkaji keterlarutan garam di dalam air.
• Eksperimen 8.1, muka surat 112
Rajah 8.2 Tindak balas yang terlibat dalam penyediaan garam terlarutkan
Garam terlarutkan yang terbentuk semasa penyediaan mengandungi bendasing. Maka, garam tersebut perlu ditulenkan melalui proses penghabluran semula. Mari kita jalankan aktiviti yang berikut untuk menyediakan garam terlarutkan di dalam makmal.
• Aktiviti 8.2, muka surat 113 • Aktiviti 8.4, muka surat 116 • Aktiviti 8.3, muka surat 115 • Aktiviti 8.5, muka surat 117
Semua garam ammonium, natrium, dan kalium larut di dalam air.
Kaedah yang digunakan untuk menyediakan sesuatu garam bergantung pada keterlarutan garam di dalam air dan ciri tindak balas. • Penghabluran semula
Jadual 8.1 Keterlarutan garam di dalam air
Garam Larut di dalam air Tidak larut di dalam air Garam nitrat • Semua garam nitrat
Garam • Ammonium karbonat, (NH4)2CO3 • Semua garam karbonat yang karbonat • Natrium karbonat, Na2CO3 lain
• Kalium karbonat, K2CO3
Garam klorida • Semua garam klorida kecuali • plumbum(II) klorida, PbCl2 • argentum klorida, AgCl
• merkuri(I) klorida, Hg2Cl2
Garam sulfat • Semua garam sulfat kecuali • plumbum(II) sulfat, PbSO4
• kalsium sulfat, CaSO4
• barium sulfat, BaSO4
Penyediaan dan penulenan garam terlarutkan
Garam dapat disediakan di dalam makmal dengan menggunakan pelbagai kaedah. Rajah 8.2 menunjukkan tindak balas dalam penyediaan garam terlarutkan.
Garam terlarutkan • Garam ammonium • Garam natrium • Garam kalium Garam lain
Asid + alkali ⎯→ garam + air Asid + oksida logam ⎯→ garam + air Asid + logam ⎯→ garam + gas hidrogen
Asid + karbonat logam ⎯→ garam + air + karbon dioksida
BAB 8.indd 139
140
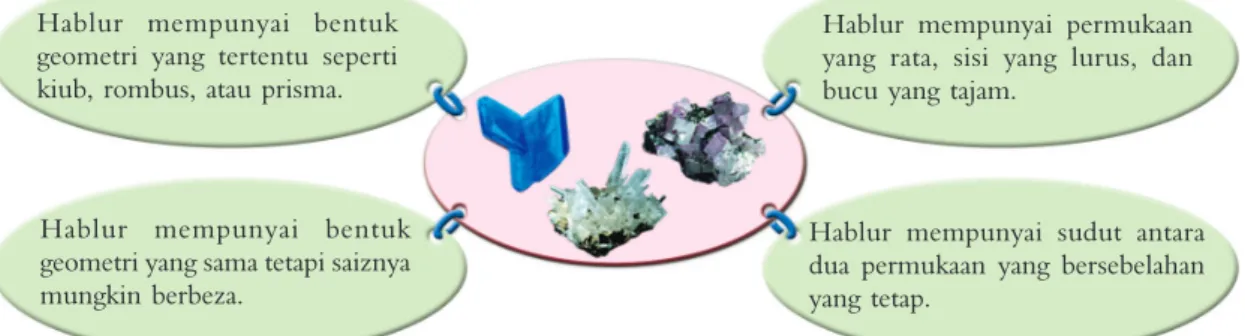
Hablur mempunyai sudut antara dua permukaan yang bersebelahan yang tetap.
Hablur mempunyai bentuk geometri yang tertentu seperti kiub, rombus, atau prisma.
Hablur mempunyai bentuk geometri yang sama tetapi saiznya mungkin berbeza.
Hablur mempunyai permukaan yang rata, sisi yang lurus, dan bucu yang tajam.
Gambar foto 8.2 Ciri-ciri fi zik hablur
Penyediaan garam tak terlarutkan
Sesuatu garam tak terlarutkan dapat disediakan melalui tindak
balas pemendakan. Dalam tindak balas ini, larutan akueus yang
mengandungi ion-ion garam tak terlarutkan dicampurkan bagi membentuk garam tersebut. Mendakan garam tak terlarutkan yang terbentuk akan diperoleh melalui penurasan. Mari kita jalankan Aktiviti 8.7 di dalam makmal untuk menyediakan garam tak terlarutkan.
• Aktiviti 8.7, muka surat 118
Persamaan kimia dan persamaan ion
Semua tindak balas yang terlibat dalam penyediaan garam dapat diwakili oleh persamaan kimia dan persamaan ion. Sebagai contoh, persamaan kimia bagi pembentukan mendakan barium sulfat, BaSO4 ialah:
BaCl2(ak) + Na2SO4(ak) ⎯→ BaSO4(p) + 2NaCl(ak) Daripada persamaan kimia ini, boleh kita pisahkan ion-ion daripada garam terlarutkan seperti yang berikut:
BaCl2(ak) + Na2SO4(ak) ⎯→ BaSO4(p) + 2NaCl(ak) Ba2+ + 2Cl– + 2Na+ + SO
42– ⎯→ BaSO4(p) + 2Na+ + 2Cl–
(ak) (ak) (ak) (ak) (ak) (ak)
Perhatikan bahawa ion natrium, Na+ dan ion klorida, Cl– terdapat di kedua-dua belah persamaan. Ion-ion ini tidak mengambil bahagian dalam tindak balas dan boleh diabaikan.
Langkah-langkah menulis persamaan ion daripada persamaan kimia:
• Tulis persamaan kimia. • Tulis semua ion daripada
bahan dan hasil tindak balas yang hadir di dalam larutan akueus. • Abaikan ion-ion yang
tidak mengambil bahagian dalam tindak balas. Semua garam plumbum(II) kecuali plumbum(II) nitrat, Pb(NO3)2 dan plumbum(II) etanoat, Pb(CH3COO)2 ialah garam tak terlarutkan.
• Tidak balas pemendakan
Ciri-ciri fizik hablur
Semua hablur mempamerkan ciri-ciri yang tertentu. Apakah ciri-ciri tersebut? Mari kita jalankan Aktiviti 8.6 untuk mengetahuinya.
• Aktiviti 8.6, muka surat 117
BAB 8.indd 140
141
8.1
Menulis persamaan kimia dan persamaan ion
1. Tukarkan setiap persamaan perkataan yang berikut kepada persamaan kimia yang
seimbang.
(a) Asid sulfurik + zink ⎯→ zink sulfat + hidrogen
(b) Argentum nitrat + kalium iodida ⎯→ argentum iodida + kalium nitrat (c) Asid nitrik + kromium(III) hidroksida ⎯→ kromium(III) nitrat + air
2. Lengkapkan persamaan yang berikut:
(a) HCl(ak) + NiO(p) ⎯→
(b) HNO3(ak) + Ca(OH)2(ak) ⎯→ (c) H2SO4(ak) + MgCO3(p) ⎯→
3. Tulis persamaan ion bagi setiap tindak balas antara pasangan bahan yang berikut:
(a) Asid sulfurik, H2SO4 dan larutan barium hidroksida, Ba(OH)2
(b) Larutan ammonium klorida, NH4Cl dan larutan argentum nitrat, AgNO3 (c) Larutan plumbum(II) nitrat, Pb(NO3)2 dan larutan kuprum(II) sulfat, CuSO4 (d) Larutan ammonia, NH3 dan asid sulfurik, H2SO4
(e) Ferum(III) oksida, Fe2O3 dan asid hidroklorik, HCl
Penyediaan garam tertentu
Setelah mempelajari kaedah penyediaan garam, anda harus dapat menyediakan suatu garam yang tertentu. Mari kita jalankan Aktiviti 8.8 untuk menyediakan suatu garam yang tertentu di dalam makmal.
• Aktiviti 8.8, muka surat 120
Maka, persamaan dapat diringkaskan seperti yang berikut: Ba2+(ak) + SO
42–(ak) ⎯→ BaSO4(p)
Persamaan ini disebut persamaan ion bagi tindak balas pembentukan barium sulfat, BaSO4. Persamaan ion hanya menunjukkan ion-ion yang terlibat dalam tindak balas.
Anda boleh mendapatkan maklumat tambahan tentang kaedah perubahan berterusan daripada Internet. Gunakan kata kunci “continuous variation
method”.
Pembinaan persamaan ion melalui kaedah perubahan
berterusan
Kaedah perubahan berterusan digunakan untuk membina
persamaan ion bagi pembentukan garam tak terlarutkan. Kaedah ini melibatkan tindak balas antara larutan yang mengandungi ion A yang mempunyai isi padu malar dengan larutan yang mengandungi ion B yang isi padunya dimanipulasikan. Hal ini bertujuan untuk menentukan nisbah mol ion A yang bertindak balas lengkap dengan ion B. Jika x mol ion A bertindak balas dengan y mol ion B, maka formula empirik bagi garam tak terlarutkan ialah AxBy.
x(ion A) + y(ion B) ⎯→ AxBy Garam tak terlarutkan
BAB 8.indd 141
142
8.1
1 Hitung bilangan mol (NH4)3PO4. jisimn = —————
jisim molar
2 Tulis persamaan yang seimbang. 3 Bandingkan nisbah mol NH3 dan
(NH4)3PO4.
4 Hitung bilangan mol NH3 berdasarkan nisbah mol.
5 Hitung isi padu NH3. Isi padu = n × isi padu molar
Mari kita jalankan Eksperimen 8.2 untuk membina persamaan ion melalui kaedah perubahan berterusan.
• Eksperimen 8.2, muka surat 121
Ammonium fosfat, (NH4)3PO4 digunakan sebagai baja. 29.8 g garam ini disediakan melalui tindak balas peneutralan antara asid fosforik, H3PO4 dengan gas ammonia, NH3. Hitung isi padu gas ammonia, NH3 yang bertindak balas pada keadaan bilik.
[Jisim atom relatif: H = 1, N = 14, O = 16, P = 31. Isi padu molar: 24 dm3 mol–1 pada keadaan bilik.]
Penyelesaian:
Bilangan mol ammonium fosfat, (NH4)3PO4
29.8 g
= —–——————————————— [3(14) + 12(1) + 31 + 4(16)] g mol–1 = 0.20 mol
H3PO4(ak) + 3NH3(ak) ⎯→ (NH4)3PO4(ak)
3 mol 1 mol
Daripada persamaan kimia di atas, 3 mol gas ammonia, NH3 menghasilkan 1 mol ammonium fosfat, (NH4)3PO4.
Maka, bilangan mol gas ammonia, NH3 yang bertindak balas = 3 × 0.20 mol
= 0.60 mol
Isi padu gas ammonia, NH3 yang bertindak balas pada keadaan bilik = 0.60 mol × 24 dm3 mol–1
= 14.4 dm3 Gunakan pekali stoikiometri daripada persamaan yang seimbang untuk membandingkan nisbah mol bahan dan hasil tindak balas dalam sesuatu tindak balas.
Penghitungan melibatkan persamaan stoikiometri
Persamaan yang seimbang bagi tindak balas dalam penyediaan garam boleh digunakan untuk menghitung kuantiti bagi bahan yang berikut:
• Jisim bahan tindak balas
• Isi padu dan kepekatan bahan tindak balas • Jisim hasil tindak balas
• Isi padu dan kepekatan hasil tindak balas Mari kita kaji contoh yang berikut.
BAB 8.indd 142
143
8.2
1 Hitung bilangan mol AgNO3. n = MV
2 Hitung bilangan mol KI. n = MV
3 Tulis persamaan kimia yang seimbang. 4 Bandingkan nisbah mol antara AgNO3,
KI dengan AgI.
5 Tentukan bilangan mol AgI yang terbentuk.
6 Hitung jisim AgI. Jisim = n × jisim molar
Garam argentum seperti argentum iodida, AgI digunakan dalam fotografi . Suatu sampel argentum iodida, AgI disediakan dengan mencampurkan 50 cm3 larutan argentum nitrat, AgNO3 1.0 mol dm–3 dan 50 cm3 larutan kalium iodida, KI 1.0 mol dm–3. Hitung jisim argentum iodida, AgI yang terbentuk. [Jisim atom relatif: Ag = 108, I = 127]
Penyelesaian:
Bilangan mol larutan argentum nitrat, AgNO3 = 1.0 mol dm–3 × 0.05 dm3
= 0.050 mol
Bilangan mol larutan kalium iodida, KI = 1.0 mol dm–3 × 0.05 dm3
= 0.050 mol
AgNO3(ak) + KI(ak) ⎯→ AgI(p) + KNO3(ak)
1 mol 1 mol 1 mol
Daripada persamaan di atas, 1 mol argentum nitrat, AgNO3 bertindak balas dengan 1 mol kalium iodida, KI untuk menghasilkan 1 mol argentum iodida, AgI.
Maka, 0.050 mol argentum nitrat, AgNO3 bertindak balas dengan 0.050 mol kalium iodida, KI untuk menghasilkan 0.050 mol argentum
iodida, AgI.
Jisim argentum iodida, AgI yang terhasil = 0.050 mol × (108 + 127) g mol–1 = 11.75 g
8.2
Menyelesaikan masalah penghitungan
1. Seorang pelajar menyediakan kuprum(II) nitrat, Cu(NO3)2 melalui tindak balas antara kuprum(II) oksida, CuO dengan 100 cm3 asid nitrik, HNO
3 1.5 mol dm-3. Hitung jisim kuprum(II) oksida, CuO yang diperlukan untuk bertindak balas lengkap dengan asid nitrik. [Jisim atom relatif: O = 16, Cu = 64]
2. Rajah 8.3 menunjukkan penyediaan suatu garam tak terlarutkan plumbum(II) sulfat,
PbSO4. Asid sulfurik, H2SO4 1.5 mol dm–3 50 cm3 larutan plumbum(II) nitrat, Pb(NO3)2 1.0 mol dm–3 + Mendakan putih Rajah 8.3
(a) Hitung isi padu asid sulfurik, H2SO4 yang diperlukan untuk bertindak balas lengkap dengan larutan plumbum(II) nitrat, Pb(NO3)2.
(b) Hitung jisim plumbum(II) sulfat, PbSO4 yang terbentuk. [Jisim atom relatif: O = 16, S = 32, Pb = 207]
BAB 8.indd 143
144
Mari kita jalankan aktiviti yang berikut. • Aktiviti KBSB 8.1, muka surat 124
A
1. Nyatakan tiga contoh bagi
(a) garam terlarutkan (b) garam tak terlarutkan
2. 50 cm3 larutan argentum nitrat, AgNO
3 1.0 mol dm–3 bertindak balas lengkap dengan larutan magnesium klorida, MgCl2 untuk membentuk garam argentum tak terlarutkan. (a) Tulis persamaan kimia dan persamaan ion bagi pembentukan garam argentum itu. (b) Hitung jisim garam argentum yang termendak.
[Jisim atom relatif: Cl = 35.5, Ag = 108]
3. Asid bertindak balas dengan kalsium karbonat, CaCO3 dalam batu kapur untuk membentuk garam dan karbon dioksida, CO2. Seketul batu kapur bertindak balas lengkap dengan 100 cm3 asid nitrik, HNO
3 31.5 g dm–3. [Jisim atom relatif: H = 1, C = 12, N = 14, O = 16, Ca = 40. Isi padu molar = 24 dm3 mol-1 pada keadaan bilik.]
(a) Hitung jisim garam yang terhasil.
(b) Berapakah isi padu karbon dioksida, CO2 yang terbebas pada keadaan bilik?
B
Analisis Kualitatif Garam
Rajah 8.4 Contoh analisis kualitatif memainkan peranan penting dalam kehidupan
harian kita.
Berdasarkan artikel dalam Rajah 8.4, pihak berkuasa perlu mendapatkan bukti untuk mendakwa pesalah. Namun, jenis bahan kimia dan tahap ketoksikannya perlu dikenal pasti terlebih dahulu.
Anda harus dapat: • menyatakan maksud
analisis kualitatif
• membuat inferens tentang garam berdasarkan warna dan keterlarutan di dalam
air
• memerihalkan ujian untuk mengenal pasti gas • menghuraikan tindakan
haba ke atas garam • menghuraikan ujian bagi
anion
• menyatakan pemerhatian bagi tindak balas antara kation dengan larutan natrium hidroksida dan larutan ammonia • menghuraikan ujian
pengesahan bagi kation Fe2+, Fe3+, Pb2+, dan NH4+
• merancang analisis kualitatif untuk mengenal pasti garam
PULAU PINANG, Selasa - Kesihatan ribuan penduduk di negeri ini dikhuatiri terjejas akibat sumber air dari Sungai Muda dicemari sisa toksik yang dibuang oleh kilang-kilang di Taman Kempas, Sungai Petani, Kedah. Penduduk di empat buah kampung yang berhampiran dengan kawasan perindustrian tersebut turut terancam.
Menurut S.M. Mohamed, pelbagai jenis ikan boleh didapati di dalam saliran itu tetapi sekarang telah pupus dan menyebabkan penduduk kampung-kampung tersebut hilang sumber pendapatan. Selain itu, hasil pengeluaran beratus-ratus hektar sawah padi yang menggunakan air tercemar berkenaan mungkin merosot pada masa hadapan jika ancaman sisa toksik berterusan. Sehubungan itu, beliau meminta Jabatan Alam Sekitar Kedah dan Majlis Perbandaran Sungai Petani mengambil tindakan tegas terhadap pengusaha kilang yang melakukan kesalahan tersebut.
Dipetik dan diubah suai daripada Utusan Melayu, 13 April 2011
Pulau Pinang diancam air beracun?
BAB 8.indd 144
145
Analisis kualitatif ialah teknik yang digunakan untuk
mengenal pasti jenis kation dan anion yang hadir dalam sesuatu bahan. Dalam analisis kualitatif garam, kita perlu mengenal pasti ion-ion yang terdapat di dalam garam. Hal ini dapat dilakukan dengan menganalisis sifat fi zik dan sifat kimia garam itu. Rajah 8.5 menunjukkan prosedur am yang terlibat dalam analisis kualitatif garam.
Pemerhatian terhadap sifat fizik garam
Sifat fi zik garam seperti warna dan keterlarutan di dalam air dapat membantu kita membuat inferens tentang jenis kation dan anion yang hadir di dalam garam. Langkah ini dapat mengehadkan kemungkinan jenis kation dan anion yang hadir di dalam sesuatu garam. Mari kita jalankan Aktiviti 8.9 untuk mengkaji warna dan keterlarutan pelbagai garam di dalam air.
• Aktiviti 8.9, muka surat 124
Ujian gas
Gas biasanya dibebaskan dalam sesuatu tindak balas apabila ujian makmal dijalankan terhadap garam. Dengan mengenal pasti gas yang terbebas, kita dapat membuat inferens tentang jenis kation atau anion yang hadir di dalam garam. Mari kita jalankan Aktiviti 8.10 untuk melakukan beberapa ujian kimia dan mengenal pasti gas-gas yang terbebas.
• Aktiviti 8.10, muka surat 126
Tindakan haba terhadap garam
Apabila sesuatu garam dipanaskan, garam itu akan terurai. Penguraian ini mungkin diiringi dengan perubahan warna atau pembebasan gas atau wap air. Dengan mengenal pasti gas yang terbebas, kita dapat menentukan anion yang hadir di dalam garam. Pemeriksaan terhadap baki pula dapat memberitahu kita tentang jenis kation di dalam garam. Mari kita jalankan Aktiviti 8.11 untuk mengkaji tindakan haba terhadap garam karbonat dan nitrat.
• Aktiviti 8.11, muka surat 129
Tonton simulasi komputer yang menunjukkan ujian untuk mengenal pasti gas-gas yang terbebas.
Natrium nitrat, NaNO3 terurai apabila dipanaskan untuk menghasilkan natrium nitrit, NaNO2 yang digunakan dalam industri makanan sebagai bahan pengawet bagi makanan daging.
8.3
Menonton simulasi komputer
Tonton simulasi komputer yang menerangkan tindakan haba terhadap garam karbonat, nitrat, sulfat, dan klorida. Kemudian, bina jadual atau carta untuk merumuskan tindakan haba terhadap garam secara berkumpulan.
Pemerhatian ke atas sifat fi zik garam
Tindakan haba ke atas garam
Ujian kation dan anion
Ujian pengesahan kation dan anion
Rajah 8.5 Analisis kualitatif
garam
BAB 8.indd 145
146
Ujian anion
Pelbagai ujian boleh dijalankan untuk mengenal pasti jenis anion dalam larutan garam akueus. Mari kita jalankan Aktiviti 8.12 untuk menguji kehadiran anion dalam larutan garam akueus.
• Aktiviti 8.12, muka surat 132
Ujian kation
Kehadiran kation dapat diuji dengan menggunakan larutan natrium hidroksida, NaOH dan larutan ammonia, NH3. Kedua-dua alkali ini membekalkan ion hidroksida, OH– untuk bergabung dengan ion logam bagi membentuk hidroksida logam. Warna hidroksida logam dan keterlarutannya di dalam alkali berlebihan boleh digunakan untuk mengenal pasti jenis kation yang hadir. Mari kita jalankan Aktiviti 8.13 untuk menguji kehadiran kation dalam larutan garam akueus.
• Aktiviti 8.13, muka surat 134
Ujian pengesahan ion Fe
2+, Fe
3+, Pb
2+, dan NH
4+Kita dapat mengenal pasti kehadiran ion ferum(II), Fe2+, ion ferum(III), Fe3+, ion plumbum(II), Pb2+, dan ion ammonium, NH4+ melalui ujian pengesahan yang tertentu. Mari kita jalankan Aktiviti 8.14 untuk mengenal pasti kehadiran empat kation ini dalam larutan garam akueus.
• Aktiviti 8.14, muka surat 137
Walaupun anda telah memperoleh pengetahuan untuk menjalankan analisis kualitatif terhadap garam yang tidak diketahui, anda perlu merancang ujian yang hendak dilakukan dengan teliti sebelum memulakan eksperimen. Anda harus menentukan radas, bahan kimia, teknik yang betul, dan langkah-langkah keselamatan yang perlu dipatuhi.
Apabila menjalankan ujian, anda perlu mengamalkan sikap sistematik dan teliti. Amalan yang baik dan teknik-teknik yang betul akan membantu anda mengelakkan kemalangan dan membolehkan anda mendapat keputusan yang tepat dan konsisten. Mari kita jalankan Aktiviti 8.15 untuk mengenal pasti kation dan anion dalam garam-garam yang tidak diketahui.
• Aktiviti 8.15, muka surat 139 Salts
Kita harus mengamalkan sikap sistematik, tekal, analitis, teliti, dan jujur semasa menjalankan semua aktiviti. Barium klorida, BaCl2 dan asid hidroklorik, HCl cair digunakan untuk mengesahkan kehadiran ion sulfat, SO42– dalam larutan garam. Walau bagaimanapun, dua bahan uji ini boleh digantikan dengan larutan barium nitrat, Ba(NO3)2 dan asid nitrik, HNO3 cair. Kedua-dua garam, iaitu barium klorida, BaCl2 dan barium nitrat, Ba(NO3)2 merupakan garam terlarutkan dan menghasilkan ion barium, Ba2+ di dalam air. Ion barium, Ba2+ bergabung dengan ion sulfat, SO42– untuk membentuk mendakan putih barium sulfat, BaSO4.
BAB 8.indd 146
147
Garam
✓ Garam ialah sebatian yang terbentuk apabila ion hidrogen, H+ daripada asid digantikan oleh ion logam atau ion
ammonium, NH4+.
✓ Garam digunakan dalam pelbagai bidang dan kehidupan harian kita.
✓ Garam terlarutkan disediakan melalui tindak balas antara
• asid dengan alkali • asid dengan logam • asid dengan oksida logam • asid dengan karbonat logam
✓ Garam terlarutkan ditulenkan melalui kaedah penghabluran semula.
✓ Garam tak terlarutkan disediakan melalui tindak balas pemendakan. ✓ Hablur mempunyai bentuk geometri yang
tetap, permukaan yang rata, sisi yang lurus, dan bucu yang tajam.
Analisis kualitatif garam
✓ Analisis kualitatif ialah teknik yang digunakan untuk mengenal pasti jenis kation dan anion yang hadir di dalam sesuatu bahan.
✓ Prosedur am dalam menganalisis kualitatif garam ialah:
• pemerhatian terhadap sifat fi zik garam • tindakan haba terhadap garam
• ujian kation dan anion
• ujian pengesahan kation dan anion ✓ Pelbagai jenis ujian digunakan untuk
mengenal pasti kation dan anion yang hadir di dalam garam.
✓ Ujian dijalankan terhadap garam • selepas perancangan yang teliti
• dengan mengikut teknik-teknik yang betul dan mematuhi semua langkah keselamatan
✓ Selepas membuat pemerhatian, data perlu dianalisis secara sistematik.
B
1. Kenal pasti gas yang menukarkan warna kertas litmus merah lembap kepada biru. 2. Satu sampel kuprum(II) nitrat, Cu(NO3)2 telah dipanaskan dengan kuat. Nyatakan
pemerhatian yang diramalkan.
3. Satu larutan garam yang tidak berwarna diuji dengan barium nitrat, Ba(NO3)2. Mendakan putih terbentuk. Apakah anion yang hadir dalam larutan garam itu?
4. Larutan ammonia, NH3 dicampurkan kepada satu larutan garam hijau sehingga tiada perubahan berlaku. Suatu mendakan hijau terhasil. Namakan kation yang hadir dalam mendakan hijau.
5. Huraikan secara ringkas ujian yang akan anda jalankan untuk mengenal pasti kehadiran
ion plumbum(II) dalam larutan garam akueus.
6. Keputusan yang berikut diperoleh apabila beberapa ujian dijalankan terhadap larutan
garam Y akueus.
• Mendakan putih yang terbentuk larut dalam larutan ammonia, NH3 berlebihan • Mendakan putih terhasil dalam larutan argentum nitrat, AgNO3
Kenal pasti garam Y.
147
BAB 8.indd 147
148148
Persamaan kimia
(a) Nyatakan empat ciri fi zik sesuatu hablur garam.
(b) Nyatakan empat tindak balas yang terlibat dalam penyediaan garam terlarutkan. (c) Namakan tindak balas yang terlibat dalam penyediaan garam tak terlarutkan. (d) Nyatakan gas yang membentuk mendakan putih dengan air kapur.
(e) Namakan ion yang dapat dikenal pasti dengan menggunakan larutan barium klorida, BaCl2 dan asid hidroklorik, HCl.
(f) Namakan ion yang membentuk larutan biru apabila dilarutkan di dalam air. Garam Sifat Penghitungan stoikiometri Analisis kualitatif Ciri-ciri fi zik hablur Tindakan haba Terurai kepada oksida logam dan gas-gas Keterlarutan di dalam air Garam terlarutkan Garam tak terlarutkan (a) Penyediaan Penyediaan Ujian gas Ujian kation HCl NH3 O2 NO2 SO2 Cl2 H2 (d) Al3+ Ca2+ NH4+ Fe3+ Zn2+ Pb2+ Mg2+ (f ) Fe2+ (b) (c) NO3 – CO32– Cl– (e) Ujian anion
Salin peta konsep di bawah. Kemudian, lengkapkan peta ini berdasarkan panduan yang diberi.
Kegunaan harian Persamaan ion BAB 8.indd 148 BAB 8.indd 148 9/21/11 3:39 PM9/21/11 3:39 PM
149
8
4. Natrium klorida dan natrium sulfat dapat dikenal pasti dengan menggunakan
A asid nitrik cair B larutan kalium iodida C larutan plumbum(II) nitrat D larutan barium nitrat
5. Gas X mempunyai sifat yang berikut: • Tidak berwarna
• Berwasap dalam udara lembap • Meneutralkan natrium hidroksida • Menghasilkan mendakan putih
apabila dialirkan ke dalam larutan argentum nitrat berasid
Apakah gas X?
A Ammonia B Klorin
C Karbon dioksida D Hidrogen klorida
6. Rajah 2 menunjukkan pembentukan
mendakan putih apabila dua larutan, P dan Q dicampurkan. Larutan P (biru) Larutan Q (tidak berwarna) Mendakan putih + Rajah 2 Apakah P dan Q?
I Argentum nitrat dan natrium
klorida
II Ferum(III) klorida dan kalium
karbonat
III Kuprum(II) sulfat dan barium
nitrat
IV Kuprum(II) klorida dan ammonium
karbonat
A I C I, III dan IV
B III D I, II, III dan IV Soalan Objektif
Arahan: Pilih satu cadangan jawapan yang
terbaik bagi setiap soalan.
1. Yang berikut yang manakah merupakan garam terlarutkan?
A Barium sulfat B Kalium karbonat C Plumbum(II) klorida D Kalsium sulfat
2. Rajah 1 menunjukkan kaedah untuk menyediakan garam plumbum(II) melalui tindak balas pemendakan.
Mendakan putih Kacau Larutan X Larutan plumbum(II) nitrat Rajah 1 Apakah larutan X? I Asid hidroklorik II Ammonium sulfat III Natrium karbonat IV Kalium iodida A I dan IV B II dan III C I, II dan III D I, II, III dan IV
3. Satu garam disediakan melalui tindak
balas asid dengan logam reaktif. Berapakah jisim magnesium klorida yang terbentuk apabila serbuk magnesium berlebihan dicampurkan kepada 50 cm3 asid hidroklorik 2.0 mol dm–3?
[Jisim atom relatif: Mg, 24; Cl, 35.5]
A 4.75 g C 11.9 g
B 9.50 g D 19.0 g
149
BAB 8.indd 149
150 Soalan Subjektif
Arahan: Jawab semua soalan. Langkah-langkah penghitungan perlu ditunjukkan. 1. Rajah 1 menunjukkan beberapa tindak balas garam X.
Garam X Panaskan Gas P + Gas Q
Air
Larutan natrium hidroksida Larutan X akueus Panaskan Reagen Nessler Larutan argentum nitrat
Mendakan perang Mendakan putih Larutan argentum nitrat Rajah 1
(a) (i) Namakan mendakan putih yang terbentuk.
(ii) Tulis persamaan ion bagi pembentukan mendakan putih tersebut. (iii) Kenal pasti anion di dalam garam X.
(b) (i) Apakah fungsi reagen Nessler?
(ii) Berikan formula kation di dalam garam X. (c) Namakan gas P dan Q.
(d) (i) Namakan garam X.
(ii) Tulis persamaan bagi tindakan haba ke atas garam X.
(e) Hitung isi padu gas Q yang terbebas pada keadaan bilik jika 10.7 g garam X dipanaskan. [Jisim atom relatif: H = 1, N = 14, Cl = 35.5. Isi padu molar = 24 dm3 mol–1 pada keadaan bilik.]
Soalan Esei
Arahan: Jawab semua soalan.
1. Garam ammonium biasa digunakan oleh petani sebagai baja untuk meningkatkan hasil
tanaman mereka. Garam ammonium ini mudah disediakan di dalam makmal. Salah satu contoh garam ini ialah ammonium sulfat.
(a) Terangkan maksud garam.
(b) Anda dibekalkan dengan bahan dan radas yang berikut:
• Larutan ammonia • Mangkuk penyejat • Penunu Bunsen • Asid sulfurik cair • Penitis dan rod kaca • Silinder penyukat Huraikan satu eksperimen untuk menyediakan satu sampel ammonium sulfat tulen dengan menggunakan bahan dan radas tersebut.
(c) Huraikan ujian-ujian yang akan anda jalankan untuk mengenal pasti anion dan kation di dalam ammonium sulfat.
2. Anda dikehendaki menjalankan suatu aktiviti makmal untuk menyediakan garam dengan
memilih satu contoh logam. Dengan bantuan rajah yang sesuai dan persamaan ion, huraikan kaedah penyediaan garam tersebut.
150
BAB 8.indd 150