STRUKTUR PROTEIN
Dr. MUTIARA INDAH SARI
NIP: 132 296 973
DAFTAR ISI
I . PENDAHULUAN…….……….………...………..…….….……1
II. IKATAN PEPTIDA PADA PROTEIN …….……..…...……...…..……….….…1
III. URUTAN ASAM AMINO DITENTUKAN OLEH GEN...…...….…7
IV. TINGKAT STRUKTUR PROTEIN...………..………….…..…...8
IV.1. STRUKTUR PRIMER... ……….……...….…...….….9
IV.2. STRUKTUR SKUNDER………..………….…..……….9
IV.3. STRUKTUR TERSIER………...………….14
IV.4. STRUKTUR KUARTERNER…….……….…..………...…..15
V. KESIMPULAN………..…….16
STRUKTUR PROTEIN
I. PENDAHULUAN
Semua protein pada semua spesies mulai dari bakteri sampai manusia dibentuk dari 20 asam amino yang sama dan tidak berubah selama evolusi. Keaneka ragaman fungsi yang diperantarai oleh protein dimungkinkan oleh keanekaragaman susunan yang mungkin dapat dari 20 jenis asam amino ini sebagai unsur pembangun.1
Pada protein terdapat empat tingkat struktur yang berbeda yaitu : Struktur primer, struktur skunder, struktur tersier, struktur kuartener. Terdapat faktor yang dapat mengkuatkan yang menstabilkan struktur skunder, tersier dan kuartener ini. Sifat umum semua protein mencakup hambatan pada konformasi atau susunan spasialnya oleh ikatan kovalen dan nonkovalen.2.3
II. IKATAN PEPTIDA PADA PROTEIN
ASAM AMINO PEMBENTUK MOLEKUL PROTEIN
Asam amino merupakan unit dasar struktur protein. Suatu asam amino α terdiri dari gugus amino, gugus karboksil, atom H dan gugus R tertentu yang semuanya terikat pada
atom karbon α. Atom karbon ini disebut α karena bersebelahan dengan gugus karboksil (asam).Gugus R menyatakan rantai samping 1,4
Susunan tetrahedral dari empat gugus yang berbeda terhadap atom karbon α menyebabkan asam amino mempunyai aktivitas optik. Dua bentuk bayangan cermin disebut isomer L dan isomer D. Protein hanya terdiri dari asam amino L. Sehingga tanda isomer optik dapat diabaikan. Daalm pembahasan protein selanjutnya asam amino yang dimaksud adalah isomer L, kecuali bila ada penjelasan. 1
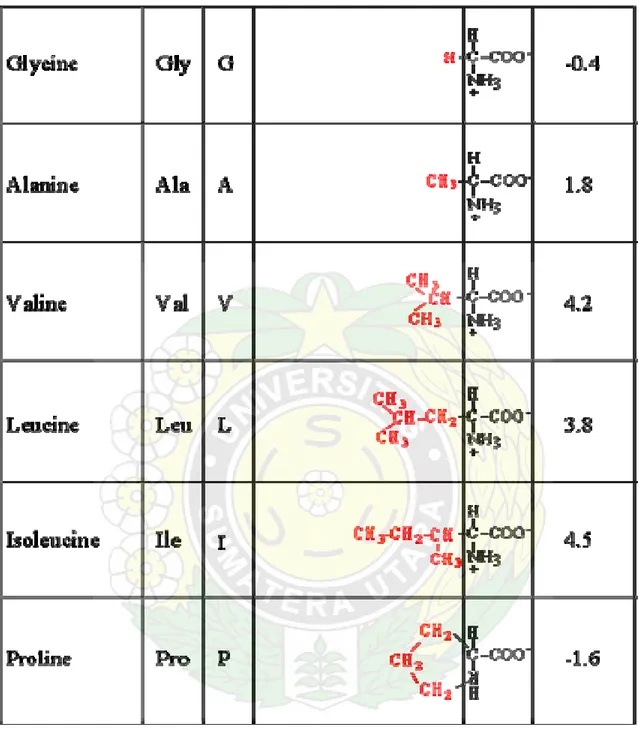
Umunya pada protein ditemukan 20 jenis rantai samping yang bervariasi dalam ukuran, bentuk. Contohnya asam amino yang paling sederhana adalah glisin, hanya mempunyai satu rantai hidrogen sebagai rantai samping. Asam amino alanin, dengan gugus metil sebagai rantai samping 1
Tabel 1. Names, symbols, chemical structures and hydrophobicity indices of the 20 amino acids found in proteins. They are arranged in the order as discussed above.
Note: The hydrophobicity index tells the relative hydrophobicity among amino acids. More
values. In a protein, hydrophobic amino acids are more likely to be located in the protein interior, whereas hydrophilic amino acids are more likely to face the aqueous environment.
ASAM AMINO BERIKATAN MELALUI IKATAN PEPTIDA
Pada protein, gugus karboksil α asam amino terikat pada gugus amino α asam amino lain dengan ikatan peptida/ ikatan amida secara kovalen membentuk rantai polipeptida Pada pembentukan suatu dipeptida pada dari dua asam amino terjadi pengeluaran satu molekul air.1,3,4
Ikatan peptida sangat stabil dan hidrolisis kimia memerlukan kondisi yang snagt ekstrim. Dalam tubuh, ikatan peptida diuraikan oleh enzim proteolitik yang disebut protease atau peptidase 3
Banyak asam amino berikatan melalui ikatan peptida membentuk rantai polipeptida yang tidak bercabang. Asam Amino di dalam suatu protein disebut residu asam amino. Residu asam amino pada salah satu ujung rantai memiliki sebuah gugus amino bebas dan pada rantai yang lain memiliki gugus karboksil bebas. Berdasarkan kesepakatan, ujung amino diletakkan pada awal rantai polipeptida, 1,3
Gambar. 1. Formation of the peptide bond by condensation reaction.
III. URUTAN ASAM AMINO PROTEIN DITENTUKAN OLEH
GEN
Pada tahun 1953, Frederick Sanger menentukan urutan asama mino insulin, suatu hormon protein. Ini merupakan pertama kali diperlihatkan bahwa protein mempunyai urutan asam amino yang tepat. Diperlihatkan juga bahwa bahwa insulin terdiri hanya dari asam amino L yang saling berhubungan melalui ikatan peptida antara gugus amino α dan gugus karboksil α. 1
Rangkaian penelitian pada akhir tahun 1950 an dan awal 1960 an mengungkapkan bahwa urutan asam amino dalam protin ditentukan secara genetik. Urutan nuklotida dalam DNA, suatu molekul herediter, menentukana urutan nukleotida komplementer dalam RNA, yang akhirnya menentukan urutan asam amino dalam suatu protein. Tiap rangkaian 20 asam amino disandi oleh satu atau lebih urutan tiga nukleotida tertentu 1
Perubahan urutan asam amino dapat mengakibatkan gangguan fungsi protein dan menimbulkan penyakit. Penyakit yang bersifat fatal seperti anemia sel sabit dan fibrosis kistik disebabkan oleh perubahan satu asam amino dalam satu protein 1
3
Amino Acid Codons
alanine GCA, GCC, GCG GCU
arginine AGA, AGG, CGA CGC, CGG, CGU
asparagine AAC, AAU
aspartate GAC, GAU
cysteine UGC, UGU
glutamate GAA, GAG
glutamine CAA, CAG
glycine GGA, GGC, GGG GGU
histidine CAC, CAU
isoleucine AUA, AUC, AUU
leucine CUA, CUC, CUG CUU, UUA, UUG
methionine AUG
tryptophan UGG
phenylalanine UUC, UUU
proline CCA, CCC CCG, CCU
serine UCA, UCC UCG, UCU AGC, AGU
threonine ACA, ACC ACG, ACU
lysine AAA, AAG
tyrosine UAU, UAC
valine GUA, GUC GUG, GUU
Gambar 2. Struktur Protein IV.1. STRUKTUR PRIMER
Struktur primer suatu protein semata adalah urutan linear asam aminoyang disatukan oleh ikaatn peptida yang mencakup lokasi setiap iakatn disulfida. Tidak terjadi percabangan rantai.2,3,4
Jumlah rangkaian protein yang diketahui sedemikian besarnya dan terus bertambah dengan cepat sehingga data rangkaian tersebut tidak mungkin dicatat dalam bentuk cetakan tetapi kini disimpan di dlam database elektronik rangkaian protein yang bisa diakses lewat Internet 2
IV. 2. STRUKTUR SKUNDER
Daerah di dalam rantai peptida dapat membentuk struktur reguler, berulang, dan lokal yang tejadi yang terjadi akibat adanya ikatan hidrogen antara atom-atom ikatan peptida Ini berhubungan dengan dengan pengaturan kedudukan ruang residu asamamino yang berdekatan dengan urutan linear. Daerah tersebut yang terkenal dengan struktur skunder mencakup α heliks, β sheet, loop.1,2,3
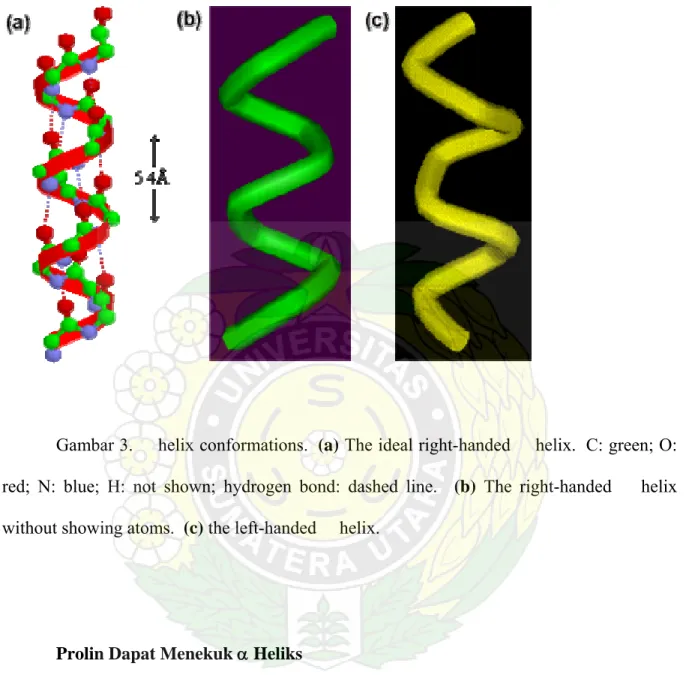
α HELIKS
Pada suatu α heliks, terbentuk ikatan hidrogen antara masing-masing atom oksigen karbonil pada suatu ikatan peptida dengan hidrogen yang melekat ke atom nitrogen amida pada suatu ikatan peptida 4 residu asam amino di sepanjang rantai polipeptida.
Jika tulang punggung polipeptida ini terpilin dengan jumlah yang sama akan terbentuk struktur coil atau heliks (ulir) reguler di mana masing-masing ikatan peptida dihubungkan dengan ikatan hidrogen ke ikatan residu asam amino di depannya dan 4 asam amino dibelakangnya dalam urutan primer.2,3
Gambar 3. helix conformations. (a) The ideal right-handed helix. C: green; O: red; N: blue; H: not shown; hydrogen bond: dashed line. (b) The right-handed helix without showing atoms. (c) the left-handed helix.
Prolin Dapat Menekuk α Heliks
Rantai sisi residu asam amino pada heliks mengarah ke luar dari sumbu sentral .Rantai sisi yang berukuran besar atau rantai yang sisi dengan muatan yang saling tolak menolak dapat mencegah terbentuknya α heliks. Residu prolin menghambat struktur α heliks pada protein karena residu prolin menimbulkan hambatan geometrik akibat adanya struktur cincin dan karena pada ikatan peptida ,nitrogen tidak mengandung atom hidrogen yang diperlukan untuk membentuk ikatan hidrogen Prolin hanya pas untuk putaran pertama α
heliks. Pada bagin lain, residu prolin akan menimbulkan tekukan (bend). Namun tidak semua tekukan dalam α heliks disebabkan prolin. Tekukan kerap terjadi pula pada residu Gly.2,3
Ikatan Hidrogen dan Kekuatan Van Der Waals Menstabilkan α heliks
Mengingat α heliks memiliki energi yang paling rendah dan merupakan konformasi yang paling stabil bagi rantai polipeptida, susunan spasial ini akan terbentuk secara spontan. Stabilitas α heliks terutama terjadi akibat pembentukan ikatan hidrogen dengan jumlah semaksimal mungkin. Nitrogen peptida bekerja sebagai sebagai donor hidrogen,dan oksigen karbonil residu yang dalam barisan letaknya nomer empat dari belakang di dalam pengertian struktur primer bekerja sebagai aseptor hidrogen Interaksi Van der Waals juga memberikan stabilitas tambahan. Atom yang dikemas kuat pada initi α heliks mengadakan kontak van der Waals antara satu sama lain melintasi sumbu heliks tersebut2,4,5
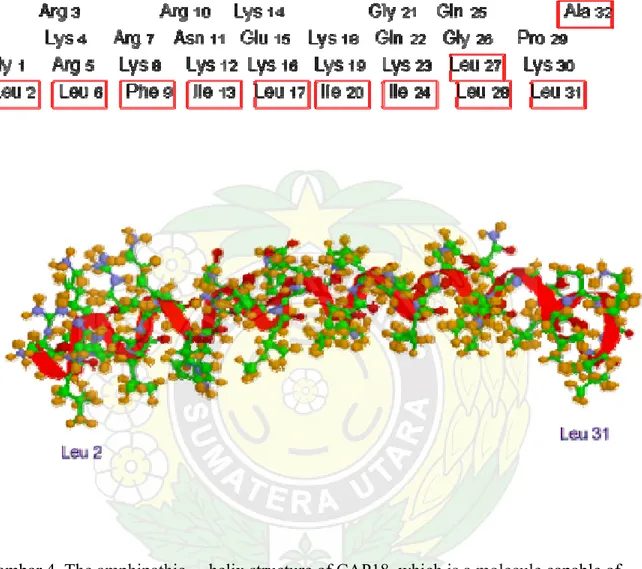
α Heliks Dapat Bersifat Amfipatik
Gambar 4. The amphipathic helix structure of CAP18, which is a molecule capable of binding to the endotoxin of bacteria. (a) Amino acid sequence of the amphipathic part of CAP18. Hydrophobic residues are boxed with red lines. (b) The 3D structure determined by nuclear magnetic resonance. Hydrophobic residues are located on the lower side. PDB ID = 1LYP.
Konformasi reguler yang kedua terdaapt pada lembaran yang terlipat struktur β atau β pleated sheet. Simbol β menunjukkan bahwa struktur ini merupakan struktur reguler kedua yang dijelaskan.. Istilah lembaran terlipat (pleated sheet) menunjukkan penampakkan stuktur tersebut kalau dilihat dari pinggir atas.1,2
Berbeda dengan kumparan α heliks, β sheet terbentuk melalui ikatan hidrogen antara daerah linier rantai polipeptida . Ikatan hidrogen ini terjadi antara oksigen karboil dari satu ikatn peptida dan nitogen dari ikatan peptida lainnya. Ikatan hidrogen dapat terbentuk antara dua ranati polipeptida yang terpisah atau antara anatara dua daerah pada sebuah rantai tunggal yang melipat sendiri. Pelipatan ini sering melibatkan sering melibatkan 4 struktur asam amino yang dikenal sebagai β turn. 2,3
IV. 3. STRUKTUR TERSIER
Struktur tersier menggambarkan pengaturan ruang residu asama mino yang berjauhan dalam urutan linier dan pola ikatan-ikatan disulfida. 1. Merupakan konformasi tiga dimensi
keseluruhannya. Istilah Struktur tersier mengacu pada hubungan spasial antar unsur struktur skunder . pelipatan polipeptida pada suatu domain biasanya terjadi tanpa tergantung pada pelipatan domain lainnya. Stuktur tersier menjelaskan hubungan antara domain ini , cara dimana pelipatan protein dapat menyatukan asam amino yang letaknya terpisah dalam pengertian struktur primer, dan ikatan yang menstabilkan konformasi ini.2,4
Bentuk protein globular melibatkan interaksi antara residu asam amino yang mungkin terletak sangat jauh satu sama lain pada urutan primer ranati polipeptida dan melibatkan α heliks dan β sheet .Interaksi nonkovalen antara rantai sisi residu asam amino penting untuk menstabilkan struktur tersier dan terdiri dari interaksi hidrofobik dan elektrostatik serta ikatan hidrogen2,3,5
Interaksi hidrofobik sangat penting bagi struktur protein. Asam amino hidrofobik cenderung berikaatn dibagian dalam protein protein globuler tempat asam amino tidak berkontak denagn air, sedang asam amino hidrofilik biasanya terletak di permukaan protein tempat asam amino berinteraksi dengan air sekelilingnya.3
Menggambarkan pengaturan subunit protein dalam ruang.1
Protein dengan dua atau
lebih rantai polipeptida yang terikat oleh kekuatan nonkovalenakan memperlihatkan struktur kovalen. Dalam protein multimerik ini, maing-masing rantai polipeptida disebut protomer atau subunit. 2
Subunit tersebut disatukan oleh jenis interaksi nonkovalen yang sama yang
berperan dalam stuktur tersier yaitu interaksi elektrostatik dan hidrofobik serta ikatn hidrogen. Protein yang tersusun dari dua atau empat subunit masing-masing disebut protein dimerik atau tetramerik2,3,5
V. KESIMPULAN
Berbagai protein yang berbeda dapat diciptakan dari hanya 20 asam amino yang umum, karena asam amino dapat saling berikatan dalam banyak kombinasi yang berbeda.
stuktur primer. Struktur skunder menjelaskan menjelaskan pelipatan rantai polipeptida menjadi multiplikasi motif terikat terikat hidrogen seperi struktur α heliks, β sheet. Struktur tersier berkenaan dengan hubungan antar domain struktural skunder dan antar residu yang letaknya terpisah jauh dalam pengertian struktur primer. Struktur kuartener yang hanya terdapat dalam protein dengan dua atau tiga rantai polipeptida (protein oligomerik) menjelaskan titik kontak dan hubungan lainnya antara polipeptida atau subunit ini
DAFTAR KEPUSTAKAAN
1. Stryer Lubert. Biochemistry 4th .EGC.2000. 17-37
2. Murray R K, et al. Harper’s Biochemistry 25th ed. Appleton & Lange. America
2000 : 48-62
3. Mark Dawn B, PhD, Marks Allan MD, Smith Collen M, PhD. Biokimia Kedokteran Dasar, Sebuah Pendekatan Klinis , 2000 : 76-95
4. Champe Pamela C , Harvey Richard A. Lippincott’s Illustrated. Biochemistry, 2nd
5. Satyanarayana U,Dr. Biochemistry. Books And Allied (P) Ltd, Calcutta. 2002. 45-71