IDENTIFIKASI MUTASI GEN BONE MORPHOGENETIC PROTEIN
RECEPTOR IB (BMPR-IB) DAN GEN BONE MORPHOGENETIC
PROTEIN 15 (BMP15) TERHADAP PROLIFIKASI PADA DOMBA
GARUT GALUR SUBUR
NUR AZIFAH CAKRA DEWI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2009
ABSTRAK
NUR AZIFAH CAKRA DEWI. Identifikasi Mutasi Gen Bone Morphogenetic
Protein Receptor IB (BMPR-IB) dan Gen Bone Morphogenetic Protein 15
(BMP15) terhadap Prolifikasi pada Domba Garut Galur Subur. Dibimbing oleh
ACHMAD FARAJALLAH dan CECE SUMANTRI.
Domba garut merupakan domba yang memiliki sifat prolifik. Sekumpulan
faktor pertumbuhan yang bekerja pada oosit dan sel-sel folikel ovarium
dikelompokkan sebagai oocyted-derived growth factor (ODGF) yang kemudian
dikenal sebagai Tansforming Growth Factor β (TGFβ). Tiga faktor anggota TGFβ
yang dianggap sebagai major gene bagi sifat prolifik adalah Bone Morphogenetic
Protein Receptor IB (BMPR-IB), Bone Morphogenetic Protein 15 (BMP15) dan
Growth Differentiation Factor 9 (GDF9).
Pada penelitian ini dilakukan identifikasi mutasi dari dua gen anggota
TGFβ, yaitu mutasi titik pada ekson ke-6 gen BMPR-IB dan mutasi titik pada
ekson ke-2 gen BMP15. Komposisi genotipe untuk gen BMPR-IB pada domba
Garut galur subur adalah BB (11%), B- (69%), dan -- (20%), dan frekuensi alel B
(tipe mutan) sebesar 46% dan alel - (tipe liar) sebesar 54%. Sedangkan komposisi
genotipe gen BMP15 adalah 100% untuk ++. Dengan kata lain, pada populasi
domba Garut tidak ditemukan mutasi titik tipe Galway pada gen BMP15. Deteksi
mutasi lebih lanjut pada ekson ke-2 gen BMP 15 dengan metode SSCP
menemukan 4 tipe mutasi, yang diberi kode A, B, C dan D. Semua genotipe yang
berhasil dideteksi, baik sebagai gen tunggal maupun kedua gen dikombinasikan,
tidak berkorelasi dengan jumlah anak per kelahiran.
ABSTRACT
NUR AZIFAH CAKRA DEWI. Mutation Identification in Bone Morphogenetic
Protein Receptor IB (BMPR-IB) and Bone Morphogenetic Protein 15 (BMP15)
Genes are Associated with Proliferation in Prolific Garut Sheep. Under the
supervision of ACHMAD FARAJALLAH and CECE SUMANTRI.
Garut sheep is prolific sheep breed. A group of growth factor that is
especially expressed in oocyte and ovarian follicle is grouped as oocyted-derived
growth factor (ODGF), also known as the Tansforming Growth Factor β (TGFβ).
Proliferation in sheep controlled by three main factor of TGFβ that are Bone
Morphogenetic Protein Receptor IB (BMPR-IB), Bone Morphogenetic Protein 15
(BMP15) and Growth Differentiation Factor 9 (GDF9).
Mutation identification in the 6
thexon of BMPR-IB gene and 2
ndexon of
BMP15 gene was done in this research. Genotype composition of BMPR-IB gene
in prolific Garut sheep consist of BB (11%), B- (69%), and – (20%). The
frequency of B allele (mutant type) was 46% and -- allele (wild type) was 54%.
Genotype composition of BMP15 gene was ++ (100%). These implied that there
was no Galway mutation in BMP15 gene. Further detection of mutation on the 2
ndexon of BMP15 gene using SSCP method was found four type of mutation
denoted by A, B, C, D. All genotype had successfully detected; either as single or
combined gene; were suggested that there was no correlation between gene and
litter size.
IDENTIFIKASI MUTASI GEN BONE MORPHOGENETIC PROTEIN
RECEPTOR IB (BMPR-IB) DAN GEN BONE MORPHOGENETIC
PROTEIN 15 (BMP15) TERHADAP PROLIFIKASI PADA DOMBA
GARUT GALUR SUBUR
NUR AZIFAH CAKRA DEWI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Program Studi Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2009
Judul skripsi : Identifikasi Mutasi Gen Bone Morphogenetic Protein Receptor IB
(BMPR-IB) dan Gen Bone Morphogenetic Protein 15 (BMP15)
terhadap Prolifikasi pada Domba Garut Galur Subur.
Nama
: Nur Azifah Cakra Dewi
NIM
: G34053528
Menyetujui:
Pembimbing I
Pembimbing II
Dr. Ir. Achmad Farajallah, M.Si.
Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc
NIP. 19650427 199002 1 002
NIP 19591212 198603 1 004
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. drh. Hasim, DEA
NIP. 19610328 198601 1 002
Tanggal Lulus:
PRAKATA
Alhamdulillahirobbil’alamiin
Puji dan syukur Penulis panjatkan kepada ALLAH SWT atas segala rahmat
dan karunia-Nya sehingga penulis diberi kekuatan, kesabaran, dan kemampuan
untuk menyelesaikan karya ilmiah ini.
Pada kesempatan ini penulis mengucapkan terima kasih yang
sebesar-besarnya kepada Bapak Achmad Farajallah dan Bapak Cece Sumantri selaku
pembimbing yang telah memberikan saran, kritik, motivasi dan bantuan yang tak
terhingga sehingga penelitian ini berjalan dengan lancar. Ucapan terima kasih juga
diberikan kepada Ibu Sri Listyowati selaku penguji yang telah memberikan saran
dan perbaikan dalam laporan ini dan kepada Ibu Dewi Apriastuti atas ketersediaan
sampel darah domba Garut yang telah digunakan dalam penelitian ini. Selain itu,
penghargaan penulis sampaikan kepada staf pengajar Zoologi, mba Tini, Pak Adi
dan mba Ani selaku staff laboratorium Biosains Hewan atas bantuannya sehingga
penelitian ini dapat berjalan dengan lancar.
Penulis juga ingin mengucapkan terima kasih kepada Pak Khoirul, Ibu Bibah,
kak Erick, kak Ogi, dan kak Wildan atas latihan-latihannya. Kepada
teman-teman: Hadi, Apria, Vina, Ika R., Ikka E., Sylvi, Jazy, Dina, Diaz, Indra, Ade, mba
Kanthi, dan ka Uche atas persahabatan dan kebersamaannya selama penelitian ini.
Juga untuk Tia, Dina, Reni, Ayu, dan Sina yang senantiasa memberikan doa dan
dukungannya serta kepada teman-teman Biologi 42 yang tidak dapat disebutkan
satu persatu.
Penghargaan terbesar penulis haturkan untuk Ayah, Ibu dan adikku tercinta
serta kepada yang tersayang Arief Syaichu Nur Alam atas segala dukungan, kasih
sayang yang tercurah dan hantaran do’a yang senantiasa diberikan.
Penulis berharap semoga laporan masalah khusus ini dapat bermanfaat.
Bogor, Agustus 2009
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 01 November 1987 dari ayah
Muchlis Alaydrus dan ibu Nina Susilawati. Penulis merupakan anak pertama dari
dua bersaudara.
Tahun 1999 penulis lulus dari MI Nurul Huda Jakarta, tahun 2002 lulus
dari SMP Negeri 12 Jakarta, kemudian melanjutkan ke SMA Negeri 6 Jakarta.
Tahun 2005 penulis lulus dari SMA Negeri 6 Jakarta dan di tahun yang sama
penulis diterima sebagai mahasiswa tingkat persiapan bersama Institut Pertanian
Bogor melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB). Penulis
kemudian terpilih masuk ke Departemen Biologi, Fakultas Matematika dan Ilmu
Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis pernah menjadi asisten praktikum
Perkembangan Hewan pada tahun ajaran 2007/2008 serta menjadi asisten
praktikum Biologi Dasar, Struktur Hewan dan Pengantar Genetika Molekuler
pada tahun ajaran 2008/2009. Penulis juga pernah mengikuti praktik lapang
dengan judul Pengolahan Limbah Cair di PT Goodyear Indonesia, Tbk.
DAFTAR ISI
Halaman
DAFTAR GAMBAR………..………... viii
DAFTAR LAMPIRAN………... viii
PENDAHULUAN………... 1
Latar Belakang………...….. ...
1
Tujuan………...…... 2
BAHAN DAN METODE………...……….... 2
Bahan... 2
Metode………...
2
Ekstraksi dan isolasi DNA... 2
Amplifikasi Gen BMPR-IB dan BMP15...….... 2
Deteksi Mutasi Titik Kodon ke-746 pada Gen BMPR-IB... 2
Deteksi Mutasi Titik Kodon ke-718 pada Gen BMP15... 2
Visualisasi Produk PCR-RFLP dan Hasil Pemotongan
dengan Enzim Restriksi………... 3
HASIL DAN PEMBAHASAN………...
3
Hasil………...
3
Amplifikasi Gen BMPR-IB………... 3
Amplifikasi Gen BMP15………... 3
PCR-RFLP
………...…... 3
Frekuensi Alel dan Frekuensi Genotip pada Domba Garut
Galur Subur……….………... 3
PCR-SSCP……… …... 4
Pembahasan ………...………..
4
SIMPULAN DAN SARAN……….
5
Simpulan………...……..
5
Saran…………...………
5
DAFTAR PUSTAKA………...……… 5
DAFTAR GAMBAR
Halaman
1. Hasil Amplifikasi Gen BMPR-IB dan BMPR15…...………. 3
2. Hasil Pemotongan Amplikon Gen BMPR-IB oleh AvaII…...…3
3. Hasil Pemotongan Amplikon Gen BMP15 oleh HinfI…...…….. 3
4. Hasil PCR SSCP Gen BMP15………...…...….. 4
DAFTAR LAMPIRAN
Halaman
1. Jumlah litter size genotip BMPR-IB dan BMP15 pada semua
sampel domba Garut………...…….. 7
2. Jumlah litter size genotip BMPR-IB dan BMP15 pada induk
betina domba
Garut... 9
3. Rata-rata jumlah litter size induk domba Garut dengan gen
BMPR-IB…………...………. 10
Tipe normal atau tipe liar…...………. 10
Tipe heterozigot………...……… 10
PENDAHULUAN Latar Belakang
Ovarium pada hewan betina merupakan tempat produksi oosit. Setiap ovarium mengandung oosit dalam jumlah yang sangat banyak, tetapi hanya sedikit sekali dari jumlah oosit tersebut yang dimatangkan dan diovulasikan selama masa reproduktif (Austin & Short 1984). Perkembangan oosit pada ovarium dipengaruhi oleh beberapa aktivitas sel lain yang berada di sekitarnya, yaitu sel-sel folikel, sel granulosa dan zona pelusida (Byskov & Hoyer 1988). Pada ovarium mamalia, setiap satu siklus reproduktif normal akan mematangkan satu oosit dominan dalam satu folikel yang mengakibatkan terjadi ovulasi tunggal (hanya dilepaskan satu oosit). Sifat prolifik terjadi jika dalam satu siklus ovarium terdapat lebih dari satu oosit matang kemudian diikuti oleh ovulasi yang juga lebih dari satu. Sifat prolifik pada domba ditunjukkan oleh superovulasi yang akan menghasilkan anak lebih dari seekor per kelahiran.
Pertumbuhan dan perkembangan folikel pada ovarium diatur oleh follicle stimulating
hormone (FSH) dan luteinizing hormone (LH)
(Austin & Short 1984). Aktivitas FSH dan LH diatur oleh beragam sinyal yang terintegrasi yang dikelompokkan sebagai oocyted-derived
growth factor (ODGF). Berdasarkan mekanisme
kerjanya sebagai faktor pertumbuhan, beberapa ODGF kemudian dikelompokkan sebagai
Tansforming Growth Factor β (TGFβ)
(Hanrahan & Owen 2004, Davis 2005). Lebih lanjut Davis (2005) menyebutkan bahwa sifat prolifik pada domba diatur oleh tiga faktor utama, yaitu Bone Morpho-genetic Protein
Receptor IB (BMPR-IB), Bone Morphogenetic Protein 15 (BMP15) dan Growth Differentiation Factor 9 (GDF9).
Gen BMPR-IB dan gen BMP15 ditemukan terekspresi khusus pada oosit yang sedang berkembang di ovarium beberapa spesies mamalia, mulai dari marsupial (Eckery et al. 2002), rodentia (Laitinen et al. 1998), ruminansia (Galloway et al. 2002) sampai primata (termasuk manusia) (Aaltonen et al. 1999).
Pematangan oosit dan perkembangan folikel pada domba dipengaruhi oleh keberadaan TGFβ, dalam hal ini TGFβ dapat memodulasi (memperkuat atau melemahkan) kerja dari FSH dan LH pada ovarium. Modulasi kerja FSH dan LH oleh TGFβ ini merupakan faktor penting yang menentukan prolifikasi.
Faktor BMPR-IB disandikan oleh gen BMPR-IB yang terdapat pada kromosom ke-6
dan dapat mempengaruhi laju ovulasi dan litter
size pada domba. Davis et al. (2002)
melaporkan bahwa gen ini pertama kali ditemukan pada domba Boorola Merino di Australia dan merupakan gen yang mempengaruhi tingkat kesuburan pada domba tersebut. Gen BMPR-IB dikenal juga dengan sebutan Fecundity gene B (FecB). Mutasi pada gen BMPR-IB yang terekspresi di oosit dan sel granulosa akan berpengaruh terhadap laju ovulasi dan litter size domba (Wilson et al. 2001). Davis (2005) melaporkan bahwa individu heterozigot (B-) pada gen BMPR-IB akan mengalami kenaikan laju ovulasi sebesar 1.5 kali. Sedangkan individu homozigot Boorola (BB) pada gen Boorola ini akan mengalami kenaikan laju ovulasi sebesar 3.0 kali.
Gen BMP15 terdapat pada kromosom X. Beberapa mutasi titik pada gen BMP15 dilaporkan mempengaruhi laju ovulasi dan sifat prolifik, antara lain FecXG (Galway) yaitu
mutasi titik gen BMP15 daerah ekson ke-2 pada basa ke-718 (Hanrahan & Owen 2004), FecXB
(Belclare) yaitu mutasi titik gen BMP15 daerah ekson ke-2 pada basa ke-1100 (Hanrahan & Owen 2004), dan FecXI (Inverdale) yaitu
mutasi titik gen BMP15 daerah ekson ke-2 pada basa ke-53 (Bodin et al. 2007). Chu et al. (2007) melaporkan bahwa pada domba Han, mutasi FecXG bertangggungjawab terhadap
stimulasi mitosis sel granulosa dan proses folikulogenesis, sama seperti pada domba Belclare dan Cambridge. Mutasi heterozigot pada gen BMP15 menyebabkan kenaikan laju ovulasi pada domba, sedangkan mutasi homozigot akan menyebabkan kegagalan proses folikulogenesis karena mengalami kerusakan pada ovarium (Davis 2005). Domba homozigot mutan akan bersifat steril sehingga peternak komersial harus menghindari terjadi persilangan antara induk betina dan induk jantan yang
carrier (heterozigot).
Domba Wanaraja adalah salah satu dari domba lokal asli Garut, yaitu dari daerah Cibuluh dan Cikeris di Kecamatan Cikajang dan dari Kecamatan Wanaraja. Domba ini adalah domba Garut galur subur hasil persilangan antara domba lokal Jawa ekor tipis, Merino dan Kaapstadt (Rusyad 1977). Persilangan ini membentuk bangsa domba dengan tampilan fisik yang khas. Domba Merino yang digunakan untuk persilangan didatangkan dari Australia pada tahun 1860-an. Mulsant et al. (2001) melaporkan bahwa domba Merino memiliki tingkat ovulasi dan litter size yang tinggi. Begitu pula dengan domba Jawa ekor tipis. Bradford et al. (1986) menyatakan bahwa domba lokal Jawa ekor tipis memiliki sifat
prolifik. Jadi kemungkinan sifat prolifik yang dimiliki oleh domba Garut Wanaraja ini berasal dari hasil persilangan antara domba lokal Jawa ekor tipis dengan domba Merino. Pada domba Han, tipe-tipe gen BMP ini dilaporkan mempengaruhi sifat prolifik (Chu et al. 2007). Tujuan
Penelitian ini bertujuan untuk mengidentifikasi mutasi dari dua gen anggota TGFβ, yaitu gen BMPR-IB dan BMP15 pada domba Garut galur subur.
BAHAN DAN METODE Bahan
Bahan yang digunakan ialah 56 sampel darah domba Garut Wanaraja yang diawetkan dalam alkohol 70% koleksi Dr. Ir. Cece Sumantri, M.Agr.Sc (FAPET, IPB) dan 14 sampel darah domba Garut yang ada di Bogor koleksi Dr. Dewi Apriastuti (FAPET IPB). Metode
Ekstraksi dan isolasi DNA
Ekstraksi dan isolasi DNA dilakukan berdasarkan metode Sambrook et al. (1989) yang telah dimodifikasi oleh Farajallah et al. (1998). Sebanyak ± 300 µl sampel darah dimasukkan ke dalam tabung 1,5 ml kemudian disentrifuse 3500 rpm selama 5 menit. Endapan sel yang diperoleh dicuci dengan bufer TE (10 mM Tris, 10 mM EDTA, pH 8.00), kemudian diendapkan lagi. Endapan sel disuspensikan dalam bufer 1x STE (100 mM NaCl, 10 mM Tris-Cl, 0.1 mM EDTA, PH 8.00), kemudian dilisis dengan SDS 1% dan 0,25 mg/ml proteinase-K. Proses pelisisan dilakukan dalam inkubator bersuhu 55°C selama 2 jam sambil dikocok pelan menggunakan rotator. Tahap selanjutnya memisahkan DNA dari bahan organik lain dengan menambahkan 40 ul larutan NaCl 5M, 400 ul larutan phenol, dan 400 ul CIAA (kloroform : isoamilalkohol = 24 : 1) dan dikocok pelan pada suhu ruang selama 2 jam. Selanjutnya, campuran disentrifuse 7000 rpm selama 5 menit. Supernatan yang mengandung DNA dipindahkan ke tabung baru dalam volume terukur. Molekul-molekul DNA diendapkan untuk dilakukan pemurnian DNA dengan metode pengendapan alkohol, yaitu menambahkan 2x volume alkohol absolut dan 1/10x volume NaCl 5M lalu dinkubasi dalam freezer minimal 2 jam. Molekul DNA dipisahkan dari alkohol absolut dengan cara disentrifuse 7000 rpm selama 10 menit. Fase air yang di bagian supernatan dibuang dan endapan DNA dicuci dengan alkohol 70%. Endapan
DNA yang telah murni kemudian disuspensikan dalam 80 ul bufer TE.
Amplifikasi Gen BMPR-IB dan BMP15 Amplifikasi dilakukan secara in vitro melalui teknik PCR (polymerase chain reaction) menggunakan pasangan primer AF84 (5’-GTCGCTATGGGGAAGTTTGG ATG) dan AF85 (5’-CAAGATGTTTTC ATCCTCATCAACACGGTC) untuk gen BMPR-IB (Chu et al. 2007). Pasangan primer AF84 dan AF85 didesain untuk mengamplifikasi ruas gen BMPR-IB pada daerah ekson ke-6 sepanjang 140 pb. Sedangkan untuk gen BMP15 menggunakan pasangan primer AF86 (5’-CACTGTCTT CTTGTTACTGTATTTCAATGAGC) dan AF87 (5’-GATGCAATACTGCCTGCTTG). Pasangan primer AF86 dan AF87 didesain untuk mengamplifikasi ruas gen BMP15 pada daerah ekson ke-2 sepanjang 141 pb.
Pereaksi untuk amplifikasi PCR dalam volume 25 μl terdiri atas sampel DNA sekitar 50 ng, masing-masing 1 nM primer, 0,2 nM dNTPs, 50 nM MgCl2, dan 0.75 unit Taq
polymerase beserta bufernya (RBC). Reaksi amplifikasi PCR dilakukan menggunakan mesin
thermocycler TAKARA MP4 dengan kondisi
untuk kedua jenis gen adalah predenaturasi 940C
selama 5 menit, diikuti 30 siklus yang terdiri dari denaturasi 940C 1 menit, penempelan
primer 580C 1 menit, dan pemanjangan 720C 1
menit, dan diakhiri dengan pemanjangan akhir 720C selama 10 menit (Patet et al. 2006).
Deteksi Mutasi Titik Basa ke-746 Gen BMPR-IB
Deteksi mutasi gen BMPR-IB dilakukan melalui teknik RFLP (restriction fragment
length polymorphism) menggunakan enzim
restriksi AvaII [G׀GACC]. Berdasarkan Chu et
al. (2007), mutasi gen BMPR-IB terjadi pada
basa ke-746, yaitu substitusi basa nitrogen A menjadi G yang akan mengubah asam amino glutamin menjadi arginin.
Deteksi Mutasi Titik Basa ke-718 Gen BMP15
Deteksi mutasi gen BMP15 dilakukan melalui teknik RFLP (restriction fragment
length polymorphism) menggunakan enzim
restriksi Hinf1 [G|ANTC]. Berdasarkan Chu et
al. (2007), mutasi gen BMP15 terjadi pada basa
ke-718 sebagai substitusi basa nitrogen C menjadi T. Substitusi ini menyebabkan terbentuk kodon stop di tempat asam glutamat pada residu asam amino ke-239 yang disebut sebagai codon stop premature.
Visualisasi Produk PCR-RFLP dan Hasil Pemotongan dengan Enzim Restriksi
Visualisasi amplikon dan produk PCR-RFLP dilakukan menggunakan metode
polyacrilamide gel electrophoresis (PAGE) 6%
yang dijalankan pada tegangan 250 V selama 30 menit yang dilanjutkan dengan pewarnaan perak menurut Tegelstorm (1986).
HASIL Amplifikasi Gen BMPR-IB
Hanya 45 dari 70 sampel yang berhasil diamplifikasi. Amplifikasi menggunakan pasangan primer AF84 dan AF85 menghasilkan pita tunggal berukuran 140 pb (Gambar 1A). Ruas gen BMPR-IB ekson ke-6 yang teramplifikasi sesuai dengan perkiraan dari desain primer sebesar 140 pb.
Amplifikasi Gen BMP15
Amplifikasi menggunakan pasangan primer AF86 dan AF87 menghasilkan pita tunggal berukuran 141 pb untuk semua sampel (Gambar 1B). Ruas gen BMP15 ekson ke-2 yang teramplifikasi sesuai dengan perkiraan dari desain primer, yaitu sebesar 141 pb.
Gambar 1 Hasil amplifikasi Gen BMPR-IB (A) dan gen BMP15 (B). (M = Marker 100 pb, 1,2,3 = sampel domba Garut Wanaraja betina)
PCR-RFLP
Pemotongan amplikon gen BMPIR-IB menggunakan enzim restriksi AvaII menunjukkan pita DNA dengan ruas ekson ke-6 gen BMPR-IB tipe normal atau tipe liar (genotipe --) sebanyak 9 sampel dan tipe homozigot mutan (genotipe BB) sebanyak 5 sampel, sedangkan 31 sampel lainnya tipe heterozigot (genotipe B-) (Gambar 2).
Gambar 2 Hasil pemotongan amplikon gen BMPR-IB oleh AvaII (M= marker 100 pb, -- = homozigot tipe liar, B-= heterozigot, dan BB= homozigot mutan).
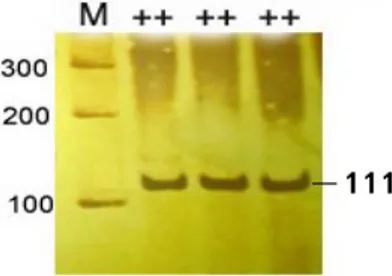
Hasil pemotongan amplikon dari gen BMP15 menunjukkan bahwa semua sampel terpotong pada situs HinfI menjadi 111 pb dan 30 pb. Hal ini diterjemahkan bahwa ruas ekson ke-2 gen BMP15 adalah normal atau tipe liar dengan genotip ++ (Gambar 3). Jika hasil pemotongan amplikon terbentuk pita sepanjang 141 pb, 111 pb dan 30 pb, menunjukkan bahwa ruas ekson ke-2 gen BMP15 adalah heterozigot atau terjadi mutasi dengan genotip F+. Sedangkan jika hasil pemotongan amplikon hanya terbentuk pita sepanjang 141 pb, menunjukkan bahwa amplikon BMP15 tidak terpotong karena tidak mempunyai situs pemotongan HinfI, ruas ekson ke-2 gen BMP15 memiliki genotip FF. Dengan demikian, 100% sampel yang teridentifikasi adalah normal atau tipe liar (genotip ++).
Gambar 3 Hasil pemotongan amplikon gen BMP15 oleh Hinf I (M= 100 pb, ++= wild type)
Frekuensi Alel dan Frekuensi Genotip pada Domba Garut Galur Subur
Pada gen BMPR-IB, frekuensi alel B adalah 46% dan alel - adalah 54%. Frekuensi genotip BB, B-, dan -- berturut-turut adalah 11%, 69%, dan 20% (Lampiran 1). Sedangkan untuk gen BMP15, frekuensi alel F adalah 0 dan alel + adalah 1 sehingga semua sampel memiliki genotip ++. (Lampiran 1).
Hasil kombinasi dari kedua gen diperoleh kombinasi genotip B-++ memiliki frekuensi
yang paling tinggi, yaitu 69%. Kombinasi genotip --++ memiliki frekuensi 20% dan kombinasi genotip BB++ memiliki frekuensi terendah, yaitu 11%.
PCR-SSCP
Atas dasar bahwa ruas ekson ke-2 gen BMP15 ditemukan monomorfik makaidentifikasi mutasi dilanjutkan dengan metode single strand conformation
polymor-phism (SSCP). Metode SSCP merupakan
metode yang handal untuk mendeteksi mutasi pada suatu ruas DNA meskipun hanya satu basa. Pada metode ini DNA produk berutas ganda didenaturasi menjadi utas tunggal dalam bufer formamida (1 mg/ml xylene cyanol, 1 mg/ml bromthymol blue, 10 mM EDTA dan formamida 80%) dengan perlakuan panas 940C,
kemudian didinginkan mendadak dalam icebath. Dengan demikian, molekul DNA utas ganda yang sudah terdenaturasi tetap berada dalam kondisi berutas tunggal. Utas tunggal yang terbentuk akan membentuk lipatan (konformasi). Perbedaan konformasi akan menyebabkan perbedaan diameter molekul utas tunggal, sehingga terjadi perbedaan pola migrasi molekul pada gel poliakrilamid. Rasio antara akrilamid dan bis-akrilamid pada gel poliakrilamid dibuat menjadi 59:1. Dengan rasio tersebut, pori-pori gel menjadi lebih memanjang sehingga bisa memisahkan DNA berdasarkan bentuknya.
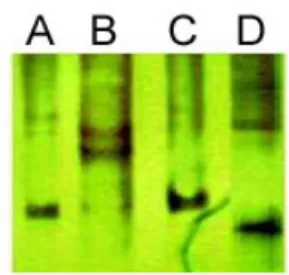
Pada hasil identifikasi ragam gen BMP15, ditemukan 4 konformasi yang saling berbeda (Gambar 4).
Gambar 4 Pola pita SSCP gen BMP15 di atas gel poliakrilamid 12%
PEMBAHASAN
Pada penelitian ini ditemukan bahwa domba Garut galur subur memiliki mutasi FecB pada gen BMPR-IB, sehingga dapat diduga berdasarkan silsilah hasil persilangan bahwa domba Garut galur subur memiliki nenek moyang yang sama dengan domba Boorola Merino, Garole, Han dan Hu. Mutasi FecB pada gen BMPR-IB ditemukan pada domba Boorola Merino (Australia), domba Garole (India),
domba Han (China) dan domba Hu (China). Genotipe gen BMPR-IB domba Garut galur subur yang berhasil diidentifikasi adalah homozigot mutan BB dan heterozigot B-. Davis (2005) melaporkan bahwa domba yang mengalami mutasi FecB pada gen BMPR-IB akan mengalami kenaikan laju ovulasi dan litter
size. Domba dengan mutasi FecB akan
memiliki sel granulosa yang lebih sensitif terhadap FSH, sehingga sel tersebut semakin aktif membelah dan menyebabkan folikel ovarium menjadi cepat dewasa dan matang. Jumlah sel granulosa yang banyak di dalam folikel ovarium menandakan semakin banyak pula folikel ovarium dominan yang terbentuk kemudian dapat menyebabkan terjadi superovulasi (dilepaskan lebih dari satu oosit) (Austin & Short 1984). Sifat prolifik terjadi jika semua oosit yang dilepaskan berhasil dibuahi sehingga dapat dihasilkan anak yang lebih dari satu (Wilson et al. 2001).
Pada penelitian ini ditemukan bahwa semua sampel yang diidentifikasi memiliki gen BMP15 tipe normal atau tipe liar (genotip ++), namun individu betina yang dijadikan sebagai sampel memiliki tipe kelahiran dari tipe 1 sampai 5, yaitu bisa menghasilkan 1 sampai 5 anak sekaligus dalam sekali kelahiran (Lampiran 2). Dengan demikian dapat disimpulkan bahwa semua sampel domba Garut yang diidentifikasi tidak mengalami mutasi pada gen BMP15. Hal tersebut sesuai bila dilihat dari sejarah penyebarannya, domba Garut merupakan hasil perkawinan silang antara domba lokal Jawa ekor tipis dan domba Merino (Rusyad 1977). Domba lokal Jawa ekor tipis adalah domba prolifik yang memiliki laju ovulasi dan litter size yang tinggi. Domba ini mengalami mutasi FecB pada gen BMPR-IB namun tidak ditemukan mutasi FecX pada gen BMP15 (genotip ++). Domba Merino adalah domba prolifik galur Boorola yang berasal dari Australia (Bindon et al. 1984). Pada domba Merino juga ditemukan mutasi FecB pada gen BMPR-IB namun tidak ditemukan mutasi FecX pada gen BMP15 (genotip ++). Jika terjadi perkawinan silang antara kedua domba ini maka akan dihasilkan keturunan normal atau tipe liar.
Terdapat beberapa jenis mutasi gen BMP15 pada domba, diantaranya mutasi FecXI
(Inverdale), FecXH (Hanna), FecXG (Gallway), FecXB (Belclare), FecXL (Lacaune), dan setiap
mutasi yang terjadi dapat mempengaruhi kenaikan atau penurunan laju ovulasi dan litter
size pada domba. Hanrahan & Owen (2004)
melaporkan bahwa domba Cambridge dan Belclare yang mengalami mutasi homozigot
untuk gen FecXG bersifat steril karena
mengalami kegagalan dalam perkembangan folikel ovariumnya. Sedangkan domba mutasi heterozigot untuk gen FecXG dan FecXB bersifat
fertil dan mengalami kenaikan laju ovulasi. Sehingga individu heterozigot (genotip F+) dapat menghasilkan anak dengan jumlah yang lebih banyak daripada individu normal atau tipe liar (genotip ++).
Selain itu, hasil identifikasi mutasi pada gen BMP15 tidak ditemukan pada individu domba Garut tipe homozigot mutan (genotip FF) yang menyebabkan domba bersifat steril dan mengalami kegagalan dalam perkembangan folikelnya. Hal tersebut karena semua sampel domba betina yang digunakan adalah fertil sehingga genotip FF memang tidak ada pada domba Garut yang diidentifikasi.
Hasil PCR SSCP menunjukan bahwa gen BMP15 memiliki 4 konformasi yang saling berbeda pada DNA tunggalnya. Gen BMP15 sebenarnya beragam (Gambar 4), hanya saja keragaman dari gen ini tidak mempengaruhi sifat prolifik pada domba garut.
Berdasarkan hasil penelitian ini, sampel domba garut yang digunakan memiliki sifat prolifik. Namun pada domba Garut mutasi hanya terjadi pada gen BMPR-IB, dan tidak pada gen BMP15. Sifat prolifik pada domba garut yang diidentifikasi dapat diduga bukan dipengaruhi oleh gen BMP15, melainkan oleh gen BMPR-IB. Kebanyakan anggota dari superfamily Transforming Growth Factor β (TGFβ), termasuk BMPR-IB dan BMP15, secara biologis aktif dalam bentuk dimer. Namun belum diketahui dengan jelas bentuk dimer yang aktif, dalam bentuk homodimer (BMPRIB-BMPRIB dan BMP15-BMP15), atau heterodimer (BMPRIB-BMP15). Berdasarkan hal tersebut, maka kombinasi mutasi antar gen BMPR-IB dan BMP15 diduga dapat memunculkan sifat prolifik yang lebih kuat pada domba. Namun hasil deteksi mutasi pada kedua gen tidak sesuai jika dikorelasikan dengan data
litter size pada domba Garut yang diidentifikasi
(Lampiran 2). Semua genotipe yang berhasil dideteksi, baik sebagai gen tunggal maupun kedua gen dikombinasikan, tidak berkorelasi dengan jumlah anak per kelahiran.
Selain faktor genetik, faktor nutrisi, faktor umur dan faktor keberhasilan dalam fertilisasi (pembuahan) juga dapat mempengaruhi baik atau tidaknya kemampuan domba untuk bereproduksi.
SIMPULAN
Domba Garut Wanaraja dan Bogor memiliki mutasi FecB pada gen BMPR-IB, sama seperti yang ditemukan pada domba Boorola Merino. Namun tidak ditemukan mutasi FecX pada gen BMP15. Sifat prolifik pada domba Garut galur subur diduga bukanlah dipengaruhi oleh gen BMP15, melainkan gen BMPR-IB.
SARAN
Sifat prolifik disebutkan diatur oleh gen-gen utama BMPR-IB dan BMP15. Hasil penelitian menunjukkan bahwa gen tunggal BMP15 kurang baik sebagai marker untuk sifat prolifik. Kombinasi mutasi antar gen dapat memunculkan sifat prolifik yang lebih baik. Untuk itu kombinasi gen yang disarankan adalah tidak melibatkan gen BMP15.
DAFTAR PUSTAKA
Aaltonen J, et al. 1999. Human growth differentiation factor-9 (GDF-9) and its novel homolog GDF-9B are expressed during early folliculogenesis. J Clin
Endocrinol Metab 84:2744–2750.
Austin CR, Short RV. 1984. Reproduction in Mammals. Ed ke-3New York : Cambridge University Press.
Bindon BM, Hilliard MA, Piper LR. 1984. Reproductive endocrinology of prolific sheep: studies of the Booroola Merino. In: Land RB, Robinson DW, editor. Genetics of Reproduction in Sheep. London: Butterworths. pp. 217-236. Bodin L, et al. 2007. A novel mutation in the
bone morphogenetic protein 15 gene causing defective protein secretion is associated with both increased ovulation rate and sterility in Lacaune sheep. Endocrinology 148 (1):393–400. Bradford GE, et al. 1986. Reproduction in
Javanese sheep: evidence for a gene with large effect on ovulation rate and litter size. J Anim Sci 63:418–431. Byskov AG, Hoyer PE. 1988. Embryology of
mammalian gonads and ducts. In: Knobil E, Neill J, editor. The physiology of reproduction. New York: Raven Press, Ltd. pp. 265-302. Chu MX, Sang JY, Wang L. 2007. Mutations in
BMPR-IB and BMP-15 genes are associated with litter size in Small Tailed Han sheep (Ovis aries). J Anim
Davis GH, et al. 2002. DNA tests in prolific sheep from eight countries provide new evidence on origin of the Booroola (FecB) mutation. Biol Reprod 66: 1869–1874.
Davis GH. 2005. Major genes affecting ovulation rate in sheep. Genet Sel Evol 37:S11–S23.
Eckery DC, et al. 2002. Expression of mRNA encoding growth differentiation factor 9 and bone morphogenetic protein 15 during follicular formation and growth in a marsupial, the brushtail possum (Trichasurus vulpecula). Mol Cell
Endocrinol 192:115–126.
Farajallah A, Suryobroto B, Takenaka O. 1998. Nucleotide Sequence of Whole Mitochondrial DNA of a Softshelled Turtle, Dogania, and PCR RFLP Analyses of Cytochrome b Gene. Proceeding of the Tokyo International Forum on Conservation and Sustainable. Japan, Agustus 1998 Japan: New Energy and Industrial technology Development Organization (NEDO) and Japan Bioindustry Association (JBA). pp. 103-109. Galloway SM et al. 2002. Mutations in an
oocyte-derived growth factor gene (BMP15) cause increased ovulation rate and infertility in a dosage-sensitive manner. Nat Genet 25:279-283.
Hanrahan JP, Owen JB. 2004. Variation and repeatability of ovulation rate in Cambridge ewes. Anim Prod 40:529. Laitinen M, et al. 1998. A novel growth
differentiation factor-9 (GDF-9) related factor is co-expressed with GDF-9 in mouse oocytes during folliculogenesis.
Mech Dev 78:135–140.
Mulsant P, et al. 2001. Mutation in bone morphogenetic protein receptor-IB is associated with increased ovulation rate in Booroola Merino ewes. Proc
Natl Acad Sci. USA 98:5104–5109.
Patet RK, et al. 2006. Lack of carriers of citrullinaemia and DUMPS in Indian Holstein cattle. J Appl Genet 47 (3):239-242.
Sambrook J, Fritsch EF, Maniatis T. 1989. Molecular cloning: A Laboratory Manual. Ed ke-8. New York: Cold Spring Harbor Laboratory Press. Rusyad A. 1977. Sheep breeds of Indonesia.
Report for FAO/UNEP Project “Conservation of Animal Genetic Resources”. 10 pp. TS.
Tegelstrom H. 1986. Mitochondrial DNA in natural populations: An improved routine for the screening of genetic variation based on sensitive silver staining. Electrophoresis 7:226-229. Wilson T, et al. 2001. Highly prolific Boorola
sheep have a mutation in intracellular kinase domain of bone morphogenetic protein IB receptor (ALK-6) that is expressed in both oocytes and granulose cells. Biol. Reprod. 64: 1225-1235.
Lampiran 1. Jumlah
litter size
genotip BMPR-IB dan BMP15 pada semua sampel domba Garut No Sampel Litter size (anak) BMPR-IB BMP151 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 S1 S2 S3 S4 S5 S6 S7 S8 S9 D2 D4 D1 D3 D5 D6 D7 D8 D9 D10 D11 D12 D13 D14 D15 D16 D17 D18 D19 D20 D21 D22 -4 4 2 2 1 2 1 2 2 2 4 5 4 3 4 4 1 3 2 3 2 B-BB B- -- B-BB B-BB --++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++
32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 D23 D24 A121 A141 A211 A212 A231 A251 A61 A71 A81 A91 A3101 A4111 A4121 AT5131 AT5141 AT5151 A5161 A6171 A7181 A8191 A9211 A9221 A231 M1 M2 M7 M5 M8 AS1 AS2 AS4 AS6 AS10 AS11 1 3 2 - -- B-BB BB B- -- B- -- B-– B- -- B- --– B-++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++
68 69 70 AS13 AS17 AS19 - B--- ++ ++ +
Lampiran 2. Jumlah litter size genotip BMPR-IB dan BMP15 pada induk betina domba Garut No Sampel No sampel Litter size
(anak) BMPR-IB BMP15 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 D2 D4 D1 D3 D5 D6 D7 D8 D9 D10 D11 D12 D13 D14 D15 D16 D17 D18 D19 D20 D21 D22 D23 D24 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 4 4 2 2 1 2 1 2 2 2 4 5 4 3 4 4 1 3 2 3 2 1 3 2 B-BB B- -- B-BB B-BB --++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++ ++
Lampiran 3. Rata-rata jumlah litter size induk domba Garut dengan gen BMPR-IB 1. Tipe normal atau tipe liar
No Sampel betina No sampel Litter size
BMPR-IB
1 2 3 D8 D15 D22 17 24 31 2 4 1 --Rata-rata litter size 3.5
2. Tipe heterozigot
No Sampel betina No sampel Litter size
BMPR-IB
1 2 3 4 5 6 7 8 D2 D4 D5 D6 D9 D10 D11 D13 10 11 14 15 18 19 20 22 4 4 1 2 2 2 4 4
B-Rata-rata litter size 2.9 3. Tipe homozigot
No Sampel betina No sampel Litter size
BMPR-IB
1 2 3 D3 D12 D14 13 21 23 2 5 3 BB BB BB Rata-rata litter size 3.3