MAKALAH KIMIA FISIKA
PEMICU-3
Fenomena Permukaan
Kelompok 10
Alphasius Omegadixon 1406607975
Muhammad Rifqi 1406608031
Muhammad Ruby M 1406608031
Naufal Syafiq M 1406607981
Reza Adhitya 1406608006
DEPARTEMEN TEKNIK KIMIA
FAKULTAS TEKNIK UNIVERSITAS INDONESIA
13 November 2015
DAFTAR ISI
BAB I : PENDAHULUAN ... 1
- Definisi masalah ... 1
BAB II : ISI ... 2-22
- Teori dasar... 2-5
- Jawaban Pemicu :
a. Pemicu A... 6-8
b.Pemicu B... 8-13
c.Pemicu C... 13-21
BAB III : PENUTUP
-
Kesimpulan... 22 DAFTAR PUSTAKA... 23BAB I : PENDAHULUAN
Definisi masalah :
1. Pengertian fenomena permukaan dan aplikasinya
2. Sifat-sifat, kegunaan, dan pembuatan surfaktan
3. Adsorbsi, adsorben, dan adsorbat
BAB II : ISI
A. Teori dasar
Banyak fenomena-fenomena alam yang kurang kita perhatikan akan tetapi fenomena-fenomena tersbut mempunyai hubungan dengan adanya tegangan permukaan. Sering terlihat peristiwa-peristiwa alam yang tidak diperhatikan dengan teliti misalnya tetes-tetes zat cair pada pipa keran yang bukan suatu aliran, laba-laba air yang berada di atas permukaan air, gelembung-gelembung sabun, pisau silet yang diletakkan perlahan-lahan di atas permukaan zat cair yang terapung, dan naiknya air pada pipa kapile. Hal tersebut dapat terjadi karena adanya gaya-gaya yang bekerja pada permukaan zat cair atau pada batas antara zat cair dengan bahan lain.
Tegangan permukaan merupakan fenomena menarik yang terjadi pada zat cair (fluida) yang berada pada keadaan diam (statis). Suatu molekul dalam fase cair dapat dianggap secara sempurna dikelilingi oleh molekul lainnya yang secara rata-rata mengalami daya tarik yang sama ke semua arah. Gejala ini yang disebut dengan tegangan permukaan. Oleh karena itu dilakukan percobaan penentuan tegangan permukaan dengan metode berat tetes agar dapat mengetahui nilai tegangan permukaan dari suatu larutan dan dapat menganalisa fenomen-fenomena yang berhubungan dalam kehidupan sehari-hari dengan mempelajari tentang tegangan permukaan.
Tegangan permukaan zat cair merupakan kecenderungan permukaan zat cair untuk menegang, sehingga permukaannya seperti ditutupi oleh suatu lapisan elastic. Selain itu, tegangan permukaan juga diartikan sebagai suatu kemampuan atau kecenderungan zat cair untuk selalu menuju ke keadaan yang luas permukaannya lebih kecil yaitu permukaan datar atau bulat seperti bola atau ringkasnya didefinisikan sebagai usaha yang membentuk luas permukaan baru.
Dengan sifat tersebut zat cair mampu untuk menahan benda-benda kecil di permukaannya. Seperti silet, berat silet menyebabkan permukaan zat cair sedikit melengkung ke bawah tampak silet itu berada. Lengkungan itu memperluas permukaan zat cair namun zat cair dengan tegangan
permukaannya berusaha mempertahankan luas permukaan-nya sekecil mungkin. Tegangan permukaan merupakan fenomena menarik yang terjadi pada zat cair (fluida) yang berada dalam keadaan diam (statis). Tegangan permukaan didefinisikan sebagai gaya F persatuan panjang L yang bekerja tegak lurus pada setia garis di permukaan fluida.
Tegangan antar muka adalah gaya persatuan panjang yang terdapat pada antarmuka dua fase cair yang tidak bercampur. Tegangan antar muka selalu lebih kecil dari pada tegangan permukaan karena gaya adhesi antara dua cairan tidak bercampur lebih besar dari pada adhesi antara cairan dan udara.
Faktor yang mempengaruhi
Tegangan permukaan terjadi karena permukaan zat cair cenderung untuk menegang, sehingga permukaannya tampak seperti selaput tipis. Hal ini dipengaruhi oleh adanya gaya kohesi antara molekul air. Pada zat cair yang adesiv berlaku bahwa besar gaya kohesinya lebih kecil dari pada gaya adesinya dan pada zat yang non-adesiv berlaku sebaliknya. Salah satu model peralatan yang sering digunakan untuk mengukur tegangan permukaan zat cair adalah pipa kapiler. Salah satu besaran yang berlaku pada sebuah pipa kapiler adalah sudut kontak, yaitu sudut yang dibentuk oleh permukaan zat cair yang dekat dengan dinding. Sudut kontak ini timbul akibat gaya tarik-menarik antara zat yang sama (gaya kohesi) dan gaya tarik-menarik antara molekul zat yang berbeda (adesi).
Molekul biasanya saling tarik-menarik. Dibagian dalam cairan, setiap molekul cairan dikelilingi oleh molekul-molekul cairan di samping dan di bawah. Di bagian atas tidak ada molekul cairan lainnya karena molekul cairan tarik-menarik satu dengan yang lainnya, maka terdapat gaya total yang besarnya nol pada molekul yang berada di bagian dalam caian. Sebaliknya molekul cairan yang terletak di permukaan di tarik oleh molekul cairan yang berada di samping dan bawahnya. Akibatnya, pada permukaan cairan terdapat gaya total yang berarah ke bawah karena adanya gaya total yang arahnya ke bawah, maka cairan yang terletak di permukaan cenderung memperkecil luas
permukaannya dengan menyusut sekuat mungkin. Hal ini yang menyebabkan lapisan cairan pada permukaan seolah-olah tertutup oleh selaput elastis yang tipis.
Ada beberapa metode dalam melakukan tegangan permukaan :
-
Metode kenaikan kapiler Tegangan permukaan diukur dengan melihat ketinggian air/ cairan yang naik melalui suatu kapiler. Metode kenaikan kapiler hanya dapat digunakan untuk mengukur tegangan permukaan tidak bisa untuk mengukur tegangan permukaan tidak bias untuk mengukur tegangan antar muka.-
Metode tersiometer Du-Nouy Metode cincin Du-Nouy bisa digunakan utnuk mengukur tegangan permukaan ataupun tegangan antar muka. Prinsip dari alat ini adalah gaya yang diperlukan untuk melepaskan suatu cincin platina iridium yang diperlukan sebanding dengan tegangan permukaan atau tegangan antar muka dari cairan tersebut.Pada dasarnya tegangan permukaan suatu zat cair dipengaruhi oleh beberapa factor diantaranya suhu dan zat terlarut. Dimana keberadaan zat terlarut dalam suatu cairan akan
mempengaruhi besarnya tegangan permukaan terutama molekul zat yang berada pada permukaan cairan berbentuk lapisan monomolecular yang disebut dngan molekul surfaktan.
Faktor-faktor yang menpengaruhi :
a. Suhu Tegangan permukaan menurun dengan meningkatnya suhu, karena meningkatnya energy kinetik molekul.
b. Zat terlarut (solute) Keberadaan zat terlarut dalam suatu cairan akan mempengaruhi tegangan permukaan. Penambahan zat terlarut akan meningkatkan viskositas larutan, sehingga tegangan permukaan akan bertambah besar. Tetapi apabila zat yang berada dipermukaan cairan membentuk lapisan monomolecular, maka akan menurunkan tegangan permukaan, zat tersebut biasa disebut dengan surfaktan.
c. Surfaktan Surfaktan (surface active agents), zat yang dapat mengaktifkan permukaan, karena cenderung untuk terkonsentrasi pada permukaan atau antar muka. Surfaktan mempunyai orientasi yang jelas sehingga cenderung pada rantai lurus. Sabun merupakan salah satu contoh dari surfaktan.
Sturktur surfaktan secara 3 dimensi
Molekul surfaktan yang bersifat amfifil yaitu suatu molekul yang mempunyai dua ujung yang terpisah, yaitu ujung polar (hidrofilik) dan ujung non polar (hidrifobik). Sifat surfaktan yang amfifil menyebabkan surfaktan diadsorpsi pada antar muka baik itu cair/gas (yang tidak saling bercampur).
Surfaktan akan selalu berada pada antar muka suatu cairan (berbeda jenis), bila jumlah gugus hidrofil dan lipofilnya seimbang. Tapi, apabila suatu surfaktan memiliki gugus hidrofil lebih besar lipofil, maka surfaktan akan lebih berada pada fase air dan sedikit berada pada antar muka.
Sebaliknya, bila suatu surfaktan memiliki gugus hidrofil lebih kecil dari lipofil maka surfaktan akan lebih berada pada fase minyak dan sedikit berada pada antar muka. Surfaktan dapat digunakan menjadi dua golongan besar yaitu, surfaktan yang larut dalam minyak dan surfaktan yang larut dalam pelarut air.
Surfaktan yang larut dalam minyak : ada tiga yang termasuk dalam golongan ini, yaitu senyawa polar berantai panjang, senyawa fluorocarbon, dan senyawa silicon. Surfaktan yang larut dalam pelarut air : Golongan ini banyak digunakan antara lain sebagai zart pembasah, zat pembusa, zat pengemulsi, zat anti busa, detergen, zat flotasi, oencegah korosi, dan lai-lain. Ada empat yang temasuk dalam golongan ini yaitu surfaktan anion yang bermuatan negative, surfaktan yang bermuatan positif, surfaktan nonion yang tak terionisasi dalam larutan, dan surfaktan amfoter yang bermuatan negative dan positif bergantung pada pH-nya.
Surfaktan menurunkan tegangan permukaan air dengan mematahkan ikatan-ikatan hydrogen pada permukaan. Hal ini dilakukan dengan menaruh kepala-kepala hidrofiliknya terentang menjauhi permukaan air. Sabun dapat membentuk misel (miceves), suatu molekul sabun mengandung suatu rantai hidrokarbon panjang plus ujung ion. Bagian hidrokarbon dari molekul sabun bersifat hidrofobik dan larut dalam zat-zat non polar, sedangkan ujung ion bersifat hidrofilik dan larut dalam air. Karena adanya rantai hidrokarbon, sebuah molekul sabun secara keseluruhan tidaklah benar-benar larut dalam air, tetapi dengan mudah akan tersuspensi di dalam air. Larutan surfaktan dalam air menunjukkan perubahan sifat fisik yang mendadak pada daerah konsentrasi yang tertentu. Perubahan yang mendadak ini disebabkan oleh pembentukan agregat atau penggumpalan dari beberapa molekul surfaktan menjadi satu, yaitu pada konsentrasi kritik misel (KMK).
Tegangan permukaan juga merupakan sifat fisik yang berhubungan dengan gaya
antarmolekul dalam cairan dan didefinisikan sebagai hambatan peningkatan luas permukaan cairan. Awalnya tegangan permukaan didefinisikan pada antar muka cairan dan gas. Namun, tegangan yang mirip juga ada pada tegangan antar muka cairan-cairan, atau padatan dan gas. Tegangan semacam ini secara umum disebut dengan tegangan antar muka.
Adsorbsi dan Absorbsi Absorbsi
Dalam absorbansi, satu substansi diambil ke dalam struktur fisik dari bahan lainnya. Zat, yang menyerap ke dalam zat lain, dikenal sebagai “absorbat.” Zat yang menyerap absorbat yang dikenal sebagai “absorben.” Sebagai contoh, jika suatu molekul organik masuk ke dalam partikel padat (partikel tanah), maka molekul organik absorbat, dan partikel tanah adalah absorben. Absorben bisa menjadi gas, cair atau padat, sedangkan absorbat dapat menjadi atom, ion atau molekul. Biasanya, absorbat dan absorben yang berada dalam dua fase yang berbeda. Sifat Penyerapan bahan kimia yang digunakan dalam berbagai kesempatan. Sebagai contoh, ini adalah prinsip di belakang ekstraksi cair-cair. Di sini, zat terlarut dapat diekstraksi dari satu cairan ke cairan lainnya, karena zat terlarut lebih diserap ke salah satu cairan dari yang lain ketika mereka berada dalam wadah yang sama. Dalam rangka untuk menyerap, absorben harus memiliki struktur berpori atau cukup ruang di mana absorbat dapat ditampung. Molekul absorbat juga harus memiliki ukuran yang cocok, untuk masuk ke dalam struktur penyerap. Selanjutnya, harus ada gaya tarik menarik antara dua untuk memudahkan proses penyerapan. Sama seperti massa yang diserap; energi juga dapat diserap ke dalam zat. Ini adalah dasar spektrofotometri. Di sana, cahaya diserap oleh atom, molekul atau yang lainnya.
Adsorpsi
Dalam adsorpsi, suatu zat atau energi yang tertarik pada permukaan adalah masalah lainnya. Zat yang menarik disebut “adsorbat”, dan permukaan disebut “adsorben.” Benda antara bahan organik dan karbon aktif adalah contoh adsorpsi. Bahan organik adalah adsorbat dalam kesempatan ini, dan adsorben adalah karbon aktif. Contoh lain dari adsorpsi menarik protein ke biomaterial. Adsorpsi dapat dari tiga jenis, adsorpsi fisik, kemisorpsi, dan adsorpsi elektrostatik. Dalam adsorpsi fisik, gaya lemah van der Waals adalah kekuatan menarik. Dalam kemisorpsi, daya tarik berlangsung melalui reaksi kimia antara adsorben dan adsorbat. Seperti namanya, dalam adsorpsi elektrostatik, interaksi elektrostatik terbentuk antara ion dan permukaan.
Perbedaan antara Absorpsi dan Adsorpsi
Dalam absorpsi, suatu zat (materi atau energi) dibawa ke zat lain. Namun dalam adsorpsi interaksi terjadi hanya pada tingkat permukaan yang sedang berlangsung.
Kedua zat yang terlibat dalam absorpsi dikenal sebagai absorbat dan absorben; sedangkan, dalam adsorpsi, dua zat yang dikenal sebagai adsorbat dan adsorben.
B. Jawaban Pemicu Pemicu A
1. Dalam kasus diatas terjadi fenomena permukaan pada fluida, jelaskan pengertian tentang fenomena permukaan, dan jelaskan mengapa terjadi perubahan tegangan
permukaansetelah adanya nanopartikel.
Jawab :
Fenomena permukaan merupakan peristiwa yang terjadi pada permukaan zat (dalam kasus ini fluida). Secara lebih spesifik, fenomena permukaan pada fluida adalah tegangan permukaan. Hal ini merupakan fenomena yang terjadi oleh karena gaya intermolekular pada fluida. Dalam keadaan diam, permukaan zat cair akan membuat gaya tarik ke segala arah, kecuali ke atas. Hal itulah yang
menyebabkan adanya tegangan permukaan. Tegangan permukaan berhubungan dengan peristiwa yang disebut kohesi (gaya tarik menarik antara molekul sejenis) dan adhesi (gaya tarik menarik antara molekul tidak sejenis).
Dalam fluida mengandung nano partikel, tegangan permukaan dapat berubah karena perubahan konsentrasi nanopartikel FeC. Hal ini disebabkan konsentrasi solut di permukaan lebih besar dari konsentrasi dalam larutan, sehingga akan mengurangi tegangan permukaan pada konsentrasi rendah. Namun pada konsentrasi lebih tinggi, akan semakin banyak molekul nanopartikel dalam air yang menyebabkan gaya intermolekul semakin besar pula. Sehingga seiring dengan kenaikan konsentrasi nanopartikel, tegangan permukaan larutan pun makin besar.
2. Istilah tegangan permukaan (surface tension) sangat erat hubungannya dengan istilah
intermolecular forces, jelaskan definisi dan hubungan dari kedua istilah tersebut.
Jawab :
Gaya intermolekul adalah gaya aksi di antara molekul-molekul yang menimbulkan tarikan antarmolekul dengan berbagai tingkat kekuatan. Pada suhu tertentu, kekuatan tarikan antarmolekul menentukan wujud zat, yaitu gas, cair, atau padat. Sedangkan seperti yang sudah dibahas diatas, tegangan permukaan merupakan fenomena permukaan yang terjadi pada permukaan fluida yang nampak seperti lapisan transparan pada muka fluida. Tegangan permukaan disebabkan oleh gaya intermolekul itu sendiri. Semakin besar gaya intermolekul yang terjadi, semakin besar pulan tegangan permukaan yang tercipta.
3. Ada beberapa metode yang dapat kita gunakan untuk menentukan tegangan permukaan dari suatu cairan, jelaskan metode apa saja yang anda ketahui, terangkan prinsipnya dan sertakan dengan gambar.
Jawab :
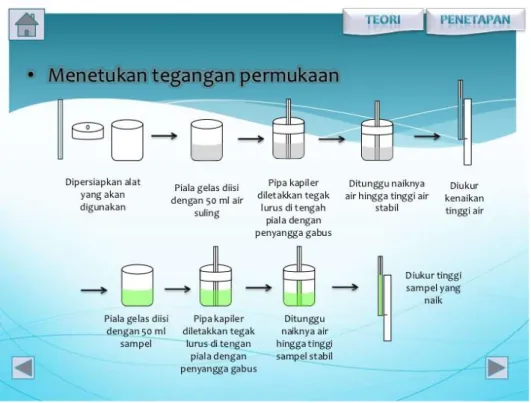
Tegangan permukaan cairan dapat diukur dengan cara : a. Metode Kenaikan Kapiler :
Tegangan permukaan diukur dengan melihat ketinggian air/cairan yang naik melalui suatu kapiler. Metode kenaikan kapiler hanya dapat digunakan untuk mengukur tegangan permukaan, tidak bisa untuk mengukur tegangan antar muka. Menurut rumus:
y = ½ h.d.g.r ...(1) Karena kadang-kadang penentuan jari-jari kapiler itu sukar, maka dipergunakan cairan pembanding yang telah diketahui tegangan mukanya.
Gambar 1. Skema metode kenaikan kapiler b. Metode tersiometer Du-Nouy :
Metode cincin Du-Nouy bisa digunakan untuk mengukur tegangan permukaan ataupun tegangan antar muka. Prinsip dari alat ini adalah gaya yang diperlukan untuk melepaskan suatu cincin platina iridium yang dicelupkan pada permukaan sebanding dengan tegangan permukaan atau tegangan antar muka dari cairan tersebut.
Gambar 2. Metode tersiometer Du-Nuoy
4. Air juga memiliki tegangan permukaan, tahukah anda berapa tegangan permukaan air? Ketika anda mempelajari tegangan permukaan air, anda akan menemukan istilah “skin-like”, terangkan pengertian dari istilah tersebut, dan jelaskan mengapa peristiwa tersebut bisa terjadi.
Jawab :
Tegangan permukaan air pada suhu 25 ⁰C = 72,75 dyne/cm. Fenomena seperti kulit atau skin like phenomenon, merupakan sebuah fenomena dimana permukaan air seakan seperti kulit atau membrane sehingga membuat objek sukar untuk menembus permukaan air. Air memiliki fenomena skin like karena adanya ikata hydrogen dalam molekul air sehingga memiliki daya tarik-menarik dengan atom oksigen di dekatnya. Fenomena skin-like ini memungkinkan jarum untuk mengambang, serangga seperti nyamuk dapat berjalan di air, dan lain-lain.
Fenomena skin-like ini dapat diakibatkan oleh tegangan permukaan, yatu sebuah sifat dari cairan yang memungkinkan cairan untuk menahan gaya dari luar. Fenomena ini terjadi karena peristiwa tegangan permukaan. Tegangan permukaan sendiri diakibatkan oleh gaya antar-molekul antara molekul air. Gaya antarmolekular ini akan tersebar ke berbagai arah. Namun saat di permukaan, tidak ada gaya ke atas sehingga terjadi penumpukan gaya antar molekul ke samping pada permukaan air. Gaya antar molekul ke samping ini akan menyebabkan tegangan berkontraksi. Hal ini yang
menyebabkan permukaan air menjadi tegang dan sulit ditembus.
5. Dapatkah anda menjelaskan kenapa pada konsentrasi rendah nanopartikel FeC, tegangan permukaan nanofluida lebih rendah dibandingkan dengan tegangan permukaan air, sedangkan pada konsentrasi tinggi, tegangan permukaan nanofluida adalah hampir sama dengan tegangan permukaan air?
Jawab :
Pengaruh konsentrasi terhadap tegangan permukaan Konsentrasi zat terlarut (solut) suatu larutan biner mempunyai pengaruh terhadap sifat-sifat larutan termasuk tegangan muka dan adsorbsi pada permukaan larutan. Telah diamati bahwa solut yang ditambahkan kedalam larutan akan menurunkan tegangan muka, karena mempunyai konsentrasi dipermukaan yang lebih besar daripada didalam larutan.Sebaliknya solut yang penambahannya kedalam larutan menaikkan tegangan muka mempunyai konsentrasi dipermukaan yang lebih kecil daripada didalam larutan.
Konsentrasi FeC di permukaan lebih kecil dibandingkan konsentrasi di dalam larutan sehinggan pada konsentrasi tinggi nano partikel FeC tegangan permukaan lebih tinggi sedangkan pada
konsentrasi rendah nanopartikel FeC tegangan permukaannya lebih rendah.
Pemicu B
1. Dapatkah Anda membantu memberikan penjelasan tentang proses pembuatan surfaktan, seperti yang diharapkan oleh mahasiswa tersebut? Berikan uraiannya secara sistematik.
Produksi alkohol lemak sulfat atau sulfat lainnya terdiri atas lima tahap, yaitu: a. Process Air Preparation
Proses udara harus benar-benar kering dengan titik embun(dewpoint) sekitar 50 °C. Dengan adanya embun akan terjadi korosif (sebab reaksi ini ditambah gas SO3) dan juga meningkatkan warna produk. Udara dialirkan ke dalam kompresor besar untuk sistem pendinginan, di mana suhu yang digunakan sekitar 3-5 °C dan uap-uap di kondensasikan. Selanjutnya udara di dikeluarkan melalui sebuah dehumdifier (pengering udara), seperti silika gel dimana sisa-sisa uap terakhir di tahan/di simpan.
Gambar 3. Ballestra’s air drying system b. Sulfur Trioxide Generation
Dalam proses ini, sulfur dengan kemurnian yang tinggi (kemurnian 99,5%) di larutkan dalam sebuah tanki dan suhu dijaga sekitar 145-150 °C untuk mempertahankan viskositas minimum dan nilai konstan. Sulfur cair dimasukkan ke dalam sulfur burner (pembakar sulfur) dengan pompa meter khusus dan kemudian dibakar dengan SO2 menggunakan udara kering. Gas SO2 cair (6-7%) meninggalkan burner pada suhu 650 °C dan didinginkan pada suhu 430 °C sebelum diumpankan ke dalam konverter.
Katalitik konverter dengan tiga sampai empat katalis vanadium pentoksida
mengkonversi SO2 menjadi SO3 dengan efisiensi konversi 98%. Gas SO3 didinginkan di bawah suhu 60 °C, dicairkan hingga 4% volume, dan dikeluarkan melalui mist eliminator untuk
memindahkan sisa oleum sebelum diumpankan ke dalam reaktor.
Gambar 4. Typical System For Generation SO3 Gas c. Sulfasi
Sulfasi dilakukan di reaktor film multitude untuk mengontrol keakurasian rasio mol antara SO3 dengan umpan organik dalam berbagai pipa. Umpan di masukkan di bagian atas dan
mengalir ke bawah di samping pipa. Ketika reaksi berlangsung eksotermis, air dingin pada aliran kontrol dimasukkan ke dalam jaket untuk menjaga temperatur pada 45-50 °C maksimum. Yield reaksi sebesar 97% dapat dicapai. Proses ini ditunjukkan pada gambar reaktor multitube film.
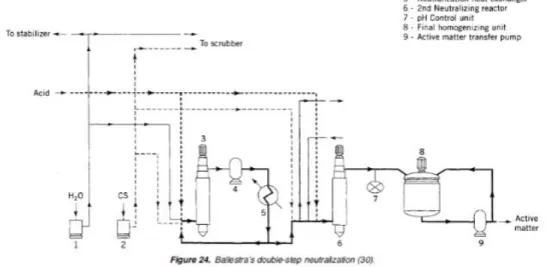
d. Netralisasi
Tingkatan produk dari reaktor harus dinetralisasi segera, dengan hidrolisis bisa
menghindari pengaruh buruk bagi proses dan kualitas produk. Proses ini akan lebih berhasil jika langkah ini dilakukan duakali terhadap unit netralisasi. Dengan pencampuran multibladed maka dihasilkan campuran yang homogen.
Perlu diperhatikan bahwa netralisasi akan memelihara sifat-sifat alkali sekecil apapun untuk menjaga kelancaran dan stabilitas proses. Konsentrasi rata-rata zat aktif sebesar 72% dapat digunakan. Konsentrasi yang terlalu tinggi tidak baik digunakan karena akan
menimbulkan kesulitan dalam proses. Jika menginginkan sebuah produk kering, maka proses selanjutnya dengan melewati sebuah wiped film evaporator.
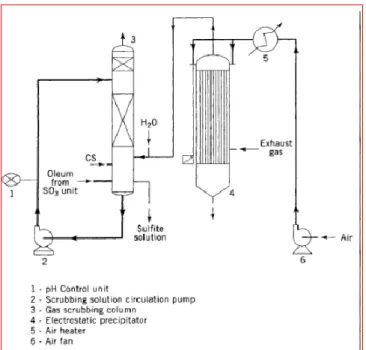
Gambar 5. Ballestra’s Double Step Neutralization e. Exhaust gas treatment
Komposisi gas harus di hilangkan dengan meregulasi lingkungan. Gas lemah terdiri dari zat-zat organik sisa, SO3 nonreaksi dan gas SO2. Pertama kedua kotoran dipindahkan dari electrostatic presipitator. Sisa gas SO2 dipindahkan dari reaksi dengan menambahkan soda kaustik yang mengalir dengan arus berlawanan sepanjang scrubbing coloumn. Konsentrasi gas sisa dalam gas lemah SO2 dilepaskan ke dalam atmosfir dengan tekanan maksimum 5 ppm.
Gambar 6. Ballestra’s Gas Scrubbing System
2. Diketahui bahwa sulfaktan memiliki gugus hidrofilik dan gugus lipofilik. Terangkan kedua istilah tersebut dan hubungannya dengan surfaktan. Jelaskan juga pengertian tentang surfaktan beserta fungsinya dan jenisnya. Ketika anda mempelajari surfaktan, Anda akan menemukan istilah “misel”, berikan penjelasan tentang istilah tersebut. Berikan contoh tentang kinerja salah satu surfaktan, gunakan model atau gambar sebagai ilustrasinya.
Jawab :
Gugus lipofilik adalah gugus dimana memiliki sifat larut dalam minyak, lemak, lipid, dan pelarut non-polar lainnya, sedangkan gugus hidrofilik adalah gugus yang memiliki sifat larut dalam air.
Hubungannya dengan surfaktan adalah bahwa surfaktan memiliki gugus hidrofilik pada ujung satu dan gugus lipofilik pada ujung lainnya. Surfaktan adalah suatu senyawa yang berfungsi untuk menurunkan tegangan permukaan antara dua cairan atau antara cairan dengan padatan. Jenis-jenis surfaktan yaitu Anionik, Karboksilat , Zwitter , Nonionik, dan lain-lain.
Misel adalah molekul-molekul surfaktan yang mulai berasosiasi karena penambahan surfaktan berikutnya. Misel dalam larutan encer membentuk suatu kumpulan dengan kepala gugus hidrofilik bersinggungan dengan solvent yang mengelilinginya, mengasingkan ekor lipofilik ke dalam pusat misel.
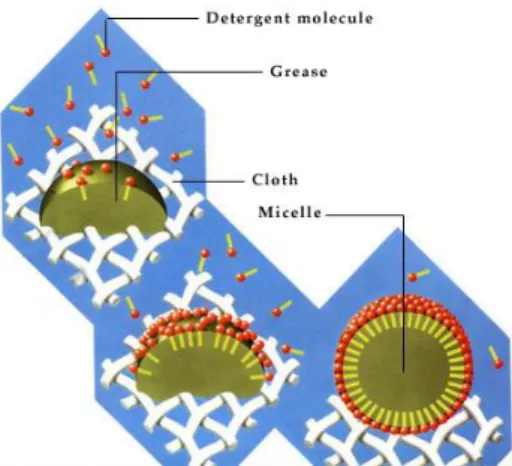
Cara kerja deterjen (salah satu surfaktan) yaitu saat larutan deterjen dicampurkan dengan suatu kotoran, maka gugus lipofilik surfaktan akan menempel ke kotoran dan
membentuk misel dengan kotoran sebagai pusatnya sehingga kotoran seakan-akan ‘larut’ dan dapat di buang.
Gambar 7. Proses pembersihan kotoran dengan surfaktan
3. Penggunaan Surfaktan terbagi atas 3 golongan, jelaskan dan uraikan dengan singkat ? Untuk penggunaan dalam bidang pangan, ada syarat-syarat tertentu yang harus dipenuhi oleh surfaktan, uraikan secara singkat.
Jawab :
Kegunaan Surfaktan: 1. Emulsifier
Surfaktan digunakan sebagai emulsifier karena dapat berinteraksi dengan air dan minyak, yang akan menstabilkan interaksi antara minyak dan air dalam suspensi, contohnya deterjen.
2. Foaming Agent
Surfaktan pada jumlah kecil akan menurunkan tegangan permukaan dari suatu cairan dimana akan mengurangi kerja yang dibutuhkan untuk membuat busa (foam)
ataumeningkatkan stabilitas koloidal. 3. Dispersan
Satu atau lebih surfaktan digunakan sebagai dispersan yaitu meningkatkan separasi antar partikel dan mencegah terbentuknya endapan.
Pada makanan, jenis surfaktan yang digunakan biasanya adalah emulsifier. Syarat untuk digunakannya surfaktan pada makanan yang dianggap aman adalah bahwa surfaktan yang digunakan mempunyai nilai Hydrophile-Lipophile Balance (HLB) antara 2-16, tidak beracun, dan tidak menimbulkan iritasi.
4. Setelah Cirtical Micelle Concetration (CMC) tercapai, tegangan permukaan akan konstan yang menunjukan bahwa antar muka menjadi jenuh dan terbentuk misel yang berada dalam keseimbangan dinamis dengan monomernya. Bagaimana menentukan CMC, gambarkan salah satu grafik yang dapat menunjukan penentuan CMC !
Jawab :
Cara menentukan Critical Micelle Concentration (CMC) dapat menggunakan cara-cara penentuan besaran fisik yang menunjukkan perubahan dari keadaan ideal menjadi tidak ideal. Di bawah CMC, larutan menjadi bersifat ideal, sedangkan diatasnya larutan menjadi bersifat tidak ideal. Besaran fisik yang dapat digunakan adalah tekanan osmosis, titik beku larutan, hantaran jenis atau hantaran ekivalen, kelarutan, indeks bias, hamburan cahaya, tegangan permukaan, dan tegangan antarmuka. Contoh Grafik CMC:
Grafik 1. Contoh grafik CMC
5. Dalam produk kosmetik, biasanya terdapat lebih dari satu jenis surfaktan. Dapatkah anda menjelaskan alasan penggunaan surfaktan ini, dan apakah surfaktan yang dipilih harus dari golongan yang sama atau tidak ? Jelaskan dan berikan contoh, tambahkan referensi yang anda gunakanuntuk mendukung penjelasan anda .
Jawab :
Dalam kosmetik, banyak melibatkan surfaktan. Surfaktan digunakan karena dapat membentuk misel yang bergunauntuk meminimalisirkan interaksi minyak dan air, sehingga minyak dapat dihilangkan (biasanya dipakai di pembersih wajah). Selain bertujuan untuk menghilangkan minyak, ada juga produk yang bertujuan untuk menambah minyak seperti gel rambut dan kulit. Karena minyak tidak dapat ditambahkan secara langsung, maka
digunakanlah surfaktan emulsifier yang berfungsi untuk menstabilkan minyak dan air. Menurut kelompok kami, jenis surfaktan yang dipakai pada kosmetik harus dengan jenis yang sama karena berbeda fungsi dari kosmetik tersebut berbeda juga jenis surfaktan yang digunakan. Contohnya adalah Emulsifier digunakan untuk menambah material berminyak ke rambut atau kulit, bukan menghilangkannya seperti cleansing product yang terdapat surfaktan tertentu.
[sumber : http://chemistscorner.com/cosmetic-surfactants-part-1/]
Pemicu C
1. Ada beberapa istilah yang hampir mirip, yaitu adsorpsi, adsorben, dan adsorbat,
dapatkah anda menjelaskan perbedaannya? Berikan penjelasan juga tentang jenis adsorbsi, sertakan dengan contoh.
Jawab :
Adsorpsi adalah peristiwa penyerapan cairan pada permukaan zat penyerap. Zat yang diserap pada proses adsorpsi disebut adsorbat. Adsorben merupakan zat yang menyerap adsorbat pada proses adsorbsi.
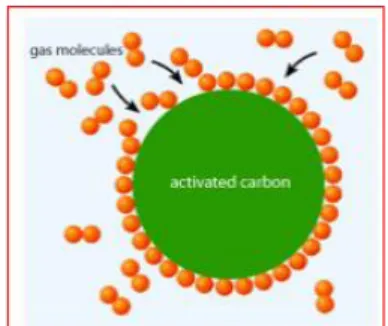
Gambar 8. Adsorbsi karbon aktif
Berdasarkan kondisi, adsorpsi dibagi menjadi dua jenis adsorbsi, yaitu : a. Adsorpsi Fisika
Terjadi karena gaya Van der Waals dimana ketika gaya tarik molekul antara larutan dan permukaan media lebih besar daripada gaya tarik substansi terlarut dan larutan, maka substansi terlarut akan diadsorpsi oleh permukaan media. Physisorption ini memiliki gaya tarik Van der Walls yang kekuatannya relatif kecil.
b. Adsorpsi Kimia
Terjadi ketika terbentuknya ikatan kimia antara substansi terlarut dalam larutan dengan molekul dalam media.
2. Proses atau mekanisme adsorpsi secara umum dapat berlangsung melalui tiga tahap, jelaskan apa saja? Tuliskan referensi yang ada rujuk dan kalau ada model atau video untuk proses ini, anda bisa tambahkan sebagai penjelasannya.
Jawab :
Berikut adalah 3 tahap adsorpsi secara umum : a. Tahap Adsorpsi
Tahap ini merupakan tahap dimana terjadi proses adsorpsi. Adsorbat tertahan pada permukaan adsorben (tertahannya gas atau uap atau molekul pada permukaan padatan). Pada proses adsorpsi umumnya dilakukan untuk senyawa organik dengan berat molekul (BM) lebih besar dari 46 dan dengan konsentrasi yang kecil.. Semakin besar BM maka proses adsorpsi akan semakin baik.
b. Tahap Desorpsi
Tahap ini merupakan kebalikan pada tahap adsorpsi, dimana adsorbate dilepaskan dari adsorbent (lepasnya gas atau uap atau molekul pada permukaan padatan).
c. Tahap Recovery
Tahap ini merupakan tahap pengolahan dari gas, uap atau molekul yang telah di desorpsi.
Referensi : Joni Hermana & Rachmat Boedisantoso. ADSORPSI. [ONLINE] Available at http://www. oc.its.ac.id/ambilfile.php?idp=1809/. [Accessed 5
November 2015].
3. Dalam adsorpsi isotherm, terdapat 5 tipe yang biasanya digambarkan dalam grafik, yang memperlihatkan apakah adsorpsi yang terjadi pada suhu konstan, tersebut monolayer atau multilayer. Jelaskan pengertian dari adsorpsi isoterm dan jelaskan 5
tipe yang dimaksud. Dalam model adsorpsi isotherm kita diperkenalkan dengan model adsorpsi isotherm Langmuir, Freundlich dan BET. Jelaskan perbedaannya antara ketiga model tersebut. Berikan masing-masing satu contoh penggunaan persamaannya.
Dapatkah kita menentukan efisiensi kapasitas adsorpsi dari model yang diberikan? Jelaskan. (sertakan dengan referensi yang anda gunakan)
Jawab :
a. 5 Tipe Grafik Adsorpsi Isoterm
Pemahaman mengenai luas permukaan dan porositas dari suatu material dapat dicapai dengan memahami isoterm adsorpsinya. Ketika kuantitas dari adsorbat (bahan yang diserap) pada permukaan material dapat diukur dalam kisaran tekanan relatif yang lebar pada suhu konstan maka akan mengasilkan sebuah isotherm. Isotherm yang dihasilkan oleh suatu material dengan adsorbat tertentu memiliki bentuk yang unik dan biasanya dapat dikategorikan pada salah satu dari lima kategori isoterms sebagai berikut :
Gambar 9. 5 tipe adsorpsi isotherm
Tipe I, atau isotherm Langmuir, berbentuk lengkung dan mendekati sejajar pada P/Po mendekati 1. Tipe I ini biasanya dijumpai pada material yang memiliki pori ukuran mikro (500A). Tipe ini merepresentasikan proses adsorpsi berlapis – lapis yang tanpa halangan. mempresentasikan proses proses adsorpsi monolayer
Tipe II, mempresentasikan proses proses adsorpsi multimolekularlayer. Tipe III, isoterm berbentuk cekung pada seluruh kisaran P/Po. Tipe ini cukup jarang dijumpai. Contoh yang terkenal adalah isoterm dari uap air pada karbon tidak berpori. Tipe ini juga mempresentasikan proses proses adsorpsi multimolekularlayer.
Tipe IV, isoterm diasosiasikan dengan adanya fenomena kondensasi kapiler dalam pori ukuran meso (mesoporous) yang diindikasikan dengan slop yang tajam pada tekanan relatif yang tinggi. Bentuk isotherm ini pada awalnya mengikuti bentuk isotherm tipe II.
Tipe V, isotherm ini tidak umum dijumpai, serupa dengan kondisi pada isotherm tipe III namun kemungkinan didalam bahannya juga mengandung pori berukuran meso (mesoporous).
b. Model Isoterm Langmuir
Isoterm ini berdasar asumsi bahwa Adsorben mempunyai permukaan yang homogen dan hanya dapat mengadsorpsi satu molekul adsorbat untuk setiap molekul adsorbennya. Pada model isoterm ini tidak ada interaksi antara molekul-molekul yang terserap. Serta, semua proses adsorpsi dilakukan dengan
mekanisme yang sama. Selain itu juga hanya terbentuk satu lapisan tunggal saat adsorpsi maksimum.
...(2)
c. Model Isoterm Freundlich
Model isoterm ini berdasarkan asumsi bahwa adsorben mempunyai permukaan yang heterogen dan tiap molekul mempunyai potensi penyerapan yang berbeda-beda. Persamaan ini merupakan persamaan yang paling banyak digunakan saat ini. Persamaannya adalah :
...(3)
d. Model Isoterm BET
Model isoterm ini berdasar asumsi bahwa adsorben mempunyai permukaan yang homogen. Perbedaan isoterm ini dengan Langmuir adalah BET berasumsi bahwa molekul-molekul adsorbat bisa membentuk lebih dari satu lapisan adsorbat di permukaannya. Pada isoterm ini, mekanisme adsoprsi untuk setiap proses adsorpsi berbeda-beda. Mekanisme yang diajukan dalam isoterm ini adalah:
...(4)
Model isoterm Langmuir biasanya lebih baik apabila diterapkan untuk adsorpsi kimia, sedangkan isoterm BET akan lebih baik daripada isotherm Langmuir bila diterapkan untuk adsoprsi fisik.
4. Teknologi Adsorpsi dikenal paling ekonomis. Bagaimana menurut anda? Berikan contoh kasus adsorpsi terutama kasus untuk penghilangan merkuri dalam hidrokarbon cair. Tuliskan referensi yang anda gunakan !
Jawab :
Adsorpsi merupakan teknik pemurnian yang dikenal ekonomis karena dari segi penggunaan, ketersediaan, dan biayanya dinilai unggul. Adsorpsi menganut prinsip yang sederhana tanpa
membutuhkan kondisi spesifik yang ekstrim. Adsorbent, yaitu zat pengadsorpsi merupakan zat yang umumnya dapat diregenerasi sehingga dapat digunakan kembali dan mengurangi biaya perusahaan. Salah satu penerapan adsorpsi yang kerap digunakan adalah proses penghilangan merkuri pada hidrokarbon cair.
Merkuri sangat diperhatikan dalam proses pengolahan gas. Walaupun kandungan merkuri dapat bervariasi, meskipun hanya sedikit merkuri harus dihilangkan untuk mencegah kerusakan dari heat exchangers aluminum kriogenik dan peralatan yang lainnya. Terdapat dua tipe material untuk menghilangkan merkuri, yaitu non-regenerative sorbent dan regenerative adsorbent.
Terdapat beberapa metode dalam penyerapan non-regenerative sorbent, antara lain :
a. Elemen sulfur tersebar didalam porous carrier seperti butiran karbon aktif. Untuk tipe ini, sulfur digunakan sebagai bahan pereaksi merkuri dan menghasilkan merkuri sulfida. Merkuri sulfida akan tetap berada didalam penyerap yang nantinya akan diganti jika masa umurnya habis. Tipe ini sangat bergantung pada teknik penyebaran sulfur oleh pihak manufaktur. Jika penyebaran sulfur kurang merata, maka hal ini bisa mengurangi kualitas dari penyerap merkuri dan kandungan merkuri hasil penyerapan akan berada diatas toleransi. Jika hal ini terjadi, maka peralatan yang digunakan bukan tidak mungkin untuk segera terkorosi. b. Metal sulfida tersebar didalam solid carrier seperti karbon aktif atau alumina. Merkuri
bereaksi dengan sulfida dan tertinggal didalam sorbent. Metal sulfida dan polysulfidaakan sangat efektif untuk menyerap/ menghilangkan merkuri. Tebaga dan seng adalah metal yang sangat baik untuk metal sulfida. Untuk beberapa kasus dimana penyerap H2S dibutuhkan, maka akan terjadi reaksi dimana :
Hg + H2S HgS + H2
Semakin banyak dan semakin kecil partikel, maka kualitas penyerap akan semakin baik dan efisiensi penyerapan merkuri akan meningkat. Secara umum, ukuran dari partikel tersebut diantara 0,9 sampai 4 mm.
c. Halide-menghasilkan partikel-partikel karbon aktif. Partikel ini digunakan untuk
menghilangkan merkuri pada liquid hydrocarbon. Merkuri beraksi dengan halida, seperti iodid, menjadi HgI2 yang kemudian terserap di dalam sorbent.
d. Ion-exchanged resins. Resin ini menghilangkan kadungan merkuri dari input liquid naphtha pada petrochemical plants.
Regenerative mercury removal pada umumnya digunakan tidak hanya sebagai penyerap merkuri, tetapi juga digunakan sebagai fungsi lainnya seperti pengering. Dengan menghilangkan fungsi pengering dengan menggantikannya dengan water and mercury removal adsorbent, air dan merkuri dapat dihilangkan langsung di dehydrator. Kelebihan dari tipe ini yaitu pada harga peralatan yang cukup murah, tidak ada penurunan pressure, dan adanya kemungkinan untuk menghilangkan merkuri lebih banyak.
Penyerap merkuri tipe regeneratif yang sudah dikembangkan dan banyak dipakai oleh industri-industri adalah HgSIV yang menggunakan prinsip molecular sieve. Untuk saat ini, HgSIV sudah dikembangkan dengan modivikasi tambahan perak/silver (Ag). HgSIV memiliki sifat-sifat yang memenuhi untuk menghilangkan air dan material lainnya.
Perak yang digunakan ini hanya diletakkan di bagian permukaan dari molecular sieve. Merkuri dari gas ataupun dari liquid, kontak dengan perak yang ada dipermukaan dan bercampur dengannya. Karena adanya perak, atom merkuri tidak dapat terdifusi ke poripori yang menuju ke output. Ketika adsorben tersebut dipanaskan dengan suhu regenerasi dehidrator normal, merkuri dilepaskan dari perak dan meninggalkan bersamaan dengan gas. Literatur menjadi acuan adalah materi tentang perminyakan dan gas dari website Society of Petroleum Engineers serta ebook dari Carnell dan Willis tentang Mercury Removal from Liquid Hydrocarbon.
5. Karbon aktif, zeolit, clay, kitosan dan sebagainya telah dimanfaatkan sebagai adsorben untuk mengadsorp logam seperti merkuri. Dapatkah anda menjelaskan konsep adsorpsi dari beberapa jenis adsorbent tersebut? Apa yang membedakan sehingga efisiensi kapasitas adsorben itu berbeda ? Faktor apa sajakah yang berpengaruh pada adosrpsi logam berat? Jelaskan secara umum !
Jawab :
Zeolit, clay, kitosan adalah nama – nama dari adsorben yang umum digunakan di Indonesia, adsorben tersebut dapat ditemukan di alam dengan melewati beberapa proses, namun juga dapat dibuat di laboratorium.
Adsorpsi Oleh Membran Zeolit
Dalam keadaan normal maka ruang hampa dalam kristal zeolit terisi oleh molekul air bebas yang membentuk bulatan di sekitas kation. Bila kristal tersebut dipanaskan selama beberapa jam, biasanya pada temperatur 250-900oC, maka kristal zeolit yang bersangkutan berfungsi menyerap gas atau cairan.
Daya serap (absorbansi) zeolit tergantung dari jumlah ruang hampa dan luas permukaan. Biasanya mineral zeolit mempunyai luas permukaan beberapa ratus meter persegi untuk setiap gram berat. Beberapa jenis mineral zeolit mampu menyerap gas sebanyak 30% dari beratnya dalam keadaan kering. Pengeringan zeolit biasanya dilakukan dalam ruang hampa dengan menggunakan gas atau udara kering nitrogen atau methana dengan maksud mengurangi tekanan uap ari terhadap zeolit itu sendiri, Keuntungan lain dari penggunaan mineral zeolit sebagai bahan penyaring adalah pemilahan molekul zat yang terserap, disamping penyerapan berdasarkan ukuran garis tengah molekul ruang hampa.
Apabila ada dua molekul atau lebih yang dapat melintas, tetapi karena adanya pengaruh kutub atau hubungan antara molekul zeolit itu sendiri dengan molekul zat yang diserap, maka hanya sebuah saja yang diloloskan, sedang yang lain ditahan atau ditolak. Molekul yang berkutub lebih atau tidak jenuh akan lebih diterima daripada yang tidak berkutub atau yang jenuh. Air dalam etanol dapat teradsorbsi karena gaya tarik dari permukaan membran zeolit lebih besar dari pada gaya tarik yang menahan air tersebut untuk tetap larut dalam etanol. Dengan memanfaatkan sifat fisik dan kimia zeolit tersebut yaitu sifat hidrofilik dan ukuran pori < 0.44 nm sehingga air dalam etanol dapat diserap secara sempurna dan pada akhirnya kemurniannya meningkat. Adsorpsi terjadi pada permukaan pori membran.
Partikel zeolit memiliki tiga tipe pori, yaitu macropore dan micropore (masingmasing dengan ukuran >50nm dan <2nm). Di antara keduanya terdapat mesopore. Macropore merupakan jalan masuk ke dalam partikel menuju micropore. Macropore tidak berkontribusi terhadap besarnya luas
permukaan membran zeolit. Sebaliknya, micropore adalah penyebab besarnya luas permukaan membran zeolit. Micropore tersebut sebagian besar terbentuk selama proses aktifasi.
Pada micropore inilah sebagian besar peristiwa adsorpsi terjadi. Proses adsorpsi terjadi melalui tiga tahap, yaitu:
1. macro transport : pergerakan material organik melalui sistem macropore membran zeolit. 2. micro transport : pergerakan material organik melalui sistem mesopore dan micropore dari membran zeolit.
3. sorption : melekatnya material organik pada permukaan membran zeolit, yaitu di permukaan macropore, mesopore dan micropore.
Hal yang membedakan antara zeolite, clay, dan kitosan, selain zat penyusunnya, tetapi juga bentuk serta luas permukaan dari adsorben tersebut. Kita mengetahui bahwa semakin luas permukaan adsorben, semakin banyak adsorbat yang dapat terserap, sehingga adsorben tersebut lebih lama jenuh. Keefektifan adsorben dilihat dari waktu penyerapan adosorbat dan berapa lama waktu yang
dibutuhkan untuk meregenerasi adsorban tersebut. Semakin lama adsorben jenuh, dan makin cepat atau mudah regenerasinya, maka ia semakin baik.
Ada beberapa faktor yang mempengaruhi kemampuan adsorpsi suatu adsorben diantaranya adalah sebagai berikut :
a. Luas Permukaan Adsorben
Semakin luas permukaan adsorben, semakin banyak asorbat yang diserap, sehingga proses adsorpsi dapat semakin efektif. Semakin kecil ukuran diameter partikel maka semakin luas permukaaan adsorben, dan sebaliknya.
b. Ukuran Partikel
Semakin kecil ukuran partikel yang digunakan maka semakin besar kecepatan adsorpsinya. Ukuran partikel dalam bentuk butir adalah lebih dari 0,1 mm, sedangkan ukuran diameter dalam bentuk serbuk adalah 200 mesh.
c. Waktu
Kontak Semakin lama waktu kontak dapat memungkinkan proses difusi dan
penempelan molekul adsorbat berlangsung lebih baik. Konsentrasi zat-zat organik akan turun apabila kontaknya cukup dan waktu kontak biasanya sekitar 10-15 menit.
d. Distribusi Ukuran Pori
Distribusi pori akan mempengaruhi distribusi ukuran molekul adsorbat yang masuk dalam partikel adsorben. Kebanyakan zat pengadsorpsi atau adsorben merupakan bahan yang sangat berpori dan adsorpsi berlangsung terutama pada dinding-dinding pori atau letak-letak tertentu di dalam partikel tersebut.
Di Samping itu, terdapat beberapa faktor lain yang mempengaruhi adsorpsi, yaitu : a. Agitation (Pengadukan)
Tingkat adsorbsi dikontrol baik oleh difusi film maupun difusi pori, tergantung pada tingkat pengadukan pada sistem.
b. Karakteristik Adsorban (Misal : Karbon Aktif)
Ukuran partikel dan luas permukaan merupakan karakteristik penting karbon aktif sesuai dengan fungsinya sebagai adsorban. Ukuran partikel karbon mempengaruhi tingkat adsorbsi; tingkat adsorbsi naik dengan adanya penurunan ukuran partikel. Oleh karena itu adsorbsi menggunakan karbon PAC (Powdered Acivated Carbon) lebih cepat dibandingkan dengan menggunakan karbon GAC (Granular Acivated Carbon).
c. Kelarutan Adsorbat
Senyawa terlarut memiliki gaya tarik-menarik yang kuat terhadap pelarutnya sehingga lebih sulit diadsorbsi dibandingkan senyawa tidak larut.
Hal ini dapat dijelaskan dengan kenyataan bahwa gaya tarik antara karbon dan molekul akan semakin besar ketika ukuran molekul semakin mendekati ukuran pori karbon. Tingkat adsorbsi tertinggi terjadi jika pori karbon cukup besar untuk dilewati oleh molekul.
e. pH
Asam organik lebih mudah teradsorbsi pada pH rendah, sedangkan adsorbsi basa organik efektif pada pH tinggi.
f. Temperatur
Tingkat adsorbsi naik diikuti dengan kenaikan temperatur dan turun diikuti dengan penurunan temperatur.
6. Untuk dapat mengetahui regenerasi penggunaan adsorben setelah digunakan, perlu dilakukan proses desorpsi, jelaskan dan bagaimana caranya ?
Jawab :
Adsorpsi dan desorpsi adalah suatu proses yang reversibel. Desorpsi merupakan proses pelepasan adsorbat dari adsorben, dimana proses ini membutuhkan energi panas, sehingga disebut proses endotermik. Jumlah adsorbat yang terkandung di dalam adsorban dapat
digambarkan oleh garis isoters pada diagram tekanan vs temperature (ln P vs -1/T) seperti pada gambar berikut.
Grafik 2. Hubungan ln P terhadap -1/T
Proses desorpsi disebut juga pendingin adsorpsi, proses ini membutuhkan energi panas. Namun, ada 4 tahap dalam proses desorpsi dan tahapan tersebut terdiri dari proses endotermik dan eksotermik. Keempat tahapan ini digambarkan dalam gambar berikut :
Grafik 3. Diagram Clapeyron Ideal
Keempat proses tersebut adalah sebagai berikut:
1. Proses Pemanasan (pemberian tekanan) : Selama periode ini, tidak ada aliran metanol yang masuk maupun keluar dari adsorber. Adsorber menerima panas sehingga temperatur adsorber meningkat dan diikuti oleh peningkatan tekanan dari tekanan evaporasi menjadi tekanan kondensasi. Proses ini sama seperti proses kompresi pada sistem pendingin mekanik. 2. Proses pemanasan-desorpsi-kondensasi : Selama periode ini, adsorber terus dialiri panas sehingga adsorber terus mengalami peningkatan dan temperatur yang menyebabkan timbulnya uap desorpsi. Sementara itu, katup aliran ke kondensor dibuka sehingga adsorbat dalam bentuk gas mengalir ke kondensor untuk mengalami proses kondensasi menjadi cair. Kalor laten pengembunan adsorbat diserap oleh media pendingin pada kondenser. Siklus ini sama dengan siklus kondensasi pada sistem pendingin mekanik.
3. Proses pendinginan (penurunan tekanan) : Selama periode ini, tidak ada aliran metanol yang masuk maupun keluar dari adsorber. Adsorber melepaskan panas dengan cara didinginkan sehingga suhu di adsorber turun dan diikuti oleh penurunan tekanan dari tekanan kondensasi ke tekanan evaporasi. proses ini sama seperti proses ekpansi pada sistem pendingin mekanik. 4. Proses pendinginan-adsorpsi-evaporasi : Selama periode ini, adsorber terus melepaskan panas sehingga adsorber terus mengalami penurunan temperatur dan tekanan yang
menyebabkan timbulnya uap adsorpsi. Sementara itu, katup aliran dari evaporator ke adsorber dibuka sehingga adsorbat dalam bentuk uap mengalir dari evaporator ke adsorber. Adsorbat dalam bentuk uap dihasilkan dari proses penyerapan kalor oleh adsorbat dari lingkungan sebesar kalor laten penguapan adsorbat tersebut. Proses ini berlangsung pada tekanan saturasi yang rendah sehingga penyerapan kalor berlangsung pada temperatur saturasi yang rendah pula.